明胶药物载体、明胶颗粒栓塞剂及其制备方法和应用与流程
本发明涉及明胶药物载体、明胶颗粒栓塞剂及其制备方法和应用。
背景技术:
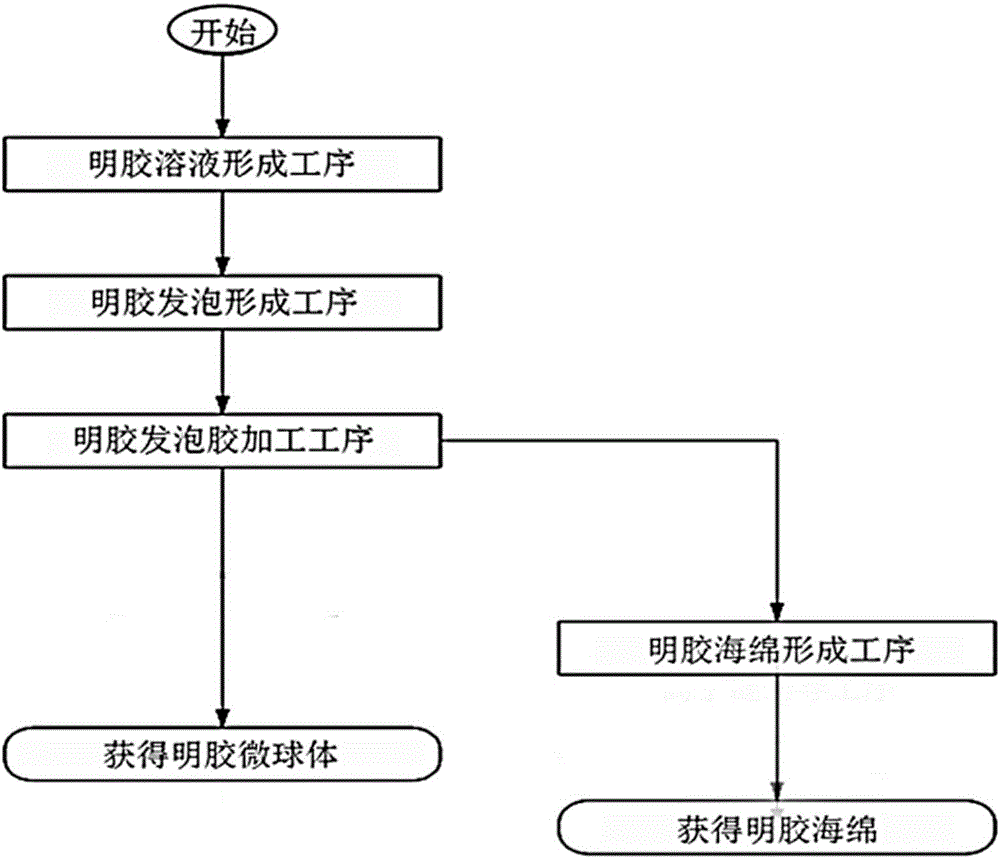
:一般来说,肝癌(Hepatoma)是世界上最常见的癌中的一种,特别是男性中较多见。肝癌的主要诱因是由B型肝炎病毒引起的慢性肝炎和由C型肝炎病毒引起的慢性肝炎,由这些病毒引起的慢性肝炎会导致肝硬化,如果炎症常时间持续,则极易发生肝癌。此外,酒精性肝疾患或如黄曲霉毒素一样的毒素引起的肝损伤等慢性肝疾患也都有可能成为肝癌的诱因。肝癌的扩散速度很快,因此早期诊断极其重要。作为治疗肝癌的方法有:通过手术去除癌组织的方法;利用肝动脉化疗栓塞术(TransarterialChemoembolzation)的方法;和利用经皮(瘤内)无水乙醇注射(PercutaneousEthanolInjection)、高频热消融治疗(RadiofrequencyThermalAblation)来杀死癌细胞的方法等。但是,如果肝瘤很大,或有大血管侵入,或癌已转移到了其他脏器时,上述方法就会无效。此外,肝癌治疗还有肝切除术、肝移植、局部治疗(例如局部高频热消融治疗、局部乙醇注射术)等方法。但是,我国肝癌细胞患者中约50%以上是在已扩散的病期、或肝硬化已扩散的状态下诊断出,因此肝动脉化疗栓塞术、靶向治疗抗癌药、外部照射放射线治疗等非根治治疗的作用也是很重要的。在非根治肝癌治疗的肝动脉化疗栓塞术中,有一种新的肝动脉治疗术,即利用药物缓释微球(drug-elutingmicrobead)的肝癌治疗方法。在该方法中,药物缓释微球为100~700μm大小的微球与抗癌药物结合的栓塞物,并利用肝动脉来治疗肝癌。现有的药物缓释微球是由聚乙烯醇(polyvinylalcohol)制作的微珠(Bead)等形态的永久性栓塞物,对肝血管的损伤大,肝血管被永久性地堵塞,当对复发率高的肝癌再次用化疗栓塞术进行治疗时,其难度加重。因而,开发一种不会对肝功能造成障碍特别是对肝癌有效的药物缓释微球变得很紧迫。本申请人于2015年7月29日申请并于同年12月1日注册的“用于肝动脉化疗栓塞术的含有磷酸盐缓冲盐水或磷酸盐缓冲液的明胶海绵及其制造方法”中公开了以下内容:在4~37℃的磷酸盐缓冲液(PBS)或磷酸缓冲液(PhosphateBuffer)中浸渍明胶海绵3~12小时的工序;将沉淀有磷酸盐缓冲液(PBS)或磷酸缓冲液(PhosphateBuffer)的明胶海绵在-10℃~-35℃的温度条件下冷冻干燥30分钟到16小时的工序;对上述冷冻干燥后的明胶海绵进行粉碎的工序;把上述被粉碎的明胶海绵分离成10~100μm、100~300μm、300~500μm、500~700μm的大小后,放入消毒后的小药瓶或放入装有磷酸盐缓冲盐水或磷酸盐缓冲液中的任一个的包装容器中的状态下保管,之后投入生理盐水、蒸馏水和抗癌药,所投入的生理盐水、蒸馏水和抗癌药相互键合形成离子键,以作为一种肝癌治疗药。上述公开的技术方案具有工序比较简单、制备比较容易的优点,但是上述方案中使用的初始明胶海绵为市售产品,在制造过程中进行过冷冻干燥,而在将已经冷冻干燥完毕的明胶海绵浸渍到磷酸盐缓冲液或者磷酸缓冲液之后进行再制冷干燥的过程中,海绵的多孔尺寸无法避免地会被破坏,因此存在很难控制其形态的问题和在利用粉碎机粉碎明胶海绵的工艺中因出现栓塞剂颗粒的形态不均匀或者表面尺寸似被剪切般不均匀问题,存在很难控制产品形态的问题。而且,所公开的工艺如果无法适当地调节冻结干燥时的水分含量,磷酸缓冲液会形成为粉末状,会引发与明胶海绵结块儿的缺点,因此也需要改善其附加工艺。技术实现要素:本发明所解决的技术问题在于克服现有的明胶海绵存在再制冷干燥会产生多孔尺寸破坏乃至粉碎时引起的栓塞剂颗粒形态不规则的缺陷,提供了明胶药物载体、明胶颗粒栓塞剂及其制备方法和应用。本发明通过将交联化的明胶发泡胶添加至磷酸盐缓冲盐水(PBS)、磷酸缓冲液(PhosphateBuffer)、Tris(三羟甲基氨基甲烷)缓冲液或者glycine(甘氨酸)缓冲液中并保持pH值在7以上,有效地改善了因再制冷干燥引发的问题。本发明的明胶颗粒栓塞剂通过将含有磷酸盐缓冲盐水、磷酸缓冲液、Tris缓冲液或者glycine缓冲液的明胶药物载体与抗癌剂结合并将此作为栓塞物质,利用肝动脉对肝癌进行非根治性治疗。本发明是通过下述技术方案解决上述技术问题的。本发明提供了一种明胶药物载体的制备方法,其包括如下步骤:在交联结构状态的明胶发泡胶里添加溶液A,并使氢离子浓度保持在从中性至碱性的pH范围内,然后对其进行干燥,即可;所述溶液A为磷酸盐缓冲盐水、磷酸缓冲液、Tris缓冲液或者glycine缓冲液,其中,所述交联结构状态的明胶发泡胶通过下述方法制备:在明胶水溶液中添加醛类固化剂,并进行搅拌使明胶溶液固化,或者将明胶水溶液加入到稳定剂中搅拌混匀后,再添加醛类固化剂固化,之后再用丙酮或蒸馏水清洗去除残留的醛类固化剂,即得交联结构状态的明胶发泡胶。本发明中,本领域技术人员根据本领域常识和本发明所述交联结构状态的明胶发泡胶的制备方法,可知晓本发明所述交联结构状态的明胶发泡胶呈现水溶液状态,并且知晓所述交联结构状态的明胶发泡胶在制备过程中,明胶水溶液和醛类固化剂进行交联反应后在溶液内形成气孔,具体状态图可参见附图1的照片。本发明中,所述交联结构状态的明胶发泡胶在添加磷酸盐缓冲盐水、磷酸缓冲液、Tris缓冲液或者glycine缓冲液前,还可先进行如下步骤:将所述交联结构状态的明胶发泡胶进行冷冻,得到冻结状态的明胶发泡胶,之后再以蒸馏水浸渍或者漂洗的方式进行清洗并脱水,以清洗除去明胶发泡胶上残留的甲醛。其中,所述冷冻的温度较佳地为-35~-45℃,所述冷冻的时间较佳地为12小时以上,例如12~16h。其中,所述冻结状态的明胶发泡胶还可先进行粉碎,再用蒸馏水浸渍或者漂洗的方式进行清洗并脱水。本领域技术人员均知晓将本发明呈现水溶液状态的所述交联结构状态的明胶发泡胶冷冻后可得到坚硬如石头般的明胶发泡胶。本发明中,所述用丙酮或蒸馏水清洗去除残留的醛类固化剂可通过用丙酮或蒸馏水反复清洗、离心分离实现,所述离心分离一般利用离心分离机进行,所述清洗的次数较佳地为5次。本发明中,所述磷酸盐缓冲盐水、磷酸缓冲液、Tris缓冲液或者glycine缓冲液起到保持pH值的功能,以用于避免pH值发生急剧变化。较佳地,所述溶液A为磷酸盐缓冲盐水或者磷酸缓冲液。本发明中,所述磷酸盐缓冲盐水为本领域常规使用的磷酸盐缓冲盐水,其组分一般包括磷酸二氢钠或磷酸二氢钾、磷酸氢二钠或磷酸氢二钾以及氯化钠和/或氯化钾。所述磷酸盐缓冲盐水可按照本领域常规方法配制。所述磷酸缓冲液为本领域常规使用的磷酸缓冲液,其组分一般包括磷酸二氢钠或磷酸二氢钾以及磷酸氢二钠或磷酸氢二钾。所述磷酸缓冲液可按照本领域常规方法配制。所述Tris缓冲液和glycine缓冲液均为本领域常规使用的Tris缓冲液和glycine缓冲液,皆市售可得。本发明中,使用的磷酸盐缓冲盐水、磷酸缓冲液、Tris缓冲液或glycine缓冲液的pH和浓度本领域技术人员可根据实际需要结合本领域常识进行选择。较佳地,所述磷酸盐缓冲盐水的浓度为12.5mM和25mM时,pH为8时最佳;所述磷酸缓冲液的浓度为12.5mM和25mM时,pH为8时最佳;所述Tris缓冲液的浓度为任意浓度时,pH为9时最佳,而浓度为12.5mM和25mM时,pH为8时最佳;所述glycine缓冲液的浓度为25mM时,pH为9时最佳。本发明中,所述干燥的方式为本领域常规操作的方式,例如除湿干燥、氮气干燥、冷风干燥、真空干燥、自然干燥、冷冻干燥和喷雾干燥中的任一方式。所述干燥为冷冻干燥时,所述冷冻干燥的温度和时间可按照本领域常规选择,所述冷冻干燥的温度一般为-35~-45℃,所述冷冻的时间一般为14小时以上,例如14~16h。较佳地,所述冷冻干燥为干燥至水分含量为10~20%,更佳地,所述冷冻干燥为干燥至水分含量为10~15%。在本发明一较佳实施例中,所述明胶药物载体的制备方法包括如下步骤:(1)明胶溶液形成工序:把明胶放入100mL的水中,浸泡30分钟并加热搅拌至明胶溶解,然后再降温至40℃,即得浓度为1~6%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:添加0.1~2mg/mL浓度的甲醛,并以500~1000rpm、1200~1400rpm或1400~1500rpm的速度进行搅拌,使其固化,以此形成明胶发泡胶;(3)离心分离工艺:利用丙酮或者蒸馏水清洗所获得的明胶发泡胶,然后离心分离;(4)明胶发泡胶加工工序:将离心分离的明胶发泡胶添加至磷酸盐缓冲盐水或者磷酸缓冲液中,使其保持pH值7以上,并清洗5次之后进行离心脱水;(5)明胶海绵形成工序:对明胶发泡胶进行冷冻干燥,即得。其中,步骤(1)中,所述明胶溶液的浓度较佳地为4~5%(w/v),所述百分比为明胶溶液中的明胶质量占明胶溶液体积的比值,单位为g/mL。其中,步骤(2)中,所述甲醛的浓度较佳地为0.1~0.5mg/mL,更佳地为0.1~0.3mg/mL。其中,步骤(2)中,所述搅拌的时间可根据本领域常规选择。较佳地,所述搅拌的速度为1400~1500rpm,所述搅拌的时间为15~30秒。其中,步骤(3)中,所述离心分离可采用本领域常规设备进行,例如离心分离机。其中,步骤(5)中,所述冷冻干燥可采用本领域常规设备进行,一般采用冷冻干燥机。在本发明另一较佳实施例中,所述明胶药物载体的制备方法包括如下步骤:(1)明胶溶液形成工序:把明胶溶解于30~70℃的水中,并通过对其过滤获得15~60%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:把明胶溶液放入质量比为1~2%的稳定剂span80当中,并使得水与油的体积比为1/1~1/10,以200~800r/min搅拌15秒,然后在10℃温度下,添加质量比为2~50%的醛类交联剂化合物,并凝固1~2h之后,通过清洗或者离心分离的方法来清除交联剂,即得明胶发泡胶;(3)明胶发泡胶加工工序:把明胶发泡胶添加至磷酸盐缓冲盐水或者磷酸缓冲液,并保持pH值为7以上,清洗5次以后进行离心脱水;(4)明胶微球体形成工序:将上述明胶发泡胶进行溶解,并进行喷雾干燥,即得。其中,步骤(1)中,所述水的温度较佳地为55~65℃。其中,步骤(1)中,所述明胶溶液的浓度较佳地为25~30%(w/v),所述百分比为明胶溶液中的明胶质量占明胶溶液体积的比值,单位为g/mL。其中,步骤(2)中,所述稳定剂span80的质量比较佳地为2%,所述质量比的数值与用质量体积比g/mL折算的数值基本一致。其中,步骤(2)中,所述水与油的体积比较佳地为1/1。其中,步骤(2)中,所述醛类交联剂化合物的质量比较佳地为6~8%,所述质量比的数值与用质量体积比g/mL折算的数值基本一致。本发明还提供了一种由上述制备方法制得的明胶药物载体。本发明还提供了一种明胶颗粒栓塞剂的制备方法,所述制备方法包括如下步骤:将上述明胶药物载体粉碎后,以包装容器的状态进行保管;并投入肝癌治疗药,使其与肝癌治疗药形成离子键。其中,所述粉碎可按照本领域常规操作进行,所述粉粹后较佳地还进行筛分,所述筛分较佳地按照50~100μm、100~300μm、300~500μm、500~700μm、500~700μm、700~1000μm、1000~1500μm、1500μm~2000μm的粒径进行筛分。其中,所述肝癌治疗药剂为本领域常规的肝癌治疗药剂。本领域技术人员均知晓在投入所述肝癌治疗药剂的同时一般还一并投入生理盐水、蒸馏水或无菌水稀释。本发明还提供了一种由上述制备方法制得的明胶颗粒栓塞剂。本发明还提供了一种上述明胶颗粒栓塞剂在肝动脉化疗栓塞术中的应用。在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:(1)本发明通过将交联化的明胶发泡胶利用丙酮或蒸馏水清洗后,添加至磷酸盐缓冲盐水、磷酸缓冲液、Tris缓冲液或者glycine缓冲液并保持pH值在7以上,有效地改善了因再制冷干燥引发的多孔尺寸的破坏及进行粉碎时产生的栓塞剂颗粒形态出现不规则等问题,这将更加有益于使用于肝动脉化疗栓塞术中。(2)本发明通过将肝癌治疗药剂结合到明胶海绵或者明胶微球体中,并将其作为栓塞物质,能够对肝癌进行非根治性治疗,并且具有当复发率较高的肝癌患者需要再次进行手术时,还可以进行利用药物缓释微球的化疗栓塞术的效果。(3)本发明提供的一种明胶药物载体——明胶微球体是一种在体内分解的微球,具体为在肝癌治疗中注射到肝时经过规定时间后在体内分解的微球,在这期间遮断对血管型的恶性肿瘤供给的血液,药物缓释微球局部地分解并持续地将药物递送(DrugDelivery)到肿瘤,从而减少由抗癌药流入全身血流引起的副作用,并增加肿瘤反应。附图说明图1为本发明交联结构状态的明胶发泡胶的溶液状态图。图2为本发明明胶药物载体的制备方法的顺序流程示意图。图3为本发明交联结构状态的明胶发泡胶浸渍在磷酸盐缓冲盐水中的状态的立体示意图。图4为本发明交联结构状态的发泡胶浸渍在磷酸盐缓冲液中的状态的立体示意图。图5为本发明的明胶海绵在粉碎成粉末的状态下放入小药瓶中包装处理后的状态的立体示意图。图6为本发明被保管在小药瓶中的明胶海绵中结合生理盐水或蒸馏水以及抗癌药的状态的立体示意图。图7为利用本发明实验例在420nm波长下检测的各个浓度的阿雷素吸光度的检测结果图。图8为利用本发明实验例在450nm波长下检测的各个浓度的阿雷素吸光度的检测结果图。图9为利用本发明实验例在510nm波长下检测的各个浓度的阿雷素吸光度的检测结果图。图10为根据本发明实验例中水化溶液的种类的明胶粒子的阿雷素吸附能力的吸光度检测结果图。图11为根据本发明实验例中水化溶液的种类的明胶粒子的阿雷素吸附能力的阿雷素浓度检测结果图。图12为本发明实验例中从生理盐水洗脱出来的阿雷素。图13为对照组明胶海绵的数码照片(a)和不同放大倍率下的SEM照片(b、c)。图14为对照组明胶微球体的SEM照片。图15为本发明明胶海绵的SEM照片。图16为本发明明胶微球体的显微镜照片和SEM照片。附图标记说明如下:10明胶海绵20磷酸盐缓冲盐水30磷酸盐缓冲液具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。下述说明书附图中,与说明无关的部分进行了省略,以更清楚地说明本发明,对于相似的部分,标记相似的附图标记。实施例1一种明胶药物载体,其制备流程图如图2所示,具体制备方法如下:(1)明胶溶液形成工序:把明胶放入100mL的水中,浸泡30分钟并加热搅拌至明胶溶解,然后再降温至40℃,以获得浓度为4%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:向所得明胶溶液中添加0.5mg/mL浓度的甲醛,并以1400~1500rpm的速度搅拌15~30秒,使其明胶溶液固化,以此形成交联结构状态的明胶发泡胶;(3)离心分离工艺:利用丙酮清洗所获得的明胶发泡胶,然后利用离心分离机进行离心分离;(4)明胶发泡胶加工工序:将离心分离后的明胶发泡胶添加至pH为8,浓度为12.5mM的磷酸盐缓冲盐水中,并使其保持pH值7以上,且清洗5次之后进行离心脱水;其中明胶发泡胶浸渍在磷酸盐缓冲盐水中的状态的立体图可参见图3;(5)明胶海绵形成工序:利用冷冻干燥机对上述明胶发泡胶进行干燥,使水分达到10~15%,以此形成明胶海绵。所得明胶海绵的外形和多孔尺寸稳定,孔隙大小均一,孔隙大小和厚度处于最佳状态。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:对上述所得的明胶海绵进行粉碎,粉碎后按照50~100μm、100~300μm、300~500μm、500~700μm粒径进行筛分,并将筛分选别后的颗粒以包装容器的状态进行保管,具体可参见图5,然后利用生理盐水稀释后投入到肝癌治疗药剂中,以此诱导离子键耦合,具体可参见图6;其中,完成粉碎及选别工序的明胶海绵被保管至装有pH为8,浓度为12.5mM的磷酸盐缓冲盐水的包装容器中保管,然后投入生理盐水和抗癌药,使其相互诱导离子耦合,以此作为一种肝癌治疗药使用。实施例2一种明胶药物载体,其制备流程图如图2所示,具体制备方法如下:(1)明胶溶液形成工序:把明胶放入100mL的水中,浸泡30分钟并加热搅拌至明胶溶解,然后再降温至40℃,以获得浓度为5%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:向所得明胶溶液中添加0.3mg/mL浓度的甲醛,并以1400~1500rpm的速度搅拌15~30秒,使其明胶溶液固化,以此形成交联结构状态的明胶发泡胶;(3)离心分离工艺:利用蒸馏水清洗所获得的明胶发泡胶,然后利用离心分离机进行离心分离;(4)明胶发泡胶加工工序:将离心分离后的明胶发泡胶添加至pH为8,浓度为25mM的磷酸缓冲液中,并使其保持pH值7以上,且清洗5次之后进行离心脱水;其中明胶发泡胶浸渍在磷酸缓冲液中的状态的立体图可参见图4;(5)明胶海绵形成工序:利用冷冻干燥机对上述明胶发泡胶进行干燥,使水分达到10~15%,以此形成明胶海绵。所得明胶海绵的外形和多孔尺寸稳定,孔隙大小均一,孔隙大小和厚度处于最佳状态。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶海绵进行粉碎,粉碎后按照50~100μm、100~300μm、300~500μm、500~700μm粒径进行筛分,并将筛分选别后的颗粒以包装容器的状态进行保管,具体可参见图5,然后利用蒸馏水稀释后投入到肝癌治疗药剂中,以此诱导离子键耦合,具体可参见图6;其中,完成粉碎及选别工序的明胶海绵被保管至装有pH为8,浓度为25mM的磷酸缓冲液的包装容器中保管,然后投入蒸馏水和抗癌药,使其相互诱导离子耦合,以此作为一种肝癌治疗药使用。实施例3一种明胶药物载体,其制备流程图如图2所示,具体制备方法如下:(1)明胶溶液形成工序:把明胶放入100mL的水中,浸泡30分钟并加热搅拌至明胶溶解,然后再降温至40℃,以获得浓度为1%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:向所得明胶溶液中添加0.1mg/mL浓度的甲醛,并以500~1000rpm的速度进行搅拌,使其明胶溶液固化,以此形成交联结构状态的明胶发泡胶;(3)离心分离工艺:利用丙酮清洗所获得的明胶发泡胶,然后利用离心分离机进行离心分离;(4)明胶发泡胶加工工序:将离心分离后的明胶发泡胶添加至pH为8,浓度为12.5mM的Tris缓冲液中,并使其保持pH值7以上,且清洗5次之后进行离心脱水;(5)明胶海绵形成工序:利用冷冻干燥机对上述明胶发泡胶进行干燥,使水分达到15~20%,以此形成明胶海绵。所得明胶海绵的外形和多孔尺寸较为稳定,孔隙大小不均一。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶海绵进行粉碎,粉碎后按照50~100μm、100~300μm、300~500μm、500~700μm粒径进行筛分,并将筛分选别后的颗粒以包装容器的状态进行保管,具体可参见图5,然后利用蒸馏水稀释后投入到肝癌治疗药剂中,以此诱导离子键耦合,具体可参见图6;其中,完成粉碎及选别工序的明胶海绵被保管至消毒完毕的小药瓶中保管,然后投入蒸馏水和抗癌药,使其相互诱导离子耦合,以此作为一种肝癌治疗药使用。实施例4一种明胶药物载体,其制备流程图如图2所示,具体制备方法如下:(1)明胶溶液形成工序:把明胶放入100mL的水中,浸泡30分钟并加热搅拌至明胶溶解,然后再降温至40℃,以获得浓度为6%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:向所得明胶溶液中添加0.1mg/mL浓度的甲醛,并以1200~1400rpm的速度进行搅拌,使其明胶溶液固化,以此形成交联结构状态的明胶发泡胶;(3)离心分离工艺:利用丙酮清洗所获得的明胶发泡胶,然后利用离心分离机进行离心分离;(4)明胶发泡胶加工工序:将离心分离后的明胶发泡胶添加至pH为9,浓度为25mM的glycine缓冲液中,并使其保持pH值7以上,且清洗5次之后进行离心脱水;(5)明胶海绵形成工序:利用冷冻干燥机对上述明胶发泡胶进行干燥,使水分达到10~15%,以此形成明胶海绵。所得明胶海绵的外形和多孔尺寸较为稳定,孔隙大小和厚度处于较佳状态。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶海绵进行粉碎,粉碎后按照50~100μm、100~300μm、300~500μm、500~700μm粒径进行筛分,并将筛分选别后的颗粒以包装容器的状态进行保管,具体可参见图5,然后利用蒸馏水稀释后投入到肝癌治疗药剂中,以此诱导离子键耦合,具体可参见图6;其中,完成粉碎及选别工序的明胶海绵被保管至装有pH为8,浓度为12.5mM的磷酸盐缓冲盐水的包装容器中保管,然后投入蒸馏水和抗癌药,使其相互诱导离子耦合,以此作为一种肝癌治疗药使用。实施例5一种明胶药物载体,其制备流程图如图2所示,具体制备方法如下:(1)明胶溶液形成工序:把一定量的明胶溶解于55~65℃的水中,并通过对其过滤获得浓度为25~30%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:把明胶溶液放入质量比为2%的稳定剂span80当中,并使得水与油的体积比为1/1,以500r/min搅拌15秒,然后在10℃温度下,添加质量比为6~8%的醛类交联剂化合物,并凝固1~2h之后,通过清洗或者离心分离的方法来清除交联剂,即得交联结构状态的明胶发泡胶;(3)明胶发泡胶加工工序:把明胶发泡胶添加至pH为8,浓度为25mM的磷酸盐缓冲盐水中,并保持pH值为7以上,清洗5次以后进行离心脱水;(4)明胶微球体形成工序:溶解上述明胶发泡胶,利用喷雾干燥机进行喷雾干燥,以此形成明胶微球体。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶微球体按照50~100μm、100~300μm、300~500μm、500~700μm、700~1000μm、1000~1500μm的大小进行筛选;筛选后的明胶微球体以包装容器的状态进行保管,然后利用生理盐水稀释后注入肝癌治疗药剂,以此诱导键合离子键;其中,完成粉碎及筛选工序的明胶微球体被保管至装有pH为8,浓度为25mM的磷酸盐缓冲盐水的包装容器中保管,然后投入生理盐水和抗癌药,使其相互键合形成离子键,以此作为一种肝癌治疗药使用。通过上述实施例5获得的明胶微球体作为微小型球形栓塞剂,已确认到其内部为海绵状,不仅吸水力优秀,而且尺寸均一,最重要的是确认到其具有一定弹性及膨胀力。实施例6一种明胶药物载体,其制备流程图如图2所示,具体制备方法如下:(1)明胶溶液形成工序:把一定量的明胶溶解于30~40℃的水中,并通过对其过滤获得浓度为15~25%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:把明胶溶液放入质量比为2%的稳定剂span80当中,并使得水与油的体积比为1/2,以500r/min搅拌15秒,然后在10℃温度下,添加质量比为2~4%的醛类交联剂化合物,并凝固1~2h之后,通过清洗或者离心分离的方法来清除交联剂,即得交联结构状态的明胶发泡胶;(3)明胶发泡胶加工工序:把明胶发泡胶添加至pH为8,浓度为12.5mM的磷酸盐缓冲盐水中,并保持pH值为7以上,清洗5次以后进行离心脱水;(4)明胶微球体形成工序:溶解上述明胶发泡胶,利用喷雾干燥机进行喷雾干燥,以此形成明胶微球体。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶微球体按照50~100μm、100~300μm、300~500μm、500~700μm、700~1000μm、1000~1500μm的大小进行筛选;筛选后的明胶微球体以包装容器的状态进行保管,然后利用生理盐水稀释后注入肝癌治疗药剂,以此诱导键合离子键;其中,完成粉碎及筛选工序的明胶微球体被保管至装有pH为8,浓度为12.5mM的磷酸盐缓冲盐水的包装容器中保管,然后投入生理盐水和抗癌药,使其相互键合形成离子键,以此作为一种肝癌治疗药使用。通过上述实施例6获得的明胶微球体作为微小型球形栓塞剂,已确认到其内部为海绵状,不仅吸水力优秀,而且尺寸均一,最重要的是确认到其具有一定弹性及膨胀力。实施例7一种明胶药物载体,其制备流程图如图2所示,具体制备方法如下:(1)明胶溶液形成工序:把一定量的明胶溶解于60~70℃的水中,并通过对其过滤获得浓度为50~60%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:把明胶溶液放入质量比为1%的稳定剂span80当中,并使得水与油的体积比为1/10,以500r/min搅拌15秒,然后在10℃温度下,添加质量比为45~50%的醛类交联剂化合物,并凝固1~2h之后,通过清洗或者离心分离的方法来清除交联剂,即得交联结构状态的明胶发泡胶;(3)明胶发泡胶加工工序:把明胶发泡胶添加至pH为8,浓度为12.5mM的磷酸缓冲液中,并保持pH值为7以上,清洗5次以后进行离心脱水;(4)明胶微球体形成工序:溶解上述明胶发泡胶,利用喷雾干燥机进行喷雾干燥,以此形成明胶微球体。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶微球体按照50~100μm、100~300μm、300~500μm、500~700μm、700~1000μm、1000~1500μm的大小进行筛选;筛选后的明胶微球体以包装容器的状态进行保管,然后利用蒸馏水稀释后注入肝癌治疗药剂,以此诱导键合离子键;其中,完成粉碎及筛选工序的明胶微球体被保管至装有pH为8,浓度为12.5mM的磷酸缓冲液的包装容器中保管,然后投入蒸馏水和抗癌药,使其相互键合形成离子键,以此作为一种肝癌治疗药使用。通过上述实施例7获得的明胶微球体作为微小型球形栓塞剂,已确认到其内部为海绵状,不仅吸水力优秀,而且尺寸均一,最重要的是确认到其具有一定弹性及膨胀力。实施例8一种明胶药物载体,其制备方法包括如下步骤:(1)明胶溶液形成工序:把明胶放入100mL的水中,浸泡30分钟并加热搅拌至明胶溶解,然后再降温至40℃,以获得浓度为4%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:向所得明胶溶液中添加0.5mg/mL浓度的甲醛,并以1400~1500rpm的速度搅拌15~30秒,使其明胶溶液固化,以此形成明胶发泡胶,将所得明胶发泡胶在-35~-45℃下冷冻12~16h,得到冻结状态的明胶发泡胶;(3)离心分离工艺:利用蒸馏水浸渍清洗所获得的明胶发泡胶,然后利用离心分离机进行离心分离脱水;(4)明胶发泡胶加工工序:将离心分离后的明胶发泡胶添加至pH为8,浓度为25mM的磷酸盐缓冲盐水中,并使其保持pH值7以上,且清洗5次之后进行离心脱水;(5)明胶海绵形成工序:利用冷冻干燥机对上述明胶发泡胶在-35~-45℃下冷冻干燥14~16h,以此形成明胶海绵。所得明胶海绵的外形、多孔尺寸稳定性、孔隙大小和厚度与实施例1相当。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶海绵按照50~100μm、100~300μm、300~500μm、500~700μm、700~1000μm、1000~1500μm、1500~2000μm的大小进行筛选;筛选后的明胶海绵以包装容器的状态进行保管,然后利用蒸馏水稀释后注入肝癌治疗药剂,以此诱导键合离子键;其中,完成粉碎及筛选工序的明胶海绵被保管至装有pH为8,浓度为25mM的磷酸盐缓冲盐水的包装容器中保管,然后投入蒸馏水和抗癌药,使其相互键合形成离子键,以此作为一种肝癌治疗药使用。实施例9一种明胶药物载体,其制备方法包括如下步骤:(1)明胶溶液形成工序:把明胶放入100mL的水中,浸泡30分钟并加热搅拌至明胶溶解,然后再降温至40℃,以获得浓度为4%(w/v)的明胶溶液;(2)明胶发泡胶形成工序:向所得明胶溶液中添加0.5mg/mL浓度的甲醛,并以1400~1500rpm的速度搅拌15~30秒,使其明胶溶液固化,以此形成明胶发泡胶,将所得明胶发泡胶在-35~-45℃下冷冻12~16h,得到冻结状态的明胶发泡胶;(3)离心分离工艺:利用蒸馏水漂洗所获得的明胶发泡胶,然后利用离心分离机进行离心分离脱水;(4)明胶发泡胶加工工序:将离心分离后的明胶发泡胶添加至pH为8,浓度为12.5mM的磷酸盐缓冲盐水中,并使其保持pH值7以上,且清洗5次之后进行离心脱水;(5)明胶海绵形成工序:利用冷冻干燥机对上述明胶发泡胶在-35~-45℃下冷冻干燥14~16h,以此形成明胶海绵。所得明胶海绵的外形、多孔尺寸稳定性、孔隙大小和厚度与实施例1相当。一种明胶颗粒栓塞剂,其由包括如下步骤的方法制备:将上述所得的明胶海绵按照50~100μm、100~300μm、300~500μm、500~700μm、700~1000μm、1000~1500μm、1500~2000μm的大小进行筛选;筛选后的明胶海绵以包装容器的状态进行保管,然后利用蒸馏水稀释后注入肝癌治疗药剂,以此诱导键合离子键;其中,完成粉碎及筛选工序的明胶海绵被保管至装有pH为8,浓度为12.5mM的磷酸盐缓冲盐水的包装容器中保管,然后投入蒸馏水和抗癌药,使其相互键合形成离子键,以此作为一种肝癌治疗药使用。效果实施例1本效果实施例所使用的静脉注射用阿雷素是日东制药公司的ADRIAMYCIN-RDF(10mg小药瓶)。通过把药剂溶于10mL的无菌蒸馏水的方法制作了1mg/mL的stocksolution,并将其保管于4℃环境下,应用于实验当中。利用水溶液状态的阿雷素呈红色的特性,使用分光光度计来替代精度管理较为复杂的HPLC,确认是否能够简单地对阿雷素进行定量。为了在吸光度检测值和阿雷素浓度之间,具有比例相关性的光源波长,利用多种波长检测了阿雷素溶液的吸光度。首先,通过把stocksolution稀释到蒸馏水当中,准备浓度各为20ug/mL、40ug/mL、60ug/mL、80ug/mL、100ug/mL的阿雷素之后,在420nm、450nm及510nm的波长下检测了各自的吸光度值。检测结果见下表1和图6~8。在三种波长当中,都观察了与各个浓度的阿雷素的吸光度检测值准确地呈比例的结果,本研究利用450ml的波长进行了实验。表1根据检测波长阿雷素各浓度的吸光度效果实施例2为了检测阿雷素吸附至明胶微粒的条件,把颗粒水化(hydration)到多种溶液里。在此所使用的溶液为包括磷酸缓冲生理盐水(PBC)的12种缓冲液和无菌及生理盐水(normalsaline)。表2明胶微粒水化(hydration)溶液No.溶液No.溶液1200mMTris-HClpH9.88100mMcitratepH32200mMTris-HClpH89100mMcitratepH43200mMTris-HClpH7.510100mMcitratepH54200mMTris-HClpH6.811100mMcitratepH65200mMTris-KClpH2D.W无菌水6200mMglycinepH3Saline0.85%NaCl7200mMglycinepH9.6PBS磷酸盐缓冲盐水pH7.5明胶微粒的水化过程概要如下。把10mL本发明的明胶颗粒分别放入表2所示的14种溶液中,并在4℃下搅拌一个晚上。把1mL的此悬浮液移到e-tube后,进行10分钟vortexing。将其在13000rpm下进行2分钟的离心分离之后,清除上层清液,并添加稀释为200ug/mL的阿雷素溶液1mL,并进行10分钟vortexing。之后,再将其在13000rpm下进行2分钟的离心分离之后,在450nm下,检测了上层清液的吸光度。检测结果如下表3及图9~10,吸光度检测值和阿雷素的浓度值越低,其药剂在明胶微粒当中的吸附越好。效果实施例3表3根据水化溶液种类的明胶微粒的阿雷素吸附能力(上层清液液位吸光度检测值及阿雷素浓度)溶液吸光度阿雷素浓度(ug/mL)0.2mg/mL2.762195.0493D.W2.736193.2183Saline2.686189.6972PBS0.84159.7676110.0947.16197220.51937.0915530.86661.5281741.23887.7253552.85201.246562.842200.683170.1037.79577582.768195.471892.736193.2183102.522178.1479111.47104.0634在蒸馏水和生理盐水进行水化的凝胶粒子上阿雷素几乎没有吸附,而在PBS上进行水化的凝胶粒子上则有相当数量的阿雷素吸附。但是,值得注意的是,不管缓冲液的种类,根据pH条件来左右阿雷素的吸附。Tris及glycine缓冲液,在其最强碱性值pH-9.6~9.8下,大部分的药剂被吸附,而在pH值3~4的glycine,柠檬酸盐缓冲液当中,几乎没有发生阿雷素的吸附。综合这些结果,可以理解为pH值高的碱性状态下易于进行吸附,而酸性状态越强,出现吸附被抑制,满足此条件的化学键可以举离子键(ionicbond)。为了确认吸附到明胶微粒上的阿雷素的化学键是否是可逆性结合,所以把吸附有阿雷素的凝胶粒子与pH值呈中性的生理盐水进行了反应。把因吸附药材而呈红色的凝胶粒子悬浮到蒸馏水上,并在13000rpm下进行2分钟离心分离后,扔掉上层清液,并在此添加0.5mL的生理盐水,以此把凝胶粒子再次悬浮后,进行10分钟的vortexing。之后,再将其在13000rpm下进行2分钟的离心分离之后,在450nm下,检测了上层清液的吸光度。检测结果如下表4及图11。PBS和Tris及glycine缓冲液中被吸附到凝胶粒子当中的阿雷素被生理盐水洗脱出来,从此确认到洗脱程度根据pH值为临近中性的缓冲液,其被吸附的药剂最易于分离。综合这些观察结果,水化缓冲液的碱性越强,对凝胶粒子的阿雷素的吸附率就越高,而与此相比,水化中使用了靠近中性的缓冲液时,被吸附的药剂的洗脱率则高。表4洗脱至生理盐水的阿雷素效果实施例4为了了解根据水化溶液的种类和浓度的明胶粒子所具有的吸附阿雷素的能力,把粒子水化(Hydration)到多种溶液里。在此所使用的溶液为,包括Tris缓冲液,glycine缓冲液,磷酸钠缓冲液,D.W.,0.2mg/mL,PBS(pH7.4),不含KCl的PBSpH7.4,不含NaCl的PBSpH7.4,不含KCl和NaCl的PBSpH7.4等的磷酸缓冲生理盐水(PBS)的11种缓冲液和无菌水以及生理盐水(normalsaline)。表5明胶微粒水化(hydration)溶液Tris缓冲液在pH值9时,不管摩尔浓度如何,出现最强的吸附力,Tris缓冲液在pH值8时,在12.5mM和25mM下出现最强的吸附力,且从摩尔浓度越高其吸附力就越强的实验结果而言,与Tris缓冲液呈相反的结果。磷酸钠缓冲液pH值8在12.5mM和25mM下出现最强的吸附力,而磷酸钠缓冲液pH值7在25mM下出现最强的吸附力。另外,BPS缓冲液为NaCl时,其吸附力最好。表6PBSph7.4和不含KCl和NaCl的PBSpH7.4的各浓度吸附力表7根据PBSpH的吸附力PBS,pH9.50.605PBS,pH4.52.500100mMTris-磷酸盐,pH110.191效果实施例5为了了解根据水化溶液磷酸钠缓冲液的pH值和浓度的明胶粒子的阿雷素吸附能力,把粒子水化(Hydration)至溶液里。在此所使用的溶液为1种缓冲液和无菌水以及生理盐(NormalSaline)。表8明胶微粒水化(hydration)溶液效果实施例6对本发明实施例制得的明胶海绵和明胶微球体的微观结构进行表征,并选用韩国专利申请KR20150107270中的明胶海绵和明胶微球体作为对照组,KR20150107270中明胶海绵及明胶微球体的原料与本申请不同,其以市售明胶海绵为起始原料,而本发明以明胶发泡胶为起始原料,具体表征结果参见附图13-16。图13为对照组明胶海绵的数码照片(a)和不同放大倍率下的SEM照片(b、c)。由图13可知,对照组的明胶海绵孔隙大小不均一,且孔隙形成得较大。图14为对照组明胶微球体的SEM照片。图15为本发明明胶海绵不同放大倍率下的SEM照片。由图14可知,本发明明胶海绵的孔隙大小均一,孔结构稳定。图16为本发明明胶微球体的显微镜照片(a)和SEM照片(b)。比较图16和图14可知,采用本发明明胶发泡胶为起始原料制得的微球体仍保持了较好的孔结构。应该理解如上述的本发明的说明只是为了例示,本发明所属的
技术领域:
中的本领域技术人员在不变更本发明的技术构思或必要特征的情况下,能够以其他具体方式容易进行变形。因此,应该理解以上记载的实施例是在所有方面上的例示,并不是限定性的。例如,以单一形式进行说明的各构成要素,也可以被分散地实施,同样被分散地进行说明的构成要素也可以以结合的形式被实施。本发明的范围不是通过
发明内容而是由后附的权利要求书来体现,应解释为,权利要求书的含义和范围以及由其均等的概念推导出的所有变更或变形的方式均包含在本发明的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1