低密度的无定形载体颗粒及其制备方法和应用与流程
本发明涉及药物制剂技术领域,特别是涉及一种低密度的无定形载体颗粒及其制备方法和应用。
背景技术:
肺部药物传递系统(pulmonary drug delivery system,PDDS)是通过特殊给药装置将颗粒状药物传递到肺部,以非侵入的方式进入人体,可有效实现靶向肺部给药、全身给药和大分子给药。肺部上有3-4亿个肺泡,呼吸道的面积高达70-140m2的面积,而且肺泡上皮细胞壁或毛细血管壁的厚度只有0.5~1μm,药物通过交换的距离很短,膜通透性较高,吸收速度快,药物极易穿透肺泡,使活性成分快速传递;粘膜下的肺泡毛细血管网丰富,药物浓度可形成梯度分布,有效的分段进入血液循环。由于吸收面积巨大、跨膜间距极小所以肺部为药物吸收提供很好的环境;药物可直接到达肺部病灶部位,降低给药剂量及毒副反应,这对于需局部长期治疗的疾病如哮喘、慢性肺阻塞极其重要。因此,肺部药物传递系统已成为治疗肺部疾病主要的发展方向。
吸入给药一般包括以下3种方式:雾化吸入剂(Nebulizer)、定量吸入剂(Pressurized metered dose inhaler,pMDI)和干粉吸入剂(Dry Power Inhalers,DPI)。干粉吸入剂又称吸入粉雾剂是在定量吸入气雾剂的基础上,综合粉体学的知识发展起来的新剂型,系指固体微粉化药物单独或与合适载体混合后,以胶囊、泡囊或多剂量贮库形式,采用特制的干粉吸入装置,由患者吸入雾化药物至肺部的制剂。相比pMDI,干粉吸入剂携带方便,不使用抛射剂,微粉化的固体颗粒能够较多的到达病灶部位,这种剂型对于蛋白质大分子类药物的破坏程度较小,很好的实现药物的药效。患者使用干粉吸入剂主动吸入药粉,消除了给药协同配合的问题,无大气污染,对呼吸道没有刺激,且不含有酒精及防腐剂等。
DPI的临床疗效由肺部总沉积决定。呼吸道的生理结构、患者的呼吸道和肺部疾病状况,均可影响药物在肺部的沉积,而药物粉末的处方组成及干粉吸入装置的类型则是影响药物肺沉积的主要因素。作为微粉给药系统,DPI干粉的粉体学性质尤为重要,是DPI肺部给药的基础,直接影响干粉的流动性、分散性以及雾化性能。干粉的粉体学性质包括颗粒粒径、粒度分布、晶型、表面形态和表面静电荷等,只有具备适合DPI肺部沉积粉体学性质的药物颗粒,才能到达肺部病灶区域,实现预期临床疗效。目前,公认的适合肺部传递药物颗粒的质量中质空气流动力学直径(mass median aerodynamic diameter,MMAD)应小于5μm,该粒径范围内,颗粒粒径越小,药物肺部总沉积、外周支气管沉积和吸收速率越大,反之亦然。粒径小于5μm的颗粒分数称为可吸入细粉分数(fine particle fraction,FPF),通常采用新型颗粒分布撞击器(next-generation pharmaceutical impactor,NGI)测量干粉粒径分布(如FPF),从而评价药物体外雾化性能。
干粉吸入剂主要包括载体型和无载体型两大类。无载体粉雾剂则由一定剂量的药物微粉单独组成,由于呼吸道独特的生理结构,一般要求药物微粉粒径为0.5~5μm,此粒径的药物受药物自身理化性质如静电引力的影响作用,流动性较差。载体型干粉吸入剂主要由载体与药物微粉混合而成,小剂量药物微粉通过吸附于载体表面以提高其流动性,减少在口腔、咽喉及上呼吸道中的沉降,使药物更多地到达肺部产生药效。而且由于药物的加工性能劣于载体、故更多考虑改善载体的性质以提高FPF。
技术实现要素:
基于此,本发明提供了一种低密度的无定形载体颗粒,该无定形载体颗粒具有密度低、非晶型、热力学稳定性高、对湿度不敏感的特点,作为干粉吸入剂载体可有效提高DPI的药物沉积效率,减少水分对其晶型的影响。
具体技术方案如下:
一种低密度的无定形载体颗粒,由小分子糖醇、羟丙基-β-环糊精和溶剂通过喷雾干燥的方法制备而成,所述小分子糖醇选自海藻糖、棉子糖、赤藓糖醇、木糖醇、山梨醇和乳糖中的至少一种;所述小分子糖醇和羟丙基-β-环糊精的质量比为90:10-10:90。
在其中一些实施例中,所述小分子糖醇和羟丙基-β-环糊精的质量比为80:20-20:80。
在其中一些实施例中,所述小分子糖醇和羟丙基-β-环糊精的质量比为60:40-20:80。
在其中一些实施例中,所述分子糖醇和羟丙基-β-环糊精的质量比为45:55-35:65。
在其中一些实施例中,所述小分子糖醇为赤藓糖醇。
在其中一些实施例中,所述溶剂为水。
本发明还提供了上述低密度的无定形载体颗粒的制备方法。该制备方法简单,可一步制备得到低密度的无定形载体颗粒产品。
具体技术方案如下:
一种上述的低密度的无定形载体颗粒的制备方法,包括以下步骤:将小分子糖醇和羟丙基-β-环糊精溶于溶剂中,得到溶液A;将溶液A进行喷雾干燥,即得所述低密度的无定形载体颗粒;
所述溶液A中小分子糖醇和羟丙基-β-环糊精的总浓度为30-70g/ml;
所述喷雾干燥的条件包括:进风温度120-150℃,出风温度80-95℃,雾化压力100-180Kpa,泵液速率3-10ml/min。
在其中一些实施例中,所述进风温度为125-135℃,所述出风温度为80-90℃。
在其中一些实施例中,所述雾化压力为110-150KPa。
在其中一些实施例中,所述雾化压力为115-125KPa。
在其中一些实施例中,所述泵液速率为5-9ml/min。
在其中一些实施例中,所述溶液A中小分子糖醇和羟丙基-β-环糊精的总浓度为40-60mg/ml。
本发明还提供了上述低密度的无定形载体颗粒的应用。
具体技术方案如下:
上述低密度的无定形载体颗粒作为干粉吸入剂载体在制备干粉吸入剂中的应用。
本发明还提供了一种干粉吸入剂。
具体技术方案如下:
一种干粉吸入剂,由药物与干粉吸入剂载体制备而成,所述干粉吸入剂载体为上述的低密度的无定形载体颗粒。
在其中一些实施例中,所述药物为难溶性类固醇及其盐(如布地奈德)、水溶性喹诺酮类抗菌药(盐酸环丙沙星)或水溶性苯乙胺类抗抑郁药(文拉法辛)。
在其中一些实施例中,所述药物与干粉吸入剂载体的质量比为1:10-50。
在其中一些实施例中,所述药物与干粉吸入剂载体的质量比为1:25-35。
本发明通过选择特定的小分子多糖醇和羟丙-β-环糊精以特定比例配合制备得到一种低密度的无定形载体颗粒,该无定形的载体颗粒具有密度低,稳定的无定形状态且热力学稳定性高、对湿度不敏感的特点,将其作为干粉吸入剂载体能有效提高干粉吸入剂的药物有效沉积率,同时可降低干粉吸入剂对储存环境的要求。其原理如下:
粒径大小是影响干粉吸入剂吸入效果的关键因素,由于实际中颗粒的形态常常不规则,因此可用一个具有相同表面积或相同体积的球体代表之,将它作为被测定粒子的等价球体。用这一等价球体的直径代表被测定的形态不规则的粒子的粒径,测得的直径称为球形等价径(diameter of an equivalent sphere,d)。然而,气雾中粒子多为运动粒子,其行为又与静止粒子不同。所以目前认为,评估气雾粒子粒径比较合理的方法是使用空气动力学粒径(aerodynamic diameter,dae)来表示。两种粒径的关系如下式所示:
dae=d(ρp/ρ0X)1/2
其中ρp为颗粒密度,ρ0为参照密度,等于1g·cm-3,X为动态形态因子(球形时,X=1)。这就将粒子的大小、密度和形态联系起来,并由一个值表示。
空气动力学直径和吸入气流情况共同决定了颗粒沉积的效果。所谓FPF值,即肺部药物传递系统中空气动力学粒径dae≤5μm的粒子质量占全部粒子总质量的比例。FPF值越高,代表粒子空气动力学性能越好,能有效沉积到肺部的粒子比例越高,故通常认为DPIs的FPF值越高,吸入性能越好。FPF的定义来源于一系列研究:dae<1μm的粒子将被呼出,而dae>10μm一般在沉积在上呼吸道,能够最有效沉积到肺部的药物粒子则在1~5μm。
关于载体粒径和DPIs的FPF之间的相关性已有了较为系统的阐释。当载体和药物的比值保持恒定而载体粒径减小时,药物的FPF提高,这主要基于粒径效应产生的“四增一减”现象:载体的粒径减小,单位质量的载体粒子数量增加,单个载体上吸附的药物粒子减小,载体粒子表面积增加,载体粒子间的内聚力增加,载体粒子在流化和雾化过程中的碰撞几率增加。虽然粒径小的载体可以增加FPF,但同时会带来粒子流动性差、药物含量不均一以及药物颗粒聚集等问题,可能影响最终制剂的药学性能。
同样的,载体形态对DPIs的FPF也有一定的影响,但是以载体形态为指标用于指导干粉吸入剂的研制还面临着挑战:第一,特异形态的颗粒难以批量生产;第二,由于测量误差,目前采用的形状系数依然不足以用来客观地研究载体形态对DPIs雾化效率的影响;第三,采用显微镜对载体成像时无法对相关指标进行量化。
因此,当我们将载体颗粒的粒径和形态固定时,密度将对dae的大小起决定性作用,降低载体颗粒的密度,可有效地提高雾化和沉积性能,所需吸入速度慢,更易进入下呼吸道,从而大幅提高肺部生物利用度和药物疗效。
另外,无定形状态的载体颗粒可提高难溶性药物的生物利用度,同时能维持蛋白、多肽类药物的构象,大大提高蛋白多肽类药物的活性及生物利用度,扩大了各种药物和载体的组合。但是无定形态存在物理稳定性差的问题,尤其是肺部给药系统的载体大多为小分子糖醇类,而这些小分子糖醇的稳定晶型都是几水化物,稳定性低,有吸水转变成稳定晶型的趋势。而吸水后,其表面吸附水分后会产生表面张力及毛细管引力,影响粒子的大小、结晶形态,使粉末聚集,从而影响粉体的流动性和分散性,最终降低干粉吸入剂的雾化。同时无定形态吸水转变,导致湿度增加还会破坏蛋白质的化学稳定性。本发明的发明人通过大量的创造性实验研究发现在小分子糖醇中添加一定量的羟丙-β-环糊精可起到稳定剂的作用,可抑制小分子糖醇从无定形状态向结晶状态的转变,可提高所制备载体颗粒的热力学稳定性,保持载体颗粒的无定形状态,以提高药物肺部生物利用度和药物疗效。
目前制备低密度载体的方法大多为双乳剂溶剂蒸发法、重结晶法和喷雾干燥法。双乳剂溶剂蒸发法大多使用模板剂及大量表面活性剂,并且步骤繁琐。而重结晶法得到的产物产率低,制备不易。喷雾干燥的方法比较简单,且能形成无定形的载体颗粒,但文献报道大多都使用大量有机溶剂及表面活性剂,不利于肺部给药。本发明采用的喷雾干燥法一步制备低密度的无定形载体颗粒,所用溶剂为水,没有添加任何有机溶剂,克服了双乳剂溶剂蒸发法、重结晶法存在的步骤繁琐、有机溶剂残留、表面活性剂添加剂过多的问题。
因此,本发明的低密度的无定形载体颗粒及其制备方法和应用具有以下优点和有益效果:
(1)本发明的低密度的无定形载体颗粒具有密度低、无定形状态稳定、物理化学稳定性高、流动性好、对湿度不敏感的特点,将其作为干粉吸入剂载体可有效提高干粉吸入剂的雾化和传递性能,能有效提高干粉吸入剂的药物有效沉积率,可大幅提高药物在肺部的生物利用度和药物疗效,同时可降低干粉吸入剂对储存环境的要求。
(2)本发明的低密度的无定形载体颗粒没有表面活性剂的添加,而且不使用任何有机溶剂,没有有机溶剂的残留。
(3)本发明的制备方法可一步制备得到低密度的无定形载体颗粒,该制备方法没有添加表面活性剂、没有有机溶剂的残留,操作简单,参数可控性好,适用于工业化批量生产。制备得到的无定形载体颗粒,无定形状态稳定,物理化学稳定性高,对湿度不敏感。通过对制备方法中工艺条件的进一步优化,可以制备得到效果更佳的低密度的无定形载体颗粒,将其用于干粉吸入剂载体可以更有效的提高干粉吸入剂的药物有效沉积率,同时降低干粉吸入剂对存储环境的要求。
附图说明
图1为新一代药用撞击器(NGI)的示意图;
图2为实施例1中不同质量比的赤藓糖醇和羟丙基-β-环糊精的文拉法辛干粉吸入剂的药物的肺部沉积分布图;
图3为实施例1中载体颗粒的密度和文拉法辛干粉吸入剂的FPF之间的相关性图;
图4为实施例1中不同质量比的赤藓糖醇和羟丙基-β-环糊精制备的载体颗粒的XRD图谱;
图5为实施例1中不同质量比的赤藓糖醇和羟丙基-β-环糊精制备的载体颗粒的休止角柱状图;
图6为实施例1中不同质量比的赤藓糖醇和羟丙基-β-环糊精制备的载体颗粒的动态水分吸附曲线;
图7为实例3中的不同质量比的棉子糖、赤藓糖醇和羟丙基-β-环糊精制备的载体颗粒在加速试验条件下放置不同时间的的Tg折线图;
图8为实施例3中的赤藓糖醇载体颗粒在加速试验条件下放置不同时间后制备的布地奈德干粉吸入剂的药物的肺部沉积分布图;
图9为实施例3中的添加60%羟丙基-β-环糊精的赤藓糖醇载体颗粒在加速试验条件下放置不同时间后制备的布地奈德干粉吸入剂的药物的肺部沉积分布图;
图10为实施例3中的棉子糖载体颗粒在加速试验条件下放置不同时间后制备的布地奈德干粉吸入剂的药物的肺部沉积分布图;
图11为实施例3中的添加60%羟丙基-β-环糊精的棉子糖载体颗粒在加速试验条件下放置不同时间后制备的布地奈德干粉吸入剂的药物的肺部沉积分布图。
具体实施方式
以下将结合具体实施例和附图对本发明的低密度的无定形载体颗粒及其制备方法和应用做进一步详细的说明。
实施例1
将赤藓糖醇和羟丙基-β-环糊精按不同的质量比(100:0、80:20、70:30、60:40、40:60、30:70、20:80、0:100)溶解在水中,分别配制成浓度为50mg/ml(赤藓糖醇和羟丙基-β-环糊精的总浓度)的溶液,然后采用喷雾干燥机对上述溶液进行喷雾干燥制备载体颗粒,喷雾干燥的条件如下:进风温度为130℃,出风温度为85℃,泵液速率为7ml/min,喷嘴直径为0.71mm,雾化压力为120Kpa,气流量为0.60m3/h。对该条件下得到的赤藓糖醇载体颗粒进行如下评价或表征。
(1)密度测定:松密度(bulk density)和振实密度(tap density)是干粉吸入处方的重要性质。具体方法为:将一定量已知质量的粉末(约100mg)装入定制的10mL(±0.05mL)带刻度细长小量筒内并记录初始体积V0。然后人工敲击量筒约500次,直到内部粉体压缩到体积最终恒定并记录终末的粉体体积Vt。未经敲击时粉体的密度为松密度ρb=m/V0,敲击完成后粉体的密度为振实密度ρt=m/Vt。结果如表1所示。从表中可以看到,随着羟丙基-β-环糊精的加入,赤藓糖醇载体颗粒的密度骤降;随着羟丙基-β-环糊精比例的增大,赤藓糖醇载体颗粒的密度先减小后微量变大,当赤藓糖醇载体颗粒的密度最小时,药物肺部有效沉积率最高。
表1不同质量比的赤藓糖醇和羟丙基-β-环糊精对载体颗粒性质的影响
(2)粒径测定:采用激光粒度分析仪干法测定载体颗粒的粒径,分散压力为3.5bar,每份平行测定3次,结果如表1所示。结果表明:不同质量比的赤藓糖醇和羟丙基-β-环糊精对载体颗粒的粒径几乎没有变化,无统计学差异,说明羟丙基-β-环糊精的添加对粒径几乎无影响,证明该载体颗粒肺部有效沉积率的提高跟粒径的变化无关。
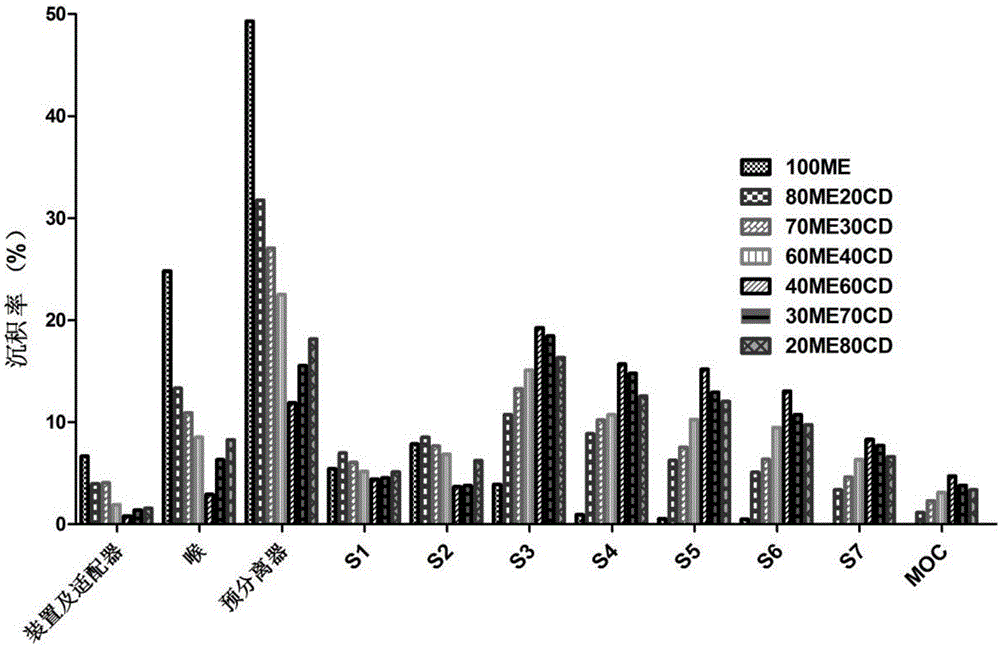
(3)药物有效沉积率FPF:将喷雾干燥后的载体颗粒与微粉化的文拉法辛药物(1~3um)颗粒以质量比30:1混合,以“三文治”的方式将药粉置于两层载体中,漩涡混合器调至500r·min-1先预混合15min,125μm筛网以除去大的聚集粒子,再按一定振动强度混合。每种混合物都按200mg的量制备。装入3号hpmc胶囊中(10±0.5mg/颗),即得文拉法辛干粉吸入剂,采用新一代药用撞击器(NGI,图1)测定干粉吸入剂的体外药物沉积率。
测定方法:取上述文拉法辛干粉吸入剂的供试品胶囊1粒,装到吸入装置TurbospinTM内,用手指揿压装置底端的按钮,将胶囊底端刺破,开启真空泵,设定气流量为60L/min(由吸入装置TurbospinTM的固有内阻决定);吸入装置与适配器连接并插入Induction port(喉),抽气4秒钟后取下吸入器,重新安置1粒胶囊。如此共抽吸10粒胶囊。
用水分别收集适配器、喉、预分离器、s1、s2、s3、s4、s5、s6、s7、MOC(s1-s7、MOC分别对应于第1-8级收集盘)中的干粉制剂并测定含量。可吸入细颗粒部分(Fine Particle Fraction,FPF,即药物有效沉积率)反映药物传递至肺部的能力,因此作为筛选干粉吸入剂载体的最重要指标。具体地,FPF等于s3至s6四个收集盘收到的药物量除以装置中总药物量。将载体颗粒的密度和干粉吸入剂的FPF之间的相关性进行拟合,结果如表1以及图2和图3所示。结果显示:不添加羟丙基-β-环糊精的赤藓糖醇载体颗粒密度很大,相应的其体外沉积率也很低;而添加羟丙基-β-环糊精的载体颗粒的密度与药物的沉积率呈现一定的正性相关(图3),R2值大于0.98,线性非常好。随着环糊精比例的增大时,其密度先显著下降后出现微弱上升,其药物有效沉积率也先显著增大后微弱变小,同时体外分布越趋向于更低空气动力学部分,越来越少地沉积在装置、喉、预分离器部分。当添加40%环糊精时,赤藓糖醇载体颗粒的密度达到最低,此时得到最高的体外沉积率。由此可见,添加羟丙基-β-环糊精制备的赤藓糖醇载体颗粒可以明显提高药物的有效沉积率,改变其流动性和分散性。
(4)晶型评价:采用X射线粉末衍射仪XRD测定载体颗粒的晶型,结果如图4所示。结果表明:所有的喷雾干燥后的赤藓糖醇载体颗粒的衍射图都呈现典型的分散光晕模式,为无定形材料的特征。当加入不同比例的羟丙基-β-环糊精后使得赤藓糖醇载体颗粒逐渐出现羟丙基-β-环糊精无定形的光晕模式,说明赤藓糖醇复合载体颗粒表面可能被羟丙基-β-环糊精包裹,所以逐渐呈现羟丙基-β-环糊精的无定形态。
(5)热力学稳定性评价:采用差示扫描量热仪DSC测定载体颗粒的吸热或放热效应的化学或物理现象。称取5~10mg样品置于铝坩埚中,并以空白铝坩锅为参比物,在40mL/min的氮气流中,以10℃/min的升温速率,从25℃加热至300℃。记算样品在热分析图中的玻璃态转变温度(Tg),Tg是粉末颗粒的稳定性指数,因为它是结晶的开始。结果如表1所示。结果表明:羟丙基-β-环糊精的加入,载体颗粒的Tg最初呈现骤升,然后随着羟丙基-β-环糊精含量的增大,Tg逐渐增大。说明添加20%羟丙基-β-环糊精就能显著提高赤藓糖醇载体颗粒的热力学稳定性,也就是说极大地提高了载体颗粒的无定形状态的稳定性,减少其结晶趋势。因此,羟丙基-β-环糊精的添加能提高赤藓糖醇载体颗粒的无定形稳定性。
(6)流动性评价:载体粉体颗粒的流动性无法用单一的特性值来表达,常采用休止角评价粉体的流动性。休止角(θ)是指粉体堆积层的自由斜面与水平面所形成的最大角。休止角的测定方法如下:方法为固定漏斗法,即将漏斗固定在适宜的高度,本实验中为5cm,然后将1g粉末置于孔径为5.0mm的漏斗中,使之自然流下成堆,然后测量形成的圆锥体的直径(D)以及高度h。则休止角(θ)可与根据公式1计算:
结果如图5所示,载体颗粒的休止角与羟丙基-β-环糊精的加入量呈现相反的关系,也就意味着羟丙基-β-环糊精的比例越大,载体的流动性越好。当不添加羟丙基-β-环糊精时,赤藓糖醇载体颗粒的休止角达到58°,流动很困难;当添加羟丙基-β-环糊精20%时,休止角就骤降到28°,流动性良好,当羟丙基-β-环糊精比例超过40%时,载体休止角便小于20°,此时载体具有非常好的流动性,有利于提高载体颗粒和药物的混合均一性以及雾化性能。从沉积率分布图(图2)我们也可以看到,当羟丙基-β-环糊精的比例越大时,在装置、喉、预分离器的残留越少,说明在气流下,载体颗粒的流动性越好。
(7)抗湿性评价:吸湿性是指在一定温度及湿度条件下物质吸收水分的能力或程度的特性。《中国药典》2015年版第四部“药物引湿性试验指导原则”中有相关测定方法:首先取干燥的具塞玻璃称量瓶(外径为50mm,高为15mm),置于放置硫酸铵饱和溶液的干燥器内(80%±2%RH,25℃±1℃),平衡24小时后,精密称定重量(m1)。取供试品适量,平铺于上述称量瓶中,厚度约为1mm,精密称定重量(m2)。将称量瓶敞口,和瓶盖同置于干燥器内24小时。盖好瓶盖,精密称定重量(m3)。增重百分率的计算如公式2所示:
吸湿性特征描述与吸湿性增重的界定如下:
潮解(Deliquiation):吸收足量水分形成液体;
极具吸湿性(High hygroscopicity):吸湿增重不小于15%;
有吸湿性(Hygroscopicity):吸湿增重小于15%但不小于2%;
略有吸湿性(Slight hygroscopicity):吸湿增重小于2%但不小于0.2%;
无或几乎无吸湿性(Without hygroscopicity):吸湿增重小于0.2%。
粉末吸湿严重会聚集成团,导致无法雾化和排空。动态水分吸附分析法(Dynamic vapor sorption,DVS),是一种可高效分析干粉吸入剂中的水分吸附情况的新技术。该系统由精密的电子天平、气体流量控制器和温湿度控制器组成。取样品置于DVS的样品盘中,将工作温度设置为25℃,在持续的氮气流作用下,平衡直至样品质量不发生变化。湿度梯度设置为10%RH,湿度跨度从0%RH到90%RH。样品在设置的湿度下平衡至恒重,认为达到吸湿平衡,即递增至下一级的湿度。依次升高湿度,到达90%RH后,湿度达到平衡即可进行脱吸附。样品在设置湿度下平衡至恒重后,递减到下一级湿度,直至0%RH。以湿度变化为横坐标,样品平衡质量变化为纵坐标,绘制吸附/脱吸附曲线,吸附/脱吸附曲线结果如图6所示。喷雾干燥后的赤藓糖醇载体颗粒(100ME)在80%RH下,吸湿增重达到64%,为极具吸湿,可能是由于其无定形状态趋向于向稳定晶型转变,因此在这过程中物理稳定性降低;当添加20%羟丙基-β-环糊精后,载体的吸湿性骤降到30%,随着羟丙基-β-环糊精的含量增大,其载体的吸湿性逐渐降低,当添加40%羟丙基-β-环糊精时,载体吸湿减低到10%,为有吸湿性;而当添加60%以上羟丙基-β-环糊精时,载体吸湿骤降到0.4%以下,几乎无吸湿性。因此,添加羟丙基-β-环糊精可以有效减少赤藓糖醇载体颗粒对水分的吸收,提高其抗水分的能力,其原因可能是提高了赤藓糖醇载体颗粒整体的物理稳定性,减少无定形载体颗粒的结晶性。
实施例2
将小分子糖醇(海藻糖、棉子糖、赤藓糖醇、木糖醇、乳糖)和羟丙基-β-环糊精按40:60的质量比溶解于水中,分别配制成浓度为50mg/ml(小分子糖醇与羟丙基-β-环糊精的总浓度)的溶液,然后采用喷雾干燥机对上述溶液进行喷雾干燥制备载体颗粒,喷雾干燥的条件如下:进风温度为130℃,出风温度为85℃,泵液速率为7ml/min,喷嘴直径为0.71mm,雾化压力为120Kpa,气流量为0.60m3/h。
(1)喷雾干燥后不同复合载体颗粒的粒径、松密度、晶型、玻璃态转变温度(Tg)见表2(测试方法同实施例1)。结果显示,不同小分子糖醇和羟丙基-β-环糊精经喷雾干燥制备的复合载体颗粒的粒径没有显著变化,同时都具有较小的松密度。并且所有载体颗粒都为无定形,其Tg都大于200,说明其无定形状态很稳定。
表2不同复合载体的物理化学性质(n=3)
(2)不同复合载体的体外沉积率:将喷雾干燥后的低密度无定形载体颗粒与微粉化的盐酸环丙沙星药物颗粒、布地奈德药物颗粒分别以质量比30:1混合,装入3号胶囊中(10±0.5mg/颗),即得盐酸环丙沙星干粉吸入剂或布地奈德干粉吸入剂,采用新一代药用撞击器(NGI)对盐酸环丙沙星干粉吸入剂和布地奈德干粉吸入剂的体外药物沉积率做出评价。
检测方法:取上述盐酸环丙沙星干粉吸入剂或布地奈德干粉吸入剂的供试品胶囊1粒,装到吸入装置TurbospinTM内,用手指揿压装置底端的按钮,将胶囊底端刺破,开启真空泵,设定气流量为60L/min(由吸入装置TurbospinTM的固有内阻决定);吸入装置与适配器连接并插入Induction port(喉),抽气4秒钟后取下吸入器,重新安置1粒胶囊。如此共抽吸10粒胶囊,
用水溶液/乙醇溶液分别收集适配器、喉、预分离器、s1、s2、s3、s4、s5、s6、s7、MOC(s1、s2、s3、s4、s5、s6、s7、MOC分别对应于第一级、第二级、第三级、第四级、第五级、第六级、第七级、第八级收集盘)中的干粉制剂并测定含量,可吸入细颗粒部分(Fine Particle Fraction,FPF,即药物有效沉积率)等于s3至s6四个收集盘收到的药物量除以装置中总药物量。该指标为筛选干粉吸入剂载体的最重要指标。
结果如表3、4所示,结果说明:不同小分子糖醇和羟丙基-β-环糊精经喷雾干燥制备的复合载体颗粒与微粉化药物组成的干粉吸入剂的有效沉积率都很高,尤其是以赤藓糖醇和羟丙基-β-环糊精为原料制备的载体颗粒,可以获得更高的药物有效沉积率。
表3不同载体的盐酸环丙沙星干粉吸入剂的药物的体外有效沉积率(n=3)
表4不同载体的布地奈德干粉吸入剂的药物的体外有效沉积率(n=3)
实施例3
将小分子糖醇(棉子糖或赤藓糖醇)和羟丙基-β-环糊精按40:60的质量比溶解于水中,分别配制成浓度为50mg/ml(小分子糖醇与羟丙基-β-环糊精的总浓度)的溶液,然后采用喷雾干燥机对上述溶液进行喷雾干燥制备载体颗粒,喷雾干燥的条件如下:进风温度为130℃,出风温度为85℃,泵液速率为7ml/min,喷嘴直径为0.71mm,雾化压力为120Kpa,气流量为0.60m3/h。然后将载体颗粒平均分为3份,将其中两份分别放置在加速稳定性条件(40℃,75%RH)下5天,10天。然后对0天的棉子糖、赤藓糖醇载体颗粒以及在加速稳定性条件下放置5天,10天后的棉子糖、赤藓糖醇载体颗粒进行如下评价或表征。
(1)粒径测定:采用激光粒度分析仪干法测定载体颗粒的粒径,分散压力为3.5bar,每份平行测定3次,结果如表5所示。结果表明:没有添加羟丙基-β-环糊精的喷雾干燥后的棉子糖载体颗粒(100RN)或赤藓糖醇载体颗粒(100LC)在加速试验条件下(40℃,75%RH)下放置5天后,粒径显著增大,明显可见颗粒团聚,放置10天后,粒子聚集更加严重,成团状,粒径继续增大,可能是由于颗粒趋向于转变为含水的结晶状,降低了物理稳定性,其表面吸收水分,粒子间由于水分产生的毛细管力从而形成固体桥,增加了颗粒的聚集;而添加60%羟丙基-β-环糊精的40RN60CD、40ME60LL处方的棉子糖载体颗粒或赤藓糖醇载体颗粒在在加速试验条件下(40℃、75%RH)放置5天,10天后粒径都无显著性变化。因此添加一定比例的羟丙基-β-环糊精可以减少载体颗粒之间的聚集。
表5加速试验条件下放置不同时间对棉子糖或赤藓糖醇复合载体颗粒性质的影响
(2)密度测定。密度测定方法如实施例1所示,结果如表5所示:添加60%羟丙基-β-环糊精的载体颗粒(40RN60CD、40ME60LL)的密度显著低于不添加羟丙基-β-环糊精的载体颗粒(100RN、100ME);同时不添加羟丙基-β-环糊精的喷雾干燥棉子糖载体颗粒(100RN)、赤藓糖醇载体颗粒(100ME)在加速条件下放置5天、10天后,密度逐渐增大,可能是由于载体颗粒聚集引起的;而添加60%羟丙基-β-环糊精的载体颗粒(40RN60CD、40ME60LL)在加速条件下放置5天,10天后密度都无显著性变化。因此添加一定比例的羟丙基-β-环糊精可以显著降低载体颗粒的密度,同时保持低密度载体颗粒不受湿度的影响。
(3)水分测定。采用卡式水分测定剂对放置0天、5天、10天后的载体进行水分测定,结果如表5所示。结果表明,不添加羟丙基-β-环糊精的喷雾干燥棉子糖载体颗粒(100RN)、赤藓糖醇载体颗粒(100ME)放置5天、10天后,水分含量急剧上升。而添加60%羟丙基-β-环糊精的载体颗粒(40RN60CD、40ME60LL)的水分都极低,低于0.01%,而且没有上升的趋势。因此,添加一定比例的羟丙基-β-环糊精可以显著降低载体颗粒对水分的吸收,提高其抗湿能力。
(4)晶型评价:采用X射线粉末衍射仪XRD测定放置0天、5天、10天的载体颗粒的晶型,结果分别如表5所示。采用差示热扫描仪测定0天、5天、10天的载体颗粒的玻璃态转变温度,Tg的变化结果如图4所示。结果显示添加60%羟丙基-β-环糊精的棉子糖载体颗粒40RN60CD、赤藓糖醇载体颗粒40ME60CD在加速条件下放置0天、5天、10天后依然保持无定形态,且Tg几乎没有变化,显著高于不添加羟丙基-β-环糊精的载体颗粒;而不添加羟丙基-β-环糊精的喷雾干燥棉子糖载体颗粒(100LC)、赤藓糖醇载体颗粒(100ME)放置5天后,由0天的无定形态转变为明显的结晶态,放置10天后结晶更加明显。同时不添加羟丙基-β-环糊精的喷雾干燥棉子糖载体颗粒(100LC)、赤藓糖醇载体颗粒(100ME)的Tg显著低于添加羟丙基-β-环糊精的喷雾干燥的载体颗粒,其Tg还随着在加速试验条件下放置时间的增长而显著下降,说明添加一定量的羟丙基-β-环糊精可以保持载体颗粒的无定形状态,显著提高其玻璃态转变温度,也就是说可以提高其无定形状态的稳定性。提示我们添加羟丙基-β-环糊精的喷雾干燥后的载体颗粒的储存环境几乎不需要控制,其在40℃、75%RH条件下很稳定。因此,添加羟丙基-β-环糊精可以显著提高喷雾干燥后的载体颗粒的物理稳定性。
(5)药物有效沉积率FPF:将在加速试验条件下(40℃,75%RH)放置不同时间的载体颗粒分别与微粉化的布地奈德药物颗粒以质量比30:1混合,以“三文治”的方式将药粉置于两层载体中,漩涡混合器调至500r·min-1先预混合15min,125μm筛网以除去大的聚集粒子,再按一定振动强度混合。每种混合物都按200mg的量制备。装入3号hpmc胶囊中(10±0.5mg/颗),即得布地奈德干粉吸入剂,采用新一代药用撞击器(NGI,图1)测定干粉吸入剂的体外药物沉积率。测定方法如实施例1所示,结果如表5和图8-图11所示。结果说明,添加60%羟丙基-β-环糊精的棉子糖载体颗粒40RN60CD、赤藓糖醇载体颗40ME60CD肺部有效沉积率明显远高于不添加羟丙基-β-环糊精的喷雾干燥的棉子糖载体颗粒(100RN)、喷雾干燥后的赤藓糖醇载体颗粒(100ME);同时,在加速试验环境下(40℃、75%RH)放置5天、10天后添加60%羟丙基-β-环糊精的棉子糖载体颗粒40RN60CD、赤藓糖醇载体颗粒40ME60CD肺部有效沉积率没有显著变化,沉积分布图也类似;而不添加羟丙基-β-环糊精的喷雾干燥的棉子糖载体颗粒(100RN)、喷雾干燥的赤藓糖醇载体颗粒(100ME)的肺部有效沉积率随着放置时间的增长逐渐变得更低,且沉积分别越来越趋向于大粒径部分。因此添加羟丙基-β-环糊精制备的低密度无定形载体颗粒可有效提高肺部有效沉积率,同时还可以提高载体的抗湿能力,减少潮湿环境对其肺部雾化性能的影响。
实施例4
将赤藓糖醇和羟丙基-β-环糊精按40:60的质量比溶解于水中,配制成浓度为50mg/ml(总浓度)的溶液,然后采用喷雾干燥机对上述溶液进行喷雾干燥制备载体颗粒,固定如下喷雾干燥条件:进风温度为130℃,出风温度为85℃,泵液速率为7ml/min,喷嘴直径为0.71mm,气流量为0.60m3/h,改变雾化压力,将其分别设为90Kpa、120Kpa、150Kpa、180Kpa。喷雾干燥后的的载体颗粒的松密度、结晶状态、流动性见表6(测试方法同实施例1)。结果表明当喷雾压力过低时,其形成的复合载体颗粒的密度偏大,可能是由于喷雾压力过低时,制备过程中喷射出的液滴偏大,水分受热挥发不够快,没能较好地形成无定形态。随着喷雾压力的逐渐增大,复合载体颗粒密度逐渐变小,在180Kpa时达到最小,且都为无定形态。但当喷雾压力偏大时(大于120Kpa),由于制备过程中喷射出的液滴受冲击力过大,可能分散成很碎的小碎片,粒径太小,容易团聚,且受热后,其表面形态很可能不为球形,所以其休止角变大,流动性变差。因此选用120Kpa作为最佳喷雾压力。
表6不同喷雾压力对载体颗粒性质的影响
实施例5
将赤藓糖醇和羟丙基-β-环糊精按40:60的质量比溶解于水中,配制成浓度为50mg/ml(总浓度)的溶液,然后采用喷雾干燥机对上述溶液进行喷雾干燥制备载体颗粒,固定如下喷雾干燥条件:喷雾压力120Kpa,泵液速率为7ml/min,喷嘴直径为0.71mm,气流量为0.60m3/h,改变进风温度,将其分别设为110℃、130℃、150℃,其对应的出风温度为75℃,85℃,95℃。不同进风温度喷雾干燥后的的载体颗粒的结晶状态、水分含量、松密度见表7(测试方法同实施例1)。结果表明当进风温度偏低时(110℃),由于温度低,水分挥发慢,所以最终载体的水分含量偏高,同时为结晶状态,无法得到低密度无定形载体颗粒;当进风温度为130℃、150℃时都能得到低密度无定形的载体颗粒,但由于进风温度为150℃时,出风温度达到95℃(出风温度超过100℃时喷雾干燥会报警停机),不太容易控制好,因此采用130℃作为最优的进风温度。
表7不同进风温度对载体颗粒性质的影响
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!