一种低氧响应脂质体药物载体及其制备方法与应用与流程
本发明涉及药剂学领域,具体涉及一种具有低氧响应效应的脂质体药物载体,以及该药物载体的制备方法及应用。
背景技术:
肿瘤治疗中小分子化疗药物没有组织选择性,难以在肿瘤病灶部位达到高的药物浓度,大剂量使用下治疗效果差,毒副作用强。将小分子化疗药物装载到纳米药物载体如脂质体中能够显著降低毒副作用,但是传统的脂质体药物载体并不能显著的提高抗癌药的治疗效果,所以,使用新颖的控释材料改进脂质体药物载体使其能够在肿瘤部位特异性释放药物,提高疗效,是目前迫切需要研究的内容。
低氧是实体瘤微环境的基本特征之一,正常组织的氧浓度一般在30mm Hg左右,而肿瘤组织的氧浓度较低,有的甚至接近于0。低氧是很多肿瘤治疗失败的主要原因,但是低氧同样提供了一种治疗途径,因此,设计制备具有根据肿瘤低氧特征而改变自身理化性装的纳米药物载体用于低氧实体瘤的治疗,将有利于提高肿瘤的治疗效果。
在低氧控释方面,通过文献调研发现芳香硝基类化合物及其衍生物因其低氧响应性而常被用于肿瘤低氧的检测,例如,CN201610026007中利用疏水的2-硝基咪唑在低氧环境下在细胞内会转变成水溶性的2-氨基咪唑。因此,可以利用这一特性来设计纳米药物载体时引入芳香硝基类基团,基团在低氧肿瘤细胞内发生反应,导致纳米药物载体自身的稳定性降低,从而释放出装载的抗癌药物,显著提高肿瘤部位的药物浓度,从而提高药物的利用度。此外,现阶段低氧响应药物载体主要局限于硝基芳烃功能化的聚合物形成的载体,未见有低氧响应脂质体药物载体的报道。
技术实现要素:
发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供一种低氧响应脂质体药物载体。
本发明还要解决的技术问题是提供该低氧响应脂质体药物载体的制备方法及应用。
为了解决上述技术问题,本发明公开一种低氧响应脂质体药物载体,该脂质体包括磷脂、胆固醇和低氧响应分子,所述胆固醇与磷脂的质量比为1:10-1:2,低氧响应分子与磷脂的质量比为1:10-1:4。
其中,所述磷脂为二棕榈酰磷脂酰胆碱(DPPC)、二肉豆蔻酰磷脂酰胆碱(DMPC)和甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)的混合物,其中二棕榈酰磷脂酰胆碱(DPPC)占磷脂总质量的80-95%,二肉豆蔻酰磷脂酰胆碱(DMPC)占磷脂总质量的2-10%,甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)占磷脂总质量的3-10%;所述胆固醇为高纯胆固醇(HP-CHOL);所述低氧响应分子为疏水性芳香硝基化合物衍生物(HR);所述的低氧响应分子位于所述磷脂的双分子层之间。
其中,所述疏水性芳香硝基化合物衍生物(HR)具有的结构通式为下述两种通式之一:
通式(1)通式(2)
其中n为8-20之间的任意自然数,基团R为H或者Ar-NO2,Ar为咪唑环、2-甲基咪唑、苯环以及含有1-2个硝基苯环中的一种或多种。
所述疏水性芳香硝基化合物衍生物(HR)具有如下结构式之一:
其中,所述脂质体药物载体的水化粒径为50~500纳米。
一种低氧响应脂质体药物载体的制备方法,将配方量的磷脂、胆固醇和低氧响应分子溶于有机溶剂中,真空旋蒸成膜,水化后即得到空载脂质体。
其中,所述的有机溶剂为分析纯甲醇和氯仿按体积比1:3-1:5的混合物。
该低氧响应脂质体药物载体在负载抗肿瘤药物中的应用。
其中,所述抗肿瘤药物为亲水性抗肿瘤药物和/或疏水性抗肿瘤药物,其中,所述的亲水性抗肿瘤药物包括但不仅限于盐酸阿霉素、盐酸伊立替康和顺铂中的任意一种或几种的混合物;所述的疏水性抗肿瘤药物包括但不仅限于阿霉素、多西他赛、紫杉醇和喜树碱中的任意一种或几种的混合物。
其中,所述抗肿瘤药物的负载量为1~25wt%。
该载药脂质体负载抗肿瘤药物的制备方法为:
(1)若所述抗肿瘤药物为疏水性抗肿瘤药物,则:
将配方量的磷脂、胆固醇和低氧响应分子和抗肿瘤药物溶于有机溶剂中,室温下真空旋蒸成膜,pH 7.4的磷酸缓冲液水化后即得到载药脂质体;
(2)若所述抗肿瘤药物为亲水性药物,则:
采用pH梯度法载药,则将配方量的磷脂、胆固醇和低氧响应分子溶于有机溶剂中,真空旋蒸成膜后用100~300mM柠檬酸或醋酸钙水溶液水化,用pH 7.4的磷酸缓冲液透析除去脂质体外的柠檬酸或醋酸钙,加入抗肿瘤药物,30~70℃搅拌10~60分钟即得到载药脂质体;或者,在水化时按比例加入抗肿瘤药物,水化后用pH 7.4的磷酸缓冲液透析即得到载药脂质体;
采用上述两种方法之一处理之后,未包封的游离药物可以通过G-50葡聚糖凝胶柱分离除去。
其中,抗肿瘤药物添加质量与磷脂、胆固醇和低氧响应分子的三者总质量之比为1/3-1/10。
该低氧响应脂质体药物载体在制备治疗抗肿瘤或者其他低氧相关的疾病药物中的应用。
有益效果:
1、本发明的脂质体的磷脂组成为相变温度较高的DPPC和DMPC,在人体的生理温度下呈胶晶态,不会发生药物非特异性释放或泄漏,极大地降低对人体正常组织和器官的毒副作用,因此本发明的脂质体可以负载各种小分子抗肿瘤药物,亲水性药物(盐酸阿霉素、盐酸伊立替康、顺铂等)位于脂质体内部核心,疏水性药物(阿霉素、紫杉醇、喜树碱等)位于磷脂双分子层之间,可同时共载任意一种或几种,对弱碱性或弱酸性药物可以采用pH梯度法载药达到高的包封率。
2、本发明的脂质体在保持传统脂质体药物载体的稳定性的前提下,在双分子层之间加入疏水性的芳香硝基类化合物作为低氧响应分子,在低氧的肿瘤细胞内,低氧响应分子的硝基被还原为氨基,由疏水性变为亲水性,使脂质体的结构不再稳定,释放药物,达到在低氧肿瘤部位特异性释放药物的目的,显著提高肿瘤部位的药物浓度,提高抗肿瘤效果。
3、本发明的脂质体含有PEG化磷脂可以避免被内皮网状系统捕获,有效延长脂质体的血液循环时间,使脂质体药物有充足的时间通过EPR效应在肿瘤部位滞留富集;胆固醇能够收紧磷脂双分子膜,使脂质体更加稳定。
4、本发明的脂质体制备方法简单,易于放大生产,可以采用pH梯度法装载弱酸性或弱碱性药物,在较高的载药率(20%)时依然保持高的包封率(大于90%);对于脂溶性药物,可以在旋蒸成膜时直接加入药物;水化后使用G-50葡聚糖凝胶柱分离载药脂质体和游离药物,既可得到载药低氧响应脂质体。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
图1为实施例1制备的低氧响应分子的核磁共振氢谱图(1H NMR);
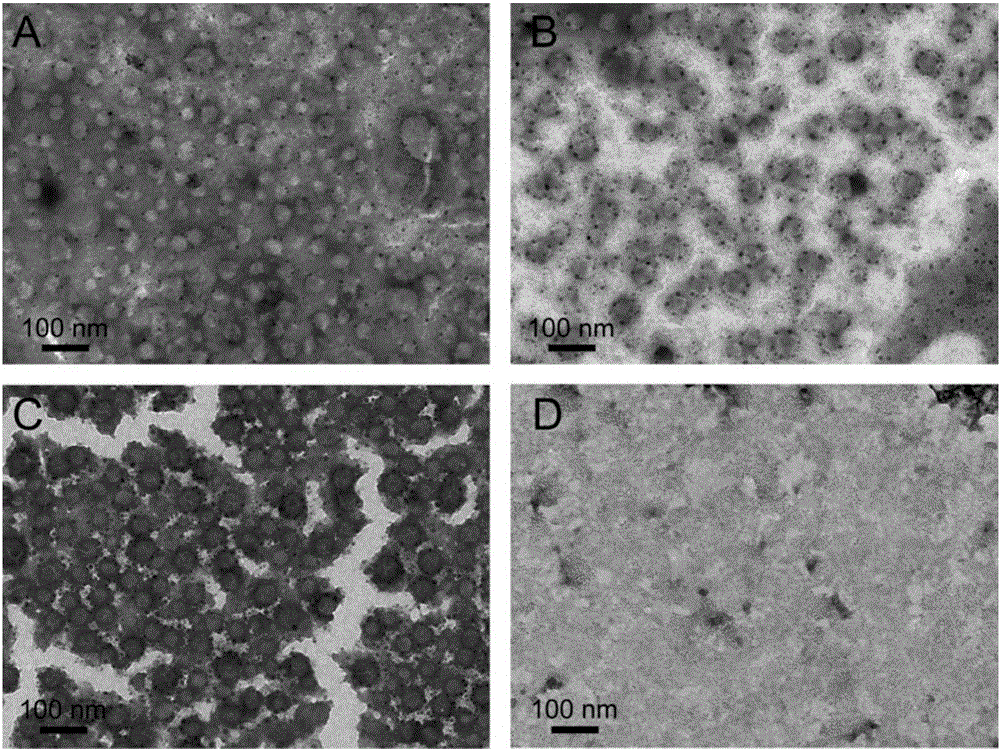
图2为实施例2-1制备的具有低氧响应脂质体(HR-LPs)和传统脂质体(LPs)的低氧处理前后的透射电镜图(TEM);
图3为实施例2-1制备的具有低氧响应效应的脂质体药物载体的体外低氧响应性-紫外吸收特征峰的变化;
图4为实施例4-1制备的具有低氧响应效应的阿霉素脂质体药物载体(DOX-HR-LPs)和传统阿霉素脂质体(DOX-LPs)在低氧和常氧条件下的阿霉素释放曲线;
图5为实施例4-1制备的具有低氧响应效应的阿霉素脂质体药物载体(DOX-HR-LPs)和传统阿霉素脂质体(DOX-LPs)在低氧和常氧条件下的细胞内阿霉素的释放行为观察结果;
图6为实施例4-1制备的具有低氧响应效应的阿霉素脂质体药物载体、传统阿霉素脂质体、及阿霉素以及对照组(PBS给药组)在小鼠实体瘤模型上的治疗效果图;
图7为本发明制备的低氧响应脂质体药物载体的结构示意图。其中,图中的磷脂代表二棕榈酰磷脂酰胆碱和二肉豆蔻酰磷脂酰胆碱,聚乙二醇磷脂代表甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺。
具体实施方式
以下结合实施例,对本发明所述的一种具有低氧响应效应的脂质体药物载体、制备方法及其应用做进一步说明。
实施例1
本实施所选用的低氧响应分子为2-硝基咪唑衍生物,其制备方法如下:
取2-硝基咪唑60mg和1,12-二溴十二烷70mg加入5mL二甲基甲酰胺(DMF)中溶解充分,再加入K2CO380mg,50℃搅拌反应24h;向反应溶液中加入5mL去离子水,再加入5mL乙酸乙酯萃取,重复萃取3次,合并萃取溶液,再向萃取液中加入2mL去离子水震荡后静置分层,除去下层水溶液,重复3次后真空旋蒸除去乙酸乙酯,得到2-硝基咪唑衍生物,即线形低氧响应分子HR(hypoxia responsive elements),其核磁共振氢谱图(1H NMR)如图1所示。
实施例2-1
具有低氧响应效应的脂质体药物载体的制备:
将二棕榈酰磷脂酰胆碱(DPPC)、高纯胆固醇(HP-CHOL)、二肉豆蔻酰磷脂酰胆碱(DMPC)、甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:20:3:3:16的质量比(总20mg)溶于甲醇和氯仿混合溶液中(体积比1:4),减压旋蒸成膜,用10mL去离子水50℃超声水化,得到空白低氧响应脂质体HR-LPs;对照空白组脂质体LPs的制备方法同HR-LPs,脂质体组分中DPPC、HP-CHOL、DMPC、DSPE-MPEG2K同样按质量比70:20:3:3(总20mg),不添加低氧响应分子,减压旋蒸成膜,10mL去离子水50℃超声水化,得到空白脂质体LPs。
实施例2-2
具有低氧响应效应的脂质体药物载体的制备:
将二棕榈酰磷脂酰胆碱(DPPC)、高纯胆固醇(HP-CHOL)、二肉豆蔻酰磷脂酰胆碱(DMPC)、甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:18:3:3:12的质量比(总20mg)溶于甲醇和氯仿混合溶液中(体积比1:3),其余步骤同实施例2-1,制备空白低氧响应脂质体HR-LPs。
实施例2-3
具有低氧响应效应的脂质体药物载体的制备:
将二棕榈酰磷脂酰胆碱(DPPC)、高纯胆固醇(HP-CHOL)、二肉豆蔻酰磷脂酰胆碱(DMPC)、甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:8:3:3:18的质量比(总20mg)溶于甲醇和氯仿混合溶液中(体积比1:3),其余步骤同实施例2-1,制备空白低氧响应脂质体HR-LPs。
实施例2-4
具有低氧响应效应的脂质体药物载体的制备:
将二棕榈酰磷脂酰胆碱(DPPC)、高纯胆固醇(HP-CHOL)、二肉豆蔻酰磷脂酰胆碱(DMPC)、甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:38:3:3:8的质量比(总20mg)溶于甲醇和氯仿混合溶液中(体积比1:5),其余步骤同实施例2-1,制备空白低氧响应脂质体HR-LPs。
实施例2-5
具有低氧响应效应的脂质体药物载体的制备:
将二棕榈酰磷脂酰胆碱(DPPC)、高纯胆固醇(HP-CHOL)、二肉豆蔻酰磷脂酰胆碱(DMPC)、甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按70:20:2:4:16的质量比(总20mg)溶于甲醇和氯仿混合溶液中(体积比1:4),其余步骤同实施例2-1,制备空白低氧响应脂质体HR-LPs。
实施例2-6
具有低氧响应效应的脂质体药物载体的制备:
将二棕榈酰磷脂酰胆碱(DPPC)、高纯胆固醇(HP-CHOL)、二肉豆蔻酰磷脂酰胆碱(DMPC)、甲氧基-聚乙二醇-二硬脂酰基磷脂酰乙醇胺(DSPE-MPEG2K)、疏水性芳香硝基化合物衍生物(HR)按62:21:7:7:15的质量比(总20mg)溶于甲醇和氯仿混合溶液中(体积比1:4),其余步骤同实施例2-1,制备空白低氧响应脂质体HR-LPs。
实施例3
具有低氧响应效应的脂质体药物载体(HR-LPs)的低氧响应性考察:
将实施例2-1制备的HR-LPs和LPs在37℃水浴处理3h,低氧组加入肝微粒体和还原性辅酶Ⅱ(NADPH)分别作为除氧剂和还原剂,常氧组只加入NADPH。图2为具有低氧响应效应的脂质体药物载体(HR-LPs)及对照组传统的脂质体药物载体(LPs)低氧处理前后的透射电镜(TEM)图,结果显示,实施例2-1制备的HR-LPs(图2C)和LPs(图2A)呈球形,颗粒粒径为50纳米左右,粒径分布均匀,多分散性好。低氧处理后,LPs的形态无明显变化(图2B),HR-LPs的球形结构已经被完全破坏(图2D)。
HR-LPs低氧还原之后在325nm处硝基咪唑的紫外特征吸收峰消失,在290nm处出现新的氨基咪唑特征峰(图3A),而LPs低氧还原之后紫外特征吸收峰没有发生明显变化(图3B),结果显示HR-LPs有的低氧响应性,而LPs无低氧响应性。
实施例4-1
本实施例所使用的脂质体药物载体装载了抗癌药物阿霉素,采用pH梯度载药法,其制备方法为:实施例2-1制备的空白脂质体LPs和HR-LPs采用250mM柠檬酸水溶液水化,用pH 7.4的磷酸缓冲液透析除去脂质体外的柠檬酸或醋酸钙,之后用磷酸氢二钠调节脂质体溶液的pH为7左右,按照药脂质量比1:4加入阿霉素,50℃避光搅拌1h后,得到装载阿霉素的脂质体DOX-LPs和低氧响应脂质体DOX-HR-LPs,4℃保存待用。离心取上清,HPLC测得DOX-LPs和DOX-HR-LPs包封率为96.8±0.29和93.4±1.30(%)。
实施例4-2
本实施例所使用的脂质体药物载体装载了抗癌药物多西他赛,采用pH梯度载药法,其制备方法为:实施例2-1制备的空白脂质体LPs和HR-LPs采用100mM柠檬酸水溶液水化,按照药脂质量比1:3加入阿霉素,30℃避光搅拌10min,其余步骤同实施例4-1得到得到装载多西他赛的载药脂质体。
实施例4-3
本实施例所使用的脂质体药物载体装载了抗癌药物紫杉醇,采用pH梯度载药法,其制备方法为:实施例2-1制备的空白脂质体LPs和HR-LPs采用300mM柠檬酸水溶液水化,按照药脂质量比1:10加入阿霉素,70℃避光搅拌30min,其余步骤同实施例4-1得到得到装载紫杉醇的载药脂质体。
实施例4-4
本实施例所使用的脂质体药物载体装载了抗癌药物盐酸阿霉素,将配方量的磷脂、胆固醇和低氧响应分子和抗肿瘤药物溶于有机溶剂中,室温下真空旋蒸30分钟成膜,pH 7.4的磷酸缓冲液水化后即得到装载盐酸阿霉素的载药脂质体。
实施例5
DOX-LPs和DOX-HR-LPs分别在常氧和低氧条件下的体外释放曲线测定:
将实施例4-1制备的DOX-LPs和DOX-HR-LPs用PBS稀释后密封在石英比色皿中,37℃进行阿霉素的体外释放实验,其中低氧组加入大鼠肝微粒体(100μg/ml)和NADPH(100μM),常氧组只加NADPH。比色皿中阿霉素的浓度用荧光分光光度法测定。结果如图4所示,DOX-HR-LPs在低氧条件下37℃,pH 7.4左右12h释放了60%左右的阿霉素,而常氧常氧条件下只有30%左右的阿霉素释放,DOX-LPs在常氧和低氧条件下的释放量均很少,不足30%。说明DOX-HR-LPs在低氧条件下可以加速药物的释放,传统阿霉素脂质体DOX-LPs在低氧和常氧条件下均难以释放药物。
实施例6
DOX-HR-LPs在低氧和常氧细胞内的药物释放行为观察,通过观察DOX的细胞内荧光强度来判断DOX的细胞内释放速度。
鼠源前列腺癌细胞(RM-1)购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。具体实验过程如下:将RM-1细胞以合适密度接种于玻璃底细胞培养皿中,生长24h贴壁,用含有实施例4-1制备的DOX-HR-LPs(DOX 10μg/ml)的培养液处理细胞2h后吸去含药培养液,PBS洗三遍后加培养液,在细胞表面加盖玻片形成低氧环境,3h后在莱卡SP8激光共聚焦显微镜下观察细胞内的DOX荧光强度。结果如图5所示,选取通过盖玻片中心的区域,拼图观察(图5A)和局部观察(图5C),以及专业图像分析软件Image-Pro Plus对荧光强度的分析(图5B),从盖玻片外到中心,细胞内的阿霉素荧光强度在逐渐增强,说明从盖玻片外到中心,随着氧浓度的降低,DOX-HR-LPs在细胞内释放DOX的速度逐渐提高。在低氧严重的中心部位,细胞内的荧光强度最大,释放的速度最快。
实施例7
DOX-HR-LPs和DOX-LPs以及DOX在C57BL/6实体瘤模型小鼠上的治疗效果结果。
具体实施过程如下:在皮下注射接种RM-1细胞后,待肿瘤体积生长至大约50mm3,将实体瘤模型小鼠随机分为四组(n=6),分别尾静脉注射PBS、DOX、以及实施例4-1制备的DOX-LPs和DOX-HR-LPs(DOX剂量5mg/kg),第一次给药记为第0天,第5天第二次给药,每3天测量肿瘤体积、小鼠体重至第18天。
结果如图6所示,图6A为4个处理组小鼠的体重变化情况,PBS组小鼠的体重一直升高,是由于肿瘤的飞速生长,DOX组在给药期间体重明显下降,是由于DOX严重的系统毒性导致的,相对于其他三组,DOX-HR-LPs组的体重最稳定,说明DOX-HR-LPs低的毒副作用。图6B为四个处理组小鼠的生存曲线,PBS、DOX、DOX-LPs以及DOX-HR-LPs的评价生存时间分别为16天、20天、25天和34天,DOX-HR-LPs可以显著延长小鼠的生存时间,说明治疗效果最好,DOX-LPs对治疗效果的提升有限,主要作用在于降低毒副作用。
本发明提供了一种低氧响应脂质体药物载体的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
- 还没有人留言评论。精彩留言会获得点赞!