多肽‑抗体免疫偶联物及其制备方法与流程
本发明涉及药物工程技术领域,具体地说,涉及一种多肽-抗体免疫偶联物及其制备方法。
背景技术:
恶性肿瘤是仅此于心脑血管疾病的人类第二大杀手,近年来,随着治疗性单克隆抗体临床应用的逐渐增加,抗体依赖细胞介导的细胞毒(antibody-dependent cell mediated cytotoxicity,ADCC)的抗肿瘤效果日益受到重视。抗体依赖的细胞介导的细胞毒性作用是指具有杀伤活性的细胞(如NK细胞、巨噬细胞和中性粒细胞等)通过其表面表达的Fc受体(FcR)识别包被于靶抗原(如细菌或肿瘤细胞)上的Fc段,直接杀伤靶细胞。自然杀伤细胞(NK细胞)是介导ADCC特异性抗肿瘤最主要的效应细胞,而吞噬细胞、T细胞及粒细胞对ADCC抗肿瘤效应也有一定作用。ADCC被证明是单克隆抗体临床治疗肿瘤的重要机制和手段,在抗体介导的ADCC作用的发生过程中,抗体只能与靶细胞上的相应抗原表位特异性结合,而NK细胞等效应细胞可杀伤任何已与抗体结合的靶细胞,故抗体与靶细胞上的抗原结合是特异性的,NK细胞等对靶细胞的杀伤作用是非特异性的。但并非所有的肿瘤类型都有十分特异的抗体,ADCC作用的发生十分依赖于抗体的特异性和有效性,上述情况限制了这一疗法在肿瘤治疗中的应用。
与正常细胞相比,肿瘤细胞是一种快速增殖的细胞,在生长过程中需要大量氧气和营养物质,肿瘤部位间质高压和血管异常限制了氧气和营养物质的输运,无氧呼吸产生的乳酸在肿瘤部位堆积,导致肿瘤部位偏酸的性质。
细胞穿膜肽(CPPs)又称为蛋白转导域或膜转导肽,是由30个氨基酸或更少的氨基酸组成的具有穿透细胞膜能力的多肽。自1988年发现第一个穿膜肽Tat可以一种无毒且高效的方式穿入细胞后,穿膜肽就一直作为一种细胞内有效转导的工具。它可以通过化学结合或基因融合等方式携带蛋白质、DNA、化学药物、核苷酸、40nm磁珠和200nm脂质体等各种生物大分子穿透细胞生物膜和血脑屏障并且没有明显的细胞毒性,也没有细胞种类的限制,在细胞生物学、基因治疗学、药学等领域都有很大的研究价值。但是,由于CPPs的穿膜作用缺乏特异性,人们试图寻找某些适宜的靶向策略即在CPPs到达肿瘤组织之前设法屏蔽其结构域,当CPPs到达肿瘤组织后完全去屏蔽,从而规避非特异性摄取,以提高CPPs在肿瘤治疗方面的应用,pH敏感型CPPs是其中的优良代表。组氨酸的pKa≈6.5,含组氨酸的多肽在pH≤6.5时会发生质子化而带正电荷,而在pH 7.4时大部分不带电荷。应用这一原理构建的pH敏感型CPPs可在微酸性环境中(肿瘤组织)发挥穿膜作用而对正常组织没有影响。
本发明旨在构建一种可广泛应用于各类实体瘤的抗体或抗体片段,该抗体或抗体片段既能靶向肿瘤组织,又能介导抗体依赖细胞介导的细胞毒作用,杀伤肿瘤细胞,弥补引发ADCC的抗体受限制肿瘤细胞表面抗原变大的限制,扩大其以ADCC为杀伤机制的免疫治疗的使用范围。
技术实现要素:
本发明的目的是提供一种广泛应用于实体瘤的可诱导ADCC的多肽-抗体免疫偶联物及其制备方法。
为了实现本发明目的,本发明的多肽-抗体免疫偶联物,所述免疫偶联物由多肽与抗体或抗体Fc段通过共价键连接而成,其中,所述多肽为pH敏感型穿膜肽(pHLIP)。
所述多肽的序列如下:Ac-ACEQNPIYWARYADWLFTTPLLLLDLALLVDADEGT,其中,Ac为乙酰基。
本发明的免疫偶联物是由pH敏感型穿膜肽与抗体Fc段或抗体通过琥珀酰亚胺-4-(N-马来酰亚胺)环已烷-1-1羟酸酯共价键连接而成,即所述pH敏感型穿膜肽N端半胱氨酸残基上的巯基与抗体Fc段赖氨酸残基上的ε-氨基通过琥珀酰亚胺-4-(N-马来酰亚胺)环已烷-1-1羟酸酯共价交联而成。
本发明所述抗体或抗体Fc段为可诱导ADCC的抗体或抗体片段,包括人CD20抗体(例如,利妥昔单抗),小鼠IgG 2a或IgG 2b的Fc片段等。
本发明的多肽-抗体免疫偶联物中,每个抗体或抗体Fc段连接1-2条pH敏感型穿膜肽。
本发明的多肽-抗体Fc段免疫偶联物,可按照如下方法制备得到,包括步骤:
S1、抗体Fc段与交联剂琥珀酰亚胺-4-(N-马来酰亚胺)环已烷-1-1羟酸酯在pH7.4的磷酸盐缓冲溶液中室温搅拌反应约0.5-1.5h(优选1h),形成马来酰亚胺修饰的Fc蛋白,即Fc-SMCC;
S2、将步骤S1所得产物与pH敏感型穿膜肽在pH7.4的磷酸盐缓冲溶液中室温搅拌约2-4h(优选4h),即得所述多肽-抗体Fc段免疫偶联物。
其中,抗体Fc段和交联剂的摩尔比为0.025-0.5:1,pH敏感型穿膜肽与Fc-SMCC的摩尔比为0.1-1:10。
前述的方法,步骤S1还包括将生成的Fc-SMCC通过Sephadex G25除去未反应的交联剂,并通过截留分子量3KDa的Amicon ultra超滤管对产物进行浓缩的步骤。
前述的方法,步骤S2还包括将生成的多肽-抗体Fc段免疫偶联物用截留分子量10KDa的Amicon ultra超滤管除去未反应的pH敏感型穿膜肽的步骤。所得反应产物用聚丙烯酰胺凝胶电泳(SDS-PAGE)和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF)进行分子量测定。
本发明多肽-抗体Fc段免疫偶联物的制备方法中,反应所使用的缓冲液均通氮气充分排除氧气,所有反应均在氮气保护下进行。
本发明多肽-抗体免疫偶联物的合成过程及作用机理见图1。
本发明的穿膜肽-抗体Fc段免疫偶联物(pHLIP-Fc)既保留了穿膜肽pH响应穿膜的特点,又保留了抗体Fc段引起抗体依赖细胞介导的细胞毒(ADCC)的功能。体外实验证明,pHLIP-Fc可实现酸响应型穿膜并将Fc段蛋白锚定在细胞膜上诱发ADCC。体内实验结果表明,pHLIP-Fc明显抑制小鼠黑色素瘤和乳腺癌的生长。因此,pHLIP-Fc偶联物可用于临床实体瘤的免疫治疗。
本发明具有以下优点:
(一)本发明成功解决了以ADCC免疫疗法依赖肿瘤表面抗原的问题,该方法将抗体Fc段直接锚定在肿瘤细胞表面进步一引发ADCC。
(二)本发明多肽-抗体免疫偶联物的合成方法简单,快速,无需构建融合蛋白。
(三)该合成方法保留了多肽和抗体各自的生物学活性,即抗体Fc段上游离氨基与多肽NH3端半胱氨酸巯基偶联,不影响免疫细胞对Fc段识别与穿膜肽COOH端的穿膜行为。
附图说明
图1为本发明多肽-抗体免疫偶联物的合成过程及作用机理。
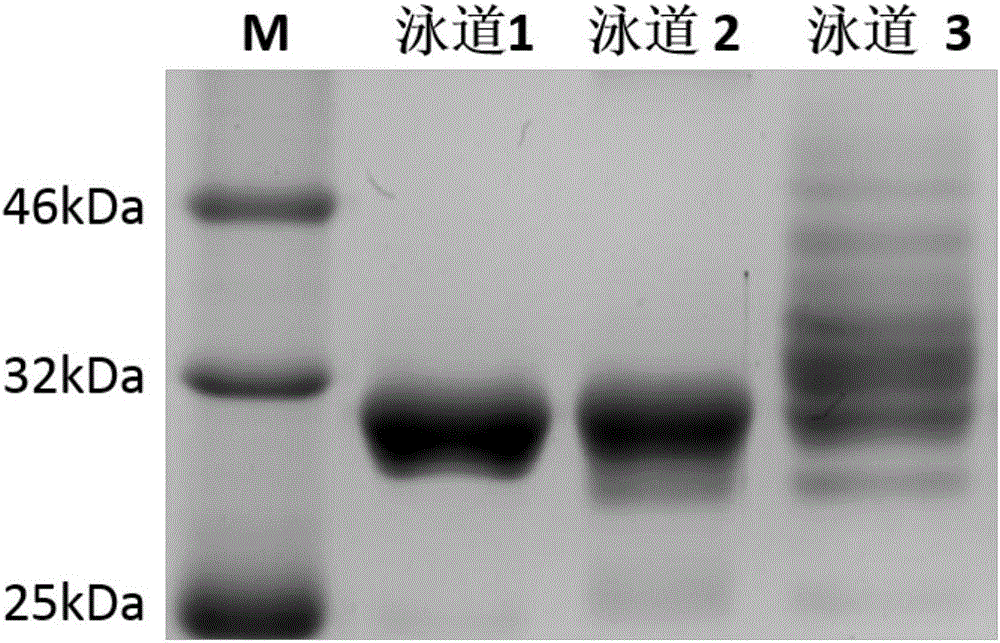
图2为本发明实施例1中pHLIP-Fc偶联物的SDS-PAGE分析结果(考马斯亮蓝染色)。其中,M为蛋白Marker,泳道1为Fc蛋白,泳道2为马来酰亚胺修饰的Fc蛋白,泳道3为pHLIP-Fc免疫偶联物。
图3为本发明实施例1中pHLIP-Fc偶联物的MALDI-TOF分析结果。其中,小鼠IgG2a Fc蛋白二聚体的分子量为58kDa,pHLIP分子量为4kDa,二者偶联产物根据pHLIP在Fc蛋白上的偶联数目不同可见分子量为62kDa,66kDa,70kDa,74kDa产物。
图4为本发明实施例2中激光共聚焦显微镜观察pHLIP-Fc免疫偶联物在酸性pH和生理pH条件下的细胞膜锚定作用。
图5为本发明实施例3中pHLIP-Fc偶联物对小鼠黑色素瘤B16细胞(A)和乳腺癌4T1(B)细胞的杀伤作用评价结果。
图6为本发明实施例4中pHLIP-Fc偶联物对小鼠黑色素瘤B16(A)和乳腺癌4T1(B)的免疫治疗效果。
图7为本发明实施例5中pHLIP-利妥昔单抗偶联物对人乳腺癌细胞系MDA-MB-231杀伤作用评价结果。
图4-图6中,pHLIP-Fc/a代表小鼠IgG 2a Fc蛋白与穿膜肽pHLIP构建的免疫偶联物。pHLIP-Fc/b代表小鼠IgG 2b Fc蛋白与穿膜肽pHLIP构建的免疫偶联物。pHLIP-Fc/G3代表小鼠IgG3Fc蛋白与穿膜肽pHLIP构建的免疫偶联物。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
以下实施例中多肽pHLIP的序列如下:Ac-ACEQNPIYWARYADWLFTTPLLLLDLALLVDADEGT。
实施例1穿膜肽-抗体Fc段偶联物(pHLIP-Fc)的制备
1、小鼠IgG2a Fc蛋白与sulfo-SMCC的共价交联
取200μg小鼠IgG2a Fc蛋白与55.2μg sulfo-SMCC溶解在0.5mLpH=7.4的10mM磷酸盐缓冲溶液中室温搅拌反应1h。用10mL10mM磷酸盐缓冲液(pH=7.4)平衡NAP-5Sephadex G25柱,将0.5mL反应产物加入柱中,除去未反应的SMCC,并通过截留分子量3KDa的Amicon ultra超滤管对产物进行浓缩离心至200μL,得到马来酰亚胺修饰的Fc蛋白。
2、将步骤1所得产物与0.2mg pHLIP溶解在pH=7.4的0.3mL 10mM磷酸盐缓冲溶液中室温搅拌4h,生成pHLIP-Fc。并用截留分子量10KDa的Amicon ultra超滤管离心除去未反应的pHLIP,得到pHLIP-Fc/2a。所得产物用聚丙烯酰胺凝胶电泳(图2)和基质辅助激光解吸电离飞行时间质谱(图3)进行分子量测定。pHLIP-Fc/b和pHLIP-Fc/G3的偶联物制备同pHLIP-Fc/a。
实施例2pHLIP-Fc免疫偶联物在酸性pH和生理pH条件下的细胞膜锚定作用
将B16细胞接种在共聚焦皿中,37℃5%CO2培养一段时间。用pH计对DMEM培养基(含10%胎牛血清)进行调整,得到pH6.8和pH7.4的完全培养基。用pH计对磷酸盐缓冲液pH进行调整,得到pH6.8和pH7.4的磷酸盐缓冲液。
(1)pHLIP-Fc在微酸条件下(pH=6.8)的细胞膜锚定作用观察。细胞融合到60%时,用pH=6.8磷酸盐缓冲液洗三遍,将pHLIP-Fc/a和pHLIP-Fc/b稀释在pH=6.8的完全培养基中,加入共聚焦皿。37℃ 5%CO2培养细胞2h后,弃去培养基,pH=6.8磷酸盐缓冲液洗三遍,4%多聚甲醛固定15min。封闭液室温封闭60min后,加入封闭液稀释的异硫氰酸荧光素(FITC)标记的兔抗小鼠荧光二抗,37度孵育30min,磷酸盐缓冲液洗3次。Hoechst染核10min,磷酸盐缓冲液洗3次,在激光显微镜下进行观察,Hoechst的激发波长为405,FITC激发波长为488。
(2)pHLIP-Fc在生理条件下(pH=7.4)的细胞膜锚定作用观察。操作步骤同pHLIP-Fc在微酸条件下(pH=6.8)的细胞膜锚定作用观察,pHLIP-Fc处理阶段的完全培养基和磷酸盐缓冲液pH为7.4。
实验结果见图4。图4显示pHLIP-Fc/a偶联物和pHLIP-Fc/b偶联物在微酸条件下(pH值6.8)的细胞处理组可见FITC荧光信号,该信号均匀分布于B16细胞表面,证明pHLIP通过穿膜行为将偶联物固定在细胞表面。而在生理条件下(pH值7.4),处理组基本无FITC信号。
实施例3pHLIP-Fc偶联物引起抗体依赖的细胞介导的细胞毒性作用ADCC能力鉴定
提取C57/BL-6小鼠全脾细胞为ADCC效应细胞,并对脾细胞进行计数。靶细胞选择小鼠B16黑色素瘤细胞和乳腺癌4T1细胞。
(1)在微酸条件下(pH值6.8)的ADCC能力鉴定
对靶细胞进行不同药物组处理,每种药物均在pH6.8的培养基中孵育细胞1h,后续实验过程中所用缓冲液pH值均调整为6.8。胰蛋白酶消化靶细胞,对靶细胞进行计数。效应细胞与靶细胞按25:1比例混合接入96孔板,靶细胞为20000个/孔,效应细胞与靶细胞在pH6.8的培养基中相互作用4h。
(2)在生理条件下(pH值7.4)的ADCC能力鉴定
对靶细胞进行不同药物组处理,每种药物均在pH7.4的培养基中孵育细胞1h,后续实验过程中所用缓冲液pH值均调整为7.4。胰蛋白酶消化靶细胞,对靶细胞进行计数。效应细胞与靶细胞按25:1比例混合接入96孔板,靶细胞为20000个/孔,效应细胞与靶细胞在pH7.4的培养基中相互作用4h。
利用乳酸脱氢酶(LDH)试剂盒检测效应细胞对靶细胞的杀伤效率。设置如下对照组并测定各对照组乳酸脱氢酶含量。
①效应细胞自发释放乳酸脱氢酶(LDH效应细胞)。
②靶细胞自发释放乳酸脱氢酶(LDH靶细胞)。
③靶细胞最大释放乳酸脱氢酶(LDH靶细胞裂解)。
④实验组(LDH实验)。
细胞杀伤率(%)=(LDH实验-LDH效应细胞-LDH靶细胞)/LDH靶细胞裂解×100%
实验结果见图5。结果表明,与其他对照组相比,pHLIP-Fc偶联物,包括pHLIP-Fc/a和pHLIP-Fc/b处理后的肿瘤细胞在微酸性条件下可引起明显的ADCC作用,细胞杀伤率达70%~80%。
实施例4pHLIP-Fc偶联物体内抗肿瘤能力检测
1、pHLIP-Fc偶联物静脉注射对小鼠黑色素瘤B16/F10的疗效
实验用体重为18-22g的C57/BL-6雌性小鼠,随机分5组,每组8只。背部皮下接种5×106个B16-F10肿瘤细胞构建小鼠黑色素瘤模型。当肿瘤长到4–5mm时,尾静脉注射药物(0.1mg/kg Fc蛋白),隔天给药。每天用游标卡尺记录小鼠肿瘤的大小。肿瘤体积用以下公式计算:V=L×W2/2,其中L代表肿瘤的长度,W代表肿瘤的宽度。实验结果见图6A。
2、pHLIP-Fc偶联物静脉注射对小鼠乳腺癌4T1的疗效
实验用体重为18-22g的BALB/C雌性小鼠,随机分5组,每组8只。小鼠右侧胸壁乳垫下接种5×106个4T1肿瘤细胞构建小鼠原位乳腺癌模型。当肿瘤长到4–5mm时,尾静脉注射药物(0.1mg/kg Fc蛋白),隔天给药。每天用游标卡尺记录小鼠肿瘤的大小。肿瘤体积用以下公式计算:V=L×W2/2,其中L代表肿瘤的长度,W代表肿瘤的宽度。实验结果见图6B。
图6A和B结果表明,与其他对照组相比,pHLIP-Fc偶联物,包括pHLIP-Fc/a和pHLIP-Fc/b抑瘤效果显著。
实施例5pHLIP-CD20抗体偶联物引起抗体依赖的细胞介导的细胞毒性作用ADCC能力鉴定
利妥昔单抗购自美国艾博抗公司。pHLIP-CD20抗体偶联物的制备方法同实施例1中穿膜肽-抗体Fc段偶联物(pHLIP-Fc)的制备。人全血样本来自血库志愿者。通过密度梯度离心法收集人外周血单核细胞PBMC,PBMC中的自然杀伤细胞(NK细胞)为ADCC效应细胞。对全部PBMC进行计数,一般情况下,NK细胞在PBMC中的含量为1~2%。靶细胞选择人乳腺癌细胞系MBA-MD-231细胞。
(1)在微酸条件下(pH值6.5)药物引起ADCC能力鉴定
对靶细胞进行处理药物处理,分为pHLIP-利妥昔单抗组和利妥昔单抗组,每种药物均在pH6.5的培养基中孵育细胞1h,后续实验过程中所用缓冲液pH值均调整为6.5。胰蛋白酶消化靶细胞,对靶细胞进行计数。按效应细胞与靶细胞按等比例混合接入96孔板,靶细胞为20000个/孔,效应细胞与靶细胞在pH6.5的培养基中相互作用4h。
(2)在生理条件pH下(pH值7.4)药物引起ADCC能力鉴定
对靶细胞进行处理药物处理,分为pHLIP-利妥昔单抗组和利妥昔单抗组,每种药物均在pH7.4的培养基中孵育细胞1h,后续实验过程中所用缓冲液pH值均调整为7.4。胰蛋白酶消化靶细胞,对靶细胞进行计数。按效应细胞与靶细胞按等比例混合接入96孔板,靶细胞为20000个/孔,效应细胞与靶细胞在pH=6.5的培养基中相互作用4h。
利用乳酸脱氢酶(LDH)试剂盒检测效应细胞对靶细胞的杀伤效率。具体操作过程同实施例3。实验结果如图7所示,与利妥昔单抗相比,pHLIP-利妥昔单抗偶联物处理后的肿瘤细胞在微酸性条件下引起可引起明显的ADCC作用,细胞杀伤率达65%左右。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110> 国家纳米科学中心
<120> 多肽-抗体免疫偶联物及其制备方法
<130> KHP161118723.3
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 36
<212> PRT
<213> 人工序列
<400> 1
Ala Cys Glu Gln Asn Pro Ile Tyr Trp Ala Arg Tyr Ala Asp Trp Leu
1 5 10 15
Phe Thr Thr Pro Leu Leu Leu Leu Asp Leu Ala Leu Leu Val Asp Ala
20 25 30
Asp Glu Gly Thr
35
- 还没有人留言评论。精彩留言会获得点赞!