没有α壳且具有增强的骨诱导的植入物表面的制作方法
本申请要求2016年8月3日提交的美国临时专利申请no.62/370,459的优先权,其内容通过引用结合在本文中。
本发明总体涉及骨科植入物领域。特别地,本发明涉及用于骨科植入物的金属表面,其在植入体内时刺激间充质干细胞分化成前成骨细胞,并刺激前成骨细胞成熟为成骨细胞,从而促进新骨生长。通过增材制造工艺和随后二次加工的组合来制备表面。表面没有α壳。
背景技术:
在整个说明书中引用了各种出版物、包括专利、公开的申请、技术文献和学术文章。
这些引用的出版物中的每一个都通过引用整体并入本文并用于所有目的。
各种骨科植入物用于矫正骨骼缺陷。在许多情况下,需要将植入物与相邻骨骼整合,但不容易实现。例如,已知通常用于骨科植入物的某些聚合物材料如聚醚醚酮(peek)不能与骨整合。即使对于能够与骨整合的钛合金等金属,光滑的表面也提供缓慢和较差的整合。此外,骨科植入物上的整合表面装饰有齿、刺、凹槽和其他突出表面,其实际上可以阻止或避免骨整合。
在需要整合的时,整合率直接与患者的整体健康状况相关。整合越快,手术修复区愈合的速度越快,患者从受到骨科干预需要的条件的阻碍而恢复之前生活方式的速度越快。因此,非常希望在骨科植入物和相邻骨之间发生整合。因此,本领域仍然需要能够实现快速和高质量骨整合的整合表面。
技术实现要素:
为了满足这个和其他需要,并且鉴于其目的,本发明的特征在于骨科植入物的骨诱导表面,包括骨接触和自由表面。这些骨诱导表面根据包括增材制造具有一个或多个自由表面并且具有一个或多个适于与骨接触的骨接触表面的骨科植入物,然后机械地、化学地、或机械并化学地侵蚀一个或多个骨接触表面,并且可选地机械地、化学地、或机械并化学地侵蚀一个或多个自由表面中的一个或多个,以去除α壳并且给机械、化学或机械并化学侵蚀的表面赋予包括微米级结构和纳米级结构的骨诱导粗糙度。一个或多个骨接触表面和自由表面中的一个或多个可包括宏观级粗糙度。在优选的方面,在增材制造之后,该方法包括机械侵蚀然后化学侵蚀一个或多个骨接触表面,并且可选地机械地、化学地、或机械并化学地侵蚀一个或多个自由表面中的一个或多个,以赋予骨诱导粗糙度。因此,在一个或多个自由表面中的一个或多个被侵蚀的某些优选方面中,某些自由表面被侵蚀而某些自由表面不被侵蚀。
根据该方法产生的骨接触表面和自由表面显著增强、促进并/或上调(包括其速率和程度)骨诱导、骨发生、碱性磷酸酶的间充质干细胞表达、osterix的前成骨细胞表达和骨钙蛋白的成骨细胞表达中的一种或多种。当这些表面与骨接触或与间充质干细胞接触时,会发生这种增强、促进和/或上调。这种接触可以是体外的、或体内的或原位的。根据该过程产生的表面获得的骨诱导、骨发生、间充质干细胞碱性磷酸酶表达、前成骨细胞osterix的表达和骨钙蛋白的成骨细胞表达中的一种或多种的增强显著大于,当其他类型的骨科植入物表面与骨接触或与间充质干细胞接触时(体外、体内或原位)时获得的骨诱导、骨发生、间充质干细胞碱性磷酸酶表达、前成骨细胞osterix表达和/或骨钙蛋白的成骨细胞表达。在某些方面,这样的其他类型的表面没有包括微米级结构和纳米级结构的骨诱导粗糙度,例如未经过机械和/或化学侵蚀处理以赋予包括微米级结构和纳米级结构的骨诱导粗糙度的表面。
在某些方面,根据该方法产生的一个或多个骨接触表面,当与骨接触时,其骨诱导相对于对比骨接触表面接触骨时的骨诱导显著增加,该对比骨接触表面包括宏观级粗糙度并且包括骨诱导粗糙度,该骨诱导粗糙度包括通过机械和化学侵蚀大块基材产生的微米级结构和纳米级结构。在某些方面,根据该方法产生的一个或多个骨接触表面,当与骨接触时,其骨发生相对于对比骨接触表面接触骨时的骨诱导显著增加,该对比骨接触表面包括宏观级粗糙度并且包括骨诱导粗糙度,该骨诱导粗糙度包括通过机械和化学侵蚀大块基材产生的微米级结构和纳米级结构。在某些方面,根据该方法产生的一个或多个骨接触表面,当与骨接触时,间充质干细胞的碱性磷酸酶表达水平相对于对比骨接触表面接触骨时的间充质干细胞的碱性磷酸酶表达水平显著增加,该对比的骨接触表面包括宏观级粗糙度并且包括骨诱导粗糙度,该骨诱导粗糙度包括通过机械和化学侵蚀大块基材产生的微米级结构和纳米级结构。在某些方面,根据该方法产生的一个或多个骨接触表面,当与骨接触时,前成骨细胞的osterix表达水平相对于对比骨接触表面接触骨时的前成骨细胞osterix表达水平显著增加,该对比骨接触表面包括宏观级粗糙度并且包括骨诱导粗糙度,该骨诱导粗糙度包括通过机械和化学侵蚀大块基材产生的微米级结构和纳米级结构。在某些方面,根据该方法产生的一个或多个骨接触表面,当与骨接触时,成骨细胞的骨钙蛋白表达水平相对于对比骨接触表面接触骨时的成骨细胞的骨钙蛋白表达水平显著增加,该对比骨接触表面包括宏观级粗糙度并且包括骨诱导粗糙度,该骨诱导粗糙度包括通过机械和化学侵蚀大块基材产生的微米级结构和纳米级结构。
增材制造骨科植入物的步骤可包括用电子束熔化(ebm)增材制造地制造骨科植入物。增材制造骨科植入物的步骤可包括通过选择性激光烧结增材制造地制造骨科植入物,包括例如直接金属激光烧结(dmls)。增材制造骨科植入物的步骤可包括用选择性激光熔化(包括例如lasercusingtm)增材制造地制造骨科植入物。增材制造骨科植入物的步骤可以包括通过熔融沉积成型(fdm)、直接金属沉积、激光工程净成形(lens)、基于线的定向能量沉积或使用能量源融化的任何其他方法来增材制造地制造骨科植入物。在增材制造骨科植入物的步骤之后,增材制造过程可以进一步包括热等静压(hip)或对骨科植入物进行应力消除。
骨科植入物优选包括金属或陶瓷。金属可包括钴铬合金、钛合金、钛、铝和钒的合金、钛和镍的合金、镍钛诺或不锈钢。
本发明还涉及骨科植入物,该植入物包括一个或多个骨接触表面和根据本文描述或示例的任何方法生产的一个或多个自由表面。通过机械侵蚀、化学侵蚀或机械和化学侵蚀处理的这些植入物的表面包括骨诱导粗糙度,该骨诱导粗糙度包括微米级结构和纳米级结构,其显著增强、促进并/或上调(包括其速率和程度)当这些表面与骨接触或与间充质干细胞接触时(例如在将植入物植入体内之后)的骨诱导。
本发明的特征还在于一种骨科植入物,其具有带有多个表面的钛或钛合金本体。
骨科植入物根据包括以下步骤的方法生产:(a)增材制造构建骨科植入物;然后(b)机械地、化学地、或机械地和化学地侵蚀骨科植入物的一个或多个表面,以(i)从中除去α壳,并(ii)将包括微米级结构和纳米级结构的骨诱导粗糙度赋予一个或多个表面。或者,该方法包括以下步骤:(a)增材制造地构建具有一个或多个自由表面的骨科植入物,并且其具有一个或多个适于与骨接触的骨接触表面,至少一个或多个骨接触表面具有宏观级粗糙度,当骨接触表面与骨接触时,该宏观级粗糙度抑制骨科植入物的移动;然后(b)依次机械地和化学地腐蚀一个或多个自由表面和一个或多个骨接触表面中的一个或多个,以(i)从中除去α壳,并(ii)将包括微米级结构和纳米级结构的骨诱导粗糙度赋予一个或多个自由表面和一个或多个骨接触表面中的一个或多个。
应理解,本发明前面的一般性描述和以下的详细描述都是示例性而非限制性的。
附图说明
当结合附图阅读时,从以下详细描述中可以最好地理解本发明。附图中包括若干图,如下所述。
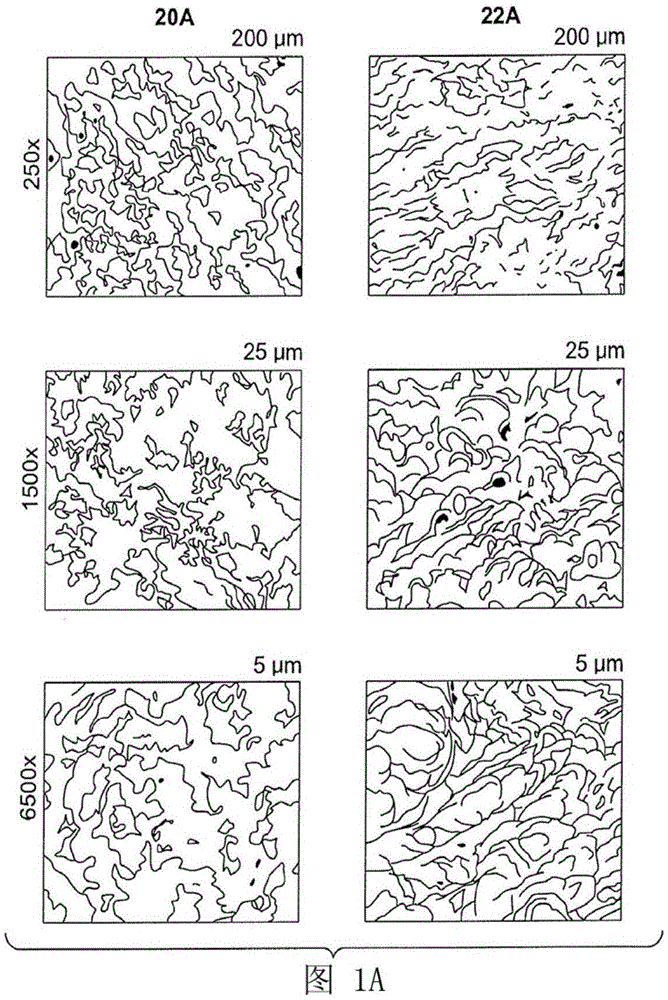
图1a显示了增材制造的表面的扫描电子显微镜(sem)图像,其中,表面20a是dmls产生的表面,其经受应力消除但没有侵蚀,而表面22a是dmls产生的表面,其受到应力释放和机械及化学侵蚀;
图1b显示了增材制造的表面的sem图像,其中,表面20b是ebm产生的表面,其经受热等静压(hip)但没有侵蚀,而表面22b是ebm产生的表面,其经受hip和机械及化学侵蚀;
图1c显示了增材制造的表面的sem图像,其中,表面20c是dmls产生的表面,其经受hip但没有侵蚀,而表面22c是dmls产生的表面,其经受hip和机械及化学侵蚀;
图1d显示了增材制造的表面的sem图像,其中,表面16e是激光产生的表面,其经受热等静压和碳酸氢钠喷射的机械侵蚀,而表面16f是激光产生的表面,其经受热等静压和钛喷射(titaniumblast)的机械腐蚀;
图1e示出了增材制造的表面29d的sem图像,该表面是激光产生的表面,具有内部宏观纹理,经受热等静压和机械及化学侵蚀;
图2a显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的mg63细胞表达的碱性磷酸酶水平(表面20a、20b和20c以及22a、22b和22c是如图1a、1b和1c中所述的相同表面);
图2b显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的mg63细胞表达的骨桥蛋白水平(表面20a、20b和20c以及22a、22b和22c是如图1a、1b和1c中所述的相同表面);
图2c显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的mg63细胞表达的runx2的水平(表面20a、20b和20c以及22a、22b和22c是如图1a、1b和1c中所述的相同表面);
图3a显示了在增材制造的表面20a、20b和20c以及22a、22b和22c(表面20a、20b和20c以及22a、22b和22c是如图1a、1b和1c中所述的相同表面)上培养的saos-2细胞表达的碱性磷酸酶水平;
图3b显示了在增材制造的表面20a、20b和20c以及22a、22b和22c(表面20a、20b和20c以及22a、22b和22c是如图1a、1b和1c中所述的相同表面)上培养的saos-2细胞表达的osterix水平;
图3c显示在增材制造的表面20a、20b和20c以及22a、22b和22c(表面20a、20b和20c以及22a、22b和22c是如图1a、1b和1c中所述的相同表面)上培养的saos-2细胞表达的骨钙蛋白水平;
图3d显示分别在增材制造的表面16e、16f和29d(表面16e、16f和29d是如图1d和1e中所述相同的表面)上培养的saos-2细胞表达的碱性磷酸酶(最左边的柱)、osterix(中心柱)和骨钙蛋白(最右边的柱)的水平;
图4显示了钛的微观结构,说明了钛的不同合金相;
图5表示钛-氧相图;
图6是表示在加热过程中空气与钛反应时,碳、氮和氧浓度随离表面的距离变化的曲线图;
图7a是离开ebm机器并经受hip的钛盘的金相截面的光学显微照片;
图7b是离开ebm机器并且经受hip和传统的喷射工艺的钛盘的金相截面的光学显微照片;
图7c是离开ebm机器并且经受hip和机械及化学侵蚀的钛盘的金相截面的光学显微照片;以及
图8显示了机械侵蚀以及机械和化学侵蚀的组合如何从增材制造构建中去除未烧结或部分烧结的粉末。
具体实施方式
在整个说明书和权利要求中使用与本发明的方面有关的各种术语。除非另有说明,否则这些术语将在本领域中给出它们的普通含义。其他具体定义的术语应以与本文提供的定义一致的方式解释。
如本文所用,除非另有明确说明,否则单数形式“一”(“a”、“an”)和“该”包括复数指示物。
术语“受试者”或“患者”可互换使用。受试者可以是任何动物,包括哺乳动物,例如伴侣动物、实验动物和非人灵长类动物。优选人类。
“垂直地”增材制造骨科植入物意味着在增材制造过程中,构建开始于植入物的不接触骨骼的表面(例如自由表面),使得由一个或多个增材叠加层的边缘产生骨接触的表面。作为示例而非限制,如果骨科植入物的顶部或底部表面旨在接触骨骼但是植入物的侧面不旨在接触骨骼,则构建开始于植入物的一侧,当层沉积时,产生骨接触的顶部和底部。垂直增材制造与更传统的水平增材制造工艺形成对比,其中构建始于骨接触表面。作为示例而非限制,如果骨科植入物的顶部或底部表面旨在接触骨骼但是植入物的侧面不旨在接触骨骼,则通过水平增材制造,构建从骨接触顶层或底层的任一个开始。
如本文所用,“大块基材”是指骨科植入物或前体、样例或骨科植入物的原型,例如预制件、坯料、固料、金属铸件、锻造金属、金属块、金属锭或大块金属,没有任何增材制造。
如本文所用,“骨诱导”(“osteoinduction”和“osteoinducting”)是指诱导或引发骨发生,并且包括将未成熟的间充质干细胞募集到加工的(例如,机械和/或化学侵蚀的)骨接触表面和/或骨科植入物的加工的(例如,机械和/或化学侵蚀)自由表面,随后是这些干细胞向前成骨细胞的表型进展和分化,以及前成骨细胞向成骨细胞的进一步表型进展和分化。这种表型进展和分化的特征在于通过间充质干细胞上调碱性磷酸酶表达,随后当间充质干细胞分化成前成骨细胞时上调osterix,随后随着前成骨细胞成熟为成骨细胞而上调骨钙蛋白。
“骨发生”包括骨基材的形成和发展。
如本文所用,“自由表面”是骨科植入物的表面,其在植入物植入体内时不直接接触骨骼。然而,经过处理以赋予包括微米级和纳米级结构的骨诱导粗糙度的自由表面可以刺激骨骼从头生长,使得在植入后一段时间之后,伴随骨骼从自由表面生长,自由表面接触骨。在某些方面,例如,当植入物植入体内时,骨科植入物的一个或多个自由表面可接触骨移植物材料(例如,合成的、同种异体移植物或自体移植物材料)。从业者可以将骨移植材料放置成与一个或多个自由表面接触。
根据本发明已经观察到,增材制造骨科植入物,随后对增材制造的表面进行机械和化学侵蚀的组合导致这样的表面能够刺激前成骨细胞成熟为成骨细胞,并刺激前成骨细胞和成骨细胞上调能促进和支持骨生成的蛋白质的表达。发现这些表面至少显著增强了这些蛋白质的量,并且据信这些蛋白质的表达速率也得到了提高。据信这些表面还能够刺激间充质干细胞分化成前成骨细胞,并上调能促进和支持骨生成的蛋白质的表达。
当骨科植入物与相邻骨的整合(例如,骨整合)是期望的结果时,这种蛋白质的上调意味着体内的整合过程(例如,在这些表面和相邻骨之间)将快速且稳健地进行。因此,本发明的特征在于用于骨科植入物的骨诱导骨接触表面,该骨科植入物是根据一种方法生产的,该方法开始于增材制造骨科植入物,然后处理增材制造的植入物的表面,其旨在依靠产生并/或增强表面的骨诱导结构特征的侵蚀技术,促进新的骨生长。
通常,用于产生骨诱导增强的骨接触表面的方法包括首先增材制造骨科植入物,例如,植入物体具有所需的基本形状、构造和结构取向,用于植入物所要植入的身体内的特定位置,用于植入物的特定矫正应用,然后处理植入物的一个或多个表面(例如,骨接触和自由表面中的任一个或两个)以去除α壳并产生骨生长增强的生物活性表面地形。在某些优选的方面,通过顺序增材制造和减成蚀刻工艺产生的一个或多个骨接触表面包括重叠的宏观级粗糙度、微米级粗糙度和纳米级粗糙度。在某些优选的方面,通过顺序增材制造和减成蚀刻工艺产生的一个或多个自由表面包括重叠的微米级粗糙度和纳米级粗糙度。每个粗糙度可以包括规则的、不规则的或规则和不规则结构特征的组合,例如宏观级粗糙度、微米级粗糙度和纳米级粗糙度表面的结构布置可以独立地是规则的、不规则的、或者规则的和不规则的。
增材制造工艺产生的表面通常在微观上是光滑的。因此,优选用于生产骨科植入物的增材制造技术至少在骨接触表面上赋予宏观级粗糙度,尽管通过增材过程产生的自由表面触摸起来可能是粗糙的或光滑的。宏观级粗糙度包括宏观级结构特征,其用于抓握骨骼并且一旦植入体内就抑制植入物的移动。宏观级特征的形状、构造、取向、尺寸、设计和布局可以编程到增材制造软件中。
因此,在某些方面,骨科植入物的增材制造包括通过增材制造来工程化和设计植入物本体的几何形状、尺寸和结构特征。植入物本体可包括任何合适的形状或几何形状,以及任何合适数量的侧面和表面-包括骨接触表面并包括自由表面-其可取决于例如体内植入部位内的特定形状和位置。植入物可包括平坦的、圆形的、规则的和/或不规则的表面。作为示例而非限制,骨科植入物可包括关节替代物(例如,臀部、膝盖、肩部、肘部、踝部、腕部、颌部等)、长骨或短骨(或其部分)替代物、颅骨或颌骨替代物、用于诱导单独骨骼(例如,手指关节、踝关节、椎骨或脊柱运动节段)的融合或物理连接的植入物、旨在将另一种植入物固定到骨骼上的植入物(例如,骨螺钉、椎弓根螺钉和固定元件)、促进骨折重新连接的植入物(包括骨螺钉、髓内钉、杆和板等),或替换、修复、支撑或补充任何体内骨骼的任何植入物。在某些方面,植入物包括用于替换椎间盘或用于替换脊柱运动节段的植入物。在高度优选的方面,植入物旨在与周围骨骼整合。植入工程和设计可以是计算机辅助的。
此外,增材制造还包括工程化和设计宏观级结构特征的几何形状、尺寸和结构特征或要赋予植入物的骨接触表面的粗糙度。工程化可以源自通过强力酸蚀刻大块基材产生的表面的宏观级粗糙度的成像/光学扫描,其中成像信息输入到增材制造程序模型中。
宏观级粗糙度的工程化可以考虑由国际标准化组织(iso)建立的一个或多个粗糙度参数的特定值的合理设计,例如iso468:1982。这些参数包括但不限于rp(最大高度轮廓)、rv(最大轮廓谷深度)、rz(轮廓的最大高度)、rc(轮廓的平均高度)、rt(轮廓的总高度)、ra(轮廓的算术平均偏差)、rq(轮廓的均方根偏差)、rsk(轮廓的偏斜度)、rku(轮廓的峰度)、rsm(轮廓的平均宽度)、rδq(轮廓的均方根斜率)、rmr(轮廓的材料比)、rδc(轮廓截面高度差)、lp(采样长度-主轮廓)、lw(采样长度-波纹轮廓)、lr(采样长度)-粗糙度轮廓)、ln(评估长度)、z(x)(纵坐标值)、dz/dx(局部斜率)、zp(轮廓峰值高度)、zv(轮廓谷深度)、zt(轮廓元素高度)、xs(轮廓元素宽度)和mi(轮廓的材料长度)。其他参数可包括rsa(表面积增加)、rpc(峰值计数)、h(瑞典高度)、iso平坦度(面积平坦度偏差)、ptiso(峰谷轮廓高度)、rtm(平均峰谷粗糙度)、rv(最低值)、rvm(平均谷轮廓深度)、ry(最大峰谷粗糙度)、rpm(平均峰区域高度)、s(局部峰值之间的平均间距)、sm(平均线的峰值之间的平均间距)、峰顶数、峰顶密度、峰顶间距、谷数、谷密度和谷间距。另外,预期增材制造可以进一步包括工程化和设计微米级粗糙度和/或纳米级粗糙度的几何形状、尺寸和结构特征,以将其赋予植入物的骨接触表面或自由表面,特别是随着增材制造设备的能力的发展,以允许增材制造更精细和更细微的细节。
骨科植入物可以由任何合适的材料(包括金属、陶瓷、骨或其任何组合或复合物)增材制造。高度地优选金属。金属可包括合金。优选的金属包括钛和钛合金(例如镍-钛合金(如,镍钛诺),以及铝和钒(如,6-4)钛合金)、钴铬合金,以及外科级钢(如,不锈钢)。骨科植入物优选地不由诸如聚醚醚酮(peek)的聚合物制成。
增材制造可以包括通过将固体材料接连分层沉积到基材上,然后将沉积的固体材料烧结或熔化成骨科植入物层,然后将更多固体材料沉积到前一层上,然后将新沉积的层烧结或熔化,与前一层融合并建立下一层,并重复这些步骤直到植入完成。沉积的固体材料可以是线、粉末、颗粒、微粒、碎片或其组合的形式,其通过能量源烧结或熔化。粉末、颗粒、微粒、碎片或其组合优选基本上为球体。优选粉末、颗粒、微粒、碎片或其组合不包括不规则形状或边缘或锯齿状边缘。球体可以包括不同的尺寸,或者可以具有基本相同的尺寸。
增材制造可包括烧结和/或熔化粉末、颗粒、微粒、线、碎片或其组合。烧结和/或熔化优选实现基本上完全熔化粉末、颗粒、微粒、碎片或其组合,使得沉积的层包括基本上完全熔融的材料,该材料优选为金属。合适的增材制造技术包括但不限于选择性激光烧结(包括例如直接金属激光烧结(dmls)(
沉积和/或烧结或熔化可以在惰性环境中进行,例如,用低氧和/或在氮气和/或氩气存在下进行。在某些方面,前一层(刚刚形成)在连续层沉积在其上之前,基本上没有固化。在某些方面,前一层(刚刚形成)在连续层沉积在其上之前,至少部分固化。
在某些方面,植入物是垂直增材制造的。垂直增材制造开始是创建层,该层将构成正在制造的植入物的不同于骨接触表面的表面(例如自由表面),其中沉积和烧结或熔化的连续层直到完成相对的面。因此,骨接触表面由以垂直构建方案铺设的层的边缘产生。
在通过增材过程完成植入物本体的构建之后,植入物本体可以经受应力消除处理,包括对形成的植入物本体的再加热。应力消除可以在真空和/或惰性气体下进行。加热可以在引起金属内扩散的温度下进行,然后进行冷却步骤。在某些方面,再加热也可伴有压力。压力可以是单轴的(例如,从一个方向施加;热单轴压制或hup)或等静压(例如,从所有方向均匀地施加)。高度优选的是热等静压(hip)。
通过将植入物本体置于密封容器中来进行hip,该容器可加热并通过添加与移除气体来压力控制。通常,一旦将植入物本体放置在密封容器中,就将容器抽空以除去任何污染气体。然后加热容器,同时将惰性气体(例如氩气)引入腔室中以增加压力。然后将容器在升高的温度和压力下保持一段时间,之后将容器快速冷却并减压。
hip在低于制造植入物本体的材料的熔点的温度下进行,但是在使得植入体的扩散和塑性变形发生的足够高温度下进行。温度通常低于熔化温度的80%。例如,根据astm标准规范f3001,对于含有6%铝和4%钒的钛合金,可以在至少100mpa(14,504psi)的压力下,将植入体加热到895℃(1,643°f)至955℃(1,751°f)±15℃(59°f)的温度范围,保持180±60分钟的时间,然后冷却至低于425℃(797°f)。本领域普通技术人员已知对于其他材料的类似规范,例如来自astm的其他标准。
据信hip导致植入物本体的变化。例如,温度和压力的组合导致植入物体内存在的任何内含物的塌陷。在某些方面,植入物本体的密度在hip之后可以基本上接近或等于100%,这意味着植入物可以基本上没有包含本体(内部孔)。去除层间边界并去除内含物改善了植入物本体的机械强度并降低了植入后失效的可能性。金属扩散还可以减少或消除由上述增材制造工艺产生的金属层之间的边界。
此外,来自hip的升高的温度和压力促使金属扩散穿过晶界,导致晶粒结构、晶粒尺寸、晶粒组成、晶粒分布或其任何组合的细化。在某些方面,hip可以至少增加晶粒尺寸,特别是当耦合到电子束熔化增材构建时。hip可以改变植入物表面上的晶粒结构和晶间边界。
在增材制造步骤之后,并且进一步进行应力消除、hup或hip处理,如果在该方法中采用这种处理,该方法还包括侵蚀增材产生的骨接触表面、自由表面或骨接触表面和自由表面,以将骨诱导结构特征赋予这些表面。骨诱导结构特征包括促进或增强骨诱导的微米级结构和纳米级结构。机械地、化学地或机械地和化学地侵蚀增材制造的植入物的一个或多个骨接触表面,以将包括微米级结构和纳米级结构的骨诱导粗糙度赋予骨接触表面。在某些方面,机械地、化学地或机械地和化学地侵蚀增材制造的植入物的一个或多个自由表面,以将包括微米级结构和纳米级结构的骨诱导粗糙度赋予自由表面。因此,可以处理增材制造的植入物的骨接触表面和自由表面中的任一个或两者,以包括骨诱导微米级和纳米级结构。有效地,这种处理可以建立增材制造的宏观级结构与侵蚀产生的微米级和纳米级结构的重叠。
机械和/或化学处理用作减成处理,例如侵蚀或蚀刻。机械侵蚀包括但不限于将骨科植入物的骨接触表面暴露于光蚀刻、能量轰击、等离子体蚀刻、激光蚀刻、电化学蚀刻、机械加工、钻孔、研磨、喷丸、磨料喷射(例如喷砂或喷粒,包括用铝或氧化钛颗粒喷砂处理),或这些处理的任何组合。化学侵蚀可包括,例如,将选择的表面或整个植入物暴露于化学物质如酸或碱,其中酸或碱蚀刻与酸或碱接触的骨接触表面。化学侵蚀可包括但不限于化学、电化学、光化学、光电化学或其他类型的化学研磨、蚀刻或用于去除部分基材的其他处理。蚀刻剂可以是湿的或干的,以及任何状态:液体、气体或固体。在优选的方面,在增材制造之后连续使用机械腐蚀和化学(例如酸)侵蚀。机械侵蚀优选在化学侵蚀之前。优选地,机械侵蚀和化学侵蚀都不会将孔引入骨接触表面。
在用于将骨诱导特征赋予这些表面的植入物表面的侵蚀之前,可以通过掩蔽来保护植入物的其他表面,该其他表面不是用于骨诱导或以其他方式诱导骨生长,或者已经增材制造成光滑的。在某些方面,可以通过掩蔽来保护自由表面。然后可以机械地和化学地侵蚀植入物的暴露的非掩蔽表面。
优选通过使用颗粒喷射来实现机械侵蚀。颗粒可包括有机或无机介质。合适的颗粒包括例如氧化铝颗粒和/或氧化钛颗粒和/或玻璃珠颗粒和/或浮石颗粒和/或碳化硅颗粒和/或羟基磷灰石颗粒,或其他合适的金属颗粒,或陶瓷颗粒。有机颗粒如核桃壳或可溶解颗粒如碳酸氢钠也是合适的。
优选使用酸实现化学侵蚀,但是可以使用能够侵蚀植入物材料的骨接触表面的任何化学品。优选的酸是强酸,例如hf、hno3、h2so4、hcl、hbr、hi、hclo4、柠檬酸及其任何组合,但所用的具体酸并不重要。据信,酸以增强骨接触表面或自由表面的骨诱导增强特性的方式蚀刻晶粒结构和晶界。高度优选机械侵蚀之后化学侵蚀。化学侵蚀可以在单一化学处理中完成,尽管可以按顺序采用多种处理以增加或增强骨接触表面上的纳米级结构。控制化学侵蚀的强度,侵蚀发生的温度以及分配给侵蚀过程的时间允许精细控制由侵蚀产生的所得表面。
机械和化学侵蚀处理步骤中的一个或两个可以去除不需要的污染物。在某些应用中,可以去除倾向于在金属表面上形成的氧化物。然而,在其他应用中,可能需要氧化物,因此,应设计处理步骤以避免除去氧化物。更具体地,钛表面上的某些氧化物可能是有益的。参见,例如,格雷泽(gretzer)等人提交的美国专利申请公开no.2010/0174382。格雷泽等人公开了一种具有植入物表面的骨组织植入物。表面覆盖有包括锶离子的氧化物层。申请人断言氧化物层中的锶离子具有所需的骨诱导效应。
在其他应用中,必须避免或去除钛表面上的氧化物。特别希望在由钛或钛合金形成的植入物上避免或除去称为“α壳”的特定的富氧表面相。上面讨论的机械和化学侵蚀处理步骤中的一个或组合可以基本上从钛植入物的侵蚀表面去除α壳(如果存在的话)。下面讨论这种去除。
a.α壳及其钛基础
钛分别于1791年和1795年发现和命名。尽管在1887年首先制备其不纯的形式,但其纯金属(99.9%)直到1910年才制成。钛在许多来源中被发现,包括陨石、矿物、铁矿石、煤灰、植物和人体。1946年发现仍然主要用于商业生产钛的方法,并使用镁来还原四氯化钛并分离纯金属。
纯钛是一种有光泽的白色金属。它具有约1,720℃(3,140°f)的相对较高的熔点、4.5的低比重、低密度、良好的强度、以及在低于约425-540℃(800-1,000°f)的温度下具有出色的耐腐蚀性。钛的弹性模量为16x106lb/in2,这意味着它比大多数铝合金具有更大的刚度。钛很容易制造。这些特性使钛及其合金的使用非常有吸引力,钛是重要的与其他金属的合金剂。钛合金用于例如医疗植入物中。
钛金属及其合金的缺点是在温度高于约425℃(800°f)时与其他元素反应,这限制了它在高温下的使用。钛在高温下的反应特性在处理操作以及初始生产中造成相当大的困难。
钛以两种同素异形形式存在:在温度高达885℃(1,625°f)为α,高于该温度为β。α钛具有六方密堆积(hcp)晶体结构,而β是体心立方(bcc)。大多数合金元素降低了α-β转变温度。氧气、氮气和铝会提高转变温度。然而,氧气和氮气增加了硬度和强度,降低延展性,因此降低可成形性。铝对α相的稳定作用促进了在较高温度下的稳定性,这使得铝成为许多钛合金中的重要元素。
合金元素铁、锰、铬、钼、钒、铌和钽稳定β相,从而降低α-β转变温度。添加铌和钽引起强度提高,并有助于防止钛和铝化合物存在带来的脆化。元素镍、铜和硅是活性共析体形成物,而锰,铬和铁在共析体的形成中是缓慢的。元素锡和锆可溶于α和β结构。
根据结构,钛合金可分为三大类:(1)全α合金仅含有中性合金元素和/或α稳定剂,对热处理无响应,因此不能提高其他合金的可能强度;(2)α-β合金含有α和β稳定剂的组合,可以不同程度地热处理,并具有良好的延展性;(3)全β合金是亚稳态的,具有相对低的延展性,含有足够的β稳定剂以在加工时完全保留β相,并且可以进行溶液处理和老化以实现强度的显著增加。
图4显示了钛微结构的一个例子,说明了钛的不同合金相。稳定剂是在金属中具有高溶解度的元素,通常用于合金中。向钛添加稳定剂的目的是改变特定相的转变温度以产生二元α-β相。添加α稳定剂(通常为铝),以提高α相的转变温度。钒是一种同晶β稳定剂,完全溶于β相。其他β稳定剂如铁不能完全溶解,产生共析相。稳定剂以其周期表符号的名称和重量百分比表示。例如,ti-6al-4v是6%的铝和4%的钒。
ti-6al-4v是最常见的钛合金,占钛总用量的50%以上。它是一种α-β合金,可热处理以实现适度的强度增加。ti-6al-4v是许多应用中的世界标准,因为它具有高强度、轻重量、延展性和耐腐蚀性。该合金最常见的应用之一是医疗器械。
eli代表超低间隙,是ti-6al-4v的高纯度版本,对铁和间隙元素碳和氧的限制较低。与ti-6al-4v一样,它也是α-β合金。ti-6al-4veli具有出色的生物相容性,因此成为许多医疗应用的首选材料。与标准ti-6al-4v相比,它具有优异的损伤容限(断裂韧性、疲劳裂纹扩展速率)和在低温下更好的机械性能。ti-6-4eli的常见应用包括关节置换物、骨固定装置、手术夹和低温容器。
b.α壳
钛在高温下容易吸收氧气。当钛及其合金暴露于加热的空气或氧气时,会形成称为α壳的富氧表面相。α壳是由氧扩散到钛表面引起的。更一般地,α壳是加热后存在于钛上的碳,氮或尤其富含氧的α稳定表面。
图5表示钛-氧相图。hcp相代表α相,bcc是β相。α-β相是hcp和bcc之间的区域。将二元相与hcp相分开的线是形成α壳所需的氧浓度。通常,热处理过程中,相图上会达到可能出现这种情况的温度。
图6是表示在加热过程中空气在钛表面与钛反应时的碳、氮和氧浓度的图。正如所料,碳和氮浓度低且稳定。氧气更易溶于钛;因此,其表面的浓度梯度要高得多。图6的曲线图中显示的值受加热条件的影响,但氧、氮和碳的一般表现对于钛来说是典型的。氧浓度梯度表示上述α壳相。α壳的厚度取决于曝光时间、气氛和温度。
α壳是不期望的,因为它坚硬而易碎。此外,α壳会产生一系列微裂纹,这会降低钛金属的性能,特别是其疲劳强度性能。α壳还存在对钛使用的缺点,因为α壳会影响耐腐蚀性,并且限制了钛在机械性能方面的高温性能。
c.形成没有α壳的表面
鉴于α壳的缺点,通常希望形成没有α壳的钛植入物的表面。通常,有两种方法可以实现这样的表面。一种方法是首先避免或至少最小化α壳的形成(即,在钛的加工过程中)。通过使用真空冶金或惰性气体可以最小化α壳的形成,其中钛在没有氧的情况下加热。因此,通过在非常深的真空水平或惰性环境中处理钛,可以最小化或避免α壳。
然而,由于各种原因,在不存在氧的情况下处理钛可能是不切实际或不合需要的。
还可以施加涂层以阻挡被加热的钛表面中的碳、氮和氧,以控制α壳的形成。可从a.o.获得的ceram-
然而,一旦存在于钛的表面上,形成没有α壳的钛植入物表面的第二种方法是去除α壳。在机械或化学热处理后可以除去α壳。参见,例如名称为“从β相钛合金中去除α壳钛层的方法”的欧洲专利申请公开no.1947217b1,其于2012年5月23日公布,并转让给unitedtechnologiescorporation。公开的申请公开了一种表面处理钛制品的方法,该方法包括化学去除具有钛合金α相的表面层的步骤。在一个公开的示例中,化学去除包括使用具有硝酸和氢氟酸的第一溶液,和使用具有硝酸的第二溶液。
一种新兴技术是使钛金属在高温度下在熔融盐(例如氯化钙或氯化锂)中进行电化学处理。该方法至少在实验室环境中有效地从α壳中除去溶解的氧,并因此回收金属。然而不幸的是,高温处理的不期望的后果是金属中晶粒的生长。通过降低熔盐温度可以限制晶粒生长。或者,可以进一步处理金属以将大颗粒破碎成较小的颗粒。
根据本发明以及当植入物由钛形成时,用于形成增强骨诱导的植入物表面的方法的一个重要方面是去除任何α壳。通过机械腐蚀(例如,机械加工),化学腐蚀(例如,蚀刻或研磨)或两者的减成处理步骤去除α壳。以上讨论了这些步骤。在图7a、7b和7c中示出这种减成处理步骤去除α壳中的功能。
在抛光和蚀刻的微截面中可以看到α壳,其作为光学冶金显微镜中的白色层或者在后向散射模式下的扫描电子显微镜(sem)中的暗层。(sem是一种显微镜,通过用聚焦的电子束扫描产生样品的图像。)α壳也可以通过垂直于表面的截面的显微硬度压痕来检测。
钛盘使用电子束熔化(ebm)进行增材制造。然后将这些圆盘进行热等静压(hip)。其中一个盘未经过进一步处理(图7a),另一个盘使用常规工艺进行喷砂(图7b),并且根据上述工艺步骤,另一个盘受到机械和化学侵蚀。获得了光盘的光学显微照片,并示于图7a、7b和7c。
图7a是离开ebm机器并经受hip的钛盘的金相截面的光学显微照片。该盘表现出较轻的蚀刻相(etchingphase)(两个箭头之间的区域),与α壳的存在一致,深约0.09mm。图7b是离开ebm机器并且经受hip和常规喷射工艺的钛盘的金相截面的光学显微照片。该盘表现出较轻的蚀刻相(两个箭头之间的区域),与α壳的存在一致,深约0.015mm。图7c是根据上述工艺步骤,离开ebm机器并且经受hip和机械及化学侵蚀的钛盘的金相截面的光学显微照片。该盘没有表现出任何较轻的蚀刻相,表明没有任何α壳。
机械侵蚀、化学侵蚀以及机械和化学侵蚀的组合基本上从钛植入物的侵蚀表面去除α壳(如果存在的话)。据信这种侵蚀组合完全去除了α壳。因此,在某些方面,植入物的骨接触和自由表面优选基本上不含或完全不含α壳。
更一般地,机械侵蚀,化学侵蚀以及机械和化学侵蚀的组合可以从植入物表面去除其他(除了α情况下)不需要的污染物(或碎片)。图8显示了机械腐蚀以及机械和化学侵蚀的组合如何从增材构建中去除未烧结或部分烧结的粉末。图8显示了放大250倍(顶行)和放大1500倍(底行)的烧结钛合金表面的sem图像。左列图像显示了机器的放大表面(增材构建),没有任何后续侵蚀处理。中列图像显示增材构建后机械侵蚀后的放大表面。右列图像显示了增材构建后依次机械侵蚀和化学侵蚀后的放大表面。
除了赋予微米级结构特征之外,机械侵蚀还可以从植入物表面移除或减少碎片。除了将纳米级结构特征赋予植入物表面之外,酸侵蚀还可以从植入物表面除去或减少碎片。碎片可能包括外部碎片,如灰尘或其他处理工件。外部碎片还可以包括来自机械侵蚀/喷射步骤的介质的颗粒或组分,这些颗粒可能已经嵌入植入物表面。碎片还可以包括固有碎片,例如增材构建过程的伪影,例如在增材构建过程中未完全熔化或完全烧结的粉末、颗粒、微粒等。
例如,图8显示了由增材构建产生的钛表面的sem图像,左列图像(在两个不同的放大率下)说明某些颗粒未从增材构建中完全整合。因此,存在植入物上的这种颗粒在植入后可能脱落的风险,并且在局部或全身对患者产生负面影响。因此,侵蚀过程可用于从表面除去未烧结/未熔化或未完全烧结或熔化的颗粒,从而降低颗粒移位的风险。
如图8中列所示,机械侵蚀可以显著减少来自增材构建结构表面的未整合或部分整合的颗粒的量。并且如图8右列所示,附加化学侵蚀(在机械侵蚀之后)可以进一步减少来自增材构建结构的表面的未整合或部分整合的颗粒的量。
在一个或多个侵蚀工艺步骤之后,可以从植入物移除任何保护性掩蔽,并且可以清洁侵蚀和未侵蚀的表面。表面也可以钝化,例如,使用包含硝酸的水溶液。可以清洁表面并用水冲洗。
在优选的方面,没有材料添加、浸渍、嵌入、涂覆、喷涂或以其他方式放置在骨接触表面上。在优选的方面,没有材料添加、浸渍、嵌入、涂覆、喷涂或以其他方式放置在自由表面上。(事实上,侵蚀过程可用于去除不想要的污染物。)
通过增材制造、然后机械侵蚀、化学侵蚀或机械和化学侵蚀产生的骨接触表面和自由表面包括骨诱导粗糙度,其包括宏观级,微米级和纳米级结构的组合。增材制造工艺优选主要产生宏观级特征,其特别工程化到在制造期间产生的骨接触表面中,并且由增材制造工艺产生的自由表面基本上是光滑的并且没有这些宏观级结构。然而,在某些方面,当一个或多个自由表面在植入时与骨移植材料接触时,特别是但不是必须的,该表面可以包括宏观级特征。机械和化学侵蚀分别将微米级和纳米级结构添加到加工的骨接触表面和加工的自由表面。在优选的方面,机械侵蚀主要将微米级结构赋予加工表面,并且机械侵蚀之后的化学侵蚀主要赋予纳米级结构。因此,由增材制造和机械和/或化学侵蚀产生的骨接触表面和自由表面包括宏观级粗糙度,微米级粗糙度和纳米级粗糙度,其可以至少部分地重叠,或者可以是基本上重叠,或者可以完全重叠。总的来说,这三种结构特征尺度显著增强了干细胞分化、前成骨细胞成熟、成骨细胞发育、骨诱导和骨发生中的一种或多种。
宏观级的结构特征包括相对大的尺寸,例如,以毫米(mm)为单位测量的尺寸,例如1mm或更大。微米级结构特征包括以微米(μm)为单位测量的尺寸,例如1微米或更大,但小于1毫米。纳米级结构特征包括以纳米(nm)测量的尺寸,例如1纳米或更大,但小于1微米。宏观结构特征、微米结构特征和/或纳米结构特征的图案可以规则组织和/或重复图案,并且可选地可以彼此重叠,或者这些特征可以是不规则或随机图案,或重复不规则图案(例如,一个不规则图案的网格)。
可以调节本文所述的增材制造和机械和化学侵蚀步骤,以产生适合于特定植入物应用的深度、高度、长度、宽度、直径、特征尺寸和其他几何形状的混合物。还可以调整特征图案的取向。这种柔性是合乎需要的,特别是因为骨诱导增强表面的最终图案可以与植入时可能施加在植入物上的生物力和植入方向相反。
宏观级结构特征,微米级结构特征和纳米级结构特征不同于齿、刺、脊和其他骨抓握超宏观级结构,这些结构通常存在于骨接触植入物的表面上。这种齿、刺和脊旨在挖入或耙入骨。相反,包括如本文所述或示例的宏观结构的骨接触表面,其通过增材制造而产生,不会像齿,刺,脊和其他骨抓握超宏观结构那样损坏或挖入骨中。相反,本发明的骨接触表面支持骨表面的摩擦型抓握,并且一旦植入体内就抑制植入物的移动。
在增材制造之后由机械侵蚀和化学侵蚀产生的在骨接触表面上和自由表面上的骨诱导微米级和纳米级结构,增强并/或促进骨诱导。增材制造随后是机械侵蚀、化学侵蚀、或机械和化学侵蚀两者,产生或赋予经过这种侵蚀处理的骨接触和自由表面的骨诱导粗糙度。骨诱导粗糙度包括微米级结构和纳米级结构,其结合以促使、增强或促进骨诱导的速率和/或量。因为这种骨诱导粗糙度,新骨生长起源于骨科植入物的这种加工表面并在其上生长出。骨科植入物的骨接触表面上的宏观级结构抓握骨骼并抑制植入物在体内的移动,这随即进一步促使、增强或促进骨诱导的速率和/或量,因为当新骨生长进行时,移动抑制抑制初始骨组织的破裂(例如,非预期的移动可以通过破坏新形成的骨基质和组织来破坏骨生长过程)。
由增材制造随后机械侵蚀、化学侵蚀、或机械和化学侵蚀来赋予骨诱导粗糙度而带来骨接触表面和自由表面的骨诱导增强和/或促进,显著高于未经受机械和化学侵蚀之一或两者的表面所获得的骨诱导或骨诱导的增强和/或促进水平。未经受机械和化学侵蚀之一或两者的骨接触和/或自由表面可以没有包括微米级结构和纳米级结构的骨诱导粗糙度。在某些方面,相对于与骨接触的未处理的骨接触表面(未经机械和/或化学侵蚀处理)的骨诱导、骨发生、间充质干细胞的碱性磷酸酶表达、前成骨细胞的osterix表达、和成骨细胞的骨钙蛋白表达,根据该方法产生的一个或多个骨接触表面(增材制造随后是机械和/或化学侵蚀),当与骨接触时,其显著增强骨诱导、骨发生、间充质干细胞的碱性磷酸酶表达、前成骨细胞的osterix表达、和成骨细胞的骨钙蛋白表达中的一种或多种。
由增材制造随后机械侵蚀、化学侵蚀、或机械和化学侵蚀来赋予骨诱导粗糙度产生的骨接触表面和自由表面的骨诱导增强和/或促进,显著高于对比表面所获得的骨诱导或骨诱导的增强和/或促进水平,该对比表面包括大块基材(即,不是增材制造的基材)的机械侵蚀、化学侵蚀或者机械和化学侵蚀产生的的微米级结构和纳米级结构的骨诱导粗糙度。因此,当增材制造植入物并且加工/侵蚀其表面时,并且当由大块基材制造对比植入物并且加工/侵蚀其表面时,来自加工的增材制造的植入物的骨诱导可以显著强于来自加工的大块基材的骨诱导。
据信,骨科植入物表面是光滑的,或包括未加工/侵蚀的齿、脊、凹槽和超宏观结构,或包括其上已经冷喷涂、热喷涂或粘合剂附着的颗粒、纤维或粉末,或者其他未经机械侵蚀、化学侵蚀、或机械和化学侵蚀两者,以赋予包括微米级结构和纳米级结构的骨诱导粗糙度,或者否则缺少包括微米级结构和纳米级结构的骨诱导粗糙度不显著增强骨诱导、不会骨诱导,和/或相对于根据本发明增材制造随后机械侵蚀、化学侵蚀或机械和化学侵蚀两者赋予骨诱导粗糙度所产生的骨科植入物表面的骨诱导能力较差。相关地,骨科植入物表面是光滑的,或包括未加工/侵蚀的齿、脊、凹槽和超宏观结构,或包括其上已经冷喷涂、热喷涂或粘合剂附着的颗粒、纤维或粉末,或者其他未经机械侵蚀、化学侵蚀、或机械和化学侵蚀,以赋予包括微米级结构和纳米级结构的骨诱导粗糙,或者否则缺少包括微米级结构和纳米级结构的骨诱导粗糙度不显著增强骨诱导、不会骨诱导,和/或相对于大块基材的机械侵蚀、化学侵蚀或者机械和化学侵蚀产生的骨科植入物表面的骨诱导能力较差。
在增材制造之后由机械侵蚀和化学侵蚀产生的骨接触表面和自由表面上的骨诱导微米级和纳米级结构增强并/或促进骨发生。增材制造随后是机械侵蚀、化学侵蚀、或机械和化学侵蚀两者产生或赋予经过这种侵蚀处理的骨接触和自由表面的骨诱导粗糙度。骨诱导粗糙度包括微米级结构和纳米级结构,其结合以促使、增强或促进骨发生的速率和/或量。因为这种骨诱导粗糙度,新骨生长起源于骨科植入物的这种加工表面并在其上生长出。骨科植入物的骨接触表面上的宏观结构抓握骨并抑制植入物在体内的移动,这随即进一步促进、增强或促进骨发生的速率和/或量,因为当新骨生长进行时,移动抑制抑制初始骨组织的破裂(例如,非预期的移动可以通过破坏新形成的骨基质和组织来破坏骨生长过程)。
由增材制造、随后机械侵蚀、化学侵蚀、或机械和化学侵蚀以赋予骨诱导粗糙度产生的骨接触表面和自由表面的骨发生的增强和/或促进,显著大于对比表面所获得的骨发生或骨发生的增强和/或促进水平,该对比表面包括大块基材的机械侵蚀、化学侵蚀或者机械和化学侵蚀所产生的微米级结构和纳米级结构。因此,当增材制造植入物并且加工/侵蚀其表面时,并且当由大块基材制造对比植入物并且加工/侵蚀其表面时,来自加工的增材制造的植入物的骨发生可显著强于来自加工的大块基材的骨发生。
据信,骨科植入物表面是光滑的,或包括未加工/侵蚀的齿、脊、凹槽和超宏观结构,或包括其上的已经冷喷涂、热喷涂或粘合剂附着颗粒、纤维或粉末,或者其他未经机械侵蚀、化学侵蚀,或机械和化学侵蚀以赋予包括微米级结构和纳米级结构的骨诱导粗糙度,或者否则缺少包括微米级结构和纳米级结构的骨诱导粗糙度不会显著增强骨发生,不是骨发生,和/或相对于根据本发明增材制造随后机械侵蚀、化学侵蚀或机械和化学侵蚀赋予骨诱导粗糙度所产生的骨科植入物表面的骨发生能力较差。相关地,骨科植入物表面是光滑的,或包括未加工/侵蚀的齿、脊、凹槽和超宏观结构,或包括其上已经冷喷涂、热喷涂或粘合剂附着的颗粒、纤维或粉末,或者其它未经机械侵蚀、化学侵蚀、或机械和化学侵蚀以赋予包括微米级结构和纳米级结构的骨诱导粗糙度,或者否则缺少包括微米级结构和纳米级结构的骨诱导粗糙度不显著增强骨发生、不是骨发生的,并/或相对于大块基材的机械侵蚀、化学侵蚀或者机械和化学侵蚀产生的骨科植入物表面的骨形成能力较差。
可测量骨诱导作为碱性磷酸酶(alp)表达、osterix(osx)表达和骨钙蛋白(oxn)表达中的一种或多种的水平的函数。这些标志物表明证实骨诱导的表型进展正在发生。alp代表干细胞分化成前成骨细胞的早期标志物。osterix代表第一骨特异性转录因子表达(通常认为runx2是表达为成骨细胞分化过程的一部分的第一转录因子,尽管该转录因子不是骨特异性并影响细胞内的其他生化过程)。骨钙蛋白代表成熟的成骨细胞标记物。在优选的方面,当干细胞分化为前成骨细胞,并成熟为成骨细胞,增材制造、机械侵蚀和化学侵蚀产生的骨接触表面和自由表面显著增强并/或促进alp表达、然后是osterix表达、然后是干细胞的骨钙蛋白表达。
因此,在增材制造植入物并且加工/侵蚀其表面,并且其中由大块基材制造对比植入物并且加工/侵蚀其表面的情况下,分别来自接触加工增材制造的植入物表面的间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中的一种或多种的表达,显著强于分别来自接触加工的大块基材表面的间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中的一种或多种的表达。
据信,其表面不具有包括由机械侵蚀、化学侵蚀或机械和化学侵蚀产生的微米级结构和纳米级结构的骨诱导粗糙度的骨科植入物,诱导分别来自间充质干细胞、前成骨细胞和成骨细胞的alp、osx、ocn中的一种或多种的最小表达,或者分别完全不诱导来自间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中的一种或多种的表达。因此,骨科植入物表面是光滑的,或包括未加工/侵蚀的齿、脊、凹槽和超宏观结构,或包括其上已经冷喷涂、热喷涂或粘合剂附着的颗粒、纤维或粉末,或者其它未经机械侵蚀、化学侵蚀、或机械和化学侵蚀以赋予包括微米级结构和纳米级结构的骨诱导粗糙度,或者否则缺少包括微米级结构和纳米级结构的骨诱导粗糙度不显著增强分别来自间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中的一种或多种的表达,不诱导分别来自间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中的一种或多种的表达,和/或相对于根据本发明增材制造随后机械侵蚀、化学侵蚀、或机械和化学侵蚀以赋予骨诱导粗糙度产生的骨科植入物表面,诱导分别来自间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中一种或多种表达的能力较差。相关地,骨科植入物表面是光滑的,或包括未加工/侵蚀的齿、脊、凹槽和超宏观结构,或其上包括已经冷喷涂、热喷涂或粘合剂附着颗粒、纤维或粉末,或者其它未经机械侵蚀、化学侵蚀、或机械和化学侵蚀以赋予包括微米级结构和纳米级结构的骨诱导粗糙度,或者否则缺少包括微米级结构和纳米级结构的骨诱导粗糙度不显著增强分别来自间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中的一种或多种的表达,不诱导分别来自间充质干细胞、前成骨细胞和成骨细胞alp、osx和ocn中的一种或多种的表达,和/或相对于大块基材的机械侵蚀、化学侵蚀或机械和化学侵蚀的产生的骨科植入物表面,诱导分别来自间充质干细胞、前成骨细胞和成骨细胞的alp、osx和ocn中的一种或多种表达的能力较差。
包括以下示例以更清楚地说明本发明的总体性质。本发明的这些示例是示例性而非限制性的。
示例1
增材制造的钛表面的sem图像
使用激光熔化/烧结(例如,直接金属激光烧结(dmls))或电子束熔化(ebm)来增材制造钛盘。如表1所示,然后对这些盘进行应力消除或热等静压、并进行机械和化学侵蚀。获得了盘的扫描电子显微镜(sem)图像,并示于图1a、1b、1c、1d和1e中。(sem是电子显微镜,其中由反射的电子束扫描样品的表面形成图像。)
表面20a是dmls产生的表面,其经受应力消除但没有侵蚀。表面20b是ebm生产的表面,其经受热等静压但没有侵蚀。表面20c是dmls生产的表面,其经受热等静压但没有侵蚀。表面22a是dmls产生的表面,其经受应力消除和机械以及化学侵蚀。表面22b是ebm生产的表面,其经受热等静压和机械以及化学侵蚀。表面22c是dmls生产的表面,其经受热等静压和机械以及化学侵蚀。
表面16e是激光产生的表面,其经受热等静压和使用碳酸氢钠喷射的机械侵蚀。表面16f是激光产生的表面,其经受热等静压和使用钛喷射的机械侵蚀。表面29d是激光产生的表面,具有内置的宏观纹理,经受热等静压和机械以及化学侵蚀。
图1a、1b、1c、1d和1e示出了如何通过增材制造的表面的连续机械和化学侵蚀将微米级和纳米级结构赋予钛表面。
表1增材制造的表面
例2
碱性磷酸酶、osterix和骨钙蛋白作为成骨细胞发育和骨诱导的公认标志物
成骨分化是一个连续过程,其特征在于几种蛋白质的上升和下降。本文分析的蛋白质表征早期(alp)、中期(osx)和晚期(ocn)成骨细胞标志物。成骨细胞分化的过程开始于间充质干细胞发展成能够经历骨生成或软骨形成并表达alp的中间祖细胞。致力于成骨谱系的这些中间祖细胞(现称为前成骨细胞)增加alp的表达。随着前成骨细胞发展为成骨细胞,osx的表达增加,并且最终,一旦前成骨细胞变成成骨细胞,ocn的表达增加。
成骨细胞最终将进一步成熟并开始转变为骨细胞或经历细胞凋亡。成熟的成骨细胞状态的特征在于alp的降低,并且一旦成骨细胞分化为骨细胞,osx和ocn的表达也都降低(baekw-yetal.,j.boneminer.res.24:1055–65(2009);zhangc.,j.orthopaedicsurg.andres.5:1(2010);和tuqetal.,tissueeng’g1:2431–40(2007))。体内评估显示在骨折愈合期间存在alp和ocn。在这些评估中,alp和ocn产量在骨折后8周的愈合骨折中最高(leungksetal.,bone&jointjournal75:288–92(1993);和herrmannm.etal.,clin.chemistry48:2263–66(2002))。此外,alp和ocn已用于体外评估合成材料促进体内骨形成的潜能。已经进一步证明体外增加的alp和ocn与体内合成移植物成功相关(bordenm.etal.,j.biomed.mater.res.61:421–29(2002);bordenm.etal.,biomaterials.23:551–59(2002);和bordenm.etal.,j.bonejointsurg.br.86:1200–08(2004))。使用钛网的类似评估已经使体外alp和骨桥蛋白(分化早于ocn的分泌的基质蛋白)与体内成功相关(dattan.,biomaterials.26:971–77(2005);bancroftg.n.,proc.natl.acad.sci.u.s.a.99:12600–05(2002);和sikavitsasvietal.,j.biomed.mater.67a:944–51(2003))。
示例3
骨诱导表面上生长的mg63细胞的成骨标志物的评估
mg63细胞是前成骨细胞系。将mg63细胞以10,000个细胞/cm2接种到圆盘上,在含有10%fbs、1%青霉素/链霉素、50μg/ml抗坏血酸和10mmβ-甘油磷酸的emem中培养。培养7天后,用具有蛋白酶抑制剂的皮尔斯哺乳动物蛋白质提取试剂(piercemammalianproteinextractionreagent)裂解细胞,并评估裂解物中碱性磷酸酶(alp)、骨桥蛋白(opn)和runx2的表达。碱性磷酸酶(alp),一种早期成骨细胞分化标志物,通过酶测定法测量,该测定法依赖于在alp存在下将对硝基苯基磷酸酯转化为对硝基苯酚,然后测量对硝基苯酚的吸光度。将alp标准化为样品中存在的dna量。用标准picogreen测定法测量dna。骨桥蛋白(opn),一种由成骨细胞在整个分化过程中表达的蛋白质,通过定量的蛋白质印迹法(westernblotting)测量并归一化为微管蛋白。结果如图2a、2b和2c所示。图2a-2c的表面键(surfacekey)如表1所示。
图2a中显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的mg63细胞表达的碱性磷酸酶的水平。图2b显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的mg63细胞表达的骨桥蛋白水平。图2c显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的mg63细胞表达的runx2的水平。表面20a、20b和20c以及22a、22b和22c是与图1a、1b和1c所述的相同的表面。
如图所示,在alp、runx2和opn表达方面,增材制造的(dmls和ebm)和加工的(机械和化学侵蚀)表面明显优于增材制造但未加工的表面。
示例4
骨诱导表面上生长的saos-2细胞的成骨标志物的评估
saos-2细胞获自atcc(manassas,va);picogreenassays,mccoy’s5a培养基和青霉素/链霉素均lifetechnologies(carlsbad,ca);胎牛血清获自atlantabiologicals(atlanta,ga);碱性磷酸酶测定法获自bio-rad(hercules,ca);osterixelisa获自lifespanbiosciences(seattle,wa);骨钙蛋白elsia获自r&dsystems(minneapolis,mn)。
将saos-2细胞维持在由补充有15%fbs和1%青霉素/链霉素的mccoy's5a组成的基础生长培养基中。一旦在培养物中达到适当数量的细胞,将saos-2细胞以10,000细胞/cm2的密度接种在钛盘表面(表1)上。在每种表面类型上培养saos-2细胞7天,并且每两天更换培养基。在第7天,将培养基冷冻用于进一步分析,并将saos-2细胞在ripa缓冲液(150mm氯化钠、1%v/v
按照制造商的方案,使用picogreenassay定量细胞dna。根据制造商的方案,通过alp催化的对硝基苯基磷酸酯转化为对硝基苯酚来测定碱性磷酸酶(alp)。使用elisa测定并遵循制造商的方案,定量osterix(osx)和骨钙蛋白(ocn)。还测定了runx2和opn,但未显示任何实质趋势或显著数据(数据未显示);这些都是非常早期的成骨细胞标志物。结果如图3a、3b、3c和3d所示。图3a-3d的表面键如表1所示。
图3a显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的saos-2细胞表达的碱性磷酸酶的水平。图3b显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的saos-2细胞表达的osterix水平。图3c显示了在增材制造的表面20a、20b和20c以及22a、22b和22c上培养的saos-2细胞表达的骨钙蛋白水平。图3d显示分别在增材制造的表面16e、16f和29d上培养的saos-2细胞表达的碱性磷酸酶(最左列)、osterix(中列)和骨钙蛋白(最右列)的水平。表面20a、20b、20c、22a、22b、22c、16e、16f和29d是与图1a、1b、1c、1d和1e中所述的相同的表面。
如图3a、3b和3c所示,所有增材制造并加工(机械和化学侵蚀)的表面相对于没有加工(机械和化学侵蚀)的增材制造的表面,表现出提高的alp、osx和ocn标志物的表达。如alp、osx和ocn标志物所证明的,相对于没有侵蚀的增材制造表面,增材制造的表面的处理显著地增强了成骨细胞分化。如图3d所示,相对于仅用机械而非化学侵蚀增材制造并加工的表面16e和16f,增材制造和并加工的(机械和化学侵蚀)表面29d表现出提高的alp、osx和ocn标记物的表达。
尽管以上参考某些特定实施例和示例进行了说明和描述,但是本发明并不旨在限于所示的细节。而是,在不脱离本发明的精神的情况下,可以在权利要求的等同物的范围内对细节进行各种修改。例如,明确地旨在本文件中广泛叙述的所有范围,包括其中落入更宽范围内的所有较窄范围。除非特别说明,否则还明确地指出,制造上述各种装置的过程的步骤不限于任何特定顺序。
- 还没有人留言评论。精彩留言会获得点赞!