免疫原性缀合物及其用途的制作方法
背景技术:
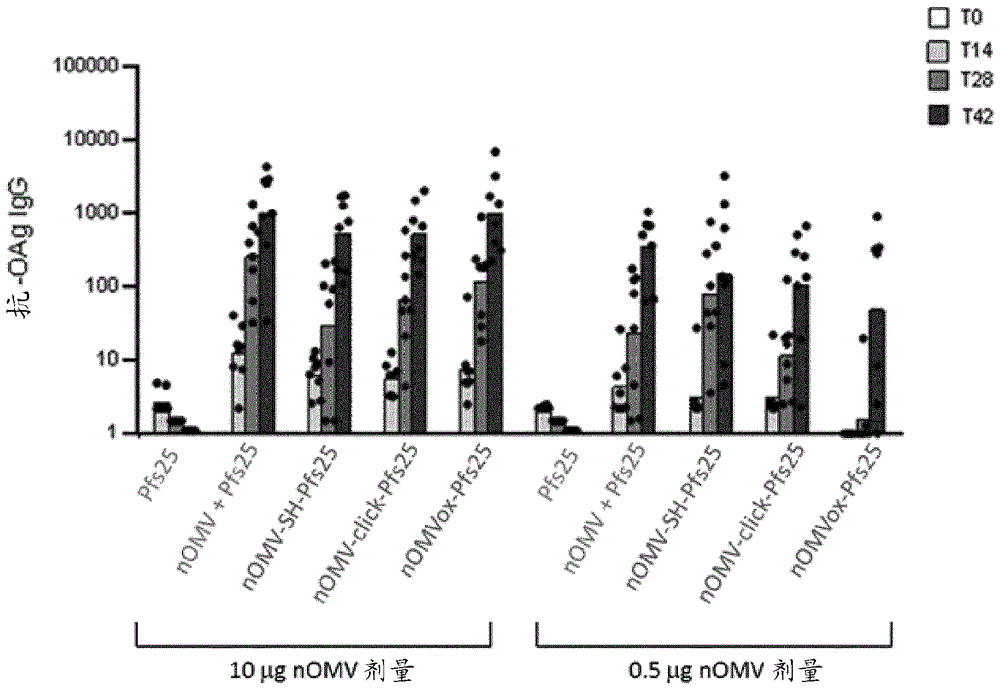
:抗原与载体的缀合是用于改善免疫原性的确立的程序,尤其是对于糖。例如,细菌荚膜糖是天然t-细胞非依赖性抗原,其产生缺乏几种重要特性的免疫应答。与载体部分的缀合将这些糖转化为t-细胞依赖性抗原,其然后可以产生免疫记忆效应,并且还在幼儿中引发有效的免疫应答。此类缀合物中的蛋白载体的一种已知来源是来自脑膜炎奈瑟氏球菌血清群b的外膜蛋白复合物(ompc)(例如参见ep-0467714,merck&co.),其已被包括在批准的流感嗜血杆菌b缀合疫苗中作为载体。ompc也已被用作蛋白缀合物中的载体。根据现有技术,ompc经由蛋白残基与抗原缀合,所述蛋白残基可以被活化或化学修饰,以便更好地与选择的抗原进行缀合。wu等人(pnasusa2006;103(48):18243–18248)报道了pfs25h(一种人疟疾传播阻断蛋白)与ompc的缀合产生pfs25h-ompc缀合物疫苗,其在小鼠中产生抗-pfs25helisa反应性方面的效力是类似剂量的单独的pfs25h的>1,000倍。ompc与pfs25h蛋白的缀合可以通过使马来酰亚胺活化的pfs25h与ompc内的硫醇化外膜蛋白反应来实现(对于一般参考文献,参见例如wo2006/124712),如方案1中所示。即使该过程可以代表有效的合成途径,所考虑的囊泡可能难以以纯的形式获得,并且它们通常经由费力的过程收集。而且,与选择的抗原的连接需要合适的囊泡蛋白的存在和活化,因此鉴于在囊泡分离期间使用去污剂或化学品(其可改变表面蛋白组成),提出了额外的挑战。因此,仍然需要提供可用作免疫原性化合物的新缀合物,其克服了现有技术的问题,并且可通过简单且方便的程序实现。本申请人现已发现,当nomv经由糖部分与选择的抗原连接时,因此获得的缀合物被赋予显著的免疫原性,并且可通过可靠且方便的方法获得,如下文更详细描述。发明概述在第一个方面,本发明涉及免疫原性nomv-抗原缀合物,其包含通过无去污剂方法获得的天然、外膜囊泡(nomv),其至少具有与至少外来选择的抗原连接的天然表面糖部分。在一个进一步方面,本发明涉及用于制备所述缀合物的方法,其包括以下步骤:i)活化至少一个nomv糖部分,其通常与nomv表面键合,和ii)将因此获得的活化糖与至少一个选择的抗原连接。根据一个优选实施方案,nomv-表面键合糖通过氧化活化,且然后与选择的抗原连接,更优选在还原胺化条件下。在一个额外方面,本发明还是指上述缀合物,其用作药物,特别是作为免疫原性化合物,或用于制备免疫原性组合物或疫苗。仍在一个进一步方面,本发明涉及免疫原性组合物或疫苗,其包含上述缀合物和至少一种药学上可接受的载体或佐剂;以及涉及用于产生脊椎动物中的免疫应答的方法,其包括施用所述组合物或疫苗。在一个进一步方面,本发明还是指nomv用于制备免疫原性缀合物的用途。附图简述图1显示索氏志贺氏菌(s.sonnei)的-oag结构。图2显示相比于与所述nomv物理混合或与更传统载体crm197缀合的fvi(用alhydrogel配制)相比,用与鼠伤寒沙门氏菌(s.typhimurium)nomv缀合的片段化vi(fvi)糖免疫之后的抗-vi(图2a)和抗-oag(图2b)igg滴度。在第0天和第28天用1μgvi/剂量皮下免疫5周龄的cd1雌性小鼠(每组8只)。在第0、14、28和42天测量滴度。图3显示用与各种载体缀合的ctf1232多肽(用alhydrogel配制)免疫之后的抗-ctf1232igg滴度。在研究第0、21和38天,将5周龄的cd1雌性小鼠(每组8只)鼻内接种30μl疫苗(每个鼻孔15μl)。在第0、14、35和52天收集血清。剂量为0.5μgctf1232。图4显示与单独的pfs25或与所述nomv物理混合的pfs25相比,用与鼠伤寒沙门氏菌1418δtolrnomv缀合的pfs25多肽免疫之后的抗-pfs25igg滴度。在第0天和第28天用0.1μgpfs25/剂量(图4a,用alhydrogel)或1μgpfs25/剂量(图4b,无alhydrogel)皮下免疫5周龄的cd1雌性小鼠(每组8只)。在第0、14、28和42天测量滴度。图4c显示使用2和0.1μgpfs25/剂量(分别对应于10和0.5μgnomv/剂量)(用alhydrogel配制)的抗-oagigg滴度。再次,在第0天和第28天皮下免疫5周龄的cd1雌性小鼠(每组8只)。图5显示在用单独的ro6c或与鼠伤寒沙门氏菌1418δtolrnomv囊泡缀合的ro6c免疫之后的抗-ro6cigg滴度(图5a)和抗-oagigg滴度(图5b)。通过从第一缀合批次再循环未缀合的ro6c来制备再循环的缀合物。在第0天和第28天皮下免疫5周龄的cd1雌性小鼠(每组8只),并且使用1、4和20μgro6c的剂量。对于缀合物,nomv的相应剂量分别为13μg、52μg和258μg(对于再循环的缀合物,4μgro6c和32μgnomv)。在第0、14、28和42天测量igg滴度。图6a:根据本发明的实施方案,通过在有或没有猝灭反应的情况下缀合鼠伤寒沙门氏菌nomv与pfs25抗原产生的本发明的nomv缀合物在小鼠中诱导的抗-pfs25igg应答(在第0天和第28天注射200μl/剂量sc,并且在第0、14、27和42天放血)。图6b:根据本发明的实施方案,通过在有或没有猝灭反应的情况下缀合鼠伤寒沙门氏菌nomv与pfs25抗原产生的本发明的nomv缀合物在小鼠中诱导的抗-oag应答(在第0天和第28天sc注射200μl/剂量,并且在第0、14、27和42天放血)。发明详述为了便于理解本发明,下面定义许多术语和短语。考虑本领域公认的以下术语和短语(包括过去、现在等时态)的同义词或替代词,即使没有具体描述。如在本公开和权利要求中所用,单数形式“一个/种(a)”、“一个/种(an)”和“该(the)”包括复数形式,除非上下文另有明确规定;即,“一个/种(a)”意指“一个/种或多个/种”,除非另有说明。术语“约”或“近似”意指大致、周围或其区域内。术语“约”或“近似”进一步意指如本领域普通技术人员所确定的特定值的可接受的上下文误差范围内,其部分取决于如何测量或确定所述值,即,测量系统或特定目的(例如饲喂制剂内的营养素的量)所需的精度的限制。当术语“约”或“近似”结合数值范围使用时,它通过延伸所示数值的上限和下限而修改范围。例如,“在约0.2和5.0mg/ml之间”意味着数值范围的边界延伸低于0.2且高于5.0,使得所讨论的特定值实现与该范围内相同的功能结果。例如,“约”和“近似”可以意指根据本领域中的实践在1个或大于1个标准偏差内。或者,“约”和“近似”可以意指给定值的最多达20%、优选最多达10%、更优选最多达5%和更优选最多达1%的范围。如在短语诸如“a和/或b”中所使用的术语“和/或”旨在包括"a和b"、"a或b"、"a"和"b"。同样地,如短语诸如“a、b和/或c”中使用的术语“和/或”旨在涵盖以下实施方案中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);和c(单独)。除非另有说明,否则所有名称"a%-b%"、"a-b%"、"a%至b%"、"a至b%"、"a%-b"、"a%至b"均给予它们的普通和习惯意义。在一些实施方案中,这些名称是同义词。术语“实质上”或“实质性”意味着所描述或请求保护的条件在所有重要方面中起所描述的标准的作用。因此,“实质上不含”意指涵盖在所有重要方面作为自由条件起作用的条件,即使数值表明存在一些杂质或物质。“实质性”通常意指大于90%、优选大于95%、最优选大于99%的值。在说明书和权利要求书中使用特定值的情况下,除非另有说明,否则术语“实质上”意指对于特定值具有可接受的误差范围。“有效量”意指足以引起参考效果或结果的量。“有效量”可以使用与所述目的相关的已知技术凭经验且以常规方式确定。如本文所用,“异源”意味着两个或更多个参考分子或结构衍生自不同生物体。例如,异源抗原是衍生自与其附着的nomv囊泡不同的生物体的抗原。如本文所用的“同源”意味着两个或更多个参考分子或结构衍生自相同生物体。如本文所用,“外来”意指两个或更多个参考分子或结构彼此不天然相关。例如,本文中旨在对本文的nomv表面糖“外来”的选择的抗原意味着抗原不是天然地或固有地与表面糖缀合,且因此也不与nomv分子天然缀合,即使抗原和糖(或nomv分子)可以源自同一生物体。以这种方式,外来抗原不一定是异源抗原,但异源抗原是外来抗原。“序列同一性”可以通过如mpsrch程序(oxfordmolecular)中执行的smith-waterman同源性检索算法使用仿射缺口检索(参数为缺口开放罚分=12和缺口延伸罚分=1)测定,但优选通过needleman-wunsch全局比对算法(参见例如,rubin(2000)pediatric.clin.northam.47:269-285)使用默认参数(例如,缺口开放罚分=10.0和缺口延伸罚分=0.5,使用eblosum62评分矩阵)测定。在emboss软件包中的needle工具方便地进行该算法。当应用是指与具体seqid的序列同一性,旨在经该seqid的全长来计算同一性。术语“w/w%”表示给定组分相对于不同组分或组合物的全部含量的重量百分比,如所示。类似地,术语“%v/v”表示给定组分相对于不同组分或组合物的全部含量的体积百分比,如所示。术语“-oag”(o-抗原)在本发明中用于表明在所考虑的nomv的表面上存在于脂多糖(lps)或脂寡糖(los)中的抗原功能,其可用于根据本发明与适当抗原(通常表示为ag)缀合。更详细地,lps通常由三个不同部分形成,所述被称为:脂质a(负责lps的毒性),核心寡糖和-oag链,重复聚糖聚合物和细菌血清学特异性的主要贡献者。术语“直链或支链c1-cx烷基或烯基”在其含义中包括具有1至x个碳原子的二价饱和或不饱和的直链或支链烷基或烯基。例如,术语二价c1-c10烷基或烯基在其含义中包括具有1至10个碳原子的二价饱和或不饱和的烷基或烯基,诸如甲基、乙基、乙烯基、烯丙基等。如本文所用,术语“糖(或糖)部分”在其含义中包括单糖,以及多糖单元。应理解,糖部分可以以开放和封闭(环)形式存在,并且尽管在本文的结构式中显示封闭形式,但本发明也涵盖开放形式。类似地,应理解,糖部分可以以吡喃糖和呋喃糖形式存在,并且尽管在本文的结构式中显示吡喃糖形式,但也涵盖呋喃糖形式。还涵盖糖部分的不同异头形式。术语“寡糖”在其含义中包括具有3至10个单糖单元的多糖。除非另有提供,术语“多肽”是指能够充当所选抗原的任何长度的多肽。形成本发明的多肽的氨基酸聚合物可以是直链或支链的,其可以包含修饰的氨基酸,并且其可以被非氨基酸中断。该术语也涵盖天然或通过干预修饰的氨基酸聚合物;所述干预例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰,诸如与标记组分缀合。该定义还包括,例如,含有氨基酸的一个或多个类似物(包括例如,非天然氨基酸等)以及本领域已知的其他修饰的多肽。多肽可以作为单链或缔合链存在。“平均分子量”旨在表示通过普通算术平均值获得的平均分子量或单个组分(例如,在多肽衍生物的情况下,氨基酸)的分子量的平均值。术语“荚膜多糖/糖”(cps)表示可以在位于细菌的细胞包膜外的层中发现、因此是细菌细胞自身外包膜的一部分的那些糖。cps在各种各样的细菌的最外表面上表达,且在一些情况下甚至在真菌中表达。除非另有提供,否则术语“缀合”表示受试实体(特别是指nomv和选择的抗原部分)的连接或链接。“免疫有效量”意指以单一剂量或作为一系列剂量的部分向个体施用该量对于治疗或预防是有效的。该量可以取决于待治疗个体的健康和身体状况、待治疗个体的年龄、分类组(例如非人灵长类动物、灵长类动物等)、个体的免疫系统合成抗体的能力、期望的保护程度、疫苗制剂、治疗医生对医学情况的评估和其他相关因素而不同。预期所述量将落入可通过常规试验确定的相对宽范围内。术语“nomv”在本文中表示从培养基分离或从细胞剪切的囊泡,并且它们是未暴露于去污剂或变性剂的完整膜囊泡,即不是去污剂提取的。本发明的nomv以其天然构象和天然膜环境中的正确取向呈现外膜蛋白(omp)和脂多糖(lps),并且通常缺乏细胞质组分。相反,术语“omv”或“domv”涵盖通常通过去污剂提取方法破坏革兰氏阴性细菌的外膜以从其形成囊泡而获得的各种蛋白脂质体囊泡。可以在这样的定义中考虑外膜蛋白复合物(例如来自脑膜炎奈瑟氏球菌的ompc),因为具有与domv类似的三维结构和组成,并且经由去污剂提取程序分离(参见例如ep0467714、us4271147、us4459286和us4830852)。去污剂提取方法除去lps和磷脂,连同免疫保护性脂蛋白。此类除去改变天然囊泡结构并促进聚集。聚集可以导致在工艺开发方面的后续问题(产量、生产一致性和稳定性)。与特征在于限定的均匀大小分布(通常在20-250nm范围内,通过动态光散射dls技术测量)的nomv不同,domv具有由去污剂诱导的囊泡聚集引起的不限定的异质大小分布(通常在550-5500nm范围内,通过动态光散射dls技术测量)(对于一般参考文献,参见vaccine28,2010,4810)。作为细菌细胞裂解的结果,去污剂提取过程还引起含有omv的组合物(例如疫苗)被细胞质蛋白污染。根据现有技术方法,可以使用透射电子显微镜(tem)在杂质或污染的非omv材料(如在domv的情况下,囊泡聚集体或去污剂残留物)的大小、形状和整体外观方面分析和描述domv和nomv。对于关于domv和nomv之间差异的详细参考文献,参见例如vandewaterbeemd(2013)j.prot.res.“quantitativeproteomicsrevealsdistinctdifferencesintheproteincontentofoutermembranevesiclevaccines”;和j.klimentova等人microbiologicalresearch170(2015)1-9“methodsofisolationandpurificationoftheoutermembranevesiclesfromgram-negativebacteria”。如上所示,在第一个方面,本发明涉及缀合物,其包含与存在于非去污剂提取的天然外膜囊泡(nomv)的表面上的糖部分连接的选择的抗原。值得注意的是,根据本发明的nomv实质上不使用去污剂进行收集和分离,其不同于例如经由脱氧胆酸盐提取或使用两性离子去污剂如empigenbb(参见例如us4707543)或类似物获得的现有技术的domv。相反,必须强调的是,由于一系列原因,去污剂提取步骤在本发明中可能是不合需要的,所述原因有以下事实,去污剂会降低囊泡上存在的脂多糖(lps)/脂寡糖(los)的量,其实际上可用于与下文所述的选择的抗原缀合。更详细地,nomvs是天然存在的膜囊泡,其在细菌生长期间自发形成,且释放至培养基中。它们可以例如通过以下获得:在肉汤培养基中培细菌,将肉汤培养基中的全细胞与较小nomvs分离(例如,通过过滤或通过低速离心以仅沉淀细胞而不沉淀较小囊泡),然后从细胞耗竭的培养基收集nomvs(例如,通过过滤,通过差速沉淀或聚集,通过高速离心以沉淀囊泡)。通常可根据培养基中产生的nomvs的量来选择用于产生nomvs的菌株。本发明的nomv的特征在于在无去污剂程序后收集和分离的事实。优选地,将本发明的nomv释放至发酵液中并使用离心和随后的过滤步骤纯化(对于一般参考文献,参见例如clinvaccineimmunol.2016apr;23(4):304–314)。仍优选地,将本发明的nomv释放至发酵液中并使用以下两个连续切向流过滤(tff)步骤纯化:(i)微滤,其中将含有nomv的培养上清液与细菌分离,和(ii)超滤,其中nomv与可溶性蛋白分离(对于一般参考文献,参见例如plosone.2015;10(8):e0134478)。因此获得的nomv然后可以直接用于本发明内而无需额外的纯化/分离步骤。目前考虑的nomv具有包含20至250nm的优选的大小分布,其通过动态光散射dls技术测量。根据一些实施方案,nomvs通常从野生型细菌或从已经遗传操作的细菌制备,以增加免疫原性(例如超表达免疫原)、降低毒性、抑制荚膜糖合成、下调免疫优势抗原表达等。它们也可以从高发泡菌株(hyperblebbingstrains)制备。本发明的nomv还可以在其表面上表达外源蛋白,并且它们可以是内毒素耗尽的。优选地,待用于本发明中的nomv由遗传修饰的细菌菌株产生,所述细菌菌株被突变以增强囊泡产生,并且任选地还除去或修饰抗原(例如脂质a)和/或过表达同源抗原或来自其他生物体的抗原。所述优选的nomv也被称为膜抗原的通用模块(gmma),如例如plosone.2015;10(8):e0134478中所述。例如,通过靶向缺失参与维持膜完整性的蛋白,可以实现增强的囊泡自发生成。已经观察到,nomv的外表面实质上对应于它们来源的细菌的外表面,在膜的背景下保留膜抗原(包括例如脂多糖、脂寡糖和脂蛋白)。有利地,本发明中使用的nomv(与去污剂提取的domv不同)保持呈其天然构象和正确取向的这些外膜组分,更好地保持针对它们来源的细菌菌株的免疫原性。通常,用于本发明中的nomv可以由任何合适的细菌制备,其中优选的细菌包括,但不限于:奈瑟氏球菌(例如具体而言任何血清群(包括a、b、c、x、y或w135)的脑膜炎奈瑟氏球菌,或来自非致病性奈瑟氏球菌),志贺氏菌(诸如索氏志贺氏菌、弗氏志贺氏菌、痢疾志贺氏菌或鲍氏志贺氏菌),沙门氏菌肠血清变型(例如甲型、乙型或丙型副伤寒沙门氏菌、肠炎沙门氏菌、伤寒沙门氏菌或鼠伤寒沙门氏菌),流感嗜血杆菌(例如非典型流感嗜血杆菌),霍乱弧菌,百日咳博德特氏菌,耻垢分枝杆菌,牛分枝杆菌bcg,大肠杆菌,拟杆菌(包括卟啉单胞菌),铜绿假单胞菌,幽门螺杆菌,马尔他布鲁氏菌、空肠弯曲杆菌、伴放线放线杆菌、嗜线虫致病杆病、粘膜炎莫拉氏菌或伯氏疏螺旋体。特别优选的细菌选自以下中的至少一种:索氏志贺氏菌,弗氏志贺氏菌,沙门氏菌细菌,和脑膜炎球菌,特别是脑膜炎球菌血清群b。毒性志贺氏菌菌株具有220kb质粒,其介导毒力特性。已显示该“毒力质粒”编码志贺氏菌毒力的几个方面的基因,包括靶上皮细胞的粘附素,侵袭质粒抗原、virf、virg等。本发明使用的志贺氏菌可以具有或可以不具有毒力质粒。质粒的不存在可以在工业培养期间稳定菌株,通过除去毒力因子来使菌株减毒(由此增加制造安全性),避免存在shet-2肠毒素(由质粒上的ospd3或sen基因编码),以及避免msbb2的存在,所述msbb2是负责脂质a的酰化的msbb基因的第二个拷贝。毒力质粒的不存在也可以破坏脂多糖。然而,应当优选通过维持突变的毒力质粒,或通过包括在另外的质粒中或克隆至细菌染色体中来保留-oag的生物合成基因。就沙门氏菌细菌而言,特别优选的菌株选自:鼠伤寒沙门氏菌、肠炎沙门氏菌和甲型副伤寒沙门氏菌。脑膜炎球菌细菌nomv也是优选的。此类囊泡可以从任何脑膜炎球菌菌株制备。所述囊泡优选从血清群b菌株制备,但也优选从除了b以外的血清群诸如a、c、w135或y之一根据本领域中已知的程序来制备囊泡。所述菌株可以是任何血清型(例如,1、2a、2b、4、14、15、16等)、任何血清亚型(例如,p1.4)和任何免疫型(例如,l1;l2;l3;l3,7;l3,7,9;l10;等)。所述脑膜炎球菌可以来自任何合适的谱系,包括高侵袭性和高毒力谱系,优选以下七种高毒力谱系中的任一种:亚群i;亚群iii;亚群iv-1;et-5复合群(complex);et-37复合群;a4簇;谱系3。最优选地,从菌株nz98/254或具有p1.4pora血清亚型的另一菌株制备omv。在另一个实施方案中,用于制备可用于本发明的nomv的细菌可以是这样的突变菌株,其已经被操作,以例如增强囊泡产生,表达一种或多种期望抗原,和/或敲除或修饰不期望的基因(例如,编码毒素或编码参与生成毒性产物、诸如内毒素的酶的基因)。在该方向上,本发明的其他优选的nomv由不表达功能性tolr蛋白的沙门氏菌属细菌、特别是鼠伤寒沙门氏菌(也称为鼠伤寒沙门氏菌肠血清变型(salmonellaentericaserovartyphimurium))产生。当囊泡由大肠杆菌、志贺氏菌或沙门氏菌制备时,细菌可以表达tola、tolb、tolq、tolr和pal蛋白中的不超过4种。因此,来自天然五蛋白tol-pal系统的至少一种蛋白可以不存在,产生这样的细菌,其在培养基中生长期间,比表达所有5种tol-pal蛋白的相同细菌释放更大量的外膜囊泡至培养基中。优选地,不表达tolr,但可以表达其他四种蛋白(即δtolr菌株)。在优选实施方案中,大肠杆菌、志贺氏菌或沙门氏菌中的五种tol-pal蛋白中的至少一种例如通过缺失或失活编码该蛋白的基因除去。因此,所述细菌可以表达tola、tolb、tolq、tolr和pal蛋白中的0、1、2、3或4种。除去五种蛋白之一可足够,在该情况下,细菌仅表达这些蛋白中的4种。优选地,tolr蛋白例如通过失活起始菌株的tolr基因来除去。因此,优选的细菌可以是tola+tolb+tolq+tolr-pal+。在一些实施方案中,所述细菌表达所有五种tol-pal蛋白,但至少一种被突变以引起高发泡(hyperblebbing)。例如,tola、tolq、tolr和/或pal蛋白可以突变,使得蛋白保留其膜定位,但其与tol-pal系统的其他成员的相互作用被破坏。因此,细菌将保留tolr、tolq和tolr作为内膜中的跨膜蛋白,并且保留pal蛋白作为外膜中的周质面向的脂蛋白,但tola、tolq、tolr和/或pal蛋白中的至少一种是突变的并且不是完全功能性的。此外,还可以存在其他突变,例如,以得到oag-缺陷菌株,例如在其中-oag功能不意欲用于期望的免疫应答的那些情况下,或者在其中-oag可以负面影响针对异源抗原的免疫原性的那些情况下。在该方向上,可能的突变在大肠杆菌、志贺氏菌或沙门氏菌菌株中可能是△galu、△gale或△wbap。在一个进一步优选实施方案中,脑膜炎球菌不表达功能性mlta蛋白。脑膜炎球菌中的mlta(膜结合的裂解性糖基转移酶,也称为gna33)的敲除提供了这样的细菌,其将大量nomv自发释放入培养基,它们可以容易地从所述培养基纯化。例如,所述囊泡可以使用两阶段大小过滤方法进行纯化,所述方法包括:(i)第一过滤步骤,其中囊泡基于它们不同的大小与细菌分离,其中囊泡通入滤液;和(ii)第二过滤步骤,其中囊泡保留于保留物中。在本发明中,优选的是,-oag存在于nomv上,因为我们观察到(例如来自沙门氏菌和志贺氏菌的nomv),所述nomv的表面上-oag的存在有利于提供二价疫苗,因为-oag可以充当保护性抗原。在突变msbb、htrb、ddg和/或pagp之后,一些优选的菌株具有五酰化或四酰化的较低毒性的lps,其包括连接的-oag(参见例如rossio等人,clinvaccineimmunol.2016apr4;23(4):304-14和rossio等人,jbiolchem.2014sep5;289(36):24922-35。在奈瑟氏球菌中,所述菌株优选具有修饰的fur基因。根据该实施方案,突变型奈瑟氏球菌被工程改造以降低或关闭参与赋予lps的脂质a部分毒性的至少一种基因、具体地lpxl1基因的表达。以该方式,所得的nomv呈现相对于野生型菌株降低的毒性,因为酰化脂质a以较少酰化的形式转化。类似地,本发明的优选的突变型奈瑟氏球菌可以被工程改造以降低或关闭参与荚膜多糖合成或输出的至少一种基因、具体地synx和/或ctra基因的表达。以该方式,所得的nomv可以呈现相比于不同血清型的交叉保护,这是本领域技术人员特别理解的。在优选实施方案中,菌株可以包括例如fukusawa等人(1999),vaccine17:2951-2958中公开的敲除和/或超表达突变中的一种或多种。例如,遵循其中的指导和命名,用于下调和/或敲除的有用基因包括:(a)cps、ctra、ctrb、ctrc、ctrd、frpb、gale、htrb/msbb、lbpa、lbpb、lpxk、opa、opc、pilc、porb、siaa、siab、siac、siad、tbpa和/或tbpb;(b)ctra、ctrb、ctrc、ctrd、frpb、gale、htrb/msbb、lbpa、lbpb、lpxk、opa、opc、phop、pilc、pmre、pmrf、siaa、siab、siac、siad、tbpa和/或tbpb;(c)exbb、exbd、rmpm、ctra、ctrb、ctrd、gale、lbpa、lpbb、opa、opc、pilc、porb、siaa、siab、siac、siad、tbpa和/或tbpb;或(d)ctra、ctrb、ctrd、frpb、opa、opc、pilc、porb、siad、syna、synb、synx和/或sync。如上所提及,本缀合物通过将至少一个nomv表面糖部分(优选包含在相关的-oag中)与一个或多个外来选择的抗原(即不形成囊泡的一部分)连接而获得。就nomv糖部分而言,必须注意,其可以是天然存在于nomv的表面上的-oag官能团的一部分(例如在lps或los中),或者其可以存在于不同的nomv表面部分内,例如cps,如下文所详细描述。有利地,可以将任何合适的抗原与nomv缀合以获得本发明的nomv-抗原缀合物,优选以(多)糖或多肽的形式。在任何情况下,一种或多种选择的抗原的连接产生免疫原性缀合物,其可以产生识别所述抗原并且还识别nomv中的一种或多种组分的免疫应答,由此方便地可用于制备多价疫苗。抗原将以足够高的浓度包括在本发明的缀合物中,以当向宿主施用时引发识别该抗原的免疫应答。此外,免疫应答优选针对抗原来源的病原体、甚至更优选针对下列病原体之一是保护性的。在本发明的一个实施方案中,nomv与至少一种同源抗原(即源自nomv来源的相同生物体)缀合。在一个仍优选的实施方案中,选择的抗原是异源抗原,即源自与nomv来源的生物体不同的生物体。在任何情况下,抗原通常选自任何免疫原性多肽,即当施用于受试者时能够引发免疫应答的多肽。本发明使用的多肽将包括这样的氨基酸,其具有残基或侧链,具有适合于缀合的官能团,优选氨基或硫醇基,甚至更优选通式:-nh2或-sh的氨基或硫醇基。这些残基可以天然存在于抗原中,或者它们可以人工引入用于缀合的目的。优选的氨基酸残基包括但不限于:精氨酸、赖氨酸、天冬酰胺、谷氨酰胺、半胱氨酸和组氨酸。用于缀合的最优选的氨基酸残基是赖氨酸。事实上,根据本文详细公开的方法,其-nh2侧链可以与来自nomv糖部分的活化的氧化的-oh反应,并且通过还原胺化与因此获得的醛基反应。优选制备实质上纯或实质上分离的形式的多肽抗原(即实质上不含其他多肽)。它们可通过各种方式,例如通过化学合成(至少部分地),通过使用蛋白酶消化较长多肽,通过从rna翻译,通过从细胞培养物(例如从重组表达或从天然培养物)纯化等制备本发明的多肽。大肠杆菌宿主中的重组表达是有用的表达途径。多肽抗原可以采用各种形式(例如,天然的,融合体,糖基化的,非糖基化的,脂化的,二硫桥等)。本发明使用的多肽抗原具有至少1kda、更优选至少3.5kda、甚至更优选10至80kda的优选平均分子量。仍更优选地,平均分子量包含15至75kda。用于与根据本发明的nomv缀合的进一步优选的多肽抗原包含来自真菌、细菌、原生动物或病毒多肽的表位。优选的原生动物多肽来自疟原虫(诸如恶性疟原虫、间日疟原虫、卵形疟原虫)。特别优选的细菌多肽选自:大肠杆菌、脑膜炎奈瑟氏球菌和链球菌(诸如无乳链球菌、肺炎链球菌、酿脓链球菌)。优选的大肠杆菌多肽抗原包括ctf1232、405和3526。作为一个非限制性优选实例,根据本发明,来自志贺氏菌或沙门氏菌的nomv可以与ctf1232缀合,以生成覆盖产肠毒素大肠杆菌(etec)和志贺氏菌/沙门氏菌的二价疫苗。在一个实施方案中,考虑的脑膜炎奈瑟氏球菌多肽,当施用于哺乳动物时,能够引发抗体应答,其针对脑膜炎球菌是杀细菌的。本发明使用的优选的脑膜炎奈瑟氏球菌多肽选自以下中的至少一种:nhba、nada、nspa、nhha、app和fhbp,如下文详述。nhba抗原.nhba抗原作为基因nmb2132包括于脑膜炎球菌血清群b菌株mc58的公开基因组序列中(genbank登录号gi:7227388;本文为seqidno:2)。从那时起已经公开了来自许多菌株的nhba抗原的序列。还已经报道了nhba抗原的各种免疫原性片段。用于本发明使用的优选的nhba抗原包含以下氨基酸序列:(a)与seqidno:2具有50%或更高同一性(例如60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高同一性);和/或(b)包含seqidno:2的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自seqidno:2的表位。在施用于受试者之后,本发明的最有用的nhba抗原可以引发可以结合由氨基酸序列seqidno:2组成的脑膜炎球菌多肽的抗体。在施用于受试者之后,用于本发明使用的有利的nhba抗原可以引发杀细菌性抗脑膜炎球菌抗体。nada抗原.nada抗原作为基因nmb1994包括于脑膜炎球菌血清群b菌株mc58的公开基因组序列(参见例如tettelin等人(2000)science287:1809-1815)中(genbank登录号gi:7227256;本文为seqidno:3)。从那时起已经公开了来自许多菌株的nada抗原的序列,并且已经充分记录了该蛋白作为奈瑟氏球菌黏附素的活性。也已经报道了nada的各种免疫原性片段。用于本发明使用的优选的nada抗原包含以下氨基酸序列:(a)与seqidno:3具有50%或更高同一性(例如60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高同一性);和/或(b)包含seqidno:3的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自seqidno:3的表位。在施用于受试者之后,本发明的最优选的nada抗原可以引发可以结合由氨基酸序列seqidno:3组成的脑膜炎球菌多肽的抗体。在施用于受试者之后,用于本发明使用的有利的nada抗原可以引发杀细菌性抗脑膜炎球菌抗体。seqidno:7是一种这样的片段。nspa抗原.nspa抗原作为基因nmb0663包括于脑膜炎球菌血清群b菌株mc58的公开基因组序列(参见,例如,tettelin等人(2000)science287:1809-1815)中(genbank登录号gi:7225888;本文为seqidno:4)。从那时起已经公开了来自许多菌株的nspa抗原的序列。也已经报道了nspa的各种免疫原性片段。用于本发明使用的优选的nspa抗原包含以下氨基酸序列:(a)与seqidno:4具有50%或更高同一性(例如60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高同一性);和/或(b)包含seqidno:4的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自seqidno:4的表位。在施用于受试者之后,本发明的最优选的nspa抗原可以引发可以结合由氨基酸序列seqidno:4组成的脑膜炎球菌多肽的抗体。在施用于受试者之后,用于本发明使用的有利的nspa抗原可以引发杀细菌性抗脑膜炎球菌抗体。nhha抗原.nhha抗原作为基因nmb0992包括于脑膜炎球菌血清群b菌株mc58的公开基因组序列(参见,例如,tettelin等人(2000)science287:1809-1815)中(genbank登录号gi:7226232;本文为seqidno:5)。从例如wo00/66741和wo01/55182起已经公开了来自许多菌株的nhha抗原的序列,并且已经报道了nhha的各种免疫原性片段。其也被称为hsf。用于本发明使用的优选的nhha抗原包含以下氨基酸序列:(a)与seqidno:5具有50%或更高同一性(例如60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高同一性);和/或(b)包含seqidno:5的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自seqidno:5的表位。在施用于受试者之后,本发明的最优选的nhha抗原可以引发可以结合由氨基酸序列seqidno:5组成的脑膜炎球菌多肽的抗体。在施用于受试者之后,用于本发明使用的有利的nhha抗原可以引发杀细菌性抗脑膜炎球菌抗体。app抗原.app抗原作为基因nmb1985包括于脑膜炎球菌血清群b菌株mc58的公开基因组序列(参见,例如,tettelin等人(2000)science287:1809-1815)中(genbank登录号gi:7227246;本文为seqidno:6)。从那时起已经公开了来自许多菌株的app抗原的序列也已经报道了app的各种免疫原性片段。用于本发明使用的优选的app抗原包含以下氨基酸序列:(a)与seqidno:6具有50%或更高同一性(例如60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%或更高同一性);和/或(b)包含seqidno:6的至少‘n’个连续氨基酸的片段,其中‘n’是7或更多(例如,8、10、12、14、16、18、20、25、30、35、40、50、60、70、80、90、100、150、200、250或更多)。(b)的优选片段包含来自seqidno:6的表位。在施用于受试者之后,本发明的最优选的app抗原可以引发可以结合由氨基酸序列seqidno:6组成的脑膜炎球菌多肽的抗体。在施用于受试者之后,用于本发明使用的有利的app抗原可以引发杀细菌性抗脑膜炎球菌抗体。fhbp抗原.因子h结合蛋白作为三种变体(v1、v2和v3)存在,并且本发明可以使用这些中的任一种作为优选实施方案。v1fhbp优选包含(a)与seqidno:8具有至少k’%同一性的氨基酸序列,和/或(b)seqidno:8的片段。k’是指百分比同一性并且可以被定义为1至100的任何数目。关于氨基酸或核酸序列,通常在本申请中使用的同一性从低至40%开始,具体参考更高的百分比,即70%、75%、80%。所述片段将优选包括来自seqidno:8的至少一个表位。优选地,v1fhbp可以引发针对v1菌株、例如针对菌株mc58(可作为‘baa-335’得自atcc)杀细菌的抗体。v2fhbp优选包含(a)与seqidno:1具有至少k’%同一性的氨基酸序列,和/或(b)seqidno:1的片段。上面给出关于‘k’和片段的信息。所述片段将优选包括来自seqidno:1的至少一个表位。优选地,v2fhbp可以引发针对v2菌株、例如针对菌株m2091(atcc13091)杀细菌的抗体。v3fhbp优选包含(a)与seqidno:9具有至少k’%同一性的氨基酸序列,和/或(b)seqidno:9的片段。上面给出关于‘k’和片段的信息。所述片段将优选包括来自seqidno:9的至少一个表位。优选地,v3fhbp可以引发针对v3菌株、例如针对菌株m01-240355杀细菌的抗体。来自a群链球菌(gas)、b群链球菌(gbs)和肺炎球菌的抗原也是同样优选的。作为非限制性实例,根据本发明的一些实施方案,gas25(slo)、gas40(spyad)和gas57(spycep)抗原可以并入缀合物中。疟原虫抗原是进一步优选的。这些可以来自任何合适的物种,其中优选的物种选自:恶性疟原虫、间日疟原虫和卵形疟原虫。还有另一种优选的抗原是pfs25(seqidno:10),其为在寄生虫的合子和动合子形式的表面上表达的恶性疟原虫的有性阶段抗原。另一种优选的抗原是pfs48/45,其为阻断传播的候选疫苗。最近,含有阻断传播的抗体的三个已知表位的pfs48/45的c末端10个半胱氨酸片段(10c)已经产生为与glurp(ro)(无性血液阶段抗原富含谷氨酸的蛋白)的n末端部分的嵌合体。所得融合蛋白(ro10c)在啮齿动物中引发高水平的阻断传播的抗体(参见theisen等人.(2014)vaccine32:2623-2630)。shing等人(2015)vaccine33:1981-1986描述了含有截短的6c片段的嵌合体,其增加正确折叠的构象异构体的产量。ro6c构建体能够在大鼠中引发高滴度的阻断传播的抗体。ro6c(seqidno:11)是可以根据本发明缀合的优选抗原。另一种优选的抗原是环子孢子蛋白(csp;seqidno:12)。根据本发明,也可以缀合来自csp的较短肽。例如,根据优选的实施方案,可以使用衍生自csp的12个氨基酸(nanp)3肽(seqidno:13)。在另一个仍优选实施方案中,所述抗原是糖物质。事实上,本发明也适合于将一种或多种选择的糖抗原与nomv缀合,其中糖可以以其全长天然形式使用。作为替代方案,还可以有利地选择特定大小的级分。因此,所述糖可以从它们的天然长度片段化,并且任选地可以使用这些片段的大小级分。甚至进一步,所述糖不限于从天然来源纯化的糖,并且反而可以使用合成或半合成的糖。优选的糖抗原是细菌荚膜糖(cps)。这些包括但不限于选自以下中的至少一种的荚膜糖:流感嗜血杆菌b型;脑膜炎奈瑟氏球菌血清群a、c、w135、x和y;肺炎链球菌血清型1、2、3、4、5、6a、6b、7f、8、9n、9v、10a、11a、12f、14、15b、17f、18c、19a、19f、20、22f、23f和33f;沙门氏菌,包括伤寒沙门氏菌肠血清变型(salmonellaentericaserovartyphi)vi,全长或片段化的(表示为fvi);无乳链球菌血清型ia、ib和iii;酿脓链球菌,志贺氏菌属,a群和b群链球菌(分别为gas和gbs)。更优选的糖抗原来自脑膜炎奈瑟氏球菌血清群a和c。因此,根据本发明的一个实施方案,nomv是衍生自menb的gmma,并且选择的抗原是来自mena或menc的荚膜糖。在一个仍额外的实施方案中,本发明涉及经由多糖残基与来自mena抗原的荚膜糖缀合的来自menb的gmma,其中所述gmma还经由不同的多糖残基与menc抗原缀合,因此获得双官能化的gmma囊泡,如下面更详细描述。在任何情况下,并且如上所提及,选择的抗原可以与源自相同或甚至不同细菌菌株的nomv缀合,因此提供多价缀合物。在该方面,在本发明的一个更优选实施方案中,nomv和糖抗原源自不同的细菌菌株。其他优选的糖抗原是β-葡聚糖,其特别可用于针对白色念珠菌进行保护(对于一般性参考文献,参见sandlin等人(1995)infect.immun.,63:229-37)。其他优选的糖抗原是用于针对a群链球菌(gas)进行保护的聚-鼠李糖寡糖。天然gas糖具有被nacglcn取代的聚-鼠李糖骨架。根据本发明,可以将聚-鼠李糖的合成寡糖或具有天然gas糖的结构的寡聚物与nomv缀合。根据一个优选实施方案,本发明的nomv缀合物包含与选择的抗原直接连接的nomv表面糖部分,其中可以通过活化糖部分、随后与选择的抗原的直接反应(例如经由还原胺化)来实现直接连接,如本实施例4中所举例说明。在一个等同优选实施方案中,nomv与选择的抗原间接地(即经由接头部分)连接,如本文中更详细描述和实施例3中举例说明。本发明的缀合物是免疫原性的,如小鼠中的研究所表明,并且由本文包括的实验部分支持。有利地,除了能够诱导针对缀合抗原的免疫应答以外,本发明的缀合物还能够诱导针对nomv组分的免疫应答,因此是用于制备其多价免疫原性组合物的良好候选者。事实上,已令人惊讶地观察到,选择的抗原通过存在于nomv的表面上的糖部分的缀合不会负面影响nomv诱导其自身免疫应答的能力,与domv不同。因此,本发明的缀合物可以是有用的,例如,作为二价免疫原性试剂,适合于制备疫苗,其中nomv和缀合的异源抗原均显示良好的免疫原性。此外,有利地发现本发明的缀合物在小鼠中诱导高抗原特异性igg应答,对抗-oagigg应答没有影响,如例如本实施例5和6中所支持。本发明的缀合物提供与未缀合的抗原相比的还有几个优点,如例如实施例3至6中所述。如前所示,在一个进一步方面,本发明涉及用于制备上述缀合物的方法,其包括活化nomv-表面糖部分的第一步骤,和将因此获得的活化的囊泡与至少一种选择的抗原任选地经由二价接头连接的第二步骤。根据本方法,nomv上的至少一种糖部分与一种选择的抗原(如上所述)缀合,以形成本发明的缀合物。根据不同的实施方案,两种或更多种糖部分与两种或更多种不同的选择的抗原缀合,因此提供与两种或更多种不同抗原缀合的nomv衍生物,其特别适合于制备多价免疫原性组合物。如上所示,连接步骤通常涉及活化nomv-表面糖部分和/或选择的抗原。类似地,连接步骤可以涉及在nomv-糖部分和选择的抗原之间引入接头,如下所详述。因此,在一个实施方案中,本发明的方法包括以下步骤:(i)活化nomv表面上的糖部分;和(ii)活化部分与选择的抗原直接连接,以获得本发明的nomv缀合物。作为一个替代实施方案,本发明的方法包括以下步骤:(i)活化nomv表面上的糖部分;(ii)将活化部分与二价接头基团连接以形成囊泡-接头缀合物;和(iii)将选择的抗原与囊泡-接头缀合物连接以形成本发明的nomv缀合物。作为另一个替代实施方案,本发明的方法包括以下步骤:(i)活化nomv表面上的糖部分;(ii)将选择的抗原与二价接头基团连接以形成抗原-接头缀合物;和(iii)将步骤(i)的活化部分与抗原-接头缀合物连接以形成本发明的nomv缀合物。作为另一个替代实施方案,本发明的方法包括以下步骤:(i)活化nomv表面上的糖部分;(ii)将活化部分与二价接头基团连接以形成囊泡-接头缀合物;(iii)将选择的抗原与二价接头基团连接以形成抗原-接头缀合物;和(iv)将步骤(ii)的接头部分与步骤(iv)的抗原-接头缀合物连接以形成本发明的nomv缀合物。就nomv糖部分而言,必须注意,其可以是-oag官能团的一部分,或者是天然存在于nomv的表面上的核心区域的一部分(例如在lps或los中),或者其可以存在于不同的nomv表面部分(例如cps)内。在所有这些优选的情况下,本发明的方法允许以简单且有效的方式将所述糖部分与选择的抗原连接,因此产生赋予显著的免疫原性活性的本发明的最终nomv缀合物。有利地,-oag的存在基本上不干扰针对选择的抗原的应答。比较实施例9a-c显示当本发明的方法应用于domv时,不发生与抗原的缀合,因此防止形成期望的囊泡-抗原缀合物。取决于由其制备nomv的物种,各种糖部分(包括四糖、戊糖和己糖)可用于活化和随后的缀合。优选地,脂多糖(经由-oag部分或核心区域)或荚膜糖可用于活化和随后的缀合。优选的糖部分选自以下中的至少一种:葡萄糖、半乳糖、果糖、甘露糖、核糖、β-脱氧岩藻糖、半乳糖胺、葡糖胺、甘露糖胺、唾液酸、磺基异鼠李糖、赤藓糖、苏糖、阿拉伯糖、鼠李糖、山梨糖、核酮糖、木糖、木酮糖、来苏糖、塔格糖或酮-脱氧辛酮糖酸酯(keto-deoxyoctulosonate)。优选通过在合适的氧化剂、诸如tempo或高碘酸盐存在的情况下氧化糖的羟基以形成羰基醛官能团来活化nomv上的糖部分。后者高碘酸盐优选选自碱性高碘酸盐或偏高碘酸盐,更优选选自naio4。氧化剂优选以范围为0.5mm至20mm、优选3mm至20mm的浓度用作水溶液,其中仍更优选10至20mm和0.5至5mm或3至5mm的浓度。根据一些实施方案的其他活化反应在以下物质存在的情况下发生:氰基化试剂,诸如cdap(例如1-氰基-4-二甲基氨基吡啶鎓四氟硼酸盐),碳二亚胺,酰肼,活性酯,降冰片烷,对硝基苯甲酸,n-羟基琥珀酰亚胺,s-nhs,edc和tstu。通常,在多糖被氧化的情况下,不必氧化所有可用的糖。实际上,可能期望保留至少部分天然糖结构,特别是在这些是有用抗原的情况下。还应注意的是,由于如上所详述的特殊nomv组成和构象,多糖部分可以通过本方法方便地活化,导致形成高反应性氧化的nomv中间体物质。在一个优选实施方案中,对于给定的目标糖部分,氧化残基的比例可以范围为1%至100%,优选10-50%,或20-40%,或20-35%,而在-oag结构内的20-35%的氧化是特别优选的。在该方向上,已经发现所述范围允许有效缀合,对-oag结构完整性具有微小或实质上不存在的影响。此外,已经注意到,较高的nomv氧化程度对应于较低的-oag大小,意味着对天然-oag结构及其诱导特异性免疫应答的能力存在重大影响。氧化残基的比例可以通过高效阴离子交换色谱法与脉冲安培检测法(hpaec-pad),通过比较氧化前后的完整糖残基来确定。在该方向上,发现氧化剂和nomv的浓度连同ph可以影响氧化步骤的总体进行,如例如在本实施例2、表2c中所示。因此,在一个优选的实施方案中,氧化剂的使用量超过起始nomv,其中相对于可以进行氧化的单糖的数量3:1或2:1摩尔过量是特别优选的。氧化剂优选以范围为0.5mm至20mm、优选3mm至20mm的浓度用作水溶液,其中仍更优选10至20mm和0.5至5mm或3至5mm的浓度。nomv的浓度优选包含0.2至5mg/ml。优选地,ph包含4至8,而特别优选5至7的值。在这个程度上,可以使用缓冲剂(诸如乙酸盐/磷酸盐等)调节ph。可以方便地设置所述参数,以使优选的氧化程度包含在超过进行的糖部分的20%至35%。这允许与选择的抗原进行有效的进一步缀合,而实质上不影响糖部分结构。例如,-oag官能团中的rha残基可以被氧化,如例如使用naio4的以下方案2中所示。氧化步骤通常在室温(例如,约15℃至约40℃)下进行合适的时间,例如,包括30分钟至3小时,这取决于例如考虑的nomv的量和类型。在任何情况下,已发现没有发生实质上的nomv交联和/或聚集。这对于随后的如本文所详述与选择的抗原的缀合步骤的有效性也是最重要的。在氧化之后,nomv可以任选地进行还原步骤,例如用nabh4进行还原步骤,以通过除去形成的cho基团来稳定氧化的nomv。然后可以储存和/或进一步表征稳定的氧化的nomv。通常,在本方法的活化步骤之后,分离和纯化获得的氧化的nomv,例如通过在4℃以110000rpm超速离心30分钟,随后与选择的抗原反应。因此,在一个优选的实施方案中,所述方法包括以下步骤:(i)活化nomv表面上的糖部分,优选通过氧化;(i-bis)分离因此获得的氧化的nomv;和(ii)将步骤(ii)的氧化的nomv与至少一种选择的抗原连接,任选地经由二价接头。在一个仍优选的实施方案中,该方法在碱性亚硫酸盐、优选na2so3存在的情况下进行。这是特别有利的,因为通过用na2so3淬灭氧化反应,可以在一个步骤中进行该过程,即避免分离中间体氧化的nomv(上述步骤(i-bis)),如实施例5中所例举。这允许节省时间,因此以简单且有效的方式获得最终缀合物。在实践中,并且根据例举的实施方案,在活化步骤(i)之后,将反应用适量的碱性亚硫酸盐淬灭,并使其反应适当的时间段(通常包含5至20分钟),以中和过量的氧化剂。其后,根据步骤(ii),将选择的抗原直接添加至混合物(即不分离氧化的nomv),因此获得本发明的nomv缀合物。作为替代方案,通过氧化步骤获得的糖部分的羰基醛基团可以进一步被修饰以形成适当的官能团,其然后可以根据具体情况与选择的抗原或接头反应(在这种情况下给出囊泡-接头缀合物,其然后可以与选择的抗原偶联)。选择的抗原通常在室温下以相对于所用nomv的1:1w/w比率添加,持续适当的时间段,例如,包括2小时至24小时。当抗原用接头衍生化时,使用相对于nomv过量(优选2:1或更优选3:1w/w比率)的抗原方便地实施反应,如例如本实施例3中所示。在一个特别优选的实施方案中,本发明的方法包括以下步骤:(i)氧化糖部分;和(ii)使氧化部分与选择的抗原残基上的氨基反应。甚至更优选地,所述选择的抗原残基是多肽选择的抗原内赖氨酸残基上的氨基-nh2基团。优选地,nomv的氧化糖部分与抗原的氨基、优选游离–nh2基团的偶联通过还原胺化实现,更优选使用nabh3cn,例如根据本领域中已知的程序实现。nabh3cn的使用重量(w/w)相比于氧化的nomv为3至1/3,优选1:1。实际上,nabh3cn可以与选择的抗原一起直接添加至氧化的nomv中间产物中,如下面的方案3和4中所通常举例说明,其使用例如经由氧化的鼠李糖单元与疟疾膜蛋白pfs25或r06c分别缀合的nomv。作为一个替代实施方案,可以通过引入接头基团或通过将抗原上的官能团转化为适合与nomv上的活化糖部分或与囊泡-接头缀合物(当使用时)的接头反应的另一官能团来修饰选择的抗原。具体而言,如果选择的抗原是糖,则其可以通过随机地(r)(意味着接头在沿着糖链的多个点处被引入)或者选择性地(s)(意味着接头在糖链的还原末端(即仅在一个位置)引入)与接头反应来修饰。在一个优选实施方案中,在选择的抗原的末端位置选择性地引入接头,如例如实施例3中所示。抗原的选择性修饰优选通过在nabh3cn存在的情况下与己二酸二酰肼(adh)反应来实现,如通常方案5中所示,其使用fvi作为抗原。抗原的随机修饰优选通过活化抗原上的一个或多个羧酸基团(例如通过使用nhs/edac)和随后与adh反应来实现,如方案6中所示,其使用fvi作为抗原。这种类型的缀合反应在下面的方案7中举例说明,其使用例如经由氧化的鼠李糖单元与通过与adh反应而被修饰为包括–nh2的fvi缀合的nomv。本发明的一个替代实施方案是指包括以下步骤的方法:a)修饰选择的抗原以包括氨基基团,优选-nh2;b)通过氧化糖部分的羟基基团来活化nomv,如上所讨论,和c)将氧化的糖部分与步骤a)的修饰的抗原连接,优选通过还原胺化,如上所讨论。本发明的一个替代实施方案是指制备nomv-抗原缀合物的方法,其包括将活化的nomv的氧化糖部分与修饰的抗原连接,由此制备本发明的nomv缀合物,其中抗原被修饰为包括氨基基团,优选-nh2,并且其中通过氧化糖部分的羟基基团来活化nomv。在本发明的一个进一步实施方案中,反应步骤是还原胺化。如上所详述,本发明的nomv缀合物包含与选择的抗原直接连接的活化的nomv表面糖部分。在一个等同优选实施方案中,活化的nomv表面糖部分与选择的抗原间接地连接,例如,经由接头单元。后者通常是双官能接头,其使用一个官能团与nomv(经由活化的糖部分)反应,且使用另一个官能团与选择的抗原反应。所述接头可以是通式(i)的异双官能接头或同双官能接头:x-l-x’(i)其中:x和x’基团彼此独立地相同或不同,并且分别与活化的nomv表面糖部分和选择的抗原反应;且l是连接间隔物,优选通式(ii)的连接间隔物:-l'-l2-l'-(ii)其中:两个l’基团彼此独立地相同或不同并且选自:羰基(c=o),酯(-c(o)o-)或酰胺基基团(-c(o)nr1-),其中r1是h或,直链,或当包含至少3个碳原子时,是具有1至10个碳原子(例如,c1、c2、c3、c4、c5、c6、c7、c8、c9、c10)的支链环状c1-c10烷基基团;且l2是具有1至10个碳原子、优选具有c4碳原子的直链或支链c1-c10烷基基团,甚至更优选为直链的形式。x基团优选选自:–nh2、-nh-nh2、-o-nh2、任选地取代的磺基-n-羟基琥珀酰亚胺和n氧基琥珀酰亚胺残基。当与nomv和选择的抗原的反应涉及相同的官能团时,优选使用通式(i)的双官能接头,其中两个x基团是相同的。当nomv糖部分和选择的抗原上的官能团都是醛时,优选使用具有选自以下的x的同官能接头:–nh2、-nh-nh2或-o-nh2反应性基团。在一个仍优选的实施方案中,接头是以下通式的己二酸二酰肼(adh):然后可以通过如上所述的还原胺化使接头与nomv和/或抗原反应。尤其可用于与选择的抗原的胺基反应的优选的双官能接头选自:丙烯酰卤,优选丙烯酰氯、二琥珀酰亚胺基戊二酸酯、二琥珀酰亚胺基辛二酸酯和乙二醇双[琥珀酰亚胺基琥珀酸酯]。其他仍优选的接头选自:β-丙酰胺基、硝基苯基-乙基胺、卤代酰卤、糖苷衍生物键、6-氨基己酸。在一个仍优选的实施方案中,所述接头选自:n-羟基琥珀酰亚胺,n-氧基琥珀酰亚胺,甚至更优选选自己二酸n-羟基琥珀酰亚胺二酯(sidea)。当与nomv和抗原的反应涉及不同的官能团(诸如nomv上的胺和抗原上的硫醇)时,应理解将使用能够与两种不同官能团选择性反应的异双官能接头。在这种情况下,优选的异双官能接头选自以下中的至少一种:琥珀酰亚胺基3-(2-吡啶基二硫基)丙酸酯(spdp)、琥珀酰亚胺基6-(3-[2-吡啶基二硫基]丙酰胺基)己酸酯(lc-spdp)、磺基琥珀酰亚胺基6-(3'-(2-吡啶基二硫基)丙酰胺基)己酸酯(磺基-lc-spdp)、4-琥珀酰亚胺基氧基羰基-α-甲基-α-(2-吡啶基二硫基)甲苯(smpt)、磺基琥珀酰亚胺基-6-[α-甲基-α-(2-吡啶基二硫基)甲苯酰胺基(tolueamideo)]己酸酯(磺基-lc-smpt)、琥珀酰亚胺基4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯(smcc)、磺基琥珀酰亚胺基4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯(磺基-smcc)、间-马来酰亚胺基苯甲酰基-n-羟基琥珀酰亚胺酯(mbs)、间-马来酰亚胺基苯甲酰基-n-羟基磺基琥珀酰亚胺酯(磺基-mbs)、n-琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(siab)、磺基琥珀酰亚胺基(4-碘乙酰基)氨基苯甲酸酯(磺基-siab)、琥珀酰亚胺基4-(n-马来酰亚胺基苯基)丁酸酯(smpb)、磺基琥珀酰亚胺基4-(n-马来酰亚胺基苯基)丁酸酯(磺基-smpb)、n-γ-马来酰亚胺基丁酰基-氧基琥珀酰亚胺酯(gmbs)、n-γ-马来酰亚胺丁酰基-氧基磺基琥珀酰亚胺酯(磺基-gmbs)、琥珀酰亚胺基-6-((((4-(碘乙酰基)氨基)甲基)环己烷-1-羰基)氨基)己酸酯(siacx)、琥珀酰亚胺基6[6-(((碘乙酰基))氨基)己酰基)氨基]己酸酯(siaxx)、琥珀酰亚胺基-4-(((碘乙酰基)氨基)甲基)环己烷-1-羧酸酯(siac)和琥珀酰亚胺基6-[(碘乙酰基)氨基]己酸酯(siax)和对硝基苯基碘乙酸酯(npia)。在一个进一步实施方案中,该方法涵盖再循环未反应的选择的抗原的可能性,特别是当呈多肽的形式时。就此而言,已发现来自缀合混合物的未反应抗原可以在缀合步骤中方便地再循环,因此提高本发明的缀合物的总生产效率,并且获得仍赋予显著免疫原性的最终缀合物(参见本实施例6)。如上所详细解释,本方法允许以简单且方便的方式制备本发明的nomv缀合物,当与用于制备类似的缀合衍生物的先前方法(例如从domv开始)相比时,还需要更少的步骤。因此,本发明还涉及根据上述实施方案通过本发明的方法获得(或可获得)的nomv缀合物。具体地,本方法不一定需要昂贵的多肽抗原衍生化的步骤,以及不需要进行起始囊泡的萃取(例如使用去污剂)或变性。事实上,本发明的nomv的生产和纯化比传统的载体蛋白更便宜,并且比domv的生产更稳健和一致。本发明中使用的nomv可以使用例如两个简单的切向流过滤步骤以高产率生产,并且避免去污剂萃取程序。此外,未反应的选择的抗原可以从缀合混合物再循环用于该方法中,提高缀合物的制备效率,如实施例6中所例举。此外,本发明提供了通过适当地选择如本文更详细描述的nomv和选择的抗原制备多价疫苗(即包括多种免疫原(通常来自不同病原体)的疫苗)的简单方法。事实上,由于其多功能性,本方法可以方便且有效地应用于来自不同来源(例如沙门氏菌、志贺氏菌和脑膜炎球菌)的nomv,其成功应用于蛋白和糖抗原两者。最后,必须注意的是,本方法不仅允许制备高免疫原性缀合物,而且其实质上不改变nomv完整性和大小分布。本领域技术人员特别理解这一点,因为nomv聚集体的不存在允许本方法的更好的产率和总体一致性和稳健性。本发明还可用于制备各种官能化的nomv缀合物,允许在选择的囊泡的表面上多价呈递不同的抗原。因此,根据一个优选的实施方案,本发明涉及包含如上所述的天然外膜囊泡的缀合物,其具有与至少第一抗原连接的至少一种表面糖部分,其中根据通式(i),所述第一抗原与第二不同抗原连接:nomv----ag1-ag2(i)在这个方向上,两种选择的抗原(本文表示为ag1和ag2)可以偶联在一起以得到抗原-抗原衍生物(ag1-ag2),其随后可以经由如上所述的还原胺化程序与选择的nomv表面糖部分连接。或者,nomv表面糖可以首先经由如上所述的还原胺化程序与选择的ag1连接,以得到nomv-ag1缀合物,且随后将第二ag2与所述nomv-ag1缀合物连接,以得到上述通式(i)的缀合物。在任何情况下,优选的天然外膜囊泡是gmma囊泡,更优选来自奈瑟氏球菌menb。ag1和ag2可以选自如上所述的优选抗原,即蛋白或多糖部分。优选地,用于本文所考虑的多官能化的抗原是两种蛋白或两种多糖,或甚至是蛋白或糖。在任何情况下,抗原和nomv糖部分之间的连接可以直接实施,或者通过使用根据本文所述优选实施方案的活化剂或合适的接头实施。因此,根据一个更优选的实施方案,本发明涉及上述通式(i)的缀合物,其中ag1包含(nanp)3蛋白抗原,ag2包含pfs25蛋白抗原,更优选具有获得自鼠伤寒沙门氏菌的nomv颗粒。更详细地,所述缀合物优选通过包括以下步骤的方法制备:a)使用emcs活化pfs25抗原,以得到下面所示的活化的pfs25中间体:b)将所述活化的pfs25中间体与(nanp)3连接,以得到pfs25-emcs-(nanp)3衍生物:c)经由根据上述实施方案的还原胺化反应使这种衍生物的pf25部分与天然外膜囊泡中间体反应,以得到gmma-pfs25-(nanp)3缀合物。western印迹分析证实了缀合物的形成,其中pfs25与gmma表面糖部分连接,并且未检测到聚集。根据一个进一步实施方案,本发明涉及包含天然外膜囊泡的免疫原性缀合物,其具有至少经由如上所述的还原胺化程序与第一抗原(ag1)连接的表面糖部分,和至少经由如上所述的还原胺化程序与第二不同抗原(ag2)连接的表面糖部分,以得到通式(ii)所示的缀合物:ag1---nomv---ag2(ii)根据一个优选实施方案,在上述通式(ii)中,nomv是来自menb的gmma,ag1是来自脑膜炎球菌血清群c的荚膜多糖,且ag2是来自脑膜炎球菌血清群c的荚膜多糖。通过使用根据本发明的还原胺化程序,通过使用特定的官能化模式,式(ii)的缀合物可以有利地提供nomv的选择性多官能化。技术人员将认识到,鉴于所提出的技术的多功能性,本发明可合适地用于nomv、优选gmma、甚至用多于2种不同的抗原的多官能化。除了选择不同抗原的可能性以外,本发明还允许引入不同量的抗原,因此根据例如选择的抗原或nomv调节抗原/nomv比率。根据一个进一步方面,本发明涉及上述nomv-抗原缀合物,其用作药物,特别是用作免疫原性剂,甚至更优选用于如本文所示的病原体中的一种或多种。换言之,本发明涉及本nomv缀合物用于制备免疫原性组合物的用途。根据一个进一步方面,本发明因此涉及免疫原性组合物,优选疫苗,其包含本发明的缀合物和至少一种额外的药学上可接受的载体、赋形剂或佐剂。通常,药学上可接受的载体或赋形剂可以是本身不诱导产生对接受所述组合物的患者有害的抗体的任何物质,且可以在无不当毒性的情况下施用。药学上可接受的载体是本领域中使用的那些,并且可包括液体,诸如水、盐水、甘油和乙醇。根据现有技术,辅助物质,诸如湿润剂或乳化剂、ph缓冲物质等也可存在于此类媒介物中。本发明还提供了用于产生脊椎动物、优选哺乳动物中的免疫应答的方法,其包括将本发明的缀合物施用于哺乳动物或其他脊椎动物。本发明还提供了用于此类方法的本发明的缀合物。免疫应答优选是保护性的,并且优选涉及抗体。所述方法可以产生加强应答。哺乳动物优选是人。其中预防疾病的受试者可以与接受本发明的缀合物的受试者不同。例如,可以将缀合物施用于雌性(在怀孕之前或怀孕期间)以保护后代(所谓的“母体免疫”)。本发明的缀合物也可用于免疫其他哺乳动物,例如牛、绵羊和猪(特别是针对沙门氏菌属种)和其他非哺乳动物脊椎动物,包括鱼和家禽。本发明提供了用于疗法中(例如作为免疫原性组合物或作为疫苗)的缀合物。本发明还提供了用于产生脊椎动物、优选哺乳动物中的免疫应答的方法中的缀合物。本发明还提供了缀合物在制备用于产生脊椎动物、优选哺乳动物中的免疫应答的的药物中的用途。所述用途和方法特别可用于预防/治疗多种疾病,这取决于如上所述的缀合物内的抗原和nomv。本发明的优选缀合物可以在患者中赋予抗体滴度,所述抗体滴度优于各抗原组分对于可接受百分比的人受试者的血清保护的标准。具有这样的相关抗体滴度的抗原是众所周知的,高于所述相关抗体滴度宿主被认为针对抗原是血清转化的,并且这样的滴度由组织诸如who公布。优选多于80%的统计学显著的受试者的样品发生血清转化,更优选多于90%,仍更优选多于93%,最优选96-100%。本发明的免疫原性组合物将通常直接施用于患者。直接递送可通过肠胃外注射(例如皮下、腹膜内、静脉内、肌内或至组织间隙),或通过直肠、经口、阴道、局部、透皮、鼻内、眼、耳、肺或其他粘膜施用完成。优选例如在大腿或上臂进行肌内施用。注射可以经由针头(例如皮下针头)进行,但或者可以使用无针注射。肌内剂量通常为约0.5ml。本发明还可以用于引发全身和/或粘膜免疫。剂量治疗可以是单剂量时间表或多剂量时间表。多剂量可用于初次免疫时间表和/或加强免疫时间表。初次剂量时间表之后可以是加强剂量时间表。可以常规确定引发剂量之间(例如4-16周之间)和引发和加强之间的合适时机。感染影响机体的各个区域,所以可将本发明的组合物以各种形式制备。例如,可将所述组合物制备为可注射剂,作为液体溶液或悬浮液。也可制备适合在注射前溶解或悬浮于液体媒介物中的固体形式。可将所述组合物制备用于外用施用,例如,油膏、乳膏或粉末。可将所述组合物制备用于口服施用,例如,作为片剂或胶囊,或作为糖浆(任选调味的)。可将所述组合物制备为使用细粉或喷雾进行肺部施用,例如作为吸入剂。可将所述组合物制备为栓剂或阴道栓。可将所述组合物制备用于鼻腔、耳部或眼部施用,例如作为滴剂。适合于肠胃外注射的组合物是最优选的。所述组合物优选是无菌的。其优选不含热原。其优选被缓冲的,例如在ph6到ph8之间,通常为约ph7。本发明的组合物相对于人可以是等张的。免疫原性组合物包含免疫有效量的本发明的缀合物,以及需要的任何其他的其他指定组分。剂量治疗可以是单剂量时间表或多剂量时间表(例如,包括加强剂量)。所述组合物可与其他免疫调节剂结合施用。本发明的组合物中可以任选地使用的佐剂包括但不限于不溶性金属盐,水包油乳剂(例如mf59或as03,两者均含有角鲨烯),皂苷,lps的无毒衍生物(诸如单磷酰脂质a或3-o-脱酰化mpl),免疫刺激性寡核苷酸,脱毒的细菌adp-核糖基化毒素,微粒,脂质体,咪唑并喹诺酮类(imidazoquinolones),或其混合物。充当免疫刺激剂的其他物质公开于例如watson,pediatr.infect.dis.j.(2000)19:331-332。使用氢氧化铝和/或磷酸铝佐剂是特别优选的。这些盐包括羟基氧化物和羟基磷酸盐。所述盐可采取任何合适的形式(例如,凝胶、晶体、无定形等)。包含来自一种病原体的nomv和来自第二种病原体的选择的抗原的本发明的缀合物可用作多价疫苗。可以组合的病原体对(一种作为抗原,且另一种作为nomv囊泡)包括但不限于:脑膜炎奈瑟氏球菌和非伤寒沙门氏菌(例如,鼠伤寒沙门氏菌或肠炎沙门氏菌);恶性疟原虫和非伤寒沙门氏菌;伤寒沙门氏菌和非伤寒沙门氏菌;etec和志贺氏菌属种;a群链球菌(gas)和脑膜炎奈瑟氏球菌;和gas和非伤寒沙门氏菌。本发明的优选配对示于下表a中。表a:优选的nomv-ag组合nomv抗原鼠伤寒沙门氏菌脑膜炎奈瑟氏球菌fhbp鼠伤寒沙门氏菌恶性疟原虫csp鼠伤寒沙门氏菌恶性疟原虫pfs25鼠伤寒沙门氏菌恶性疟原虫ro6c鼠伤寒沙门氏菌恶性疟原虫ro10c鼠伤寒沙门氏菌大肠杆菌ctf1232鼠伤寒沙门氏菌伤寒沙门氏菌vi糖脑膜炎奈瑟氏球菌脑膜炎奈瑟氏球菌fhbp脑膜炎奈瑟氏球菌多鼠李糖寡糖志贺氏菌,优选索氏志贺氏菌大肠杆菌ctf1232脑膜炎奈瑟氏球菌b来自mena的荚膜糖脑膜炎奈瑟氏球菌b来自menc的荚膜糖因此,本nomv-抗原缀合物特别可用作针对表a中列出的病原体的免疫原性剂。包含来自一种病原体的nomv和来自第二种病原体的选择的抗原的本发明的缀合物可用作用于制备多价疫苗的免疫原性化合物。因此,本发明提供了包含本发明的缀合物和以下其他抗原中的一种或多种的组合物:-来自脑膜炎奈瑟氏球菌血清群a、c、w135和/或y的糖抗原,-来自肺炎链球菌(streptococcuspneumoniae)的糖抗原,-来自甲型肝炎病毒,诸如灭活病毒的抗原,-来自乙型肝炎病毒的抗原,诸如表面和/或核心抗原,-白喉抗原,诸如白喉类毒素,例如crm197突变体,-破伤风抗原,诸如破伤风类毒素,-来自百日咳博德特氏菌(bordetellapertussis)的抗原,诸如来自百日咳博德特氏菌的百日咳全毒素(pt)和丝状血凝素(fha),也可任选与百日咳杆菌黏附素(pertactin)和/或凝集原2和3组合,-来自流感嗜血杆菌a或b的糖抗原,-脊髓灰质炎抗原,诸如ipv,-麻疹、腮腺炎和/或风疹抗原,-流感抗原,诸如血凝素和/或神经氨酸酶表面蛋白,-来自卡他莫拉菌(moraxellacatarrhalis)的抗原,-来自无乳链球菌(streptococcusagalactiae)(b群链球菌)的蛋白抗原,-来自无乳链球菌(streptococcusagalactiae)(b群链球菌)的糖抗原,-来自酿脓链球菌(streptococcuspyogenes)(a群链球菌)的抗原,-来自金黄色葡萄球菌(staphylococcusaureus)的抗原。现在将通过以下实验部分描述本发明,而不对其范围造成任何限制。实验部分实施例1:nomv产生本实验部分中使用的优选的nomv是由鼠伤寒沙门氏菌或索氏志贺氏菌的δtolr菌株制备的gmma,分别如例如clinvaccineimmunol.2016apr;23(4):304–314和plosone.2015;10(8):e0134478中所公开。所述nomv的特征如下表2中所示。表2:由鼠伤寒沙门氏菌或索氏志贺氏菌的δtolr菌株制备的纯化的nomv的特征。实施例2:nomv氧化测试各种氧化条件。例如,对于nomvδtolr1418的氧化,测试5-20mm范围内的naio4浓度。评价氧化对-oag链长的影响。随着氧化进行,链长减小。较高的naio4浓度倾向于降低oag大小。据验证,增加naio4体积摩尔浓度不仅导致更高的氧化水平,从5%至45%(鼠李糖是参与该过程中的主要糖),而且还降低-oag链长。同时,囊泡大小分布没有变化,并且维持囊泡的完整性。这通过动态光散射(dls)、纳米颗粒追踪分析(nta)和高效液体大小排阻色谱/多角度光散射(hplc-sec/mals;参见表2a)来验证。还验证了在还原胺化的条件下,nomv上的nh2基团不与产生的cho基团反应,导致更大的交联的颗粒(表2b)。表2a-通过dls和hplc-secmals分析氧化的nomv(通过与10和20mmnaio4反应获得)。表2b-在还原胺化的条件下通过dls和hplc-sec/mals验证的nomv没有反应。在还原胺化的条件下,在没有nomv的情况下,对于缀合物外来的抗原不产生任何聚集,如对于几种抗原(例如,fhbp、pfs25和ctf1232)所验证。此外,验证了nabh3cn没有还原s-s键,其否则可以影响蛋白、诸如pfs25的构象。通过模拟缀合条件用nabh3cn处理pfs25,并且用dtt作为还原剂进行相同的反应用于比较。在室温下混合过夜之后,通过用nabh3cn处理的pfs25的sdspage和hplc-sec分析,与用dtt处理的pfs25相比,显示与新鲜pfs25相比蛋白没有变化。当在nabh3cn或dtt存在的情况下用碘乙酰胺(iaa)处理蛋白时,通过maldi-ms分析证实相同的结果。对鼠伤寒沙门氏菌三重突变体nomv(鼠伤寒沙门氏菌2192nomv△tolr△pagp△msbb)的进一步实验显示,低naio4浓度(3-5mm)也足以获得良好的氧化水平。示例性结果显示于表2c中,其使用0.2-4mg/ml范围内的nomv浓度,5-8范围内的ph,和0.5-5mm范围内的naio4浓度。评价所得囊泡的%nomv回收率、%鼠李糖氧化、nomv大小和oag大小。表2c鼠伤寒沙门氏菌三重突变体nomv氧化。对于所有反应条件观察到相似的nomv回收率,如通过微量二辛可宁酸蛋白测定(微量bca)所测试。进一步验证,所测试的反应条件无一引起nomv交联或聚集。鼠李糖氧化百分比受nomv浓度和naio4浓度两者的影响,其中较低的nomv浓度和较高的naio4浓度倾向于提供较高的鼠李糖氧化速率。因此,通常,可以操纵nomv浓度和/或naio4浓度以实现期望的鼠李糖(或其他糖)氧化率。为了比较具有不同-oag大小和鼠李糖氧化水平的囊泡,表5的运行5、14和16的囊泡用nabh4处理以除去醛(cho)基团并稳定nomv囊泡,并且在处理之后再次评价鼠李糖氧化水平和-oag大小。结果显示于下表2d中。表2d:用nabh4的运行5、14和16处理。结果显示还原步骤不影响-oag长度或nomv氧化程度。在分开的实验中获得类似的结果。实施例3:nomv-ag缀合步骤(fvi-鼠伤寒沙门氏菌nomv;经由接头间接缀合)通过与adh接头随机(r)或选择性(s)反应来修饰fvi。然后使用还原胺化将修饰的fvi与氧化的鼠伤寒沙门氏菌nomv缀合。当用adh随机活化fvi时,在缀合中使用fvi:nomv1:1重量比,而当用adh末端衍生fvi时使用3:1重量比。使用微量bca/lowry测定法表征缀合物以测定总蛋白含量(nomv回收率);使用高效阴离子交换色谱脉冲安培检测(hpaec-pad)以测定总vi含量(无nomv干扰);使用高效液相色谱大小排阻色谱(使用tsk凝胶3000pwxl柱的hplc-sec)来使用差示折射率(dri)估计游离vi%,并且使用动态光散射高效液相色谱大小排阻色谱多角度静态光散射(dls/hplc-secmals)以测定大小。考虑hpaec-pad收集的数据连同通过纳米颗粒追踪分析(nta)的nomv数量,评价该缀合方法的缀合条件对每个nomv的fvi链的最终数量的影响。结果在表3中给出。表3:naio4浓度和ph对fvi-nomv缀合物的影响。r:沿着fvi抗原引入随机接头(adh)。s:在fvi抗原末端引入选择性接头(adh)。ru:重复单元。amw通过hplc-sec使用葡聚糖标准品测量。在ph4.5下用48.5kdafvi进行还原胺化,导致与在更高ph下相比,在10mm和20mmnaio4两者下,fvi/nomv比率更高,并且每个nomv的fvi链更多。用随机修饰的fvi,在ph4.5下发生沉淀;通过用选择性修饰的fvi作用来避免沉淀。通常,选择性化学被鉴定为改进nomv回收率和避免沉淀的方式。对于具有avmw≤23kda的fvi,在低ph下,用随机修饰的fvi链,未观察到沉淀。用10mmnaio4代替20mmnaio4氧化nomv,导致改进的缀合物回收率。增加naio4的浓度不影响最终缀合物的特征。当使用23kdafvi时,获得较低的fvi:nomv比率,这可能与用于缀合的fvi-adh的较低衍生化百分比(11%的fvi重复单元)相关。将fvi-adh的ph和活化程度鉴定为用于调节每个nomv连接的fvi链的数量的变量。实施例3a:vi-鼠伤寒沙门氏菌nomv缀合物(经由接头的间接缀合)在小鼠中测试根据上表3的缀合物1和5,其分别具有vi:nomvw/w比率0.45和0.44)。为了比较,crm197也用作载体,并且还测试了fvi+nomv的简单混合物。在第0和28天用缀合物(1μgvi剂量)和alhydrogel佐剂皮下免疫小鼠。在第0、14、28和42天测量抗viigg滴度,并且结果显示于图2a中。nomv不劣于crm197,但明显好于未缀合的混合物。还评价针对-oag的igg滴度。图2b显示单独的囊泡或与vi缀合的囊泡的抗-oag滴度。缀合使-oag应答少量减少,但应答仍然显著。实施例4:nomv-ag缀合步骤(etecctf1232-鼠伤寒沙门氏菌△tolr1418或索氏志贺氏菌1790nomv;没有接头的直接缀合)ctf1232是大肠杆菌抗原(seqidno:14,具有c-末端六组氨酸标签,其与两种类型的nomv囊泡缀合。该多肽包括五个赖氨酸残基,其可用于连接至囊泡中的氧化糖。为了与ctf1232缀合,将囊泡在100mm乙酸钠(ph5)中用高碘酸钠(对于鼠伤寒沙门氏菌为20mm,对于索氏志贺氏菌为40mm)在室温下在黑暗中氧化2小时。鼠伤寒沙门氏菌中的氧化在鼠李糖(rha)残基中是优先的,其中约30%的rha单元被氧化(相对于甘露糖计算)。索氏志贺氏菌中的氧化影响lps分子的核心区域。将来自鼠伤寒沙门氏菌△tolr1418或索氏志贺氏菌1790nomv的500μg氧化囊泡(总测量蛋白)与500μgctf1232和1-2mgnabh3cn在室温下经周末反应。基于缀合之后未反应的抗原定量,nomv表面上的抗原存在被计算为鼠伤寒沙门氏菌中<36%和索氏志贺氏菌中<31%。结果显示,还原胺化化学适合于多肽抗原与囊泡的缀合。将ctf1232抗原与两个囊泡的氧化lps缀合。将小鼠用单独的所述蛋白、所述蛋白和志贺氏菌nomv的混合物或所述缀合物免疫。在所有组中都使用alhydrogel佐剂。在第0、21和38天鼻内施用免疫,并且在第0、14、35和52天评价免疫应答。抗ctf1232igg滴度在图3中。在第14天,1418nomv-ctf1232缀合物能够诱导的应答显著高于单独蛋白的反应(p=0.0005)或与nomv物理混合物(p=0.042)(用dunn氏事后分析的kruskal-wallis检验)。除了抗-ctf1232滴度的改善以外,所述缀合物具有作为二价疫苗的另外的优点。在1790nomv-ctf1232和1418nomv-ctf1232缀合物之间未观察到主要差异,意味着沙门氏菌和志贺氏菌nomv均可以充当etec抗原的良好载体。实施例5:nomv-ag缀合步骤(在na2so3存在的情况下的pfs25-鼠伤寒沙门氏菌nomv缀合)通过两种不同的化学法将疟疾抗原pfs25与鼠伤寒沙门氏菌nomv囊泡缀合:经由sh-马来酰亚胺或点击化学法与蛋白缀合;或与naio4氧化的oag缀合。为了与氧化的-oag连接,使用1:1比率的nomv:pfs25,以pbs中2.6mg/ml的pfs25浓度,在室温下孵育过夜。当用na2so3淬灭过量的naio4(在该实验中使用10mm的浓度,持续10分钟),随后将pfs25直接添加至同一罐中(0.2mg/ml最终浓度)时,也获得缀合物形成。图4a显示响应于以下的抗pfs25igg滴度:三种缀合物;单独的pfs25;或与囊泡物理混合的pfs25。所有构建体都用alhydrogel配制。将小鼠在第0天和第28天以0.1μgpfs25/剂量皮下免疫。在第0、14、28和42天测量抗-pfs25igg滴度。单独的pfs25诱导显著低于nomv-sh-pfs25(p=0.001)和nomv-ox-pfs25缀合物(p=0.0095)的抗-pfs25igg抗体应答。与nomv物理混合的pfs25类似地诱导比nomv-sh-pfs25和nomv-ox-pfs25(分别为p=0.0038和p=0.0282)更低的应答(使用dunn氏事后分析的kruskalwallis检验)。有趣的是,通过nomv上的糖组分连接的pfs25(nomv-ox-pfs25缀合物)诱导与连接至nomv上的蛋白的pfs25(nomv-sh-pfs25和nomv-click-pfs25)类似的抗体应答,并且高于单独的pfs25或与nomv物理混合的pfs25。当通过标准膜-进料测定法测试时,来自pfs25-nomv缀合物的血清显示传播阻断活性(smfa;对于nomv-sh-pfs25和nomv-ox-pfs25,传递降低活性在1:8稀释度下>90%并且在1:16稀释度下维持)。nomv上的pfs25的连接不影响抗-oagigg应答。通过还原胺化获得的缀合物(其中使用的化学品对-oag结构和长度具有影响)维持高抗-oagigg滴度。因此,鼠伤寒沙门氏菌nomv上的外源抗原的存在不影响抗-oagigg应答(参见图4c)。在第二项研究中,将pfs25-nomv缀合物(通过还原胺化产生)的免疫原性与在没有alhydrogel的情况下以1μgpfs25的剂量与nomv物理混合的pfs25进行比较。图4b显示使用与图4a相同的免疫时间表,pfs25-nomv缀合物在小鼠中诱导的抗-pfs25igg应答与在没有alhydrogel的情况下与nomv物理混合的pfs25的比较。与和nomv混合的蛋白相比,所述缀合物能够诱导显著更高的抗-pfs25igg应答(p=0.0002;mann-whitney双尾分析)。实施例6:ro6c-鼠伤寒沙门氏菌nomv缀合物(再循环步骤)使用还原胺化将疟原虫ro6c抗原与氧化的鼠伤寒沙门氏菌nomv囊泡缀合。通过从第一缀合批次再循环未反应的ro6c并重新使用它用于缀合来产生另外的缀合物。ro6c与总蛋白的比率通过竞争性elisa测量,并且对于未再循环缀合物为7.2%,并且对于再循环缀合物为11.1%。为了比较,使用单独的ro6c。所有构建体都用alhydrogel配制。在第0天和第28天皮下免疫小鼠,并且使用1、4和20μgro6c的剂量。以4μgro6c剂量测试再循环的缀合物。在第0、14、28和42天测量抗-ro6cigg滴度,并且结果显示于图5a中。在第42天,与单独的ro6c相比,nomv-ro6c缀合物诱导更高的抗-ro6cigg应答(mannwhitney检验,在1μg剂量,p=0.05,在4μg剂量,p=0.03,并且在20μg剂量,p=0.04)。此外,nomv-ro6c缀合物以剂量依赖性方式引发抗-ro6cigg应答(spearman秩,p=0.001,第42天)。所有构建体(在所有剂量下)显示加强应答的能力(第14天-第42天)。通过mannwhitney双尾检验比较在4μg剂量的未再循环和再循环缀合物,显示再循环缀合物诱导不劣于未再循环缀合物的应答的能力。还评价针对-oag的igg滴度。图5b显示未再循环和再循环囊泡的抗-oagigg滴度。对应于1、4和20μg的ro6c剂量的nomv剂量分别为13μg、52μg和258μg。对于再循环缀合物,nomv剂量为32μg(对应于4μg的ro6c剂量)。实施例7a-c:比较实施例实施例7a:domv(来自脑膜炎奈瑟氏球菌b)与fhbpv3的反应(无反应)本实施例的domv通过去污剂提取方法制备,其中脱氧胆酸盐用作选择的去污剂。根据本发明的方法,因此获得的去污剂提取的囊泡已经与选择的抗原(fhbp)反应。具体而言,将浓度为0.96mg/ml的domv与naio410mm在室温下在黑暗中孵育30分钟。将过量的naio4用最终浓度为20mm的na2so3在室温下淬灭15分钟。将fhbp(dwv与fhbp的w/w比率为1:1,并且domv浓度为0.335mg/ml)和nabh3cn(3mg)直接添加至反应混合物中。在室温下轻轻混合过夜之后,将缀合物通过超速离心(110000rpm,4℃,1小时)纯化,重悬浮于pbs中并通过sdspage/western印迹分析。实施例7b:nomv(来自脑膜炎奈瑟氏球菌b)与fhbpv3的反应(形成本发明的nomv-fhbp缀合物)本实施例的nomv在不使用任何去污剂的情况下制备,如koeberling等人vaccine(2014)32:2688中所述。根据本发明的方法,因此获得的提取的囊泡已经与选择的抗原(fhbp)反应。具体而言,将浓度为0.96mg/ml的nomv与naio45mm在室温下在黑暗中孵育30分钟。将过量的naio4用最终浓度为20mm的na2so3在室温下淬灭15分钟。将fhbp(dwv与fhbp的w/w比率为1:1,并且domv浓度为0.335mg/ml)和nabh3cn(3mg)直接添加至反应混合物中。在室温下轻轻混合过夜之后,将缀合物通过超速离心(110000rpm,4℃,1小时)纯化,重悬浮于pbs中并通过sdspage/western印迹分析。sdspage/抗-fhbpwestern印迹分析证实通过还原胺化化学法仅与nomv形成缀合物,但不与domv形成缀合物(10%sdspage凝胶)。实施例7c:遵循实施例7b的程序,使nomv(来自沙门氏菌)与fhbpv1反应。使用来自鼠伤寒沙门氏菌的nomv进行与实施例7b相同的实验,并且收集类似的结果,获得本发明的nomv-fhbp缀合物。实施例8:根据本发明使用(nanp)3-sh-pfs25制备多官能化nomv。pfs25蛋白根据以下程序用emcs接头衍生化。向浓度为2.6mg/ml的pbs缓冲液中的pfs25添加emcs接头(emcs接头与pfs25lys残基的摩尔比为0.3)。将反应物在室温下混合4小时。通过pd10柱针对nah2po410mmph6纯化所得衍生化蛋白(pfs25-emcs)。通过maldi-tofms的分析揭示每个pfs25分子引入平均4个emcs接头。将(nanp)3添加至pfs25-emcs的溶液中,使(nanp)3与emcs接头的摩尔比为3:1,且pfs25浓度为0.7mg/ml。将反应物在室温下混合过夜。该时间之后,通过vivaspin10k针对pbs缓冲液纯化pfs25-(nanp)3衍生物。通过sdspage/western印迹和maldi-tofms的分析证实产物形成。将nah2po4100mmph6.5中浓度为2.1mg/ml的鼠伤寒沙门氏菌nomv与naio45mm在25℃下在黑暗中孵育30分钟。将过量的naio4用最终浓度为10mm的na2so3在室温下淬灭10分钟。将pfs25-(nanp)3(nomv与pfs25-(nanp)3的w/w比率为1:1,并且domv浓度为0.45mg/ml)和nabh3cn直接添加至反应混合物中。在室温下轻轻混合过夜之后,将缀合物通过超速离心(110000rpm,4℃,30分钟)纯化,重悬浮于pbs中并通过sdspage/western印迹分析,其证实缀合物形成。实施例9:根据本发明的实施方案,通过在有或没有猝灭的情况下将鼠伤寒沙门氏菌nomv颗粒与pfs25抗原缀合而获得的本发明的缀合物的体内数据。在第0天和第28天用在有或没有猝灭步骤的情况下与pfs25抗原缀合的2.5μg总蛋白鼠伤寒沙门氏菌nomv颗粒(参见实施例5)皮下免疫cd1雌性小鼠。两种缀合物通过竞争性elisa显示pfs25与总蛋白w/w比率接近20%并且吸附在alhydrogel(0.7mg/mlal3+)上。在第0、14、27和42天测量抗-pfs5和抗-oagigg滴度。在所有时间点,两种缀合物诱导相似的抗-pfs25igg应答(mannwhitney检验),如图6a中所示。此外,所述缀合物能够诱导相似的抗-oagigg应答,如图10b中所示。可以在通过还原胺化的缀合中引入猝灭的步骤,而不影响小鼠中诱导的免疫应答,因此避免gmma氧化中间体纯化。实施例10:nomv(来自脑膜炎奈瑟氏球菌b)与menc的反应(形成本发明的nomv-menc缀合物)menc多糖以40mg/ml的浓度溶解于acona100mmph4.5中。添加adh接头和nabh3cn,w/w比率分别为1:1.2:1.2menc/adh/nabh3cn。将混合物在30℃下加热过夜,且然后通过g10柱脱盐。通过tnbs比色法和hpaec-pad的表征显示100%衍生化。将nah2po4100mmph6中浓度为8.5mg/ml的过表达fhbp的menbgmma与naio45mm在室温下在黑暗中孵育30分钟。将过量的naio4用最终浓度为10mm的na2so3在室温下淬灭10分钟。将先前用adh接头末端衍生的menc寡糖(gmma与menc的w/w比率为1:10,并且gmma浓度为7.7mg/ml)和nabh3cn直接添加至反应混合物中。在室温下轻轻混合过夜之后,将缀合物通过超速离心(110000rpm,4℃,1小时)纯化,并重悬浮于pbs中。通过sdspage/western印迹的分析证实缀合物形成,并且通过微量bca和hpaec-pad的分析揭示menc多糖与蛋白的重量比等于0.11。实施例11:nomv(来自脑膜炎奈瑟氏球菌b)与mena的反应(形成本发明的nomv-mena缀合物)menaos以40mg/ml的浓度溶解于acona100mmph6.5中。添加adh接头和nabh3cn,w/w比率分别为1:1.2:1.2mena/adh/nabh3cn。将混合物在30℃下加热5天,且然后通过g10柱脱盐。通过tnbs比色法和hpaec-pad的表征显示90%衍生化。如对于menc多糖所述,进行与过表达fhbp的menbgmma的缀合。实施例11:nomv(来自脑膜炎奈瑟氏球菌b)与mena和menc的缀合物的制备对于合成mena-和menc-menbgmma缀合物所述的相同缀合条件用于在相同gmma颗粒上缀合两种多糖。将gmma如前所述氧化,并且在用na2so3淬灭之后,同时添加mena-adh和menc-adh,w/w比率分别为8:8:1mena/menc/gmma。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1