白蛋白结合型抗肿瘤药-马来酰亚胺分子前药的制作方法
本发明属于药物制剂前体药物设计领域,涉及以内源性血浆白蛋白为载体,设计并合成于肿瘤组织特异性响应的氧化还原敏感前药,及其在抗肿瘤方面的应用。
背景技术:
目前化疗依然是治疗肿瘤的主要途径,但多数抗肿瘤药物因其低溶解性,在血液中易降解代谢,缺乏肿瘤靶向性以及不良反应严重等等都极大地限制了在临床上的使用。为开发高效安全的药物传递系统,我们将抗肿瘤药物进行结构修饰,设计能与体内血浆白蛋白结合的前药,经静注给药后,前药可快速结合体循环中的白蛋白,以其为载体实现药物递送。白蛋白是血浆中含量最多的蛋白质,其在体内半衰期为19天,目前,在药学研究领域,白蛋白作为药物载体的应用非常广泛,许多水溶性差的药物都通过与其结合被运输来改善自身的药代动力学性质。经文献证明,肿瘤部位能聚集大量白蛋白以满足其生长的营养供应,另外基于EPR效应和白蛋白相关受体转运作用,均使白蛋白能靶向并聚集到肿瘤组织,所以目前白蛋白作为抗肿瘤药物的优良载体。其载药方式主要有两类,一是将药物包埋于白蛋白纳米颗粒中,二是利用白蛋白分子表面的活性基团,将药物以共价或非共价的方式结合到白蛋白分子上。
其中经文献报道马来酰亚胺结构可与白蛋白34位半胱氨酸的游离巯基通过迈克尔加成形成白蛋白-药物共轭物,且白蛋白中游离巯基占血浆中总巯基含量的80%以上,而且活性很强,可以说是体循环中很特殊的存在。故我们设计以马来酰亚胺结构作为共价结合白蛋白的靶头,设计一系列抗肿瘤药物-马来酰亚胺前药,实现药物在体内靶向到肿瘤组织的递送。
技术实现要素:
本发明的第一个目的旨在提供一系列由不同连接键连接,在血液中能快速结合白蛋白,增强药物稳定性,显著延长药物循环时间,在肿瘤细胞内迅速释放化疗药物,具有很强抗肿瘤活性的抗肿瘤药物-马来酰亚胺前药,所述的抗肿瘤药物包括紫杉烷类,蒽醌类;核苷类药物等。
本发明第二个目的在于提供上述不同连接键连接的前药的合成方法。
本发明的第三个目的是提供并比较上述不同连接键的前药对药物释放,细胞毒性以及抗肿瘤药物效果上的影响。
本发明通过以下技术方案实现上述目的:
本发明所述的抗肿瘤药-马来酰亚胺分子前药为抗肿瘤药物和马来酰亚胺直接通过酯键、肿瘤环境敏感键连接,所述的肿瘤环境敏感键为pH敏感键或还原环境敏感键,所述的pH敏感键为腙键、碳酸酯键,所述的还原环境敏感键为单硫醚键、二硫醚键、二硫键或金属蛋白酶敏感键。优选地,本发明设计并合成由不同连接键(氧化敏感的硫醚键,还原敏感的二硫键和作为对照的酯键)连接的抗肿瘤药物-马来酰亚胺前药,利用前药结构中的马来酰亚胺环在药物静注进入体内后迅速结合血浆中白蛋白形成白蛋白-药物复合物,靶向到肿瘤组织发挥抗肿瘤效果。
以多烯紫杉醇为例,其所述的多烯紫杉醇-马来酰亚胺前药的结构式通式如下:
n=0,1,2。
优选结构为:
本发明所述的前药,以马来酰亚胺环作为结合血浆白蛋白的靶头,分别设计合成由不同连接链(氧化敏感的硫醚键,还原敏感的二硫键和非敏感键酯键)连接的多烯紫杉醇-马来酰亚胺前药,具体的合成路线及方法如下:
(a)非敏感键酯键连接键的前药(简记为DM):多烯紫杉醇(DTX)和马来酰亚胺己酸(EMC)在双环己基碳酰亚胺(DCC)和4-二甲氨基吡啶(DMAP)催化作用下,N2保护,室温反应经柱层析分离纯化得到白色粉末化合物DM。
(b)还原敏感的二硫键连接键前药(简记为DSSM):马来酸酐和呋喃在甲苯中反应,得到呋喃环保护的马来酸酐(化合物2);呋喃环保护的马来酸酐和乙醇胺在甲醇中反应,得到呋喃环保护的N-(2-羟乙基)马来酰亚胺(化合物3);再将其加到甲苯中回流,得到N-(2-羟乙基)马来酰亚胺(Mal-OH,化合物4)。反应全程都在N2保护下进行。
将二硫代二丙酸溶于适量乙酸酐中,室温下搅拌成二硫代二丙酸酐,与上述合成的N-(2-羟乙基)马来酰亚胺(Mal-OH),在4-二甲氨基吡啶(DMAP)催化作用下,N2保护反应,经柱层析分离纯化得到淡黄色油状物(化合物6)。加入2-(7-偶氮苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)和N-甲基吗啉(NMM),冰水浴活化后与多烯紫杉醇N2保护反应,经柱层析分离纯化得到白色粉末化合物DSSM。催化剂HATU可以替代为O-苯并三氮唑-四甲基脲六氟磷酸酯、二环己基碳二亚胺、1-(3-二甲氨基丙基)-3-乙基-碳二亚胺、1-羟基苯并三唑等缩合剂;N-甲基吗啉可以替代为三乙胺或N-乙基二异丙胺。
(c)氧化敏感的硫醚键连接键前药(简记为DSM):与上述DSSM的合成路线类似,只需将二硫代二丙酸换成单硫代二丙酸即可,其余路线参照上述。
本发明所述的马来酰亚胺前药可以用来修饰更多的其他抗肿瘤药物,包括紫杉烷类,蒽醌类;核苷类药物等,进而改善母体药物在体内的不佳药动学性质。
本发明以抗肿瘤药物多烯紫杉醇为模型药物,设计一系列多烯紫杉醇-马来酰亚胺分子前药,另外基于肿瘤细胞比正常细胞高数倍的特殊氧化还原环境,设计由不同氧化还原敏感键连接的前药,这样药物进入体循环后可一方面利用其结构中的马来酰亚胺环迅速与血浆中的白蛋白结合形成白蛋白-药物共轭物,由此药物在体内滞留时间就会显著延长,越来越多的白蛋白药物共轭物向肿瘤组织聚集,在其到达肿瘤组织后利用肿瘤细胞内特殊的高氧化还原特性实现快速释药,进而发挥疗效。
本发明具有以下有益效果:合成的一系列多烯紫杉醇-马来酰亚胺前药经静注进入体内后,能与血浆中白蛋白快速结合形成白蛋白-药物偶联物,进而增加药物在血浆中的稳定性,药动结果表明前药在血液中绝大多数都是以白蛋白-药物偶联物的形式存在,可以显著延长药物在体内的循环时间,进而靶向到肿瘤组织发挥作用。体外细胞实验和体内组织分布考察均证明本发明的前药对肿瘤组织有很好的选择性,实现了增效减毒的目的。
附图说明
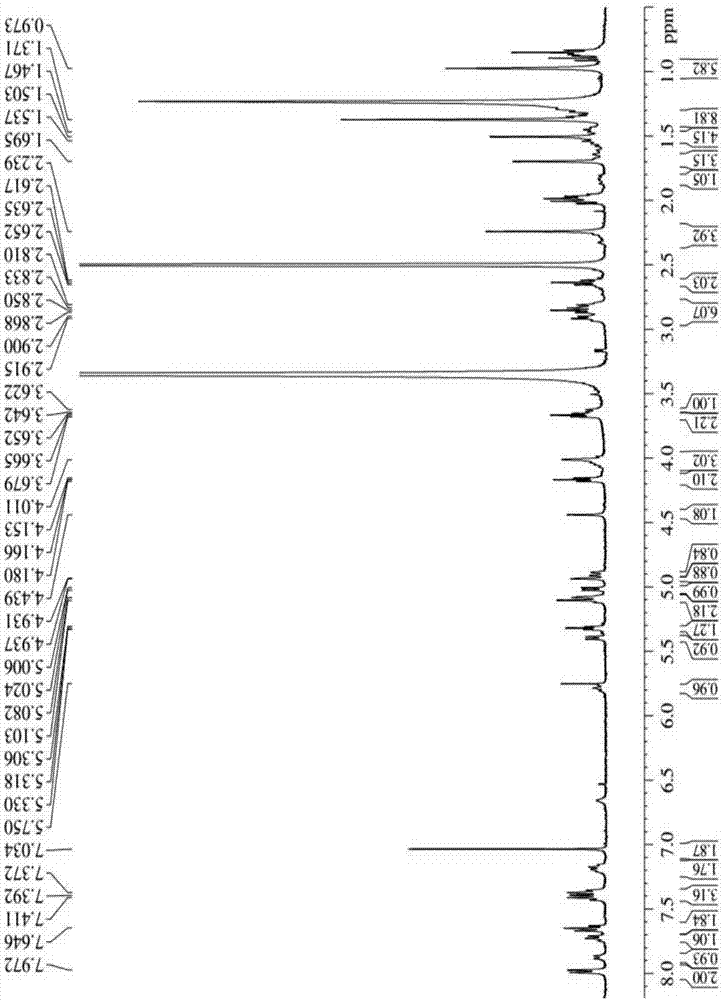
图1为本发明实施例1的酯键相连的多烯紫杉醇-马来酰亚胺前药(DM)的1HNMR谱图。
图2为本发明实施例1的二硫键相连的多烯紫杉醇-马来酰亚胺前药(DSSM)的1HNMR谱图。
图3为本发明实施例1的硫醚键相连的多烯紫杉醇-马来酰亚胺前药(DSM)的1HNMR谱图。
图4为本发明实施例2的三种多烯紫杉醇-马来酰亚胺前药与牛血清白蛋白溶液的体外结合实验色谱图。
图5为本发明实施例2的三种多烯紫杉醇-马来酰亚胺前药与大鼠血浆的体外结合实验色谱图。
图6为本发明实施例3的三种多烯紫杉醇-马来酰亚胺前药-白蛋白复合物的体外释放实验图。
图7为本发明实施例4的三种多烯紫杉醇-马来酰亚胺前药的细胞毒性图。
图8为本发明实施例4的三种多烯紫杉醇-马来酰亚胺前药在肿瘤细胞和正常细胞的细胞毒性图。
图9为本发明实施例5的三种多烯紫杉醇-马来酰亚胺前药经静脉注射给药后血药浓度-时间曲线图。
图10为本发明实施例6的三种多烯紫杉醇-马来酰亚胺前药的组织分布图。
图11为本发明实施例7的三种多烯紫杉醇-马来酰亚胺前药在体内抗肿瘤实验中肿瘤体积变化图。
图12为本发明实施例7的三种多烯紫杉醇-马来酰亚胺前药在体内抗肿瘤实验中小鼠体重变化图。
图13为本发明实施例7的三种多烯紫杉醇-马来酰亚胺前药在体内抗肿瘤实验中荷瘤小鼠肿瘤和主要器官组织的HE染色图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将发明限制在所述的实施例范围之中。
实施例1
三种不同连接键连接的多烯紫杉醇-马来酰亚胺前药的合成。
(a)非敏感键酯键连接的前药的合成(简记为DM):取405mg多烯紫杉醇(DTX),116mg马来酰亚胺己酸(EMC)溶于二氯甲烷中,加入210mg双环己基碳酰亚胺(DCC),12mg 4-二甲氨基吡啶(DMAP),N2保护下室温反应12h,柱层析分离纯化得到白色粉末化合物DM。
(b)还原敏感的二硫键连接的前药的合成(简记为DSSM):首先按如下合成路线合成关键中间体N-(2-羟乙基)马来酰亚胺(化合物4)。取30g马来酸酐溶解于甲苯中,加入呋喃,室温下搅拌24h停止反应,溶液中析出白色固体,过滤收集,甲苯洗三次,干燥,得到呋喃环保护的马来酸酐(化合物2);再把5g化合物2,2ml乙醇胺加入适量甲醇中,室温下搅拌,回流24h,将反应液冷却至0℃,过滤收集析出的固体,干燥,得到呋喃环保护的N-(2-羟乙基)马来酰亚胺(化合物3),再将其加到甲苯中回流搅拌12h,趁热过滤,滤液在4℃下保存过夜,过滤收集析出的产物,干燥得到N-(2-羟乙基)马来酰亚胺(Mal-OH,化合物4)。
取420mg二硫代二丙酸溶于乙酸酐中,室温搅拌3h成二硫代二丙酸酐;再加入上述合成的N-(2-羟乙基)马来酰亚胺(Mal-OH)310mg,以干燥二氯甲烷为溶剂,在4-二甲氨基吡啶(DMAP)催化作用下,N2保护室温反应12h,经柱层析分离纯化得到淡黄色油状物(化合物6)。然后加入450mg 2-(7-偶氮苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU),冰水浴下活化30min,再加入480mg多烯紫杉醇,50μL N-甲基吗啉(NMM),室温反应12h,经柱层析分离纯化得到白色粉末化合物DSSM。
(c)氧化敏感的硫醚键连接的前药的合成(简记为DSM):与上述DSSM的合成路线类似,只需将二硫代二丙酸换成单硫代二丙酸即可,其余路线参照上述。
采用核磁共振测定1H-NMR氢谱来确定实施例1中三种多烯紫杉醇-马来酰亚胺前药化合物(DM,DSSM和DSM)的化学结构,选用的溶剂为d-DMSO,结果如图1,2,3所示,波谱解析结果如下:
前药DM的1H-NMR(400MHz,DMSO-d6,ppm)谱图:δ7.97-7.99(2H,d),7.83-7.87(1H,d),7.67-7.73(1H,t),7.64-7.67(2H,t),7.34-7.41(4H,m),7.13-7.18(1H,t),7.0(2H,S),5.75-5.78(1H,S),5.38-5.40(1H,d),4.89-5.08(6H,m),4.39-4.42(1H,S),4.01-3.62(6H,m),2.36-2.39(2H,t),2.21-2.23(4H,m),0.98-1.78(30H,m).
质谱结果:ESI-MS(m/z):[M+Na]+=1023.5
前药DSSM的1H-NMR(400MHz,DMSO-d6,ppm)谱图:δ7.97-8.01(2H,d),7.85-7.88(1H,d),7.7-7.73(1H,t),7.64-7.69(2H,t),7.37-7.42(4H,m),7.14-7.18(1H,t),7.03(2H,S),5.75-5.82(1H,t),5.38-5.41(1H,d),5.08-5.1(3H,m),5.0-5.02(1H,d),4.9-4.94(2H,t),4.42-4.45(1H,S),4.15-4.17(2H,t),4.01-4.03(3H,S),3.65-3.68(1H,d),3.6-3.65(2H,t),2.24-2.91(12H,m),0.97-1.90(24H,m).
质谱结果:ESI-MS(m/z):[M+Na]+=1145.5,[M+K]+=1161.4
前药DSM的1H-NMR(400MHz,DMSO-d6,ppm)谱图:δ7.97-7.99(2H,d),7.87(1H,d),7.67-7.72(1H,t),7.61-7.65(2H,t),7.37-7.41(4H,m),7.13-7.19(1H,t),7.03(2H,S),5.75-5.82(1H,t),5.37-5.41(1H,d),5.03-5.1(3H,m),5.0-5.03(1H,d),4.87-4.93(2H,t),4.41-4.45(1H,S),4.12-4.17(2H,t),4.01-4.07(3H,S),3.65-3.68(1H,d),3.6-3.65(2H,t),2.24-2.72(12H,m),0.97-1.88(24H,m).
质谱结果:ESI-MS(m/z):[M+Na]+=1113.7,[M+K]+=1129.6
实施例2
三种多烯紫杉醇-马来酰亚胺前药与牛血清白蛋白和血浆的体外结合实验
称取适量的DM,DSSM和DSM加入到牛血清白蛋白的pH7.4磷酸盐缓冲液中,使得前药和牛血清白蛋浓度分别为300μM和700μM。随后将混合溶液至于37℃恒温振荡器中孵育,在特定的时间点取样进高效液相考察结合情况。
另将上述牛血清白蛋白溶液换成大鼠血浆,重复上述操作,考察三种前药体外和血浆白蛋白的结合情况。并利用过量的马来酰亚胺己酸进行竞争性结合实验:先将过量的马来酰亚胺己酸加入到血浆中孵育1h,再加入各前药,取点进液相,考察在血浆白蛋白34-SH被基本结合后和各前药的结合情况。
结果如图4所示,三种多烯紫杉醇-马来酰亚胺前药在孵育5min后,可明显看到前药色谱峰面积大幅下降,约有85-92%的前药与牛血清白蛋白结合;在孵育30min后,几乎看不到前药峰,说明前药和白蛋白基本结合完全。由此可说明合成的马来酰亚胺前药可快速的结合白蛋白形成白蛋白-药物复合物。另三种前药与大鼠血浆结合情况如图5所示,与上述白蛋白溶液有相似的实验结果,30min前药和血浆白蛋白基本结合完全,同时当血浆提前和过量的马来酰亚胺己酸孵育后,再加入前药继续孵育,此时发现前药峰面积基本不变。以上结果说明前药和白蛋白的结合的确是通过其结构中的马来酰亚胺环与白蛋白34-半胱氨酸游离巯基特异性结合所致。
实施例3
三种白蛋白-前药复合物在不同氧化还原条件下的体外释放实验
采用上述结合实验的条件,将三种前药和牛血清白蛋白溶液孵育2h,进样发现无游离前药剩余,即结合完全。随后将溶液冻干即得到三种白蛋白-前药复合物(BSA-DM,BSA-DSSM和BSA-DSM)。然后以含30%乙醇的pH 7.4磷酸盐缓冲液为释放介质,考察三种白蛋白-前药复合物体外释放情况:将上述冻干得到的白蛋白-前药复合物(多烯紫杉醇含量为500mg)加入到1mL的pH 7.4磷酸盐缓冲液中,并转移至透析袋里,置于30mL释放介质中,在37℃条件下,于设定的时间点取样,通过高效液相色谱测定释放出的多烯紫杉醇浓度。向释放介质中加入一定浓度的双氧水(H2O2)或二硫苏糖醇(DTT),分别考察三种白蛋白-前药复合物在不同氧化还原条件下的释放情况。
结果如图6所示,以酯键相连的BSA-DM复合物具有很高的稳定性,无论在含有10mM H2O2和还是10mM DTT中,几乎不发生水解,DTX很难从前药上释放出来。相比之下,以硫醚键和二硫键连接的BSA-DSM和BSA-DSSM复合物则表现出一定程度的氧化或还原敏感性。实验结果表明本发明设计的以二硫键和硫醚键连接的多烯紫杉醇-马来酰亚胺前药具有氧化还原敏感释药的特性,能对肿瘤组织特异的氧化还原环境作出响应,实现肿瘤部位特异性释药。
实施例4:三种多烯紫杉醇-马来酰亚胺前药的细胞毒性
采用MTT法考察三种多烯紫杉醇-马来酰亚胺前药对三种肿瘤细胞:人鳞状上皮癌细胞(KB-3-1),人前列腺癌细胞(PC-3-1),小鼠乳腺癌细胞(4T1)和人正常肝细胞(L02)的细胞毒性。将处于对数生长期的细胞以5×103/孔/0.1mL的1640或DMEM培养液埋于96孔板中,置培养箱中孵育24h使其贴壁。待细胞贴壁后加多烯紫杉醇或实施例1中制备的三种多烯紫杉醇-马来酰亚胺前药。每孔加入100μL含药溶液,每个浓度3个平行孔,置培养箱中孵育。培养48h和72h后,取出96孔板,每孔加入20μL的5mg/mL MTT溶液,培养箱中孵育4h,甩板,将96孔板倒扣于滤纸中充分吸干残留液体,每孔加入200μL DMSO于振荡器中振荡10min,酶标仪测定各孔570nm处的吸光度。
MTT结果如图7所示,与多烯紫杉醇溶液剂相比,三种多烯紫杉醇-马来酰亚胺前药的体外细胞毒性均存在一定程度的降低。其中DSSM和DSM两种敏感键连接的前药细胞毒性相当,均较强,以酯键连接的DM前药细胞毒性较弱。另在图8中展现了DTX和这三种前药在不同细胞中细胞毒的结果,实验结果表明,DSSM和DSM这两种敏感键连接的前药可明显区分肿瘤细胞和正常细胞,连接键对肿瘤部位氧化还原环境的敏感程度很高。而以酯键连接的DM前药因在ROS和还原环境弱的正常细胞中不能及时释放出母药,故对正常细胞的细胞毒性很弱。本发明设计的这两种氧化还原敏感前药能对肿瘤部位特异的氧化还原环境作出响应,实现肿瘤部位特异性释药,提高多烯紫杉醇的抗肿瘤效果并降低对机体的毒副作用。
实施例5:三种多烯紫杉醇-马来酰亚胺前药的药代动力学研究
取20只健康、雄性SD大鼠,体重200-250g,随机分为4组,给药前禁食12h,自由饮水。分别静脉注射多烯紫杉醇溶液剂(泰索帝),实施例1中合成的三种多烯紫杉醇-马来酰亚胺前药溶液剂,多烯紫杉醇的剂量为5mg/kg。于规定的时间点眼眶取血,分离获得血浆,于-20℃冰箱中冷冻保存,液质联用法测定血浆中的药物浓度。
结果如图9表明,与多烯紫杉醇溶液剂相比,各前药组明显延长了药物在血浆中的循环时间,药时曲线下面积明显增加,具有长循环作用,可能是因为各前药静注进入体循环后,利用结构中的马来酰亚胺结构迅速与血浆白蛋白结合,在体循环中以白蛋白-前药复合物的形式存在,故明显提高了药物稳定性,延长了药物在血液中的循环时间。
实施例6:三种多烯紫杉醇-马来酰亚胺前药的组织分布实验
将小鼠乳腺癌细胞悬液(4T1,1x106cells/100μL)接种于BABL/C小鼠右侧腋下,待肿瘤体积生长至200mm3,将荷瘤小鼠随机分为4组,每组12只,尾静脉注射给药:DTX溶液,DSSM溶液,DSM溶液和DM溶液,给药剂量为8mg/kg。分别在12h,24h,48h和72h后,将小鼠处死,分离出主要器官(心,肝,脾,肺,肾)和肿瘤,称重,用生理盐水匀浆,于-20℃冰箱中冷冻保存,液质联用法测定不同组织中的药物浓度。
结果如图10所示,与DTX和DM溶液组相比,DSSM和DSM溶液组在肿瘤组织的药物浓度明显增加,在正常组织中释放出的药物却很少,与细胞毒结果一致,说明由氧化还原敏感键连接的前药可以在肿瘤组织快速释放出母药发挥作用,对肿瘤组织和其他正常组织有很高的选择性,进而实现增效减毒的作用。
实施例7:三种多烯紫杉醇-马来酰亚胺前药的体内抗肿瘤实验
将小鼠乳腺癌细胞悬液(4T1,1x106cells/100μL)接种于BABL/C小鼠右侧腋下,待肿瘤体积生长至150-200mm3,将荷瘤小鼠随机分为5组,每组6只:空白对照组(PBS),DTX组,DSSM组,DSM组合DM组,给药剂量为8mg/kg,每隔1d给药1次,连续给药5次。给药后,每天观察小鼠的存活状态,称体重,测量肿瘤体积。给药后11天将小鼠处死,获取器官和肿瘤,称瘤重,并对重要器官和组织进行HE染色进行进一步分析评价。
结果如图11所示,与空白对照组相比,各给药组均表现出了一定的抗肿瘤作用。且以酯键连接的前药DM组与多烯紫杉醇溶液剂组相比没有明显优势,但由敏感键连接的DSSM和DSM组则能明显抑制肿瘤生长。给药11天以后,DSM组的肿瘤体积约为120mm3,而DSSM组的肿瘤仅为60mm3左右。抗肿瘤效果与体外释放结果和细胞毒性结果保持一致,敏感键连接的前药对肿瘤部位氧化还原的敏感程度较高,多烯紫杉醇很容易实现肿瘤部位特异性释药,相应的抗肿瘤效果好。如图12所示,除去多烯紫杉醇溶液剂组,其他前药组小鼠体重并没有明显变化。另图13所示,HE染色结果表明PBS组明显发生了肿瘤的肝肺转移,而前药组则没有,且DSSM和DSM组肿瘤组织大面积坏死,以上结果说明合成的多烯紫杉醇-马来酰亚胺前药在具有明显抗肿瘤效果的同时,没有对机体造成显著的非特异性毒性,是安全有效的抗肿瘤药物传递系统。
- 还没有人留言评论。精彩留言会获得点赞!
- 低介电常数树脂基材用处理铜箔及使用该处理铜箔的覆铜层压板以及印刷配线板的制造方法与工艺
- 含有色酮结构的吡唑类N‐对溴苯基马来酰亚胺衍生物及其制备方法与应用与制造工艺
- 一种双吲哚马来酰亚胺生物碱HD‑ZWM288在制备抗肿瘤微管抑制剂药物的应用的制造方法与工艺
- 马来酰亚胺膜的制造方法与工艺
- 多孔性酰亚胺系树脂膜制造系统、隔膜、及多孔性酰亚胺系树脂膜制造方法与制造工艺
- 聚苯并噁嗪前体及其制备方法与制造工艺
- 含酰亚胺结构的环三磷腈无卤阻燃剂、制备方法及用途与制造工艺
- 开关型硫醇荧光标记试剂及其合成方法和应用与制造工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 3-(6-溴-4-氧-4H-色酮)-1-苯基-5-对甲氧基苯基-1,6a-二氢吡咯啉[3,4-c]吡唑-4,6 ...的制作方法
- 含有色酮结构的吡唑类n-苯基马来酰亚胺衍生物及其制备方法与应用
- 含有色酮结构的吡唑类n-对甲苯基马来酰亚胺衍生物及其制备方法与应用
- 一种马来酰亚胺丙酰哌嗪七甲川菁盐荧光载体及其制备方法和应用
- 一种利用固体酸催化剂制备n-苯基马来酰亚胺的方法
- 一种n-(取代苯基)马来酰亚胺接枝埃洛石纳米管的制备方法
- 3-(6-溴-4-氧-4H-色酮)-1-苯基-5-对氯苯基-1,6a-二氢吡咯啉[3,4-c]吡唑-4,6(3aH ...的制作方法
- 一种4-(3-氰苄基)苯基乙酰亚胺的合成方法
- 马来酰亚胺封端的含硫聚合物、其组合物及其用图
- 一种提高n-苯基马来酰亚胺收率的方法