一种基于核酸的纳米药物载体的构建方法与流程
本发明涉及一种基于核酸的纳米药物载体的构建方法。
背景技术:
纳米载体作为一种重要的纳米材料,以其优良的穿透运载性能以及药物可控制释放能力,在生物医学领域上具有广阔的应用前景,其中最重要方向之一就是抗肿瘤靶向缓释药物的开发。
设计药物输送系统旨在解决药物靶向性问题,很多化学药物在体外里取得很好的治疗效果,但在人体内却效果不明显,原因在于这些药物缺乏靶向性以及在人体内环境中缺乏稳定性,需要开发特殊的药物运输技术来克服如溶解度低,生物体内不稳定,生物利用度低以及对正常组织潜在的生物毒性等问题,良好的药物运输系统是解决问题的关键所在,其核心便是具有靶向性的药物载体的设计。
目前纳米药物载体研究领域的核心问题主要集中为以下三个方面:
1、如何提高药物的生物利用率。当今人类开发的药物中约有40%是不溶于水的,而动物体内的循环系统主要基于水相的,非水溶性药物较难在其中进行均匀的扩散,进而造成生物利用率的降低。以抗肿瘤药物紫杉醇为例,目前常用的方法主要是使用脂质体对其进行包裹,通过对其粒径的控制,使之能够在体内形成乳浊液保证其随血液运输时具有较好的流动性与分散性。
但是此种方法在实际应用中依然存在明显的问题,虽然利用脂质体对药物进行包裹,可以利用其与细胞磷脂双分子层亲和性,促使细胞发生胞吞,提高药物的生物利用率,但是由于无法做到靶向递送,非目标区域生物组织的生物毒性也将明显加剧。
2、如何维持装载药物的稳定释放。在临床治疗中,需要保证药物能够在一定时间内在病灶部位维持足够的浓度,目前常利用多聚乙烯乙二醇(PEG)、聚乙烯亚胺(PEI)等聚合物,与药物分子共价连接或自身组装形成聚合物保护层,进而包裹药物使其在体内不被快速代谢或清除,避免被网状内皮系统吞噬,并持续稳定的释放,以达到长时间血液循环的目的。
虽然共聚物的包裹可以促使药物安全稳定的转运与缓慢释放,但是由于共聚物单体所具有的生物激素类似性,以及其在体内降解程度与降解周期的不确定性,导致此类方法的生物安全性亦存在潜在的隐患。
3、如何实现药物的靶向运输。实现药物的靶向运输,是规避药物对正常组织造成细胞毒性的有效方式之一,目前主要通行方法是,利用特异性适体、抗体/抗原等具有靶向识别能力的组件对纳米载体表面进行修饰,修饰后的载体能克服药物在体内输送过程中遇到的各种生理屏障,将药物送到靶位并实现缓慢释放,对于蛋白质等半衰期短的生物活性分子,由于载体的隔离作用,可克服体内的物理化学屏障,防止药物在达到靶标部位前被降解。
此种方法便捷可行,但是由于分子间握手识别的不确定性,时常会有脱靶现象的发生,进而导致装载药物的提前释放引起局部正常组织坏死等不良反应的发生,同时此类靶向方法往往不能应对靶标细胞的耐药性变异,若靶标消失则不能做出正常的药物递送,亦无法更好的满足肿瘤晚期扩散以及发病初期特异性表达低时的治疗要求。
技术实现要素:
本发明所解决的技术问题在于提供一种利用生物体中所大量存在的、生物相容性良好的核酸为材料,通过对DNA的折纸结构,建立了一种新的纳米药物载体平台,兼具常规脂质体包裹亲和性好的优点,以及共聚物结构缓慢释放的稳定性与适体识别的靶向作用性,同时解决了脂质体缺乏靶向性,共聚物的生物安全性以及适体识别作用单一的问题。
本发明所解决的技术问题采用以下技术方案来实现:一种基于核酸的纳米药物载体的构建方法,基于DNA折纸结构的设计原理,以控制互补碱基间的配对情况为基础,设计了核酸纳米载体结构,其主体为6组相互缠绕为双螺旋的柱状刚性结构(分别由序列GJ1、GJ2、GJ3、GJ4、GJ5、GJ6,6条核酸序列两两相互螺旋杂交形成,其结合状态如图2中所示),中间为直径1.8-2nm的贯穿柱状孔洞,载体的两端被锁状核酸单链(lock1、lock3)封堵,其中的一端的封堵序列lock3的一部分为靶标适体mRNA的互补序列,通过动态光散射测得的载体的整体长度为40±4.3nm。当细胞中存在靶标适体mRNA时,由于靶标 mRNA与lock3的配对碱基数远大于lock3与载体基本结构端口的结合数,致使发生熵取代过程,使载体的一端被打开,载体内部的药物得以释放出来。同时由于肿瘤细胞内的偏酸性环境,当载体的一端打开后,刚性结构破坏,整体的稳定性降低,使之产生pH响应,整体骨架散开,失去原有的结构,致使嵌插于双链核酸结构中的小分子抗肿瘤药物得以缓慢释放出来,达到不同机理药物共同运载的作用,提升了对小分子核酸干扰类药物的装载效率。在纳米载体结构的表面,由于构成结构的核酸序列进行了羧基化修饰,故存在游离羧基,利用其与RGD环肽表面游离氨基的缩合作用,将RGD环肽修饰到结构表面,以实现纳米载体与靶标细胞的结合与促进胞吞作用的进行。
本发明的有益效果:
1、以核酸为原料,利用DNA折纸技术,创造了一种新的主动运输载体,为药物靶向运输提供新的载体方式和思路,区别于以往的脂质体装载技术缺乏靶向性以及高聚物缓释微球技术中载体微球的生物毒性。在提高生物利用率的同时增强生物安全性。
2、利用生物体中自身存在的核酸作为原材料,通过人工设计来调控碱基间的配对情况,使核酸进行立体折叠形成形貌可控折纸结构,作为药物装载的基本载体。
3、利用细胞内部特异性mRNA适体作为靶标,而非传统的细胞表面适体识别,缓解脱靶、细胞耐药性变异以及降低由识别错误导致的药物误释放,引起的局部组织坏死等问题。
4、通过表面的生物亲和环肽修饰实现纳米载体与细胞的高亲和性,在改善细胞利用率的同时,相对于脂质体更加容易控制成品的粒径,以利于生物体内的药物运输。
5、精确的进行载体尺寸控制,使药物能透过毛细血管上的空隙进入器官和组织,在靶标部位提高治疗效果并且降低体内其它组织或器官的毒副作用。
6、相对于传统的胶囊式装载,本案利用高浓度渗透,与小分子抗癌药物的核酸嵌插机理,实现了内容物装载与结构嵌插装载的双装载效力,有效的提高了载药效率。
7、载体结构内部具有均匀一致的孔道,可以实现多种符合孔径尺寸药物的混合装载,而非以往药物载体中的多分散性尺寸不一的微孔性结构,更加适合当下临床治疗中的鸡尾酒疗法的应用。
8、6股双螺旋刚性结构,能够有效的降低生物体内对载体的降解作用,同时具有pH响应的能力,当进入偏酸性的肿瘤内部后,在存在靶标mRNA的前提下,一端打开进而发生骨架解体,缓慢的释放出所嵌插其中的小分子药物。
附图说明
图1为纳米载体的整体结构图
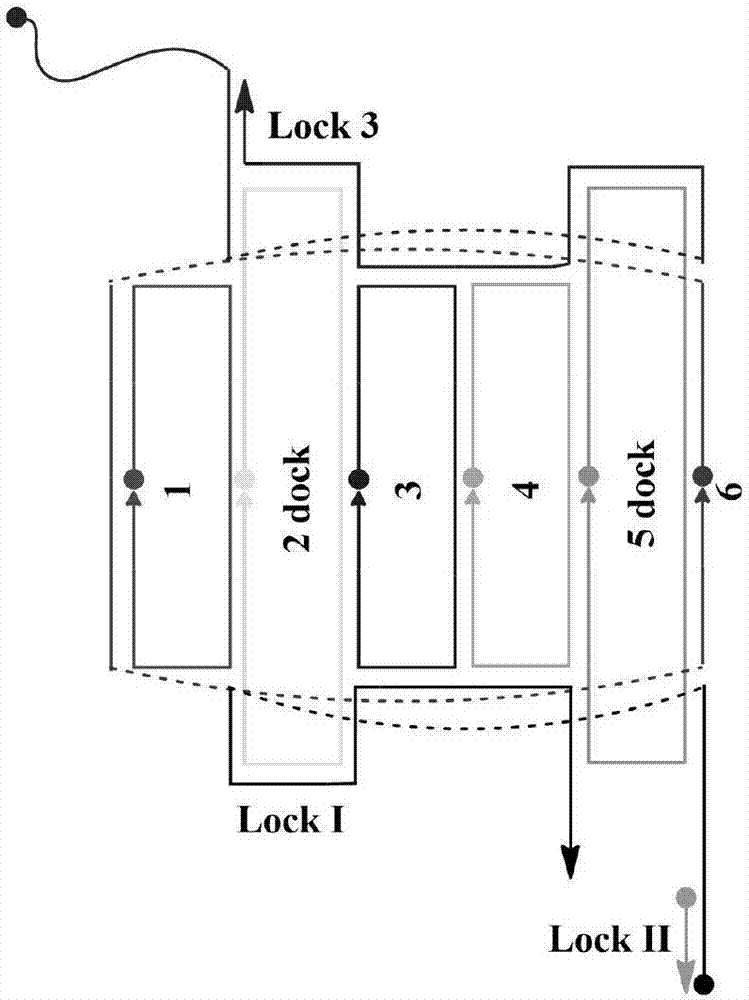
图2为纳米载体的单链核酸相互结合情况示意图
图3为载药载体运输效果的验证图
图4为载药载体表面RGD修饰的紫外表征图
图5为两种药物协同释放的荧光表征图
图6为载药载体动态光散射表征图。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体图示,进一步阐述本发明。
实施例:以装载药物荧光紫杉醇与阿霉素例;
(一)基础载体结构的构建
1、分别取10μL浓度为10μMol/L的7种核酸单链(GJ1、GJ2、GJ3、GJ4、 GJ5、GJ6、LOCK3)于小离心管中,用混匀仪混匀后置于95℃的水浴中加热4 分钟,随后取出,缓慢降温至室温后即可得到基础载体结构,将其保存于4℃环境中待用。
(二)结构表面RGD环状多肽的修饰
1、取50μL浓度为10μmol/L氨基修饰的核酸单链(MB)于离心管中,随后加入100μL浓度为0.2mol/L的NHS溶液,于室温下反应30分钟后用混匀仪混匀待用。
2、取10μL表面羧基修饰的磁珠于离心管中,加入100μL浓度为0.8 mol/L的EDC溶液,于室温下反应30分钟后用混匀仪混匀待用。
3、分别取100μL上述反应结束后的溶液于离心管中,置于摇床37℃的环境中,避光振荡反应10h后取出,使用pH=7.2的Tris-Hcl缓冲溶液磁分离洗涤三次,弃掉上清液保留磁珠,加入100μLTris-Hcl缓冲溶液用混匀仪混匀后待用。
4、取50μL步骤(一)中获得的基础载体结构于离心管中,随后加入100 μL浓度为0.8mol/L的EDC溶液,于室温下反应30分钟后用混匀仪混匀待用。
5、取50μL浓度为25μmol/L的RGD环肽溶液于离心管中,加入100μL 浓度为0.2mol/L的NHS溶液,于室温下反应30分钟后用混匀仪混匀待用。
6、分别取50μL上述反应结束后的溶液于离心管中,置于摇床37℃的环境中,避光振荡反应10h后取出,用混匀仪混匀后加入100μL之前步骤中得到的表面结合有核酸链的磁珠,于37℃的摇床中反应3小时后取出,使用pH=7.2 的Tris-Hcl缓冲溶液于15℃的水浴环境中,磁分离洗涤三次,弃掉上清液保留磁珠,加入100μLTris-Hcl缓冲溶液用混匀仪混匀后待用。
7、将上述反应结束后的溶液于60℃水浴中加热5分钟后,在50℃的水浴中磁分离三次,保留上清液于新的离心管中待用,即得到表面RGD环状多肽修饰的纳米载体结构。
(三)药物装载
1、取50μL步骤(二)中得到的,表面GD环状多肽修饰的纳米载体结构于离心管中,依次加入20μL浓度为500μM的阿霉素溶液与20μL浓度为500μM荧光基团修饰的紫杉醇溶液,于37℃的摇床中避光振荡反应12小时后取出待用,即完成药物的装载。
(四)载体末端封堵与纯化
1、向步骤(三)中得到的溶液中分别加入50μL浓度为10μmol/L核酸单链(LOCK1)、30μL浓度为10μmol/L核酸单链(LOCK2)于离心管中,再加入50μL步骤(二)中得到的表面结合有核酸链的磁珠,置于摇床中,37 ℃的条件下避光振荡反应3小时后取出。
2、将上一步中得到的溶液,加入pH=7.2的Tris-Hcl缓冲溶液于15℃的水浴环境中,磁分离洗涤三次,弃掉上清液保留磁性吸附部分,加入100 μLTris-Hcl缓冲溶液用混匀仪混匀后待用。
3、将上述反应结束后的溶液于60℃水浴中加热5分钟后,在50℃的水浴中磁分离三次,保留上清液于新的离心管中待用,即得可完成载体的封堵,得到从药液中分离提纯后的已载药载体。
(五)药物载体转染组织细胞;
1、取装载好药物的纳米载药载体30μL于离心管中,加入含血清20%的1640 培养液1ml,混合均匀后加入细胞培养皿中进行细胞培养,于37℃的培养箱中, 5%的二氧化碳条件下,混合培养3小时。
(六)药物释放与检测;
1、取出步骤(五)中培养3小时后的培养皿,弃去其中的培养液,加入新鲜的1640培养液,反复冲洗三次后,加入1ml含有20%血清的培养液待用。
2、将培养皿移至激光共聚焦显微镜下观察肿瘤细胞内荧光分布情况,以 495nm为激发光,分别收集525nm与585nm的发射光,可以观察到,其分布与抗肿瘤药物的作用机理一致,阿霉素的橙红色荧光在细胞核区域聚集,荧光紫杉醇的绿色荧光在细胞质聚集,表征其在细胞中的成功释放与药物的抗肿瘤性能良好。
3、将上一步骤的中的培养皿用pH=7.0的PBS缓冲液反复洗涤3次,然后用超声波粉碎仪器,将其中的细胞粉碎后离心,取其上清液,反复三次后,取 100μL上清液于微量比色皿中,在荧光分光光度计中,以495nm为激发波长,扫描500-700nm范围的荧光发生情况,可以观察到525nm与585nm两个发射峰,分别对应所装载的药物荧光紫杉醇与阿霉素,进一步确定其在细胞中的成功释放。
如图1所示,其中所示的FITC-PTX与DOX分别为荧光紫杉醇与阿霉素两种抗肿瘤药物,RGD为表面修饰的环肽,6条核酸单链结合成的圆柱状骨架结构,其具体结合方式为图2中所示,LOCK1为封堵核酸单链1,LOCK3为带有靶标 mRNA识别序列的封堵核酸单链2。
如图2所示,图中的1、2dock、3、4、5dock、6,分别对应序列表中的GJ1、 GJ2、GJ3、GJ4、GJ5、GJ6,各单链以相互挽手的形式与周围单链通过碱基间的互补配对形成单螺旋结构,构成纳米载体的主体柱状中空结构。
其中GJ1、GJ2、GJ3、GJ4、GJ5、GJ6、lock1、lock2、lock3和MB的核酸序列如下:
如图3所示,其中bright为显微镜明场中所示的细胞状态图,PTX-FITC为荧光紫杉醇通道中的成像图像,DOX为阿霉素通道中的成像图像,DAPI为核染试剂用以确认细胞核所在位置,Merge为上述通道的叠加图像,图中可见由于阿霉素作用于细胞核其分布与DAPI一直,故叠加后呈粉色而荧光紫杉醇分布于细胞质中,作用于微管蛋白,故周围的细胞质呈绿色荧光。
如图4所示,图中a,b,c三条曲线分别对应载体结构、单纯的RGD环肽、修饰了RGD环肽的载体结构,由图可知,核酸在280nm下有特征的紫外吸收,RGD 环肽在215有明显的吸收峰,核酸表面修饰RGD环肽后,其紫外光谱兼顾上述两者的吸收峰且出现整体蓝移。
如图5所示,图中a为空白组,b为实验组,由图可见实验组在525nm附近与 585nm附近均出现了较为强烈的特征发射峰,与荧光紫杉醇及阿霉素的发射波长一致,证明药物释放效果良好。
图6所示,图中A为纳米载体基本结构的动态光散射表征图,B为表面修饰了RGD环肽的载体动态光散射表征图,由图中所示,在修饰RGD环肽前,载体的粒径分布为20nm左右,修饰了RGD环肽后载体的粒径分布变为40nm左右,符合体系的设计预期,此粒径能够生物体内扩散运输的需求。
以上显示和描述了本发明的基本原理和主要特征及本发明的优点,本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内,本发明要求保护范围由所附的权利要求书及其等效物界定。
序列表
<110> 青岛科技大学
<120> 一种基于核酸的纳米药物载体的构建方法
<160> 10
<170> SIPOSequenceListing 1.0
<210> 1
<211> 50
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
agcgaacgtg gattttgtcc gacatcggca agctcccttt ttcgactatt 50
<210> 2
<211> 86
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
ccgatgtcgg acttcgtgcg cttttagtca cgttacacga tcttcgcctg ctgggttcga 60
gggtcttttc atcatttggg agcttg 86
<210> 3
<211> 50
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
cgaagatcgt gtttttccac agttgattgc ccttcacttt tcccagcagg 50
<210> 4
<211> 50
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
aatcaactgt ggtttttctc actggtgatt agaatgcttt tgtgaagggc 50
<210> 5
<211> 86
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
tcaccagtga gattgcacgg cttttcgacg gatttgtcgt accaggtgca tggatttacc 60
gagtttttta tcatcttgca ttctaa 86
<210> 6
<211> 50
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
cctggtacga catttttcca cgttcgctaa tagtcgattt tatccatgca 50
<210> 7
<211> 77
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
caccgatcgg tgagctcggt tgtcctggat gatgatgttt tcaaccctcg gttgtcctga 60
tgatgatgtt ttcaacc 77
<210> 8
<211> 14
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
ctcaccgatc ggtg 14
<210> 9
<211> 126
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
gggagacaag aataaacgct caagcagttg atcctttgga taccctggtt cgacaggagg 60
ctcacaacag gcgaaaatca gtgctttttt ttcgtgccga aaagctgcct ttttttttgc 120
acgcgc 126
<210> 10
<211> 11
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
ctcccttttt t 11
- 还没有人留言评论。精彩留言会获得点赞!