盐酸金刚烷胺的速释口溶膜及其制备方法和应用与流程
本发明涉及药物制剂领域,具体涉及一种盐酸金刚烷胺速释口溶膜及其制备方法和应用。
背景技术:
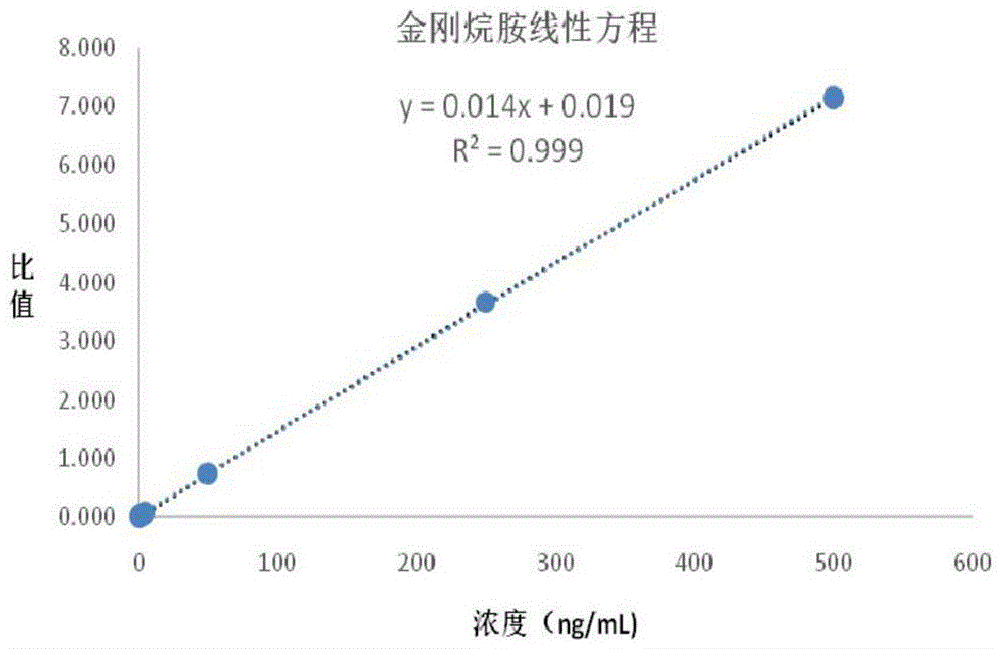
:金刚烷胺是一个抗病毒药。在1969年首次报道一位晚期帕金森病患者在预防流感过程中使用了6周的金刚烷胺。服药期间她的帕金森病症状震颤、强直和少动均得到缓解。此后许多研究均证实金刚烷胺有轻微的抗帕金森病作用。其作用机制目前尚不很清楚。研究提示金刚烷胺有下述四方面药理作用:①促进内源性多巴胺的释放,抑制突触前膜对多巴胺的再摄取,从而增加突触间隙的多巴胺含量;②抗胆碱能作用;③直接作用于多巴胺受体;以及④阻断谷氨酸兴奋性神经毒性作用,因而可能还有神经保护作用。一般而言,金刚烷胺耐受性良好,脑分布良好,有体液的再分布,并不提示心肾功能不全。金刚烷胺用于预防或治疗亚洲甲-ⅱ型流感病毒所引起的呼吸道感染。本品与灭活的甲型流感病毒疫苗合用时可促使机体产生预防性抗体。膜剂通常是指主药与成膜材料经专业的制备膜剂的方法制备而成的剂型,本专利口腔速溶膜剂,也就是我们常说的口溶膜。我国最早出现的膜剂是外用避孕药膜,之后相继出产了一些口腔膜剂,如硝酸甘油舌下膜、安定口溶膜、中药万年青普膜及利福平口腔贴膜。现如今市面上常见到的口溶膜绝大多数用于口服或者口腔粘膜的使用。口溶膜剂性有以下优点:(1)无需饮水,使用方便:在唾液中可以快速的溶解,为吞咽药物困难的人群提供了一种健康的、新型的,更加安全的用药方式。(2)迅速给药,药效加快。口溶膜部分经口腔黏膜及舌下吸收,部分进入消化道,因此在患者服用进入口腔后,很快就会被吸收,从而进入血液。(3)企业生产药物方式简单,便捷携带:膜剂的制备过程较简单,便于生产,且膜剂自身小且轻,便于运输。现有单方和复方金刚烷胺药品主要剂型有片剂和颗粒剂,经口腔给药剂型未见报道,有必要开发一种新的金刚烷胺口溶膜剂,以解决传统片剂等剂型对于禁食患者、有吞咽障碍的老人及儿童用药的用药不便,增加患者的依从性和新的用药选择。技术实现要素:针对以上技术现状,本发明提供一种盐酸金刚烷胺速释口溶膜,所述口溶膜含有盐酸金刚烷胺5~10质量份、水溶性聚合物骨架材料40~50质量份、水溶性多糖10~15质量份、增塑剂10~20质量份、填充剂10~20质量份、矫味剂0.001~0.005质量份。本发明中,作为实施方案之一,所述口溶膜含有盐酸金刚烷胺5~10质量份、水溶性聚合物骨架材料40~50质量份、水溶性多糖10-12质量份、增塑剂10-15质量份、填充剂12-14质量份、矫味剂0.001-0.005质量份。本发明中,作为实施方案之一,所述口溶膜含有盐酸金刚烷胺5~10质量份、水溶性聚合物骨架材料40~50质量份、水溶性多糖10-12质量份、增塑剂12-15质量份、填充剂12-12.5质量份、矫味剂0.001-0.005质量份。本发明中,作为实施方案之一,所述口溶膜制备前分散溶解于溶剂中的盐酸金刚烷胺及辅料的最大粒径为50-100nm的范围。本发明中,作为实施方案之一,所述水溶性聚合物骨架材料选自羟丙基甲基纤维素、羟乙基纤维素、乙基纤维素、或羧甲基纤维素钠,或它们中的两种或两种以上组合。本发明中,作为实施方案之一,所述羟丙基甲基纤维素为k4m羟丙基甲基纤维素和/或k15m羟丙基甲基纤维素。本发明中,作为实施方案之一,所述水溶性多糖选自海藻酸钠、角叉菜胶、瓜尔胶、阿拉伯胶、琼脂、黄原胶、结冷胶、阿拉伯树胶、树胶茄替胶、刺梧桐胶、西黄蓍胶或果胶,或它们中两种或两种以上组合。本发明中,作为实施方案之一,所述水溶性多糖为海藻酸钠、琼脂、或果胶,或它们中两种或两种以上组合。本发明中,作为实施方案之一,所述增塑剂选自聚乙二醇-400(peg-400)、甘油、明胶、聚环氧烷,聚乙二醇、聚丙二醇、聚乙-丙二醇、单乙酸甘油酯、二乙酸甘油酯或三乙酸甘油酯、乙酸甘油酯、聚山梨酯、鲸蜡醇、丙二醇、山梨糖醇、二乙基磺基琥珀酸钠、柠檬酸三乙酯、或柠檬酸三丁酯,或他们中的两种或两种以上组合;作为实施方案之一,所述增塑剂选自聚乙二醇-400、甘油或明胶,或它们中两种或两种以上组合。本发明中,作为实施方案之一,所述填充剂选自淀粉、蔗糖、预胶化淀粉或微晶纤维素,或它们中两种或两种以上组合物。作为实施方案之一,填充剂为淀粉,优选在填充剂中还包括增塑剂甘油,以提高淀粉材料的流动性。本发明中,作为实施方案之一,进一步含有载药基质助溶剂,所述载药基质助溶剂为无水乙醇。本发明中,作为实施方案之一,所述矫味剂由本领域技术人员根据本领域常识选自源自植物、叶、花、果实、茎及其组合的提取物或挥发油、合成香料油、矫味香料、油、液体、或油性树脂,或它们中两种或两种以上的组合。作为实施方案之一,矫味剂可选自橘子香精、薄荷油、柑橘油、桂花浸膏、草莓味香精、山梨糖醇或甘露醇,或它们中两种或两种以上组合物。本发明还提供一种盐酸金刚烷胺速释口溶膜的制备方法,该方法包括以下步骤:(1)将盐酸金刚烷胺速释口溶膜的各成分过120目筛;(2)配制载药溶液并经高压均质机高速剪切为均匀初乳,载药溶液体积为总体积的10%~15%,载药溶液包括药物、载药基质助溶剂、增塑剂、注射用水;(3)空白基质包括水溶性骨架材料、水溶性多糖、增塑剂、填充剂,向其加入70℃-90℃,优选范围75℃-88℃,最佳范围80℃-88℃(作为示例性说明为80℃、81℃、82℃、83℃、84℃、85℃、87℃、88℃)的注射用水,迅速溶剂搅拌,并过60~100目筛(作为示例性说明为60、61、62、63、64、65、70、75、80、85、90、95、100目筛);优选筛孔小于或等于0.25mm;(4)于50~60℃下物理混合载药溶液以及矫味剂;(5)在溶液温度30~40℃下进行机械涂膜,快速烘干,包装。本发明还提供一种盐酸金刚烷胺速释口溶膜在制备治疗帕金森综合征、原发性震颤麻痹、以及亚洲a-ⅱ型流感病毒引起的呼吸道症状疾病的药物中的应用。本发明盐酸金刚烷胺速释口溶膜剂型,采用亲水聚合物骨架材料可使药物迅速溶胀,快速完全释放,以达到释放速度调控加快,减少每天服药次数,提高病人对药物的依从性的效果。本口溶膜剂型无需喝水,尤其适用于禁食患者、有吞咽障碍的老人及儿童用药。本发明盐酸金刚烷胺速释口溶膜剂型采用亲水凝胶骨架材料,载药溶液高压均质工艺、高温溶解高分子基质并过滤、温度控制铺膜生产工艺,药物在8小时内缓慢释放,12小时释放完全,与相应的盐酸金刚烷片相比(中国药典2015版收录金刚烷胺片、金刚烷胺胶囊),给药频率减少一半,显著增加了患者的依从性。本发明的盐酸金刚烷胺速释口溶膜制剂质量如片重差异、脆度、稳定性等检测均符合药典规定。本发明盐酸金刚烷胺速释口溶膜的制备方法工艺简单,无需特殊生产设备,成本低廉,有利于产品的批次放大和工业化生产。附图说明图1:金刚烷胺标准曲线;图2:金刚烷胺血药浓度-时间曲线;图3:实施例3中混合标准品mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图4:实施例3中自制口溶膜1-0mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图5:实施例3中自制口溶膜1-1mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图6:实施例3中自制口溶膜1-2mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图7:实施例3中自制口溶膜1-3mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图8:实施例3中自制口溶膜1-4mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图9:实施例3中自制口溶膜1-5mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图10:实施例3中自制口溶膜1-6mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图11:实施例3中自制口溶膜1-7mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图12:实施例3中自制口溶膜1-8mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图13:实施例3中市售片剂7-0mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图14:实施例3中市售片剂7-1mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图15:实施例3中市售片剂7-2mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图16:实施例3中市售片剂7-3mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图17:实施例3中市售片剂7-4mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图18:实施例3中市售片剂7-5mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图19:实施例3中市售片剂7-6mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图20:实施例3中市售片剂7-7mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图;图21:实施例3中市售片剂7-8mrm图,岛津8050超高效液相色谱-质谱联用系统获得的液相色谱图。具体实施方式以下实施例用于进一步阐述本发明,但不以任何的方式限制本发明的有效范围。以下实施例中所使用的t-214型电子天平购自北京赛多利斯仪器系统有限公司;dh-202型恒温干燥箱购自天津市中环试验电炉有限公司。盐酸金刚原料药提取物购于上海源叶生物科技有限公司。实施例1分三组实验,分别将盐酸金刚烷胺1.5830g在研钵中研磨粉碎,过120目筛。载药溶液的制备,将原料药溶解在3ml无水乙醇中,加入peg-400,注射用水3ml,甘油1ml。载药溶解经高压均质机剪切混合,为透明溶液,无油滴产生。空白基质的配置,将羧甲基纤维素钠、羟丙基甲基纤维素k4m、乙基纤维素、淀粉物理混合,经200ml80℃注射用冲拌,搅拌,空白基质呈半透明;60目筛网过滤未溶解固体颗粒(远少于1.0g),加入甘油1ml,peg-400。温度控制在60℃,50ml空白基质预混合载药溶液,再总混和;温度控制在35摄氏度,载药基质粘稠度较高,采用流涎法铺板,干燥烘干6小时。脱片包装。以上述制备的制剂为基础处方,进行单因素考察的实验,以筛选骨架材料和增塑剂的配比。在制备过程中对溶液流动性、重量进行跟踪测量以保证膜剂要求的相应指标在可控范围内。将羧甲基纤维素钠、羟丙基甲基纤维素(k4m)(15000cps)、peg(400)、乙基纤维素四个变量按表1中的四因素三水平设计l9(3)4正交表,l9(3)4试验结果如表2所示。表1四因素三水平的因素水平表表2l9(3)4试验结果记录与计算(g)释放度以药品中盐酸金刚烷胺含量为考察对象。对1h、2h、3h、4h释放度的k值,极差r数值分析,可以得出影响盐酸金刚烷胺口溶膜释放度的各辅料的用量,确定基本处方为:羧甲基纤维素钠2.0质量份,羟丙基甲基纤维素28.5质量份,peg(400)7质量份,乙基纤维素3质量份。实施例2盐酸金刚烷胺速释口溶膜,所述组合物中以质量份计为:酸金刚烷胺5质量份、水溶性聚合物骨架材料48质量份、水溶性多糖10质量份、增塑剂13质量份、填充剂12质量份、矫味剂0.005质量份)制备方法,包括以下步骤:将盐酸金刚烷胺在研钵中研磨粉碎,过120目筛。载药溶液的制备:将原料药溶解在1.4ml无水乙醇中,加入peg-4004.3g,注射用水4.3ml,甘油1.45g。载药溶解经高压均质机剪切混合,为均匀初乳,无油滴产生。空白基质的配置:将羧甲基纤维素钠2.9g、羟丙基甲基纤维素k4m40.7g、乙基纤维素4.3g、淀粉12g、琼脂10.3g、甘露醇0.0014g和柑橘油0.0036g、物理混合,经285.7ml80℃注射用水冲拌,搅拌,空白基质呈半透明;60目筛网过滤未溶解固体颗粒(远少于1.0g),加入甘油1.45g,5.7g的peg-400。温度控制在60℃,50ml空白基质预混合载药溶液,再总混和;温度控制在35℃,载药基质粘稠度较高,采用流涎法铺板,干燥烘干6小时。脱片包装。在制备过程中对溶液流动性、重量、释放度、成膜性进行跟踪测量以保证膜剂要求的相应指标在可控范围内。(1)盐酸金刚烷胺口溶膜的释放度考察按上述盐酸金刚烷胺口溶膜的处方制备三批样品,并分别进行释放度的测量。测得的试验数据如下表3,结果表明:这三批金刚烷胺口溶膜的释放曲线趋于一致,释放效果都能达到标准,样品质量稳定,重复性好。表3三批盐酸金刚烷胺口溶膜的释放度(2)盐酸金刚烷胺口溶膜的重量差异检测:取成品盐酸金刚烷胺口溶膜20片(2cm×3cm),按照中国药典2010年版二部附录片剂重量差异检查法项下方法盐酸金刚烷胺口溶膜的测定,进行片重差异性考察。首先精密称定每一片盐酸金刚烷胺口溶膜的重量,再称定20片总重量,算得平均值,而后将每片的重量与平均值进行对比[15],得出片重差异范围,从而进行片重差异性性考察。表420片口溶膜片重差异检查表实验结论:参考中国药典,数据评判如下当平均片重在0.002g及0.002g以下时,重量差异限度为±15%,由于本实验制备的盐酸金刚烷胺口溶膜的平均片重为0.002g以下,片重范围为0.00140g-0.00166g,测量的20片药品都在此范围内,所以本实验制备的盐酸金刚烷胺口溶膜重量差异符合中国药典的规定盐酸金刚烷胺口溶膜稳定性试验。(3)盐酸金刚烷胺口溶膜的空气中试验将盐酸金刚烷胺口溶膜剪成2cm×3cm,取其5片置于平皿中放在空气中,静置7天,分别于第1天,第3天,第5天,第7天,4个时间点取样。并测定盐酸金刚烷胺口溶膜每片的溶化时限。记录结果如下:表5空气试验口溶膜溶化时限表实验结论:在空气中保存,对盐酸金刚烷胺口溶膜的溶化时限及形状影响并不大,基本无变化,但出于对药品的安全性考量,本品仍应密封保存。(4)盐酸金刚烷胺口溶膜的光照加速试验将盐酸金刚烷胺口溶膜剪成2cm×3cm,取其5片置于平皿中放在光照度为2000lx的下,静置7天,分别于第1天,第3天,第5天,第7天,4个时间点处取样。并测定盐酸金刚烷胺口溶膜每片的溶化时限。记录结果如下:表6光照加速试验口溶膜溶化时限表实验结论:在光照的条件下,随着天数的增加溶化时限呈逐渐增长趋势,且口溶膜表面出现褶皱,水分蒸发的现象,由此可知本品仍需要避光保存。(5)高温加速试验实验口溶膜溶化时限将盐酸金刚烷胺口溶膜剪成2cm×3cm,取其5片置于平皿中放在恒温60℃下,静置7天,分别于第1天,第3天,第5天,第7天,4个时间点取样。并测定盐酸金刚烷胺口溶膜每片的溶化时限。记录结果如下:表7高温加速试验实验口溶膜溶化时限表实验结论:在温度为60℃的条件下,随着天数的增加溶化时限呈逐渐增长趋势,且在第5天时,口溶膜表面干皱,水分大量蒸发,由此可知本品应低温保存。实施例3金刚烷胺口溶膜大鼠体内药动研究,包括实验一:金刚烷胺片(上市药品)单次单剂量灌胃给药在大鼠(麻醉状态下)体内药物动力学研究;实验二:金刚烷胺口溶膜(自研药品)单次单剂量给药在大鼠(麻醉状态下,贴于舌上)体内药物动力学研究。实验材料与仪器1.药品及试剂供试品:金刚烷胺片(东北制药集团沈阳第一制药有限公司;规格0.1g;批号:5161001;有效期至2019年9月);金刚烷胺口溶膜(按实施例2制备,载药量0.1g/片,实际测量平均值89.1mg/片)。对照品:金刚烷胺对照品(纯度99%,上海源叶生物科技有限公司,批号:h22d6q7829)美金刚对照品(内标)(纯度98%,上海源叶生物科技有限公司,批号:yo3j8c39151)试剂:色谱纯乙腈(fisher公司);无水甲醇(分析纯);生理盐水;肝素钠(常州千红生化制药股份有限公司);高纯氮气(北京如源如泉科技有限公司)等。2.动物wistar大鼠,20只(随机选择2只用于对照线性制备,随机选择12只用于样品测定)。动物来源:斯贝福生物科技有限公司。3.仪器岛津8050超高效液相色谱-质谱联用系统,phenomenexc18色谱柱(100mm×2.1mm,2.6μm);bt-25s电子分析天平(北京赛多利斯仪器有限公司);dzkw-4电热恒温水浴锅(北京中兴伟业仪器有限公司);kh7200db型数控超声波清洗器(昆山超声仪器有限公司);超速离心机(cp100wx,日本hitachi公司)。二、实验方法1.剂量选择设置实验一:本试验给药途径采用大鼠灌胃给药,选择10mg/kg剂量作为大鼠药动研究的给药剂量。实验二:口溶膜按0.6×1.1cm(约5.1mg/kg)口腔舌上粘贴给药。2.取血时间点大鼠给药前及给药后0.083,0.25,0.50,1,2,4,8,24h于眼眶后静脉丛取血。3.样本采集制备wistar大鼠每组6只,隔夜禁食12小时称重,10%水合氯醛溶液麻醉后(每100g0.3ml)。按体重给药,分别于给药前、及给药后不同时间取血0.5ml置肝素化具塞试管中,高速离心制备血浆,血浆-20℃冷藏备用。4.血浆样品的处理取大鼠血浆100μl,加入10μl(浓度为2μg/ml)美金刚(内标)溶液,涡旋混匀30s,加入400μl甲醇,涡旋混匀1min,离心(10000r/min)10min,取上清液40℃n2吹干,200μl甲醇复溶,过0.22μm微孔滤膜;取滤液20μl,取上清液进行lc-ms分析。5.液质分析条件分析仪器为岛津8050超高效液相色谱-质谱联用系统,包括shimadzu30ad液相系统(lc-30ad二元泵、sil-30ac自动进样器、spd-m30a二极管阵列检测器、cto-20ac柱温箱)和8050三重四级杆质谱检测器。液相分离选择phenomenexc18色谱柱(100mm×2.1mmi.d.;2.6μm)。流动相包含乙腈(a)和0.1%甲酸水(b),流速为0.4ml·min–1,等度洗脱,a:b为37:63。柱温保持在30℃,进样体积为1μl。质谱条件如下:干燥气流速,10.0l·min–1;雾化气流速,3.0l·min–1;加热器流速,10.0l·min–1;接口电压,3kv;检测器电压,1.8kv;接口加热器温度,300℃;脱溶剂管温度,250℃,加热模块温度,400℃。采用esi正离子源检测,扫描方式为多反应监测(mrm)。离子化参数包括离子对信息,q1能量、q3能量、碰撞能量和滞留时间如下表8所示。金刚烷胺和内标的lc-ms/ms优化参数表8离子化参数化合物母离子-子离子dwelltimeq1ceq3金刚烷胺152.15-135.15100-30-24-28美金刚180.20-163.20100-30-24-30实验结果1.标准曲线的线性取美金刚甲醇溶液10μl(内标,浓度:2μg/ml),置5ml试管;取100μl金刚烷胺的系列甲醇溶液(1、5、10、100、500、1000ng/ml)加入已有内标的试管;40℃水浴,n2气吹干;取空白血浆100μl,置含金刚烷胺和美金刚的试管,其余步骤按照“血浆样品的处理”项下操作,建立标准曲线表9。分别以血浆中金刚烷胺的浓度为横坐标,以金刚烷胺与内标的峰面积比为纵坐标,用加权最小二乘法(权重w=1/x2)进行回归计算,求得线性方程,即为标准曲线参见图1。表9浓度(ng/ml)化合物峰面积内标峰面积化合物/内标0.518801397640.01352.564291306960.04925106341393360.07635065830889990.73972506586481803623.6518500667526935037.1391(二)药动参数计算结果采用pkplus(软件版本:9.5.0004)软件程序进行每一个供试品的血药浓度-时间数据分析,计算药动学参数。血药浓度时间曲线如图2,采用二房室模型参数估算方法,求得药动学参数见下表10-11。注:灌胃给药剂量换算为5mg/kg。表10表11药动学参数灌胃给药(po)口溶膜给药(odf)aic(一房室)-15.8469-31.1461aic(二房室)-28.3259-32.414auc0-24/ug.h/ml1.059±0.530.884±0.16auc0-∞/ug.h/ml1.079±0.540.891±0.16mrt(平均滞留时间)/h4.371±1.845.034±0.77cmax(达峰浓度)/ng/ml261.9165tmax(达峰时间)/h0.50.25vd(分布容积)/l0.091±0.103.943±2.14cl(清除率)/l/h0.926±0.131.714±0.14t1/2α/h(吸收半衰期)1.93±0.230.064±0.05t1/2β/h(消除半衰期)3.55±0.433.661±3.11k1010.14±6.020.435±0.24k125.650±3.455.299±3.32k211.530±0.284.280±2.39药代动力学结果证实,盐酸金刚烷胺口溶膜剂的达峰浓度cmax为165ng/ml,在15分钟达峰,本盐酸金刚烷胺口溶膜剂具有达峰时间快于片剂的优点,生物利用度高的速释优势。血液分布容积为3.943±2.14l,多于片剂分布容积。盐酸金刚烷胺口溶膜剂的吸收半衰期t1/2α为0.064±0.05h,吸收时间短于盐酸金刚烷胺片剂,说明口溶膜剂利于药物吸收,吸收速度更快有利于迅速达峰。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1