组蛋白甲基转移酶EZH2抑制剂在制备治疗ARDS后肺纤维化的药物中的用途的制作方法
本发明属于生物医学领域,涉及组蛋白甲基转移酶ezh2抑制剂,具体来说是组蛋白甲基转移酶ezh2抑制剂在制备治疗ards后肺纤维化的药物中的用途。
背景技术:
急性呼吸窘迫综合征(acuterespiratorydistresssyndrome,ards)是一组涉及多学科的临床常见危重症。尽管呼吸支持治疗等危重病救治手段不断进步,ards的病死率仍高达40%左右。有资料表明,半数以上ards机械通气患者并发肺纤维化,肺损伤后的病理性修复和纤维化是ards患者死亡的独立危险因素。
迄今为止临床的治疗措施十分有限:激素治疗疗效不肯定且充满争议,其它治疗如酪氨酸激酶抑制剂、特异性针对细胞外基质及其受体的激肽等尚无明确的结果。因此如何防治ards后纤维化仍是呼吸和危重症领域内的难题,需要积极探索其分子机制,为寻找逆转纤维化的新途径和新靶点奠定基础。
技术实现要素:
针对现有技术中的上述技术问题,本发明提供了组蛋白甲基转移酶ezh2抑制剂在制备治疗ards后肺纤维化的药物中的用途,所述的这种用途要解决现有技术中ards后纤维化治疗效果不佳的技术问题。
本发明提供了组蛋白甲基转移酶ezh2抑制剂在制备治疗ards后肺纤维化的药物中的用途。
进一步的,所述的组蛋白甲基转移酶ezh2抑制剂为3-dznep。
为防治ards后肺纤维化的作用,使用3-dznep能有效减轻肺损伤,并通过作用于tgf-β/smad信号通路抑制上皮间充质转分化,进而预防和减轻肺纤维化的发生。
组蛋白甲基转移酶果蝇zeste基因增强子同源物2(ezh2)是pcg蛋白家族成员多梳抑制复合物2(polycombrepressivecomplex2,prc2)的核心组分,具有组蛋白赖氨酸转移酶活性,研究发现其在细胞的生长周期中,通过抑制相关的靶基因来调节细胞的增殖、分化。ezh2在多种肿瘤组织中高表达,具有促进细胞增殖、加速肿瘤细胞扩散的特点,并可作为相关肿瘤诊断和预后判断的一个重要生物标志物,也为肿瘤复发转移治疗提供潜在靶点和新的治疗思路。
3-dznep,化学结构式如下:
是一种腺苷的碳环类似物可选择性地降解ezh2,继而抑制h3k27me3。该复合物作为ezh2抑制剂,目前已被广泛地用于相关的体外和临床前期研究,发现其能有效抑制细胞增殖,逆转上皮间充质转分化(emt)和防治肿瘤的进展。但遗憾的是,迄今为止尚无ezh2在ards后肺纤维化中的表达及药物抑制剂对纤维化的防治作用的研究结果。
本发明通过一系列的探究发现,ards后肺纤维化小鼠肺组织ezh2表达水平明显增高,药物抑制剂3-dznep能通过作用于tgf-β/smad信号通路抑制上皮间充质转分化(emt),进而预防肺纤维化的发生;并通过调控肺泡巨噬细胞m2样极化,调控肺部微环境中巨噬细胞和肺上皮细胞的相互作用,抑制tgf-β1产生,进而抑制emt,减轻纤维化。
附图说明
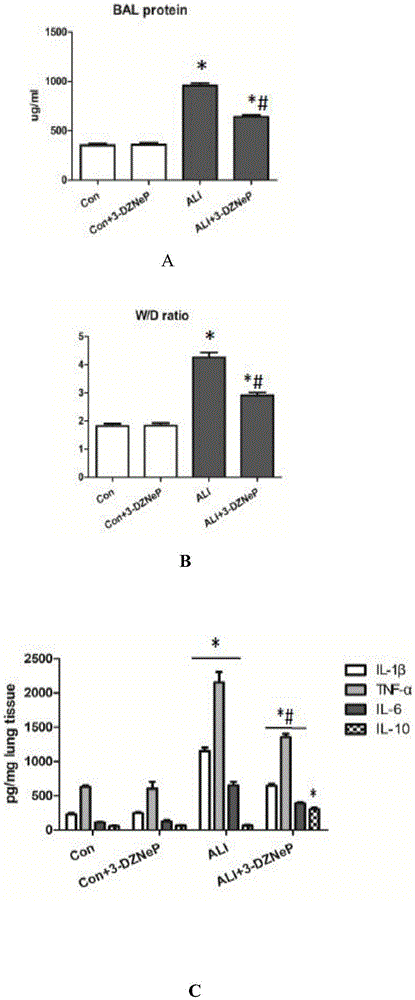
图1显示了3-dznep减轻lps诱导的肺损伤,预防纤维化的发生。
图2显示了3-dznep抑制lps诱导肺纤维化肺泡巨噬细胞m1极化,促进m2分化。
图3显示了3-dznep通过调控tgf-β/smad信号通路抑制emt,减轻肺损伤。
图4显示药物抑制剂了3-dznep对上皮标志e-cadherin、纤维增生蛋白α-sma和collageni以及tgf-β信号通路蛋白(tgf-βr1、p-smad2和smad-7)的影响。
具体实施方式
实施例1
为了评估3-dznep对ards后肺纤维化的作用及机制,首先通过lps滴鼻法建立ards小鼠模型,分为对照组,3-dznep+对照组,ards模型组(非药物干预)以及3-dznep药物干预ards组。
3-dznep组于制模前24和制模后1h腹腔注射ezh2抑制剂3-dznep1mg/kg。通过肺泡灌洗液蛋白渗漏、肺干/湿重比例以及elisa法检测促炎及抗炎细胞因子评估了解对急性肺损伤的作用;通过masson染色及测量肺组织羟基脯氨酸评估肺纤维化程度;通过蛋白质免疫印迹试验(westernblot)及逆转录酶pcr了解肺组织和支气管肺泡灌洗液中巨噬细胞的分型变化,并评估对emt及纤维化的影响。并进一步通过分离各组小鼠肺泡灌洗液中巨噬细胞,通过体外与肺上皮细胞系(mle-12)共培养,了解对emt的影响,并探索对细胞信号通路的影响。
具体实施过程如下:
一、3-dznep减轻lps诱导的肺损伤,预防纤维化的发生。
与ali模型小鼠相比,3-dznep干预组ali小鼠在lps诱导后1天检测肺泡蛋白渗漏明显减轻,肺湿/干比明显降低,肺组织损伤减轻(炎性细胞浸润减少,肺泡间隔增厚和水肿明显减低)(图1a,1b,1d)。elisa检测还发现,3-dznep干预组明显降低肺组织中il-1β,tnf-α和il-6水平,明显增加il-10水平(图1c)。
通过masson染色及半定量发现,lps诱导ali小鼠从造模后第3天开始进行性出现肺纤维化,到第14天出现明显纤维化(图1d,1f),此外还检测到羟基脯氨酸含量明显增高(图1e)。同时lps刺激后第14天组织中纤维化相关蛋白α-sma和collageni明显增高,但是上皮标志e-cadherin明显降低(图1g,1h)。而3-dznep干预组肺组织纤维化明显减轻(masson染色和羟基脯氨酸含量明显降低),纤维化标志蛋白α-sma和collageni含量明显减少,上皮标志e-cadherin明显增加(图1d-h)。此外,我们还发现与对照小鼠相比,ali组小鼠肺组织中ezh2和h3k27me3明显增加,但是3-dznep干预组明显降低其水平(图1g,1h)。
二、3-dznep抑制lps诱导肺纤维化肺泡巨噬细胞m1极化,促进m2分化。
我们采集上述各组小鼠肺泡灌洗液,分离巨噬细胞,通过逆转录pcr和蛋白质免疫印迹试验检测m1巨噬细胞表面标记蛋白inos和m2标记蛋白fizz-1和arg-1的水平。结果发现与模型组相比,3-dznep干预组小鼠肺泡灌洗液中巨噬细胞m1极化明显抑制,表现为inos含量明显降低,其相关细胞因子tnf-α,il-1β和il-6也明显降低;出现明显的m2型巨噬细胞极化,表现为fizz-1和arg-1的水平明显上升,其相关细胞因子il-10含量上调(图2a-2c,2f)。此外,我们还发现与模型组相比,m1极化相关信号通路蛋白p-stat1和socs3明显抑制,而m2极化相关信号通路蛋白p-stat6,socs1和ppar-γ明显激活(图2b,2d,2e)。
三、3-dznep通过调控tgf-β/smad信号通路抑制emt,减轻肺损伤
我们进一步通过蛋白质免疫印迹试验检测上述各组小鼠肺组织中tgf-β/smad信号通路相关分子的表达,结果发现tgf-β1,tgf-βr1,p-smad2在ali模型小鼠肺组织中明显上调,而smad-7蛋白明显降低(图3a,3b).而3-dznep干预的ali小鼠肺组织中tgf-β1,tgf-βr1,p-smad2明显降低,且部分恢复smad-7蛋白的表达(图3a,3b)。
四、3-dznep通过抑制tgf-β/smad信号通路调控体外共培养的肺泡灌洗液巨噬细胞和肺上皮细胞相互作用,减轻emt。
为了进一步了解ards肺泡微环境中巨噬细胞和肺上皮细胞的相互作用以及3-dznep的作用及机制,我们首先动态(从第1天,3天,7天到14天)检测了各组小鼠肺泡灌洗液中tgf-β1的水平,结果发现与对照组相比,ali模型组tgf-β1水平从第3天开始逐步上升,到第14天达最高峰。与模型组相比,3-dznep干预组明显抑制肺泡灌洗液中tgf-β1水平(图3c)。接着我们分离了上述4组小鼠肺泡灌洗液中巨噬细胞,然后与小鼠肺上皮细胞系mle-12细胞体外培养,结果发现3-dznep干预组巨噬细胞与肺上皮细胞培养组emt明显抑制,表现为上皮标志e-cadherin明显增加,而纤维增生蛋白α-sma和collageni含量明显减少(图3d,图4)。进一步的蛋白质免疫印迹试验发现,3-dznep干预组共培养体系中tgf-βr1,p-smad2明显下,而smad-7蛋白明显升高(图3d,图4).
综上所述,本发明发现ezh2在ards后肺纤维化小鼠模型表达增高,药物抑制剂3-dznep能明显减轻lps诱导ards小鼠肺损伤和纤维化,促进肺泡巨噬细胞m2极化,进一步通过调控tgf-β/smad信号通路抑制emt,预防肺纤维化。本发明提供ezh2抑制剂3-dznep作为ards后纤维化候选抗纤维化药物的选择。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!
- Virosaine A的四氢吡咯基和吗啉基衍生物的组合物在抗骨质疏松药物中的应用
- 鉴定嗅觉受体调节剂的方法
- 用于治疗局部晚期或转移性雌激素受体阳性乳腺癌的雌激素受体调节剂的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法
- Virosaine A的哌嗪基和咪唑基衍生物的组合物在抗骨质疏松药物中的应用
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法
- 雄激素受体调节剂的晶形的制作方法
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法