一种纳米级β‑磷酸三钙及其制备方法与流程
本发明属于骨科植入物材料领域,具体涉及纳米级β-磷酸三钙的制备方法,尤其是一种用高能球磨法制备纳米β-磷酸三钙的方法。
背景技术:
人体骨由无机物、有机物和水共同组成,无机物主要为纳米级羟基磷灰石。β-磷酸三钙(β-tricalcium phosphate,β-TCP)是最常见的一种生物活性材料,钙/磷比与羟基磷灰石接近,与骨基质的无机成分相似,且降解速度快于羟基磷灰石,可以与骨组织很好的接合,具有良好的生物相容性,目前已在临床上广泛应用。作为生物降解材料,β-TCP既可以单独制成多孔支架材料应用于各部位骨缺损的修复,也可以与有机材料复合制成高强度可降解骨科植入物材料,如螺钉、钢板等。
随着纳米科学技术在医学的应用,纳米级β-TCP材料的研制和应用也引起了国内外学者的广泛关注。纳米级β-TCP颗粒的粒径、晶粒尺寸和宽度都只限于纳米量级的水平,减少了材料的内在缺陷,同时具有纳米材料的表面效应、体积效应优势,在力学和生物学方面有很大的优越性和应用潜力。纳米级β-TCP与人体骨成分的纳米羟基磷灰石结构非常相似,十分有利与骨组织的整合,适合骨细胞爬入,且溶解性能较微米级β-TCP也有很大提高。
目前制备纳米级β-TCP的方法主要采用化学合成法,存在着工艺复杂、对场地和生产设备要求高和易掺入其他物质等缺点。
因此,本领域的技术人员致力于开发一种工艺简单、产生杂质少的纳米级β-TCP制备方法。
技术实现要素:
为实现上述目的,本发明提供了一种通过高能球磨法将微米级β-TCP颗粒加工成纳米级β-TCP颗粒的方法。
具体地,本发明提供的纳米级β-磷酸三钙的制备方法包括以下步骤:
1)准备符合外科植入物用β-TCP标准的微米级β-TCP颗粒作为原料;
2)将微米级β-TCP颗粒分散在一缩二乙二醇中,以氧化锆珠为球磨介质进行高速球磨,直至微米级β-TCP颗粒细化为纳米级颗粒;
3)离心,去除一缩二乙二醇;
4)用二氯甲烷漂洗后真空干燥。
其中,所述微米级β-TCP颗粒的粒径范围为75-100μm,所述纳米级β-TCP颗粒的粒径范围为20-160nm。
优选地,步骤2)中高速球磨的转速为1600-2000r/min,最佳为1800r/min。
优选地,步骤2)中高速球磨的时间为8-16小时,最佳为12小时。
优选地,步骤3)中离心的转速为1000-1400r/min,最佳为1200r/min,时间为12-18min,最佳为15min。
本发明制备的纳米级β-磷酸三钙可应用于聚乳酸(PLA)/纳米β-磷酸三钙复合材料的制备,制得的聚乳酸/纳米β-磷酸三钙复合材料自身具备可降解性,同时由于加入了β-TCP,使得复合材料具有良好的骨诱导性和骨传导性。
其制备方法包括以下步骤:
A)将根据本发明方法制得的纳米级β-TCP颗粒与PLA按一定比例混合,溶于有机溶剂中配制成复合溶液,浇筑并干燥成膜;
B)通过取向模压法将膜加工为具有一定形状的PLA/纳米β-TCP复合材料。
优选地,步骤A)中所述纳米级β-TCP颗粒与PLA的质量比为1:1-1:9;最佳地,所述纳米级β-TCP颗粒与PLA的质量比为3:7;所述有机溶剂为二氯甲烷。
优选地,步骤A)中配制溶液的步骤包括搅拌和超声混合;所述浇筑的步骤为将复合溶液倒入平底玻璃皿中;所述干燥为真空干燥。
优选地,步骤B)中所述模压法的具体步骤为:取步骤A)获得的PLA/纳米β-TCP膜在100-120℃,250-270MPa下熔融压制成型;较佳的压制形状为圆柱形。
上述高强度复合材料作为骨科内固定材料既可提供力学支撑,在骨折愈合后材料又可自行降解,无需二次手术取出,可通过机器的切削加工工艺,将复合材料棒材制备成骨科内固定植入物,如钢板、螺钉、融合器等,具有良好的临床应用前景。
本发明制备的纳米级β-磷酸三钙还可进一步应用于聚乳酸(PLA)/纳米β-磷酸三钙复合多孔支架的制备,制得的复合多孔支架具有合适的孔径、孔隙率、力学性能以及成骨活性。
其制备方法包括以下步骤:
a)称取一定量的PLA溶于二氧六环中配成PLA溶液,另称取由本发明方法制得的纳米级β-TCP颗粒加入PLA溶液中,超声分散并搅拌均匀;
b)将溶液倒入特制聚四氟乙烯模具中后,液氮淬冷;
c)置于-20~-40℃的低温冰箱中冷冻20~28小时,再置入-60~-50℃冷冻干燥器中干燥;
d)从模具中取出,洗净,常温干燥后得到PLA/纳米β-TCP复合多孔支架。
优选地,步骤a)中所述PLA溶液的浓度为1.2~1.8wt%,超声分散的时间为30~50分钟;加入纳米级β-TCP颗粒后,溶液中纳米级β-TCP颗粒与PLA的质量比为1:1-1:9,最佳地,所述纳米级β-TCP颗粒与PLA的质量比为3:7。
优选地,步骤c)中在冷冻干燥器中的干燥时间为20~28小时。
优选地,步骤d)中洗净采用蒸馏水洗净。
本发明利用球磨机的高速转动和强烈的撞击和研磨作用,将外科植入用微米级β-TCP晶粒细化为纳米级β-TCP晶粒,所用原料为微米级β-TCP,其本身化学和结晶性质符合外科植入物用β-磷酸三钙的标准,加工的过程中不涉及化学合成、沉淀反应等,不易混入其他化学物质;且步骤简单,加工后的颗粒除粒径改变外,化学和结晶性质未发生变化,保证了β-TCP的纯度和安全性,获得的纳米级β-TCP颗粒可作为生物降解材料,β-TCP既可以单独制成多孔支架材料应用于各部位骨缺损的修复,也可以与有机材料复合制成高强度可降解骨科植入物材料,如螺钉、钢板等。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
图1是透射电镜中观察到的制备的纳米级β-TCP颗粒;
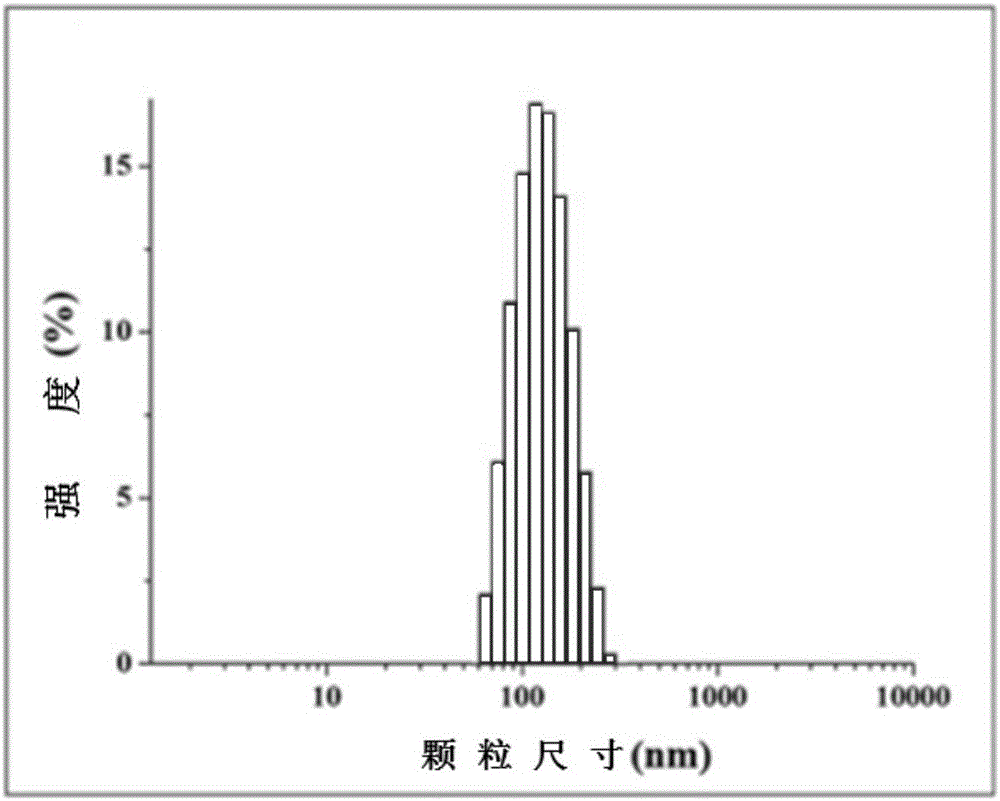
图2是动态光散射测得的纳米级β-TCP粒径分布;
图3是圆柱形聚乳酸/纳米β-磷酸三钙复合材料棒材的热压加工示意图;
图4是不同β-TCP含量材料随降解时间的压缩强度变化图;
图5是不同β-TCP含量材料随降解时间的抗弯强度变化图;
图6是不同β-TCP含量材料对成纤维细胞细胞活性的影响;
图7是透射电镜中观察到的不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架的孔径;
图8是不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架的孔隙率随降解变化的统计图;
图9是不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架的压缩强度随降解变化的统计图;
图10是不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架载rhBMP-2后植入兔背部肌肉内后分别在2、4、8周观察到的组织切片图;
图11是不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架载rhBMP-2后植入兔背部肌肉内后分别在第4和8周的成骨面积的统计图。
具体实施方式
实施例1纳米级β-磷酸三钙的制备
1)准备符合外科植入物用β-TCP标准的微米级β-TCP颗粒作为原料;
2)将微米级β-TCP颗粒分散在一缩二乙二醇分散液中,以氧化锆珠为球磨介质,以1800r/min的转速连续球磨12小时;
3)离心,去除一缩二乙二醇分散液;
4)用二氯甲烷漂洗后真空干燥,然后保存。
实施例2透射电镜和动态光散射分析验证
通过H-7000透射电镜观察实施例1制得的β-TCP颗粒粒径,采用的加速电压为75KV。通过动态光散射测试所制得的β-TCP颗粒粒径。Zetasizer Nano-ZS型电位及粒度测定仪测定聚合物药物的粒径和Zeta电势。粒径测定参数:He-Ne激光(波长635nm),折光率和粘度分别为n=1.333和η=0.933cp,测定温度25℃。电势测定参数:He-Ne激光(波长635nm),散射角θ=14°,测定温度25℃。
通过TEM观察制备的纳米级β-TCP颗粒,颗粒呈不规则形态,粒径范围为20-160nm(如图1A,B)。通过动态光散射观察发现制备的纳米级β-TCP颗粒在液体中粒径均匀分布,平均粒径为125nm(如图2)。
实施例3聚乳酸/纳米β-磷酸三钙复合材料的制备
1)根据需要按比例称量纳米级β-TCP颗粒与PLA,其中β-TCP的含量分别为10wt%、30wt%、50wt%,用二氯甲烷配制成复合溶液,搅拌并超声混合均匀后获得PLA/纳米β-TCP复合物溶液,将该溶液倒入平底玻璃皿中,并真空干燥,即得PLA/纳米β-TCP复合物膜;
2)取PLA/纳米β-TCP复合物膜,在110℃、260MPa下熔融压制成10×20mm(底面直径×高)的圆柱形型坯,热压成型(热压加工示意图如图3所示,其中1为复合物膜,其余为加工模具),快速冷却,脱模,即可制得不同配比的高强度PLA/纳米β-TCP复合材料的棒材。
实施例4不同β-TCP含量材料的力学性能测定
本实施例对实施例3中不同β-TCP含量材料(0wt%、10wt%、30wt%、50wt%)的力学性能进行了测定。
图4所示为纯PLA、β-TCP含量10wt%(P10)、β-TCP含量30wt%(P30)、β-TCP含量50wt%(P50)的各材料在PBS溶液中分别降解15、20、25、30周后的压缩强度性能变化,从图中可见含50wt%β-TCP的复合材料初始压缩强度最好,其次为含30wt%,再次为10wt%,三种复合材料的初始压缩强度均高于纯PLA材料。随着降解进行,压缩强度下降,至降解25周后复合材料的压缩强度才接近或低于纯PLA。
图5所示为上述四组材料在PBS溶液中分别降解15、20、25、30周后的抗弯强度性能变化,从图中可见β-TCP含量为50wt%的复合材料初始抗弯强度最差,而含30wt%β-TCP的复合材料在第30周时仍有较好的抗弯强度,与纯PLA接近。
实施例5不同β-TCP含量材料的生物相容性测定
本实施例对不同β-TCP含量材料(0wt%、10wt%、30wt%、50wt%)的生物相容性进行了测定,用上述各组材料配制的溶液对(L929)成纤维细胞进行了细胞活力的MTT实验,溶液的孵育时间为5天。
实验结果如图6所示,1mg/ml浓度的纯PLA对细胞产生的毒性最大,而1mg/ml浓度的三种复合材料的细胞毒性都小于PLA组,而0.1mg/ml与0.01mg/ml各组的毒性都很小与对照组无显著差异,且复合材料组的毒性也都小于PLA组的毒性,可见PLA/纳米β-TCP复合材料的生物相容性非常好。
实施例6聚乳酸/纳米β-磷酸三钙复合多孔支架的制备
1)精密称取一定量的PLA溶于二氧六环中,配成1.5wt%的PLA溶液,另分别根据PLA质量称量1:9、3:7及5:5质量比(PLA:纳米级β-TCP)的纳米级β-TCP颗粒,同法称量3:7质量比(PLA:微米级β-TCP)的微米级β-TCP颗粒,分别加入已配比的PLA溶液中,低速搅拌混匀一分钟,使其混合均匀,超声分散40分钟,搅拌均匀;
2)将溶液倒入特制聚四氟乙烯模具(底面直径11mm,高度22mm)后液氮淬冷;
3)将步骤2)淬冷后的聚四氟乙烯模具置于-30℃的低温冰箱中冷冻24小时,再置入-55℃冷冻干燥器中干燥1天;
4)从模具中取出放入烧杯中,用蒸馏水洗净后,常温干燥得到PLA多孔支架,纳米β-TCP含量分别为10wt%、30wt%、50wt%的PLA/纳米β-TCP复合多孔支架,及含30wt%微米级β-TCP颗粒的PLA复合多孔支架。
实施例7不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架的孔径,以及在PBS溶液中降解8周、26周的电镜观察测定
观察结果如图7所示,图中PLA表示纯PLA组,PLA/10nmβ-TCP表示纳米β-TCP含量为10wt%组,PLA/30μmβ-TCP表示微米β-TCP含量为30wt%组,以此类推,图中的标尺为300μm。从图中可知降解前各组支架孔径形态均一,纯PLA多孔支架孔壁光滑,而复合材料组孔壁则有β-TCP附着。降解前8周各组多孔支架孔形态均无明显变化,而在26周时部分支架孔壁降解,小孔径孔壁融合形成大孔。PLA/50nmβ-TCP组多孔支架降解最为明显,其次为PLA/30nmβ-TCP组和PLA/10nmβ-TCP组。此外PLA/30nmβ-TCP多孔支架降解快于PLA/10μmβ-TCP组。
实施例8不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架在PBS溶液中降解26周的孔隙率变化测定
测定结果如图8所示,降解前所有组的多孔支架的孔隙率无明显差异,均在73~74%,β-TCP含量不影响支架的孔隙率。降解过程中各组支架孔隙率都呈增加趋势,而7周后PLA/50nmβ-TCP组孔隙率增加最为显著,明显快于PLA/10nmβ-TCP组多孔支架和PLA/30nmβ-TCP组多孔支架。在26周降解过程中PLA/30nmβ-TCP组和PLA/30μmβ-TCP组多孔支架孔隙率无明显差异。
实施例9不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架的压缩强度随降解时间的变化测定
测定结果如图9所示,在26周降解过程中,各组支架的压缩强度均呈下降趋势,纳米级β-TCP含量直接影响支架的初始力学性能。其中PLA/30nmβ-TCP组多孔支架在降解16周后压缩强度仍接近1.0MPa,而降解过程中PLA/30nmβ-TCP组多孔支架和PLA/30μmβ-TCP多孔支架的压缩强度并无显著差异。
实施例10不同粒径β-TCP颗粒和不同纳米β-TCP含量复合多孔支架的成骨活性测定
分别将以上5种多孔支架载rhBMP-2后植入兔背部肌肉内,分别于术后2、4、8周取出植入的多孔支架用于组织学观察(HE染色、骨钙素免疫组化),结果如图10所示,30wt%和50wt%纳米β-TCP组的成骨效率最高。
然后还统计分析了成骨面积,结果如图11所示(a、b、c、d分别表示成骨面积大小与PLA组、PLA/10nmβ-TCP组、PLA/30μmβ-TCP组、PLA/30nmβ-TCP组多孔材料差异有统计学意义),第4周取出的各组支架均可观察到一定数量新骨生成,其中PLA/30μmβ-TCP组、PLA/30nmβ-TCP组和PLA/50nmβ-TCP组新生骨量显著多于纯PLA支架组和PLA/10nmβ-TCP支架组。第8周时,PLA/30nmβ-TCP支架成骨面积约为32.4±1.6%,显著高于PLA/30μmβ-TCP多孔支架组(24.3±0.5%)、PLA/10nmβ-TCP多孔支架组(21.3±1.2%)和纯PLA支架组(9.2±1.1%)(p<0.05),而PLA/30nmβ-TCP多孔支架组与PLA/50nmβ-TCP(33.2±1.5)多孔支架组成骨面积差异无统计学意义。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!