作为电极材料的纳米粒子装饰的纳米结构化材料及其获得方法与流程
对相关申请的交叉引用本申请要求2008年9月8日提交的美国临时申请No.61/095,090的优先权,各自的内容出于各种目的全文经此引用并入本文。
技术领域:
本发明涉及电化学领域,特别涉及电化学电容器的电化学。
背景技术:
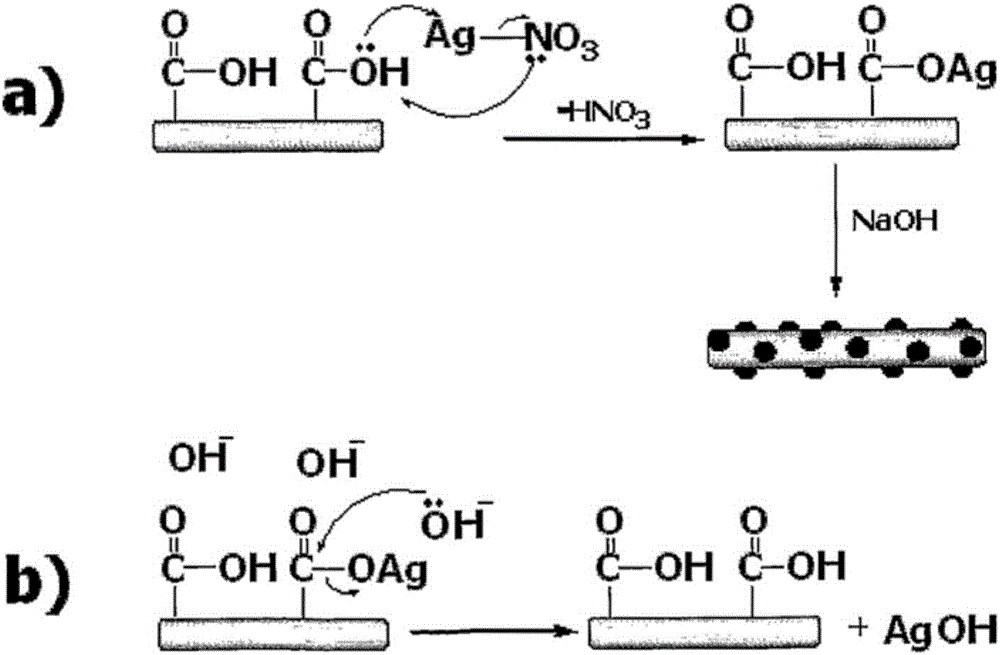
:电化学电容器也被称作超级电容器(supercapacitors)或超电容器(ultracapacitors),其功率密度(~10kW/kg)的量级高于常规蓄电池,代表电荷存储器件的重要领域。除优异的能量和功率密度外,超级电容器还提供了非常高的充电-放电速率和长周期寿命(>104个周期,与此相比,锂电池为<103个周期)的优点,这使它们成为从高负荷电动汽车解决方案到用于集成绿色能源利用和存储用途的光伏系统的多种用途的有吸引力的选择。尽管常规超级电容器包含金属电荷收集器和无定形碳致能的双电层(EDL),碳纳米管(CNTs)已由于它们的高电导率/热导率、化学稳定性、低质量密度和大表面积而作为超级电容器和Li离子电池的电极材料被研究。加入作为CNT网络的单层集电极和活性材料产生了轻型挠性电荷存储器件,其也有机会用于卷到卷印刷工艺。这种“印刷能(printedpower)”解决方案如今致力于解决可能与例如射频识别标签(RFIDs)、可佩戴电子产品和大面积显示器的背板之类的用途整合的带有印刷超级电容器的印刷电子产品的部署中的临界间隙。但是,已认识到,归因于电极-电解质的器件内阻或管间(CNT-CNT)接触电阻尤其可能限制超级电容器的功率密度和充电-放电能力。克服这种接触电阻的已知策略包括用导电聚合物或纳米结构化材料(包括无定形碳)涂覆。因此,需要提供适用于超级电容器和其它能荷存储装置的电极材料,它可克服上文提到的至少一些问题。发明概要第一方面,本发明涉及纳米结构化材料,其包含与其表面结合的纳米粒子。该纳米结构化材料包含与表面结合的纳米粒子,其中该纳米粒子具有大约20纳米的最大尺寸。此外,该纳米结构化材料包含具有大约2纳米至大约5微米的最大尺寸的孔。结合在纳米结构化材料表面上的纳米粒子可以是贵金属纳米粒子或金属氧化物纳米粒子或其混合物。这些材料在本文中也被称作纳米粒子装饰的纳米结构化材料。另一方面,本发明涉及制造纳米粒子装饰的纳米结构化材料的方法。该方法包括:将多孔纳米结构化材料与包含贵金属纳米粒子前体或金属氧化物纳米粒子前体的溶液混合,以获得纳米结构化材料与包含贵金属纳米粒子前体或金属氧化物纳米粒子前体的溶液的悬浮液。在进一步步骤中,该方法包括下述步骤:在等于或小于80℃的温度将所述贵金属纳米粒子前体或金属氧化物纳米粒子前体化学还原,以使得纳米粒子沉淀在所述纳米结构化材料表面。本发明还涉及通过本文所述的方法获得的纳米粒子装饰的纳米结构化材料。本发明进一步涉及纳米粒子装饰的纳米结构化材料的用途,用于制造电极。附图简述在联系非限制性实施例和附图考虑时,参照详述可更好地理解本发明。图1公开了制造纳米粒子装饰的纳米结构化材料的方法的一般原理。如图1中所示,将纳米结构化材料与包含金属粒子前体的溶液混合,所述纳米结构化材料包含结合在其表面上的连接剂。在≤80℃的温度将所述前体化学还原的步骤中,形成纳米粒子,并且该纳米粒子通过与连接剂结合而沉淀在所述纳米结构化材料的表面上。图2显示了为(a)在SWCNTs的羧基上沉积银纳米晶和(b)在高pH下氢氧化银从SWCNTs表面解析而提出的反应机制。图3显示Ag-CNT(银装饰的碳纳米管)的TEM图像,其中Ag纳米粒子粒度为(a)大约13纳米,(b)大约4纳米和(c)大约3纳米。图3(a)和3(b)中的图像与图4(b)和4(c)中的相同(比例尺100纳米)。图4(a)显示了使用银装饰的碳纳米管作为第二电极材料和碳纳米管作为第一电极的超级电容器的实验电池组装件的示意图(CNT/Ag-CNT网络)。图4(b)显示了直径大约13纳米的Ag纳米粒子装饰的CNTs(Ag-CNT)(比例尺100纳米);图4(c)显示了具有大约4纳米的Ag纳米粒子直径的Ag-CNT(比例尺100纳米)。图4(d)显示了4纳米Ag-CNT的高分辨率TEM图像(比例尺5纳米),而图4(e)显示了含13纳米Ag-CNT电极、7纳米Ag-CNT电极、4纳米Ag-CNT电极、1纳米Ag-CNT电极和与CNT混合的2%Ag(Ag+CNT)电极的CNT超级电容器的循环伏安图。图4(f)显示了相应的超级电容器的恒电流充电-放电曲线。图5显示了通过本文所述的方法获得的并与纳米结构化材料表面结合的MnO2纳米片的TEM图像。比例尺100纳米。图6显示了通过本文所述的方法获得的并用于如本文所述的金属纳米粒子装饰的TiO2纳米管的TEM图像。比例尺100纳米。图7显示了不同的金属前体浓度(在这种情况下为AgNO3)对纳米结构化材料的银装饰的影响。(a)在0.15M(Ag-CNT6)下形成大的胶体银簇,和(b)在0.05M(AgCNT2)下平均尺寸为1纳米。图8是显示AgCNT6的金属银反射的XRD曲线。图9(a)1纳米Ag-CNT和CNT器件的循环伏安图,其清楚显示对于在1MH3PO4液体电解质中的1纳米Ag-CNT观察到的氧化还原峰,图9(b)显示在实验部分中提到的所有超级电容器的能量密度和功率密度曲线。图10是显示对图4中已提到的超级电容器测得的内阻和薄层电阻的条形图。图11(a)显示了Nyquist阻抗曲线。图11(a)中的插图显示高频率、低阻抗区,(b)CNT、13纳米Ag-CNT、7纳米Ag-CNT和2%Ag-CNT器件的等效电路模型,(c)4纳米Ag-CNT和1纳米Ag-CNT器件的等效电路模型。图12(a)是结合(装饰)在纳米结构化材料(例如CNT)表面上的1纳米银粒子的图示,和所提供的图解管内的势垒(管内阻)的相应能量图,与较小的金属纳米粒子或金属氧化物纳米粒子(例如AgNP。<5nm,实线)相比,对较大的金属纳米粒子或金属氧化物纳米粒子(例如AgNP,>20纳米AgNP,虚线)装饰的CNT而言,所述势垒较深。图12(b)显示导致形成肖特基势垒的金属和半导体CNT结的能量图;和导致改进的金属与半导体纳米管之间的电荷传输(较低的管间电阻)的NP介导的势垒高度降低。图13显示了通过本文所述的方法获得的MnO2纳米花(左图)、MnO2纳米线(中图)和MnO2粉末(右图)的SEM图像。(所有图像中的比例尺为1微米)图14显示了具有与其表面结合的MnO2纳米粒子的单壁碳纳米管的TEM图像。纳米粒子的平均粒度为大约1至10纳米。(左图和右图显示相同结构,但放大率不同;左图比例尺100纳米,右图比例尺20纳米)。图15至17显示了MnO2的不同纳米结构与MnO2粉末的BET表面积的测量(图15:MnO2纳米花;图16:MnO2纳米线;图17:MnO2粉末)。图18和19显示了对MnO2纳米花(图18)和MnO2纳米线(图19)收集的XRD图。图18和19表明,纳米花实际上由MnO2相构成。图18是表明形成MnO2的定性证据。图19的结果是使用Rietveld精修获得的。Rietveld精修是MnO2结构的定量晶体学分析。可以从Rietveld精修中得出该结晶粉末的确切组成。图20显示了在20mVs-1测得的含CNT和MnO2装饰的CNT电极的超级电容器的循环伏安图,该MnO2装饰的CNT具有105F/g的略高于CNT电极(~90F/g)的电容。发明详述第一方面,本发明涉及纳米结构化材料,其包含与其表面结合的纳米粒子。纳米粒子与纳米结构化材料表面结合的这种材料在本文中也被称作装饰的或金属纳米粒子装饰的纳米结构化材料。所有与表面结合的纳米粒子都具有大约20纳米的最大尺寸。该纳米结构化材料包含具有大约2纳米至大约5微米的最大尺寸的孔,且该纳米粒子包括但不限于贵金属纳米粒子、金属氧化物纳米粒子或其混合物。装饰的纳米结构化材料经证实是用于诸如电化学电容器和电池之类的器件的有效的双功能电荷收集器和电极材料。包含装饰的纳米结构化材料的器件表现出提高的能量密度和功率密度。纳米粒子可以由贵金属制成。贵金属包括银、钯、金、铂、铱、锇、铑和钌。在一个实施方案中,可以使用银、钯、金、铂、其混合物或其合金。仅举若干实例,贵金属合金的实例包括铂和铱、Pd-Pt、Pd-Rh、Pd-Pt-Rh、银或金与钙的合金。贵金属合金例如用于获得抗蚀电极材料。在另一实施方案中,纳米粒子可以由过渡金属氧化物或氧化铝制成。此类氧化物的实例包括,但不限于,PtO2、V2O3、V2O5、Nb2O5、NiO2·xH2O、LiCoO2、LiFeO2、LiMn2O3、Li2MoO4、Li2TiO3、MnO2、Ag-MnO2、Al2O3、MoO3、TiO2、SiO2、ZnO2、SnO2、Fe2O3、NiO、Co3O4、CoO、Nb2O5、W2O3、其混合物和合金。所述金属氧化物可以是化学计量的或非化学计量的(例如Men-xOm-y,0<x<1;0<y<1;1≤n≤3;1≤m≤5)。在本文中证实,被粒度为大约0.5纳米至大约20纳米的纳米粒子装饰的纳米结构化材料最适合作为不同器件(例如超级电容器、传感器、混合电化学器件、锂离子电池或金属-空气电池,如Zn-空气电池)的电极材料。由于纳米粒子的维度并非总是规则的,即完美球形的,上述粒度是指纳米粒子在任何方向上的最大尺寸。在另一些实施方案中,纳米粒子的粒度为大约0.5至15纳米,或大约0.5至12,或大约0.5至5纳米,或大约5纳米至大约12纳米,或大约5至大约15纳米,或大约0.5至13纳米。此外,在一个实施方案中,本文所述的方法能够制造具有非常窄的粒度分布的纳米粒子。例如,在一个实施方案中,粒度为大约≥12至20纳米的纳米粒子的纳米粒子粒度分布为大约±5。粒度为大约≥5至<12纳米的纳米粒子的纳米粒子粒度分布为大约±3纳米。粒度为大约2至<5纳米的纳米粒子的纳米粒子粒度分布为大约±1纳米。例如,粒度为1纳米的银纳米粒子估计由大约31个银原子构成。较小的纳米粒子具有不堵塞纳米结构化材料的孔并因此不降低纳米结构化材料的表面积的优点。高表面积会提高装饰的纳米结构化材料的电容。因此,根据纳米粒子的粒度,纳米结构化材料的孔为大孔或中孔。根据IUPAC定义,大孔被认为是尺寸为大约>50纳米至大约5微米的孔,而中孔具有大约2纳米至大约50纳米的尺寸。由于多孔结构,纳米结构化材料具有高表面积。纳米结构化材料可以以至少大约50平方米/克的大表面积为特征。在一个实施方案中,纳米结构化材料的表面积为大约100或200或300平方米/克。纳米结构化材料可以由可用在本文提到的用途中的任何材料制成。仅举几个实例,该纳米结构化材料可以由碳材料、陶瓷、玻璃(例如钠钙玻璃、硼硅玻璃、丙烯酸玻璃)、白云母薄片(白云母)、氮氧化铝、金属(例如钛)、金属氧化物、聚吡咯制成,或是由不同的前述材料制成的纳米结构化材料的混合物。在一个实施方案中,纳米结构化材料由碳材料制成。碳材料的实例包括但不限于活性炭、炭黑和石墨烯。在一个实例中,纳米结构化材料由TiO2制成,例如TiO2纳米管,而在另一实例中,使用碳纳米管,例如单壁碳纳米管(SWCNT)。纳米结构化材料是指尺寸在纳米范围内的材料。在一个实施方案中,纳米结构化材料的至少一个维度小于100纳米。在另一实施方案中,纳米结构化材料具有通常1至100纳米(其中10埃=1纳米=1/1000微米)的尺寸。纳米结构化材料可以分成下列维度类型:0维(OD):纳米球形粒子(也称作纳米粒子);一维(ID):纳米杆、纳米线(也称作纳米纤维)和纳米管;和二维(2D):纳米片、纳米花、纳米圆盘和纳米膜。纳米结构化材料的纳米结构可以包括但不限于纳米管、纳米花、纳米线(也称作纳米纤维)、纳米片、纳米粒子、纳米圆盘、纳米膜和前述纳米结构的组合(例如纳米管和纳米线的混合物)。纳米管可以是单壁(SWNT)或双壁(DWNT)或多壁纳米管(MWNT)。单壁纳米管可以由直径大约0.7至大约10或20纳米或直径<20或<2纳米的圆柱片划定。它们可以为数微米长,即至少1微米或至少2微米或大约1微米至5微米。双壁或多壁纳米管由一个紧密插入另一个的多个圆柱体构成。在一个实施方案中,纳米管由碳制成,并可以以单壁碳纳米管(SWCNT)、双壁碳纳米管(DWCNT)或多壁碳纳米管(MWCNT)的形式使用。单壁碳纳米管可以被描述为卷成中空圆柱形的石墨平面(所谓的石墨烯)薄片,以使该结构为轴对称的一维结构并大致表现出螺旋构象,被称作手性。例如,使用碳纳米管作为电极材料可提供至少或大约2000S/cm的高电导率,这对电子传输而言是重要的。此外,可以将碳纳米管薄层制成透明电极,并由此提供在可见光和红外波长范围内的透明度。同时,碳纳米管层提供良好的机械和热性质并可制成挠性的。碳纳米管也是可溶液加工的,并因此与制造用的印刷技术相容。与纳米结构化材料表面结合的纳米粒子经由连接剂而化学结合或固定到纳米结构化材料上。连接剂是将纳米结构化材料的表面与纳米粒子连接的分子。连接剂包含官能团,例如羟基,芘,酯,硫醇,胺或羧基。也可以使用前述类别的不同连接剂的混合物将纳米粒子与纳米结构化材料表面连接。合适的连接剂的实例可包括但不限于紫菜碱(包含胺基团)或聚乙二醇(PEG;也称作聚(环氧乙烷))(包含-OH基团)。在一个实施方案中,在连接剂中可包含羧基,该连接剂包括但不限于甲酸、乙酸、丙酸、丁酸、戊酸、己酸、环烷羧酸或苯甲酸。一个实例包括4-氨基苯甲酸。此外,在连接剂中可包含羟基,该连接剂包括但不限于磷酸或磺酸。使用这些连接剂将纳米粒子与纳米结构化材料表面连接可提高器件能量密度,并降低内阻。在例如如图3中所示纳米粒子均匀分布在纳米结构化材料表面上的情况下,可以获得进一步改进。均匀分布还意味着纳米粒子不像图7(a)中所示的那样形成分离的簇。因此,在一个实施方案中,纳米粒子均匀分布在纳米结构化材料的表面上。在一个实施方案中,大约5%至大约80%的纳米结构化材料表面被纳米粒子覆盖。在另一实施方案中,至少30%或40%或50%或60%被纳米粒子覆盖。在一个实施方案中,使用银装饰的单壁碳纳米管。在另一些实施方案中,使用MnO2装饰的MnO2纳米片、纳米线或纳米花。上述装饰的纳米结构化材料可以被成型为膜,该膜可用作电极材料。其可用作例如超级电容器、传感器、混合电化学器件、可充电电池(例如锂离子电池或金属空气电池,例如锌空气电池)的电极材料。电化学电容器(ECs)常被称作“超级电容器”,是具有高度可逆的电荷存储和传输能力的电器。常规电容器由导电箔和干隔膜构成,而超级电容器通过使用特殊电极和电解质来跨界到电池技术中。电化学电容器与电池的不同之处在于它们不在电极结构中发生的氧化还原反应中存储能量。电化学电容器通过在电极和电解质界面区(也被称作双层)中发生的静电相互作用来存储能量。ECs具有与蓄电池互补的性质。这种EC可以由基于本文中提到的装饰的纳米结构材料的电极和电解质构成。ECs可以使用液态或固态的水性和非水电解质。本文中描述了包含装饰的纳米结构化材料的超级电容器。该装饰的纳米结构化材料可用于超级电容器的一个电极或两个电极。在一个实施方案中,使用银装饰的碳纳米管作为电极材料。混合电化学器件是混合电化学电容器(HEC),其中一个电极来自电池(通常为Li离子电池),另一个来自超级电容器。电容器的电极可以由本文提到的装饰的纳米结构化材料制成。可充电电池包含两个电极,电解质位于它们之间。电解质可以是液体电解质或凝胶状聚合电解质。仅举若干实例,可充电电池的实例包括汞、镍-镉、镍-铁、镍-氢、镍-金属氢化物、镍-锌、锂离子、锂-锰、锂-聚合物、锂-铁-磷酸盐、锂-硫、锂-钛酸盐或银-锌电池。例如,锂离子电池常用于消费电子产品,例如用于便携电子产品,其具有最佳能量重量比、无记忆效应和不使用时的缓慢电荷损失之一。锂离子电池的电极由轻型锂和碳制成。可以将碳电极换成本文提到的装饰的纳米结构化材料。装饰的纳米结构化材料也可用在金属空气电池中。金属/空气电池以高能量密度、稳定放电电压和长贮存寿命为特征。在金属/空气电池中,反应性阳极和空气电极产生无穷无尽的阴极反应物。阳极中的安时容量以及反应产物的操作和存储决定了容量限。存在一次、备用以及电和机械可充电的金属/空气电池。尽管机械可充电电池很像一次电池,但电可充电类型需要用于释放氧的第三或双功能电极。金属空气电池的实例包括但不限于锌-空气电池、锂-空气电池和铝-空气电池。类似于锂离子电池,金属-空气电池通常还使用由碳质材料制成的电极。这种碳电极可以换成本文提到的装饰的纳米结构化材料。例如,锌-空气电池的阴极可以由本文提到的装饰的纳米结构化材料构成。这种阴极与电解质层直接电接触。阳极是通过电解质层与阴极隔开的锌阳极,由此形成挠性锌-空气电池。另一方面,本发明涉及制造(纳米粒子)装饰的纳米结构化材料的方法。该方法在第一步骤中包括将多孔纳米结构化材料与包含贵金属纳米粒子前体或金属氧化物纳米粒子前体的溶液混合,以获得纳米结构化材料与包含贵金属纳米粒子前体或金属氧化物纳米粒子前体的溶液的悬浮液。在进一步步骤中,在等于或小于80℃的温度将所述贵金属纳米粒子前体和/或金属氧化物纳米粒子前体化学还原,以使纳米粒子沉淀在所述纳米结构化材料的表面上。图1显示了该方法的一个实施方案。在使用贵金属纳米粒子前体的一个实施方案中,化学还原步骤的温度低于60℃或低于50℃。在另一实施方案中,该温度为大约15℃至约30℃,或大约15℃至25℃,或大约0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃或低于60℃。如上所述,纳米粒子的较小粒度特别有利。因此,调节上述方法的反应条件,以形成具有大约20纳米的最大尺寸或粒度、或大约0.5纳米至大约20纳米的粒度、或本文提到的任何其它粒度的纳米粒子。调节反应条件以形成具有所示粒度的纳米粒子的一个选项是调节所述悬浮液中、即纳米结构化材料和贵金属纳米粒子前体或金属氧化物纳米粒子前体的混合物中的贵金属纳米粒子前体或金属氧化物纳米粒子前体的浓度。通常,前体材料的浓度可以为大约0.001M至大约1M。在一个实施方案中,贵金属前体材料的浓度范围为大约0.01M至大约1M,而在另一实施方案中,金属氧化物前体材料的浓度范围可以为大约0.001M至大约0.1M。可以通过下列任一方法实现化学还原。可以例如通过调节包含纳米结构化材料和贵金属纳米粒子前体或金属氧化物纳米粒子前体的悬浮液中的pH来实现化学还原。化学还原的另一方法是通过在还原气氛中加热所述悬浮液,例如在5%H2/N2或5%H2/Ar气氛中在<500℃的温度加热所述悬浮液4至8小时;或使用化学还原剂,例如硼氢化钠(NaBH4)或其它金属氢化物,例如CaH2或MgH2。在一个实施方案中,调节包含纳米结构化材料和贵金属纳米粒子前体或金属氧化物纳米粒子前体的悬浮液的pH,以通过将pH调节在大约1至10、或3至10、或4至10的范围内来实现纳米粒子前体的化学还原。在另一实施方案中,该pH可以为大约1至7.5和1至10。例如,在使用银纳米粒子前体材料的情况下,调节pH以在大约4至8或大约4.3至<7.3的范围内。在使用金纳米粒子前体的另一实例中,调节pH以在大约3至10、或3.5至10、或4至10的范围内。在使用铂纳米粒子前体的情况下,调节pH以在大约4至10或大约4至9的范围内。在使用金属氧化物纳米粒子前体(例如锰纳米粒子前体)的情况下,调节pH以在大约1至7的范围内。因此,在调节pH的情况下,使用还原剂(例如酸或碱)实现化学还原。仅举若干实例而言,实例包括,但不限于NaOH、NH3、HCl、HClO4、H2SO4。通常可以使用任何已知的酸或碱调节悬浮液的pH。纳米结构材料与纳米粒子前体的反应时间或培养时间也影响所形成的纳米粒子的粒度。通常,反应时间为大约5或10或15分钟至大约120分钟。在另一实施方案中,反应时间为大约15分钟至大约60分钟。可影响所形成的纳米粒子的粒度的另一因素是与纳米结构化材料混合之前起始溶液中的纳米粒子前体的浓度。在一个实施方案中,纳米粒子前体的浓度为大约3mM至大约150mM,或至少3mM,或大约3mM至大约6.5或6.3mM,或大约3mM至大约100mM或低于150mM。本文所述的方法能够制造装饰的纳米结构化材料,其中结合到该纳米结构化材料表面上的纳米粒子具有如上文已进一步概述的窄粒度范围。上述材料所用的纳米粒子前体材料是本领域中已知的。仅举若干实例,前体材料的不同实例包括金属氯化物,例如贵金属氯化物;金属硝酸盐,例如贵金属硝酸盐,金属醇盐,有机金属前体或金属乙酸盐。贵金属纳米粒子前体和金属氧化物纳米粒子前体的实例包括,但不限于AgNO3、[Ag(NH3)2]+(水)(即[Ag(NH3)2]+(aq))、AuCl3、HAuCl4·3H2O、H2PtCl6·6H2O、H2PdCl6·6H2O、Mn(NO3)2或KMnO4。例如,TiO2纳米粒子的前体可以是金属醇盐或有机金属前体。醇钛的实例包括但不限于甲醇钛、乙醇钛、异丙醇钛、丙醇钛和丁醇钛。通常,金属纳米粒子前体与纳米结构化材料的摩尔比可以为大约0.05至大约0.6,或大约0.1至大约0.55。在一个实施方案中,贵金属纳米粒子前体(例如银纳米粒子前体)与纳米结构化材料的摩尔比为0.18至大约0.54。在另一实施方案中,金属氧化物纳米粒子前体与纳米结构化材料的摩尔比为大约0.1至大约0.5。在与纳米粒子前体混合之前,将纳米结构化材料以大约0.1至大约1毫克/毫升的浓度分散在适于各纳米结构化材料的溶剂中。这些溶剂是本领域中已知的。例如,碳纳米结构化材料或MnO2纳米结构化材料容易溶解在水溶液中,例如水中。本文中可用的其它合适的溶剂包括醇,例如乙醇,异丙醇,乙二醇,和丙酮。本文所述方法中所用的纳米结构化材料应包含固定在其表面的连接剂。可以对不含或仅很少量含有这种连接剂的纳米结构化材料(例如碳纳米管)进行处理,以引入固定在纳米结构化材料表面上的连接剂。不含或仅很少量含有这种连接剂的纳米结构被称作“原始”纳米结构化材料。用于引入连接剂的这些处理是本领域中已知的,并可包括例如将纳米结构化材料暴露在氧化处理中,或在<500℃的温度烧结,或在无机极性溶剂中回流,或等离子体处理,例如N2或H2或O2等离子体处理。在另一实施方案中,使用γ射线辐射对纳米结构化材料(例如碳纳米管)进行处理,并然后使经过γ辐射的纳米结构化材料与不饱和羧酸接触。γ射线可以在纳米结构化材料的表面产生自由基,该自由基容易与不饱和羧酸反应,形成固定或结合在该纳米结构化材料表面上的连接剂分子。该不饱和羧酸可以是不饱和羧酸或其衍生物。为避免纳米粒子与纳米结构化材料之间的距离太大,形成连接剂分子的不饱和羧酸包含等于或小于12个C原子。在一个实施方案中,所述不饱和羧酸是丙烯酸或其衍生物。可用的丙烯酸或其衍生物的实例包括但不限于丙烯酸、甲基丙烯酸、甲基丙烯酸甲酯、乙基丙烯酸、α-氯丙烯酸、α-氰基丙烯酸、β甲基-丙烯酸(巴豆酸)、α-苯基丙烯酸、山梨酸、α-氯山梨酸、当归酸、肉桂酸、对氯肉桂酸、衣康酸、柠康酸、甲基反丁烯二酸、戊烯二酸、乌头酸、马来酸、富马酸或tricarboxyethylene。如图2中所示,在化学还原过程中形成的纳米粒子在沉淀过程中与连接剂结合。在图2中所示的实施方案中,使用AgNO3作为贵金属纳米粒子前体,使用HNO3将其化学还原,由此形成Ag,Ag经由连接剂的羧基与纳米结构化材料结合。在另一实施方案中,使用KMnO4作为金属氧化物纳米粒子前体,其被还原成MnO2纳米粒子,并也经由连接剂与纳米结构化材料结合。为了制造由本文所述的装饰的纳米结构化材料制成的膜,可以洗涤该装饰的纳米结构化材料,并然后通过滤膜筛分。然后,可以以自立膜的形式从过滤膜上剥离由装饰的纳米结构化材料形成的膜,并可以直接将其用作电极材料。也可以在将装饰的纳米结构化材料经过滤膜筛分以获得电极材料之前将其与要用在电极材料中的其它组分混合。例如,可以将装饰的纳米结构化材料与未处理和/或未氧化的纳米结构化材料混合。未氧化的或原始的纳米结构化材料是指尚未经预处理(如上文提到的氧化处理、烧结、回流或等离子体处理)的材料。另一方面,本发明涉及通过本文所述方法获得的纳米粒子装饰的纳米结构化材料,或通过本文所述方法制成的电极膜。该纳米粒子装饰的纳米结构化材料可用于制造电极,例如超级电容器、或传感器、或混合电化学器件、或可充电电池、或金属-空气电池的电极。例如,在用于传感器时,装饰的纳米结构化材料可用作传感器或传感器的传感材料。本文举例描述的本发明可以合适地在不存在本文中未明确公开的任何要素、限制的情况下实施。因此,例如,术语“包含”、“包括”、“含有”等应可扩展且非限制性地解读。另外,本文所用的术语和措辞作为描述性而非限制性术语使用,在此类术语和措辞的使用中无意排除所示和所述特征或其部分的任何对等物,而是要认识到,各种修改可能在要求保护的本发明的范围内。因此,应该理解的是,尽管已通过优选实施方案和任选特征明确公开了本发明,但本领域技术人员可采取本公开中具体化的发明的修改和变动,且此类修改和变动被认为在本发明的范围内。在本文中已经宽泛和笼统地描述了本发明。落在类属公开内的各个更窄种类和亚类也构成本发明的一部分。这包括带有从该类属中排除任何对象的但书或否定性限制的本发明的类属描述,无论在本文中是否明确列举了所排除的材料。另一些实施方案在下述权利要求和非限制性实施例内。此外,当就马库什群而言描述本发明的特征或方面时,本领域技术人员会认识到,也由此就该马库什群的任何独立成员或成员亚群而言描述本发明。实验部分1.金属装饰的单壁碳纳米管的合成1.1银装饰的单壁碳纳米管。为了制备银纳米粒子装饰的单壁碳纳米管,将0.08克单壁碳纳米管(P3-SWCNTs,CarbonSolutionInc.)分散在15毫升去离子水中,然后进行超声处理(120kW)20分钟。通过使用添加到100毫升AgNO3等分试样(99.99%,Aldrich)(0.1-0.15M)中的0.1MNaOH(99%,Merck)通过pH调节(4.3<pH<7.3)来控制银纳米粒子的分散。银纳米粒子前体与CNTs的摩尔比应该为0.18至0.54。将该SWCNTs悬浮液与pH调节过的AgNO3溶液混合并剧烈搅拌。通过离心(15,000rpm,10min)从母液中分离Ag装饰的SWCNTs,此后通过用去离子水多次洗涤,除去过量的Na离子和硝酸盐。然后将最终产物在使用之前再分散在去离子水中。1.2金装饰的单壁碳纳米管。将0.1MNaOH(Sigma-Aldrich)逐滴添加到20毫升3.0-6.3mMHAuCl4(HAuCl4·3H2O,AlfaAesar)(在此实施例中为4.5mM)中直至pH稳定在4至10的预定值,由此制备金储液。将SWCNTs悬浮液(0.08克在15毫升去离子水中)分散在包含金前体的溶液中(金前体与SWCNTs的摩尔比应为0.1至0.55)。将SWCNTs与金前体混合之后,溶液中的pH为大约3.5。将所得混合物在剧烈搅拌下在75℃老化30分钟,此后过滤收集载金的催化剂并用去离子水反复洗涤以除去氯化物。1.3铂装饰的单壁碳纳米管。将H2PtCl6·6H2O(3.0-6.3mM,Aldrich,在此实施例中为5mM)在去离子水中的溶液调节至合意的pH(4至9)。将SWCNTs悬浮液(0.08克在15毫升去离子水中)分散在Pt前体溶液中(Pt前体与SWCNTs的摩尔比应为0.1至0.55),然后添加甲醇(Merck)作为还原剂。将该悬浮液在75℃老化40分钟并用去离子水洗涤数次。1.4aMnO2纳米片的合成将溶液A在剧烈搅拌下添加到溶液B中,溶液A含有溶解在10毫升蒸馏水中的0.2克硝酸锰Mn(NO3)2,溶液B含有在10毫升蒸馏水中的0.5克KMnO4。将所得溶液搅拌2小时,然后转移到衬里的不锈钢高压釜中,并在140至170℃的炉中放置1至24小时以获得产物,将其用蒸馏水洗涤数次直至溶液的pH为7。将其在炉中在100℃风干24小时。通过该方法获得的纳米片显示在图5的TEM图像中。1.4bMnO2纳米花和纳米线的合成将MnSO4(8毫克/毫升)和KMnO4(20毫克/毫升)的水溶液混合,并转移到Teflon衬里的不锈钢高压釜中。然后将高压釜装入预热至140℃的炉中。反应停留时间为1至18小时不等,以针对电化学用途优化材料。通过将MnSO4和MnSO4的充分混合溶液加热1小时,如图13(左图)中所示形成MnO2纳米花。将水热反应时间进一步增至18小时,如图13(中图)中所示,形成大量个体纳米线。MnO2纳米线的直径为大约80至大约150纳米,且长度大于1微米。在140℃的停留时间后,将高压釜自然冷却至室温。将形成的棕黑色沉淀物过滤并用去离子(DI)水洗涤以除去任何未反应的原材料和在反应过程中产生的可溶副产物。将该沉淀物在空气中在100℃干燥,且在1小时后已可收集MnO2纳米花/纳米杆。图13(右图)显示粒度为2至3.5微米的市售MnO2粉末的SEM图像。图15至17显示MnO2的不同纳米结构的BET表面积的测量结果。图15显示MnO2纳米花的BET表面积测量结果。图16显示MnO2纳米线的BET表面积测量结果。图17显示MnO2粉末的BET表面积测量结果。下表1摘录了由这些测量获得的结果。表1:MnO2纳米结构和MnO2粉末的BET表面积(平方米/克)MnO2纳米花MnO2纳米线MnO2粉末BET表面积(平方米/克)10613911.5MnO2装饰的单壁纳米管(SWCNT)将溶液A在剧烈搅拌下添加到溶液B中,溶液A含有溶解在10毫升至20毫升蒸馏水中的0.2克至0.5克硝酸锰Mn(NO3)2或乙酸锰,溶液B含有在10毫升至20毫升蒸馏水中的0.5克至0.9克KMnO4。将0.05至0.2克SWCNT在搅拌和在50至80℃加热下分散在该溶液中。使用0.01MHCl或0.01至0.05MHNO3(MnO2粒子粒度/分散度随pH而变)将pH控制在1至7。将搅拌1-2小时后的所得悬浮液离心,用蒸馏水洗涤并在炉中在100℃干燥24小时。在MnO2装饰的纳米结构的另一制造方法中,将10毫克单壁碳纳米管溶解在100毫升蒸馏水中,并利用溶液的声处理混合大约30分钟。然后将该溶液的样品添加到KMnO4溶液(40毫克KMnO4在200毫升H2O中)中。将所得混合物在大约70℃的温度在pH8.5搅拌3天。在此反应过程中,随着氧化发生,KMnO4溶液的紫色消失。在培养3天结束时,过滤该溶液并洗涤,以获得MnO2装饰的SWCNT。图14显示MnO2装饰的SWCNT的TEM图像,其中与SWCNT表面结合的MnO2纳米粒子具有大约1至10纳米的平均粒度。图14中提供的图像显示相同结构,但放大率不同。图20显示在20mVs-1测得的含CNT和MnO2装饰的CNT电极的超级电容器的循环伏安图,该MnO2装饰的CNT具有105F/g的略高于CNT电极(~90F/g)的电容。1.6TiO2纳米管的合成将二氧化钛(TiO2)粉末0.5-1.0克添加到15M氢氧化物溶液中并剧烈搅拌2小时。然后将内容物转移到衬里的不锈钢高压釜中,其在炉中在170℃放置4至5天。所得分散体用0.1摩尔/升HNO3洗涤数次直至pH为7,然后在炉中在80℃干燥24小时。通过该方法获得的纳米管显示在图6的TEM图像中。使用上述方法,可以用金属纳米粒子装饰TiO2纳米管。1.7超级电容器电极的制备下面基于超级电容器所用的电极材料的制造证实金属装饰的纳米结构化材料作为电极材料的一般适用性。为了制备超级电容器电极,经过滤膜(Whatman,20纳米孔径,47毫米直径)过滤SWCNT、Ag装饰的SWCNT或MnO2装饰的SWCNT悬浮液(0.2毫克/毫升在去离子水中)。CNT截留在过滤器表面上,由此形成互连网络。在干燥后,从过滤器上剥离自立CNT网络(厚度大约20微米)并用作电极。为了比较,还制备了由2重量%Ag粉末(Sigma-Aldrich,2-3.5微米)和SWCNT构成的、通过在去离子水(0.2毫克/毫升)中将它们机械混合并经膜过滤而得到的薄膜电极。1.8聚合物电解质和超级电容器组装件的制造在50毫升去离子水中在90℃加热5克PVA单体粉末(AlfaAesar,98-99%水解,中/高分子量)直至获得清澈的凝胶状溶液,由此制备酸性聚合物电解质。然后,将3毫升H3PO4(Sigma-Aldrich,85%纯度)添加到经受连续搅拌的这种溶液中。使用真空干燥器除去该凝胶状溶液中的气泡,并将该溶液加热至60℃达4小时以除去水,并形成0.5毫米聚合物电解质膜。将其堆叠在两条Ag-CNT或MnO2-CNT网络之间(图4a),使用双面胶带将其固定到聚对苯二甲酸乙二酯(PET)基底上。该聚合物电解质也充当两个电极之间的隔膜,防止电短路但能够实现离子电荷转移。1.9结构和电化学表征使用Shimadzu衍射仪(CuKα),通过在10°至140°的2θ范围内的步进扫描(0.02°,0.6秒停留时间)收集的X-射线衍射(XRD)图表征Ag-CNTs中的银。使用在200kV电压下运行的JEOL2100F进行在高解析模式下运行的透射电子显微术(TEM)。使用双电极构造测量电容。使用计算机控制的双恒电位仪(PineInstrument,AFBP1),在0至1V的电势范围内分别以20mVs-1的扫描速率和恒电流(0.4至1mA)进行循环伏安法和恒电流充电/放电循环试验。使用阻抗谱分析器(Solatron,SI1255阻抗/晶粒相分析器;计算机软件ZView)在室温在5mV的AC振幅下,在开路电势(OCP)下从55kHz至1mHz测量AC阻抗。1.10用于纳米结构化材料的装饰的合成条件的优化研究表明,pH、反应时间和AgNO3浓度是控制SWCNT上的AgNP的分散和尺寸的主要参数。在将SWCNTs引入0.15MAgNO3溶液后,由于在纳米管上存在酸性羧基,pH如表2中所示从5.6降至3.4。表2:随着金属装饰单壁碳纳米管所用的pH和反应时间而变化的银纳米粒子特性αAgNO3溶液的pH。b添加SWCNTs后的AgNO3的pH。c添加NaOH后的悬浮液的pH。d通过TEM测定。rxn.时间=培养时间然后,被CNT上的这些基团吸附的AgNO3形成COO-Ag基团(图2)。添加NaOH溶液是控制pH以确保羟基离子量足以将Ag1逐渐还原成Ag0中的关键步骤。表2显示了随pH和反应时间而变的三种不同样品的银纳米粒子粒度。在pH4.3下(在添加NaOH后),装饰在SWCNTs上的Ag纳米粒子粒度最大,直径为大约15纳米(图3a)。随着pH提高至6.3,在相同反应时间内,Ag纳米粒子粒度显著降至6纳米(图3b)。这种现象可能归因于过量羟基离子与COO-Ag基团之间在较高pH下的反应,这促进SWCNTs上的羧基的重新形成并随之释放Ag-OH。因此,可用的成核点数量和Ag纳米粒子的生长降低。通过老化时间从120分钟降至15分钟(在相同pH条件下),Ag纳米粒子的粒度从6纳米降至3纳米(图3b和3c)。这意味着较长反应时间通过成核后的晶体生长和聚集实际上产生了较大的Ag纳米粒子。研究了AgNO3浓度的变化(0.05-0.15M,pH6,老化时间15分钟),以优化可防止形成胶体Ag簇的条件。在Ag前体超过成核和生长所需的条件时(0.15M),形成大胶体Ag簇(20-100纳米,图7a)的混合物和装饰在SWCNTs上的Ag(3纳米)。当AgNO3浓度降至0.10M时,不存在在0.15M条件下的SWCNTs上具有恒定Ag粒度的Ag簇。在0.05MAgNO3溶液条件下,实现了SWCNT表面上较低的分散和较小的银晶体粒度,1纳米(图7b)。XRD图(图8)证实在2θ=38、45、64、78和82形成了立方Ag0。1.11超级电容器电化学器件测试图4e显示了含下述电极材料的六种超级电容器类型的循环伏安图:含CNT电极的参比器件、在四种不同AgNP粒度范围内的Ag装饰的CNT:13±2纳米、7±1纳米、4±1纳米和1纳米(1至2纳米粒度范围),和2重量%Ag粉末-CNT混合物(2%Ag+CNT)。使用循环伏安法(CV;图4e)和恒电流充电和放电(GCD;图4f)方法测定所有器件的比电容,为0.03-0.24F/cm2,其中参比CNT器件表现出与文献值的良好相符性。用每电极的面积而非质量将比电容正规化,因为与液体电解质不同,聚合物电解质仅润湿电极表面,因此只有Ag-CNT电极的表面而非整个质量有助于形成双电层。致密CNT网络的比电容为0.09F/cm2,且其CV曲线显示在0.2V的峰,该峰可归因于含氧官能团,其作为赝电容贡献到总电容中。官能团、表面活性剂和由CNT合成和器件制造法产生的杂质、源自未优化的器件构造和外部器件触点的内器件和外器件电阻被认为导致偏离理想超级电容器的盒形CV特征。表3.使用CV和GCD方法为所有器件测得的比电容、内阻和薄层电阻在比较中,对于1纳米Ag-CNT和4纳米Ag-CNT,可以观察到在V=0和1V的氧化还原峰,它们也分别表现出0.24F/cm2和0.15F/cm2的明显较大的比电容。由于与固态水性电解质相比该液体电解质中所含的离子的较高迁移率,通过使用1MH3PO4液体电解质,可更清楚看出这些氧化还原峰(图9a)。出现氧化还原峰有力地表明,提高1纳米Ag-CNT和4纳米Ag-CNT器件中的电容的机制可归因于下述事实:Ag-NPs作为法拉第可逆氧化还原位点参与,以致作为赝电容贡献到总比电容中。因此,总比电容可以被视为双电层电容与赝电容的总份额;前者强烈地受表面积影响,而后者受Ag的存在影响。超级电容器的比电容(在图9b中显示为能量和功率密度)随着粒度提高而降低,4纳米Ag-CNT、7纳米Ag-CNT和13纳米Ag-CNT器件分别产生0.15F/cm2、0.09F/cm2和0.05F/cm2的值。也由使用恒电流充电和放电方法的比电容测量获得了类似观察结果,电容值(表3)反映了循环伏安结果。含较大AgNPs的器件(例如7纳米Ag-CNT和13纳米Ag-CNT器件)的比电容的降低可能归因于CNT孔被较大的AgNP堵塞,以致有效表面积降低,并因此降低双电层电容。另一方面,较小的AgNP(直径<5nm)较不可能堵塞碳纳米管的中孔,并也可能提高有效表面积,在CNT表面上产生小凸起的Ag原子簇有助于该有效表面积。1纳米AgNP估计由大约31个Ag原子构成,它们可能造成提高的有效表面积,这有助于对于1纳米Ag-CNT和4纳米Ag-CNT器件观察到的提高的电容。将2重量%Ag粒子物理混入CNT中而制备电极,其标作2%Ag+CNT器件,通过研究该器件而进一步研究Ag对赝电容的作用。记录的电容0.12F/cm2高于参比CNT、13纳米Ag-CNT和7纳米Ag-CNT器件(>5纳米AgNP),但低于4纳米Ag-CNT和1纳米Ag-CNT器件(<5纳米AgNP)。这种2%Ag+CNT器件的电容高于参比CNT器件,表明Ag粒子不堵塞CNT表面,且Ag确实通过其赝电容发挥作用。因此,前述段落中详述的观察结果可概括如下:Ag-CNT超级电容器中的比电容包括来自电双层电容的份额和来自赝电容的份额;前者主要受表面积控制,而后者强烈地受AgNPs的粒度影响。较小的AgNPs不会降低总表面积;而它们提高了赝电容,因此使得1纳米Ag-CNT与参比CNT器件相比比电容提高最多达大约150%。1.12超级电容器阻抗测试低内阻在超级电容器中非常重要,因为其是功率密度(P=V2/4R)的限制因素之一,并且也影响充电-放电周期。在超级电容器中,许多原因会影响内阻,并共同被测量和称作等效串联电阻或ESR。超级电容器的ESR的份额包括电极的薄层电阻、电极与电解质之间的界面电阻、电解质的离子电阻和外部引线接触电阻。薄层电阻是使用探针台在网络中的数个点测得的,从参比CNT器件的15.74Ωcm-2分别降至包含1纳米和4纳米AgNP的器件的10.20Ωcm-2和6.34Ωcm-2。如预期的那样,将AgNP添加到CNT网络中确实降低了薄层电阻,这可能归因于管间电阻的降低;但是,随着AgNP粒度提高,这种趋势逆转,7纳米Ag-CNT和13纳米Ag-CNT器件分别表现出6.34Ωcm-2至10.26Ωcm-2的电阻。通过由恒电流充电和放电试验(图4f)获得的内阻测量结果进一步证实了这些观察结果。从放电曲线开始时的电压(IR)降,发现CNT电极的内阻为83.2Ω。AgNP并入CNT网络使得1纳米Ag-CNT和4纳米Ag-CNT的内阻为83Ω和65Ω;但是,7纳米Ag-CNT、13纳米Ag-CNT和2%Ag+CNT器件分别表现出68Ω、160Ω和141Ω的内阻,这类似于来自薄层电阻测量的观察结果。电极的内阻和薄层电阻的结果由条形图(图10)表示,其给出关于AgNP粒度与该器件的内阻和薄层电阻的关系的更清楚综述。用AC阻抗能谱法(图11a)进一步研究AgNP对超级电容器性能和Ag-CNT电极的电化学表现的影响。交点出现在高频区中的实轴中,然后是低频区中的单个准半圆。高频区中的这种半圆可归因于(1)电极与电解质之间的界面的存在,和(2)涉及双层电容与电阻并联的RC回路的存在。在低频率下,该曲线转化成几乎垂直线,对应于多孔碳的电容响应。在超级电容器的低频率下的阻抗曲线的非垂直斜率可归因于不同的孔径分布碳和该电极内的低离子迁移率。Ag-CNT电极的等效电路涉及下述电路元件:溶液体电阻,Re;双层电容,Cd1;界面电荷转移电阻,Rct;和归因于中孔内的分布电阻的Warburg阻抗,Ws。由于活性材料和集电极合并成该器件中的单部件,因此Cb和Rb对应于电极内的电容和电阻。特别对于1纳米Ag-CNT和4纳米Ag-CNT而言,在等效电路中需要包括与赝电容对应的额外Cp元件。在图11b和11c中分别提出和显示了电路元件的组合。相应地,在不存在赝电容的情况下,CNT、13纳米Ag-CNT、7纳米Ag-CNT和2%Ag-CNT器件的等效电路的总阻抗Z如下给出:Z=Rs+RbjωRbCb+1+RctjωRctCdl+1---(1)]]>对于存在额外赝电容元件的4纳米Ag-CNT和1纳米Ag-CNT器件而言,阻抗Z公式如下表示:Z=Rs+RbjωRbCb+1+1jωCdl+jωCpjωRctCp+1---(2)]]>公式(1)和(2)与图11a中的阻抗数据一起用于评估图11b和11e中的等效电路的元件的值。表4摘录了评估值。表4.适合阻抗光谱的设备电路的分量电解质电阻为大约65Ω,与液体电解质(<10Ω)相比,其值相对较高,这主要归因于聚合物电解质内较低的离子迁移率。各Ag-CNT电极的Rct值占总电阻的主要比例,而Rb起到次要作用。电荷转移电阻Rct随AgNP粒度变小而降低,在4纳米Ag-CNT和1纳米Ag-CNT器件的情况下观察到显著降低,其中Rct为1至4Ω(表4)。这种观察结果表明,在1至5纳米粒度范围内的AgNP有效降低了CNT电极和电解质之间的电阻;而较大的AgNPs(>7纳米)可能由于堵塞CNT表面上的孔而降低电化学氧化还原动力学,从而在13纳米Ag-CNT器件的情况下产生87Ω的Rct值;明显高于参比CNT器件(大约28Ω)。随着AgNP从7降至1纳米,由阻抗分析获得的双层电容Cdl提高,这类似于来自CV测量的观察结果。4纳米Ag-CNT和1纳米Ag-CNT器件的赝电容Cp构成总电容(作为Cdl+Cp)的一部分。1纳米Ag-CNT仍具有所有器件中最高的电容,进一步证实来自CV测量结果的发现,这表明赝电容是造成<5nmAgNP器件的电容提高的重要因素。与总电阻和电容相比,Rb和Cb值(电极的贡献份额)小到可忽略(表4)。只要在金属和半导体之间形成接触以造成电荷再分布和形成包围该金属的耗尽层,就预计会发生费米能级校准。Ag装饰的CNTs也发生这种效应并产生局部耗尽区,其充当电荷散射点并在纳米管内产生潜在势垒,造成迁移率和管内电导率降低(图12(a))。可以认为,耗尽区(和潜在势垒)的深度随纳米簇中的原子数而提高,达到在5至20纳米范围内某处的最大值,超过这一值,深度可保持恒定;但是,宽度随Ag纳米粒子的覆盖率提高而提高。金属-金属和半导体管-半导体管之间的接触电阻已知可忽略不计。另一方面,半导体-金属CNTs之间的显著管间接触电阻归因于肖特基势垒的生成。另一方面,Ag纳米粒子介导的半导体-金属CNT结造成肖特基势垒降低,由此降低管间接触电阻(图12(b))。现在就Ag对管内以及管间电阻的影响论述提高的薄层电阻和内阻的观察结果。可以认为,在13纳米AgNP情况下的管内阻可能是该研究中评测的所有AgNP粒度(1纳米至13纳米)中最高的。另一方面,由于CNT表面上的Ag覆盖率,在1纳米AgNP器件的情况下,管间电阻可能最高。将AgNP添加到CNT中导致随Ag粒度降低,薄层电阻从参比器件的大约15Ωcm-2降至大约10Ωcm-2(13纳米AgNP)、大约6Ωcm-2(7和4纳米AgNP)和大约10Ωcm-2(1纳米AgNP)。13纳米和7纳米器件的薄层电阻的降低可归因于改进的管间接触,而对于较小的AgNP器件而言,由于CNTs上的Ag的降低的粒度/表面覆盖率,Ag介导的CNT-CNT接触可能性降低,1纳米AgNP-CNT的薄层电阻略微提高至大约10Ωcm-2,其仍低于参比(大约15Ωcm-2)。2%Ag-CNT器件的薄层电阻最低,为5Ωcm-2,这可能归因于大银簇和2至5微米银粒子内的可能逾渗通路。另一方面,内阻的响应除管间和管内接触电阻问题外还包括电解质效应,尽管确实表现出一定的AgNP依赖性,但其与EIS相比是最佳的;如上所述,由大AgNP堵塞孔造成的离子扩散阻力分别造成13纳米AgNP和2%Ag+CNT器件的160Ω和141Ω的高内阻。因此,总体而言,金属-装饰的纳米结构化材料已证实是超级电容器的有效电荷收集器和电极材料。通过用粒度小于大约5纳米的金属纳米粒子或金属氧化物纳米粒子(它们不堵塞纳米结构化材料的中孔,并通过法拉第反应引发的赝电容补充双层电容)装饰纳米结构化材料,可以提高器件的单位面积电容。通过添加粒度为3至8纳米的纳米粒子,也可以降低器件的内阻。AgNP的存在有助于降低CNT的管间接触电阻,并降低器件的总内阻,这对改进功率密度而言是重要的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1