一种高纯碳酸钙的制备方法与流程
本发明属于无机化工领域,具体涉及一种高纯碳酸钙的制备方法。
背景技术:
碳酸钙作为填料广泛应用于橡胶、油墨、塑料、造纸、食品、电子等领域。而细粒径、高纯度的碳酸钙能有效提高产品的填充性能和外观,是高品质碳酸钙的发展趋势。
目前生产碳酸钙的主要方法有化学沉淀法、铵盐-氨循环法,化学沉淀法是基于碳化原理,工艺过程为先煅烧石灰石或大理石原料,再加水消化得到石灰乳,在搅拌的条件下向石灰乳中通入二氧化碳碳化,得到碳酸钙沉淀,经过滤、干燥得到产品。该方法中不溶性杂质在消化过程会混入石灰乳中,造成产品纯度下降,且高温焙烧下能耗较高。
申请号为201010156418.3的中国专利公开了一种氯化铵浸出铵碳化法生产碳酸钙的物料循环利用方法。该方法采用的为铵盐-氨循环法生产碳酸钙,工艺包括如下步骤:1)粗石灰粉和氯化铵反应得到二氧化碳气体和氨水与氯化钙的混合溶液;2)步骤1)中氨水和氯化钙溶液抽滤后与同一步骤中二氧化碳反应,得到碳酸钙和氯化铵,过滤洗涤得到碳酸钙产品和氯化铵溶液,铵盐溶液进入下一个循环周期。该工艺中并未说明氯化铵浸出石灰粉的反应条件,而铵盐与碳酸钙在常压条件下几乎不发生反应,只有在高温下加热固体混合物或者通过加压来促进反应的发生,但高温下铵盐已分解或者挥发,反应难以进行,导致最终碳酸钙的产率不会太高。
此外,白云山等人(氨浸法由白云石制备高纯度碳酸钙和氧化镁[j].无机盐工业,2005,37(2):27-29)公开了一种氨浸法制备碳酸钙:将白云石煅烧后,加入氯化铵,浸出氧化钙得到钙盐和氨水的混合溶液,溶液经抽滤后通入二氧化碳气体,得到碳酸钙沉淀,过滤洗涤后得到碳酸钙产物。但该方法需要高温下煅烧碳酸钙使其分解,能耗较大,并且溶液中含有浓氨水,会污染环境,如果处理不当还会影响生产过程。
技术实现要素:
针对现有技术存在的问题,本发明提供一种高纯碳酸钙的制备方法。本发明的技术方案为:
一种高纯碳酸钙的制备方法,包括以下步骤:
(1)将碳酸钙矿石原料磨矿,分级得到-200目矿石粉末;
(2)将矿石粉末置于铵盐溶液一中减压浸出,浸出过程中用水吸收生成的二氧化碳和氨气气体得到碳酸氢铵和氨水的混合溶液;
(3)将减压浸出结束后的混合液过滤后得到钙盐溶液;
(4)将钙盐溶液与碳酸氢铵和氨水的混合溶液混合进行复分解反应,反应完成后过滤得到碳酸钙沉淀和铵盐溶液二,将碳酸钙沉淀洗涤并干燥后得到高纯碳酸钙产品,将铵盐溶液二回收套用至步骤(2)中。
进一步地,所述碳酸钙矿石原料为石灰石、大理石、方解石或者白云石中的一种。
进一步地,所述步骤(2)的减压浸出条件为:所述铵盐溶液一为硝酸铵或氯化铵溶液,浓度为2~6mol/l,所述铵盐溶液一中的铵离子与矿石粉末中的钙离子摩尔比为2~6:1,反应温度为70~95℃,反应压力为0.3~0.02atm,搅拌速度为180~600rpm,反应时间为1.5~4h。
进一步地,所述高纯碳酸钙产品的纯度≥99.5%。
本发明的原理为:
首先,将含有杂质的碳酸钙矿石原料与铵盐在加热、搅拌及减压条件下反应,反应方程式如下:
caco3+2nh4cl=cacl2+2nh3↑+co2↑+h2o[1]
caco3+2nh4no3=ca(no3)2+2nh3↑+co2↑+h2o[2]
反应[1]和[2]为可逆反应,依条件不同反应平衡进行的程度不同,在本反应条件下,随着反应生成的氨气与二氧化碳气体不断溢出并被水吸收,反应向正向进行,反应完毕恢复常压,少量残余的氨气和二氧化碳立即与氯化钙或硝酸钙逆向反应被消耗,不会带来氨气污染。此外,采用细磨、筛分选取出的-200目矿粉进行减压浸出,由于该粒度的矿粉比表面积大,能有效加快反应速率。
氨气与二氧化碳气体用水吸收,反应得到碳酸氢铵和氨水的混合溶液,反应方程式如下:
nh3+co2+h2o=nh4hco3[3]
接下来,将碳酸氢铵和氨水的混合溶液与过滤后的可溶性钙盐溶液在常温常压下发生复分解反应,过滤,洗涤得到高纯碳酸钙产品,反应方程式如下:
nh4hco3+nh3+cacl2=caco3↓+2nh4cl[4]
2nh4hco3+nh3+ca(no3)2=caco3↓+2nh4no3[5]
反应[4]和[5]在常温常压条件下的平衡常数大,能充分进行。
本发明的有益效果是:1)本发明以碳酸钙矿石和铵盐为起始原料,采用加热、减压条件强化浸出,保证碳酸钙与铵盐的反应向正向充分进行,并且工艺简单,条件温和;2)本发明的反应体系为溶液,无需高温煅烧,保证碳酸钙高产率、高纯度、高品质的同时节约能耗;3)铵盐溶液可循环使用,无挥发氨污染,环保且具有经济效益。
附图说明
图1为本发明实施例6的减压与常压条件下钙离子浓度对浸出时间的变化曲线对比图;
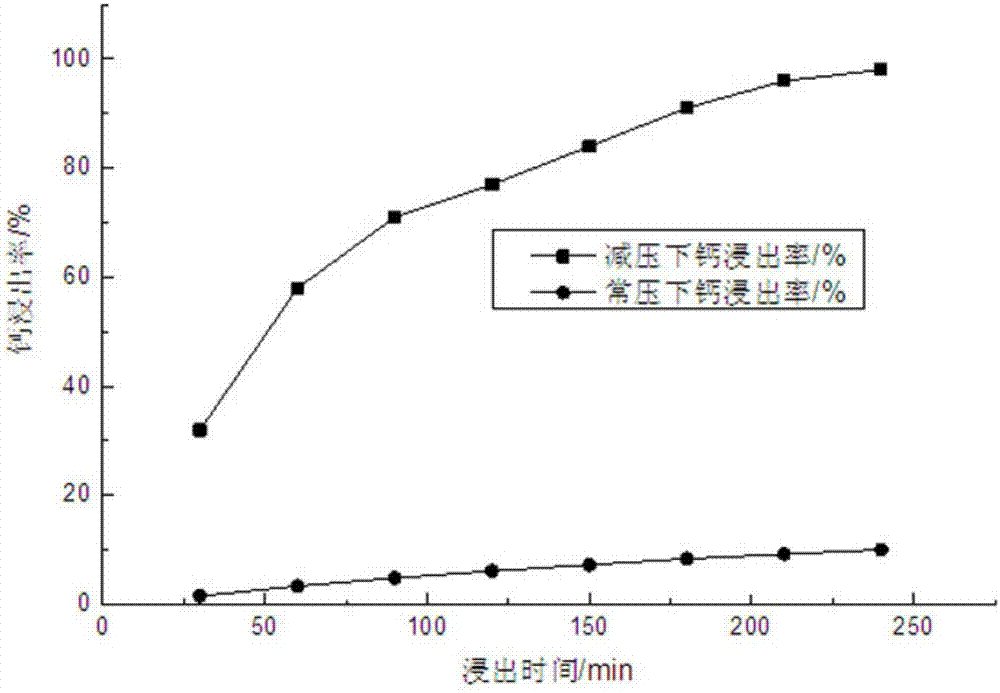
图2为本发明实施例6的减压与常压条件下钙浸出率对浸出时间的变化曲线对比图。
具体实施方式
本发明实施例采用的碳酸钙矿石原料包括石灰石,大理石,白云石,方解石,均来自河北灵寿县某矿产有限公司。
并且,在本发明的描述中,需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面结合附图和具体的实施例对本发明做进一步详细说明,所述是对本发明的解释而不是限定。
实施例1
一种高纯碳酸钙的制备方法,以石灰石为起始原料,包括以下步骤:
1)将石灰石原料磨矿,筛分,得到-200目粉末,该石灰石中caco3含量为93%;
2)称取1kg石灰石粉末加入至反应釜中,再取氯化铵2.0kg加水溶解成3mol/l的铵盐溶液一加入至反应釜中,开启搅拌,搅拌速度为300rpm,将反应釜加热至90℃,以真空泵抽负压至压强为0.1atm,浸出过程中不断补充蒸发水维持反应釜中的液面高度,蒸出的气体直接通入水中吸收,得到碳酸氢铵和氨水的混合溶液并收集,反应时间为2.5h;
3)减压浸出反应结束后将反应釜中的溶液过滤,得到氯化钙溶液;
4)将氯化钙溶液加入至收集得到的碳酸氢铵和氨水的混合溶液中进行复分解反应,反应结束后经过滤、洗涤、干燥得到碳酸钙产品0.77kg,碳酸钙回收率83%,检测白度为98.9,分散均匀;滤液回收,滤液的主要成分为氯化铵。
以edta容量法滴定本实施例制备的碳酸钙产品的纯度,为99.8%。
实施例2
一种高纯碳酸钙的制备方法,以石灰石为起始原料,并以实施例1中的回收氯化铵溶液进行实验,包括以下步骤:
1)将石灰石原料磨矿,筛分,得到-200目粉末,该石灰石中caco3含量为93%;
2)称取1kg石灰石粉末加入至反应釜中,再将实施例1步骤4)回收的氯化铵溶液(浓度为4mol/l)加入至反应釜中,开启搅拌,搅拌速度为180rpm,将反应釜加热至90℃,以真空泵抽负压至压强为0.05atm,浸出过程中不断补充蒸发水维持反应釜中的液面高度,蒸出的气体直接通入水中吸收,得到碳酸氢铵和氨水的混合溶液并收集,反应时间为2h;
3)减压浸出反应结束后将反应釜中的溶液过滤,得到氯化钙溶液;
4)将氯化钙溶液加入至收集得到的碳酸氢铵和氨水的混合溶液中进行复分解反应,反应结束后经过滤、洗涤、干燥得到碳酸钙产品0.79kg,碳酸钙回收率85%,检测白度为99.3,分散均匀,滤液回收,滤液的主要成分为氯化铵。
以edta容量法滴定本实施例制备的碳酸钙产品的纯度,为99.7%。
实施例3
一种高纯碳酸钙的制备方法,以方解石为起始原料,包括以下步骤:
1)将方解石原料磨矿,筛分,得到-200目粉末,该方解石中caco3含量为84%;
2)称取1kg方解石粉末加入至反应釜中,再取硝酸铵1.3kg加水溶解成4mol/l的铵盐溶液一加入至反应釜中,开启搅拌,搅拌速度为500rpm,将反应釜加热至70℃,以真空泵抽负压至压强为0.3atm,浸出过程中不断补充蒸发水维持反应釜中的液面高度,蒸出的气体直接通入水中吸收,得到碳酸氢铵和氨水的混合溶液并收集,反应时间为4h;
3)减压浸出反应结束后将反应釜中的溶液过滤,得到硝酸钙溶液;
4)将硝酸钙溶液加入至收集得到的碳酸氢铵和氨水的混合溶液中进行复分解反应,反应结束后经过滤、洗涤、干燥得到碳酸钙产品0.73kg,回收率87%,检测白度为99.7,分散均匀,滤液回收,滤液的主要成分为硝酸铵。
以edta容量法滴定本实施例制备的碳酸钙产品的纯度,为99.7%。
实施例4
一种高纯碳酸钙的制备方法,以白云石为起始原料,并以实施例3中的回收硝酸铵溶液进行实验,包括以下步骤:
1)将白云石原料磨矿,筛分,得到-200目粉末,该白云石中caco3含量为57%;
2)称取1kg白云石粉末加入至反应釜中,再将实施例3步骤4)回收的硝酸铵溶液(浓度为6mol/l)加入至反应釜中,开启搅拌,搅拌速度为600rpm,将反应釜加热至90℃,以真空泵抽负压至压强为0.02atm,浸出过程中不断补充蒸发水维持反应釜中的液面高度,蒸出的气体直接通入水中吸收,得到碳酸氢铵和氨水的混合溶液并收集,反应时间为1.5h;
3)减压浸出反应结束后将反应釜中的溶液过滤,得到硝酸钙溶液;
4)将硝酸钙溶液加入至收集得到的碳酸氢铵和氨水的混合溶液中进行复分解反应,反应结束后经过滤、洗涤、干燥得到碳酸钙产品0.53kg,碳酸钙回收率92%,检测白度为99.4,分散均匀,滤液回收,滤液的主要成分为硝酸铵。
以edta容量法滴定本实施例制备的碳酸钙产品的纯度,为99.5%。
实施例5
一种高纯碳酸钙的制备方法,以大理石为起始原料,并以实施例2中的回收氯化铵溶液进行实验,包括以下步骤:
1)将大理石原料磨矿,筛分,得到-200目粉末,该大理石中caco3含量为62%;
2)称取1kg大理石粉末加入至反应釜中,再将实施例1步骤4)回收的氯化铵溶液(浓度为2mol/l)加入至反应釜中,开启搅拌,搅拌速度为400rpm,将反应釜加热至95℃,以真空泵抽负压至压强为0.2atm,浸出过程中不断补充蒸发水维持反应釜中的液面高度,蒸出的气体直接通入水中吸收,得到碳酸氢铵和氨水的混合溶液并收集,反应时间为3.5h;
3)减压浸出反应结束后将反应釜中的溶液过滤,得到氯化钙溶液;
4)将氯化钙溶液加入至收集得到的碳酸氢铵和氨水的混合溶液中进行复分解反应,反应结束后经过滤、洗涤、干燥得到碳酸钙产品0.59kg,回收率95%,检测白度为99.2,分散均匀,滤液回收,滤液的主要成分为氯化铵。
以edta容量法滴定本实施例制备的碳酸钙产品的纯度,为99.8%。
实施例6
平行实验:
本申请发明人设计了一组平行试验,旨在对比减压和常压条件下氯化铵浸出碳酸钙的试验效果:将caco3含量为93%的石灰石磨矿,筛分,得到-200目矿石粉末;取两份400g的矿石粉,再取两份1.1kg的氯化铵配置成浓度为5mol/l的溶液,于反应釜中混合矿石粉和氯化铵溶液,分别在压强为0.05atm、温度为90℃和常压、温度为100℃下浸出,转速均为450rpm,过程中不断补充蒸发水至刻度线,每隔30min在两个反应釜中取液少量,以edta测量并计算钙离子浓度,得到如图1所示的对比图,然后分别计算两组的浸出率,得到如图2的对比图,由图可知:在压强为0.05atm、温度为90℃条件下,钙离子浓度随浸出时间延长上升较明显,在4h时浸出率可达98%,钙离子浓度为0.73mol/l;而常压下加热至100℃浸出4h,浸出率只有10%,钙离子浓度为0.075mol/l,浸出率小,说明减压浸出是一个有效的浸出方法,常压浸出不具可行性。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!