对应于转基因事件MON87712的大豆植物和种子及其检测方法与流程
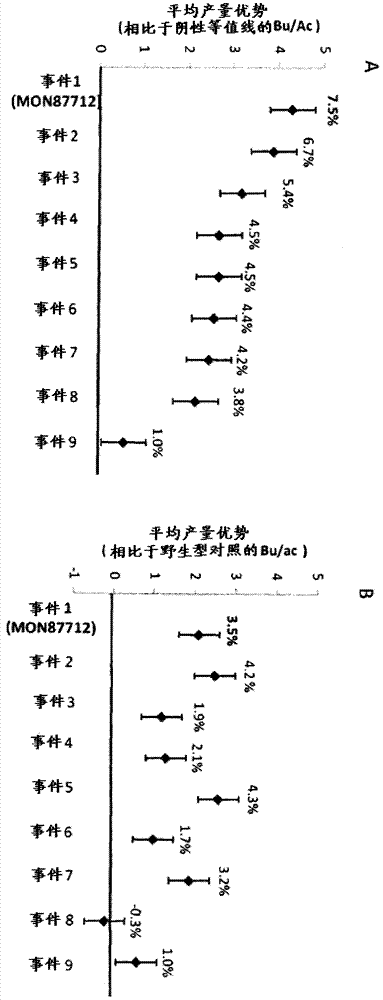
对应于转基因事件MON87712的大豆植物和种子及其检测方法相关申请的交叉引用本申请要求2010年10月12日提交的美国临时申请号61/392,267和2010年10月15日提交的美国临时申请号61/393,448的权益,所述美国临时申请通过引用整体并入本文。序列表的并入文件中包含的称为“MONS299WO.txt”的序列表(其在MicrosoftWindows操作系统中测量为26.3千字节并且创建于2011年10月5日)以电子形式一起提交并且通过引用并入本文。发明领域本发明涉及转基因大豆事件MON87712和包含显示增加的产量的事件的植物。本发明还提供了与所述事件相关的细胞、植物部分、种子、植物、商品,以及对于事件是独特的并且通过将转基因DNA插入大豆植物的基因组来产生的DNA分子。本发明进一步提供了用于检测样本中所述大豆事件核苷酸序列的存在的方法,用于检测诊断所述大豆事件的存在的核苷酸序列的探针和引物。发明背景大豆(Glycinemax)是重要的作物并且在世界上的许多地区中是主要的食物来源。生物技术的方法已应用于大豆以改善产品的农艺性状和质量。一种这样的农艺性状是增加的产量。可通过表达能够提供这样的增加的产量的转基因来在转基因植物中获得增加的产量。已知外源基因在植物中的表达受很多因素影响,这些因素例如转基因盒中使用的调控元件、转基因插入物的染色体定位、靠近转基因插入位点的任何内源调控元件的接近度(proximity)、以及环境因素例如光和温度。例如,已观察到在类似产生的事件之间在转基因表达的总体水平上或转基因表达的空间或时间模式上存在广泛的变化。为此原因,通常必需筛选数百个独立转化事件以最终鉴定对于商业农业目的有用的一个事件。一旦被鉴定为具有期望的转基因表达、分子特征和改善的性状,那么可使用植物育种方法将这样的事件用于将该改善的性状渗入其他遗传背景。所得的后代可含有转基因事件,并且因此可具有原始转化体的该性状的转基因表达特征。这可用于产生许多不同的包含改良的性状并且经适当地改造适合于特定地方生长条件的作物品种。发明概述本发明提供了包含事件MON87712的转基因大豆植物和种子,其代表性种子样本已经在美国模式培养物保藏所(AmericanTypeCultureCollection,ATCC)以登录号PTA-10296保藏。包含该事件的植物显示增加的产量。本发明提供了包含该事件的植物、种子、细胞、后代植物或植物部分以及来源于包含事件MON87712的植物、细胞、植物部分或种子的商品。本发明因此提供了包含具有选自以下的核苷酸序列的DNA分子的植物、种子、细胞、后代植物、植物部分或商品:SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:7、SEQIDNO:8和SEQIDNO:6及其互补序列。本发明提供了包含重组DNA分子的植物、种子、细胞、后代植物或植物部分,所述重组DNA分子例如在DNA扩增方法中产生包含本发明的DNA分子的扩增子。包含本发明的事件MON87712的大豆的植物部分包括但不限于花粉、胚珠、花、芽、根、茎、叶、豆荚和种子。在包含事件MON87712的植物的基因组中所包含的新型基因组合物和由包含事件MON87712的植物制备的产品例如完整或加工的种子、动物饲料、油、粗粉(meal)、面粉、食品、蛋白补充剂、燃料产品和生物质(包含MON87712的大豆植物已从其收获)是本发明的方面。本发明提供了涉及事件MON87712的DNA分子。这些DNA分子可包含代表或来源于如下的核苷酸序列:事件MON87712的转基因插入与侧翼基因组DNA的接合处、和/或位于插入DNA侧翼的基因组DNA的区域、和/或位于插入位点侧翼的所整合的转基因DNA的区域、和/或所整合的转基因表达盒的区域、和/或任何此类区域的连续序列。在一个实施方案中,本发明提供了包含选自SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:7、SEQIDNO:8和SEQIDNO:6及其互补序列的核苷酸序列的DNA分子。在另一个实施方案中,DNA分子可包含具有包含选自SEQIDNO:7和SEQIDNO:8的序列的至少约51-100个连续核苷酸的序列的多核苷酸或具有与SEQIDNO:6具有至少90%同一性的序列的多核苷酸分子。在又一个实施方案中,本发明提供了包含SEQIDNO:1和SEQIDNO:2的DNA分子。根据再一个实施方案,在SEQIDNO:1的3’末端与SEQIDNO:2的5’末端之间有不超过5000个连续核苷酸,例如,在SEQIDNO:1的3’末端与SEQIDNO:2的5’末端之间有不超过4500、4000、3500、3000、2500、2250、2100、2050、2000或1992个连续核苷酸。根据又一个实施方案,在SEQIDNO:7的3’末端与SEQIDNO:8的5’末端之间有不超过5000个连续核苷酸,例如,在SEQIDNO:7的3’末端与SEQIDNO:8的5’末端之间有不超过4500、4000、3500、3000、2500、2250、2100、2050、2000或1914个连续核苷酸。在进一步实施方案中,本发明提供了包含SEQIDNO:1或SEQIDNO:2并且进一步包含BBX32编码序列的DNA分子。在一些实施方案中,BBX32编码序列与SEQIDNO:1或SEQIDNO:2可操作地或遗传地连接。在其他实施方案中,SEQIDNO:1和SEQIDNO:2位于BBX32编码序列侧翼。本发明还提供了用作诊断该事件的引物和探针的DNA分子。提供了包含这些分子的植物、细胞、植物部分、商品、后代和种子。根据本发明的一个方面,提供了用于检测来自包含MON87712的新型大豆植物的转基因/基因组插入区域的存在的组合物和方法。提供了DNA序列,其包含选自SEQIDNO:1(对应于SEQIDNO:6的位置3495至3516,图1[F])、SEQIDNO:2(对应于SEQIDNO:6的位置5509至5530,图1[F])、SEQIDNO:7(对应于SEQIDNO:6的位置3456至3555)、SEQIDNO:8(对应于SEQIDNO:6的位置5470至5569)及其互补序列的MON87712的至少一个接合序列;其中接合序列为横跨插入到基因组中的异源DNA与大豆细胞基因组DNA连接的点的核苷酸序列并且在含有大豆DNA的生物样本中该序列的检测诊断大豆事件MON87712DNA在所述样本中的存在(图1)。大豆事件MON87712和包含这些DNA分子的大豆种子为本发明的方面。根据本发明的另一方面,提供了用于DNA检测方法的两个DNA分子,其中DNA分子用作DNA引物,当所述DNA引物与来源于事件MON87712的模板一起用于扩增反应时以产生诊断样本中的事件MON87712DNA的扩增子。在一个实施方案中,第一和第二DNA分子包含具有SEQIDNO:6的足够长度的连续核苷酸的核苷酸序列、或其互补序列的多核苷酸分子。在另一个实施方案中,第一DNA分子包含具有SEQIDNO:3或SEQIDNO:5的DNA分子的转基因区域的任何部分的足够长度的连续多核苷酸的核苷酸序列的多核苷酸,并且第二DNA分子包含SEQIDNO:3的5’侧翼大豆基因组DNA区域的任何部分的类似长度的多核苷酸。由与SEQIDNO:3和SEQIDNO:5的任何部分同源或互补的DNA引物产生的任何扩增子以及包含SEQIDNO:1或SEQIDNO:7的至少51个连续核苷酸的任何扩增子为本发明的方面。根据本发明的另一方面,第一DNA分子包含具有SEQIDNO:4或SEQIDNO:5的DNA分子的转基因区域的任何部分的足够长度的连续多核苷酸的核苷酸序列的多核苷酸,并且第二DNA分子包含SEQIDNO:4的3’侧翼大豆基因组DNA的任何部分的类似长度的多核苷酸。由与SEQIDNO:4和SEQIDNO:5的任何部分同源或互补的DNA引物产生的任何扩增子、以及包含SEQIDNO:2或SEQIDNO:8的至少51个连续核苷酸的任何扩增子为本发明的方面。本发明提供了用于检测来源于大豆事件MON87712的DNA的存在的方法、组合物和试剂盒。某些方法包括(a)将包含DNA的样本与引物组接触,所述引物组当与来自包含事件MON87712的大豆的基因组DNA用于核酸扩增反应时产生诊断该事件的扩增子;(b)进行核酸扩增反应,从而产生扩增子;以及(c)检测扩增子,其中所述扩增子包含SEQIDNO:1和/或SEQIDNO:2、或SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸。本发明还提供了通过如下步骤检测该事件的方法:(a)将包含DNA的样本与探针接触,所述探针当与来自事件的基因组DNA用于杂交反应时与对事件特异的DNA分子杂交;(b)使样本和探针经受严格杂交条件;以及(c)检测探针与DNA分子的杂交。还提供了包含用于检测来源于事件的DNA的存在的本发明的方法和组合物的试剂盒。本发明的另一方面是测定样本中包含大豆事件MON87712DNA的大豆植物基因组的接合性的方法,其包括:a)将所述样本与三种不同的引物接触,所述引物i)当与大豆事件MON87712DNA一起用于核酸扩增反应时产生诊断大豆事件MON87712的第一扩增子;并且ii)当与除MON87712DNA之外的大豆基因组DNA一起用于核酸扩增反应时,产生诊断除事件MON87712DNA之外的大豆野生型基因组DNA的第二扩增子;b)进行核酸扩增反应;以及c)检测所述第一扩增子和所述第二扩增子,其中所述第一扩增子和第二扩增子的存在诊断为所述样本中的杂合基因组,并且其中仅所述第一扩增子的存在诊断为所述样本中的纯合基因组。在一个实施方案中,引物包括SEQIDNO:10、SEQIDNO:11或15和SEQIDNO:13。在一个实施方案中,确定包含事件MON87712的大豆的接合性的方法包括(a)将包含大豆DNA的样本与引物组SEQIDNO:10、SEQIDNO:11或SEQIDNO:15、SEQIDNO:13以及探针组6FAMTM-标记的SEQIDNO:12和VICTM-标记的SEQIDNO:14接触,所述引物组和探针组当与来自包含事件MON87712的大豆的基因组DNA用于核酸扩增反应时产生第一扩增子,释放来自引物SEQIDNO:10和SEQIDNO:11或15和诊断大豆事件MON87712的6FAMTM-标记的探针(SEQIDNO:12)的组合的荧光信号;(b)进行核酸扩增反应,从而产生第一扩增子;和(c)检测所述第一扩增子;以及(d)将包含大豆DNA的样本与引物组SEQIDNO:10和SEQIDNO:13以及VICTM-标记的探针(SEQIDNO:14)接触,所述引物组和探针当与来自大豆植物的基因组DNA用于核酸扩增反应时产生第二扩增子,释放荧光信号,所述荧光信号诊断为与被鉴定为大豆事件MON87712的转基因插入的大豆基因组区域同源的野生型大豆基因组DNA;(e)进行核酸扩增反应,从而产生第二扩增子;和(f)检测所述第二扩增子;以及(g)比较样本中的第一扩增子和第二扩增子,其中两种扩增子的存在指示样本对于转基因插入是杂合的。本发明进一步提供了产生具有增加的产量的大豆植物的方法,其包括:(a)使包含MON87712的大豆植物自交,从而产生种子;(b)使所述种子生长以产生多个后代植物;和(c)选择包含MON87712的后代植物或具有增加的产量的后代植物。本发明的另一方面提供了产生具有增加的产量的大豆植物的方法,其包括:(a)将包含MON87712的大豆植物与第二大豆植物杂交,从而产生种子;(b)使所述种子生长以产生多个后代植物;以及(c)选择包含MON87712的后代植物或具有增加的产量的后代植物。在又一个方面,本发明提供了增加作物产量的方法,其包括:a)种植包含事件MON87712的作物植物或种子;以及b)使所述作物植物或种子生长。本发明的前述和其他方面将从以下详述而变得更加显而易见。附图简述图1.包含事件MON87712的大豆的基因组中的转基因插入物的图解表示;[A]对应于SEQIDNO:1和SEQIDNO:7的相对位置,两者形成转基因插入物的5’部分与侧翼基因组DNA的3’部分之间的接合处;[B]对应于SEQIDNO:2和SEQIDNO:8的相对位置,两者形成转基因插入物的3’部分与侧翼基因组DNA的5’部分之间的接合处;[C]对应于SEQIDNO:3的相对位置,其含有大豆基因组侧翼区域和转基因DNA插入物的任意指定的5’末端的一部分;[D]对应于SEQIDNO:4的相对位置,其含有大豆基因组侧翼区域和转基因DNA插入物的任意指定的3’末端的一部分;[E]表示SEQIDNO:5,其为包括整合到包含事件MON87712的大豆植物的基因组中的BBX32表达盒的转基因DNA插入物的序列;[F]表示SEQIDNO:6,其为包含5’侧翼基因组序列、转基因插入物和3’侧翼基因组序列的连续序列,包含如图中从左到右表示的SEQIDNO:3、SEQIDNO:5和SEQIDNO:4,其中SEQIDNO:1和7以及SEQIDNO:2和8如上所述并入,因为这些序列存在于包含事件MON87712的植物的基因组中;[G]和[H]表示用于事件特异性接合性端点TAQMANPCR的正向引物(SEQIDNO:11或SEQIDNO:15和SEQIDNO:13)以用于分别鉴定MON87712和野生型等位基因;[I]表示用于鉴定MON87712和野生型等位基因的反向引物(SEQIDNO:10);[J]和[K]表示用于事件特异性接合性端点TAQMANPCR的探针(SEQIDNO:12和SEQIDNO:14)以用于分别鉴定MON87712和野生型等位基因。箭头指示5’至3’的方向。LB:是指T-DNA的左边界;RB:是指T-DNA的右边界。图2.来自美国或南美洲的田间测试的4个田野季节的9个转基因事件的产量数据的元分析,示出具有最高产量的包含MON87712DNA的事件1。图A:转基因事件相比于其相应负等值线(蒲式耳/英亩)的平均产量增加。图B:转基因事件相比于野生型对照(蒲式耳/英亩)的平均产量增加。各条上方的数字表示增加%。序列简述SEQIDNO:1-代表大豆基因组DNA与所整合的DNA插入物之间的左边界接合处的22bp核苷酸序列。该序列对应于SEQIDNO:6的位置3495至3516,并且对应于SEQIDNO:3的位置3495至3516(图1的[C])。此外,SEQIDNO:1对应于在SEQIDNO:5的位置1至11处的表达盒的所整合的左边界(图1的[E])。SEQIDNO:2-代表所整合的DNA插入物和大豆基因组DNA之间的右边界接合处的22bp核苷酸序列。该序列对应于SEQIDNO:6的位置5509至5530,并且对应于SEQIDNO:4的位置90至111(图1的[D])。此外,SEQIDNO:2对应于SEQIDNO:5的位置2004至2014(图1的[E])。SEQIDNO:3-包括位于事件MON87712的插入DNA侧翼的5’大豆基因组序列(3505bp)加上所整合的DNA的区域(100bp)的3605bp核苷酸序列。该序列对应于SEQIDNO:6的位置1至3605。据信在SEQIDNO:3的位置3451至3463处的序列可在任何地方含有行中的13至100个单独c残基。SEQIDNO:4-包括位于事件MON87712的插入DNA侧翼的3’大豆基因组序列(1965bp)加上所整合的DNA的区域(100bp)的2065bp核苷酸序列。该序列对应于SEQIDNO:6的位置5420至7484。SEQIDNO:5-赋予增加的产量的所整合的表达盒的序列,包括整合后的左和右边界序列。SEQIDNO:5对应于SEQIDNO:6的核苷酸位置3506至5519。SEQIDNO:6-代表位于MON87712的插入DNA侧翼的5’序列(SEQIDNO:3)、所整合的DNA插入物的序列(SEQIDNO:5)和位于MON87712的插入DNA侧翼的3’序列(SEQIDNO:4)的重叠群的7484bp核苷酸序列。据信在SEQIDNO:6的位置3451至3463处的序列可在任何地方含有行中的13至100个单独c残基。SEQIDNO:7:代表大豆基因组DNA与所整合的DNA插入物之间的左边界接合处的100bp核苷酸序列。该序列对应于SEQIDNO:6的位置3456至3555,并且对应于SEQIDNO:3的位置3456至3555(图1的[C])。此外,SEQIDNO:7对应于在SEQIDNO:5的位置1至50处的表达盒的所整合的左边界(图1的[E])。SEQIDNO:8-代表所整合的DNA插入物与大豆基因组DNA之间的右边界接合处的100bp核苷酸序列。该序列对应于SEQIDNO:6的位置5470至5569,并且对应于SEQIDNO:4的位置51至150(图1的[D])。此外,SEQIDNO:8对应于SEQIDNO:5的位置1965至2014(图1的[E])。SEQIDNO:9-pMON83132的BBX32表达盒的核苷酸序列。SEQIDNO:10-在用于鉴定MON87712DNA/等位基因和野生型DNA/等位基因两者的事件特异性接合性端点TAQMANPCR测定中使用的反向引物序列。SEQIDNO:10对应于SEQIDNO:6的核苷酸位置5517至5546。使用引物SEQIDNO:10和SEQIDNO:11或15的组合产生PCR扩增子对于事件MON87712的存在是阳性结果。SEQIDNO:11-用于鉴定MON87712事件和MON87712事件接合性的正向引物序列。SEQIDNO:11对应于SEQIDNO:6的核苷酸位置5435至5458。SEQIDNO:12-用于鉴定MON87712事件和MON87712事件接合性的探针序列。SEQIDNO:12为6FAMTM-标记的合成寡核苷酸。TAQMAN测定中,在使用引物SEQIDNO:10和SEQIDNO:11或15与6FAMTM-标记的探针组合的扩增反应中荧光信号的释放诊断为事件MON87712。SEQIDNO:13-在用于鉴定野生型DNA/等位基因的事件特异性接合性端点TAQMANPCR中使用的正向引物序列。使用引物SEQIDNO:13和SEQIDNO:10产生PCR扩增子诊断为野生型DNA。SEQIDNO:14-用于测定大豆野生型DNA/等位基因的存在的探针序列。SEQIDNO:14为VICTM-标记的合成寡核苷酸。TAQMAN测定中,在使用引物SEQIDNO:10和SEQIDNO:13与VICTM-标记的探针组合的扩增反应中释放荧光信号诊断为接合性测定中的野生型等位基因。SEQIDNO:15-用于鉴定MON87712事件和MON87712事件接合性的备选正向引物序列。SEQIDNO:15对应于SEQIDNO:6的核苷酸位置5432至5455。SEQIDNO:16-用于鉴定MON87712事件的引物SQ3983的序列。使用引物SQ3983和SQ22982(SEQIDNO:17)的组合产生97bpPCR扩增子对于事件MON87712的存在是阳性结果。SEQIDNO:17-用于鉴定MON87712事件的引物SQ22982的序列。SEQIDNO:18-用于鉴定MON87712事件的探针PB10453的序列。其为6FAMTM-标记的合成寡核苷酸。SEQIDNO:19-在端点TAQMAN测定中用作内部对照的引物SQ1532的序列。SEQIDNO:20-在端点TAQMAN测定中用作内部对照的引物SQ1533的序列。SEQIDNO:21-在端点TAQMAN测定中用作内部对照的VICTM-标记的合成寡核苷酸探针PB0359的序列。详述下列定义和方法被提供来更好地定义本发明和在本发明的实施中指导本领域普通技术人员。除非另外指出,否则将根据相关领域普通技术人员常规使用的含义来理解术语。分子生物学中常见术语的定义也可在Rieger等,GlossaryofGenetics:ClassicalandMolecular,第5版,Springer-Verlag:NewYork,1991;和Lewin,GenesV,OxfordUniversityPress:NewYork,1994中发现。本发明提供了转基因大豆事件MON87712。本文中所用的术语“事件”是指由于在染色体上的特定位置处将转基因DNA插入到植物基因组中而产生的DNA分子。事件MON87712是指由于将具有在本文以SEQIDNO:5提供的序列的转基因DNA插入到大豆(Glycinemax)基因组的特定染色体位置中而产生的DNA分子。也在本发明中提供包含事件MON87712的植物、种子、后代、细胞及其植物部分。包含MON87712的种子的样本已经在美国模式培养物保藏所(ATCC)以登录号PTA-10296于2009年8月20日保藏。包含MON87712的植物显示增加的产量。如本文中所用,术语“大豆”是指大豆(Glycinemax)并且包括可与大豆育种的所有植物变种,包括野生大豆种类以及属于允许种类间育种的野大豆(Glycinesoja)的那些植物。转基因“事件”通过以下方式来产生:用异源DNA即包含所关注转基因的核酸构建体转化植物细胞、再生由将转基因插入植物的基因组而获得的独立转化的转基因植物群体以及选择具有所需分子特征(例如单拷贝的转基因插入特定基因组位置中、转基因DNA的完整性和增强的性状例如增加的产量)的特定植物。包含事件的植物可以指包括插入植物的基因组中的特定位置的转基因的原始转化体。包含事件的植物还可指在植物的基因组中的相同特定位置处保留转基因的原始转化体的后代。这样的后代可通过自交或通过转化体或其后代与另一种植物之间的有性异型杂交(outcross)来产生。这样的其他植物可以是包含相同或不同的转基因的转基因植物;或可以是非转基因植物,例如来自不同种类的非转基因植物。所得的后代对于事件MON87712DNA(插入DNA和侧翼DNA)可以是纯合或杂合的。甚至在与轮回亲本重复回交后,来自转化的亲本的事件DNA在相同的基因组位置处存在于杂交的后代中。包含事件MON87712的DNA分子是指包含插入的转基因DNA的至少一部分(以SEQIDNO:5提供)和紧邻插入DNA的侧翼基因组DNA的至少一部分的DNA分子。这样,包含事件MON87712的DNA分子具有代表转基因DNA插入物的至少一部分和将转基因DNA插入其中的植物的基因组的特定区域的至少一部分的核苷酸序列。与周围植物基因组相关的事件MON87712中的插入DNA的排列对于事件MON87712是特异性的和独特的,并且因此,这样的DNA分子的核苷酸序列是诊断性的并鉴定事件MON87712。这样的DNA分子的序列的实例在本文中以SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:7、SEQIDNO:8和SEQIDNO:6提供。该DNA分子也是包含事件MON87712的植物的染色体的完整部分并且可被传递至植物的后代。如本文中所用,“重组DNA分子”为包含不能一起天然存在的DNA分子的组合并且为人干预的结果的DNA分子,例如,由至少两个彼此异源的DNA分子的组合组成的DNA分子,和/或为人工合成的并且包含来源于通常存在于自然界中的多核苷酸序列的多核苷酸序列的DNA分子,和/或包含人工并入宿主细胞的基因组DNA的转基因和宿主细胞基因组的相关侧翼DNA的DNA分子。重组DNA分子的实例为本文中描述的由将转基因插入至大豆(Glycinemax)基因组内而产生的DNA分子,其可最终导致重组RNA和/或蛋白质分子在该生物体中的表达。核苷酸序列或由其衍生的任何片段也可被视为重组DNA分子,如果该DNA分子可从细胞或组织、或来自植物或种子或植物组织的匀浆提取;或者可作为扩增子由从细胞或组织、或来自植物或种子或植物组织的匀浆提取的DNA或RNA产生,其任何一个来源于源自包含事件MON87712的植物的此类材料。就此而言,如在SEQIDNO:1、SEQIDNO:2、SEQIDNO:7和SEQIDNO:8所示的接合序列,以及来源于也含有这些接合序列的事件MON87712的核苷酸序列被认为是重组DNA,不论这些序列存在于包含事件MON87712的细胞的基因组内或以可检测量存在于来源于包含事件MON87712的植物的组织、后代、生物样本或商品中。如本文中所用,术语“转基因”是指人工并入宿主细胞的基因组的多核苷酸分子。这样的转基因对于宿主细胞可以是异源的。术语“转基因植物”是指包含这样的转基因的植物。“转基因植物”包括其基因组已通过重组DNA的稳定整合而发生改变的植物、植物部分、植物细胞或种子。转基因植物包括从原始转化的植物细胞以及来自经转化植物的后生代或杂交的后代转基因植物再生的植物。由于这种基因组变化,转基因植物明显不同于相关野生型植物。转基因植物的实例是本文描述为包含事件MON87712的植物。如本文中所用,术语“异源的”是指在遗传环境(其中目前发现序列)中通常不存在于给定宿主基因组的序列。在这方面,序列可原产于宿主基因组,但是相对于宿主序列中的其他基因序列重排。本发明提供了DNA分子及其相应的核苷酸序列。如本文中所用,术语“DNA序列”、“核苷酸序列”和“多核苷酸序列”是指通常从5’(上游)末端至3’(下游)末端呈现的DNA分子的核苷酸的序列。本文中使用的命名法为美国联邦法规法典(UnitedStatesCodeofFederalRegulations)§1.822的第37条标题所要求的和WIPOStandardST.25(1998),附录2中的表1和3中所示的命名法。本发明公开仅关于转基因事件MON87712中提供的两条核苷酸序列链的一条链。因此,通过暗示和推导,互补序列(在本领域中也称为完全互补序列或反向互补序列)在本发明的范围内,并且从而也预期在所述要求保护的主题的范围内。对应于插入的转基因DNA的完全核苷酸序列和位于插入的转基因DNA的任一末端侧翼的大豆(Glycinemax)基因组DNA的大部分区段的核苷酸序列在本文中以SEQIDNO:6提供。该核苷酸序列的小部分为以SEQIDNO:5提供的插入的转基因DNA。位于插入的转基因DNA的5’末端和插入的DNA的5’末端的一部分侧翼的基因组DNA的核苷酸序列在本文中以SEQIDNO:3提供。位于插入的转基因DNA的3’末端和插入的DNA的3’末端的一部分侧翼的基因组DNA的核苷酸序列在本文中以SEQIDNO:4提供。横跨其中转基因DNA连接于和联接于基因组DNA的位置的区域,在本文中称为接合处(junction)。“接合序列(junctionsequence)”或“接合区域(junctionregion)”是指横跨插入的转基因DNA和相邻侧翼基因组DNA的DNA序列和/或相应DNA分子。事件MON87712的接合序列的实例在本文中以SEQIDNO:1、SEQIDNO:2、SEQIDNO:7和SEQIDNO:8提供。来源于大豆植物或种子的核苷酸分子中这些接合序列之一的鉴定确定了DNA获自事件MON87712并且诊断来自事件MON87712的DNA的存在。SEQIDNO:1为横跨基因组DNA与插入DNA的5’末端之间的接合处的22bp核苷酸序列。SEQIDNO:7为横跨基因组DNA与插入DNA的5’末端之间的接合处的100bp核苷酸序列。SEQIDNO:2为横跨基因组DNA与插入DNA的3’末端之间的接合处的22bp核苷酸序列。SEQIDNO:8为横跨基因组DNA与插入DNA的3’末端之间的接合处的100bp核苷酸序列。来源于转基因事件MON87712的包括SEQIDNO:1的连续核苷酸或SEQIDNO:7的51个连续核苷酸、55个连续核苷酸、60个连续核苷酸、65个连续核苷酸、70个连续核苷酸、75个连续核苷酸、80个连续核苷酸、85个连续核苷酸、90个连续核苷酸、95个连续核苷酸或所有核苷酸的DNA的任何区段在本发明的范围内。来源于转基因事件MON87712的包括SEQIDNO:2的连续核苷酸或SEQIDNO:8的51个连续核苷酸、55个连续核苷酸、60个连续核苷酸、65个连续核苷酸、70个连续核苷酸、75个连续核苷酸、80个连续核苷酸、85个连续核苷酸、90个连续核苷酸、95个连续核苷酸或所有核苷酸的DNA的任何区段在本发明的范围内。此外,包含与本段落内描述的任何序列互补的序列的任何多核苷酸分子在本发明的范围内。图1举例说明了包含事件MON87712的大豆的基因组中的转基因DNA插入物,和以5’至3’排列的SEQIDNO:1-8的相对位置。本发明还提供了包含多核苷酸的核酸分子,所述多核苷酸具有与全长SEQIDNO:6具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的序列。本发明进一步提供了可用作用于诊断来源于事件MON87712的DNA在样本中的存在的引物或探针的示例性DNA分子。此类引物或探针对于靶核酸序列是特异性的,并且因此对于通过本文中描述的本发明的方法鉴定事件MON87712核酸序列是有用的。″探针″是可检测标记或报告分子例如放射性同位素、配体、化学发光剂或酶所连接的分离的核酸。这样的探针与靶核酸的链互补,在本发明的情况下,与来自包含事件MON87712的大豆的基因组DNA的链互补(不管来自大豆植物或来自包含来自事件的DNA的样本)。根据本发明的探针不仅包括脱氧核糖核酸或核糖核酸而且还包括特异性结合靶DNA序列的聚酰胺和其他探针材料,并且这样的结合的检测可用于诊断/确定/确认该靶DNA序列在特定样本中的存在。″引物″通常是分离的多核苷酸,其被设计来用于特异性退火或杂交法以与互补的靶DNA链杂交以形成引物与靶DNA链之间的杂交体,然后通过聚合酶例如DNA聚合酶沿着靶DNA链延伸。可将引物对与模板DNA例如大豆(Glycinemax)基因组DNA的样本一起用于热扩增或等温扩增,例如聚合酶链式反应(PCR)或其他核酸扩增方法,以产生扩增子,其中从这样的反应产生的扩增子可具有对应于位于其中引物与模板杂交的两个位点之间的模板DNA的序列的DNA序列。如本文中所用,“扩增子”为一条或一段已使用扩增技术合成的DNA,即扩增反应的产物。在本发明的一个实施方案中,诊断事件MON87712的扩增子包含未在大豆(Glycinemax)基因组中天然存在的序列。如在本发明中所用,引物对意图是指为了线性扩增被引物对的单个成员靶向结合的位置之间的多核苷酸区段,通常在热扩增或等温扩增反应或其他核酸扩增方法中使用结合双链核苷酸区段的相反链的两个引物。用作引物的示例性DNA分子以SEQIDNO:10-11、SEQIDNO:13和SEQIDNO:15提供。以SEQIDNO:10和SEQIDNO:11或15提供的引物对可用作第一DNA分子和不同于第一DNA分子的第二DNA分子,并且两个分子各自具有充足长度的SEQIDNO:4、SEQIDNO:5或SEQIDNO:6的连续核苷酸或其互补序列以用作DNA引物,以便当与来源于事件MON87712的模板DNA一起用于扩增反应时,可产生对于转基因事件MON87712是特异性和独特的扩增子。术语“扩增子”的使用特别排除可在DNA扩增反应中形成的引物-二聚体。根据本发明的探针和引物可与靶序列具有完全序列同一性,虽然可通过常规方法设计与靶序列不同的保持优先与靶序列杂交的能力的引物和探针。为了核酸分子能够用作引物或探针,仅需在序列上充分互补以能够在所使用的特定溶剂和盐浓度下形成稳定的双链结构。任何核酸杂交或扩增方法可用于鉴定来自事件MON87712的转基因DNA在样本中的存在。探针和引物的长度通常为至少约11个核苷酸、至少约18个核苷酸、至少约24个核苷酸和至少约30个核苷酸或更多个核苷酸。此类探针和引物在高度严格杂交条件下与靶序列特异性杂交。用于制备和使用探针和引物的方法例如在MolecularCloning:ALaboratoryManual,第2版,1-3卷,Sambrook等编著,ColdSpringHarborLaboratoryPress,ColdSpringHarbor,NY,1989(在下文为″Sambrook等,1989″);CurrentProtocolsinMolecularBiology,Ausubel等编著,GreenePublishingandWiley-Interscience,NewYork,1992(定期更新)(在下文为″Ausubel等,1992”);和Innis等,PCRProtocols:AGuidetoMethodsandApplications,AcademicPress:SanDiego,1990中描述。PCR-引物对可来源于已知序列,例如通过使用意图用于该目的的计算机程序例如Primer(版本0.5,1991,WhiteheadInstituteforBiomedicalResearch,Cambridge,MA)。基于本文公开的侧翼DNA和插入序列的引物和探针可用于通过已知方法例如通过对此类序列进行重新克隆和测序来确认公开的序列。本发明的核酸探针和引物在严格条件下与靶DNA序列杂交。任何核酸杂交或扩增方法可用于鉴定来自转基因事件的DNA在样本中的存在。核酸分子或其片段能够在某些环境下与其他核酸分子特异性杂交。如本文中所用,如果两个核酸能够形成反向平行双链核酸结构,则两个核苷酸分子被认为能够彼此特异性杂交。如果两个核酸分子显示完全互补性,则一个核酸分子被认为是另一个核酸分子的“互补序列”。如本文中所用,当分子之一的每个核苷酸与另一个分子的核苷酸互补时,则分子被认为显示“完全互补性”。如果两个分子可以以足够的稳定性彼此杂交以允许它们在至少“低严格”条件下保持彼此退火,则它们被认为是“最低程度互补”。类似地,如果分子可以以足够的稳定性彼此杂交以允许它们在“高严格”条件下保持彼此退火,则它们被认为是“互补的”。严格条件由Sambrook等,1989和由Haymes等,见:NucleicAcidHybridization,APracticalApproach,IRLPress,Washington,DC(1985)描述。因此偏离完全互补性是可允许的,只要这样的偏离不完全排除分子形成双链结构的能力。为了核酸分子用作引物或探针,仅需要在序列上充分互补以能够在采用的特定溶剂和盐浓度下形成稳定的双链结构。如本文中所用,基本上同源的序列是在高严格条件下与所比较的核酸序列的互补序列特异性杂交的核酸序列。促进DNA杂交的合适的严格条件,例如在约45℃下6.0x氯化钠/柠檬酸钠(SSC),接着在50℃下2.0xSSC洗涤,是本领域技术人员已知的或可在CurrentProtocolsinMolecularBiology,JohnWiley&Sons,N.Y.(1989),6.3.1-6.3.6中找到。例如,洗涤步骤中的盐浓度可选自50℃下约2.0xSSC的低严格条件至50℃下约0.2xSSC的高严格条件。此外,洗涤步骤中的温度可以从室温约22℃的低严格条件增加到约65℃的高严格条件。温度和盐均可以变化,或者温度或盐浓度中的任一个可以保持恒定,而另一个变量发生变化。在一个实施方案中,本发明的核酸在高严格条件下与SEQIDNO:1、SEQIDNO:2、SEQIDNO:7和SEQIDNO:8或其互补序列或片段中所示的一个或多个核酸分子特异性杂交。探针与靶DNA分子的杂交可通过本领域技术人员已知的许多方法来检测。这些可包括但不限于荧光标签、放射性标签、基于抗体的标签和化学发光标签。关于使用特定扩增引物对扩增靶核酸序列(例如,通过PCR),″严格条件″是使得引物对仅与具有相应的野生型序列(或其互补序列)的引物将结合的靶核酸序列杂交的条件,并优选在DNA扩增反应中产生独特的扩增产物(扩增子)。DNA扩增方法的实例包括PCR、重组酶聚合酶扩增(RPA)(参见例如美国专利号7,485,428)、链置换扩增(SDA)(参见例如,美国专利号5,455,166和5,470,723)、转录介导的扩增(TMA)(参见例如,Guatelli等,Proc.Natl.Acad.Sci.USA87:1874-1878(1990))、滚环扩增(RCA)(参见例如,Fire和Xu,Proc.Natl.AcadSci.USA92:4641-4645(1995);Lui,等,J.Am.Chem.Soc.118:1587-1594(1996);Lizardi,等,NatureGenetics19:225-232(1998),美国专利号5,714,320和6,235,502))、解链酶依赖性扩增(HDA)(参见例如Vincent等,EMBOReports5(8):795-800(2004);美国专利号7,282,328)和多重置换扩增(MDA)(参见例如Dean等,Proc.Natl.AcadSci.USA99:5261-5266(2002))。术语″对于(靶序列)特异性的″指示探针或引物在严格杂交条件下仅与包含靶序列的样本中的靶序列杂交。如本文中所用,术语“分离的”是指至少部分地将分子与通常以其原始或天然状态与其联接的其他分子分离。在一个实施方案中,术语“分离的”是指这样的DNA分子,其至少部分地与以原始或天然状态通常位于所述DNA分子侧翼的核酸分离。因此,例如作为重组技术的结果融合于它们通常不与其联接的调控或编码序列的DNA分子在本文中被认为是分离的。此类分子即使当整合入宿主细胞的染色体或与其他DNA分子一起存在于核酸溶液中时亦被认为是分离的。本领域技术人员公知的许多方法可用于分离和操作本发明中公开的DNA分子或其片段。例如,PCR(聚合酶链式反应)技术可用于扩增特定起始DNA分子和/或产生原始分子的变体。DNA分子或其片段还可通过其他技术例如通过利用化学方法直接合成片段(这通常通过使用自动寡核苷酸合成仪来实施)来获得。能够检测特定植物的转基因/基因组DNA的存在以便确定有性杂交的后代是否含有所关注的转基因/基因组DNA将是有利的。此外,用于检测特定植物的方法当遵守需要上市前批准和标记来源于转基因作物植物的食品的规程时将是有用的。转基因的存在可通过任何公知的核酸检测方法例如聚合酶链式反应(PCR)或使用核酸探针的DNA杂交来检测。这些检测方法一般集中于常用的遗传元件例如启动子、终止子、标记基因等。这样,此类方法可能不用于区分不同转化事件,特别是使用相同DNA构建体产生的那些,除非邻近插入DNA(“侧翼DNA”)的染色体DNA的序列是已知的。事件特异性PCR测定例如由Taverniers等(J.Agric.FoodChem.,53:3041-3052,2005)进行了讨论,其中显示了转基因玉米品系Bt11、Bt176和GA21以及油菜(canola)事件GT73的事件特异性跟踪系统。在该研究中,基于每个事件的基因组/转基因接合处的序列设计事件特异性引物和探针。转基因植物事件特异性DNA检测方法也在美国专利号6,893,826;6,825,400;6,740,488;6,733,974;6,689,880;6,900,014和6,818,807中描述。因此,本文中提供的DNA分子和相应核苷酸序列可用于(除其他用途之外)鉴定事件MON87712,选择包含事件MON87712的植物品种或杂交体,检测来源于事件MON87712的DNA在样本中的存在,和监测样本的事件MON87712的存在和/或不存在或包含事件MON87712的植物和植物部分。本发明提供了植物、后代、种子、植物细胞、植物部分(例如花粉、胚珠、豆荚、花、根或茎组织、纤维和叶)以及商品。这些植物、后代、种子、植物细胞、植物部分和商品包含可检测量的本发明的多核苷酸,即例如包含以SEQIDNO:1的连续核苷酸、SEQIDNO:2的连续核苷酸、SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸提供的序列中的至少一个的多核苷酸。本发明的植物、后代、种子、植物细胞、植物部分和商品还可含有一个或多个另外的转基因。这样的转基因可以是编码赋予期望的性状的蛋白质或RNA分子的任何核苷酸序列,所述期望的性状包括但不限于增强的昆虫抗性、增加的水分利用效率或抗旱性、增加的产量性能、增加的氮使用效率或增加的氮应力的耐受性例如高或低氮供应、增加的种子质量、增加的疾病抗性、改善的营养质量和/或增强的除草剂耐受性例如草甘膦或麦草畏耐受性,其中相对于缺乏这样的另外的转基因的可比较植物来测量期望的性状。本发明提供了来源于包含事件MON87712的转基因植物的植物、后代、种子、植物细胞和植物部分例如花粉、胚珠、豆荚、花、根或茎组织以及叶。为了使得能够进行本发明,已按照布达佩斯条约(BudapestTreaty)保藏了包含事件MON87712的种子的代表性样本。经选择用于接收保藏物的贮藏处为美国模式培养物保藏所(ATCC),地址为10801UniversityBoulevard,Manassas,VirginiaUSA,邮政编码20110。ATCC贮藏处已对含有事件MON87712的种子指定了登录号PTA-10296。本发明提供了包含存在于其基因组中的具有选自SEQIDNO:1的连续核苷酸、SEQIDNO:2的连续核苷酸、或SEQIDNO:7的至少51个连续核苷酸、或SEQIDNO:8的至少51个连续核苷酸的核苷酸序列的DNA分子的微生物。这样的微生物的实例为转基因植物细胞。微生物例如本发明的植物细胞在许多工业应用中是有用的,所述工业应用包括但不限于:(i)用作用于科学调查或工业研究的研究工具;(ii)用在用于产生可用于随后的科学研究或用作工业产品的内源或重组碳水化合物、脂质、核酸、酶或蛋白质产物或小分子的培养物中;和(iii)与现代植物组织培养技术一起使用以产生随后可用于农业研究或生产的转基因植物或植物组织培养物。微生物例如转基因植物细胞的产生和使用利用现代微生物学技术和人干预来产生人造的独特的微生物。在该方法中,将重组DNA插入植物细胞的基因组以产生与天然存在的植物细胞分离且独特的转基因植物细胞。该转基因植物细胞可随后使用现代微生物技术进行培养(与细菌和酵母细胞非常相似),并且可以以未分化的单细胞状态存在。新型植物细胞的遗传组成和表型为通过将异源DNA整合入细胞的基因组而产生的技术作用。本发明的另一个方面为使用本发明的微生物的方法。使用本发明的微生物例如转基因植物细胞的方法包括(i)通过将重组DNA整合入细胞的基因组,并且然后使用该细胞衍生具有相同异源DNA的另外的细胞来产生转基因细胞的方法;(ii)使用现代微生物技术培养含有重组DNA的细胞的方法;(iii)从培养细胞产生并且纯化内源或重组碳水化合物、脂质、核酸、酶或蛋白质产物的方法;和(iv)使用现代植组织培养技术利用转基因植物细胞产生转基因植物或转基因植物组织培养物的方法。如本文中所用,“后代”包括包含来源于具有以SEQIDNO:1的连续核苷酸、SEQIDNO:2的连续核苷酸、或SEQIDNO:7的至少51个连续核苷酸、或SEQIDNO:8的至少51个连续核苷酸提供的序列中的至少一个的祖先植物和/或多核苷酸的事件DNA的任何植物、种子、植物细胞和/或可再生植物部分。植物、后代和种子对于转基因可以是纯合或杂合的。后代可从由包含事件MON87712的植物产生的种子和/或从由利用包含事件MON87712的植物的花粉授精的植物产生的种子生长而来。可对后代植物进行自花受粉(也称为“自交”)以产生植物的纯育种系,即对于转基因是纯合的植物。或者,可将后代植物与另一种植物异型杂交例如育种,以产生品种或杂种种子或植物。另一种植物可以为转基因或非转基因的。本发明的品种或杂种种子或植物因此可通过如下方式来衍生:将不存在事件MON87712的特异性和独特的DNA的第一亲本与包含事件MON87712的第二亲本杂交,从而产生包含事件MON87712的特异性和独特的DNA的杂种。每一个亲本可以为杂种或近亲育种(inbred)/品种,只要杂交或育种产生本发明的植物或种子,即具有包含事件MON87712的特异性和独特的DNA和/或SEQIDNO:1和SEQIDNO:2的连续核苷酸、SEQIDNO:7的至少51个连续核苷酸、或SEQIDNO:8的至少51个连续核苷酸的至少一个等位基因的种子。因此可将两种不同的转基因植物交配以产生含有两个独立地分离的另外的外源基因的杂种后代。例如,包含具有增加的产量的事件MON87712的植物可与另一种转基因植物(例如对草甘膦具有耐受性的一种转基因植物)杂交,以产生具有两种转基因亲本的特征的植物。适当后代的自交可产生对于两种所添加的外源基因是纯合的植物。还预期与亲本植物的回交和与非转基因植物的异型杂交,同样地涉及营养繁殖。通常用于不同性状和作物的其他育种方法的描述可见于几篇参考文献之一,例如,Fehr,见BreedingMethodsforCultivarDevelopment,WilcoxJ.编著,AmericanSocietyofAgronomy,MadisonWI(1987)中。可以通过人类干预来完成或促成一种植物与另一种植物有性杂交,即异花授粉(cross-pollinating),例如:通过人手工收集一种植物的花粉和将该花粉与第二种植物的花柱或柱头接触;通过人手和/或行动除去、破坏或覆盖植物的雄蕊或花药(例如,通过人工干预或通过施用化学杀配子剂)以便防止自然的自花受粉并且使得必将发生异花受粉以使受精发生;通过在进行“定向受粉”的位置人工放置传粉昆虫(例如,通过在果园或田间设置蜂房或通过将植物和传粉昆虫笼养);通过人为开放或去除花的部分以允许外来花粉在花柱或柱头上安置或接触;通过选择性放置植物(例如,有意地将植物种植于传粉邻近区);和/或通过施用化学药品以促使开花或培养(柱头对花粉)的感受性。在实施本方法中,可通过人工干预来完成或促成一种植物与其自身有性杂交即自花受粉或自交的步骤,例如:通过人手工收集植物的花粉和将该花粉与相同植物的花柱或柱头接触,和然后任选地阻止植物的进一步受精;通过人手和/或行动除去、破坏或覆盖其他附近植物的雄蕊或花药(例如,通过去雄或通过施用化学杀配子剂)以便防止天然异花受粉并且使得必将发生自花受粉以使受精发生;通过在进行“定向受粉”的位置人工放置传粉昆虫(例如,通过与传粉昆虫笼养单独的植物);通过人工操作花或其部分以允许自花受粉;通过选择性放置植物(例如,有意地在传粉邻近区之外种植植物);和/或通过施用化学药品以促使开花或培养(柱头对花粉)的感受性。本发明提供了来源于包含事件MON87712的植物的植物部分。如本文中所用,“植物部分”是指由从包含事件MON87712的植物衍生的材料组成的植物的任何部分。植物部分包括但不限于细胞、花粉、胚珠、豆荚、花、根或茎组织、纤维及叶。植物部分可以是活的、不能存活的、可再生的和/或非可再生的。本发明提供了从包含事件MON87712的植物衍生的商品。如本文中所用,“商品”是指由从包含事件MON87712的植物、种子、植物细胞或植物部分衍生的材料组成的任何组合物或产品。商品可售予消费者并且可以是活的或不能存活的。不能存活的商品包括但不限于不能存活的种子和谷物;经加工的种子、种子部分和植物部分;脱水的植物组织、冷冻的植物组织和经加工的植物组织;经加工用于陆生和/或水生动物消费的动物饲料的种子和植物部分、油、粗粉、面粉、薄片、麸皮、纤维和用于人消费的任何其他食品;和生物质及燃料产品。经加工的大豆是世界上蛋白质饲料和蔬菜油的最大来源。来自包含MON87712的植物的大豆和大豆油可用于制造很多不同的产品,不限于无毒塑料、印刷油墨、润滑剂、蜡、液压油、电力变压器流体、溶剂、化妆品和头发护理产品。包含MON87712的大豆和大豆油可适用于由全大豆制造的多种大豆食物,例如豆奶、大豆果仁奶油、纳豆和豆豉;和由经加工的大豆和大豆油制造的大豆食物,包括大豆粗粉、大豆面粉、大豆蛋白浓缩物、大豆蛋白分离物、组织化大豆蛋白浓缩物、水解大豆蛋白、植脂奶油(whippedtopping)、食用油、色拉油、起酥油和卵磷脂。全大豆也是可食用的,且通常销售给消费者的是生的、烤的或毛豆。通常通过浸泡和磨碎全大豆而生产的豆奶可以不经其他加工而食用,可以喷雾干燥,或加工成大豆酸奶、豆腐乳、豆腐或腐竹。活的商品包括但不限于种子和植物细胞。因此包含事件MON87712的植物可用于制造通常从大豆植物获得的任何商品。来源于包含事件MON87712的植物的任何此类商品可含有至少可检测量的对应于事件MON87712的特异性和独特的DNA,并且特别地可含有可检测量的具有SEQIDNO:1的连续核苷酸、SEQIDNO:2的连续核苷酸、SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸的核苷酸序列的多核苷酸。可使用检测多核苷酸分子的任何标准方法,包括本文中公开的检测方法。如果在商品中存在任何可检测量的SEQIDNO:1的连续核苷酸、SEQIDNO:2的连续核苷酸、SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸,那么商品在本发明的范围内。因此本发明的植物、后代、种子、植物细胞、植物部分(例如花粉、胚珠、豆荚、花、根或茎组织及叶)以及商品尤其对于生长植物以产生用于农业目的的包含事件MON87712的种子和/或植物部分、产生用于植物育种和研究目的的包含事件MON87712的后代是有用的,可与用于工业和研究应用的微生物学技术一起使用和售予消费者。本发明提供了用于产生具有增加的产量的植物和包含事件MON87712的植物的方法。含有事件MON87712的植物通过与美国专利5,914,451中所述的方法类似的土壤杆菌属(Agrobacterium)介导的转化方法,使用用构建体pMON83132(表1)近亲育种的大豆系来产生。构建体pMON83132含有用于在大豆植物细胞中表达BBX32蛋白的植物表达盒。将转基因大豆细胞再生到完整大豆植物中并且个别植物选自显示所需分子特征(例如转基因盒在单个基因座处的单拷贝、转基因盒的完整性、构建体主链序列的缺失和解链的草甘膦抗性选择盒的损失)的独立转化的转基因植物群体。而且,进行反向PCR和DNA序列分析以确定5’和3’插入物至植物基因组接合处,以确认元件在插入物内的组织(图1),以及确定插入物在大豆事件MON87712中的全DNA序列(SEQIDNO:5)。此外,在田地条件下针对增加的产量筛选并选择转基因植物。在其基因组中含有pMON83132的BBX32表达盒的大豆植物为本发明的方面。本发明的转基因植物的增加的产量可用多种方法来测量,包括试验重量、种子数/植物、种子重量、种子数/单位面积(即种子或种子重量/英亩)、蒲式耳/英亩、吨/英亩或公斤/公顷。BBX32蛋白在包含事件MON87712的植物中的表达导致约由增加的生长和生殖发育能力产生的产量的增加。增加的产量由生长的一个或多个产量参数的划分引起,所述产量参数包括更多的种子/样地(plot)、更大的种子、更多的种子/植物、和/或更多的植物/样地。本发明中使用的重组DNA通过与具有相同遗传背景的非转基因大豆相比时源化合物的增加来提供了增加的产量。这些生化和代谢变化与受BBX32活性影响的昼夜调节的途径相关并且包括碳代谢和氮代谢。提供了用于产生包含转基因事件MON87712的具有增加的产量的植物的方法。这些方法中使用的转基因植物对于转基因可以是纯合的或杂合的。通过这些方法产生的后代植物可以是品种或杂种植物;可从由植物产生的种子和/或从由利用包含事件MON87712的植物的花粉授精的植物产生的包含事件MON87712的种子生长而来;以及对于转基因可以是纯合的或杂合的。随后可将后代植物自花受粉以产生植物的纯育种系,即,对于转基因是纯合的植物,或可选择地将后代植物异型杂交,例如与另一种无关植物育种以产生品种或杂种种子或植物。如本文中所用,术语“接合性”是指植物中DNA在特定染色体位置(基因座)处的相似性。在本发明中,DNA特异性是指连同接合序列(事件DNA)一起的转基因插入物。如果具有接合序列的转基因插入物存在于染色体对的每条染色体(2个等位基因)上的相同位置处,那么植物是纯合的。如果具有接合序列的转基因插入物存在于染色体对的仅一条染色体(1个等位基因)上,那么植物被认为是杂合的。野生型植物对于事件DNA是无效的(null)。具有增加的产量的植物可通过将包含事件MON87712(包含具有SEQIDNO:1的连续核苷酸的核苷酸序列的多核苷酸、具有SEQIDNO:2的连续核苷酸的核苷酸序列的多核苷酸、SEQIDNO:7的至少51个连续核苷酸、和/或SEQIDNO:8的至少51个连续核苷酸的多核苷酸分子)的植物与另一种植物有性杂交和从而产生种子(随后生长成后代植物)来产生。可使用诊断方法分析这些后代植物以选择含有事件MON87712DNA的后代植物或具有增加的产量的后代植物。使用的其他植物可以为或可以不为转基因的。所产生的后代植物和/或种子可以为变种或杂种种子。具有增加的产量的植物可通过将包含事件MON87712(包含具有SEQIDNO:1的连续核苷酸的核苷酸序列的多核苷酸、具有SEQIDNO:2的连续核苷酸的核苷酸序列的多核苷酸、SEQIDNO:7的至少51个连续核苷酸、和/或SEQIDNO:8的至少51个连续核苷酸的多核苷酸分子)的植物自交和从而产生种子(随后生长成后代植物)来产生。然后可使用诊断方法分析这些后代植物以选择包含事件MON87712DNA的后代植物。由这些方法涵盖的和通过使用这些方法产生的后代植物和种子与其他植物截然不同,例如因为所述后代植物和种子是重组的并且通过人工干预产生;含有至少一个由本发明的转基因DNA组成的等位基因;和/或含有可检测量的选自SEQIDNO:1的连续核苷酸、SEQIDNO:2的连续核苷酸、SEQIDNO:7的至少51个连续核苷酸和SEQIDNO:8的至少51个连续核苷酸的多核苷酸序列。种子可选自单株后代植物,并且只要种子包含SEQIDNO:1、SEQIDNO:2、SEQIDNO:7的至少51个连续核苷酸和/或SEQIDNO:8的至少51个连续核苷酸,其就可在本发明的范围内。可评估本发明的植物、后代、种子、植物细胞、植物部分(例如花粉、胚珠、豆荚、花、根或茎组织及叶)和商品的DNA组成、基因表达和/或蛋白质表达。这样的评估可通过使用各种方法例如PCR、测序、northern印迹、southern分析、western印迹、免疫沉淀和ELISA或通过使用本文中提供的检测方法和/或检测试剂盒来进行。提供了检测对于事件MON87712是特异性的组合物在样本中的存在的方法。一种方法由检测对于包含事件MON87712的细胞、组织、种子、植物或植物部分是特异性的DNA和来源于所述细胞、组织、种子、植物或植物部分的DNA的存在组成。方法提供了待与引物对接触的模板DNA样本,所述引物对能够在经历适合于扩增的条件后从事件MON87712DNA产生扩增子,特别是包含SEQIDNO:1、SEQIDNO:2、SEQIDNO:7的至少51个连续核苷酸和/或SEQIDNO:8的至少51个连续核苷酸或其互补序列的扩增子。扩增子从来源于事件MON87712的模板DNA分子产生,只要模板DNA分子结合SEQIDNO:1、SEQIDNO:2、SEQIDNO:7的至少51个连续核苷酸和/或SEQIDNO:8的至少51个连续核苷酸的特异性和独特的核苷酸序列。扩增子可以为单链或双链DNA或RNA,这取决于被选择用于产生扩增子的聚合酶。该方法提供了检测在任何这样的扩增反应中产生的扩增子分子,和确认对应于SEQIDNO:1、SEQIDNO:2、SEQIDNO:7的至少51个连续核苷酸和/或SEQIDNO:8的至少51个连续核苷酸或其互补序列的核苷酸在扩增子的序列中的存在。扩增子中对应于SEQIDNO:1、SEQIDNO:2、SEQIDNO:7的至少51个连续核苷酸和/或SEQIDNO:8的至少51个连续核苷酸或其互补序列的核苷酸的检测确定和/或诊断事件MON87712特异性DNA和从而包含事件MON87712的生物材料在样本中的存在。提供了用于检测对应于SEQIDNO:3或SEQIDNO:4的DNA分子在由来源于植物或植物组织的材料组成的样本中的存在的另一种方法。方法由如下步骤组成:(i)从植物或从一组不同的植物获得DNA样本,(ii)将DNA样本与包含SEQIDNO:1或SEQIDNO:2中所示的核苷酸的DNA探针分子接触,(iii)允许探针和DNA样本在严格杂交条件下杂交,和然后(iv)检测探针与靶DNA样本之间的杂交事件。杂交组合物的检测诊断SEQIDNO:3或SEQIDNO:4(视具体情况而定)在DNA样本中的存在。杂交的不存在可选择地诊断转基因事件在样本中的不存在,如果适当的阳性对照同时进行测试的话。或者,确定特定植物包含对应于SEQIDNO:1或SEQIDNO:2的序列或其互补序列之任一或两者确定植物含有至少一个对应于事件MON87712的等位基因。因此可能通过任何公知的核酸扩增和检测方法例如聚合酶链式反应(PCR)、重组酶聚合酶扩增(RPA)或使用核酸探针的DNA杂交检测本发明的核酸分子的存在。事件特异性PCR测定例如由Taverniers等(J.Agric.FoodChem.,53:3041-3052,2005)进行了论述,其中显示了转基因玉米品系Bt11、Bt176和GA21以及转基因事件RT73的事件特异性跟踪系统。在本研究中,基于每一个事件的基因组/转基因接合处的序列设计事件特异性引物和探针。转基因植物事件特异性DNA检测方法已在美国专利号6,893,826;6,825,400;6,740,488;6,733,974;6,689,880;6,900,014和6,818,807中描述。提供了DNA检测试剂盒。一种类型的试剂盒含有至少一种具有足够长度的SEQIDNO:3、SEQIDNO:5或SEQIDNO:6的连续核苷酸的DNA分子以用作对于检测来源于转基因事件MON87712的DNA在样本中的存在是特异性的DNA引物或探针。利用试剂盒检测的DNA分子包含SEQIDNO:1所示的序列的连续核苷酸或SEQIDNO:7的至少51个连续核苷酸。或者,试剂盒可含有至少一种具有足够长度的SEQIDNO:4、SEQIDNO:5或SEQIDNO:6的连续核苷酸的DNA分子以用作对于检测来源于转基因事件MON87712的DNA在样本中的存在是特异性的DNA引物或探针。待利用试剂盒检测的DNA分子包含SEQIDNO:2所示的连续核苷酸或SEQIDNO:8的至少51个连续核苷酸。备选试剂盒使用这样的方法,其中将靶DNA样本与上述引物对接触,然后进行足以产生包含SEQIDNO:1、SEQIDNO:2的连续核苷酸、SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸的扩增子的核酸扩增反应。扩增子的检测和确定SEQIDNO:1、SEQIDNO:2的连续核苷酸、SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸或其互补序列在扩增子的序列中的存在诊断事件MON87712特异性DNA在DNA样本的存在。提供了足以用作DNA探针的DNA分子,其对于测定、检测或对于诊断对于事件MON87712DNA是特异性和独特的DNA在样本中的存在或甚至不存在是有用的。DNA分子含有SEQIDNO:1的连续核苷酸或其互补序列、SEQIDNO:2的连续核苷酸或其互补序列、SEQIDNO:7的至少51个连续核苷酸或其互补序列或者SEQIDNO:8的至少51个连续核苷酸或其互补序列。可利用本领域已知的多种核酸扩增方法(包括热扩增和等温扩增方法)的任一方法实现核酸扩增。可通过使用来源于本文中提供的序列的引物,然后进行扩增子或克隆的DNA的标准DNA测序来验证来自事件MON87712(包含事件MON87712的代表性种子样本以ATCCPTA-10296保藏)的异源DNA插入物、接合序列或侧翼序列。可通过多种技术检测由这些方法产生的扩增子。一种这样的方法为遗传位点分析(GeneticBitAnalysis)(Nikiforov等NucleicAcidRes.22:4167-4175,1994),其中设计了与相邻的侧翼基因组DNA序列和插入DNA序列重叠的DNA寡核苷酸。将寡核苷酸固定在微孔板的孔中。在热扩增目标区域(使用插入的序列中的一个引物和相邻侧翼基因组序列中的一个引物)后,单链扩增子可与固定的寡核苷酸杂交,并将其用作模板以使用DNA聚合酶和对于预期的下一个碱基是特异性的标记的ddNTP进行单碱基延伸反应。读数可以是基于荧光或ELISA的。归因于成功的扩增、杂交和单碱基延伸,荧光或其他信号的检测指示插入物/侧翼序列的存在。另一个方法为由Winge(Innov.Pharma.Tech.00:18-24,2000)描述的焦磷酸测序技术。在该方法中,设计与相邻基因组DNA和插入DNA接合处重叠的寡核苷酸。将寡核苷酸与来自目标区域(一个引物在插入的序列中以及一个引物在侧翼基因组序列中)的单链扩增子杂交,并且在DNA聚合酶、ATP、硫酸化酶、荧光素酶、腺苷三磷酸双磷酸酶、腺苷5’磷酸硫酸和萤光素的存在下进行孵育。单独地添加ddNTP,并且掺入导致被测量的光信号。归因于成功的扩增、杂交和单或多碱基延伸,光信号指示转基因插入物/侧翼序列的存在。由Chen等,(GenomeRes.9:492-498,1999)描述的荧光偏振为可用于检测扩增子的方法。通过使用该方法,设计与基因组侧翼序列和插入DNA接合处重叠的寡核苷酸。将寡核苷酸与来自目标区域(一个引物在插入DNA中并且一个引物在侧翼基因组DNA序列中)的单链扩增子杂交,并且在DNA聚合酶和荧光标记的ddNTP的存在下进行孵育。单碱基延伸导致ddNTP的并入。并入可使用荧光计测量为偏振的改变。归因于成功的扩增、杂交和单碱基延伸,偏振的改变指示转基因插入物/侧翼序列的存在。使用由制造商提供的说明书,(PEAppliedBiosystems,FosterCity,CA)也可用于检测和/或定量DNA序列的存在。简而言之,设计与基因组侧翼序列和插入DNA接合处重叠的FRET寡核苷酸探针。在耐热聚合酶和dNTP的存在下,循环FRET探针和扩增引物(一个引物在插入DNA序列中并且一个引物在侧翼基因组序列中)。FRET探针的杂交导致荧光部分的切割和释放,与FRET探针上的猝灭部分分离。归因于成功扩增和杂交,荧光信号指示侧翼/转基因插入序列的存在。已描述了分子信标用于序列检测,如Tyangi等(NatureBiotech.14:303-308,1996)中所描述的。简而言之,设计与侧翼基因组序列和插入DNA接合处重叠的FRET寡核苷酸探针。RRET探针的独特结构导致其包含使荧光与猝灭部分保持紧密靠近的二级结构。在耐热聚合酶和dNTP的存在下循环FRET探针和扩增引物(一个引物在插入DNA序列中并且一个引物在侧翼基因组序列中)。在成功的扩增后,FRET探针与靶序列的杂交导致探针二级结构的消除以及荧光部分与猝灭部分的空间分离,从而导致荧光信号的产生。归因于成功的扩增和杂交,荧光信号指示侧翼/转基因插入序列的存在。其他描述的方法例如微流体学(microfluidics)(美国专利公布号2006068398、美国专利号6,544,734)提供了分离和扩增DNA样本的方法和装置。光学染料用于检测和测量特异性DNA分子(WO/05017181)。包括用于检测结合特异性DNA分子并且随后可被检测的DNA分子或纳米珠粒的电子传感器的纳米管装置(WO/06024023)。可使用本文中公开的组合物和DNA检测领域内公知的方法来开发DNA检测试剂盒。试剂盒用于鉴定样本中的事件MON87712并且可被应用于用于培育包含适当的事件DNA的植物的方法。试剂盒可含有与SEQIDNO:1-6或其片段或互补序列相似或互补的DNA引物或探针。本发明的试剂盒和检测方法因而可用于(除其他用途之外)鉴定事件MON87712,选择包含事件MON87712的植物品种或杂交体,检测来源于事件MON87712的DNA在样本中的存在,和监测样本的事件MON87712的存在或不存在或包含事件MON87712的植物、植物部分或商品。包括下列实施例来举例说明本发明的某些实施方案的实例。本领域技术人员应当理解,下列实施例中公开的技术代表本发明人已发现非常适合于本发明的实施,并从而被认为构成用于其实施的优选模式的实例的方法。然而,鉴于本公开内容,本领域技术人员应当理解可在不背离本发明的精神和范围的情况下在公开的特定实施方案中进行许多改变,并且获得类似或相似的结果。实施例实施例1:用pMON83132转化大豆和事件选择该实施例描述了转基因大豆事件的转化和传代,以及事件MON87712的选择。使用土壤杆菌属介导的转化方法以指定为pMON83132的双元构建体转化大豆细胞。构建体含有两个植物转化盒或T-DNA。每个盒位于右边界和左边界序列侧翼。SEQIDNO:5中所示的转基因插入物包含含有来自花椰菜花叶病毒(CaMV)的增强35S启动子的转化盒,所述增强35S启动子与编码BBX32蛋白的DNA分子可操作地连接,与来自海岛棉(Gossypiumbarbadense)(棉花)的纤维蛋白E6基因的3’未翻译区可操作地连接。第二转化盒含有嵌合启动子,所述嵌合启动子由与来自拟南芥(Arabidopsisthaliana)的编码延伸因子EF-1α的EF-1α基因的启动子组合的来自玄参花叶病毒(FMV)35SRNA的启动子的增强子序列组成。其还含有前导序列(外显子1)和具有拟南芥属(Arabidopsis)EF-1α基因的侧翼剪接位点的内含子,它们与编码来自拟南芥属EPSP合酶的叶绿体转运肽(CTP2)的DNA分子可操作地连接,与来自土壤杆菌属菌株CP4的编码CP4EPSPS蛋白的aroA基因的密码子修饰的编码序列融合,与来自豌豆(Pisumsativum)的RbcS2基因的3’未翻译区可操作地连接。CP4aroA基因赋予草甘膦耐受性,并且用作选择标记。表1是pMON83132中的遗传元件的概览。用构建体pMON83132转化后,使转化细胞在含有草甘膦的培养基上生长并繁殖。由存活细胞再生植物。产生总计4944个独立R0转化事件并通过详细的分子分析进行表征。针对插入物数目(大豆基因组中整合位点的数目)、拷贝数(一个基因座中T-DNA的拷贝数目)、插入盒的完整性和主链序列的缺失以及AtBBX32转基因转录物的表达,通过定量PCR和RT-PCR(TAQMAN)筛选事件。排除具有不希望分子特征的事件,所述不希望的分子特征例如多个拷贝的转基因的存在和/或所关注的分子复杂性、转化载体主链序列的存在。而且,进行连锁Southern分析以去除其中BBX32表达盒与CP4选择标记盒连接的事件。总计284个事件满足基于上述分析的严格分子选择标准。由于纯合的种子储备的无效性进一步排除三个另外的事件,产生281个事件先于R1代。表1.pMON83132中的遗传元件的概览1B,边界2P,启动子3CS,编码序列4T,转录终止序列5L,前导序列6I,内含子7TS,靶向序列8OR,复制起点在R1代,事件经受隔离分析以仅选择纯合的和杂合的植物继续进行测试。此外,进行CP4连锁分析、TAQMAN分析和BBX32表达分析以去除其中CP4与BBX32转基因连接的事件、或其中检测出OriV复制起点的序列(主链)的事件、或其中BBX32转基因表达水平不希望的事件,导致剩余121个事件。使用不同探针的Southern杂交分析进一步排除不是单拷贝、或单插入物或不是不含主链的42个事件。探针包括完整BBX32编码区及其各自的启动子、多聚腺苷酸化序列和质粒主链。由于缺乏足够种子继续进行所以终止另外的2个事件,留下77个事件进行到R2代。在R2代,撤销另外的9个事件,由于1)缺少用于R2保育的足够种子(1个事件)、或2)不希望的农艺学表型(2个事件)、或3)BBX32表达水平或缺乏代表性纯合系,如由InvaderR测定(ThirdWaveTechnologies,Inc.,Madison,WI)(6个事件)。结果是,针对在美国第1年产量田间试验继续进行68个事件。基于产量性能,在南美洲16个事件继续进行到第二季田间测试,其中选择9个事件用于进一步产量测试。来自美国或南美洲的田间试验(各自具有多个位置(表2)的4季的产量数据的元分析,显示指定为包含事件MON87712的一个后代系为最高产量事件(图2)。表2.产量的四季田间测试的详情年份地理位置#2007美国182007-2008南美洲142008美国242008-2009南美洲14实施例2:使用反向PCR分离侧翼序列以及通过测序鉴定侧翼序列该实施例描述了针对事件MON87712使用反向PCR分离位于转基因DNA插入物侧翼的大豆基因组DNA序列,以及通过测序鉴定侧翼基因组序列。在事件MON87712中位于T-DNA插入侧翼的序列使用反向PCR确定,如在Ochman等,1990(PCRProtocols:AguidetoMethodsandApplications,AcademicPress,Inc.)中描述。植物基因组DNA从来自在温室条件下生长的组织的野生型A3525和转基因系分离。冰冻的叶组织用研钵和研杵在液氮中磨碎或通过机械研磨进行磨碎,随后使用本领域已知的方法进行DNA提取。该方法可由本领域技术人员改进以从任何组织(包括但不限于种子)提取DNA。用基于转基因DNA的限制分析选择的限制内切核酸酶消化来自每个样本的DNA的等份试样。限制片段的自连接后,使用从转基因序列设计的引物进行PCR扩增,所述引物将扩增从转基因DNA的5’和3’末端延伸的序列。可使用多种Taq聚合酶和扩增系统。表3显示使用Phusion高保真DNA聚合酶(目录号F531S或F531L,NewEnglandBiolabs)和ThermalcyclersAppliedBiosystemsGeneAmp9700,ABI9800FastThermalCycler与MJOpticon进行侧翼序列分离的PCR扩增的实例。表3.用于侧翼序列分离的反向PCR扩增的实例PCR产物通过琼脂糖凝胶电泳分离并且使用QIAGEN凝胶纯化试剂盒(Qiagen,Valencia,CA)进行纯化。直接使用标准的测序方案对随后的产物进行测序。使用这两种方法,延伸到包括BBX32表达盒的所整合的DNA插入物的左边界序列中的5’侧翼序列得以鉴定并以SEQIDNO:3呈示(图1的[C])。延伸到包括BBX32表达盒的所整合的DNA插入物的右边界序列中的3’侧翼序列得以鉴定并以SEQIDNO:4呈示(图1的[D])。整合到大豆基因组DNA中的转基因DNA以SEQIDNO:5呈示(图1的[E])。将分离的序列与T-DNA序列相比较以鉴定侧翼序列和共分离的T-DNA片段。通过利用基于推断的侧翼序列数据和已知T-DNA序列设计的引物的PCR确认表达盒的存在。使用从MON87712中的侧翼序列设计的引物,分离对应于其中T-DNA整合到转化系中的同一区域的野生型序列。针对多个核苷酸和蛋白数据库分析MON87712中的侧翼序列以及野生型序列。该信息用于检查转基因与植物基因组的关系以及查看插入位点的完整性。使用侧翼序列和野生型序列来设计实施例3中所述的用于鉴定事件并确定接合性的TAQMAN端点测定的引物。实施例3:事件特异性端点TAQMAN和接合性测定该实施例描述了用于鉴定样本中的事件MON87712DNA的事件特异性端点TAQMAN热扩增方法。用于事件MON87712-特异性端点TAQMAN方法的条件的实例描述于表4和表5中。用于端点测定的DNA引物为引物SQ3983(SEQIDNO:16)和SQ22982(SEQIDNO:17)以及6-FAMTM标记的寡核苷酸探针为PB10453(SEQIDNO:18)。6FAMTM为与DNA探针连接的AppliedBiosystems(FosterCity,CA)的荧光染料产品。对于TAQMANMGB(MinorGrooveBinding)探针,TaqDNA聚合酶的5’外切核酸酶活性在在荧光团与淬灭剂之间从5’-末端切割探针。当与靶DNA链杂交时,淬灭剂和荧光团充分分离以产生荧光信号。当如所述与探针PB10453(SEQIDNO:18)一起使用时,引物SQ3983(SEQIDNO:16)和SQ22982(SEQIDNO:17)产生诊断事件MON87712DNA的扩增子。分析包括来自已知含有事件MON87712DNA的大豆的阳性对照、来自非转基因大豆的阴性对照和不含有模板DNA的阴性对照。优化这些测定以与AppliedBiosystemsGeneAmpPCRSystem9700、ABI9800FastThermalCycler与MJOpticon一起使用。本领域技术人员已知的其他方法和装置可用于产生鉴定事件MON87712DNA的扩增子。表4.大豆MON87712事件特异性端点TAQMANPCR条件表5.端点TAQMAN热循环仪条件以下实例描述了被开发用于确定样本中的事件MON87712的接合性的事件特异性端点TAQMAN热扩增方法。接合性测定用于确定包含事件的植物对于事件DNA是纯合的;即在染色体对的每一条染色体上的相同位置处包含外源DNA;还是对于事件DNA是杂合的,即在染色体对的仅一条染色体上包含外源DNA;或对于事件DNA是无效的,即为野生型。一组三个引物(SEQIDNO:10、13和11或15)、6FAMTM标记的探针(SEQIDNO:12)和VICTM标记的探针(SEQIDNO:14)用于测定(表8)。6FAMTM和VICTM为与DNA探针连接的AppliedBiosystems(FosterCity,CA)的荧光染料产物。引物SEQIDNO:11或15与插入的外源DNA特异性杂交并从其延伸;引物SEQIDNO:10与位于插入的外源DNA3′侧的侧翼的DNA特异性杂交并从其延伸;引物SEQIDNO:13与对应于转基因事件MON87712中的T-DNA插入期间删除的区域的野生型DNA杂交并从其延伸。这些引物为诊断性的。在该实施例中,引物SEQIDNO:10和SEQIDNO:11或15以及6FAMTM-标记的寡核苷酸探针SEQIDNO:12产生DNA扩增子(这由荧光信号从探针SEQIDNO:12的释放揭示,其诊断事件MON87712DNA),表明插入的转基因DNA的拷贝存在于基因组DNA中。引物SEQIDNO:10和SEQIDNO:13以及VICTM-标记的寡核苷酸探针SEQIDNO:14产生扩增子(这由荧光信号从探针SEQIDNO:14的释放揭示,其诊断野生型等位基因),表明没有插入的外源DNA的拷贝存在于基因组DNA中。当三个引物和两个探针与从植物提取的DNA一起混合在PCR反应中时,荧光信号仅从6FAMTM-标记的寡核苷酸探针(SEQIDNO:12)的释放指示并诊断为对于事件MON87712是纯合的植物。当三个引物和两个探针与从植物提取的DNA一起混合在PCR反应中时,荧光信号从6FAMTM-标记的寡核苷酸探针SEQIDNO:12和VICTM-标记的寡核苷酸探针SEQIDNO:14两者的释放指示并诊断为对于事件MON87712是杂合的植物。当三个引物和两个探针与从植物提取的DNA一起混合在PCR反应中时,荧光信号仅从VICTM-标记的寡核苷酸探针SEQIDNO:14的释放指示并诊断为对于事件MON87712是无效的(即野生型)植物。该测定还包括来自含有事件MON87712DNA的大豆的阳性对照、来自非转基因大豆的阴性对照和不含有模板DNA的阴性对照。表6和表7提供了用于样本中的事件MON87712的接合性测定的条件的实例。优化这些测定以与AppliedBiosystemsGeneAmpPCRSystem9700一起使用。用AppliedBiosytems的7900HT序列检测系统(7900HTSequenceDetectionSystem)或BMGLabtech的PHERAstar优化等位基因的检测。本领域技术人员已知的产生鉴定事件MON87712DNA的扩增子的其他方法和装置在本领域的技能之内。表6.大豆MON87712事件特异性接合性端点TAQMANPCR*MGB:小沟结合表7.接合性端点TAQMAN热循环仪条件表8.用于接合性测定的引物和探针组合的实例实施例4:在任何含有MON87712的育种事件中事件MON87712的鉴定该实施例描述了如何可以鉴定在含有MON87712大豆的任何育种事件的后代中的MON87712事件。使用事件DNA引物对产生诊断大豆事件MON87712的扩增子。诊断MON87712的扩增子包含至少一个接合序列,在本文以SEQIDNO:1、SEQIDNO:2、SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸或其互补序列提供([A]或[B],分别如图1中说明的)。SEQIDNO:1(图1的[A])为对应于5’侧翼序列(SEQIDNO:3的位置3495至3516[C],参见图1)和所整合的DNA插入物的左边界(SEQIDNO:5的位置1至11[E],参见图1)的接合处的核苷酸序列。SEQIDNO:2(图1的[B])为对应于所整合的DNA插入物的右边界(SEQIDNO:5的位置2004至2014[E],参见图1)和3’侧翼序列(SEQIDNO:4的位置90至111[D],参见图1)的接合处的核苷酸序列。SEQIDNO:7(图1的[A])为对应于5’侧翼序列(SEQIDNO:3的位置3456至3555[C],参见图1)和所整合的DNA插入物的左边界(SEQIDNO:5的位置1至50[E],参见图1)的接合处的核苷酸序列。SEQIDNO:8(图1的[B])为对应于所整合的DNA插入物的右边界(SEQIDNO:5的位置1965至2014[E],参见图1)和3’侧翼序列(SEQIDNO:4的位置51至150[D],参见图1)的接合处的核苷酸序列。产生诊断MON87712的扩增子的事件引物对包括使用侧翼序列(SEQIDNO:3和SEQIDNO:4)和所整合的转基因DNA序列(SEQIDNO:5)设计的引物对。为了获得其中发现SEQIDNO:1的至少15个核苷酸的诊断性扩增子,设计基于SEQIDNO:3的碱基1至3494的正向引物和基于插入的表达盒DNA序列(SEQIDNO:5的位置12至2014)的反向引物,其中引物具有与SEQIDNO:3和SEQIDNO:5特异性杂交的足够长度的连续核苷酸。为了获得其中发现SEQIDNO:2的至少15个核苷酸的诊断性扩增子,可设计基于插入的表达盒(SEQIDNO:5的位置1至2003)的正向引物和基于3’侧翼序列(SEQIDNO:4的碱基12至2065)的反向引物,其中引物具有与SEQIDNO:4和SEQIDNO:5特异性杂交的足够长度的连续核苷酸。为了实践目的,应当设计产生具有有限的大小范围例如100至1000个碱基的扩增子的引物。更小的(更短的核苷酸长度)的扩增子通常可在PCR反应中更可靠地产生,允许更短的循环时间,并且可在琼脂糖凝胶上容易地分离和显现或适合用于端点-样测定。此外,可将使用引物对产生的扩增子克隆入载体,进行繁殖,分离,并对其进行测序,或可利用本领域充分确定的方法直接对所述扩增子进行测序。来源于SEQIDNO:3与SEQIDNO:5的组合或SEQIDNO:4与SEQIDNO:5的组合的任何引物对(其在DNA扩增方法中用于产生诊断MON87712、包含MON87712的植物或其后代的扩增子)为本发明的方面。包含SEQIDNO:3的至少11个连续核苷酸或其互补序列的任何单个分离的DNA引物分子(其在DNA扩增方法中用于产生诊断MON87712、包含MON87712的植物或其后代的扩增子)为本发明的方面。包含SEQIDNO:4的至少11个连续核苷酸或其互补序列的任何单个分离的DNA引物分子(其在DNA扩增方法中用于产生诊断MON87712、包含MON87712的植物或其后代的扩增子)为本发明的方面。包含SEQIDNO:5的至少11个连续核苷酸或其互补序列的任何单个分离的DNA引物分子(其在DNA扩增方法中用于产生诊断MON87712、包含MON87712的植物或其后代的扩增子)为本发明的方面。用于该分析的扩增条件的实例举例说明于表4和表5(实施例3)中。然而,这些方法的任何修改或与SEQIDNO:3或SEQIDNO:4或事件MON87712的转基因插入物(SEQIDNO:5)的DNA序列同源或互补的DNA引物(所述引物产生诊断MON87712的扩增子)的使用在本说明书的范围内。诊断扩增子包含与至少一个转基因/基因组接合DNA(SEQIDNO:1、SEQIDNO:2、SEQIDNO:7的至少51个连续核苷酸或SEQIDNO:8的至少51个连续核苷酸或其互补序)或其大部分同源或互补的DNA分子。用于样本中的事件MON87712的分析应包括来自事件MON87712的阳性对照、来自不含事件MON87712的大豆植物的阴性对照(例如,但不限于野生型对照)和不含大豆基因组DNA的阴性对照。可扩增内源性大豆DNA分子的引物对将用作DNA扩增条件的内部对照。另外的引物序列可由DNA扩增方法领域熟练技术人员选自SEQIDNO:3、SEQIDNO:4或SEQIDNO:5,并且对于通过表4和表5中所示的方法产生扩增子所选择的条件可能不同,但产生诊断事件MON87712DNA的扩增子。根据对表4和表5的方法进行修改的使用这些DNA引物序列在本发明的范围内。由来源于SEQIDNO:3、SEQIDNO:4或SEQIDNO:5的至少一个DNA引物序列产生的可诊断MON87712的扩增子为本发明的方面。含有至少一个来源于SEQIDNO:3、SEQIDNO:4或SEQIDNO:5的DNA引物的DNA检测试剂盒为本发明的方面,当该DNA引物在DNA扩增方法中使用时,产生MON87712、包含MON87712的植物或其后代的诊断性扩增子。其中其基因组DNA在DNA扩增方法中测试时产生诊断MON87712的扩增子的大豆植物或种子为本发明的方面。可通过使用AppliedBiosytemsGeneAmpPCRSystem9700、ABI9800FastThermalCyclerandMJOpticon,StratageneRobocycler,MJEngine,Perkin-Elmer9700或EppendorfMastercyclerGradient热循环仪或任何其他可用于产生MON87712诊断性扩增子的扩增系统进行MON87712扩增子测定。上文公开的和权利要求中引用的包含大豆事件MON87712的种子已由美国模式培养物保藏所(ATCC),10801UniversityBoulevard,Manassas,VA.20110在布达佩斯条约下进行保藏。该保藏日期为2009年8月20日并且ATCC登录号为PTA-10296。在专利发布后,将移除所有针对该保藏物的限制,并且该保藏物意图满足所有37C.F.R.§§1.801-1.809的要求。将保藏物在最近的请求后将在贮藏所维持30年或5年的时期,或维持专利的有效使用期(以更长的时间为准),并且在该期间必要时可替换保藏物。由于已举例说明和描述了本发明的原理,因此对于本领域技术人员来说显而易见的是可在不背离这些原理的情况下在排列和详情上修改本发明。我们要求保护在所附权利要求的精神和范围内的所有修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1