DKK3基因的用途及其相关药物的制作方法
本发明涉及生物技术领域,更具体地涉及DKK3基因的用途及其相关药物。
背景技术:
肌肉萎缩的现有诊断方法主要包括询问病史、进行肌肉的外观检查、观察有无肌束颤动、观察病人是否有明显的肌肉质量减少,并通过肌电图结合神经传导速度和诱发电位进行诊断。目前还没有分子诊断方法。此外,对于衰老引发的肌肉萎缩及肌肉功能的衰退,目前并没有明确的治疗方法及可用作治疗药物的作用靶点。
Dkk3是Dickkopf蛋白家族的一员,属于胞外分泌蛋白。它主要作用于Wnt信号通路,通过与Wnt蛋白竞争结合膜受体LRP从而达到抑制Wnt信号通路活性的作用。但是,目前的研究还没有发现Dkk3的表达量高低是否与肌肉萎缩的发生存在关联;也没有能治疗衰老引发的肌肉萎缩的靶点。
因此,为治疗和诊断目的的研究和开发在肌肉萎缩中高表达的基因和/或蛋白具有重要意义。
技术实现要素:
本发明的目的在于公开与DKK3基因相关的治疗方法及药物,以RNA干扰(RNAi)为手段研究DKK3基因在肌肉萎缩治疗中的作用。
本发明的第一方面,以RNA干扰为手段,研究了DKK3基因在肌肉萎缩治疗中的作用,公开了一种改善或治疗肌肉萎缩的方法,该方法包括:向肌肉细胞施用一种能够特异性抑制DKK3基因的转录或翻译,或能够特异性抑制DKK3蛋白的表达或活性的分子,以此来改善或治疗肌肉萎缩。
所述改善或治疗肌肉萎缩的方法中,所述分子的施用量为足够降低DKK3基因的转录或翻译,或者足够降低DKK3蛋白的表达或活性的剂量。进一步的,所述DKK3基因的表达至少被降低50%、80%、90%、95%或99%。
所述分子可选自但不限于:核酸分子、碳水化合物、脂类、小分子化学药、抗体药、 多肽、蛋白或干扰病毒。
所述核酸包括但不限于:反义寡核苷酸、双链RNA(dsRNA)、核酶、核糖核酸内切酶III制备的小干扰RNA(siRNA)或者短发夹RNA(shRNA)。
所述双链RNA、核酶、siRNA或者shRNA含有DKK3基因的启动子序列或DKK3基因的信息序列。
进一步的,所述双链RNA为小干扰RNA(siRNA)。所述小干扰RNA包含第一链和第二链,所述第一链和所述第二链互补共同形成RNA二聚体,并且所述第一链的序列与DKK3基因中15-27个连续的核苷酸序列基本相同。所述小分子干扰RNA能特异性结合靶序列所编码的mRNA片段,并特异性沉默DKK3基因的表达。
进一步的,所述小干扰RNA的第一链序列与DKK3基因中的靶序列基本相同。
所述DKK3基因中的靶序列即为所述小分子干扰RNA特异性沉默DKK3基因表达时,与所述的小分子干扰RNA互补结合的mRNA片段所对应的DKK3基因中的片段。
较佳的,所述DKK3基因来源于人。
本发明的第一方面还公开了一种分离的DKK3基因在筛选肌肉萎缩治疗药物中的用途。
所述将分离的DKK3基因用于筛选肌肉萎缩治疗药物包括以下方面的内容:将DKK3基因作为药物或制剂针对萎缩肌肉的作用靶标应用于筛选肌肉萎缩治疗药物或制剂。
所述将DKK3基因作为药物或制剂针对萎缩肌肉的作用靶标应用于筛选肌肉萎缩治疗药物或制剂具体是指:将DKK3基因作为作用对象,对药物或制剂进行筛选,以找到可以抑制DKK3基因表达的药物作为肌肉萎缩治疗备选药物。如本发明所述的DKK3基因小分子干扰RNA(siRNA)即是以DKK3基因为作用对象筛选获得的,可用作具有治疗或改善肌肉萎缩作用的药物。除此之外,诸如抗体药物,小分子药物等也可将DKK3基因及其蛋白作为作用对象。
所述肌肉萎缩治疗药物为能够特异性抑制DKK3基因的转录或翻译,或能够特异性抑制DKK3蛋白的表达或活性的分子,从而降低萎缩肌肉细胞中DKK3基因的表达水平,达到治疗或改善肌肉萎缩的目的。
所述通过分离的DKK3基因制备或筛选获得的肌肉萎缩治疗药物包括但不限于:核酸分子、碳水化合物、脂类、小分子化学药、抗体药、多肽、蛋白或干扰病毒。
所述核酸包括但不限于:反义寡核苷酸、双链RNA(dsRNA)、核酶、核糖核酸内切 酶III制备的小干扰RNA(siRNA)或者短发夹RNA(shRNA)。
所述肌肉萎缩治疗药物的施用量为足够降低DKK3基因的转录或翻译,或者足够降低DKK3蛋白的表达或活性的剂量。以使DKK3基因的表达至少被降低50%、80%、90%、95%或99%。
采用前述肌肉萎缩治疗药物治疗肌肉萎缩的方法,主要是通过降低DKK3基因的表达水平改善肌肉萎缩来达到治疗的目的。具体的,治疗时,将能有效降低DKK3基因表达水平的物质给药于患者。
本发明第二方面公开了一种治疗肌肉萎缩的分离的核酸分子,所述核酸分子包含:
a)双链RNA,所述双链RNA中含有能够在严紧条件下与DKK3基因杂交的核苷酸序列;或者
b)shRNA,所述shRNA中含有能够在严紧条件下与DKK3基因杂交的核苷酸序列。
进一步的,所述双链RNA包含第一链和第二链,所述第一链和所述第二链互补共同形成RNA二聚体,并且所述第一链的序列与DKK3基因中15-27个连续的核苷酸序列基本相同。较佳的,所述第一链的序列与DKK3基因中19-23个连续的核苷酸序列基本相同;更佳的,所述第一链的序列与DKK3基因中19、20或者21个连续的核苷酸序列基本相同。
更进一步的,所述双链RNA包含第一链和第二链,所述第一链和所述第二链互补共同形成RNA二聚体,并且所述第一链的序列与DKK3基因中的靶序列基本相同。
所述双链RNA第一链和第二链的长度均为15-27个核苷酸;较佳的,长度均为19-23个核苷酸;最佳的,长度均为19、20或者21个核苷酸。
进一步的,所述双链RNA为小干扰RNA(siRNA)。更进一步的,所述小干扰RNA第一链的序列如SEQ ID NO:1所示,具体为5’-CCAGGAAGUUCACAAGAUAUU-3’。
SEQ ID NO:1所示的siRNA为以DKK3的序列为RNA干扰靶序列设计的、针对DKK3基因的小干扰RNA的一条链,另一条链即第二链的序列与第一链序列互补,该siRNA可以起到特异性沉默萎缩肌肉中内源DKK3基因表达的作用。
进一步的,所述shRNA包括正义链片段和反义链片段,以及连接所述正义链片段和反义链片段的茎环结构,所述正义链片段和所述反义链片段的序列互补,并且所述正义链片段的序列与DKK3基因中15-27个连续的核苷酸序列基本相同。所述shRNA经加工后可成为小干扰RNA(siRNA)进而起到特异性沉默萎缩肌肉中内源DKK3基因表达的作用。
更进一步的,所述shRNA包括正义链片段和反义链片段,以及连接所述正义链片段和反义链片段的茎环结构,所述正义链片段和所述反义链片段的序列互补,并且所述正义链片段的序列与DKK3基因中的靶序列基本相同。
较佳的,所述正义链片段与DKK3基因中19-23个连续的核苷酸序列基本相同;更佳的,所述正义链片段与DKK3基因中19、20或者21个连续的核苷酸序列基本相同。
更进一步的,所述shRNA的正义链的序列如SEQ ID NO:3所示,具体为:5’-TCGACCAGGAAGTTCACAAGATACTCGAGTATCTTGTGAACTTCCTGGTTTTT-3’。
shRNA经酶切加工后可成为siRNA,进而起到特异性沉默萎缩肌肉细胞中内源性DKK3基因表达的作用。
编码本发明所述shRNA的基因片段的干扰病毒载体含有针对DKK3基因的靶序列及其互补序列。
所述双链RNA的第一链或所述shRNA的正义链片段与DKK3基因中的靶序列基本相同,所述DKK3基因的靶序列即为siRNA用于特异性沉默DKK3基因表达时,被所述siRNA识别并沉默的mRNA片段所对应的DKK3基因中的片段。
进一步的,所述DKK3基因来源于人。
本发明第三方面,公开了一种DKK3基因干扰核酸构建体,含有编码本发明所述分离的核酸分子中的shRNA的基因片段,能表达所述shRNA。
所述的DKK3基因干扰核酸构建体可以是将编码前述DKK3基因shRNA的基因片段克隆入已知载体获得。进一步的,所述DKK3基因干扰核酸构建体为DKK3基因干扰病毒载体。
本发明的DKK3基因干扰病毒载体是将编码前述DKK3基因shRNA的DNA片段克隆入已知载体获得,所述已知载体可为任何病毒载体,例如腺病毒、逆转录病毒、慢病毒等,本文使用腺病毒载体。所述DKK3基因干扰病毒载体经过病毒包装成为有感染力的病毒颗粒后,感染萎缩肌肉,进而转录出本发明所述shRNA,通过酶切加工等步骤,最终获得所述siRNA,用于特异性沉默DKK3基因的表达。
进一步的,所述DKK3基因干扰腺病毒载体还含有启动子序列和/或编码萎缩肌肉中可被检测的标记物的核苷酸序列;较优的,所述可被检测的标记物如绿色荧光蛋白(GFP)。
进一步的,所述腺病毒载体可以选自:pAdTrack,pShuttle,pAdTrack-GFP中的任一。
本发明实施例具体列举了以pAdTrack-GFP为载体构建的DKK3基因干扰腺病毒载体。
本发明分离的核酸分子可用于制备治疗肌肉萎缩的药物。
本发明的DKK3基因siRNA可用于治疗肌肉萎缩的药物或制剂。DKK3基因干扰腺病毒载体则可用于制备所述以DKK3基因为靶点的siRNA。当用作治疗肌肉萎缩的药物或制剂时,是将安全有效量的所述核酸分子施用于哺乳动物。具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
本发明第四方面,公开了一种DKK3基因干扰腺病毒,由前述DKK3基因干扰腺病毒载体在腺病毒包装质粒、细胞系的辅助下,经过病毒包装而成。该腺病毒可感染萎缩肌肉并产生针对DKK3基因的小分子干扰RNA,从而改善肌肉萎缩。该DKK3基因干扰腺病毒可用于制备治疗肌肉萎缩的药物。
本发明的第五方面,公开了一种用于治疗肌肉萎缩的药物组合物,其有效物质含有前述的分离的核酸分子,DKK3基因干扰核酸构建体或DKK3基因干扰病毒中的一种或多种的组合。
进一步的,所述药物组合物含有1~99wt%所述双链RNA、shRNA、DKK3基因干扰核酸构建体或DKK3基因干扰腺病毒,以及药学上可接受的载体、稀释剂或赋形剂。
在制备这些组合物时,通常将活性成分与赋形剂混合,或用赋形剂稀释,或包在可以胶囊或药囊形式存在的载体中。当赋形剂起稀释剂作用时,它可以是固体、半固体或液体材料作为赋形剂、载体或活性成分的介质。因此,组合物可以是片剂、丸剂、粉剂、溶液剂、糖浆剂、灭菌注射溶液等。合适的赋形剂的例子包括:乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水等。制剂还可包括:湿润剂、乳化剂、防腐剂(如羟基苯甲酸甲酯和丙酯)、甜味剂等。
本发明还公开了所述药物组合物在制备治疗肌肉萎缩的治疗药物中的应用。
该药物组合物的应用为肌肉萎缩的治疗提供了一种方法,具体为一种预防或治疗对象体内萎缩肌肉的方法,包括将有效剂量的所述的药物组合物施用于对象中。进一步的,所述肌肉萎缩选自衰老引起的肌肉萎缩。
所述药物组合物用于预防或治疗对象体内萎缩肌肉时,需要将有效剂量的所述的药物组合物施用于对象中。采用该方法,所述萎缩肌肉内的DKK3基因表达被抑制。进一步的,所述DKK3基因的表达至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95% 或99%的部分被抑制。
所述方法的对象可以为人。
综上所述,本发明设计了针对DKK3基因的RNAi靶点序列,构建相应的DKK3RNAi载体,其中编码序列SEQ ID NO:1的RNAi载体能够显著下调DKK3基因的mRNA水平和蛋白水平。使用腺病毒作为基因操作工具携带shRNA能够靶向地将针对DKK3基因的siRNA序列高效导入萎缩肌肉,降低DKK3基因的表达水平,显著改善肌肉萎缩。因此,腺病毒介导的DKK3基因沉默是肌肉萎缩潜在的临床非手术治疗方式。
本发明提供的siRNA或者包含该siRNA序列的核酸构建体、病毒能够特异性抑制DKK3基因的表达。尤其是病毒,能够高效侵染靶细胞,高效率地抑制靶细胞中DKK3基因的表达,有效改善肌肉萎缩,在肌肉萎缩治疗中具有重要意义。
附图说明
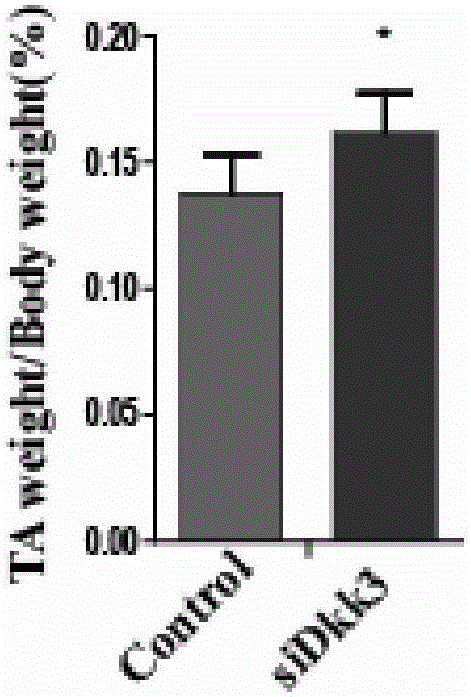
图1A:TA肌肉占体重的比例,与对照组相比,敲低DKK3表达后,TA重量明显增加。
图1B:RT-qPCR检测肌肉萎缩标志基因Atrogin 1。实验组DKK3mRNA水平明显降低,说明RNA干扰实验成功;Atrogin 1表达量下调,说明在干扰DKK3表达后,肌肉萎缩得到改善。
图1C:免疫荧光染色显示肌肉细胞轮廓;与对照组相比,实验组肌肉细胞横切面积明显更大。
图1D:统计学分析肌肉细胞横切面积的大小分布;与实验组相比,对照组肌肉细胞横切面积更大的所占比例更多。
图2A:肌肉拉力测试TA肌肉强直拉力。与对照组相比,实验组肌肉拉力明显增强,可达到2月龄年轻小鼠肌肉拉力的50%左右,说明敲低DKK3后,衰老小鼠的肌肉功能得到很好的恢复。
图2B:肌肉强直收缩后恢复时间;与对照组相比,实验组恢复时间明显更短,说明敲低DKK3后,肌肉功能得到很好的恢复。
具体实施方式
本发明涉及了一组针对DKK3基因的小分子干扰RNA(siRNA)序列、RNA干扰载体 和RNA干扰病毒。选取DKK3mRNA编码区序列作为siRNA的靶位点,根据靶位点中连续的10-30(优选15-27,更优选19-23)个碱基序列设计siRNA靶点序列。通过基因克隆,构建表达上述siRNA的核酸构建体,包装表达上述siRNA的病毒。细胞实验和动物实验均证明,上述siRNA序列能够特异性沉默DKK3基因的表达,从而治疗肌肉萎缩。
本发明的发明人经过广泛而深入的研究发现,在肌肉组织中,DKK3基因的显著高表达会致使肌肉萎缩;发明人发现,采用RNAi方法下调DKK3基因的表达后可有效地治疗肌肉萎缩,这一研究成果表明DKK3基因,可作为肌肉萎缩治疗的靶点。发明人进一步合成和测试了针对DKK3基因的siRNA,筛选出了可有效抑制DKK3的表达进而治疗肌肉萎缩的siRNA,在此基础上完成了本发明。
本发明提供了一敲低DKK3基因的小干扰RNA(siRNA)序列,构建了可特异性沉默DKK3基因表达的腺病毒。本发明研究发现,针对DKK3基因设计的小干扰RNA及RNAi腺病毒,稳定并特异地下调DKK3基因的表达,并有效地改善肌肉萎缩。本发明表明抑制DKK3基因可促进肌肉萎缩改善,有望成为肌肉萎缩治疗的靶点。而且,通过RNAi方式沉默DKK3基因的表达,可作为治疗肌肉萎缩的有效手段。
下面结合实施例进一步阐述本发明。应理解,实施例仅用于说明本发明,而非限制本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照常规条件,如[美]Sambrook.J等著;黄培堂等译。分子克隆试验指南,第三版。北京:科学出版社2002中所述的条件或者制造商建议的条件进行或配置。
实施例1针对DKK3基因RNAi腺病毒的制备
1.筛选针对DKK3基因的有效的siRNA靶点
从NCBI查询获得DKK3的mRNA序列(NM_015814),如下:
通过运用软件,设计特异性敲低DKK3蛋白表达的siDKK3,序列如下:
sense(5'-3')CCAGGAAGUUCACAAGAUAUU;(SEQ ID NO.1)
antisense(5'-3')UAUCUUGUGAACUUCCUGGUU(SEQ ID NO.2)。
用这对siRNA序列合成shRNADKK3,序列如下:
TCGACCAGGAAGTTCACAAGATACTCGAGTATCTTGTGAACTTCCTGGTTTTT;(SEQ ID NO.3)
AATTAAAAACCAGGAAGTTCACAAGATACTCGAGTATCTTGTGAACTTCCTGG(SEQ ID NO.4)。
两段oligo,按以下体系退火:
10x annealing buffer 1ul;100um oligo f:4.5ul;100um oligo r:4.5ul;95℃5min。
自动降温至室温后,用xhol1和EcoR1双酶切用作克隆插入片段。
腺病毒载体pAdTrack-GFP按以下体系酶切:
Vector 1ug;Xhol 1ul;EcoR11ul;Cutsmart 5ul;ddH2O upto 50ul。
胶回收后,用1μlNEB的T4DNA连接酶室温连接5小时后,转化感受态细胞BJ5183,用Kpn1和Xbal1限制性内切酶酶切鉴定后,转染DH5α感受态细胞扩增质粒,提取质粒后,用Pac1限制性内切酶线性化,胶回收后即可用于转染包装病毒的细胞293A。取10μg线性化好的表达质粒,磷酸钙沉淀法转染293A细胞(10μg质粒加入到250μl水中,加入250μl氯化钙溶液,充分混匀备用;取一个50ml离心管,加入500μl的2xHBS溶液,将备好的质粒-钙溶液逐滴加入到HBS溶液中,边加边充分震荡;加完后室温放置20分钟备用;长到约60%底面积的293A细胞取出,吸弃旧培养液,加入10ml生长培养(DMEM+10%FBS),将前面备好的质粒钙沉淀悬液缓慢加入到培养基中,轻轻摇匀后置于37度,5%二氧化碳培养箱中培养;转染后16小时,更换新的生长培养基,继续培养。从48小时后,每日在荧光显微镜下观察,直至镜下所有的细胞都表达绿色荧光(一般需要7-10天)。收集所有的细胞及细胞培养液,1500转/分钟离心室温离心5分钟,弃上清,留细胞沉淀。用PBS洗两次 后,加入500μlPBS重悬,用液氮-37度反复冻融法裂解细胞(冻融3次),2000转/分钟室温离心5分钟,上清转到新的管子备用(即P1代病毒)。培养40盘(10cm培养皿)293A细胞至长到60%底面积,每盘加入10μlP1代病毒感染,24小时后每日镜下观察,直至所有细胞表达绿色荧光(一般需要2-3天)后,按照收P1代病毒同样的方法收取并裂解释放病毒(一般加入2ml PBS裂解细胞获得病毒),至此即获得P2代病毒。测滴度后即可使用(后续如若需要更多的病毒,即按照获取P2代病毒的方法扩增即可)
实施例2敲低肌肉萎缩相关标记DKK3治疗衰老造成的肌肉萎缩的应用
实施例1获得干扰Dkk3的腺病毒后,滴度为1.3x107Tu/ml。对照组为表达GFP的腺病毒,滴度为1.3x107Tu/ml。取20月龄的C57/BL野生型小鼠,左腿TA注射GFP病毒,右腿TA注射干扰DKK3病毒。每次50μl,连续注射7天后,再饲养7天。通过肌肉拉力测试仪,分别测试两条腿TA肌肉的强直肌肉拉力。测试后,取出TA,取一半OCT包埋,液氮速冻后用做冰冻切片。另一半加入1ml TriZol,加入200μl氯仿,充分震荡混匀,12000转/分钟4℃离心15分钟,取上层清亮液体,转入到新的EP管中;加入500μl异丙醇,充分混匀,12000转/分钟4℃离心15分钟,弃上清,向沉淀中加入1ml 75%乙醇洗一次,弃上清后室温晾10分钟;加入40μl无RNA酶的水溶解,获得总的mRNA。分光光度法测mRNA浓度后,取1μg总RNA,加入1μl(200units)NEB公司MuLV反转录酶及其1x反应缓冲液,0.5mM dNTP混合物,4μM Oligo dT,1μl RNase inhibitor 42℃孵育1小时,反转录为cDNA。将cDNA在75℃灭活10分钟,作为qPCR模板。冰冻切片做抗Lammin B免疫荧光染色,显示肌肉细胞的轮廓,用统计软件Image J统计肌肉细胞横切面面积。
首先,通过比较实验组与对照组TA肌肉的重量,如图1A所示,我们发现认为干扰DKK3表达的实验组,TA肌肉重量较对照组有明显的增加。
肌肉组织RNA逆转录获得的cDNA为模板,进行实时荧光定量PCR检测目的基因的表达量。PCR条件为95℃ 10分钟,95℃ 30秒,60℃ 60秒,第二和第三步反复循环40次。采用GAPDH作为内参,所用引物序列为:
GAPDH forward:ACCCAGAAGACTGTGGATGG(SEQID NO.6)
GAPDH reverse:ACACATTGGGGGTAGGAACA(SEQID NO.7)
同时检测肌肉中肌肉萎缩特异性基因Atrogin1(NM_026346.3)和Dkk3(NM_015814),所用引物序列为:
Atrogin 1forward:AGAGAGGCAGATTCGCAAGCGT(SEQID NO.8)
Atrogin 1reverse:TGCAAAGCTGCAGGGTGACCC(SEQID NO.9)
DKK3forward:TGAGGCAGTGGCTACACAAG(SEQID NO.10)
DKK3reverse:GCTGGTATGGGGTTGAGAGA(SEQID NO.11)
如图1B显示降低DKK3表达水平后Atrogin 1的表达量下调了,部分挽救了肌肉萎缩。冰冻组织切片进行免疫荧光染色,切片用4%PFA固定后,加入抗Lammin B抗体(2μg/ml)4°过夜,第二天加入荧光标记的羊抗兔二抗(1:1000)室温孵育1小时候,DAPI染核,室温孵育5分钟,封片后在荧光显微镜下观察拍照。结果,如图1C显示,敲低DKK3表达后,TA肌肉的横切面积较空载对照组明显变大,提示因衰老造成的肌肉萎缩在人为敲低DKK3表达后得到显著改善。通过Image J软件统计肌纤维横切面面积,如图1D,在敲低DKK3表达后,肌肉横切面面积变大。
通过肌肉拉力测试实验,如图2A所示,敲低DKK3表达水平后,TA肌肉的肌肉拉力显著增强,可以恢复到年轻小鼠肌肉拉力的50%水平左右。如图2B所示,实验组肌肉强直收缩后恢复时间教对照组明显缩短,提示肌肉功能得到良好的修复。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!