RGDS修饰的姜黄素,其制备,生物活性和应用的制作方法
本发明涉及姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物,涉及它的制备方法,涉及它抗肿瘤细胞增殖的活性,涉及它抑制A549细胞的迁移和侵袭的作用,涉及它抑制S180荷瘤小鼠瘤体增重的活性,涉及它抑制Lewis肺癌转移的活性,进一步涉及它抑制二甲苯诱导小鼠耳肿胀的活性,进一步涉及它抑制大鼠血栓生成的活性。本发明属于生物医药领域。
背景技术:
恶性肿瘤严重威胁人类健康,恶性肿瘤的死亡率仅次于心脑血管疾病,在所有疾病中居第二位。恶性肿瘤患者大都伴随癌转移、炎症和血栓。癌转移、炎症和血栓使肿瘤患者面临更为恶劣的预后。发明同时具有抗肿瘤、抗癌转移、抗炎症和抗血栓作用的药物,是新药发明的前沿课题。众所周知,姜黄素是姜黄的主要成分,具有广泛的药理作用。例如姜黄素具有抗氧化、抗炎、抗血栓、抗肿瘤和抗菌等作用。可是,由于稳定性差、生物利用率低和水溶性差,目前仍然没有同时具有抗肿瘤、抗癌转移、抗炎症和抗血栓作用的姜黄素衍生物。发明人曾经公开2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-PAK肽是治疗缺血性中风的优秀化合物,2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-RGD肽是抗血栓的优秀化合物。可是,发明人公开的这些化合物都不是同时具有抗肿瘤、抗癌转移、抗炎症和抗血栓作用的化合物。经过3年研究,发明人发现用2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰Lys(The)与Arg-Gly-Asp-Ser偶联生成的化合物同时具有抗肿瘤、抗癌转移、抗炎症和抗血栓作用。根据这些研究结果,发明人提出了本发明。
技术实现要素:
本发明的第一个内容是提供姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物的偶联物。
本发明的第二个内容是提供制备姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物的方法,该方法包括:
(1)制备(E)-6-(4-羟基-3-甲氧基苯基)己-5-烯-2,4-二酮;
(2)制备苄基-2-(4-甲酰基-2-甲氧基苯氧基)乙酸乙酯;
(3)由步骤1和2的产物制备苄基2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6- 二烯-1-基]-2-甲氧基苯氧基}乙酸乙酯;
(4)将苄基2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酸乙酯在4N NaOH水溶液中脱去苄酯基,得到2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酸;
(5)将2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}羧酸与Lys(Boc)-OBzl缩合得到2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc)-OBzl;
(6)将2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc)-OBzl在冰浴下用4N HCl/EA脱除Boc保护基,得到2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys-OBzl;
(7)将2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys-OBzl与Boc-The缩合得到2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)-OBzl;
(8)将2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)-OBzl在2N NaOH水溶液中脱去甲酯保护基,得到2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The);
(9)将2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)与N端游离的侧链最小保护的Arg-Gly-Asp(OBzl)-Ser-OBzl,缩合,制备图2所示的9;
(10)冰浴下先用4N NaOH水溶液中脱去苄酯保护基,再用4N氯化氢的乙酸乙酯溶液脱除Boc保护基,制备图2所示的10;
本发明的第三个内容是评价姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物的抑制肿瘤细胞增殖的活性。
本发明的第四个内容是评价姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物抑制A549细胞迁移的作用。
本发明的第五个内容是评价姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物抑制A549细胞的侵袭的的作用。
本发明的第六个内容是评价姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物抑制荷S180肿瘤小鼠的肿瘤生长的作用。
本发明的第七个内容是评价姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物抑制Lewis肺癌转移的作用。
本发明的第八个内容是评价姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物对小鼠炎症的抑制作用。
本发明的第九个内容是评价姜黄素与寡肽Arg-Gly-Asp-Ser的偶联物在抑制SD大鼠体内动脉血栓生成作用。
附图说明
图1肽的合成路线.i)DCC,HOBT,DMF和NMM;ii)4N氯化氢的乙酸乙酯溶液;iii)4N的NaOH水溶液。
图2 2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(The)-Arg-Gly-Asp-Ser的合成路线.i)乙酰丙酮,硼酐,硼酸三正丁酯和正丁胺;ii)K2CO3和THF;iii)硼酐,硼酸三正丁酯和正丁胺;iv)4N NaOH水溶液;v)DCC,HOBT,DMF和NMM;vi)4N氯化氢-乙酸乙酯溶液。
图3 10对A549细胞迁移能力的影响。
图4 10对A549细胞侵袭能力的影响。
具体实施方式
为了进一步阐述本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
实施例1制备(E)-6-(4-羟基-3-甲氧基苯基)己-5-烯-2,4-二酮
将30mL(100.0mmol)乙酰丙酮溶解于200mL乙酸乙酯中,于60℃加热搅拌。在搅拌中加入12.6g(200mmol)硼酸酐(B2O3)搅拌1小时。随后加入27mL(100.0mmol)硼酸三正丁酯和15.6g(100.0mmol)香草醛,加热至70℃反应30min。之后将10mL正丁胺用乙酸乙酯稀释至100mL缓慢加入反应中并升温至100℃反应2小时。待反应完成后降温至60℃加入100mL 2N盐酸搅拌30分钟。待沉淀物充分析出后,滤除沉淀物并至于分液漏斗中。用饱和硫酸氢钾和饱和氯化钠分别洗涤三次。乙酸乙酯层用无水Na2SO4干燥12小时。过滤,滤液减压浓缩除去乙酸乙酯。残留物用柱层析分离(石油醚∶乙酸乙酯,4∶1),得到8.4g(36%)标题化合物,为浅黄色固体。ESI+-MS(m/e):235[M+H]+。
实施例2制备苄基-2-(4-甲酰基-2-甲氧基苯氧基)乙酸乙酯
将15.6g(100.0mmol)香草醛用100mL无水四氢呋喃溶解,加入8.2g(60mmol)碳酸钾搅拌2小时。随后加入17.4mL(120mol)溴乙酸苄酯,60℃加热反应3天。待原料消失后,滤除不溶物,滤液减压浓缩除去THF。残留物用乙醚结晶,得到20.6g(69%)标题化 合物,为无色固体。ESI+-MS(m/e):301[M+H]+。
实施例3制备苄基2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酸乙酯
将10g(42.7mmol)(E)-6-(4-羟基-3-甲氧基苯基)己-5-烯-2,4-二酮溶解于100mL乙酸乙酯,60℃加热搅拌。在搅拌中加入5.4g(85.4mmol)硼酸酐(B2O3),搅拌1小时。随后加入12mL(42.7mmol)硼酸三正丁酯和6.7g(42.7mmol)苄基-2-(4-甲酰基-2-甲氧基苯氧基)乙酸乙酯,70℃加热反应30min。之后,缓慢加入4.2mL正丁胺与50mL乙酸乙酯的溶液。升温至100℃反应2小时。待反应完成后降温至60℃,加入42mL 2N盐酸,搅拌30分钟。待沉淀物充分析出后,滤除沉淀物。滤液用饱和硫酸氢钾和饱和氯化钠分别洗涤三次。乙酸乙酯层用无水Na2SO4干燥12小时。过滤,滤液减压浓缩除去乙酸乙酯。残留物用柱层析分离(石油醚∶乙酸乙酯,3∶1),得到4.2g(19%)标题化合物,为浅黄色固体。ESI--MS(m/e):516[M-H]-。
实施例4制备2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酸
将8.0g(15.5mmol)2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酸乙酯溶解在100mL甲醇中,冰浴下加入NaOH水溶液(4M),调节pH值到14,搅拌反应6h,TLC检测反应结束。加饱和KHSO4调节pH值到7,滤液减压蒸馏除去全部甲醇,残留水溶液继续用KHSO4调节pH值到2,用乙酸乙酯萃取6次,乙酸乙酯层合并,用饱和NaCl萃洗三次,无水Na2SO4干燥8小时,过滤,滤液减压浓缩除去乙酸乙酯,残留物用二氯甲烷溶解,滤去不容物,得到3.2g(49%)标题化合物,为红色油状物。ESI--MS(m/e):425[M-H]-。
实施例5制备2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰酸-Lys(Boc)-OBzl
将2.13g(5.0mmol)2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酸溶解在20mL无水THF中,冰浴下加入0.81g(6.0mmol)HOBt和1.15g(6.0mmol)DCC。搅拌5分钟后加入1.862g(5.0mmol)HCl·Lys(Boc)-OBzl的无水THF溶液。反应混合物用NMM调节pH 9,冰浴搅拌24小时。停止反应,过滤除去沉淀出的DCU。滤液减压浓缩,残留物溶于乙酸乙酯中,得到的溶液依次用饱和NaHCO3水溶液和饱和NaCl水溶液洗涤3次。二氯甲烷层用无水Na2SO4干燥12小时。过滤,滤液减压浓缩除去乙酸乙酯。残留物用柱层析分离(CH2Cl2∶CH3OH,100∶1),得到2.125g(57%)标题化合物,为黄色固体。ESI+-MS(m/e):745[M+H]+。
实施例6制备2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys-OBzl
将3.720g(5.0mmol)2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc)-OBzl溶解在15mL氯化氢-乙酸乙酯(4mol/L)溶液中,室温搅拌2小时,TLC检测原料点消失。减压除去乙酸乙酯,反复加少量乙醚磨洗,减压除去产品中的氯化氢。最后加少量乙醚将产品研磨成固体粉末,直接用于下一步反应。
实施例7制备2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)-OBzl
将1.37g(5.0mmol)Boc-The溶解在20mL无水THF中,冰浴下加入0.81g(6.0mmol)HOBt和1.15g(6.0mmol)DCC。搅拌30分钟后加入3.22g(5.0mmol)2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys-OBzl的无水THF溶液。反应混合物用NMM调节pH 9,冰浴搅拌10小时。停止反应,滤去沉淀出的DCU。滤液减压浓缩,残留物溶于乙酸乙酯中,得到的溶液依次用饱和NaHCO3水溶液和饱和NaCl水溶液洗涤3次。二氯甲烷层用无水Na2SO4干燥12小时。过滤,滤液减压浓缩除去乙酸乙酯。残留物用柱层析分离(CH2Cl2∶CH3OH,20∶1),得到2.229g(50%)标题化合物,为黄色固体。ESI+-MS(m/e):901[M+H]+。
实施例8制备2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)
将4.505g(5.0mmol)2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)-OBzl溶解在10mL甲醇中,冰浴下加入NaOH水溶液(2M),调节pH值到12,搅拌反应1h,TLC检测反应结束。加饱和KHSO4调节pH值到7,滤液减压蒸馏除去全部甲醇,残留水溶液继续用KHSO4调节pH值到2,用乙酸乙酯萃取6次,乙酸乙酯层合并,用饱和NaCl萃洗三次,无水Na2SO4干燥8小时,过滤,滤液减压浓缩除去乙酸乙酯,得到3.529g(87%)标题化合物,为黄色固体。
实施例9制备2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)-Arg-Gly-Asp(OBzl)-Ser-OBzl(9)
将0.810g(1.0mmol)2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)溶解在20mL无水THF中,冰浴下加入0.135g(1.0mmol)HOBt和0.244g(1.2mmol)DCC。搅拌30分钟后加入0.649g(1.0mmol)HCl·Arg-Gly-Asp(OBzl)-Ser-OBzl的无水THF溶液。反应混合物用NMM调节pH 9,冰浴搅拌10小时。停止反应,滤去沉淀出的DCU。滤液减压浓缩,残留物溶于二氯甲烷中,得 到的溶液依次用饱和NaHCO3水溶液和饱和NaCl水溶液洗涤3次。二氯甲烷层用无水Na2SO4干燥12小时。过滤,滤液减压浓缩除去二氯甲烷。残留物用柱层析分离(CH2Cl2∶CH3OH,20∶1),得到0.124g(9%)标题化合物,为黄色固体。ESI+-MS(m/e):1406.7[M+H]+;1H-NMR(300MHz,DMSO-d6):δ/ppm=8.39-8.06(m,2H),7.82-7.48(m,3H),7.35(m,13H),7.17-6.90(m,2H),6.87-6.75(m,2H),5.08(m,4H),4.77-4.49(m,3H),4.38-4.05(m,2H),3.87-3.71(m,4H),3.72-3.69(m,2H),3.58-3.51(m,4H),3.03(m,4H),2.82(m,2H),2.64(m,1H),2.33-2.26(m,2H),2.18(m,2H),2.05-1.96(m,2H),1.76-1.65(m,6H),1.36-1.24(m,14H),1.06(m,3H)。
实施例10制备2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(The)-Arg-Gly-Asp-Ser(10)
将100mg(0.07mmol)2-{4-[(1E,6E)-7-(4-羟基-3-甲氧基苯基)-3,5-二氧庚-1,6-二烯-1-基]-2-甲氧基苯氧基}乙酰-Lys(Boc-The)-Arg-Gly-Asp(OBzl)-Ser-OBzl溶解在10mL甲醇中,冰浴下加入NaOH水溶液(1.5M),调节pH值到12,搅拌反应1h,TLC检测反应结束。加饱和KHSO4调节pH值到7,滤液减压蒸馏除去全部甲醇,残留水溶液继续用KHSO4调节pH到2,用乙酸乙酯萃取6次,乙酸乙酯层合并,用饱和NaCl洗3次,无水Na2SO4干燥8小时,过滤,滤液减压浓缩除去乙酸乙酯。随后加入氯化氢-乙酸乙酯溶液(4M),室温搅拌12小时,TLC检测原料点消失。减压除去乙酸乙酯,残留物反复加少量乙醚磨洗,减压除去产品中的氯化氢。最后加少量乙醚将产品研磨成粉末。将所得化合物溶于少量水,调pH至7,经Sephadex-G10分离并冷冻干燥。得到0.021g(25%)标题化合物,为黄色固体。 (c=0.09,甲醇);ESI+-MS(m/e):1125.9[M+H]+;1H-NMR(300MHz,DMSO-d6):δ/ppm=8.59(m,2H),8.47(m,1H),8.29(m,3H),8.01(m,1H),7.62(m,1H),7.54-7.41(m,2H),7.32-6.70(m,5H),4.65-4.49(m,2H),4.26(m,2H),3.90-3.84(m,4H),3.76(m,4H),3.64-3.35(m,3H),3.06(m,4H),2.18(m,2H),1.98-1.86(m,5H),1.72-1.60(m,5H),1.57(m,2H),1.49(m,2H),1.31-1.20(m,6H),0.98(m,4H);IR:3261,3063,2969,2938,1730,1657,1650,1511,1447,1423,1373,1250,1216,1140,1029,850,811;HPLC(甲醇∶水95%∶5%C181.0mL/min)纯度为96%。
实施例11制备HCl·Arg-Gly-Asp(OBzl)-Ser-OBzl
用于制备9的HCl·Arg-Gly-Asp(OBzl)-Ser-OBzl按照图1的路线,由标准接肽操作制备。它的前体Boc-Arg-Gly-Asp(OBzl)-Ser-OBzl:ESI-MS(m/e)为714[M+H]+,HPLC纯度>95%,用氯化氢-乙酸乙酯溶液(4M)脱Boc不再纯化,直接用于制备反应。总产率为42%。
实验例1评价化合物10的细胞毒作用
将化合物10用PBS配置,共评价了它们对A549(人肺腺癌细胞)、MCF-7(人乳腺癌细胞)、K562(人肝癌细胞)、U2OS(人骨肉瘤细胞)、HCT-116(人结肠癌细胞)、S180(小鼠肉瘤细胞)和HaCaT(人正常皮肤细胞)6株肿瘤细胞和1株正常细胞的抑制作用。分别将生长状态良好、处于对数生长期的A549、MCF-7、K562、U2OS、HCT-116、S180和HaCaT细胞以3×104个/mL的密度接种于96孔板上,每孔加入100μL含细胞的培养液,在37℃、含5%CO2培养箱中培养4小时,按照预设的浓度梯度加入待测、经灭菌处理的样品,每孔加入25μL10,对照组加入等体积的溶解样品的溶媒。继续培养48小时后,每孔加入25μL浓度为5mg/mL的MTT溶液,置于37℃、含5%CO2培养箱中继续孵育4小时,小心去除上清液(悬浮细胞离心后除去上清液)。随后每孔加入100μL DMSO溶液,振荡约10min使沉淀完全溶解。立即在酶标仪上以波长570nm检测O.D.值。实验平行重复3次。
抑制率按照公式计算,以抑制率对化合物浓度作图,计算本发明化合物10的IC50(半数有效抑制浓度)值。结果列入表1。结果表明本发明的10对A549、MCF-7、U2OS、HCT-116、K562、S180等肿瘤细胞和正常永生化HaCaT细胞没有细胞毒作用。
表1 10对A549等8株细胞增殖的影响(IC50,μM)
n=3
实验例2用Transwell小室实验评价10抗A549细胞侵袭活性
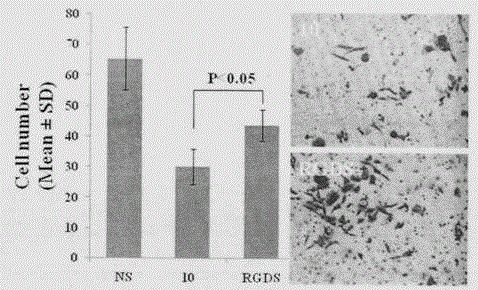
将冻存在-20℃冰箱中的的matrigel放置于4℃冰箱过夜,等待变成matrigel液态后,吸取180μL Matrigel,加入720μL无血清DMEM培养基混匀。将配制好的Matrigel溶液加入至Transwell小室中的上室,每室加入100μL。之后放入37℃、含5%CO2培养箱中孵育5h。吸除小室中残留液体,每孔加入50μL的1640培养基,37℃、5%CO2培养箱中孵育30min。将生长状态良好、处于对数生长期的A549细胞消化离心,无血清A549培养基冲洗3次,配置成密度为5×105个/mL的细胞悬液,每孔加入100μL细胞悬液,同时每 室加入25μL10,使其终浓度为20μM;在下室加入600μL含10%血清胎牛血清的1640培养基,在37℃含5%CO2培养箱中孵育48小时。用棉签小心擦去上室内的细胞;加入4%的多聚甲醛孵育30min将细胞固定。吸除固定液,用PBS洗涤3次;用0.1%结晶紫染色液染色30min,随后吸除染色液,用PBS洗涤3次。侵袭数以每个小室选取6个大致相同的视野观察,拍照,计数。细胞数以表示,重复3次,统计均采用t检验。结果列入图3。结果表明本发明的化合物10抗细胞侵袭的能力显著高。
实验例3用Transwell小室实验评价10抗A549细胞迁移能力
将生长状态良好、处于对数生长期的A549细胞消化离心,无血清A549培养基冲洗3次,配置成密度为5×105个/mL的细胞悬液,每孔加入100μL细胞悬液,同时每室加入25μL10,使其终浓度为20μM;在下室加入600μL含10%血清胎牛血清的1640培养基,在37℃含5%CO2培养箱中孵育48小时。用棉签小心擦去上室内的细胞,加入4%的多聚甲醛孵育30min将细胞固定。吸除固定液,用PBS洗涤3次。用0.1%结晶紫染色液染色30min,随后吸除染色液,用PBS洗涤3次。迁移数以每个小室选取6个大致相同的视野观察,拍照,计数;细胞数以表示,重复3次,统计均采用t检验。结果列入图4。结果表明本发明的化合物10抗细胞迁移的能力显著高。
实验例4评价化合物10的抗肿瘤活性
测定前将本发明的化合物10加吐温80助溶,溶于生理盐水。无菌条件下取接种于ICR小鼠7-10天的S180肉瘤,加入适量生理盐水配制成瘤细胞悬液,细胞数为2×107/mL,接种于健康雄性ICR小鼠前肢腋皮下,每只小鼠注射0.2mL。肿瘤接种24h后,治疗组小鼠每日腹腔注射0.2mL 10a-d的水溶液,连续给药7天,剂量为1μmol/kg。空白组小鼠每日腹腔注射0.2mL生理盐水。以阿霉素(腹腔注射剂量为2μmol/kg)作阳性对照。实验进行至第8天,称小鼠体重,并剖取各组小鼠的肿瘤称重,以瘤重表示化合物的活性,数据列入表2。实验观察到,在1μmol/kg的剂量下化合物10显示出了良好的抗肿瘤活性,而姜黄素仅有微弱的抗肿瘤活性。
表2 10对荷S180小鼠肿瘤重量的影响a
a)与生理盐水,姜黄素及姜黄素+The+RGDS物理混合比p<0.01;n=15.
实验例5评价10的抗肿瘤转移活性
取接种8-10天生长良好的Lewis肺癌荷瘤小鼠,颈椎脱臼,用75%乙醇浸泡消毒10min,在超净工作台上剥离瘤体,选择生长良好的瘤组织,在无菌平皿中剪碎,放置于玻璃组织匀浆器内,按瘤块重(g)∶生理盐水体积(mL)为1∶3的比例加入4℃预冷的生理盐水轻轻研磨,制成细胞悬液,过200目尼龙网制成单细胞悬液,用生理盐水调整细胞浓度至1.5×107/mL。取近交系C57BL/6小鼠,雄性,左手固定小鼠,用75%乙醇消毒小鼠右前肢腋窝皮肤,右手持1mL无菌注射器于小鼠腋部皮下注射瘤细胞悬液0.2mL(含肿瘤细胞数约为1.5×107/mL)。接种后8-10天可以生长成4-5mm大小的肿瘤。测量肿瘤体积,按肿瘤平均体积将小鼠随机分组。从接种肿瘤第9天开始给药,治疗组小鼠每日腹腔注射0.2mL 10的水溶液,连续给药11天,剂量为0.1μmol/kg。空白组小鼠每日腹腔注射0.2mL生理盐水。以Arg-Gly-Asp-Ser和姜黄素(腹腔注射剂量为10μmol/kg)作阳性对照。每隔两天测量并记录肿瘤体积和体重。在第22天测量瘤体积后,称取小鼠体重,摘眼球取血并脱颈椎处死小鼠,然后用镊子固定住小鼠右腋肿瘤生长部位,剪开皮肤,暴露肿瘤,钝性剥离肿瘤并称重,以瘤重表示化合物的活性,数据列入表3。实验观察到,腹腔给与0.1μmol/kg10可有效抑制小鼠肿瘤转移(p<0.05),而且与10μmol/kg Arg-Gly-Asp-Ser的活性相当(p>0.05,有效剂量下降了100倍)。数据还表明10在抑制肿瘤转移的同时能够抑制原发肿瘤生增长,与生理盐水相比具有显著性差异(p<0.05),而且与10μmol/kg姜黄素的活性相当(p>0.05,剂量下降了100倍)。
表3 10对Lewis肺癌小鼠原发瘤瘤重及肿瘤转移的影响
a)与生理盐水相比p<0.05,与RGDS相比p>0.05;b)与生理盐水相比p<0.05,与姜黄素相比p>0.05;n=12。
实验例6评价10的抗炎症活性
ICR雄性小鼠105只,体重18-22g,随机分为10a-d,阿司匹林组和空白对照组,每组 12只。治疗组小鼠腹腔注射0.2mL 10的水溶液,剂量为1μmol/kg。空白组小鼠每日腹腔注射0.2mL生理盐水。以阿司匹林(口服给药剂量为1100μmol/kg)作阳性对照。给药30分钟后,在小鼠左耳朵耳廓内侧均匀涂抹30μL二甲苯,2小时后乙醚麻醉颈椎脱臼处死小鼠,分别将左、右两耳外耳廓剪下并重合叠放在一起,用直径7mm的打孔器在同一位置打取圆形耳片,称重并记录并计算两耳重量差并进行统计;鼠耳肿胀度(mg)=左耳片重-右耳片重。数据列入表4。实验观察到,10在1μmol/kg剂量下可有效地抗炎,活性是阿司匹林的110倍。
表4腹腔注射10对小鼠炎症的影响
a)与生理盐水及110μmol/kg阿司匹林比p<0.01;n=12。
实验例7评价10的抗血栓活性
SD雄性大鼠105只,体重180-220g,随机分组,阿司匹林组、姜黄素组和空白对照组,每组12只。治疗组小鼠腹腔注射0.2mL 10的水溶液,剂量为1nmol/kg。空白组小鼠每日腹腔注射0.2mL生理盐水。以阿司匹林(口服给药剂量为167μmol/kg)作阳性对照。给药30分钟后,各组大鼠以20%乌拉坦麻醉,分离出颈总动脉和颈总静脉,以大鼠颈总动脉-静脉插管旁路循环丝线法造成大鼠动脉血栓模型;循环15分钟,取出旁路管中的带栓的丝线,拭去表面浮血,称量带栓丝线湿重,减去丝线重量后,即得形成血栓的湿重,记录数据并进行统计。实验观察到,1nmol/kg 10能抑制血栓形成,活性与167μmol/kg阿司匹林相当(p>0.05,剂量比阿司匹林下降了167000倍)。姜黄素在这个剂量下没有血栓抑制活性。数据列入表5。
表5腹腔注射10对大鼠血栓的影响
a)与生理盐水相比p<0.01,与阿司匹林比p>0.05;n=12。
- 还没有人留言评论。精彩留言会获得点赞!