一种鬼臼毒素与去甲斑蝥素的拼合物及其制备与应用的制作方法
本发明涉及有机化学和药物化学领域,具体为一种鬼臼毒素与去甲斑蝥素的拼合物,以及这种化合物的制备方法和用途。
背景技术:
在肿瘤的治疗过程中,基于单一生物靶标或途径的抗肿瘤药物在临床上已经得到广泛的应用(Nature.2004,432,294–297)。它们对特定的生物靶点或作用途径表现出较好的药效,并降低了药物副作用的风险(Nat.Rev.Drug Discov.2006,5,993–996)。然而,肿瘤是一种具有多种病因网络的复杂疾病。在很多情况下,当一种特定的靶标或路径被完全阻断后,肿瘤细胞会通过其它潜在的作用途径补偿这种改变,使作用效果大大降低,甚至消失。故现在普遍认为,作用于多个作用靶点的药物要比作用单一的药物在临床上对疾病有更好的治疗效果(Nat.Rev.Cancer.2009,9,508–516)。对于多因素多靶点疾病的治疗,一是通过多种单一靶点药物的联合用药来实现,还可以用一种同时作用于多个与疾病相关因素的多个靶点药物来治疗。尽管联合用药在临床对肿瘤的治疗已经广泛在使用,但是这些药物在使用过程中表现复杂的药代动力学性质、药物相互作用和毒理学特征(Drug Discov.Today.2007,12,34–42)。因此,在癌症的治疗过程中人们更加倾向于发现能够同时作用于多个作用靶点的药物。
依托泊苷(VP-16)作为一种重要的抗肿瘤药物,被国际卫生组织推荐为抗肿瘤特别是肺癌的首选药物之一,也是我国抗肿瘤基本药物之一,广泛应用于小细胞肺癌、急性白血病及前列腺癌等多种癌症的治疗。它主要通过抑制拓扑异构酶Ⅱ(TOP-Ⅱ)起作用(Curr.Med.Chem.Anti-Cancer Agents 2005,5,363–372)。VP-16通过捕获由TOP-Ⅱ介导的DNA断裂复合物来形成三重稳定复合物,诱导的细胞死亡。这类表鬼臼类化合物的作用是使DNA不能正常重组,从而激活表达致死性蛋白酶。但该药仍存在耐药性、水溶性差、严重的骨髓抑制和胃肠道反应、生物利用度低以及可能诱发继发性急性髓细胞白血病等缺点(Pharmacogenet.Genom.2009,19,552–553)。
斑蝥素是昆虫纲鞘翅目(Coleoptera)芫菁科(Meloidae)斑芫菁属(Mylabris)昆虫斑蝥的主要成分,在临床上主要用于肝癌、肺癌以及是消化道癌的治疗,但是由于斑蝥素具有严重的肾毒性和炎症副作用,从而限制其在临床上的广泛使用(Toxicol.Pathol.2006,34,319;Biochem.Pharmacol.2014,87,399)。去甲斑蝥素(NCTD),是抗肿瘤药物斑蝥素去甲基衍生物,与斑蝥素相比可以有效的降低对肾脏的毒性作用以及炎症等副作用,在体外对多种肿瘤细胞株具有明显的抑制作用,在临床上主要用于肝癌的治疗(Eur.J.cancer.1995,31A,953;Bioorg.Med.Chem.Lett.2000,10,1687)。
因此,本发明利用多靶点物设计的药效团结合法,设计合成一种鬼臼毒素与去甲斑蝥素的拼合物,体外实验结果表明这种化合物对癌细胞具有较好的细胞毒活性、较低的毒性和适当的脂水分配系数,是一种具有开发为新型抗癌药物的化合物;在制备方法上,本发明通过简单方法高效地合成了关键中间体及其目标化合物。
技术实现要素:
本发明的目的之一在于,将两个具有不同抗癌作用机理的化合物拼合成为一种新的化合物,期望通过多靶点作用机制实现提高所设计化合物的抗癌效果及降低其毒性。细胞毒性实验发现本发明化合物对多种癌细胞具有较强的体外抑制作用,同时对正常细胞的毒性较小。
本发明的目的之二在于,提供一种制备上述鬼臼毒素与去甲斑蝥素拼合物的方法。
一种具有抗癌活性的结构如式Ⅰ的化合物,
其中:
R为氢,或甲基,或异丙基,或新丁基,或异丁基,或甲硫亚甲基,或苯基,或苄基,或羟甲基,或2-羟基乙基,或对羟基苄基,或2-苯并吡咯亚甲基。
一种具有抗癌活性的结构如式Ⅱ的化合物,
其中:
n是2,或3。
一种具有抗癌活性的结构如式Ⅲ的化合物,
本发明中式Ⅰ所示化合物的制备方法,其特征是以去甲斑蝥素为原料,首先和甘氨酸,或L-丙氨酸,或L-缬氨酸,或L-亮氨酸,或L-异亮氨酸,或L-甲硫氨酸,或L-苯氨酸,或L-苯丙氨酸,或L-色氨酸反应生成甘氨酸去甲斑蝥酰亚胺,或L-丙氨酸去甲斑蝥酰亚胺,或L-缬氨酸去甲斑蝥酰亚胺,或L-亮氨酸去甲斑蝥酰亚胺,或L-异亮氨酸去甲斑蝥酰亚胺,或L-甲硫氨酸去甲斑蝥酰亚胺,或L-苯氨酸去甲斑蝥酰亚胺,或L-苯丙氨酸去甲斑蝥酰亚胺,或L-色氨酸去甲斑蝥酰亚胺(化学试剂.2010,32(2),111–113;化学研究与应用2009,21(2),254–257);同时以去甲鬼臼毒素为原料,通过其4-位叠氮化并还原制得4β-胺基-4′-去甲表鬼臼毒素(Bioorg.Med.Chem.Lett.2007,17,2091–2095);最后在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)和1-羟基苯并三唑(HOBT)存在的条件下上述制得的两类化合物发生反应得到式Ⅰ所代表的目标化合物。
本发明中式Ⅱ所示化合物的制备方法,其特征是以去甲斑蝥素为原料,首先和β-氨基丙酸,或γ-氨基丁酸反应生成β-氨基丙酸去甲斑蝥酰亚胺,或γ-氨基丁酸去甲斑蝥酰亚胺。然后与4β-氨基-4′-去甲表鬼臼毒素在EDCI和HOBT存在的条件下反应得到式Ⅱ所代表的目标化合物。
本发明中式Ⅲ所示化合物的制备方法,其特征是以去甲斑蝥素为原料,首先和对氨基苯甲酸反应生成对氨基苯甲酸去甲斑蝥酰亚胺,然后与4β-氨基-4′-去甲表鬼臼毒素在EDCI和HOBT存在的条件下反应得到式Ⅲ所代表的目标化合物。
本发明中式Ⅰ、Ⅱ、Ⅲ所述的化合物的制备方法,其特征是反应中4β-氨基-4′-去甲表鬼臼毒素与相应去甲斑蝥酰亚胺反应的物质量比为1:1.05-1.20,反应温度为20–40℃,催化剂为EDCI和HOBT。
本发明中式Ⅰ、Ⅱ、Ⅲ所述的化合物对A-549、HepG2、HeLa和HCT-8四种癌细胞生长有显著的抑制作用,其中的部分化合物对这些癌细胞增殖的抑制作用明显强于临床抗癌药物VP-16,且对正常人胚胎肺成纤维细胞WI-38的毒性较低。因此本发明的化合物可用于制备抗癌药物。
下面通过实施例进一步说明本发明的方法。应理解的是,本发明实施例的制备方法仅仅 是用于说明本发明,而不是对本发明的限制,在本发明的构思前提下对本发明制备方法的简单改进都属于本发明要求保护的范围。
附图说明
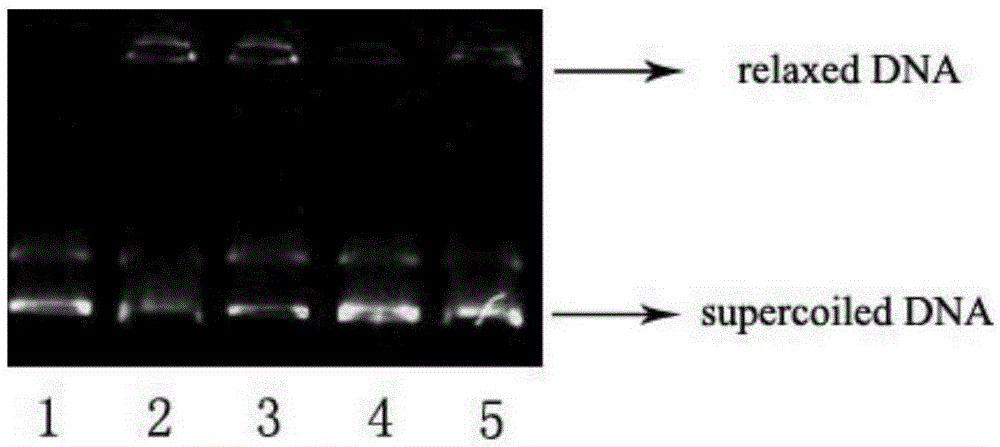
图1化合物Ⅱb对TOP-Ⅱ的影响
线1:超螺旋pBR322质粒DNA;线2:Topo-Ⅱ对照(Topo-Ⅱ+DNA);线3:50μMⅡb+DNA+Topo-Ⅱ;线4:100μMⅡb+DNA+Topo-Ⅱ;线5:100μM V-P16+DNA+Topo-Ⅱ
具体实施方式
本发明提供以下的实施例:
实施例1:去甲斑蝥酰亚胺甘氨酸的制备
将去甲斑蝥素(336mg,2.0mmol)和甘氨酸(150mg,2.0mmol)置于小型研钵中,研磨均匀后将其转移至50mL圆底烧瓶中,氮气保护,油浴加热至160-170℃,反应40mins后,反应物呈黄色油状物,且不再有气泡产生,即可终止反应,降至室温,用丙酮重结晶得到白色结晶产物去甲斑蝥酰亚胺甘氨酸。1H NMR(600MHz,DMSO-d6)δ4.63(s,2H),4.00(s,2H),3.10(s,2H),1.60–1.58(m,4H)。
用L-丙氨酸,或L-缬氨酸,或L-亮氨酸,或L-异亮氨酸,或L-甲硫氨酸,或L-苯氨酸,或L-苯丙氨酸,或L-色氨酸,或β-氨基丙酸,或γ-氨基丁酸,或对氨基苯甲酸分别代替甘氨酸,同法可制备去甲斑蝥酰亚胺L-丙氨酸,或去甲斑蝥酰亚胺L-缬氨酸,或去甲斑蝥酰亚胺L-亮氨酸,或去甲斑蝥酰亚胺L-异亮氨酸,或去甲斑蝥酰亚胺L-甲硫氨酸,或去甲斑蝥酰亚胺L-苯氨酸,或去甲斑蝥酰亚胺L-苯丙氨酸,或去甲斑蝥酰亚胺L-色氨酸,或β-N-(去甲斑蝥酰亚胺)-氨基丙酸,或γ-N-去甲斑蝥酰亚胺氨基丁酸,或对氨基-去甲斑蝥酰亚胺-苯甲酸。
实施例2:4β-氨基-4′-去甲表鬼臼毒素的制备
将4′-去甲表鬼臼毒素(4g,0.01mol)溶于干燥的二氯甲烷50mL中,然后向反应体系加入叠氮酸/苯溶液15mL,将反应体系冷却至-15℃,然后开始缓慢滴加三氟化硼乙醚2.4mL,反应完全后加入吡啶淬灭反应。有机层后分别用水、稀盐酸、碳酸氢钠以及饱和食盐水洗涤,干燥,过滤,蒸除溶剂,进一步纯化得4β-N3-4′-去甲表鬼臼毒素,产率85%。
4β-N3-4′-去甲表鬼臼毒素(18g,0.042mol)溶于干燥的乙酸乙酯200mL中,然后加入10%Pd/C,在压力为4MPa的氢气氛下反应过夜,停止反应后,滤除钯碳,蒸除溶剂,得白色固体4β-NH2-4′-去甲表鬼臼毒素,产率90%。
实施例3:去甲斑蝥酰亚胺基甘氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
将去甲斑蝥酰亚胺基甘氨酸(113mg,0.5mmol)溶于二氯甲烷中,冰浴搅拌下加入缩合剂EDCI,待其溶解后加入HOBt,再加入4β-氨基-4′-去甲表鬼臼毒素(210mg,0.53mmol),继续室温反应过夜,待反应基本完全后停止反应,反应液用水并用无水Na2SO4干燥,蒸除滤 液得淡黄色粗产物,柱层析得白色固体纯品,收率:68%。mp:201-203℃;IR(KBr cm–1)3348,2953,1775,1705,1613,1516,1484,1393,1229,1112,1036,999,938;1H NMR(600MHz,CDCl3)δ6.75(s,1H),6.50(s,1H),6.40(d,J=7.2Hz,1H),6.27(s,1H),5.97(d,J=5.4Hz,2H),5.24-5.21(m,1H),4.79(d,J=4.8Hz,1H),4.61(d,J=4.8Hz,1H),4.53(d,J=4.8Hz,1H),4.33(t,J=8.4Hz,1H),4.25(d,J=16.2Hz,1H),4.16(d,J=16.2Hz,1H),3.82(t,J=9.6Hz,1H),3.75(s,6H),2.99-2.96(m,2H),2.92–2.90(m,1H),2.80(dd,J=14.4,4.8Hz,1H),1.84-1.79(m,2H),1.63-1.61(m,2H);13C NMR(150MHz,CDCl3)δ176.3,176.2,174.5,165.5,148.2,147.4,146.4(2C),133.9,132.4,130.2,128.5,109.9,109.1,107.7(2C),101.5,79.8(2C),68.6,56.3(2C),49.9(2C),49.8,48.0,43.5,41.6,36.8,28.4,28.2;MS-ESI:629.1861([M+Na]+,100%);HRMS(ESI)629.1731for[M+Na]+(calcd 629.1742for C31H30N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ a。
实施例4:去甲斑蝥酰亚胺基-L-丙氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-丙氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:52%。mp:169-170℃;IR(KBr cm–1)3379,2943,1774,1704,1614,1515,1484,1391,1228,1114,1035,998,931;1H NMR(600MHz,CDCl3)δ6.71(s,1H),6.48(s,1H),6.27(s,2H),5.99-5.98(m,2H),5.91(d,J=7.8Hz,1H),5.43(s,1H),5.31-5.27(m,1H),4.76-4.74(m,3H),4.54(d,J=4.8Hz,1H),4.34(t,J=8.4Hz,1H),3.94(t,J=9.9Hz,1H),3.76(s,6H),2.96-2.90(m,3H),2.81(dd,J=14.4,4.8Hz,1H),1.87-1.85(m,2H),1.63-1.61(m,2H),1.59(d,J=7.2Hz,3H);13C NMR(150MHz,CDCl3)δ176.6,176.3,174.6,168.1,148.3,147.5,146.4(2C),133.9,132.3,130.3,128.8,110.0,109.0,107.7(2C),101.5,80.2,80.0,68.5,56.4(2C),49.6(2C),49.5,49.4,48.0,43.5,41.4,36.6,30.9,28.4,28.1,13.7;MS-ESI:643.2007([M+Na]+,100%);HRMS(ESI)643.1887for[M+Na]+(calcd643.1898for C32H32N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ b。
实施例5:去甲斑蝥酰亚胺基-L-缬氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-缬氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:57%。mp:163-165℃;IR(KBr cm–1) 3368,2966,1775,1705,1613,1505,1484,1386,1228,1114,1037,999,930;1H NMR(600MHz,CDCl3)δ6.68(s,1H),6.53(d,J=7.2Hz,1H),6.50(s,1H),6.28(s,2H),5.98(d,J=3.6Hz,2H),5.30(s,1H),5.18-5.15(m,1H),4.86(d,J=4.2Hz,1H),4.78(d,J=3.6Hz,1H),4.56(d,J=4.8Hz,1H),4.36(t,J=8.4Hz,1H),4.25(d,J=10.2Hz,1H),3.85(t,J=9.9Hz,1H),3.76(s,6H),2.96-2.90(m,3H),2.84(dd,J=14.4,4.8Hz,1H),2.77–2.74(m,1H),1.89-1.86(m,2H),1.62-1.60(m,2H),1.11(m,3H),0.79-0.77(m,3H);13C NMR(150MHz,CDCl3)δ177.4,177.2,174.5,168.0,148.3,147.4,146.4(2C),134.0,132.5,130.3,128.7,110.1,108.9,107.7(2C),101.5,79.6(2C),68.7,62.0,56.4(2C),49.6,49.3,48.2,43.5,41.6,37.0,28.5,28.4,26.3,20.6,19.0;MS-ESI:671.2226([M+Na]+,100%);HRMS(ESI)649.2382for[M+H]+(calcd 649.2392for C34H37N2O11).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ c。
实施例6:去甲斑蝥酰亚胺基-L-亮氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-亮氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:52%。mp:171-173℃;IR(KBr cm–1)3378,2959,1775,1700,1614,1506,1484,1388,1228,1114,1037,999,933;1H NMR(600MHz,CDCl3)δ6.71(s,1H),6.48(s,1H),6.27(s,2H),6.04(d,J=8.4Hz,1H),5.98(s,2H),5.43(s,1H),5.30-5.25(m,1H),4.76-4.71(m,3H),4.53(d,J=4.8Hz,1H),4.34(t,J=4.4Hz,1H),3.89(t,J=9.9Hz,1H),3.76(s,6H),2.96-2.88(m,3H),2.82(dd,J=14.4,5.4Hz,1H),1.98-1.93(m,1H),1.88-1.83(m,2H),1.64-1.61(m,3H),1.37-1.36(m,1H),0.93-0.89(m,6H);13C NMR(150MHz,CDCl3)δ176.8,176.7,174.6,168.2,148.3,147.5,146.3(2C),133.9,132.3,130.3,128.8,110.0,109.0,107.6(2C),101.5,80.2,80.0,68.5,56.3(2C),52.8,49.5(2C),48.0,43.5,41.5,36.7,35.6,28.5,28.1,24.8,23.1,21.1;MS-ESI:685.1986([M+Na]+,100%);HRMS(ESI)685.2354for[M+Na]+(calcd 685.2368for C35H38N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ d。
实施例7:去甲斑蝥酰亚胺基-L-异亮氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-异亮氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:53%。mp:177-179℃;IR(KBr cm–1)3463,2966,1775,1704,1615,1506,1484,1385,1227,1114,1037,999,931;1H NMR(600MHz, CDCl3)δ6.68(s,1H),6.60(d,J=7.2Hz,1H),6.51(s,1H),6.28(s,2H),5.98(d,J=5.4Hz,2H),5.43(s,1H),5.16-5.13(m,1H),4.87(d,J=4.8Hz,1H),4.79(d,J=4.8Hz,1H),4.58-4.56(m,1H),4.38(t,J=4.5Hz,1H),4.33(d,J=11.4Hz,1H),3.83(t,J=9.9Hz,1H),3.77(s,6H),2.95-2.88(m,3H),2.84(dd,J=14.4,4.8Hz,1H),2.61-2.59(m,1H),1.90-1.87(m,2H),1.63-1.59(m,3H),1.28-1.24(m,1H),1.06-0.91(m,3H),0.82-0.76(m,3H);13C NMR(150MHz,CDCl3)δ177.7,177.2,174.6,168.3,148.3,147.4,146.4(2C),133.9,132.5,130.3,128.6,110.1,108.9,107.7(2C),101.5,79.6(2C),68.8,61.2,56.4(2C),49.6,49.3,48.3,43.5,41.6,37.1,31.6,28.5,28.4,24.9,16.5,10.1;MS-ESI:685.1986([M+Na]+,100%);HRMS(ESI)685.2362for[M+Na]+(calcd 685.2368for C35H38N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ e。
实施例8:去甲斑蝥酰亚胺基-L-甲硫氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-甲硫氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:67%。mp:158-160℃;IR(KBr cm–1)3371,2917,1775,1705,1613,1505,1484,1386,1227,1113,1037,999,931;1H NMR(600MHz,CDCl3)δ6.71(m,1H),6.48(m,1H),6.27(m,2H),5.96(m,2H),5.95(d,J=8.4Hz,1H),5.26(m,1H),4.87-4.84(m,1H),4.77-4.75(m,1H),4.54(m,1H),4.34(t,J=8.4Hz,1H),3.91(t,J=10.2Hz,1H),3.75(s,6H),2.98-2.87(m,3H),2.81(dd,J=14.4,5.4Hz,1H),2.59-2.33(m,4H),2.08-2.05(m,3H),1.88-1.82(m,2H),1.65-1.59(m,3H);13C NMR(150MHz,CDCl3)δ176.8,176.7,174.6,167.4,148.3,147.5,146.4(2C),133.9,132.3,130.3,128.7,110.0,109.0,107.7(2C),101.6,80.2,80.1,68.4,56.4(2C),53.1,49.6,49.5,48.0,43.5,41.4,36.6,28.4,28.1,25.9(2C),15.4;MS-ESI:703.1952([M+Na]+,100%);HRMS(ESI)703.1923for[M+Na]+(calcd703.1932for C34H36N2O11SNa).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ f。
实施例9:去甲斑蝥酰亚胺基-L-苯氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-苯氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:63%。mp:184-185℃;IR(KBr cm–1)3416,2912,1775,1707,1613,1504,1484,1387,1228,1113,1037,1000,941;1H NMR(600MHz,CDCl3)δ6.72(s,1H),6.45(s,1H),6.26(s,2H),5.97(m,2H),5.76(s,1H),5.24-5.22(m,1H), 4.89(d,J=5.4Hz,1H),4.67(d,J=4.8Hz,1H),4.49(d,J=4.2Hz,1H),4.38(t,J=8.7Hz,1H),4.10(t,J=10.2Hz,1H),3.76(s,6H),2.98-2.93(m,3H),2.66-2.63(m,1H),1.86-1.80(m,2H),1.64-1.60(m,2H);13C NMR(150MHz,CDCl3)δ176.5,176.2,174.4,166.7,148.3,147.5,146.4(2C),134.0,133.1,132.6,130.2,129.3,129.2(2C),129.1(2C),128.2,110.1,108.9,107.8,107.7,101.6,79.6,79.4,68.9,58.3,56.4(2C),49.9(2C),48.9,43.5,41.8,37.2,28.5,28.4;MS-ESI:705.1467([M+Na]+,100%);HRMS(ESI)705.2040for[M+Na]+(calcd 705.2055for C37H34N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ g。
实施例10:去甲斑蝥酰亚胺基-L-苯丙氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-苯丙氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:56%。mp:175-177℃;IR(KBr cm–1)3387,2955,1775,1704,1613,1505,1484,1387,1228,1113,1037,999,931;1H NMR(600MHz,CDCl3)δ7.26-7.10(m,5H),6.71(s,1H),6.48(s,1H),6.27(s,2H),5.98(d,J=4.2Hz,2H),5.95(d,J=8.4Hz,1H),5.43(s,1H),5.32-5.29(m,1H),4.96-4.93(m,1H),4.71(d,J=4.8Hz,1H),4.68(d,J=4.8Hz,1H),4.54(d,J=4.8Hz,1H),4.35(t,J=8.4Hz,1H),3.91(t,J=9.9Hz,1H),3.77(s,6H),3.58(dd,J=14.4,5.4Hz,1H),3.43-3.38(m,1H),2.92-2.90(m,1H),2.80-2.67(m,3H),1.85-1.78(m,2H),1.56-1.25(m,2H);13C NMR(150MHz,CDCl3)δ176.9,176.1,174.6,167.2,148.3,147.5,146.4(2C),136.4,134.0,132.2,130.3,128.8,128.7(2C),128.6(2C),127.0,110.0,109.0,107.7(2C),101.5,80.1,79.9,68.4,56.4(2C),55.1,49.3(2C),47.9,43.5,41.4,36.6,33.0,28.3,28.1;MS-ESI:719.2307([M+Na]+,100%);HRMS(ESI)697.2389for[M+H]+(calcd 697.2392for C38H37N2O11).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ h。
实施例11:去甲斑蝥酰亚胺基-L-色氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-L-色氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:58%。mp:195-196℃;IR(KBr cm–1)3384,2910,1773,1701,1616,1506,1483,1389,1227,1112,1036,998,932;1H NMR(600MHz,CDCl3)δ8.14(s,1H),7.50(d,J=7.8Hz,1H),7.34(d,J=7.8Hz,1H),7.20-7.17(m,1H),7.10-7.04(m,2H),6.72(s,1H),6.46(s,1H),6.26(s,2H),6.01-5.98(m,3H),5.43(s,1H), 5.30-5.26(m,1H),5.04-5.01(m,1H),4.74(d,J=4.8Hz,1H),4.69(d,J=4.8Hz,1H),4.46-4.45(m,1H),4.32-4.29(m,1H),3.81-3.77(m,1H),3.76(s,6H),3.70(dd,J=15.0,6.0Hz,1H),3.57-3.52(m,1H),2.88-2.84(m,1H),2.76(d,J=6.6Hz,1H),2.62(d,J=6.6Hz,1H),2.50(dd,J=14.4,4.8Hz,1H),2.18-1.77(m,2H),1.63(s,1H),1.57-1.48(m,2H);13C NMR(150MHz,CDCl3)δ177.0,176.4,174.5,167.4,148.3,147.5,146.4(2C),136.0,133.9,132.2,130.3,128.7,127.0,122.6,122.4,119.8,118.2,111.4,110.7,110.0,109.0,107.6(2C),101.5,79.9,79.8,68.4,56.4(2C),54.9,49.5,49.4,47.8,43.5,41.3,36.6,28.4,28.1,23.1;MS-ESI:758.2207([M+Na]+,100%);HRMS(ESI)758.2310for[M+Na]+(calcd 758.2320for C40H37N3O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅰ i。
实施例12:去甲斑蝥酰亚胺基-β-丙氨酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基-β-丙氨酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:65%。mp:238-240℃;IR(KBr cm–1)3344,2955,1770,1691,1612,1524,1480,1396,1224,1116,1032,996,920;1H NMR(600MHz,CDCl3)δ6.81(s,1H),6.51(s,1H),6.27(s,2H),6.20(d,J=7.2Hz,1H),5.98(d,J=7.2Hz,2H),5.21-5.18(m,1H),4.82(d,J=4.2Hz,1H),4.72(d,J=4.2Hz,1H),4.56(d,J=4.2Hz,1H),4.38-4.35(m,1H),3.85-3.82(m,1H),3.81-3.73(m,8H),2.91-2.85(m,4H),2.58-2.55(m,2H),1.86-1.82(m,2H),1.60-1.58(m,2H);13C NMR(150MHz,CDCl3)δ177.1,177.0,174.6,169.8,148.3,147.5,146.4(2C),133.9,132.5,130.3,128.7,110.0,109.2,107.6(2C),101.6,79.1,79.0,68.9,56.3(2C),49.8(2C),48.2,43.5,41.6,37.0,35.2,34.1,28.5(2C);MS-ESI:643.1505([M+Na]+,100%);HRMS(ESI)643.1895for[M+Na]+(calcd 643.1898for C32H32N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅱ a。
实施例13:去甲斑蝥酰亚胺基丁酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基丁酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:68%。mp:178-179℃;IR(KBr cm–1)3350,2952,1773,1698,1613,1516,1484,1404,1228,1113,1036,999,940;1H NMR(600MHz,CDCl3)δ6.81(s,1H),6.52(s,1H),6.31-6.29(m,3H),5.99-5.97(m,2H),5.26-5.23(m,1H),4.83(d,J=4.8Hz,1H),4.78(d,J=4.2Hz,1H),4.59(d,J=4.2Hz,1H),4.42-4.38(m,1H),3.93-3.89 (m,1H),3.78(s,6H),3.53-3.50(m,2H),2.98-2.95(m,2H),2.89-2.87(m,2H),2.17-2.12(m,2H),1.98-1.92(m,2H),1.85-1.82(m,2H),1.62-1.60(m,2H);13C NMR(150MHz,CDCl3)δ177.7,177.5,174.6,171.9,148.2,147.5,146.4(2C),133.9,132.4,130.3,129.1,110.0,109.0,107.7(2C),101.5,79.2(2C),69.0,56.4(2C),49.8(2C),48.0,43.6,41.7,38.0,37.1,32.8,28.5(2C),23.7;MS-ESI:657.1684([M+Na]+,100%);HRMS(ESI)657.2043for[M+Na]+(calcd657.2055for C33H34N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅱ b。
实施例14:去甲斑蝥酰亚胺基苯甲酸4β-胺基-4′-去甲表鬼臼甲酰胺的制备
操作过程与实施案例3同,只是用去甲斑蝥酰亚胺基苯甲酸代替去甲斑蝥酰亚胺基甘氨酸,得白色固体纯品,收率:72%。mp:220-221℃;IR(KBr cm–1)3469,2961,1774,1712,1609,1503,1483,1383,1228,1113,1036,999,929;1H NMR(600MHz,CDCl3)δ7.82(d,J=9.0Hz,2H),7.32(d,J=8.4Hz,2H),6.79(s,1H),6.64(d,J=7.8Hz,1H),6.53(s,2H),6.30(s,2H),5.98(d,J=7.8Hz,1H),5.50(s,1H),5.41(m,1H),4.98(s,2H),4.58(d,J=4.8Hz,1H),4.45(t,J=8.1Hz,1H),3.83(t,J=9.9Hz,1H),3.77(s,6H),3.05-2.97(m,4H),1.93-1.91(m,2H),1.69-1.67(m,2H);13C NMR(150MHz,CDCl3)δ176.0,175.9,174.4,166.4,148.4,147.6,146.4(2C),134.9,134.0,133.1,132.7,130.1,128.6,127.9(2C),126.5(2C),110.0,109.1,107.7(2C),101.7,79.5(2C),69.1,56.4(2C),50.0(2C),48.6,43.6,41.8,37.3,28.6,28.5;MS-ESI:691.1542([M+Na]+,100%);HRMS(ESI)691.1887 for[M+Na]+(calcd 691.1898for C36H32N2O11Na).
进行后述对细胞增殖抑制实验中,本实施例样品编号为Ⅲa。
实施例15:去甲表鬼臼毒素与去甲斑蝥素拼合物对癌细胞的体外细胞毒活性
为了研究本次实验中所合成的目标化合物抑制肿瘤细胞增殖的能力,我们测定了化合物对四种人类肿瘤细胞(人非小细胞肺癌细胞A-549、人肝癌细胞HepG2、人宫颈癌细胞HeLa和人结肠癌细胞HCT-8)和人胚胎肺成纤维细胞WI-38的体外细胞毒活性,并以VP-16和NCTD作为空白对照。实验采用的检测方法是标准的MTT法。实验方法为:
取对数生长期的细胞,用含10%胎牛血清的RPMI 1640培养基制成细胞悬液,每孔6000个细胞接种到96孔板中,平板放入37℃,含5%CO2空气及100%湿度的孵育箱培养24h使其贴壁,后置换含有不同浓度药物的含10%胎牛血清的RPMI 1640培养基(200μL/孔),药物 浓度分别为10-4,2×10-5,4×10-6,8×10-7,1.6×10-7,3.2×10-8mol/L,并设调零孔,空白组,阳性对照组VP-16,每组三复孔,孵育培养48小时后取出,每孔加入20μL MTT(5mg/mL),再孵育培养4h,使MTT还原为甲臢,吸出上清液,每孔加入150μL DMSO,震荡使甲臢晶体溶解,用酶标仪测量细胞液在570nm处的OD值,计算化合物各浓度的抑制率。由抑制率计算IC50值,并取三次试验的平均值。
化合物Ⅰ a–i、Ⅱ a–b和Ⅲa对人肺癌A-549、肝癌HepG2、宫颈癌HeLa和结肠癌HCT-8四种癌细胞及正常人胚胎肺成纤维细胞WI-38生长抑制的体外药理试验结果见表1。
表1化合物Ⅰ a–i、Ⅱ a–b和Ⅲa、VP-16以及NCTD的细胞毒性(IC50,μM)
注:(1)实验结果是三次平行实验的统计结果;(2)作用时间:48小时
体外实验证明,合成的12个化合物对人非小细胞肺癌细胞A-549、人肝癌细胞HepG2、人宫颈癌细胞HeLa和人结肠癌细胞HCT-8都有较好的体外抑制活性;且对人肝癌细胞HepG2的抑制活性较其它三种细胞的增殖抑制活性更强;另外,所有新合成的化合物对人胚胎肺成纤维细胞WI-38的毒性均比阳性对照VP-16低。整体而言,化合物Ⅰ a、Ⅱ b和Ⅲa较其它化合物表现出较高的肿瘤抑制活性。
实施例16:化合物Ⅱ b对拓扑异构酶-Ⅱ抑制活性试验方法与结果
拓扑异构酶Ⅱ(TOP-Ⅱ)是抗肿瘤药物的作用靶标之一。VP-16作为一种重要的抗肿瘤药物,主要通过抑制TOP-Ⅱ起作用。为了确定该类化合物的作用机制,本专利进行了化合物Ⅱb对TOP-Ⅱ的活性抑制试验。具体方法按照试剂盒(Topogen,Inc.,USA,Cat No.2000H)的方法进行操作。实验结果见附图1。
如附图1所示,当药物浓度为0μM时,由于TOP-Ⅱ的拓扑异构性会使超螺旋pBR322质粒DNA变为松弛型DNA(线2),低浓度时,化合物Ⅱb对TOP-Ⅱ的抑制作用较弱(线3),但当化合物Ⅱb浓度为100μM时,可以明显观察到化合物Ⅱb对TOP-Ⅱ的抑制作用较强(线4),且这种作用要强于阳性对照药VP-16对TOP-Ⅱ的抑制作用(线5)。这一结果表明,化合物Ⅱb在体外可以抑制TOP-Ⅱ的活性。
该类化合物合成方法简单,原料廉价易得,药理活性显著,有望成为拥有我国自主知识产权的一类治疗癌症的新型药物。
对比例
疗效对比
一类新型抗肿瘤活性化合物,它们与VP-16和NCTD对比,发明的化合物Ⅱ b对人非小细胞肺癌细胞A-549、人肝癌细胞HepG2、人宫颈癌细胞HeLa和人结肠癌细胞HCT-8四种肿瘤细胞生长抑制活性均强于VP-16,而且对WI-38细胞的毒性作用较小。其中化合物Ⅱ b对A-549、HepG2、HeLa和HCT-8四种癌细胞的抑制活性分别是VP-16的6、521、3和3倍,而对正常人胚胎肺成纤维细胞WI-38的毒性是VP-16的1/6以下。
- 还没有人留言评论。精彩留言会获得点赞!