竞争性PPAR‑γ拮抗剂的制作方法
本发明涉及一种新化合物E)-2-(5-((4-甲氧基-2-(三氟甲基)喹啉-6-基)甲氧基)-2-((4-(三氟甲基)苯甲基)氧基)-苯亚甲基)己酸(MTTB)及其衍生物。本发明的所述化合物用作选择性过氧化物酶体增殖物活化受体γ(PPARγ)拮抗剂并且适用于治疗免疫相关性疾病如全身性炎症、脓毒症和脓毒性休克。
描述
全身性炎症、脓毒症和脓毒性休克是危及生命的并发症,每年引起约60000人死亡,因此在德国是第三最常见的死亡原因。这种疾患的发病率由于人口老龄化及免疫受损和危重患者数量越来越多而上升。脓毒症包括复杂的临床综合征,该综合征由身体对侵入身体的细菌和/或真菌病原体引起的感染的反应而引起。通常,有效、复杂的免疫级联反应确保对人类中微生物侵入的迅速、保护性反应。然而,免疫防御缺陷可使感染变得确立。进一步地,过度或调控不力的反应可通过内源产生的炎症化合物的不适应性释放而伤害宿主。脓毒症特征在于高炎症反应期(hyper inflammatory phase),接着是低炎症反应期(hypo inflammatory phase),后者也被称为“免疫麻痹”。具体而言,免疫麻痹对于患者而言至关重要。此时适应性免疫系统的T细胞经历了凋亡和停滞。因此患者往往死于继发性感染。
目前治疗脓毒症的方法集中在所述疾病的高炎症反应期以便阻遏疾病进展。然而,目前治疗很少成功,因为它们取决于脓毒症的极早诊断。其它治疗方法仅靶向所述疾病的症状。已知治疗脓毒症的方法包括抗生素、抗体、小分子和肽、蛋白C、用氧的支持性疗法、静脉注射液和增高血压的药物。
然而,尽管在重度感染的治疗中有过去几十年的重大进展,但脓毒症的发病率和归因于脓毒症的死亡率持续增长。因此,需要用于预防和治疗脓毒症的新方法和组合物。
在脂肪细胞内表达的过氧化物酶体增殖物活化受体γ(PPAR-γ或PPARG)是多功能核受体型转录因子,其通过响应于前列腺素类和噻唑烷二酮(TZD)配体来调控脂肪细胞基因表达和分化,在胰岛素敏感性的控制中起核心作用。其还已被鉴定为调节细胞转分化、癌细胞终末分化和炎症过程中的关键作用因子。该蛋白质还在其它组织如结肠和乳腺上皮细胞、骨髓、白细胞系和T细胞中表达,并且在巨噬细胞中,已经与TZD的抗炎作用及其对动脉粥样硬化发展的影响联系起来。已经证明在人原发性和转移性乳腺腺癌和阿耳茨海默氏病(Alzheimer's disease)脑部中过氧化物酶体增殖物活化受体γ的表达升高,而在散发性结肠癌已经报道了等位基因变体。
与核激素受体超家族的其它成员一样,PPARγ的组织和配体特异性活化和转录靶基因调控是多步过程(Kliewer等人,1994;Seargent等人,2004)。这个过程涉及几种天然和合成配体的特异性结合(Forman等人,1995;Kliewer等人,1995),与维甲类X受体α(RXRα)的异源二聚化,其靶基因启动子区内序列特异性PPARγ反应元件(PPRE)的识别和相互作用及最后辅助因子和其它核辅调控蛋白的募集(Nolte等人,1998;Chawla等人,2001;Kliewer等人,2001;Spiegelman等人,2004)。
由于其在脂肪形成和葡萄糖代谢中的作用,其中PPARγ主要诱导脂肪细胞蛋白质2(aP2)、分化簇36(CD36)、脂蛋白脂肪酶(LPL)或葡萄糖转运体4(GLUT4)的基因表达,例如,已经将其作为治疗靶标进行深入研究(Lehmann等人,1995;Tontonoz等人,1995)。具有高受体亲和力的最突出的合成PPARγ激动剂为噻唑烷二酮(TZD)。这些用于2型糖尿病中,其中它们提高胰岛素敏感性并引起游离葡萄糖水平随之降低(Rangwala等人,2004;Staels等人,2005)。PPARγ也可以与其它蛋白质直接结合并抑制信号转导。这种能力,称为反式阻抑(transrepression),主要由PPARγ和其它转录因子(如活化B细胞的核因子“κ-轻链-增强子”(NFkB)、活化T细胞的核因子(NFAT)或活化蛋白1(AP-1))之间的直接蛋白质-蛋白质相互作用介导(Yang等人,2000;Wang等人,2001;Chen等人,2003)。
这样,PPARγ抑制促炎信号并诱导抗炎反应(Pascual等人,2006;Ricote等人,2007)。在这种情况下,PPARγ受TZD活化对减轻炎症有效。与已经证实的TZD在体内的有益作用和广泛用途相反,它们还与许多有害副作用、严重耐受性和安全问题相关,包括明显增重、外周水肿、充血性心力衰竭和骨折(Nesto等人,2003;Nissen等人,2007)。另一方面,PPARγ还诱导凋亡并且因此发挥免疫抑制活性。最近,PPARγ拮抗作用,尤其是PPARγ拮抗剂2-氯-5-硝基苯甲酰苯胺(GW9662)(Leesnitzer等人,2002),指导了用于各种不同癌症类型,如乳腺癌(Seargent等人,2004;Burton等人,2008),及免疫力调节和炎症性疾病(Schmidt等人,2011)的新药物和治疗策略的开发。由于GW9962与PPARγ蛋白的不可逆结合,其不适于治疗用。增进对PPARγ生理作用和临床相关性的理解已强调了在避免已知副作用的同时,对发现、鉴定和表征新PPARγ激动剂、拮抗剂或选择性PPARγ调节剂(SPPARγM)的关键性需求。
因此,至今也没有用于治疗或预防特征在于病理性炎症(如脓毒症)和全身性炎症的疾病的满意治疗方法。此外,正需要鉴定具有更有益的毒理学性质,可应用于治疗免疫相关性疾病或其它疾病的选择性PPAR拮抗剂。
以上问题在第一方面中通过式(I)的化合物或其立体异构体、衍生物或盐得以解决:
其中
R1和R2独立地选自未取代、单取代或多取代的芳基或杂芳基,并且
R1和R2不同,并且
R3为未取代、单取代或多取代的C1-C10-烷基,其中所述烷基可为直链、支链或环状。
在本发明的上下文中术语“杂芳基”涵盖在环结构中具有至少一个可为氮、氧或硫的杂原子的单环、双环或多环杂芳族化合物。属于该定义范围的代表性杂芳基,例如,吡啶、喹啉、吡咯、吲哚、噻吩、苯并咪唑、四唑、嘧啶等。
术语“芳基”指芳香基团,优选具有6至10个碳原子,例如苯基、甲苯基等。术语“杂取代基”在本发明的意义上应涵盖具有至少一个非碳链原子(杂原子),优选选自氧、氮或硫的杂原子的任何取代基。
惊人地发现,在针对PPARγ激动剂试验时,本发明的化合物表现出竞争性拮抗作用,与最先进的PPARγ拮抗剂如GW9662相比,本发明的化合物细胞积累极高、细胞毒性地且PPARγ激动作用较小。
本发明的优选实施方案涉及其中R1和R2为单取代或多取代的芳基或杂芳基的化合物。
本发明的另一个实施方案涉及其中R3为未取代的C1-C8烷基,优选为未取代的C2-C6烷基,最优选为未取代的直链C4烷基的化合物。
在本发明另外的或替代性实施方案中,R1可优选为具有式(II)的基团,
在式(II)中R4-R8独立地选自H、OH、SH;未取代、单取代或多取代的C1-C18-烷基,其中所述烷基可为直链、支链或环状;烯基;三氟甲基;未取代、单取代或多取代的芳基或杂芳基;未取代、单取代或多取代的苯甲基;酰基,例如甲酰基、乙酰基、三氯乙酰基、三氟乙酰基、富马酰基、马来酰基、琥珀酰基、苯甲酰基或支链或经杂原子或芳基取代的酰基;烷氧基取代基,例如-OMet、-OEt、-OnPr、-iPr、-OnBu、-OiBu、-OsecBu、-OtBu,其烷基为支链、非支链或环状;通过硫原子键合的烷基,例如-SMe、-SEt;或磺酰基,例如-SO3H、-SO2Me、-SO2CF3、-SO2C6H4CH3或SO2C6H4CH2Br;或氮取代基,例如-NH2、-NHR、-NRR’(R、R’=烷基、芳基等)、-NC或-NO2;或氟、氯、溴、碘、-CN或杂取代基。更优选R4、R5、R7和R8为H,并且R6为三氟甲基(-CF3)。
另外或可选地,本发明的化合物包含为式(III)的基团的R2,
其中
X和Z独立地选自C或N,
R9至R12独立地选自H、羟基;未取代、单取代或多取代的C1-C18-烷基,其中所述烷基可为直链、支链或环状;烯基;三氟甲基;未取代、单取代或多取代的芳基或杂芳基;未取代、单取代或多取代的苯甲基;酰基,例如甲酰基、乙酰基、三氯乙酰基、三氟乙酰基、富马酰基、马来酰基、琥珀酰基、苯甲酰基或支链或经杂原子或芳基取代的酰基;烷氧基取代基,例如-OMet、-OEt、-OnPr、-iPr、-OnBu、-OiBu、-OsecBu、-OtBu,其烷基为支链、非支链或环状;通过硫原子键合的烷基,例如-SMe、-SEt;或磺酰基,例如-SO3H、-SO2Me、-SO2CF3、-SO2C6H4CH3或SO2C6H4CH2Br;或氮取代基,例如-NH2、-NHR、-NRR’(R、R’=烷基、芳基等)、-NC或-NO2;或氟、氯、溴、碘、-CN或杂取代基。
在这个实施方案中,Z优选为N,并且X优选为C。
此外可优选R10和R12为H,R9为-OMet(-OCH3),并且R11为三氟甲基(-CF3)。
在本发明的上下文中,最优选为具有式(IV)的(E)-2-(5-((4-甲氧基-2-(三氟甲基)喹啉-6-基)甲氧基)-2-((4-(三氟甲基)苯甲基)氧基)-苯亚甲基)己酸(MTTB):
特别优选的化合物亚类属于以下结构通式,其具有前面描述的基团R1至R12的定义。
具有通式(V)的化合物:
R2选自未取代、单取代或多取代的芳基或杂芳基,优选R2为式(III)的基团,
其中
X和Z独立地选自C或N,
R9至R12独立地选自H、羟基;未取代、单取代或多取代的C1-C18-烷基,其中所述烷基可为直链、支链或环状;烯基;三氟甲基;未取代、单取代或多取代的芳基或杂芳基;未取代、单取代或多取代的苯甲基;酰基,例如甲酰基、乙酰基、三氯乙酰基、三氟乙酰基、富马酰基、马来酰基、琥珀酰基、苯甲酰基或支链或经杂原子或芳基取代的酰基;烷氧基取代基,例如-OMet、-OEt、-OnPr、-iPr、-OnBu、-OiBu、-OsecBu、-OtBu,其烷基为支链、非支链或环状;通过硫原子键合的烷基,例如-SMe、-SEt;或磺酰基,例如-SO3H、-SO2Me、-SO2CF3、-SO2C6H4CH3或SO2C6H4CH2Br;或氮取代基,例如-NH2、-NHR、-NRR’(R、R’=烷基、芳基等)、-NC或-NO2;或氟、氯、溴、碘、-CN或杂取代基。
在这个实施方案中Z优选为N,并且X优选为C。
此外可优选R10和R12为H,R9为-OMet(-OCH3),并且R11为三氟甲基(-CF3)。
可选地或另外,R4至R8独立地选自H、OH、SH;未取代、单取代或多取代的C1-C18-烷基,其中所述烷基可为直链、支链或环状;烯基;三氟甲基;未取代、单取代或多取代的芳基或杂芳基;未取代、单取代或多取代的苯甲基;酰基,例如甲酰基、乙酰基、三氯乙酰基、三氟乙酰基、富马酰基、马来酰基、琥珀酰基、苯甲酰基或支链或经杂原子或芳基取代的酰基;烷氧基取代基,例如-OMet、-OEt、-OnPr、-iPr、-OnBu、-OiBu、-OsecBu、-OtBu,其烷基为支链、非支链或环状;通过硫原子键合的烷基,例如-SMe、-SEt;或磺酰基,例如-SO3H、-SO2Me、-SO2CF3、-SO2C6H4CH3或SO2C6H4CH2Br;或氮取代基,例如-NH2、-NHR、-NRR’(R、R’=烷基、芳基等)、-NC或-NO2;或氟、氯、溴、碘、-CN或杂取代基。更优选R4、R5、R7和R8为H,并且R6为三氟甲基(-CF3)。
还优选具有通式(VI)的化合物:
R2选自未取代、单取代或多取代的芳基或杂芳基,优选R2为式(III)的基团,
其中
X和Z独立地选自C或N,
R9至R12独立地选自H、羟基;未取代、单取代或多取代的C1-C18-烷基,其中所述烷基可为直链、支链或环状;烯基;三氟甲基;未取代、单取代或多取代的芳基或杂芳基;未取代、单取代或多取代的苯甲基;酰基,例如甲酰基、乙酰基、三氯乙酰基、三氟乙酰基、富马酰基、马来酰基、琥珀酰基、苯甲酰基或支链或经杂原子或芳基取代的酰基;烷氧基取代基,例如-OMet、-OEt、-OnPr、-iPr、-OnBu、-OiBu、-OsecBu、-OtBu,其烷基为支链、非支链或环状;通过硫原子键合的烷基,例如-SMe、-SEt;或磺酰基,例如-SO3H、-SO2Me、-SO2CF3、-SO2C6H4CH3或SO2C6H4CH2Br;或氮取代基,例如-NH2、-NHR、-NRR’(R、R’=烷基、芳基等)、-NC或-NO2;或氟、氯、溴、碘、-CN或杂取代基。
在这个实施方案中Z优选为N,并且X优选为C。
此外可优选R10和R12为H,R9为-OMet(-OCH3),并且R11为三氟甲基(-CF3)。
对于式(V)和式(VI)的所有化合物而言,对应于以上描述的R1和R2的基团不同。
本发明的另一方面涉及一种生成或化学合成本发明的化合物的方法。
优选地,生成或化学合成本发明的化合物的方法包括以下步骤:
(a):
(b)
(c)
和
(d)
其中R1至R3如以上所定义,并且X为反应基,优选为Cl、Br、OTs或OTf。
再一方面还涉及用于治疗或预防免疫性疾病的过氧化物酶体增殖物活化受体γ(PPARγ)拮抗剂。在这个方面可优选PPARγ拮抗剂为选择性PPARγ拮抗剂,因此是一种不或仅仅弱(优选低于50%,更优选低于40%、30%、20%且最优选低于10%)诱导或反式激活PPARγ的PPARγ拮抗剂。此类选择性化合物尤其是本文描述的新一类PPARγ拮抗剂的化合物。
在本发明的上下文中进一步发现,PPARγ的选择性拮抗剂在免疫性疾病的治疗中有用。术语“免疫性疾病”或“免疫相关性疾病”出于本发明的目的应被理解为是指特征在于免疫系统病理性活化或阻抑的疾病或疾患。在优选的实施方案中,免疫性疾病为全身性炎症或脓毒症。最优选地,免疫性疾病为低炎症反应期的脓毒症。
用于本文描述的医疗用途的PPARγ拮抗剂优选为上文和下文描述的发明的化合物,最优选为化合物MTTB。
如本文中所用,术语“治疗”是指防护性或预防性治疗和治愈性或疾病缓解性治疗,包括治疗处于感染疾病的风险或疑似已经感染疾病的患者,以及生病或已经诊断为患有疾病或医学疾患的患者。术语“治疗”还指在未患病但可能易于发展不健康状况,如病理性活跃或阻抑的免疫力的个体中保持和/或促进健康。因此,“有效量”是在个体中治疗疾病或医学疾患,或更一般地说,为个体提供营养、生理或医疗益处的量。
优选地本发明免疫性疾病的治疗或预防包括向患有免疫性疾病或处于发展免疫性疾病风险的受试者施用治疗有效剂量的所述PPARγ拮抗剂。免疫性疾病的治疗或预防可包括向所述受试者施用额外的治疗活性化合物,其中额外的治疗活性化合物在免疫性疾病,如脓毒症、全身性炎症或脓毒性休克的治疗中有效和/或有益。
本发明的额外的治疗活性化合物优选选自另一种PPARγ拮抗剂、免疫抑制剂、抗生素、血管加压药、皮质类固醇或活化的蛋白C。
本发明化合物的治疗活性或有效剂量通常将在每天0.1至100mg/kg患者体重,优选每天0.5-20mg/kg的范围内,确切剂量由临床医师根据通用标准,考虑待治疾患的性质和严重程度、患者特性等来确定。剂量的确定在本领域普通技术水平范围内。本发明的化合物通常将施用长达28天。更常见的是,蛋白质将施用一周或更少,常常施用一至三天。一般而言,本发明化合物的治疗有效量是足以引起脓毒症的低炎症反应期在临床上显著减少的量。
通常,施用的本发明的PPARγ拮抗剂的量将根据诸如患者年龄、体重、身高、性别、总体健康状况和既往病史等因素改变。通常,虽然依情况而定也可以施用较低或较高剂量,但期望为受者提供剂量在1pg/kg至10mg/kg(试剂的量/患者体重)范围内的本发明的PPARγ拮抗剂。下文提供了本发明药物组合物的具体实施方案。
另外通过包含(a)PPARγ拮抗剂和(b)在脓毒症或全身性炎症的治疗中有效的第二化合物的组合解决了本发明的目的。
本发明的组合优选包含作为试剂(a)的如上文所述的PPARγ拮抗剂,最优选MTTB或其衍生物。试剂(b),在脓毒症或全身性炎症的治疗中有效的第二化合物,优选选自另一种PPARγ拮抗剂、免疫抑制剂、抗生素、血管加压药、皮质类固醇或活化的蛋白C。
本发明的组合用于治疗如上文所述的免疫性疾病。
此外提供了一种抑制细胞中的PPARγ的体外(在活体外)方法。该方法包括使细胞与本文先前所述的化合物接触的步骤。
疾病和疾患
本发明提供了一类新的PPARγ拮抗剂,其用作治疗剂用于治疗或预防免疫相关性疾病或病理性细胞凋亡,如特征在于细胞过度凋亡的疾病,例如慢性HIV、EBV或HCV感染、阿尔茨海默病、帕金森氏病(Parkinson's disease)或缺血性心脏病。根据本发明所述化合物和组合物对于治疗和或预防特征在于病理性激活的免疫或炎症反应的疾患特别有用。具体而言本发明设法提供对脓毒症、脓毒性休克和全身性炎症的治疗。
治疗或预防免疫相关性疾病的组合物和试剂盒
本发明的另一方面涉及用于治疗或预防免疫相关性疾病的组合物、药物组合物和试剂盒。在一个实施方案中,所述组合物包含如本文所述的化合物、组合或组合物,任选地连同药学上可接受的载体。
如本文中所用,用语“药学上可接受的载体”旨在包括与药物施用相容的任何及所有溶剂、增溶剂、填料、稳定剂、粘合剂、吸收剂、基质、缓冲剂、润滑剂、控释媒介物、纳米颗粒、脂质体、稀释剂、乳化剂、湿润剂、润滑剂、分散介质、包衣、抗菌或抗真菌剂、等渗和吸收延迟剂等。此类介质和试剂作为药物活性物质的用途是本领域公知的。除非任何常规介质或试剂与活性化合物不相容,否则还考虑到了其在所述组合物中的用途。也可向组合物中掺入补充试剂。在某些实施方案中,药学上可接受的载体包含血清白蛋白。
本发明的药物组合物配制成与其预期施用途径相容。施用途径的实例包括肠胃外,例如鞘内、动脉内、静脉内、皮内、皮下、口服、经皮(局部)和经粘膜施用。
用于肠胃外、皮内或皮下施加的溶液或混悬液可包括以下组分:无菌稀释剂如注射用水、盐水溶液、不挥发性油、聚乙二醇、甘油;丙二醇或其它合成溶剂;抗菌剂如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或硫酸氢钠;螯合剂如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐及用于调节张力的试剂如氯化钠或右旋糖。可用酸或碱,如盐酸或氢氧化钠调节pH。肠胃外制剂可封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
适于注射用的药物组合物包括无菌水溶液(可溶于水时)或分散物及用于临时制备无菌注射液或分散物的无菌粉末。对于静脉施用,合适的载体包括生理盐水、抑菌水、克列莫佛EL(Cremophor ELTM,BASF,Parsippany,N.J.)或磷酸盐缓冲盐水(PBS)。在所有情况下,可注射组合物都应是无菌的并且应是流动性的,达到易于注射的程度。在生产和储存条件下必须稳定并且必须受到保护免受微生物如细菌和真菌的污染作用。载体可以是含有(例如)水、乙醇、多元醇(例如,丙三醇、丙二醇和液体聚乙二醇等)及其合适混合物的溶剂或分散介质。例如,可以通过使用包衣如卵磷脂,在分散物的情况下通过维持所需粒度及通过使用表面活性剂来维持适当的流动性。对微生物作用的预防可通过各种抗菌和抗真菌剂来实现,例如对羟基苯甲酸酯类、氯丁醇、苯酚、抗坏血酸、硫柳汞等。在许多情况下,将优选在组合物中包括等渗剂,例如糖、多元醇(如甘露醇、山梨醇)和氯化钠。可通过在组合物中包括延迟吸收的试剂,例如单硬脂酸铝和明胶而引起可注射组合物的延时吸收。
可通过在根据需要具有上面列举的一种成分或组合的适当溶剂中按所需量掺入活性化合物(例如,神经调节蛋白),接着过滤灭菌来制备无菌注射液。通常,通过将活性化合物掺入到含有基本分散介质和来自以上列举的那些其它所需成分的无菌媒介物中来制备分散物。在用于制备无菌注射液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,这样产生活性成分加上来自其先前经无菌过滤的溶液的任何所需额外成分的粉末。
口服组合物通常包括惰性稀释剂或可食用载体。可将其封装在明胶胶囊中或压缩成片剂。为了口服治疗施用的目的,活性化合物可以和赋形剂一起掺入并且呈片剂、锭剂或胶囊形式使用。也可以使用用作漱口水的液体载体制备口服组合物,其中液体载体中的化合物口服施加并且被漱洗和咳出或咽下。药学上相容的粘合剂和/或辅助材料可作为组合物的一部分被包括在内。片剂、丸剂、胶囊、锭剂等可含有以下任何成分或类似性质的化合物:粘合剂如微晶纤维素、黄蓍胶或明胶;赋形剂如淀粉或乳糖;崩解剂如藻酸、普莱默胶(Primogel)或玉米淀粉;润滑剂如硬脂酸镁或斯特尔特斯(Stertes);助流剂如胶体二氧化硅;甜味剂如蔗糖或糖精;或调味剂如薄荷、水杨酸甲酯或橙香精。
对于通过吸入施用,化合物呈气溶胶喷雾的形式从含有合适推进剂,例如气体(如二氧化碳)的容器或分配器中或从喷雾器中递送。
全身性施用也可以通过经粘膜或经皮方式。对于经粘膜或经皮施用,在配制剂中使用适于待透过的屏障的渗透剂。此类渗透剂通常是本领域已知的,并且包括,例如,对于经粘膜施用,去垢剂、胆汁盐和梭链孢酸衍生物。经粘膜施用可通过使用鼻喷雾或栓剂实现。对于经皮施用,将药物组合物配制成本领域通常所知的软膏、药膏、凝胶或乳霜。
在某些实施方案中,药物组合物经配制用于持续或控制释放活性成分。可以使用生物可降解、生物相容性聚合物,如乙烯醋酸乙烯酯、聚酸酐、聚乙醇酸、胶原蛋白、聚原酸酯和聚乳酸。制备此类制剂的方法对于本领域的技术人员而言是显而易见的。所述材料也可以从(例如)阿尔扎公司(Alza Corporation)和诺华制药公司(Nova Pharmaceuticals,Inc.)商业性获得。脂质体悬浮液(包括靶向具有病毒抗原的单克隆抗体的受感染细胞的脂质体)或纳米颗粒,包括用聚(dl-丙交酯-co-乙交酯)制备的物质,也可用作药学上可接受的载体。这些可根据本领域技术人员已知的方法制备。
为了易于施用和剂量均匀性,特别有利的是将口服或肠胃外组合物配制成剂量单位形式。如本文中所用的剂量单位形式包括适合作为待治受试者的单位剂量的物理离散单元;每个单元含有经计算连同所需药物载体一起会产生预期疗效的预定量的活性化合物。本发明的剂量单位形式的规格由以下因素决定并直接取决于以下因素:活性化合物的独特特征和要达到的特定疗效,及使此类活性化合物化合用于治疗个体的领域中固有的限制。
此类化合物的毒性和治疗功效可以通过标准制药过程在细胞培养物或实验动物中测定,例如测定LD50(群体50%致死的剂量)和ED50(在群体50%中治疗有效的剂量)。毒性和疗效之间的剂量比为治疗指数并且可表示为LD50/ED50比率。优选表现出大治疗指数的化合物。虽然可以使用表现出毒副作用的化合物,但是应该仔细设计使此类化合物靶向受影响组织部位的递送系统以便将对未受感染的细胞的潜在损伤降到最低,从而减少副作用。
由细胞培养测定法和动物研究获得的数据可用于配制用于人类的各种剂量。此类化合物的剂量优选在包括具有很少或无毒性的ED50的循环浓度范围内。该剂量可根据采用的剂量形式和利用的施用途径在这个范围内变化。对于本发明方法中所用的任何化合物而言,最初可由细胞培养测定法估计治疗有效剂量。在动物模型中可将剂量配制成达到包括在细胞培养物中测定的IC50(即,实现症状半最大抑制的试验化合物浓度)的循环血浆浓度范围。此类信息可用于更精确地确定在人类中的有用剂量。可将药物组合物连同施用说明书一起包括在容器、包装或分配器中。
现将在以下实施例中参考附图和序列,然而不限于此,对本发明做进一步描述。为了本发明的目的,本文所引用的所有参考文献通过引用整体并入。图中:
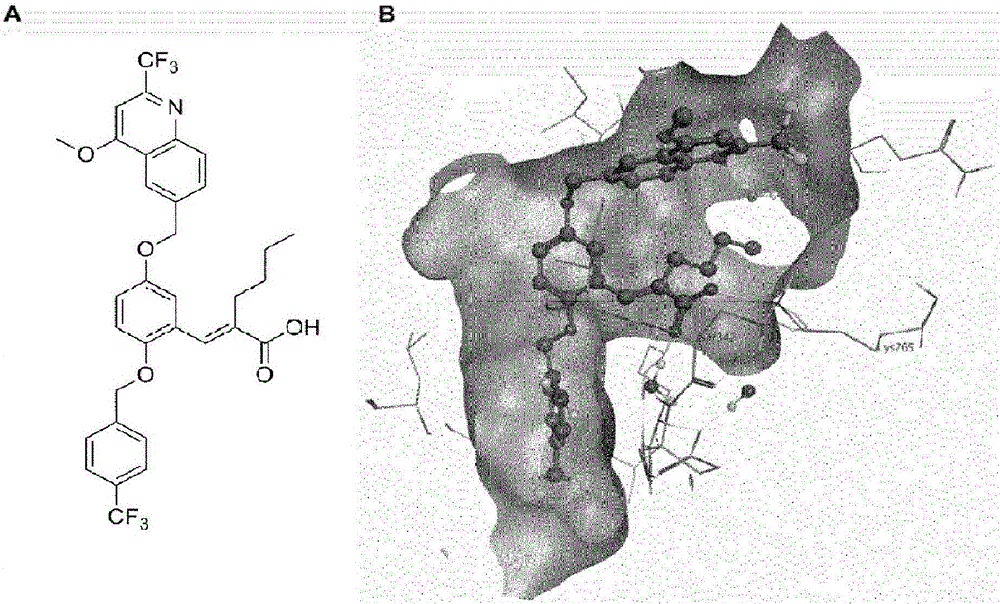
图1:MTTB的化学结构和计算模型。相应的配体并入了MTTB(A)的所有结构特征:酸性端基、相邻亲脂性部分和在相对位点上具有芳香族取代基的中心芳香核。对接方案集中于产生一个单结合模式(B)。羧基部分参与和赖氨酸265的离子相互作用和与丝氨酸323主链酰胺的氢键中。芳香族部分和α烷基链占据疏水位点,表明是有利的相互作用。
图2:PPARγ激动剂、PPARγ拮抗剂和SPPARγM在HEK293T细胞中的动力学表征。使用PPARγ依赖性反式激活(transactivation)测定法来检验PPARγ激动剂罗格列酮(rosiglitazone)、拮抗剂GW9662和两种SPPARγM FMOC-L-亮氨酸和MCC-555在用不同浓度(0.01μΜ-10μΜ)的化合物(A)刺激24小时之后的激动作用。为确定在对激动剂(1μΜ罗格列酮)刺激(B)反应的时间进程中使用10μΜ GW9662及FMOC-L-亮氨酸和MCC-555的激动作用,再次使用PPARγ依赖性反式激活测定法。值是四次实验的平均值±SEM。每项实验进行四次。
图3:针对体外递增浓度的罗格列酮,MTTB拮抗作用与GW9662拮抗作用的比较。为检验MTTB(A和C)和参考PPARγ拮抗剂GW9662(B和D)在HEK293T细胞(A和B)和Jurkat T细胞(C和D)中的激动和拮抗作用,使用PPARγ依赖性反式激活测定法。用递增剂量(0.1μΜ-10μΜ)的罗格列酮、MTTB或GW9662单独地或在MTTB和GW9662(1μΜ或10μΜ)的存在下用相同浓度的罗格列酮培养细胞系24小时。为测定在HEK293T细胞中MTTB对罗格列酮反应的拮抗作用的IC50值,使用PPARγ依赖性反式激活测定法(E)构造MTTB拮抗作用的剂量-反应曲线。数据显示在递增浓度的MTTB(0.1μ-50μΜ)的存在下对1μΜ激动剂(罗格列酮)刺激反应24小时。所有值均为四次实验的平均值±SEM。每项实验在HEK293T细胞中进行四次并且在Jurkat T细胞中进行三次。在HEK293T细胞和Jurkat T细胞中在浓度为xμΜ和yμΜ(p<0.05)的MTTB的存在下,在对罗格列酮(1-10μΜ)的反应中获得与单独的拮抗剂在统计上显著的差异。
图4:体外竞争性PPARγ拮抗剂MTTB和PPARγ拮抗剂GW9662的细胞毒性。在用不同浓度(0.1μΜ-30μΜ)的MTTB(A)或PPARγ拮抗剂GW9662(B)刺激24小时之后通过MTT测定法测定HEK293T细胞、HuT-78细胞和Jurkat T细胞的细胞活力。由以下方程式计算细胞活力:样品的MTT光密度(OD)值/对照的MTT OD值(细胞经DMSO处理)。数据显示为溶剂DMSO对照的百分比并呈现为三次单独实验的平均值±SEM。每项实验进行八次。
图5:体外MTTB和GW9662的胞内累积。用10μΜMTTB(A)或10μΜGW9662(B)刺激HEK293T细胞、HuT-78细胞和Jurkat T细胞24小时。在不同时间点收获细胞并且将累积表示为通过LC-MS/MS测定的每5x105个细胞按μmol计胞内(I)与胞外(E)浓度的百分比。值是三次实验的平均值±SEM。
图6:用MTTB处理之后脓毒症模型中小鼠的存活。
实施例
材料和方法
化学药品和试剂
所有化学药品和试剂都是最高纯度等级的并且如果没有另外说明,则可从应用化学GmbH(AppliChem GmbH,达木斯特,德国)、卡尔洛斯GmbH(Carl Roth GmbH,卡尔斯鲁厄,德国)、阿法埃莎GmbH(Alfa Aesar GmbH,卡尔斯鲁厄,德国)、阿波罗科技(Apollo Scientific,曼彻斯特,英国)和西格玛奥德里奇化学GmbH(Sigma-Aldrich Chemie GmbH,Schnelldorf,德国)商购获得。PPARγ拮抗剂GW9662、SPPARγM N-(9-芴基甲氧羰基)-L-亮氨酸(FMOC-L-亮氨酸)和萘格列酮(netoglitazone)(MCC-555)从凯曼化工公司(Cayman Chemical Company,安娜堡,USA)获得并且PPARγ激动剂罗格列酮从恩佐生命科学GmbH(Enzo Life Sciences GmbH,德国)获得。细胞培养基和补充剂购自PAA实验室GmbH(德国)和西格玛奥德里奇化学GmbH。
细胞培养
从LGC标准GmbH(韦泽尔,德国)获得人T细胞-78(HuT-78)(Gazdar等人,1980)、Jurkat T细胞(Schneider等人,1977)和稳定表达猿猴空泡病毒40的大T抗原的人胚肾293细胞(HEK293T细胞)(Graham等人,1977)。HuT-78细胞和Jurkat T细胞在劳斯维尔帕克记忆研究所(Roswell Park Memorial Institute(RPMI))1640培养基中并且HEK293T细胞在杜尔贝科改良伊格尔培养基(DMEM)中,在37℃下于加湿5%二氧化碳环境中培养。
两种培养基均含10%(v/v)热灭活胎牛血清、100单位/ml青霉素(penicillin)和100μg/ml链霉素(streptomycin)。培养基每周更换三次并且在达到融合之前使细胞传代。使用DMSO时,在所有情况下,DMSO的最终浓度不超过0.1%并且在所用细胞系中未发现有细胞毒性。
培养的细胞系的瞬时转染
对于PPARγ依赖性反式激活测定法而言,在96孔板中每孔接种1x104个HEK293T细胞并且如上所述培养过夜以允许HEK293T细胞附着。第二天,使用JetPRIMETM转染试剂(PEQLAB Biotechnologie GmbH,埃尔朗根,德国),如制造商所述,用0.01μg/孔由Manfred Schubert-Zsilavecz博士教授(Institute of Pharmaceutical Chemistry,Department of Biochemistry,Chemistry and Pharmacy,Goethe-University Frankfurt am Main,德国)友好提供的pFA-PPARγ-LBD-GAL4-DBD,0.09μg/孔pFR-Luc(Stratagene,拉荷亚,USA)和0.0005μg/孔pRL-CMV(Promega GmbH,Mannheim,德国)瞬时转染HEK293T细胞。4小时后,更换转染培养基并且再在新鲜生长培养基中培养HEK293T细胞24小时。对于每孔1x106个HuT-78细胞和Jurkat T细胞的瞬时转染,使用Super-FectTM转染试剂(QIAGEN GmbH,希尔敦,德国),如生产商所述,用0.2μg/孔pFA-PPARγ-LBD-GAL4-DBD、0.8μg/孔pFR-Luc和0.05μg/孔pRL-CMV。24小时后,添加1ml新鲜生长培养基并且再培养细胞48小时。PPARγ依赖性反式激活测定法在HEK293T细胞中使用96孔板形式进行四次并且在HuT-78细胞和Jurkat T细胞中使用12孔板形式进行三次。
培养的细胞系的PPARγ依赖性反式激活测定法
PPARγ依赖性反式激活测定法是基于编码杂交蛋白PPARγ-LBD-GAL4-DBD的载体pFA-PPARγ-LBD-GAL4-DBD和在萤火虫荧光素酶基因的前面携带GAL4响应元件的报告载体pFR-Luc。这两种载体,如上所述,与编码海肾荧光素酶的对照载体pRL-CMV组合共同转染,以将萤火虫荧光素酶活性归一化为转染效率。转染之后,用MTTB、FMOC-L-亮氨酸、MCC-555、GW9662和罗格列酮并且在递增浓度下(0.01-10μΜ),有或无罗格列酮(0.01-10μΜ)孵育细胞不同时间(2-48小时)。使用96孔板形式在密特拉斯(Mithras)LB940多模式酶标仪(Berthold Technologies,Bad Wildbad,德国)中分析反式激活。通过使用图像平板软件普利姆(GraphPad Software Prism,拉荷亚,USA)将数据拟合为S形剂量-反应曲线测定MTTB的IC50值。
细胞活力研究
按每孔5x104个细胞的密度将HuT-78细胞、Jurkat T细胞和HEK293T细胞接种在96孔板中并且如上所述培养过夜以允许HEK293T细胞附着。第二天,将培养基更换为含有不同浓度的MTTB(1-30μΜ)和GW9662(1-30μΜ)的新鲜细胞特异性生长培养基。使用单独的DMSO作为对照。24小时刺激后,添加3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)溶液(5mg/ml于磷酸盐缓冲盐水(PBS)中)并且在37℃下再孵育细胞两小时(Mosmann,1983)。之后,用MTT裂解缓冲液裂解细胞。细胞裂解后,在560nm吸光度下在密特拉斯(Mithras)LB940多模式酶标仪中测量细胞活力。使用96孔板形式的细胞活力研究进行八次。
胞内MTTB和GW9662累积的测定
为测定MTTB和GW9662的胞内累积,按每孔5x104个细胞的密度将HuT-78细胞、Jurkat T细胞和HEK293T细胞接种在12孔板中并且如上所述培养过夜以允许HEK293T细胞附着。第二天将培养基更换为含有10μΜMTTB和10μΜ GW9662的新鲜细胞特异性生长培养基。用MTTB和GW9662处理24小时后,收获细胞和上清液并通过LC-MS/MS分析。将累积表示为胞内与胞外浓度比率(I/E)的百分比。
计算模型
使用分子操作环境(Molecular Operating Environment)软件套件2012.10(Chemical Computing Group Inc.,蒙特利尔,加拿大)进行计算对接。结构中氢的分配使用普劳特耐特3D(Protonate3D)程序(Labute,2009)进行。
统计分析
所有数据均呈现为平均值±标准平均误差(SEM)。每项实验至少进行三次。统计分析用分别经邦弗伦尼(Bonferroni)多重比较检验或非配对和配对学生t检验改良的单或双因素方差分析来进行。当:p<0.05时,视为差异显著。
实施例1:MTTB的合成
本发明的化合物,尤其是MTTB在一个四阶段过程中合成。在下文中E是指反应物,P是指反应产物。
阶段1:
在具有回流冷凝器、氩气源、隔膜和磁搅拌器的三颈反应釜中,使E1(1个当量)和Cs2CO3(1.3个当量)在惰性气体下悬浮于二甲基甲酰胺(DMF)中并略微加热(约60℃约15分钟)。冷却至室温(RT)后,经由隔膜在几毫升DMF中迅速添加E2(1个当量)并且在搅拌下反应,无需加热。约1.5小时后在真空下去除溶剂直至几乎完全干燥。为50ml的H2O添加50ml乙酸乙酯以分相。水相用乙酸乙酯萃取三次,而有机相在MgSO4上干燥并蒸发至完全干燥。残余物进行柱色谱法并且在分离后使产物重结晶两次(己烷/乙酸乙酯)。
阶段2:
在具有回流冷凝器、氩气源、隔膜和磁搅拌器的三颈反应釜中,使P1(1个当量)和Cs2CO3(1.3个当量)在惰性气体下悬浮于二甲基甲酰胺(DMF)中并略微加热(约60℃约15分钟)。冷却至室温(RT)后,经由隔膜在几毫升DMF中迅速添加E3(1个当量)并且在搅拌下反应,无需加热。约1.5小时后在真空下去除溶剂直至几乎完全干燥。为50ml的H2O添加50ml乙酸乙酯以分相。水相用乙酸乙酯萃取三次,而有机相在MgSO4上干燥并蒸发至完全干燥。残余物进行柱色谱法并且在分离后使产物重结晶两次(己烷/乙酸乙酯)。
阶段3:
在具有回流冷凝器、氩气源、隔膜和磁搅拌器的三颈反应釜中,首先在氩气下添加NaH(1.3个当量),然后用四氢呋喃(THF)使其悬浮。搅拌并冷却约15分钟后在几分钟之内滴加于THF中的E4(1.3个当量)。E4可经由艾伯佐夫(Arbuzov)反应制备,通过使各自的α-溴代-酯在亚磷酸三乙酯中回流并蒸馏得到E4。然后于冰浴中搅拌混合物30至60分钟。经由隔膜滴加于THF中的醛(1个当量)。经由TLC观察反应。完成反应(约1至3小时)后,去除溶剂并且使反应经受柱色谱法。使纯化产物P3重结晶(己烷/乙酸乙酯)。
阶段4:
在具有回流冷凝器和热浴的反应釜中,使于THF中的酯与溶于H2O中的LiOH一水合物(10个当量)合并。添加甲醇直至溶液只有一个相并且边搅拌边在40-60℃下加热直至完全水解。约12-72小时后在真空下蒸发THF和甲醇。用2NHCl使酸沉淀。从沉淀中去除溶剂并干燥后,通过重结晶获得最终产物。
实施例2:MTTB与PPARγ-LBD对接
在先前的研究中已经证实,由于对PPARγ已知的明显诱导契合,共晶配体的相似性对于受体结合的配体构象的预测模型至关重要(Weber等人,2012)。因此,发明人选择比较与PPARγ-LBD(PDB代码:2HFP)复合的有效磺酰基甲酰胺拮抗剂的X-射线结构(Hopkins等人,2006)。
相应的配体并入了MTTB的所有结构特征(图1A):酸性端基、相邻亲脂性部分和在相对位点上具有芳香族取代基的中心芳香核。如图1B所示,对接方案集中于产生一个单结合模式。羧基部分参与和赖氨酸265的离子相互作用和与丝氨酸342主链酰胺的氢键中。芳香族部分和α烷基链占据疏水位点,表明是有利的相互作用。位于共晶(见上文)配体部分上的药效特征用于配体布置。水分子留在结合位点中。将经证实非常适合在PPARγ-LBD中对接的αHB分数(Weber等人,2012)用于初始评分GBVI/WSA dG(基于力场的函数),以用于改进。
实施例3:MTTB抑制罗格列酮诱导的PPARγ反式激活
为分析细胞水平下PPARγ拮抗剂GW9662(Leesnitzer等人,2002)、SPPARγM FMOC-L-亮氨酸(Rocchi等人,2001)和MCC-555(Reginato等人,1998)及PPARγ激动剂罗格列酮(Willson等人,1996)的激动和拮抗作用,在HEK293T细胞中使用PPARγ依赖性反式激活测定法。测定每份样品中的萤火虫荧光素酶发光值和对照海肾荧光素酶发光值。使用萤火虫与海肾荧光素酶发光值之比归一化荧光素酶活性值。
在刺激24小时后激动剂浓度相对于PPARγ受体相互作用剂的曲线表现出不同的进程(图2A)。仅罗格列酮显示出高激动作用并且以剂量依赖方式反式激活PPARγ。令人惊讶的是,作为不可逆性完全PPARγ拮抗剂的GW9662,显示出激动作用并且与DMSO对照处理相比,导致非剂量依赖性、高3倍的PPARγ反式激活。更高浓度(高于1μΜ)的SPPARγM MCC-555反式激活PPARγ。在所有情况下,FMOC-L-亮氨酸均未显示出激动作用。如图2B所示,仅PPARγ拮抗剂GW9962抑制对激动剂(1μΜ罗格列酮)刺激反应的时间进程。SPPARγM,FMOC-L-亮氨酸和MCC-555在HEK293T细胞中都未显示出任何拮抗作用。FMOC-L-亮氨酸和MCC-555极弱的激动作用和不存在的拮抗作用促使我们使用GW9662进行以下实验并且作为参考化合物来分析。
为检验提出的MTTB与PPARγ-LBD的相互作用(图1B)并且测试在HEK293T细胞和Jurkat T细胞中的潜在激动和拮抗作用,也在PPARγ依赖性反式激活测定法中试验了该化合物。细胞用不同剂量的单独或组合的MTTB和罗格列酮培养24小时。如图3A和C所示,MTTB在HEK293T细胞和Jurkat T细胞中未表现出激动作用。在两种细胞系中,MTTB导致剂量依赖性抑制罗格列酮诱导的PPARγ反式激活,具有竞争性拮抗/部分激动特征。参考化合物GW9662在HEK293T细胞和Jurkat T细胞中显示出完全拮抗作用并且非剂量依赖性地抑制罗格列酮介导的PPARγ反式激活(图3B和D)。然而,单独的GW9662激活PPARγ并且在在两种细胞系中的反式激活测定法中显示出惊人高的激动作用。如图3E所示,MTTB能够抑制罗格列酮(1μΜ)的激动活性,在HEK293T细胞中24小时后IC50值为4.3μΜ。
实施例4:MTTB和GW9662对细胞存活的影响
为研究MTTB和参考化合物GW9662对HEK293T细胞、HuT-78细胞和Jurkat T细胞存活的影响,使细胞经受递增剂量(1-30μΜ)的MTTB或GW9662,持续24小时。通过MTT测定法分析细胞活力。MTTB在高达10μΜ的浓度下无细胞毒性作用(图4A)。在全部三种细胞系中MTTB展示出同等活力损失。相反,GW9662在所用细胞系中显示出不同的细胞毒性(图4B)。在HEK293T细胞中,高达30μΜ的浓度,未检测到活力损失。然而,在HuT-78细胞和Jurkat T细胞中,GW9662分别在高于20μΜ和30μΜ的浓度下明显有细胞毒性。
实施例5:MTTB显示出高胞内累积
通过LC-MS/MS分析MTTB(10μΜ)和参考PPARγ拮抗剂GW9662(10μΜ)的百分比胞内累积的时间进程。如图5A所示,MTTB在HuT-78细胞和Jurkat T细胞中24小时后显示出约10%的快速持续时间非依赖性胞内累积。在HEK293T细胞中,看到胞内MTTB浓度的时间依赖性增加,24小时后达到胞外浓度的约25%。如图5B所示,GW9662与MTTB相比显示出低10倍的胞内积累率,在HEK293T细胞中随时间而减少。在HuT-78细胞和Jurkat T细胞中,GW9662的胞内累积比MTTB低约100倍(图5A)。尤其是在HuT-78细胞中,胞内GW9662累积存在快速的时间依赖性降低。
实施例6:MTTB显著增强脓毒症小鼠模型中的存活
在先前公开的脓毒症小鼠模型中测试MTTB的活性(Rittirsch D,Huber-Lang MS,Flierl MA,Ward PA.Immunodesign of experimental sepsis by cecal ligation and puncture.Nat Protoc 2009;4:31-36)。简言之,盲肠结扎和穿刺模型(CLP)如Rittirsch等人所述,使用20号口径穿刺针进行或对于佯装小鼠而言无需结扎和穿刺。在结扎和穿刺3小时后腹膜内施加负载MTTB的纳米颗粒。图6示出了与对照纳米颗粒相比,经MTTB处理的脓毒症小鼠的体内显著存活率。这是本发明化合物在免疫性疾病如脓毒症治疗中的适用性的惊人证明。
讨论和结论
对PPARγ分子相互作用和信号转导途径,及其在分子、细胞和临床情况下的激活的大量阐释,已经提供了设计治疗上有用的PPARγ激动剂和SPPARγM的宝贵见解(Willson等人,2000;Sporn等人,2001;Balint等人,2006)。虽然PPARγ受天然和合成配体的激活是非常确实的(Forman等人,1995;Kliewer等人,1995),但是关于PPARγ拮抗作用知之甚少。然而,增进对PPARγ拮抗作用的生物相关性的理解强调了对发现不产生已知副作用的新的治疗上有用的PPARγ拮抗剂的关键性需求。
目前,GW9662是最熟知且最突出的PPARγ拮抗剂(Leesnitzer等人,2002),但是其显示出不良性质,包括不可逆性PPARγ拮抗作用。因此,发明人已经从结构相关的化合物筛选中鉴定并表征MTTB,为有前景的新一类竞争性PPARγ拮抗剂的原型。与可商购获得的PPARγ拮抗剂GW9662相比,MTTB提供了调节PPARγ抑制和免疫反应的可能性并且可能非常适合在炎症情况下的受控治疗使用。
与Leesnitzer和其同事一致,发明人用GW9662观察到非竞争不可逆性拮抗作用(Leesnitzer等人,2002),使得罗格列酮介导的PPARγ反式激活完全受抑制。用罗格列酮和GW9662共同处理HEK293T细胞和Jurkat T细胞显示出预计的拮抗作用。有趣的是,单独的GW9662导致非剂量依赖性、约3倍的PPARγ反式激活,就发明人所知这在之前尚未被报道。这些结果表明在HEK293T细胞和Jurkat T细胞中GW9662不是典型的完全PPARγ拮抗剂,而是起到具有强拮抗活性和不同的非剂量依赖性激动活性的SPPARγM的作用(Olefsky等人,2000;Knouff等人,2004)。由于GW9962在PPARγ蛋白质处的不可逆性结合和非剂量依赖性激动作用,它不适合治疗使用。
已经报道称GW9962在无细胞和基于细胞的测定法中(IC50为3.3nM)和在人乳腺肿瘤细胞系中通过共价修饰PPARγ的配体结合位点中的半胱氨酸285残基而起到具有高亲和力和选择性的有效PPARγ拮抗剂的作用(Leesnitzer等人,2002;Seargent等人,2004)。因此,GW9662完全且不可逆地消除PPARγ激活和信号传递。发明人仅观察到SPPARγM,FMOC-L-亮氨酸和MCC-555的温和或微弱作用,而GW9662和MTTB在HEK293T细胞和Jurkat T细胞中强有力地抑制罗格列酮的作用。在HEK293T细胞中的IC50为4.3μΜ,MTTB在低于对细胞系中PPARγ受GW9662的拮抗作用所报道的浓度下表现出温和的剂量依赖性、竞争性拮抗活性。在Jurkat T细胞中也检验了MTTB对罗格列酮介导的PPARγ反式激活的这种竞争性拮抗效力。与GW9662相反,MTTB在HuT-78细胞和Jurkat T细胞两者中显示出更低的细胞毒性,表明在试验浓度下,很可能对炎症细胞发挥药理而非毒理作用。发明人观察到与GW9662相比,MTTB向HuT-78细胞和Jurkat T细胞中的胞内累积高约100倍,与HEK293T细胞相反,其中MTTB摄取量仅比GW9662高10倍,表明对淋巴细胞的潜在选择性。
有趣的是,MTTB的结构和计算对接分析强调了MTTB对PPARγ-LBD的潜在亲和力并且着重指出了在PPARγ处MTTB、拮抗剂GW9662和激动剂罗格列酮之间的结合特征的差异(Chandra等人,2008)。
因此MTTB将用作先导化合物用于通过修饰其外部残基而增强PPARγ结合亲和力。考虑到正如已经对结构相似的PPARγTZD完全激动剂罗格列酮和吡格列酮(pioglitazone)所示(Berger等人,2005;Nissen等人,2007),配体受体相互作用的微小变化导致药理学性质上的差异,结构修饰可进一步提高MTTB的拮抗作用。
由于GW9662的强拮抗活性,所以在细胞培养体系和动物模型中将其广泛用作研究工具用于研究PPARγ在生物过程中的作用。与GW9662结合的不可逆性相反,MTTB似乎与PPARγ蛋白可逆性结合。总的来说,竞争性拮抗作用、低的部分激动作用、低的细胞毒性和高的胞内摄取量是将允许MTTB安全重复给药以供潜在治疗使用的性质。计划在动物模型中进一步研究。这里用MTTB呈现的结果表明,它是新一类竞争性PPARγ拮抗剂的原型,及炎症和免疫性病症受控治疗广泛适用的治疗方法的有前景的候选方法。
- 还没有人留言评论。精彩留言会获得点赞!