转化单端孢霉烯的醇脱氢酶的用途,用于转化单端孢霉烯类化合物的方法和转化单端孢霉烯的添加剂与流程
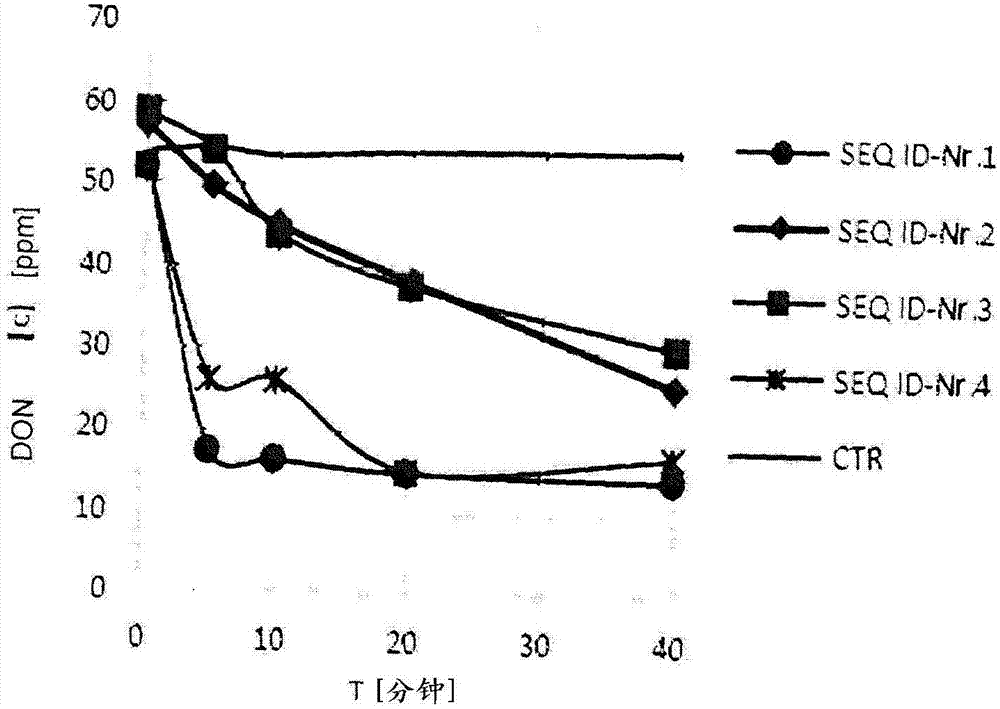
本发明涉及转化单端孢霉烯的醇脱氢酶(trichothecene-transformingalcoholdehydrogenase)的用途,用于转化单端孢霉烯类化合物的方法和转化单端孢霉烯的添加剂。单端孢霉烯类化合物代表频繁出现的一类真菌毒素,其中尤其包括脱氧瓜蒌镰菌醇(don,cas号51481-10-8),t-2毒素(cas号21259-20-1),ht-2毒素(cas号26934-87-2),瓜萎镰菌醇(cas号23282-20-4),fuseranon-x(cas号23255-69-8),藨镰刀菌烯三醇,15-乙酰氧基藨镰刀菌烯醇(cas号2623-22-5),4,15-二乙酰氧基藨镰刀菌烯醇(cas号2270-40-8),木霉菌醇(cas号2198-93-8),疣孢菌素a(cas号3148-09-2),疣孢菌素j(cas号4643-58-7),异木霉菌素(cas号91423-90-4),羟基异木霉菌素(cas号344781-02-8),calonectrin(cas号38818-51-8),t-2四醇(cas号34114-99-3),脱乙酰基新茄镰孢菌醇(cas号74833-39-9),新茄镰孢菌醇(cas号36519-25-2),乙酰基新茄镰孢菌醇(cas号65041-92-1),sporotrichiol(cas号101401-89-2),trichotriol(cas号109890-37-1),接骨木镰菌素(cas号90044-33-0),和大镰刀孢菌素(cas号18374-83-9)。单端孢霉烯类化合物,特别是don,也被称为呕吐毒素,可通过多种镰刀菌属真菌(fusariumfungi),尤其是禾谷镰刀菌(f.graminearum)和大刀镰刀菌(f.culmorum)产生。这些真菌侵袭的作物如玉米,各类谷物,如小麦、燕麦或大麦,而真菌侵袭通常在收获前发生,并且真菌生长或真菌毒素的形成也可以发生在收获之前,或在贮存不当的情况下,发生在收获之后。粮食及农业组织(fao)估计,全球25%的农产品被真菌毒素污染,这导致巨大的经济损失。在由i.rodrigues和k.naehrer,toxins,2012,4,663-675进行的较新的世界范围性研究中,从2009年1月至2011年12月的时段内,对总共23781个样品进行了分析,其中81%的测试对至少一种真菌毒素呈阳性且59%的测试对单端孢霉烯类化合物,特别是don呈阳性。单端孢霉烯类化合物,特别是don可以高达100%的频繁性在所有世界区域中发现,以及在所有测试的谷物和饲料类,如玉米、大豆粉、小麦、小麦麸、ddgs(具有可溶物的蒸馏器干燥的谷类)中发现,和在经制备的饲料混合物中发现。除了基础的、未加工的食材,单端孢霉烯类化合物的证据还发现于经加工的食物,如面粉、早餐谷物、面食制品(pastaproduct)、面包、糕点,和基于小麦的儿童和婴儿食品。单端孢霉烯类化合物具有以下结构式:其中不同的取代残基r1至r5随着单端孢霉烯的类型而不同。已知的事实是,除了环氧基,在单端孢霉烯类化合物的c-3原子上完整的α-羟基参与负责它们的毒性作用。在c-3原子上具有羟基的单端孢霉烯类型包括脱氧瓜蒌镰菌醇、t-2毒素、ht-2毒素、瓜萎镰菌醇、fuseranon-x、15-乙酰氧基藨镰刀菌烯醇、4,15二乙酰氧基藨镰刀菌烯醇、木霉菌醇、t-2四醇、脱乙酰基新茄镰孢菌醇、乙酰基新茄镰孢菌醇、sporotrichiol、trichotriol、接骨木镰菌素和大镰刀孢菌素。脱氧瓜蒌镰菌醇(don)具有在c-8原子上的特征性羰基并具有以下结构式:和iupac名称(3α,7α)-3,7,15三羟基-12,13-环氧单端孢霉-9-烯-8-酮。在自然界中,也存在于在c-3原子上具有羟基的几个有毒don亚型。这些的实例是乙酰化don(例如15酰基don),糖基化don,磺酸don(例如dons-1,dons-2),或硫酸don(硫酸don15)。这些don亚型也属于在c-3原子上具有羟基基团或取代的羟基基团的单端孢霉烯类型。由于don的毒性作用,食品和饲料主管部门已经规定限制或最高水平。因此,欧盟调节了食物中的don含量(ec号1881/2006,ec号1126/2007),并已推荐饲料最高水平(2006/576/ec)。在美国,fda已经公布最高水平。由在人类或动物中摄取真菌毒素引起的疾病被称为真菌中毒。在单端孢霉烯类化合物或单端孢霉烯类型的情况下,这些疾病也被称为“单端孢霉烯中毒”,更具体地为“在c-3原子上呈现羟基的单端孢霉烯类化合物引起的中毒”,或者甚至更具体地为“don真菌中毒”。众所周知的事实是,单端孢霉烯类化合物对动物和人类的毒性作用基于若干因素。这些因素包括蛋白质生物合成的抑制,5-羟色胺和多巴胺受体可能的相互作用,以及促炎细胞因子的上调(efsa杂志(journal)2004,73,1-41)。此外,don真菌中毒引起生物标志物的变化,如通过以下诊断的:血液中的iga浓度的增加,肝脏中的socs3浓度的增加,或血浆中igfals水平的减少(pestka等人,2004,toxicol.lett.153,61-73),以及在肠内紧密连接蛋白(claudin)浓度的减少(pinton等,2009,tox.appl.pharmacol.237,41-48)。例如,在猪中单端孢霉烯中毒通过以下表现:减少的饲料摄取,降低的生长,呕吐和腹泻的发生,以及在肠内的免疫功能障碍和受损养分吸收。在家禽的情况下,单端孢霉烯中毒引起,尤其是饲料摄取的劣化,较少体重增加,腹泻的发病率,和蛋壳重量的减少。在反刍动物的情况下,对降低的饲料摄取和较少的奶产量进行了描述。在水产养殖中,单端孢霉烯中毒引起,尤其是鱼(如鲑鱼,鲶鱼,或鳟鱼)和虾的饲料摄取和增长率的恶化(binder等人,guidetomykotoxins;isbn978-0-9573721-0-8)。毒性作用也已在狗和猫中描述(efsa杂志(journal)2004,73,1-41)。在人类中,单端孢霉烯中毒可引起,尤其是恶心,呕吐,腹泻,腹痛,头痛,或发热(sobrova等人,interdisc.toxicol.2010,3(3),94-99)。用于减少食品或饲料的单端孢霉烯或don污染的首要战略是,例如,通过符合“良好农业规范(goodagriculturalpractice)”规定,限制真菌侵袭。这包括,使用不含寄生虫和真菌的种子,或作物残体(cropresidues)的深耕式(ploughing-in)。此外,可以通过正确使用杀真菌剂,减少在该领域的真菌生长。收获后,应将作物贮存在低于15%的残留湿度和在低温下,以防止真菌生长。同样地,应在任何进一步的处理之前除去由真菌侵染污染的农作物。尽管存在这份名单的措施,i.rodriges和k.naehrer报告(2012年),即使在具有最高的农业标准的地区,如usa和中欧,don污染2009至2011测试的所有玉米样品的79%或72%。减少食品或饲料中真菌毒素污染的其他选项均为其吸附(adsorption)或转化。对于吸附,必要的是,在很宽的ph值范围内真菌毒素对吸附剂的结合是强的和特异性的,并且它在整个消化过程中在胃肠区域保持稳定。尽管某些非生物吸附剂例如活性炭,硅酸盐或酯,或例如考来烯胺的合成聚合物能有效地用于黄曲霉毒素(aflatoxins),但是将所述吸附剂用于其它真菌毒素,特别是用于单端孢霉烯类化合物是无效的。生物吸附剂如酵母或酵母提取物也描述于文献中,但具有类似于非生物吸附剂的限制。吸附剂的很大缺点是它们可能非特异性结合对于营养而言可以是必需的其它分子。同样地,通过物理和化学处理的单端孢霉烯的转化,特别是解毒是有限的,因为don是非常稳定的,甚至在高达350℃的热处理保持稳定。don可能的微生物转化在ep-b1042449中描述,根据前述文献,微生物bbsh797(dsm11798)用于don的解毒。此处解毒是基于don的c-12和c-13原子上的环氧化物环的打开。us2012/0263827a描述,通过具有国际加拿大登录号040408-1的微生物,将don生物转化为3-epi-don。然而,对于许多技术饲料或食品加工,微生物或吸附剂的混合物是不可能的,或者没有法律允许的,所以其中单端孢霉烯类化合物如don或don亚型的转化或排毒是不可能的。单端孢霉烯类化合物例如don和don亚型迅速吸收进入人体或动物体的胃肠道,这就是为什么快速和有针对性的解毒是重要的的原因。jp-a2003/159079首先描述了seqidno.1的醇脱氢酶用于生产2-酮古洛糖酸。wo2009/133464描述了,尤其是在烘烤业中,通过在食品和饲料中用于氧化淀粉的seqidno.1的酶氧化糖类的方法,以减慢面包的老化过程(ageingprocesses)。此处,醇脱氢酶用于碳水化合物的羟基的氧化。在德沃斯氏菌属的种(devosiasp.)微生物的基因组测序的过程中对具有seqid编号2和3的醇脱氢酶进行了鉴定,并且以识别号gi:737041022和gi:630002266在网上储存于生物技术信息国家中心(ncbi)的服务器。具有seqid编号2和3的醇脱氢酶的更精确的表征在该工作过程中没有给出。因为单端孢霉烯类化合物的各种毒性作用和其发生频度,因此需要可用于单端孢霉烯类化合物的特异性的、安全的、和允许的转化(特别是解毒)的物质或多组物质样酶(groupsofsubstanceslikeenzyme)。本发明的目的在于,使用特定的醇脱氢酶和其变体,采用所述醇脱氢酶和其变体,可能将至少一种在c-3原子上呈现羟基的单端孢霉烯转化为毒性较低的产物。为了解决上述任务,已经令人惊讶地证实,将含有金属离子和醌辅因子的seqidno.1的醇脱氢酶,或除此之外的显示出至少80%,优选86%,特别优选至少89%的序列同一性的功能变体和至少一种氧化还原辅因子用于转化在c-3原子上呈现羟基的至少一种单端孢霉烯,可以特异性地和可靠地转化在c-3原子上呈现羟基的单端孢霉烯类化合物如don,t-2毒素,或瓜萎镰菌醇。转化理解为发生于当毒素的结构变化时,其中所述毒素优选变换成无毒或低毒性的代谢物,即转化。在目前的情况下,结构变化发生于,特别是于在c-3原子显示出羟基的单端孢霉烯的c-3原子,其原因在于c-3羟基基团催化转化为酮基。令人惊奇的是,根据本发明使用醇脱氢酶,在最多样化的化学和生物环境中(例如在缓冲液,饲料醪液(feedmash),唾液或含饲料胃液或含有饲料的肠内容物中)产生在c-3原子上呈现出羟基的单端孢霉烯类化合物特别是don的转化。这是非凡的,因为在酶活性的各环境中,重要的参数,如ph值,蛋白酶浓度,离子强度,或物质基质是非常不同的。其结果是,从将水加入到食品和饲料,至其口服摄取以及在口腔和胃肠道中,可以保证酶的活性。令人惊奇的是,对于某些环境,可以省略外部加入氧化还原因子;这尤其适用于饲料的混合物,唾液和胃液。seqidno.1的醇脱氢酶是醌辅因子依赖性醇脱氢酶。为了产生活性全酶或活性醇脱氢酶,在金属离子(优选钙离子(ca2+))的存在下,醌辅因子(优选吡咯并喹啉醌(pcc))可以结合到酶。因此,活化的醇脱氢酶包含醌辅因子和金属离子,其中酶与醌辅因子的摩尔比为1:1。此外,醇脱氢酶的催化活性还需要氧化还原辅因子,其中除了活化醇脱氢酶,以合成产生的氧化还原因子的形式使用所述氧化还原辅因子,或也可以使用还存在于食品或饲料中和动物或人的分泌物中的氧化还原因子。例如,在人或动物的口腔和胃肠道中,在提供,处理,或消化食物或饲料的过程中,可以形成这些天然的氧化还原辅因子,并且如果需要,可以从食物或饲料中提取这些天然的氧化还原辅因子。包含这样的天然氧化还原辅因子的人或动物的分泌物的实例是消化分泌物如唾液,胃液,肠液,胰液,胆汁,或瘤胃液(rumenfluid)。表述“多肽变体”或“变体”是指,相比于seqidno.1,至少有氨基酸取代的功能性多肽,其中所述酶的功能被保留。转化,特别是在单端孢霉烯类化合物的c-3原子的羟基氧化成酮基,被理解为酶功能。此外,“多肽变体”也可具有氨基酸插入或缺失,特别是相对于seqidno.1多肽序列的c或n末端延长或缩短的序列。如果酶促反应机制保持不变,则“基本上保持”酶功能,也就是说,在相同的位置氧化单端孢霉烯,并且在seqidno.1的原始的、亲本多肽的基础上,变体的酶活性为至少10%,优选至少50%,更优选至少90%,尤其是>100%。命名“序列同一性”指的是序列同一性百分比。对于氨基酸序列和核苷酸序列,序列同一性可以在视觉上确定,但优选由计算机程序来计算。seqidno.1的氨基酸序列被定义为参考序列。序列比较也在序列段内进行,在这种情况下,段被理解为参考序列的连续序列。肽序列的序列段的长度通常为3至200,优选15至65,最优选30至50个氨基酸。存在可用于确定同源性并且正在不断进一步被具体化的销售或免费的许多生物信息学程序。这方面的实例有:gcg威斯康辛bestfit程序包(gcgwisconsinbestfitpackage)(devereux等,1984),blast(altschul等人,1990)或blast2(tatusova和madden1999)。因为对这些算法的不同的设置选项,采用这些算法有可能针对相同的输入序列得到不同的结果。因此,搜索算法和相关联的设置必须被定义。在目前的情况下,ncbiblast(基本局部比对搜索工具((basiclocalalignmentsearchtool)))程序,特别是采用用于多肽的blastp(其可获自“生物技术信息国家中心(nationalcenterforbiotechnologyinformation)”的主页(ncbi,http://www.ncbi.nlm.nih.gov/))用于计算序列同一性。通过这种方式,有可能根据altschul等人,1997(nucleicacidsres.,25:3389-3402)的算法,比较彼此的两个或更多个序列。在此处,使用了2014年8月12日的程序版本。基本设置被用作程序设置,特别是用于氨基酸比较:“最大靶序列”=100;“预期的阈值”=10;“字长”=3;“矩阵(matrix)”=blosom62;“缺口成本(gapcosts)”=“存在:11;延伸:1”;“计算调整”=“有条件的成分得分矩阵调整”。通过使用根据本发明的含有金属离子和醌辅因子的醇脱氢酶或其功能变体,可以转化至少20%,优选至少50%,特别至少90%的在c-3原子上呈现羟基的至少一种单端孢霉烯,特别是don,其中充分的是,使含有金属离子和醌辅因子的醇脱氢酶或其功能变体接触在c-3原子上呈现羟基的至少一种单端孢霉烯至少一分钟,优选至少5分钟,特别是至少60分钟。根据本发明的进一步的实施方案,使用选自seqidno.2至4组成的组的功能变体的氨基酸序列。采用具有seqidno.1的醇脱氢酶的至少86%序列同一性的这些功能变体,可能转化在c-3原子上呈现羟基的单端孢霉烯类化合物,特别是don,其具有一致良好的效果。根据本发明的进一步的实施方案,使用选自pcc,ttc,tpc,ltc和ctc组成的组,优选pcc的醌辅因子。通过在醇脱氢酶中使用醌辅因子之一吡咯并喹啉醌(pcc,cas号72909-34-3),色氨酸色氨酰醌(ttq,cas号134645-25-3),topaquinone(tpc,cas号64192-68-3),赖氨酸酪氨酰醌(ltq,cas号178989-72-5)或半胱氨酸色氨酰醌(ctc,cas号400616-72-0),可能将在c-3呈现羟基原子的单端孢霉烯类化合物(例如don)转化为从毒理学的角度来看是无毒或无害的衍生物。通过经由选自li+、na+、k+、mg2+、ca2+、zn2+、zn3+、mn2+、mn3+、fe2+、fe3+、cu2+、cu3+、co2+与co3+组成的组的金属离子中的至少一个,优选ca2+和mg2+的结合,实现特别快并完全的醌辅因子与醇脱氢酶的结合。也通过使用选自甲基硫酸吩嗪(phenazinemethosulphate)基团(pms),pms衍生物,六氰高铁(iii)酸钾,六氰高铁(iii)酸钠,细胞色素c,辅酶q1,辅酶q10,亚甲蓝和n,n,n’,n’-四甲基-对苯二胺(tmpd)组成的组的至少一种氧化还原辅因子,优选甲基硫酸吩嗪(pms,cas号:299-11-6),辅酶q1和辅酶q10,可能只在湿气的存在下进行所述单端孢霉烯类化合物的完全和快速转化,以确保例如在生产饲料的过程中和在用于动物之前的任何情况下,将饲料组分中含有的单端孢霉烯类化合物转化为无毒的衍生物。pms衍生物的实例是:1-羟基吩嗪,2-(五异戊二烯基氧基)二氢吩嗪,5,10-二氢-9-二甲基烯丙基吩嗪-1-羧酸,5,10-二氢吩嗪-1-羧酸,甲基硫酸5-甲基吩嗪鎓,6-乙酰吩嗪-1-羧酸,benthophoenin,氯法齐明,二氢桥亚甲基吩嗪(dihydromethanophenazine),esmeraldicacid,esmeraldinb,和泉吩嗪(izumiphenazine)a-c,詹纳斯绿(janusgreen)b阳离子,桥亚甲基吩嗪(methanophenazine)pelagiomicina,吩嗪,吩嗪-1,6-二羧酸,吩嗪-1-甲酰胺,吩嗪-1-羧酸,酚藏花红(phenosafranine),绿脓素(pyocyanin),山芬霉素(saphenamycin)或saphenic酸(saphenicacid)甲酯。由于在食品和饲料(特别是用于猪,禽,牛,马,鱼,水产养殖以及家畜的饲料)中和在用于生产或加工食品和饲料的基于植物的原料中在c-3原子上呈现羟基的单端孢霉烯类化合物的转化,有可能通过根据本发明的用途,防止对动物和人类的健康的伤害。此外,本发明的目的在于提供,能够将单端孢霉烯类化合物(尤其是在c-3原子上呈现羟基的单端孢霉烯类化合物)安全、可靠地转化为毒性较低的产物的方法,而不管其中存在单端孢霉烯类化合物的农产品是否已被处理或未被处理。为了解决这个课题,根据本发明的用于单端孢霉烯类化合物的酶促转化的方法本质特征在于,将在c-3原子上呈现羟基的至少一种单端孢霉烯与含有金属离子和醌辅因子的seqidno.1的醇脱氢酶接触,或另外与具有至少80%,优选至少86%,尤其优选至少89%的序列同一性的功能变体接触,与至少一种氧化还原辅因子和水接触,并在必要时与至少一种赋形剂接触。通过使在c-3原子上呈现羟基的单端孢霉烯与含有金属离子和醌辅因子的seqidno.1的醇脱氢酶接触,以及此外与至少一种氧化还原辅因子和水接触,有可能将存在于单端孢霉烯类化合物c-3原子的羟基基团氧化为酮,在这种情况下,单端孢霉烯如此被去毒并转化为无毒的或低毒性的化合物。通过持续使用选自seqidno.2至4组成的组的氨基酸序列的功能变体,而不是seqidno.1的氨基酸序列,可以实现由使用seqidno.1的醇脱氢酶所取得的相同的优点,并且可以特别快速、可靠地实现在食品和饲料中包含的单端孢霉烯类化合物的转化,而不管它们的处理状态,即,无论它们是否已经是经加工的农产品或不是经加工的农产品。在5℃至55℃,优选10℃至50℃,特别优选28℃至45℃之间的温度,采用根据本发明的方法实现,在c-3原子上呈现羟基的单端孢霉烯的特别快速和完全转化。因为可以在这样的宽温度范围内执行根据本发明的方法,seqidno.1的醇脱氢酶或其呈现出seqidno.1的至少80%的序列的功能变体可以用于各种不同的应用,例如水产养殖或也用于在升高的温度的技术工艺。其中单端孢霉烯类化合物在升高的温度的转化是重要的技术过程的实例是用于处理饲料的程序,生产面食和其它玉米产品,如玉米粥,爆米花,玉米片,玉米饼或未经发酵的玉米饼(tortillas),以及强液化过程,糖化过程,或发酵过程,例如捣碎或发酵过程,特别是生物乙醇生产。此处重要的是确保通过这些方法生产的食品或饲料中不包含任何有害数量的在c-3原子上呈现羟基的单端孢霉烯类化合物。根据本发明方法的进一步实施方案,是以如下方式进行的:使在c-3原子上呈现羟基的至少一种单端孢霉烯接触含有金属离子和醌辅因子的醇脱氢酶或至少其功能变体,氧化还原因子,水,并在必要时的用赋形剂,持续至少一分钟,优选为至少5分钟,特别优选为至少60分钟。因为1分钟至60分钟以上的接触时间足以实现将单端孢霉烯类化合物充分转化为无毒或低毒性的衍生物,根据本发明的方法可以例如用于处理用于食品或饲料的基本农用材料的方法。另一方面,它也可以由农夫在饲喂之前立即,例如,通过将水加入饲料并将其在5℃至55℃之间的温度静置1分钟至高达约1小时而施用,这将启动单端孢霉烯类化合物转化为无毒产物。如果醌辅因子选自pcc,ttc,ptc,ltc和ctc组成的组,优选pcc,那么特别快速和完全转化是可能的,因为这对应于根据本发明的方法的另一个实施例。这样的醌辅因子允许醇脱氢酶快速和可靠地攻击单端孢霉烯类化合物c-3原子上的羟基并且将它转化为含有酮基的非毒性衍生物。如果在根据本发明的方法中的辅因子是经由选自li+、na+、k+、mg2+、ca2+、zn2+、zn3+、mn2+、mn3+、fe2+、fe3+、cu2+、cu3+、co2+与co3+组成的组的金属离子中的至少一个,优选ca2+和mg2+结合至醇脱氢酶,那么反应的进一步完成和特别是反应的加速是可能的。以这样的方式执行该方法不仅产生醌辅因子与醇脱氢酶的强结合,也可以实现单端孢霉烯类化合物的快速和可靠的转化。为了进一步改进单端孢霉烯的转化,特别是为了转化反应的完成,继续根据本发明的方法,从而使用选自pms,pms衍生物,六氰高铁(iii)酸钾,六氰高铁(ⅲ)酸钠,细胞色素c,辅酶q1,辅酶q10,亚甲蓝以及tmpd组成的组,优选选自pms,辅酶q1和辅酶q10的氧化还原因子。通过加入这样的氧化还原辅因子,能够执行在c-3原子上呈现羟基的单端孢霉烯类化合物在水性介质中的转化,例如,如在被施用给水产养殖动物的无氧化还原因子的饲料浆液或饲料中,所述氧化还原因子可以例如从必须被添加或必须存在的唾液、胃液或肠液得到,或在被施用给必须已经摄取饲料浆或饲料的动物的饲料浆液或饲料中,在这种情况下,可以防止由摄入饲料的动物对单端孢霉烯类化合物的吸收。最后,本发明的目的是提供单端孢霉烯转化添加剂,采用所述单端孢霉烯转化添加剂,可能在饲料或食品中安全、可靠地将单端孢霉烯类化合物转化为无毒衍生物。为了解决这个课题,根据本发明的添加剂的本质特征在于,它包含含有金属离子和醌辅因子的seqidno.1的醇脱氢酶或还包含其呈现出至少80%,优选至少86%,尤其优选至少89%的序列同一性的功能变体,并在必要时,还包含选自由合成的氧化还原辅因子和至少一种赋形剂组成的组的至少一种附加组分。这样的添加剂可以在低浓度与常规饲料混合,例如,约10克到1千克/一吨饲料,并且在这样的低浓度,允许在c-3原子上呈现羟基的单端孢霉烯类化合物转化为非毒性衍生物,以使得例如被饲喂该饲料的动物健康和行为表现能力将改善,因此,不仅失败率(failurerates)能被减少,而且饲料利用率将得到改善。采用根据本发明的添加剂(包含选自seqidno.2至4的seqidno.1的醇脱氢酶的功能变体,而不含seqidno.1的醇脱氢酶),可实现持续良好的结果。为了通过根据本发明的添加剂基本上完全转化存在于单端孢霉烯类化合物的c-3原子的羟基基团,所述添加剂进一步体现为含有选自pcc,ttc,tpc,ltc,和ctc组成的组的醌辅因子,以及选自li+、na+、k+、mg2+、ca2+、zn2+、zn3+、mn2+、mn3+、fe2+、fe3+、cu2+、cu3+、co2+与co3+组成的组的金属离子。采用这样的进一步的实施方案,一方面可能将醌辅因子安全可靠地结合到醇脱氢酶,并且在另一方面,使用包含这样的补充剂(supplements)的醇脱氢酶,可以实现在分子的c-3原子呈现羟基基团的单端孢霉烯类化合物例如脱氧瓜蒌镰菌醇的完全转化。为了在没有氧化还原辅因子(如那些天然存在于唾液,胃液,或肠液等中的氧化还原辅因子)的存在下进行这样的反应,根据本发明的添加剂是进一步体现为除了作为进一步的氧化还原辅因子,合成的氧化还原辅因子另外选自pms,pms衍生物,六氰高铁(iii)酸钾,六氰高铁(iii)酸钠,细胞色素c,辅酶q1,辅酶q10,亚甲蓝,以及tmpd,优选pms,辅酶q1和辅酶q10。根据本发明的进一步的实施方案,开发了添加剂,使得赋形剂选自惰性载体,维生素,矿物质,植物源性物质,酶和用于真菌毒素的解毒的附加组分例如降解真菌毒素的酶类,尤其是黄曲霉毒素氧化酶,麦角胺水解酶,麦角胺酰胺酶,玉米赤霉烯酮酯酶,玉米赤霉烯酮内酯酶,玉米赤霉烯酮水解酶,赭曲霉毒素酰胺酶,烟曲霉毒素氨基转移酶,烟曲霉毒素羧基转移酶,氨基多元醇胺氧化酶,脱氧瓜蒌镰菌醇环氧化物水解酶,脱氧瓜蒌镰菌醇脱氢酶,脱氧瓜蒌镰菌醇氧化酶,单端孢霉烯脱氢酶,单端孢霉烯氧化酶;和转化真菌毒素的微生物如dsm11798;和真菌毒素结合物质如微生物细胞壁或无机材料,如膨润土或蒙脱石。例如,使用这样的添加剂,可以确保,任何数量的可能被包含在饲料或食品中在c-3原子上呈现羟基的单端孢霉烯类化合物以及任何附加的真菌毒素如镰刀菌毒素(fusariumtoxin),麦角胺,赭曲霉毒素肯定地脱毒到不存在真菌毒素对摄入这种饲料或食品的个体生物体的有害影响的程度。用于本发明进一步的应用是,除了根据本发明的至少一种醇脱氢酶,还含有至少一种涉及蛋白质分解的酶(例如,如蛋白酶)或涉及淀粉或纤维或脂肪或糖原代谢的酶(如淀粉酶,纤维素酶或葡聚糖酶,以及例如,水解酶,解脂酶,甘露糖苷酶,氧化酶,氧化还原酶,植酸酶(phytases)或木聚糖酶)的添加剂。不言而喻,添加剂当然可以以经包封或经涂覆的形式存在,在这种情况下,可以使用标准方法,例如那些在wo92/12645中描述的。通过包封或涂层,可以在没有改性,特别是在没有任何降解或损坏的情况下将添加剂输送到它被使用的位置,从而使该多肽仅在外壳溶解后才开始发挥作用,例如,如在动物的消化道中,这即使是在酸性、蛋白酶丰富和厌氧环境中,也可以实现在c-3原子上呈现羟基的单端孢霉烯类化合物的甚至更有针对性、更快和更完全的破坏。此外,通过包封或涂层,也可以提高添加剂中醇脱氢酶的温度稳定性,在这种情况下,例如,其在饲料造粒过程中的使用得到改进。根据本发明的添加剂可在各种各样的应用,如化合物生产中使用,以预防和/或治疗单端孢霉烯真菌中毒,优选在c-3原子上呈现羟基的单端孢霉烯类化合物引起的真菌中毒,特别是如脱氧瓜蒌镰菌醇真菌中毒。这样的真菌中毒对于人类和动物具有的严重后果。通过如本发明这样使用添加剂,在预防的情况下,尽管口服摄取单端孢霉烯类化合物(特别是在c-3原子上呈现羟基的单端孢霉烯类化合物,特别是脱氧瓜蒌镰菌醇),也能够维持人类和动物健康状况基本上处于与不采用或采用减少的毒素的口服摄取所得水平相同的水平。在真菌中毒的治疗的情况下,能够减轻这种疾病的症状,特别是正常化肝脏中socs3浓度或血浆中igfals水平以及在肠内的闭合蛋白(claudin)浓度。此外,有可能通过本发明这种使用,以改善家畜的生产力,特别是饲料利用率和重量增加,并降低死亡率。基于实施方案和附图如下解释本发明。在此处:图1示出针对活化的seqidno.1的醇脱氢酶以及作为比较的检验(ctr)的脱氧瓜蒌镰菌醇的时间顺序转化,以及图2示出采用seqidno.1至4的活化的醇脱氢酶以及作为比较的检验(ctr)的don的时间顺序转化的表示。实施例1:醇脱氢酶的基因的克隆与纯化用于各个宿主细胞的seqid编号1至4的醇脱氢酶的密码子优化的核苷酸序列取自dna2.0并在核酸水平含有在序列5'末端和3'末端的限制性位点,并且在氨基酸水平上还含有c-或n-末端6xhis标签。在用于大肠杆菌(escherichiacoli)或komagataella酵母(komagataellapastoris)表达的表达载体中通过标准方法整合这些核苷酸序列,并将其转化至大肠杆菌或k.酵母,并表达于大肠杆菌或k.酵母(j.m.cregg,pichiaprotocols,第二版,isbn-10:1588294293,2007;j.sambrook等2012年,分子克隆实验手册第4版,冷泉港(molecularcloning,alaboratorymanual4thedition,coldspringharbor))。在大肠杆菌中表达和在k.酵母细胞间表达的情况下从细胞裂解物,或在k.酵母的胞外表达的情况下从培养上清液,通过经由镍琼脂糖柱的标准方法,通过色谱法选择性强化具有seqidno.1至4的醇脱氢酶。孵育选择性强化的洗脱液,并将其在金属离子和醌辅因子的存在下活化,在这种情况下,“活化”指的是,醇脱氢酶呈现出结合的金属离子和醌辅因子两者。这些活化的醇脱氢酶被用于确定以下实施例3至7中具有seqidno.1至4的醇脱氢酶的酶性质。采用bradford试剂(sigma#b6916)通过光度计测定总蛋白质浓度,在这种情况下,在595纳米的波长,在微板光度计中测定吸收(板读数器,百特,协同ht(biotek,synergyht))。基于校正曲线确定蛋白质浓度,使用bradford测定法通过测量浓度最多为1500微克/毫升的牛血清白蛋白(bsa,sigma#a4919)溶液确定校正曲线。实施例2:序列同一性的测定使用blast程序(基本局部比对搜索工具),尤其是blastp,测定相对于具有seqid编号1-4的醇脱氢酶彼此的氨基酸序列的全长的序列同一性百分比,所述blast程序(基本局部比对搜索工具),尤其是blastp可获自生物技术信息国家中心(ncbi;http://www.ncbi.nlm.nih.gov/)的主页,并且采用blast程序(基本局部比对搜索工具),尤其是blastp,能够根据altschul等人1997(nucleicacidsres.(1997)25:3389-3402))的算法,比较彼此的两个或更多个序列。基本设置被用作程序设置,尤其是:“最大目标序列”=100;“预期的阈值”=10;“字长”=3;“矩阵”=blosom62;“缺口成本”=“存在:11;延伸:1”;“计算调整”=“有条件的成分得分矩阵调整”。彼此氨基酸序列的同一性百分比示于表1:表1:seqidno.1seqidno.2seqidno.3seqidno.4seqidno.1100%87%89%86%seqidno.287%100%99%90%seqidno.389%99%100%91%seqidno.486%90%91%100%实施例3:c-3原子呈现出羟基的单端孢霉烯的转化为了确定具有seqid编号1-4的醇脱氢酶是否适于转化在c-3原子上呈现羟基的单端孢霉烯类化合物(特别是don,瓜萎镰菌醇和t-2毒素),采用c-末端6xhis标签在大肠杆菌中制备具有seqid编号1-4的醇脱氢酶,如实施例1中所述。当通过使在c-3原子上呈现羟基的单端孢霉烯接触活化的醇脱氢酶(即,包含金属离子和醌辅因子的醇脱氢酶)降低在c-3原子上呈现羟基的单端孢霉烯的量时,存在转化。在每一种情况下,通过在4℃离心收获具有2.0-2.5的光密度(od600nm)的100毫升大肠杆菌培养物,和将其再悬浮在20ml磷酸钾缓冲液。通过弗细胞压碎器(frenchpress)处理以20,000psi将细胞悬浮液裂解3次。细胞裂解物通过离心分离成可溶性和不溶性的部分。将上清液无菌过滤,并通过经由镍琼脂糖柱的标准方法强化醇脱氢酶。在此之后,通过采用具有十千道尔顿的截止的特定管的透析进行缓冲液交换。所得总蛋白浓度通过bradford测定法测定。在水溶液中通过孵育使醌辅因子和金属离子结合于醇脱氢酶。在此处,醌辅因子,如吡咯并喹啉醌(pcc,cas号72909-34-3),色氨酸色氨酰醌(ttc,cas号134645-25-3),topaquinone(tpc,cas号64192-68-3),赖氨酸酪氨酰醌(ltc,cas号178989-72-5)和半胱氨酸色氨酰醌(ctc,cas号400616-72-0)作为水溶液以约二十倍摩尔过量被添加到现有的总蛋白浓度。选自li+、na+、k+、mg2+、ca2+、zn2+、zn3+、mn2+、mn3+、fe2+、fe3+、cu2+、cu3+、co2+与co3+的金属离子以其盐的水溶液的形式使用。除非另有说明,醇脱氢酶通常与pcc(sigmaaldrich#d7783)和ca2+一同所用,被活化为5mm的cacl2溶液。以这种方式纯化和活化的酶被用于在c-3原子上呈现羟基基团的单端孢霉烯的体外转化测定。除非另有说明,术语“酶”或“醇脱氢酶”总是理解为是指含有金属离子和醌辅因子的适当活化的醇脱氢酶。在具有下列成分的水溶液中进行转化测定:100mm的tris-hclph7.5或10%teorellstenhagenph7.5;选自以下的合成的氧化还原辅因子:1mm甲硫酸吩嗪pms(sigmaaldrich#p9625),1mm亚甲蓝(sigma#m9140),1mm辅酶q10(sigma#c9538),1mm辅酶q1(sigma#c9538)和20mm六氰高铁(iii)酸钠的pfc(ⅲ)(fluka#60300);通过加入所需量的毒素底物储备溶液而得到的10ppm至最多100ppm的在c-3原子上呈现羟基的基团的单端孢霉烯;和10nm至100nm,最大300nm含有金属离子和醌辅因子的seqidno.1,2,3或4的经活化的醇脱氢酶。除非另有陈述,否则通常使用tris-hcl缓冲液,氧化还原辅因子pms,don和seqidno.1的醇脱氢酶。每个转化测定在1.5ml棕色eppendorf反应容器中进行。将反应混合物在30℃在热块(thermoblock)中孵育至多120分钟,至少40分钟。0,10,20,30和40分钟后,在每种情况下取样0.1毫升,并将样品与0.1毫升甲醇混合,并储存在-20℃,或可替代地通过lc-ms/ms或hplc立即分析所述样品。无菌过滤,含水2000ppm的don溶液用作don底物储备溶液。为了产生这种溶液,将结晶形式的don(来自卢氏实验室(romerlabs)的biopure标准(biopurestandard),物品编号(art.no.)001050,纯度至少98%)称重并溶解。为了量化在c-3原子上呈现羟基基团的单端孢霉烯和它们转化代谢物,进行高效液相色谱(hplc)分析,其中所述物质通过用具有150毫米×4.6毫米的尺寸和5微米(μm)的颗粒尺寸的phenomenexc18gemininx柱经由色谱分离。用5mm的醋酸铵浓度的甲醇/水混合物作为洗脱液。uv信号被记录,并在220纳米进行评价。为了借助于lc-ms/ms分析的定量,通过具有150毫米×4.6毫米的尺寸和5微米的颗粒大小的zorbaxeclipsec8柱经由色谱分离所述物质。用具有5mm的醋酸铵浓度的甲醇/水混合物作为洗脱液。在220纳米(nm)的uv信号被记录下来。电喷雾电离(esi)用作电离源。由“增强模式”的qtrap/lc/ms/ms(三重四极(triplequadrupole),施用的生物系统(appliedbiosystems))量化在c-3原子上呈现羟基的单端孢霉烯类化合物。在线性范围内的转化线(=随时间的毒素浓度降低)的负斜率被用作醇脱氢酶的活性的标准。为了确定残余活性,在标准条件(特别是30℃和ph7.5)下测量的、相对于基本活性的不同的参数的测量活性被应用,并且通常表示为百分比。图1示出don针对seqidno.1的活化醇脱氢酶的按时间顺序的转化,并且图2示出seqid编号2-4(图1b)的活化的醇脱氢酶。从插图显而易见的是,因为don的浓度基于实时(realitytime)减少,发生的don转化。图1示出在50ppm的don和1mmpms的存在下在100mm的trishclph7.5中采用seqidno.1的醇脱氢酶的don转化。通过lc-ms/ms分析(a)获得测量结果和采用seqid编号1-4的醇脱氢酶的don转化示于图2。通过hplc分析得到测定结果(b)。ctr是在测试中用作阴性检查,其包含转化检测的所有组分,与seqid编号1-4的醇脱氢酶相比。为了比较醌辅因子的效率,在转化测定中,采用醌辅因子pcc,ttc,tpc,ltc,和ctc活化的10nm的seqidno.1的醇脱氢酶,10ppmdon和1mm合成氧化还原因子pms各自在100mmtris-hclph7.5中混合和在30℃孵育。30分钟后通过lc-ms/ms测定don浓度。结果示于表2。为了比较氧化还原辅因子的效率,在转化测定中,10nm的活化酶(seqidno.1的醇脱氢酶),10ppmdon和1mm或20mm将被测试的合成的氧化还原辅因子分别混合在100nmtris-hclph7.5中,并在30℃孵育。在30分钟后通过lc-ms/ms测定don浓度。结果示于表2。表2:醌辅因子don[ppm]氧化还原辅因子don[ppm]pcc1.941mmpms1.95ttq2.3220mmpfc(iii)2.11tpq2.411mm辅酶q18.58ltq2.041mm亚甲蓝6.88为了测试在活化的酶中的金属离子对转化的影响,seqidno.1的醇脱氢酶和pcc被活化,但在每一种情况下采用不同的金属离子,即,mg2+、ca2+、zn2+、mn2+、fe2+和cu2+。转化测定包含分别在100mmtris-hclph7.5中的10nm活化的醇脱氢酶,10ppmdon和1mmpms,并且在30℃孵育。30分钟后通过lc-ms/ms测定don浓度。结果示于表3。表3:金属离子don[ppm]金属离子don[ppm]mg2+1.90mn2+2.57ca2+1.98fe2+2.17zn2+2.46cu2+2.61类似于上述的don转化测定,用在c-3原子上呈现羟基的其他单端孢霉烯类化合物进行转化测定。在这些测定中,不采用50ppm的don,而使用50ppm的t-2毒素或50ppm的瓜萎镰菌醇。含有金属离子和醌辅因子的seqidno.1至4的所有四个醇脱氢酶也能转化t-2毒素和瓜萎镰菌醇,在这种情况下,一半以上的最初使用的毒素在30分钟内转化。实施例4:活性区域的测量为了确定seqid编号1-4的醇脱氢酶在不同条件下转化don的能力,seqidno.1醇脱氢酶用作一个实例。制作seqidno.1的醇脱氢酶,并如实施例3中所述用钙离子和pcc活化所述的醇脱氢。为了确定在10℃至50℃温度范围内和在3.0到9.0ph范围内的酶的活性,使用10%teorellstenhagen缓冲液代替100mmtris-hclph7.5缓冲液。在具有以下组分的水溶液中进行用于确定不同温度的活性的转化测定:10%teorellstenhagenph7.5,1mm的合成的氧化还原辅因子pms,50ppm的don,和10nm活化seqidno.1的醇脱氢酶。在具有10℃至50℃温度梯度的热循环仪(eppendorf)中孵育转化测定至多60分钟。0,10,20,30,40,和60分钟后,在每种情况下取样0.05毫升和将所述样品与0.05毫升甲醇混合以终止反应,并贮存在-20℃。将样品制备用于lc-ms/ms,如实施例3中所述,并通过lc-ms/ms进行分析。针对每个温度测定don还原过程和计算活性,如在实施例3中所述。30℃的转化线的线性范围的斜率的用作参考值以计算在其他的温度的残余活性。表4显示以℃计的温度和以百分比计的相关的残余活性。令人惊讶地已经表明,seqidno.1的醇脱氢酶在广泛的温度范围内具有活性。在10℃,测量到48%的残余活性,并在约50℃,测量到67%的残余活性。表4:在具有下列组分的水溶液中进行用于确定4.0~9.0的ph范围内的活性的转化测定:10%teorellstenhagenph4.0至ph10.0,20mm合成的氧化还原辅因子pfc,100ppmdon,和20nm活化的seqidno.1的醇脱氢酶。在30℃在热循环仪孵育转化测定最多60分钟。0,10,20,30,40和60分钟后,在每种情况下取样0.05毫升和将所述样品与0.05毫升甲醇混合以终止反应,并贮存在-20℃。如实施例3中所述,将样品稀释并通过lc-ms/ms进行分析。在各ph值确定don还原过程和计算活性,如实施例3中所述。在ph7.5的转化线的线性范围的斜率用作参考值以计算其他的温度的残余活性。表5示出ph值和相关联的残余活性(基于7.5的参考ph值的don降低)。表5:ph残余活性ph残余活性4.010%7.0105%5.018%7.5100%6.020%8.069%6.552%9.0105%实施例5:测定温度稳定性30℃至55℃范围内确定seqidno.1的醇脱氢酶的温度稳定性。为了做到这一点,在热循环仪(eppendorf)中在特定温度下将活化醇脱氢酶孵育在100nmtris-hcl缓冲液,ph7.5至多60分钟。0,5,10,15,20,30,40,和60分钟后,取醇脱氢酶的等分样品并在don转化测定中测定活性,如实施例3中所述。转化测定包含以下成分:100mm的tris-hcl,ph7.5,1mm的pms,50ppm的don,10nm活化的seqidno.1的醇脱氢酶。如实施例3中所描述的,孵育反应和在0,10,20,30,40和60分钟后进行取样,以确定活性。针对每个温度每个孵化时间来确定don还原过程。计算don转化线的线性范围的斜率以确定温度稳定性。在t=0分钟时的don转化线的各温度的线性范围的斜率被用作残余活性计算的参考值。表6示出了以℃计的温度,以分钟计的孵育时间,和以百分比计的相关联的残余活性。当在30℃和37℃的温度贮存一小时的时候,seqidno.1的醇脱氢酶是最稳定的。与此相比,在存储一小时后醇脱氢酶在40℃仍然有73%的残余活性。在45℃存储30分钟后测量到50%的残余活性。令人惊奇的是,在50℃存储5分钟后,检测到84%的残余活性。表6:实施例6:确定ph稳定性在ph4.0至ph10.0的范围内确定活化的seqidno.1的醇脱氢酶的ph稳定性。为了做到这一点,在30℃的温度,将十倍浓度的活化的醇脱氢酶(100nm)储存在10%teorellstenhagen缓冲液ph4.0至ph10.0中至多120分钟。0,60,和120分钟后,取出醇脱氢酶的等分样品并测定在转化测定中的活性,如实施例3中所述,在30℃下用下列组分进行:100mm的tris-hcl,ph7.5,1mm的pms,50ppm的don,10nm的活化的seqidno.1醇脱氢酶。0,10,20,30和40分钟后进行用于确定活性的取样。每次针对每个ph值测定don还原过程。为了确定稳定,在各个时间针对各ph值计算don转化线的线性范围的斜率。在t=0分钟时各ph值的don转化线的线性范围的斜率被用作下列孵育时间的活性计算的参考值。表7示出ph值,以分钟计的ph孵育时间,以及以百分比计的相关联的残余活性。seqidno.1的醇脱氢酶在60分钟孵育后在ph5.0至ph9.0是稳定的。出人意料的是,醇脱氢酶在酸性环境中(在ph5.0没有活性损失)和在重碱性环境(在ph9.0在120分钟后孵育中没有活性损失)中呈现出特别良好的稳定性。表7:实施例7:复合基质中don的转化为了确定活化的醇脱氢酶也在没有外部添加合成的氧化还原辅因子的情况下在复合基质中转化单端孢霉烯类化合物的能力,活化的seqidno.1的醇脱氢酶如实施例3中所述制备,和don转化测定在复合基质中进行。在此处,复合基质尤其被定义为牛的瘤胃液,猪空肠的肠内容物,猪的胃液,人类和猪的唾液,颗粒仔猪饲料,和与唾液、瘤胃液或肠内容物混合的颗粒仔猪饲料。为了缓冲系统的比较,用tris-hcl进行检查,如实施例3中所述。使用基于玉米、大豆以及大麦的标准饲料作为仔猪饲料。为了确定在瘤胃液中的醇脱氢酶活性(ph为5.9),在每种情况下将1ml无菌瘤胃液滤液加至100,200,和300nm的活化的seqidno.1的醇脱氢酶和50ppmdon。对照批次在水溶液中进行测试,如实施例3中所描述。测定转化在30℃在热块中孵育最多24小时。0,0.5,1.0,5.0和24.0小时后取样品,在这种情况下,每次采取0.1ml的样品,反应用0.1毫升甲醇停止。将样品储存在-20℃,解冻,并用eppendorf台式离心机以13000rpm离心10分钟,并用0.2微米的spartan滤器无菌过滤。针对lc-ms/ms,如实施例3中所述稀释样品并且通过lc-ms/ms分析分析。don在t=0h时的浓度用作以下值的参考值(100%)。表8表明在相对t=0h时的一定时间测量的don浓度的百分比。针对tris-hcl缓冲液的活性,外部加入的合成的氧化还原辅因子的存在是必要的,因为don的转化缓慢地发生,并且只有在用300nm的浓度的醇脱氢酶24个小时后是可检测的。令人惊讶的是,已经证实,在没有加入外部合成的氧化还原辅因子的情况下在5.9的ph值的菌瘤胃液滤液中,don得到转化。这清楚地表明,在瘤胃液中有作为天然氧化还原辅因子的物质。用300nm的浓度,在5小时孵育后在制剂中只包含42%的初始don量。24小时孵育后,在采用大于200nm的醇脱氢酶浓度的情况下,只可检测到低量的don。表8:为了确定在不具有大约3的ph值的醪液的猪胃液中,在ph值为约6的猪肠内容物中,和在猪和人的唾液中的醇脱氢酶活性,在每种情况下,300nm的活化的醇脱氢酶seqidno.1,约20ppmdon与1ml胃液(无菌过滤),1ml糊状肠内容物,或1ml唾液混合。作为阴性的检查,引入仅含有具有20ppmdon的消化液体的测定,并且作为阳性检查,使用包含所有组分(包括20mm的合成的氧化还原辅因子pfc(ⅲ))的转化测定。0,3.0,5.0,24.0小时后采取样品,在这种情况下,每次采取0.1ml的样品,并将该反应用0.1毫升甲醇停止。将样品贮存在20℃,解冻,并用eppendorf台式离心机以13000rpm离心10分钟,并无菌过滤(0.2μm斯巴达(spartan)滤器)。针对lc-ms/ms,在洗脱剂中以1:10稀释样品(见实施例3)和如实施例3通过lc-ms/ms进行分析。表9示出了在采样时测定的各don浓度。出人意料的是,在没有外部添加合成的氧化还原辅因子(不分品种)的情况下,发生唾液中don的减少。这清楚地表明,人类和猪的唾液分泌物中有适合作为用于采用醇脱氢酶seqidno.1转化don的天然氧化还原辅因子的物质。在不含玉米粥(mush)的纯胃液中没有测量到don浓度大幅度减少。只通过添加合成的氧化还原辅因子,使得don浓度在肠内容物中减少。表9:为了确定在仔猪饲料中的醇脱氢酶的活性,100毫克仔猪饲料分别与400μl的100mmtris-hcl缓冲液,ph7.5,400μl猪唾液,400μl无菌猪胃液或400μl的猪肠内容物混合。这些仔猪饲料悬浮液在4℃下贮存过夜。在此之后,约20ppmdon,和/或300nm的活化的seqidno.1醇脱氢酶,和/或20mm合成的氧化还原辅因子pfc(ⅲ)加入到所有样品。无醇脱氢酶和无外部合成的氧化还原辅因子的制剂被用作阴性检查。具有添加的醇脱氢酶的和合成的氧化还原辅因子的制剂被用作阳性检查。0,3.0,5.0,24.0小时后取样品。每次使用一份全部样品。对于样品,加入500μl的甲醇,随后是以300rpm在摇床上30分钟均质化。在此之后,将样品离心15分钟(eppendorf台式离心机,13,000rpm)并且将上清液通过0.2μm的spartan滤器用注射器过滤。将上清液贮存于-20℃,解冻,并在洗脱液中以1:10稀释用于lc-ms/ms,并如实施例3中所述的通过lc-ms/ms进行分析。表10示出了存在于各时刻的样品中的don浓度。在仔猪饲料缓冲液混合物中,存在可以假设具有外部加入合成的氧化还原辅因子的作用的物质,因为在没有外部合成的氧化还原辅因子的情况下don浓度持续减小。这些物质来自仔猪饲料,因为如之前所示,在没有外部合成的氧化还原辅因子的情况下,在缓冲液中无法测量到don转化。在外部合成的氧化还原辅因子的存在下,don在仔猪饲料缓冲混合物中的转化相对地发生得更快。在仔猪饲料和唾液的混合物中,醇脱氢酶也显示出独立于外部合成的氧化还原辅因子的存在的活性;而更快的don的减少发生在包含外部合成的氧化还原辅因子的转化测定中。令人惊奇的是,在没有添加外部合成氧化还原辅酶的情况下,seqidno.1的醇脱氢酶在仔猪饲料混合物中也具有活性。一方面,通过将仔猪饲料加入胃液,胃液的ph提高,而在另一方面,可以取代外部合成的氧化还原辅因子的天然存在的氧化还原辅因子从仔猪饲料释放。只有当外部合成的氧化还原辅因子加入到转化测定中时,确定肠内容物中醇脱氢酶的活性。表10:当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1