新的二氢‑噁嗪并苯并二氮*化合物、它们的制备方法以及含有它们的药物组合物与流程
本发明涉及在中枢γ-氨基丁酸能系统上具有选择性双重作用的新的1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮化合物,它们的制备方法以及含有它们的药物组合物。
背景技术:
γ-氨基丁酸(或GABA)是在哺乳动物中枢神经系统中的主要抑制性神经递质。在前脑中,GABA主要是通过经由GABAA和GABAB受体协调复杂神经元回路的中间神经元合成的。GABAA受体是主要定位于细胞质膜上的配体激活的氯通道。典型地,GABAA受体是由从蛋白质亚单位α(6基因)∶β(3基因)∶γ(3基因)各自以2∶2∶1的比率的仓库(reportory)装配的五种类似的跨膜蛋白亚单位组成的。通常假设每个亚单位的两个相同的亚型结合到特定受体中[Atack JR(2011)Curr Top Med Chem 11:1203-1214]。
传统的苯并二氮化合物比如地西泮,通过结合到跨越受体的α和γ亚单位之一的界面的苯并二氮(BDZ)位点变构调节GABAA受体。地西泮作为GABA作用的非选择性正变构调节剂(PAM)带来镇静、催眠、抗焦虑、抗惊厥、遗忘、镇痛、和肌肉松弛的效果。
基因嵌入(Knock-in)遗传实验已经显示α1亚单位负责镇静作用,同时α2和可能地α3亚单位负责BDZ-位点PAMs的抗焦虑潜能[H(2012)Neuropharmacol 62:42-53]。在BDZ-位点表现为负变构调节剂(NAM)的化合物也被称为″反向激动剂″。在临床前试验中,没有GABAA亚型选择性的BDZ-位点NAM化合物显示出益智性质。然而,主要的促惊厥(pro-convulsive)和抗焦虑作用已经阻止了在这些化合物上进行的进一步临床研究。
已经在遗传上改变的动物中并借助似乎是体内选择性的BDZ-位点调节剂,评估含有α5亚单位的GABAA受体的生物学功能。电生理学研究表明,紧张性抑制可能性存在于大多数大脑新皮层锥体神经元中,并表明该可能性设定了细胞的固有兴奋性阈值。此外,在前额皮质锥体细胞但不在海马CA1锥体细胞中,在调节神经元放电中,通过HCN通道介导的Ih和GABAA α5介导的紧张性电流之间有互补性。这表明GABAA α5抑制剂在前额皮质比在海马中对于锥体细胞活性将具有更大的影响。行为上,GABAA α5受体基因缺失或减少的数量与认知功能的改善相关。此外,用各种α5选择性NAMs的治疗增强了在完整的啮齿动物中和在唐氏综合症的小鼠模型中的认知表现。在人类中,通过α5选择性BDZ-位点NAM,急性酒精消耗的遗忘作用被减弱。
γ-氨基丁酸能的神经传递对于正常背外侧前额皮质的功能从根本上也是重要的。已经提出,在神经分裂患者中工作记忆的缺陷可能是在背外侧前额皮质中减小的γ-氨基丁酸能神经回路控制的结果[Lewis DA et al.(2008)Am.J.Psychiatry.165:1585-1593]。在细胞水平,γ-氨基丁酸能吊灯细胞(chandelier cells)经由位于轴突初始段的GABAA α2受体调节锥体神经元的活性。该机制对于在前额皮质中维持在γ频带锥体神经元活性的最佳同步化显得重要。然而,新近报道表明GABAA α2/α3功能的增强可能不足以改善认知功能[Buchanan RW et al.(2011)Biol.Psych.69:442-449]。实际上,流行的理论强调对于海马前额同步化的需求和对于最佳认知功能的连通性[Akbarian S(2008)Am.J.of Psychiatry 165:1507-1509;Uhlhaas PJ et al(2008)Schizophr Bull 34:927-943]。
基于以上概述的机制,同时发生在锥体细胞的轴突起始段上的GABAA α2亚单位上的γ-氨基丁酸能神经传递的增强(augmention)和在海马中通过阻断GABAA α5受体紧张性抑制的减弱,可以预测其在不同障碍中改善认知功能障碍,比如阿尔茨海默疾病、唐氏综合症、神经分裂症、亨廷顿氏疾病和不同起因的痴呆。
在与各种年龄相关的障碍、神经变性或血管障碍以及精神分裂症有关的认知缺陷的治疗中存在大量、不满足的需求。
目前对于阿尔茨海默疾病的治疗,具有最大患病率的病理,是基于胆碱酯酶(例如,多奈哌齐)的抑制或NMDA拮抗作用(美金刚)。然而,胆碱酯酶抑制剂具有大量与它们的作用机制有关的不希望的作用,同时美金刚的真实效力是受限制的。因此,具有更大的效力和更好的耐受性的治疗会是特别有价值的。
国际专利申请WO 2012120206公开了具有以下结构的一族化合物:
这些化合物公开可用于治疗或预防精神病和神经性障碍,作为对于GABAA受体α5亚单位的选择性配体。
技术实现要素:
本发明的化合物是新的且具有特别有价值的性质,因为它们在含有α2和α5亚单位的GABAA受体上同时活动。本发明的化合物的特定的治疗优点是在中枢γ-氨基丁酸能系统上的选择性双重作用。
本发明涉及式(I)的化合物:
其中
R1,R2是独立地选自氢和C1-4烷基;
R3是氢或C1-4烷基,其是未取代的或被苯基,吡啶基,或任选地被C1-4烷基取代的氨基所取代;
R4是氢;
R5是C1-4烷基;
R6是选自单环芳基,其是未取代的或被一个或多个相同或不同的以下基团取代的六元环,所述基团选自:C1-4烷基,C1-4烷氧基,C1-4卤代烷基,苯基,苯氧基,卤素,硝基;或由具有1至3个相同或不同选自氮,氧和硫的杂原子的五或六元环组成的单-或双-或三环杂芳基,其中至少一个环是芳香族的,且其中环是任选地被一个或多个相同或不同基团取代,所述基团选自C1-4烷基,单-,二-,三-卤代C1-4烷基,C1-4烷氧基,羟基,卤素,它们的位置异构体,它们的消旋体和对映异构体,它们的非对映异构体,以及它们与药学上可接受的酸的加成盐,它们的溶剂化物,它们的复合物,加合物和前药。
在药学上可接受的酸中,可以不意味任何限制的提到,盐酸,氢溴酸,硫酸,乙酸,三氟乙酸,乳酸,丙二酸,琥珀酸,谷氨酸,富马酸,马来酸,磷酸,柠檬酸,草酸,甲磺酸,苯磺酸,对甲苯磺酸,樟脑酸,等等。
未取代的或取代的单-双-,三环杂芳基,由具有一至三个选自氧,氮和硫的杂原子的五或六元环组成,其中在双-,三环基团中至少一个环是与所述杂环稠和的。
例如,单环杂芳基是苯基取代的噻吩且双环杂芳基是喹诺酮,吲哚,噁唑,苯并噻吩,苯并呋喃且三环杂芳基是萘并噻吩(naphto-thiophene),二苯并噻吩,萘并呋喃(naphtofuran),苯并双呋喃(benzobifuran)。
根据本发明式(I)的化合物优选的代表是那些其中R1,R2是丙基,乙基,甲基或氢,R3是氢,甲基,乙基,或苄基且R5是来自甲基或乙基。
根据本发明式(I)的化合物的进一步优选的代表是那些其中R1,R2是甲基或氢,R3是氢和R5是甲基。
本发明涉及式(I)的化合物,其中R6是苯基,其被一个或多个卤素或C1-4烷基取代,该C1-4烷基被一个或多个卤素取代。进一步,根据本发明式(I)的化合物优选其中R6是被一个或多个氟或三氟甲基取代的苯基。根据本发明进一步的方面,提供式(I)的化合物,其中R6是苯并呋喃基或苯并噻吩基,其中环是任选地被一个或多个相同或不同的以下基团取代的,所述基团选自:C1-4烷基,C1-4卤代烷基,C1-4烷氧基,卤素,羟基。
在本发明说明书中,C1-4烷基意味着饱和直链或支链烃链或环烃环。C1-4卤代烷基意味着如上定义的被一个或多个相同或不同的卤素原子,其中优选地选自F,Cl取代的C1-4烷基。通常卤素原子意味着F,Cl,Br,I。
另一组优选的式(I)的化合物是,其中R1,R2是丙基,乙基,甲基或氢,R3是氢,甲基,乙基或苄基,R5是甲基或乙基和R6是1-苯并呋喃-2-基或1-苯并噻吩-2-基基团,其是由一至三个相同或不同的以下基团取代的,所述基团是独立地选自C1-4烷基,C1-4烷氧基,卤素,羟基。
又一组进一步优选的式(I)的化合物是,其中R6是1-苯并呋喃-2-基或1-苯并噻吩-2-基基团,其是由一至三个相同或不同的以下基团取代的,所述基团独立地选自甲基,乙基,甲氧基,氟,氯和羟基。
又一组进一步优选的式(I)的化合物是,其中R6表示1-苯并呋喃-2-基基团,在3位被乙基或甲基取代且在4至7中任意位被一个或两个相同或不同的基团取代,所述基团独立地选自乙基,氯,甲氧基,和羟基。
又一组进一步优选的式(I)的化合物是,其中R6表示1-苯并呋喃-2-基基团,在3位被乙基或甲基取代且在4至7中任意位被一个或两个相同或不同的基团取代,所述基团独立地选自乙基,氯,甲氧基,和羟基。
又一组进一步优选的式(I)的化合物是,其中R6表示1-苯并噻吩-2-基基团,在3位被乙基或甲基取代且在4至7中任意位被一个或两个相同或不同的基团取代,所述基团独立地选自氯和氟。进一步,根据本发明式(I)的化合物优选的是,其中R1,R2是甲基或氢;R4,R3是氢,R5是甲基和R6是1-苯并呋喃-2-基或1-苯并噻吩-2-基基团,其是被一至三个相同或不同基团取代的,所述基团是独立地选自甲基,乙基,甲氧基,氟,氯,和羟基。根据本发明,最优选的式(I)的化合物是,其中R1,R2是甲基或氢;R4,R3是氢,R5是甲基和R6表示1-苯并呋喃-2-基基团,在3位被乙基或甲基取代且在4至7中任意位被一个或两个相同或不同的基团取代,所述基团独立地选自乙基,氯,甲氧基,和羟基。根据本发明,特别优选的式(I)的化合物是其中R1,R2是甲基或氢,R4,R3是氢,R5是甲基和R6表示1-苯并噻吩-2-基基团,在3位被乙基或甲基取代且在4至7中任意位被一个或两个相同或不同的基团取代,所述基团独立地选自氯和氟。
本发明最优选的化合物是:
6-(4-氟-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
6-(6-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
6-(6-氯-5-氟-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
6-(5-氯-3-乙基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
6-(5-氯-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
6-(3,5-二乙基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
6-(5-羟基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
式(I)的化合物的位置异构体,对映异构体,非对映异构体,与药学上可接受的酸形成的加成盐还以及溶剂化物,复合物和加合物形成本发明完整的部分。
可以使用手性HPLC色谱分离消旋体,通过经由非对映异构的衍生物拆分外消旋体,或通过手性合成获得式(I)的外消旋体化合物的纯对映异构体。如此获得的对映异构体也用旋光度测量表征。
本发明还涉及制备式(I)的化合物的方法,包含用式(III)的化合物处理式(II)的化合物,
其中R4是氢和R5表示直链或支链C1-4烷基;
其中R1和R2是独立地选自氢或直链或支链C1-4烷基;
R7表示直链或支链C1-4烷基,X表示离去基团,优选地Cl或Br,以得到式(IV)的化合物;
其中R1,R2,R4,R5和R7定义如式(I)和(III);
其被还原且任选地N-烷基化以得到式(V)的化合物,
其中R1,R2,R3,R4和R5定义如式(I);
溴化以得到式(V)的化合物以得到化合物(VI),
其中R1,R2,R3,R4和R5定义如式(I);
通过用至少一种醇或二醇处理,将式(VI)的化合物转化为化合物(VII),
其中R1,R2,R3,R4和R5定义如式(I),其中R8和R9各自表示C1-4烷基,或R8和R9一起形成C2-6亚烷基;
通过用碱金属或镁原子交换溴原子转化如此得到的产物,并通过用大约等摩尔量的通式(VIII)的羧酸衍生物与如此得到的碱金属或镁化合物反应得到化合物(IX)
其中R1,R2,R3,R4,R4和R6定义如式(I),R8和R9定义如式(VII),R10表示Cl,或Br,或OR11[其中R11表示(C1-C4)烷基],或NR12R13[其中R12和R13各自指(C1-C4)烷基或甲氧基];
将式(IX)的化合物转化为式(I)的化合物的方法,其包含
a)用酸处理化合物(IX),然后通过一锅法用肼或水合肼环化,生产化合物式(I),或
b)通过酸性处理将化合物(IX)转化为化合物(X)
其中R1,R2,R3,R4,R4和R6定义如式(I)且A-是阴离子;
并用肼或水合肼与如此得到的式(X)的化合物与反应以生产式(I)的化合物,或
c)通过酸性处理使化合物(IX)转化为化合物(XI)
其中R1,R2,R3,R4,R5和R6定义如式(I)
用肼或水合肼与式(XI)的化合物反应以生产式(I)的化合物。
制备式(I)的化合物的方法,包含还原式(V)的化合物为式(XII)的醇
其中
R1,R2,R3,R4和R5定义如式(I);
在酸性条件下,用式(XIII)的醛与如此得到的产物反应得到式(XIV)的异色满
其中R6定义如式(I);
式(II),(III)和(VIII)的化合物是市售可得的或本领域技术人员利用常规化学反应或在文献中描述的化学反应容易取得的。
本发明的化合物同时作用于含有α2和α5亚单位的GABAA受体上。在前额皮质中神经递质GABA的增强作用伴随着在海马中GABA介导的紧张性抑制的减弱。这样的化合物预期可用于治疗或预防精神病和神经障碍,其特征在于认知缺陷,比如精神分裂症,单相抑郁症,阿尔茨海默病,血管性痴呆,孤独癖谱群障碍,唐氏综合症,脆性X染色体综合征,帕金森病,亨廷顿病。其它可能的治疗适应症是与各种焦虑状态比如广泛性焦虑,有或没有广场恐怖症的惊恐障碍,强迫性障碍,创伤后应激障碍和双相情感障碍相关。本发明的化合物可以用于治疗大脑血管意外的后遗症和大脑、脊柱或髓损伤的后遗症。
化合物会优选地用于治疗或预防阿尔茨海默病,血管性痴呆比如由于大脑血管意外导致的痴呆,亨廷顿病和唐氏综合症。
本发明还涉及药物组合物,其含有作为活性成分的至少一种式(I)的化合物自身或与一种或多种惰性、无毒的赋形剂或载体的结合。根据本发明的药物组合物中尤其可以提及那些适用于口服、肠胃外(静脉或皮下)或鼻内给药,片剂或糖衣丸、舌下片剂、胶囊、锭剂、栓剂、乳膏、软膏、皮肤凝胶、可注射的制剂和可饮用的悬浮液。
有用的剂量根据患者的年龄和重量以及障碍的性质和严重性,还以及给药途径,其可以是鼻腔、直肠、肠胃外或口服变化。通常,单位剂量从0.1至1000mg/24小时给药1至3次用于治疗。
附图简要说明
图1和图2.在腹腔注射给药后,小鼠目标识别模型中实施例4和实施例24的化合物的促认知效果。平均值±S.E.M.(n=8-11/组);在ANOVA之后的邓奈特检验(*:p<0.05,**:p<0.01,***:p<0.001)。鉴别指数:新对象探索的持续时间(s)-熟悉的对象探索的持续时间(s)/新对象探索的持续时间(s)+熟悉的对象探索的持续时间(s)。
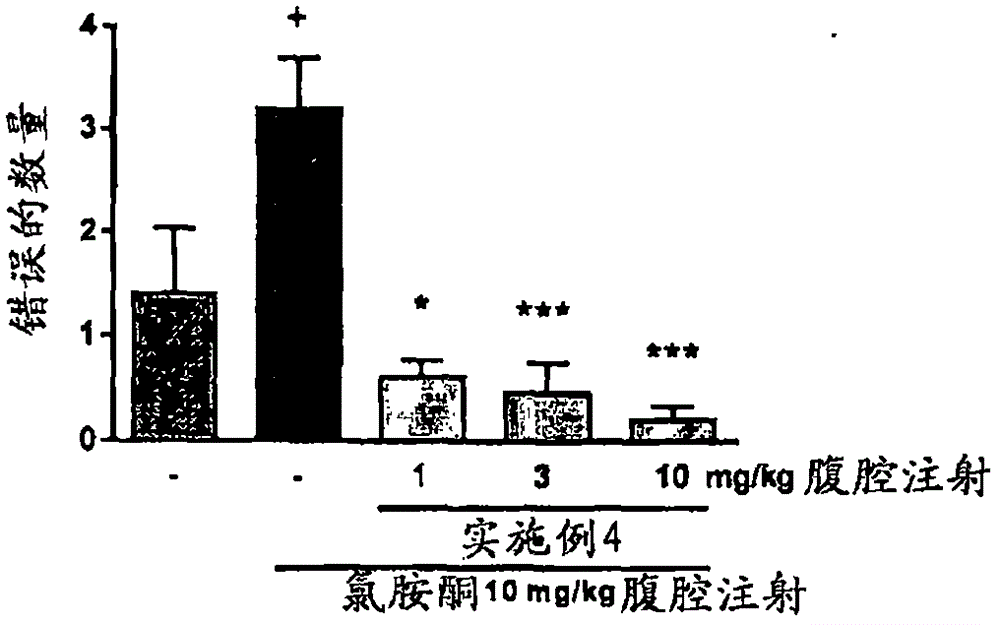
图3.在大鼠中,实施例4的化合物腹腔注射给药后,在工作记忆中氯胺酮诱导的缺陷的降低。平均值±S.E.M.(n=9-10);曼-惠特尼(Mann-Whitney)U检验(#p<0.05,对照vs.用载体处理的对照);在Kruskal-Wallis ANOVA之后的邓恩检验(Dunn test)(*p<0.05,**p<0.01,***p<0.001vs.用氯胺酮处理之后的对照)。
图4.在腹腔注射给药后小鼠PCP诱导PPI破坏模型中实施例25的化合物的改善效果。平均值±S.E.M.(n=10-12/组)T检验(Student’s t-test):媒介物vs.PCP-处理的组(***p<0.001)在ANOVA之后的新复极差法检验(Dunnett’s test):PCP-处理的vs.PCP+化合物处理的组(#:p<0.05)。
图5.腹腔注射给药后在亮暗试验(Light-dark test)的小鼠中实施例26的化合物的抗焦虑活性(在亮隔室增加的活性)。平均值±S.E.M.(n=11-20/组)T检验(Student’s t-test):媒介物vs.地西泮-处理的组(*p<0.05)在ANOVA之后的邓恩检验(Dunnett test):媒介物-处理的vs.化合物-处理的组(#:p<0.05)。
图6.腹腔注射给药后大鼠社会关系模型中实施例4的化合物的抗焦虑活性。平均值±S.E.M.(n=12/组)Kruskal-Wallis ANOVA随后曼-惠特尼(Mann-Whitney)U检验:对照vs.化合物-处理的组(**:p<0.05。
本发明将用以下实施例说明,但本发明不应被解释为局限于此。
实施例1
6-(4-氟-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
(1)搅拌1-(4-羟基-3-硝基苯基)丙烷-2-酮(1,20.0g,102.5mmol),2-溴-丙酸乙酯(14.4mL,110mmol)和丙酮(550mL)的混合物,并加入K2CO3(42.0g,303mmol)且混合物回流7小时。沉淀过滤,用丙酮(3×100mL)洗涤,并蒸发。油状残余物(28.0g,94mmol)溶解于乙酸(200mL)中,并加入Pd/C(10w/w%,8.0g)。在室温于10bar压力下氢化8小时。过滤催化剂,用乙酸(3×25mL)洗涤。蒸发乙酸且固体残余物从DIPE和甲醇的混合物中重结晶以得到2-甲基-6-(2-氧代丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(2,15.5g,69%),mp:163-166℃。
(2)在0℃,向2-甲基-6-(2-氧代丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(2,10.0g,45.6mmol)于甲醇(100mL)的悬浮液中缓慢加入硼氢化钠(1.82g,48.1mmol),并在0℃搅拌混合物30分钟并在室温进一步搅拌90分钟。加入乙酸(7.3mL),并蒸发溶剂。向残余物中加入水(40mL)并过滤结晶产物,用水(3×15mL)洗涤并干燥以得到6-(2-羟丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(8.0g,79%),mp:126-128.5℃。
6-(2-羟丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(2.76g,12.5mmol)和4-氟-3-甲基-1-苯并噻吩-2-甲醛(1.94g,10.0mmol)和含有15v/v%HCl(25mL)的乙酸乙酯的混合物搅拌过夜。沉淀过滤,用二乙醚(2×10mL)洗涤,得到6-(4-氟-3-甲基-1-苯并噻吩-2-基)-3,8-二甲基-1,6,8,9-四氢异色满并(tetrahydroisochromeno)[7,6-b][1,4]噁嗪-2(3H)-酮(3,4.0g,大约(ca.)100%)。
(3)向6-(4-氟-3-甲基-1-苯并噻吩-2-基)-3,8-二甲基-1,6,8,9-四氢异色满并[7,6-b][1,4]噁嗪-2(3H)-酮(3,3.97g,大约10mmol)在丙酮(140mL)和甲苯(60mL)的混合物的溶液中滴加琼斯(Jones)试剂[19.5mL,三氧化铬(2.7mmol/mL)和硫酸(4.2mmol/mL)的水溶液]。
在室温搅拌混合物2小时。加入甲醇(15mL)并将溶液从无机沉淀中轻轻倒出,用丙酮(2×20mL)洗涤。蒸发合并的有机层,向残余物中加入水(75mL)并搅拌混合物30分钟。沉淀过滤,用水(2×15mL)洗涤并干燥得到二酮4(3.8g,92%)。Mp:213-217℃。
(4)在剧烈搅拌下,向二酮4(3.66g,8.9mmol)于乙酸乙酯(80mL)的溶液中加入高氯酸(7.24mL,89mmol,70%水溶液),且混合物搅拌过夜。过滤结晶产物,用二乙醚(2×5mL)洗涤,并干燥得到2-苯并吡喃鎓(benzpyrylium)盐5(3.21g,73%)。Mp:260-266℃。
(5)在-10℃,向在IPA(35mL)的水合肼(0.97g,19.4mmol)中缓慢加入2-苯并吡喃鎓盐(5,3.2g,6.5mmol)。在大约0℃搅拌混合物30分钟并在室温搅拌过夜。加入水(75mL),搅拌混合物1小时,过滤结晶产物,用水(2×10mL)洗涤,从甲醇和甲苯(1∶2)的混合物中重结晶并干燥得到6-(4-氟-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,6,9,10-四氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮(6,2.4g,92%)。Mp:259-262℃。
IR(KBr,cm-1):3053,1706,1506,1370,1300.1H NMR(DMSO-d6,400MHz):δ11.06(br s,1H),7.81(m,1H),7.43(m,1H),7.18(m,1H),6.96/6.95(s,1H),6.87/6.84(s,1H),4.74/4.68(q,J=6.9Hz,1H),3.55(d,J=12.4Hz,1H),2.85(d,J=12.2Hz,1H),2.18/2.13(d,J=2.3Hz,3H),2.08(s,3H),1.41/1.37(d,J=6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.44,167.24,158.70(d,J=251.0Hz),154.74,154.73,152.25,152.17,142.52,142.29,141.56(d,J=6.5Hz),136.75,136.72,133.62(d,J=8.5Hz),131.75,131.72,130.50,129.06(d,J=14.7Hz),126.68,126.61,124.67,124.49,119.01,116.48,113.14,113.04,110.44(d,J=20.4Hz),72.92,72.77,37.25,25.61,22.72,16.27,15.95,15.79(d,J=4.0Hz)ppm。元素分析计算值:C,64.85;H,4.45;N,10.31;S,7.87。实测值:C,63.59;H,4.85;N,9.72;S,7.71。
在步骤(1)中用作起始材料的1-(4-羟基-3-硝基苯基)丙烷-2-酮(1)的制备按如下进行:
(a)将(4-羟基苯基)乙酸(4.65g,300mmol)在冰醋酸(366mL)中的溶液冷却至10-15℃,并在1小时的期间滴加硝酸(100.5mL,65w/w%)。形成沉淀物,且在10-15℃,搅拌混合物90分钟。在10-15℃加入冷水(1100mL)并搅拌1小时。沉淀过滤,用冷水(5×30mL)洗涤,并干燥。得到1-(4-羟基-3-硝基苯基)乙酸(36.1g,62%),mp:145-150℃。
(b)在室温,搅拌1-(4-羟基-3-硝基苯基)乙酸(78.2g,396.7mmol)在乙酸酐(400mL,4.24mol)中的混合物1小时,并在45分钟的期间滴加吡啶(120.5mL,1.508mol)。然后在室温搅拌混合物1小时并进一步回流4小时。然后蒸发混合物,用甲苯(3×10mL)洗涤,并蒸发。得到乙酸(Z)-2-(4-羟基-3-硝基苯基)-1-甲基乙烯酯油状物(109g)。
(c)乙酸(Z)-2-(4-羟基-3-硝基苯基)-1-甲基乙烯酯(54.3g,198mmol),乙醇(240mL)和浓盐酸(24.1mL)的混合物回流6小时。然后搅拌混合物2小时,过滤,用乙醇(2×5mL)洗涤。得到的固体从甲醇-IPA1∶5的混合物中重结晶。得到1-(4-羟基-3-硝基苯基)丙烷-2-酮(28.0g,72%),mp:95-98.5℃。
在步骤(2)中使用的4-氟-3-甲基-1-苯并噻吩-2-甲醛的制备按如下进行:
(a)在室温,搅拌1-(2,6-二氟苯基)乙酮(10.0g,0.064mol)在DMF(100mL)中的溶液,无水碳酸钾(11g,0.082mol)和甲硫基乙酸酯(6.0mL,0.064mol)的混合物过夜并然后在60-65℃搅拌8小时,并额外地在80℃搅拌4小时并之后额外地在100℃搅拌3.5小时。在反应完成之后,加入水(1L),沉淀物溶解。用1,2-二氯乙烷(4×100mL)萃取混合物,用Na2SO4干燥,过滤并真空蒸发。得到4-氟-3-甲基-1-苯并噻吩-2-羧酸甲酯的带褐色的结晶(9.5g,65%)。
(b)在搅拌下,向4-氟-3-甲基-1-苯并噻吩-2-羧酸甲酯(9.49g,0.042mol)在乙醇和THF(178+51mL)混合物的溶液中加入CaCl2(5.96g,0.054mol)。用冰浴冷却,然后在搅拌下加入NaBH4(5.56g,0.147mol)。然后在室温搅拌混合物5小时,并用冰浴冷却。滴加浓盐酸(9.39mL),然后加入水(635mL)。用HCl调整pH至4,并将混合物放置过夜。形成沉淀物,过滤,用水(5×20mL)洗涤并干燥。用二氯甲烷(3×150mL)萃取滤液,用饱和碳酸钠溶液(150mL)洗涤,用Na2SO4干燥,过滤并真空蒸发。得到(4-氟-3-甲基-1-苯并噻吩-2-基)甲醇的带黄色的结晶(7.71g,93%)。
(c)向(4-氟-3-甲基-1-苯并噻吩-2-基)甲醇(7.71g,0.039mol)在DIPE(150mL)的溶液中缓慢加入DDQ(2,3-二氯-5,6-二氰基苯醌,9.71g,0.043mol)。黑色混合物搅拌过夜,并形成沉淀物。过滤结晶,用DIPE(5×10mL)洗涤,真空蒸发滤液,并然后重新溶解在乙酸乙酯(50mL)中。用饱和NaHCO3(2×30mL)溶液萃取,用盐水(2×30mL)洗涤,用Na2SO4干燥,过滤并真空蒸发。得到4-氟-3-甲基-1-苯并噻吩-2-甲醛黄色结晶(7.86g,大约100%),mp:89-92℃。
实施例2
6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
(1)在0℃,1.5小时的期间,在冰浴中剧烈冷却下,向2-甲基-6-(2-氧代丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(2,15.0g,69mmol,参见实施例1)在甲醇(65mL)的溶液中缓慢加入N-溴代琥珀酰亚胺(12.18g,69mmol)。真空蒸发溶剂,残余物用水(200mL)研磨,过滤固体产物以得到7-溴-2-甲基-6-(2-氧代丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(18.4g,90%)的带褐色的结晶。Mp:145-149℃。
(2)7-溴-2-甲基-6-(2-氧代丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(13.2g,44mmol),乙二醇(11.1mL,200mmol),对甲苯磺酸一水合物(0.84g,4.4mmol)和甲苯(500mL)的混合物回流4小时。反应混合物冷却,倒入冰水混合物(500mL)和Na2CO3水溶液(5w/w%,100mL)中。分离有机层,水层用乙酸乙酯(2×100mL)萃取,合并有机层并用水洗涤,干燥并蒸发。残余物从DIPE重结晶,得到7-溴-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(7,12.9g,71%)的带黄色的结晶。Mp:133-138℃。
(3)7-溴-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(7,3.3g,9.6mmol)在THF(250mL)中的溶液冷却至-70℃,并在-50℃滴加在己烷(9.6mL,24mmol)中的己基锂,并搅拌10分钟。5-甲氧基-3-甲基-1-苯并呋喃-2-羧酸乙酯(2.25g,9.6mmol)在THF(30mL)中的溶液冷却至-70℃并滴加至反应混合物中并在-50-(-40)℃搅拌1.5小时。然后缓慢升温至-5℃,滴加饱和氯化铵溶液并搅拌混合物30分钟。用乙酸乙酯(2×100mL)萃取混合物,干燥有机层并真空蒸发,得到7-[(5-甲氧基-3-甲基-1-苯并呋喃-2-基)羰基]-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(8,2.18g,60%)灰白色结晶。Mp:180℃。
(4)在剧烈搅拌下,向7-[(5-甲氧基-3-甲基-1-苯并呋喃-2-基)羰基]-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(8,2.14g,4.7mmol)在乙醇(40mL)的溶液中滴加高氯酸(0.805g,5.6mmol,70%水溶液),并搅拌混合物1小时。将其冷却至15℃,过滤结晶产物,用乙醇洗涤,并干燥,得到2-苯并吡喃鎓盐9(2.72g)。
(5)在-5℃,向水合肼(0.834g,16.6mmol)在IPA(60mL)的溶液中缓慢加入2-苯并吡喃鎓盐9(2.72g,5.55mmol)。在大约0℃,搅拌混合物30分钟并在室温搅拌过夜。加入水(240mL)并过滤结晶产物,用水(3×10mL)洗涤并从DMF和水的混合物中重结晶,得到6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]-噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮(10,2.3g,49%)。Mp:252-255℃。
IR(KBr,cm-1):3080,1712,1511,1372,1303,1212.1H NMR(DMSO-d6,500MHz):δ11.01(br s,1H),7.44(dd,J1=0.5-0.4Hz,J2=9.0-8.8Hz),7.20-7.19(d,J=3.0-2.8Hz,1H),6.96(dd,J1=2.6Hz,J2=8.9Hz,1H),6.93-6.92(s,1H),6.89-6.87(s,1H),4.76-4.67(q,J=6.8-6.7Hz,1H),3.83(s,3H),3.49-3.48(d,J=12.5Hz,1H),2.83-2.82(d,J=12.2Hz,1H),2.40-2.35(s,3H),2.08-2.07(s,3H),1.44-1.38(d,J=6.7-6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.42,155.86,154.59,149.42,148.94,148.68,142.24,134.18,131.39,130.51,123.21,117.65,116.87,114.84,112.97,112.02,102.54,72.86,55.84,37.21,22.66,16.33,9.69ppm。元素分析计算值:C,68.47;H,5.25;N,10.42。实测值:C,67.41;H,5.16;N,10.35。
按如下进行在步骤(3)中使用的5-甲氧基-3-甲基-1-苯并呋喃-2-羧酸乙基酯的制备:
(a)在20℃搅拌下,向4-氢醌甲醚(12.41g,0.1mol)在THF(30mL)的溶液中滴加NaH(4.4g,0.11mol,60%分散相)在THF(50mL)中的悬浮液。向混合物中缓慢加入氯乙酸乙酯(18.11g,0.11mol)在THF(25mL)中的溶液。然后反应混合物回流8小时。在反应完成之后,加入甲醇(10mL),蒸发溶剂,残余物溶解在乙酸乙酯(400mL)中,用水(40mL),和盐水(3×30mL)洗涤,用MgSO4干燥,过滤并蒸发。得到2-(4-甲氧基苯氧基)-3-氧代丁酸乙酯油状物(26.85g)。
(b)向2-(4-甲氧基苯氧基)-3-氧代丁酸乙酯(26.8g,大约0.010mol)中加入多聚磷酸(68g,0.7mol)并在110-120℃回流2小时。将反应混合物倒入水(220mL)中并用乙酸乙酯(2×150mL)萃取。进一步用甲苯(150mL)萃取水层。合并有机层并用盐水(2×30mL)洗涤,用活性炭搅拌,过滤,用MgSO4干燥,过滤并蒸发。残余物从甲醇重结晶。得到5-甲氧基-3-甲基-1-苯并呋喃-2-羧酸乙酯无色结晶(25.0g,44%),mp:98-104℃。
实施例3
(-)-6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
在描述于实施例2中的6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮的手性HPLC分离后得到标题化合物。
手性色谱条件如下:色谱柱:Chiralpak AD(20μm,d=5cm,L=50cm);洗脱剂:EtOH-IPA(梯度:100-0→0-100),25mL/min。标题化合物是第一洗脱峰。手性纯度(HPLC):>99.9%。
Mp:250-258℃。[α]D=-17.31°(c=0.5;IPA,MeOH,DMSO)。IR,1H NMR和13C NMR数据与在实施例2中描述外消旋化合物的那些数据相同。元素分析计算值:C,68.47;H,5.25;N,10.42。实测值:C,68.00;H,5.32;N,10.31。
实施例4
(+)-6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
在描述于实施例2中的6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮的手性HPLC分离后得到标题化合物。
手性色谱条件如下:色谱柱:Chiralpak AD(20μm,d=5cm,L=50cm);洗脱剂:EtOH-IPA(梯度:100-0→0-100),25mL/min.标题化合物是第二洗脱峰。手性纯度(HPLC):>99.9%。
Mp:254-258℃。[α]D=+15.53°(c=0.5;IPA,MeOH,DMSO)。IR,1H NMR和13C NMR数据与在实施例2中描述外消旋化合物的那些数据相同。元素分析计算值:C,68.47;H,5.25;N,10.42。实测值:C,67.96;H,5.46;N,10.19。
实施例5
6-(6-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
(1)在乙酸乙酯(18mL)中的6-氯-3-甲基-1-苯并噻吩-2-甲醛(2.21g,10.0mmol)和6-(2-羟丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(2.11g,10.0mmol)的混合物用冰冷却并加入含有15V/V%HCl(10.7mL)乙酸乙酯溶液。混合物用冰冷却搅拌5小时,并在室温进一步搅拌22小时。在反应完成之后,冰冷却加入二乙醚(20mL),搅拌混合物15分钟。然后过滤混合物并用二乙醚和乙酸乙酯(1∶1,15mL)的混合物洗涤,用二乙醚(2×15mL)洗涤,并干燥得到结晶产物(3.1g,75%)。Mp:299-302℃。
(2)向如此得到的6-(6-氯-3-甲基-1-苯并噻吩-2-基)-3,8-二甲基-1,6,8,9-四氢异色满并[7,6-b][1,4]噁嗪-2(3H)-酮(2.88g,7mmol)在丙酮-甲苯(400mL+150mL)的溶液中滴加琼斯试剂[10mL,三氧化铬(2.7mmol/mL)和硫酸(4.2mmol/mL)的水溶液]并在35-37℃搅拌混合物2小时。然后加入IPA(10mL),真空蒸发溶剂,用冰水(300mL)研磨残余物。沉淀过滤,用水洗涤并干燥,然后通过柱色谱法纯化,得到结晶二酮(1.7g,57%)。Mp:235-237℃。
(3)在130℃,剧烈搅拌下,向如此得到的二酮(1.63g,4mmol)在乙酸乙酯(80mL)的溶液中加入高氯酸(0.55mL,6mmol,70%水溶液)。当添加完成时,混合物回流15分钟。加入乙酸乙酯(40mL)并在110℃搅拌混合物15分钟。然后冷却混合物,过滤,用乙酸乙酯洗涤两次并用二乙醚洗涤两次,并干燥得到2-苯并吡喃鎓盐(2.0g)。Mp:291-293℃。
(4)在室温,向以上得到的2-苯并吡喃鎓盐(1.95g,大约4mmol)在IPA(40mL)的溶液中缓慢加入水合肼(0.74mL,15mmol),并搅拌混合物8小时。在反应完成之后,用HCl(1M)调节pH至6,并真空蒸发溶剂。向残余物中加入水(50mL),过滤,并用水洗涤两次然后用冷乙腈和二乙醚洗涤,最后用P2O5真空干燥,得到标题化合物(1.42g,88%)。Mp:291-293℃。
IR(KBr,cm-1):3073,2939,1711,1619,1588,1506,1374,1303,1105.1H NMR(DMSO-d6,500MHz):δ11.06(s,2H),8.15(s,2H),7.82(d,1H,J=8.4Hz),7.81(d,1H,J=8.6Hz),7.46(d,2H,J=8.6Hz),6.97(s,1H),6.96(s,1H),6.86(s,1H),6.84(s,1H),4.73(q,1H,J=6.8Hz),4.68(q,1H,J=6.8Hz),3.53(d,2H,J=12.5Hz),2.87(d,1H,J=12.5Hz),2.86(d,1H,J=12.5Hz),2.08(s,6H),2.06(s,3H),2.01(s,3H),1.41(d,3H,J=6.8Hz),1.36(d,3H,J=6.8Hz)ppm。13C NMR(DMSO-d6,125MHz):167.44,167.20,154.78,154.75,152.50,152.40,142.45,142.16,140.26,139.68,139.62,137.08,137.06,133.80,133.69,132.17,131.66,130.58,130.56,125.01,124.98,124.45,124.26,124.16,122.01,122.00,116.64,113.12,113.01,72.93,72.78,37.23,22.73,16.30,15.90,13.80,13.74ppm。元素分析计算值:C,62.33;H,4.28;Cl,8.36,N,9.91;S,7.56。实测值:C,62.03;H,4.30;Cl,8.16,N,9.83;S,7.63。
实施例6
(+)-6-(6-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
在描述于实施例5中的6-(6-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮的手性HPLC分离后,得到标题化合物。
手性色谱条件与描述于实施例3和4中的方法类似。
Mp:295-296℃.[α]D=+19.0°(c=1,DMSO)。IR,1H NMR和13C NMR数据与在实施例5中描述外消旋化合物的那些数据相同。元素分析计算值:C,62.33;H,4.28;Cl,8.36,N,9.91;S,7.56。实测值:C,62.08;H,4.35;Cl,8.40,N,9.86;S,7.60。
实施例7
(-)-6-(6-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
描述于实施例5中的6-(6-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮的手性HPLC分离后得到标题化合物。
手性色谱条件与描述于实施例3和4中的方法类似。
Mp:294-295℃。[α]D=-19.7°(c=1,DMSO)。IR,1H NMR和13C NMR数据与在实施例5中描述外消旋化合物的那些数据相同。元素分析计算值:C,62.33;H,4.28;Cl,8.36,N,9.91;S,7.56。实测值:C,62.00;H,4.30;Cl,8.40;N,9.84;S,7.30。
实施例8
6-(6-氯-5-氟-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
(1)在乙酸乙酯(22mL)中的6-氯-5-氟-3-甲基-1-苯并噻吩-2-甲醛(2.49g,10.8mmol)和6-(2-羟丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(2.39g,10.8mmol)和含有15V/V%HCl(11mL)的乙酸乙酯的溶液的混合物在室温搅拌过夜。在反应完成之后,过滤混合物并用乙酸乙酯(3×5mL)洗涤,并干燥得到紫色结晶(2.84g,75%)。
(2)向如此得到的6-(6-氯-5-氟-3-甲基-1-苯并噻吩-2-基)-3,8-二甲基-1,6,8,9-四氢异色满并[7,6-b][1,4]噁嗪-2(3H)-酮(2.84g,6.6mmol)于丙酮(57mL)的悬浮液用冰冷却中滴加琼斯试剂[8.2mL,三氧化铬(2.7mmol/mL)和硫酸(4.2mmol/mL)的水溶液],且混合物搅拌过夜。沉淀过滤,用丙酮和水洗涤,并干燥。蒸发滤液,用水洗涤并干燥。合并的结晶溶解在丙酮(51mL)和甲苯(5.7mL)的混合物中,并在室温再次滴加琼斯试剂(8.2mL)。在室温搅拌混合2小时,并加入水(200mL),并在10小时后过滤沉淀,用水洗涤,并干燥得到灰白色结晶(2.0g,68%)。Mp:243-245℃。
(3)在130℃剧烈搅拌下,向以上得到的二酮(2.04g,4.6mmol)于乙酸乙酯(41mL)的溶液中加入高氯酸(0.4mL,4.6mmol,70%水溶液)。在添加完成之后,混合物回流15分钟。然后冷却混合物,过滤,用乙酸乙酯(3×5mL)洗涤,并干燥,得到2-苯并吡喃鎓盐(2.16g,89%)。Mp:281-283℃。
(4)在室温,向以上得到的2-苯并吡喃鎓盐(2.16g,4.1mmol)于IPA(43mL)的溶液中缓慢加入水合肼(0.55mL,11mmol),且混合物搅拌过夜。在反应完成之后,沉淀过滤,用IPA(3×5mL)洗涤,并干燥。从DMF重结晶得到标题化合物(1.24g,69%)白色结晶。Mp:296-298℃。
IR(KBr,cm-1):3042,1710,1506,1375,1306.1H NMR(DMSO-d6,500MHz):δ11.06(br s,1H),8.32(d,J=6.8Hz,1H),7.87/7.84(d,J=10.3Hz,1H),6.96-6.95(s,1H),6.85-6.83(s,1H),4.73-4.68(q,J=6.8Hz,1H),3.53(d,J=12.5Hz,1H),2.85(d,J=12.3Hz,1H),2.08(s,3H),2.03-1.98(s,3H),1.41-1.36(d,J=6.8Hz,3H)ppm。元素分析计算值:C,59.80;H,3.88;Cl,8.02;N,9.51;S,7.20。实测值:C,59.17;H,4.00;Cl,7.96;N,9.58;S,7.20。
实施例9
6-(5-氯-3-乙基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
(1)向新制备的ZnCl2于二氧杂环己烷(15mL)的溶液中加入5-氯-3-乙基-1-苯并噻吩-2-甲醛(1.86g,8.3mmol)和6-(2-羟丙基)-2H-1,4-苯并噁嗪-3(4H)-酮(1.77g,8mmol),且混合物用冰冷却。加入含有15V/V%HCl(11mL)的二氧杂环己烷溶液并在冰中保持20分钟,并然后在室温搅拌3.5小时。在反应完成之后,混合物倒入冰水(150mL)中,搅拌,过滤并用水洗涤,并干燥得到结晶产物(3.62g)结晶。
(2)用冰冷却硅胶(33g)、琼斯试剂[12mL,三氧化铬(2.7mmol/mL)和硫酸(4.2mmol/mL)的水溶液]于二氯甲烷(110mL)和丙酮(28mL)中的悬浮液,并一次性加入以上得到的6-(5-氯-3-乙基-1-苯并噻吩-2-基)-3,8-二甲基-1,6,8,9-四氢异色满并[7,6-b][1,4]噁嗪-2(3H)-酮(3.46g,8mmol),并搅拌混合物15分钟。加入IPA(30mL)并在5分钟后加入甲醇(10mL),并搅拌混合物10分钟。过滤固体,在硅胶上用二氯甲烷/甲醇(10∶1)的溶液洗脱,并部分蒸发滤液至100mL体积。加入水(250mL)并蒸发有机溶剂。加入水(150mL)并搅拌10分钟,过滤,用水洗涤3次,并干燥。用快速色谱法纯化得到结晶产物(2.2g,62%)。Mp:190-192℃。
(3)向以上得到的二酮(2.1g,4.8mmol)在乙酸乙酯(80mL)的热溶液中加入高氯酸(0.76mL,~8.8mmol,70%水溶液)。在添加完成之后,混合物回流25分钟,然后冷却,过滤,用乙酸乙酯和二乙醚洗涤,并干燥。得到2-苯并吡喃鎓盐(2.32g,93%)。Mp:250-252℃。
(4)在室温,向以上得到的2-苯并吡喃鎓盐(2.24g,4.3mmol)在IPA(30mL)的溶液中缓慢加入水合肼(0.63mL,13mmol),且混合物搅拌过夜。在反应完成之后,用HCl(4.5mL,1M)调节pH至5,并蒸发。向残余物中加入水,搅拌,过滤,用水洗涤3次,然后用乙腈(3×3mL),二乙醚(2×8mL)洗涤,并用P2O5干燥,得到标题化合物(1.59g,85%)。Mp:233-234℃。
IR(KBr,cm-1):2938,2871,1711,1621,1594,1508,1370,1299,1102.1H NMR(DMSO-d6,400MHz):δ11.06(s,2H),8.02(d,2H,J=8.6Hz),7.93(d,1H,J=2.0Hz),7.92(d,1H,J=2.0Hz),7.46(dd,2H,J=8.6,2.0Hz),6.96(s,1H),6.95(s,1H),6.85(s,1H),6.84(s,1H),4.71(q,1H,J=6.8Hz),4.68(q,1H,J=6.8Hz),3.55(d,2H,J=12.4Hz),2.85(d,1H,J=12.3Hz),2.84(d,1H,J=12.3Hz),2.68(m,2H),2.64(m,2H),2.08(s,6H),1.40(d,3H,J=6.8Hz),1.36(d,3H,J=6.8Hz),1.03(t,3H),1.00(t,3H)ppm。元素分析计算值:C,63.08;H,4.60;Cl,8.10;N,9.59;S,7.32。实测值:C,62.58;H,4.63;Cl,8.17;N,9.64;S,7.29。
实施例10
(+)-6-(5-氯-3-乙基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:233-235℃。[α]D=+17.9°(c=1,DMSO).IR,1H NMR和13C NMR数据与在实施例9中描述外消旋化合物的那些数据相同。元素分析计算值:C,63.08;H,4.60;Cl,8.10;N,9.59;S,7.32。实测值:C,62.89;H,4.62;Cl,8.04;N,9.62;S,7.28。
实施例11
(-)-6-(5-氯-3-乙基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:234-236℃。[α]D=-17.8°(c=1,DMSO).IR,1H NMR和13C NMR数据与在实施例9中描述外消旋化合物的那些数据相同。元素分析计算值:C,63.08;H,4.60;Cl,8.10;N,9.59;S,7.32。实测值:C,62.92;H,4.60;Cl,8.14;N,9.63;S,7.36。
实施例12
6-(5-氯-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
(1)在(-50)-(-45)℃,向7-溴-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(140mg,0.41mmol)在甲苯(10mL)的溶液中滴加于己烷中的丁基锂(0.4mL,10mmol,2.5M),且混合物缓慢升温至-30℃并搅拌45分钟。然后混合物冷却至-70℃并缓慢加入5-氯-N-甲氧基-N,3-二甲基-1-苯并呋喃-2-甲酰胺(140mg,0.55mmol),并在(-30)-(-40)℃搅拌2小时。在反应完成之后,混合物升温至-5℃,加入饱和氯化铵溶液(5mL)并搅拌10分钟。然后用乙酸乙酯(10mL)萃取混合物,用盐水洗涤,用MgSO4干燥,过滤并真空蒸发。残余物从乙酸乙酯重结晶得到白色结晶(40mg,22%)。Mp:210-217℃。
(2)在室温,向以上得到的7-[(5-氯-3-甲基-1-苯并呋喃-2-基)羰基]-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(70mg,0.15mmol)在乙酸乙酯(2mL)的溶液中加入高氯酸(0.025mL,0.31mmol,70%水溶液)并搅拌。在反应完成之后,过滤结晶,并用二乙醚洗涤,得到2-苯并吡喃鎓盐(30mg,40%)。
(3)在-10℃,向水合肼(0.036mL,0.73mmol)在IPA(2.5mL)的溶液中缓慢加入如此得到的2-苯并吡喃鎓盐(120mg,0.24mmol)。在-10℃搅拌混合物30分钟,并另外在0℃搅拌1小时并在室温搅拌2小时。在反应完成之后,加入水(15mL)并搅拌混合物30分钟,过滤,并用水洗涤(2×2mL),得到标题化合物(35mg,45%)。Mp:247-251℃。
IR(KBr,cm-1):3443,1709,1502,1375,1308.1H NMR(DMSO-d6,500MHz):δ11.02(br s,1H),7.81(d,J=2.2Hz,1H),7.59(d,J=8.8Hz,1H),7.39(dd,J=1.7,8.5Hz,1H),6.94-6.93(s,1H),6.93-6.90(s,1H),4.77-4.68(q,J=6.9Hz,1H),3.50(d,12.3Hz,1H),2.82(d,J=12.3Hz,1H),2.39-2.35(s,3H),2.08(s,3H),1.43-1.38(d,J=6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.44,167.20,154.72,154.68,152.21,149.71,149.58,149.17,149.13,142.33,141.84,134.25,134.09,131.55,131.53,127.56,125.74,123.02,122.88,120.15,120.12,117.22,117.19,116.82,116.77,113.08,113.05,112.97,93.17,72.87,72.77,37.24,22.67,22.65,16.35,16.01,9.54,9.51ppm。元素分析计算值:C,64.79;H,4.45;Cl,8.69;N,10.30。实测值:C,63.48;H,4.56;N,9.99。
实施例13
6-(3,5-二乙基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
(1)在-78℃,向7-溴-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(2.4g,7mmol)在THF(135mL)的溶液中滴加丁基锂(7.5mL,19mmol),并搅拌20分钟。在-78℃,向反应混合物中滴加3,5-二乙基-1-苯并呋喃-2-羧酸甲酯(1.86g,8mmol)在THF(5mL)中的溶液,并搅拌2小时。在-50℃,搅拌混合物1小时,然后缓慢升温至-30℃,并加入饱和氯化铵溶液(60mL)。然后用乙酸乙酯(80mL)萃取混合物,用盐水洗涤,用MgSO4干燥,过滤并真空蒸发,并用柱色谱法纯化得到油状产物(1.9g,59%)。
(2)在剧烈搅拌下,向以上得到的7-[(3,5-二乙基-1-苯并呋喃-2-基)羰基]-2-甲基-6-[(2-甲基-1,3-二氧杂环戊烷-2-基)甲基]-2H-1,4-苯并噁嗪-3(4H)-酮(1.77g,3.8mmol)在乙酸乙酯(15mL)的溶液中滴加高氯酸(0.56mL,70%水溶液)。在添加完成之后,混合物回流25分钟。然后混合物冷却,过滤,用乙酸乙酯洗涤,用二乙醚洗涤两次并干燥。得到2-苯并吡喃鎓盐(1.6g,84%)。Mp:202-204℃。
(3)向水合肼(0.5mL)中缓慢加入如此得到的吡喃鎓盐(1.52g,3mmol)在IPA(40mL)中的溶液。搅拌混合物24小时。在反应完成之后,加入HCl(3mL,1M),蒸发溶剂,残余物用水洗涤,过滤,溶解在乙酸乙酯/二氯甲烷(1∶1)中,干燥并蒸发。残余物通过柱色谱法纯化,得到标题化合物(0.75g,60%)。Mp:204-205℃。
IR(KBr,cm-1):2961,1701,1619,1507,1399,1327,1112,1092,1047.1H NMR(DMSO-d6,400MHz):δ11.02(s,1H);7.55(m,1H);7.43(d,1H,J=8.5Hz);7.21(dd,1H,J=8.5,1.2Hz);6.94,6.93(s,1H);6.84,6.82(s,1H);4.75,4.67(q,1H,J=6.8Hz);3.51,3.50(d,1H,J=12.4Hz);2.95,2.92(q,2H);2.84,2.83(d,1H,J=12.3Hz);2.74(q,2H);2.08(s,3H);1.43,1.37(d,3H,J=6.8Hz);1.27,1.24(t,3H,J=7.4Hz);1.25(t,3H,J=7.4Hz);ppm。13C NMR(DMSO-d6,100MHz):167.39,167.18;154.59,154.57;152.55,152.53;149.44,149.39;148.03,147.9;142.19,141.73;138.69,138.68;134.06,133.95;131.45,131.42;128.93;125.93,125.91;123.48,123.45;123.46,123.35;119.03,119.01;116.75,116.67;113.00,112.94;111.18;72.86,72.76;37.25;28.31;22.64,22.62;17.29,17.26;16.42;16.31,16.03;14.54,14.49;ppm。(在光谱中出现信号强度几乎相等的两组,其是由于存在构象异构体。)元素分析计算值:C,72.27;H,6.06;N,10.11。实测值:C,71.85;H,6.08;N,9.90。
实施例14
6-(5-羟基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
在0℃搅拌下氩气氛下,向6-(5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮(404mg,1mmol,描述在实施例2中)在二氯甲烷(50mL)的溶液中滴加三溴化硼于二氯甲烷(40mL,1.0M,4.0mmol)中的溶液。在添加完成之后,在室温搅拌混合物4小时。反应混合物倒在冰上,用乙酸钠的溶液调节pH至5-6,并分离层。用乙酸乙酯(3×50mL)萃取水层,用MgSO4干燥,过滤并真空蒸发,然后从水和丙酮1∶1的混合物中结晶。得到的固体用MTBE洗涤,得到标题化合物(0.23g,59%)。Mp:293-300℃。
IR(KBr,cm-1):3378,3200,1690,1665,1189.1H NMR(DMSO-d6,500MHz):δ11.00(br s,1H),9.26(br s,1H),7.32(d,J=8.6Hz,1H),6.95(d,1H),6.94-6.93(s,1H),6.87-6.85(s,1H),6.82(dd,J=2.0,8.6Hz,1H),4.77-4.68(q,J=7.0Hz,1H),3.48(d,J=12.5Hz,1H),2.81(d,J=12.3Hz,1H),2.33-2.30(s,3H),2.07(s,3H),1.43-1.38(d,J=6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.42,167.20,154.56,154.53,153.53,149.48,149.45,148.67,148.53,147.99,147.97,142.22,141.76,134.16,134.00,131.35,130.65,123.25,123.11,117.24,117.20,116.83,114.92,112.95,112.86,111.71,104.38,72.87,72.77,37.19,22.65,16.33,16.02,9.68ppm。元素分析计算值:C,67.86;H,4.92;N,10.79。实测值:C,66.41;H,4.95;N,10.25。
以下描述的实施例以在上述实施例中公开的类似方式从相应起始材料中制备。
实施例15
6-(2-氟苯基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
Mp:260-262℃。IR(KBr,cm-1):3455,1702,1509,1376,1297,761.1H NMR(CDCl3,500MHz):δ9.18-9.11(br s,1H),7.82(m,1H),7.44(m,1H),7.27(m,1H),7.04(m,1H),6.82-6.81(s,1H),6.76-6.75(s,1H),4.70-4.59(m,1H),3.32(d,J=12.5Hz,1H),3.10(d,J=12.3Hz,1H),2.19(s,3H),1.60-1.53(d,J=6.8Hz)ppm。元素分析计算值:C,67.65;H,4.78;F,5.63;N,12.46。实测值:C,66.56;H,4.90;N,12.25。
实施例16
6-(4-氟-1-苯并[b]噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
Mp:303-306℃。IR(KBr,cm-1):3055,1706,1508,1371,1301,769.1H NMR(DMSO-d6,500MHz):δ11.06(br s,1H),7.83(d,J=8.2Hz,1H),7.43(m,1H),7.43-7.40(d,J=0.7Hz,1H),7.34-7.33(s,1H),7.20(m,1H),6.95-6.94(s,1H),4.83-4.72(q,J=7.0Hz,1H),3.46-3.45(d,J=12.6Hz,1H),2.84-2.83(d,J=12.5Hz,1H),2.06(s,3H),1.48-1.43(d,J=6.6Hz,3H)ppm。元素分析计算值:C,64.11;H,4.10;F,4.83;N,10.68;S,8.15。实测值:C,63.90;H,4.17;N,10.69;S,8.07。
实施例17
6-(4-氟-1-苯并[b]噻吩-2-基)-1,3,9-三甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
合成的最后一步是1位N-烷化作用,如下进行:
6-(4-氟-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮(0.85g,2.2mmol),K2CO3(0.85g,6.2mmol),甲基碘(0.14mL,2.3mmol)和丙酮(25.5mL)的混合物在室温搅拌4天。然后过滤反应混合物,用丙酮(3×10mL)洗涤,且产物通过快速色谱法纯化(0.45g,51%)。
Mp:210-212℃。IR(KBr,cm-1):1695,1508,1467,1374,773.1H NMR(DMSO-d6,500MHz):δ7.85(m,1H),7.46-7.41(d,J=0.6Hz,1H),7.45(m,1H),7.39-7.38(s,1H),7.37-7.34(s,1H),7.21(m,1H),4.91-4.78(q,J=6.8Hz,1H),3.56(d,J=12.3Hz,1H),2.90-2.87(d,J=12.1Hz,1H),2.11-2.10(s,3H),1.51-1.46(d,J=6.7Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):166.61,166.48,157.28(d,J=251.0Hz),155.65,155.64,151.84,151.77,144.59,144.37,143.41,143.28,142.26(d,J=5.4Hz),134.84,134.75,133.57,133.44,128.43(d,J=19.0Hz),127.34(d,J=7.3Hz),122.44(d,J=1.5Hz),120.71,119.06,116.43,113.83,113.62,109.92(d,J=18.1Hz),73.04,72.97,37.47,28.74,28.61,22.80,22.77,16.58,16.39ppm。元素分析计算值:C,64.85;H,4.45;F,4.66;N,10.31;S,7.87。实测值:C,64.89;H,4.59;N,10.21;S,7.83。
实施例18
6-(5-氯-1-苯并[b]噻吩-2-基)-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
Mp:297-300℃。IR(KBr,cm-1):2949,1704,1505,1024,811.1H NMR(DMSO-d6,500MHz):δ11.12(br s,1H),8.02(d,J=8.6Hz,1H),7.98(d,J=2.1Hz,1H),7.51(s,1H),7.43(dd,J1=2.1Hz,J2=8.5Hz,1H),7.30(s,1H),6.95(s,1H),4.66(s,2H),3.46(d,J=12.5Hz,1H),2.84(d,J=12.3Hz,1H),2.06(s,3H)ppm。13C NMR(DMSO-d6,125MHz):165.21,155.45,151.96,145.60,142.49,141.13,138.40,134.49,131.23,129.69,126.39,125.94,124.27,124.12,122.40,116.58,113.58,66.88,37.29,22.70.元素分析计算值:C,60.68;H,3.56;Cl,8.96;N,10.61;S,8.10。实测值:C,60.54;H,3.69;Cl,8,88;N,10.56;S,7.98。
实施例19
6-(4-氟-1-苯并[b]噻吩-2-基)-1,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
合成的最后一步是1位N-烷化作用,用在实施例17中描述的方法类似地进行。
Mp:216-218℃。IR(KBr,cm-1):1697,1606,1383,794.1H NMR(DMSO-d6,500MHz):δ7.87(m,1H),7.45(m,1H),7.43(d,J=0.6Hz,1H),7.39(s,1H),7.36(s,1H),7.21(m,1H),4.78(d,J=15.1Hz,1H),4.72(d,J=15.0Hz,1H),3.55(d,J=12.3Hz,1H),3.36(s,3H),2.88(d,J=12.2Hz,1H),2.10(s,3H)ppm。元素分析计算值:C,64.11;H,4.10;F,4.83;N,10.68;S,8.15。实测值:C,63.86;H,4.24;N,10.64;S,8.00。
实施例20
6-(4-三氟甲基-苯基)-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
Mp:295-298℃。IR(KBr,cm-1):3055,1709,1323,1128.1H NMR(DMSO-d6,500MHz):δ11.10(br s,1H),7.82(~d,J=8.4Hz,2H),7.77(~d,J=8.6Hz,2H),6.95(s,1H),6.79(s,1H),4.61(d,J=15.1Hz,1H),4.59(d,J=15.3Hz,1H),3.48(d,J=12.5Hz,1H),2.82(d,J=12.3Hz,1H),2.06(s,3H)ppm。13C NMR(DMSO-d6,125MHz):165.20,155.94,154.93,142.48,142.30,134.87,130.97,129.89(q,J=31.7Hz),129.89,125.40(q,J=3.7Hz),124.33(q,J=269.3Hz),123.76,116.55,113.43,66.85,37.32,22.65ppm。元素分析计算值:C,61.13;H,3.78;F,15.27;N,11.26。实测值:C,60.75;H,3.85;N,11.34。
实施例21
1-苄基-6-(4-氟苯基)-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
合成的最后一步是1位N-烷化作用,用在实施例17中描述的方法类似地进行。
Mp:258-261℃。IR(KBr,cm-1):3441,1702,1509,1390.1H NMR(DMSO-d6,500MHz):δ7.59(~dd,J1=5.6Hz,J2=8.9Hz,2H),7.36(m,4H),7.27(m,3H),7.23(s,1H),6.81(s,1H),5.27(d,J=16.0Hz,1H),5.22(d,J=16.1Hz,1H),4.83(d,J=15.0Hz,1H),4.81(d,J=15.0Hz,1H),3.38(d,J=12.1Hz,1H),2.77(d,J=12.1Hz,1H),1.93(s,3H)ppm。13C NMR(DMSO-d6,125MHz):164.55,163.28(d,J=247.6Hz),155.48,154.68,143.86,136.25,134.86(d,J=2.9Hz),134.47,131.56,131.31(d,J=8.8Hz),128.79,127.47,127.17,124.29,116.74,115.45(d,J=22.0Hz),113.83,67.17,43.60,37.38,22.42ppm。元素分析计算值:C,72.63;H,4.88;F,4.60;N,10.16。实测值:C,72.05;H,5.11;N,9.88。
实施例22
6-(4,6-二氟-1-苯并噻吩-2-基)-1-乙基-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
合成的最后一步是1位N-烷化作用,用在实施例17中描述的方法类似地进行。
Mp:168-170℃。IR(KBr,cm-1):1699,1422,1390,1284.1H NMR(DMSO-d6,500MHz):δ7.85(dd,J1=1.7Hz,J2=8.7Hz,1H),7.42(s,2H),7.38(s,1H),7.32(~dt,J1=2.1Hz,J2=10.0Hz),4.76(d,J=15.0Hz,1H),4.70(d,J=15.1Hz,1H),4.01(m,2H),3.60(d,J=12.3Hz,1H),2.87(d,J=12.2Hz,1H),2.10(s,3H),1.23(t,J=7.1Hz,3H)ppm。元素分析计算值:C,62.11;H,4.03;F,8.93;N,9.88;S,7.54。实测值:C,61.62;H,4.19;N,9.61;S,7.63。
实施例23
乙基-6-(7-氟-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
合成的最后一步是1位N-烷化作用,用在实施例17中描述的方法类似地进行。
Mp:190-192℃。IR(KBr,cm-1):3442,1683,1466,1427.1H NMR(DMSO-d6,500MHz):δ7.76(m,2H),7.63-7.65(d,J=3.5Hz,1H),7.49-7.48(s,1H),7.42(m,1H),7.37(s,1H),7.29(m,1H),4.76-4.82(q,J=6.6Hz,1H),4.01(m,2H),3.60(d,J=12.2Hz,1H),2.90-2.88(d,J=12.3Hz,1H),2.10-2.12(s,3H),1.50-1.45(d,J=6.6Hz,3H),1.22(t,J=7.0Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):166.07,165.88,156.73(d,J=239.7Hz),155.74,151.72,151.65,144.67,144.46,143.53(d,J=22.5Hz),143.35(d,J=22.9Hz),134.87,134.84,132.32,132.20,127.48,127.35,126.54(d,J=5.9Hz),126.23,122.46,122.44,121.40,121.36,116.90(d,J=4.4Hz),113.31(d,J=19.0Hz),111.14(d,J=18.6Hz),72.96,72.84,37.38,36.47,36.37,22.97,22.79,22.74,16.40,16.29,12.56,12.50ppm。元素分析计算值:C,65.54;H,4.78;F,4.51;N,9.97;S,7.61。实测值:C,64.86;H,4.97;N,9.50;S,7.84。
实施例24
6-(5-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
Mp:286-290℃。IR(KBr,cm-1):3442,1686,1501,1291.1H NMR(DMSO-d6,500MHz):δ11.09(br s,1H),8.03(d,J=8.6Hz,1H),7.88-7.87(s,1H),7.46(d,J=8.4Hz,1H),6.97-6.96(s,1H),6.85-6.83(s,1H),4.73-4.68(q,J=6.8Hz,1H),3.54(d,J=12.3Hz,1H),2.86-2.85(d,J=12.3Hz,1H),2.08(s,3H),2.05-2.00(s,3H),1.41-1.37(d,J=6.7Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.49,167.25,154.87,154.83,152.52,152.42,142.49,142.29,142.22.142.18,138.40,138.37,137.50,137.49,133.84,133.73,132.08,131.71,129.79,129.76,125.74,124.51,124.32,124.27,122.25,116.66,113.16,72.95,72.79,37.25,22.79,22.77,16.33,15.98,13.81,13.74ppm。元素分析计算值:C,62.33;H,4.28;Cl,8.36,N,9.91;S,7.56。实测值:C,60.37;H,4.37;Cl,9.08,N,9.86;S,7.44。
实施例25
(+)-6-(5-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:298-314℃。[α]D=+24.1°(c=1,DMSO).IR(KBr,cm-1):3442,1686,1501,1291.1H NMR(DMSO-d6,500MHz):δ11.09(br s,1H),8.03(d,J=8.6Hz,1H),7.88-7.87(s,1H),7.46(d,J=8.4Hz,1H),6.97-6.96(s,1H),6.85-6.83(s,1H),4.73-4.68(q,J=6.8Hz,1H),3.54(d,J=12.3Hz,1H),2.86-2.85(d,J=12.3Hz,1H),2.08(s,3H),2.05-2.00(s,3H),1.41-1.37(d,J=6.7Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.49,167.25,154.87,154.83,152.52,152.42,142.49,142.29,142.22.142.18,138.40,138.37,137.50,137.49,133.84,133.73,132.08,131.71,129.79,129.76,125.74,124.51,124.32,124.27,122.25,116.66,113.16,72.95,72.79,37.25,22.79,22.77,16.33,15.98,13.81,13.74ppm。元素分析计算值:C,62.33;H,4.28;Cl,8.36,N,9.91;S,7.56。实测值:C,61.64;H,4.40;C1,8.49,N,9.86;S,7.49。
实施例26
(-)-6-(5-氯-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:302-310℃。[α]D=-22.5°(c=1,DMSO).IR,1H NMR和13C NMR数据与在实施例25中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,62.33;H,4.28;Cl,8.36,N,9.91;S,7.56。实测值:C,60.62;H,4.55;Cl,8.23,N,9.77;S,7.32。
实施例27
3,9-二甲基-6-[3-甲基-5-(三氟甲基)-1-苯并噻吩-2-基]-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
Mp:288-290℃。IR(KBr,cm-1):3050,1705,1330,1122.1H NMR(DMSO-d6,500MHz):δ11.07(br s,1H),8.25(d,J=8.4Hz,1H),8.16-8.15(s,1H),7.73(d,J=8.6Hz,1H),6.98-6.96(s,1H),6.88-6.86(s,1H,4.73-4.68(q,=6.8Hz,1H),3.55(d,J=12.5Hz,1H),2.87(d,1H),2.09-2.07(s,3H),1.41-1.37(d,J=6.8Hz,3H)ppm。元素分析计算值:C,60.39;H,3.97;F,12.46,N,9.19;S,7.01。实测值:C,58.61;H,3.86;N,8.96;S,6.91。
实施例28
(+)-3,9-二甲基-6-[3-甲基-5-(三氟甲基)-1-苯并噻吩-2-基]-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:287-289℃。[α]D=+25.0°(c=0.5,DMSO).IR(KBr,cm-1):3174,1711,1374,1331,1299,1119.1H NMR(DMSO-d6,500MHz):δ11.07(br s,1H),8.25(d,J=8.4Hz,1H),8.16-8.15(s,1H),7.73(d,J=8.6Hz,1H),6.98-6.96(s,1H),6.88-6.86(s,1H,4.73-4.68(q,=6.8Hz,1H),3.55(d,J=12.5Hz,1H),2.87(d,1H),2.09-2.07(s,3H),1.41-1.37(d,J=6.8Hz,3H)ppm。元素分析计算值:C,60.39;H,3.97;F,12.46,N,9.19;S,7.01。实测值:C,59.93;H,3.99;N,9.17;S,7.19。
实施例29
(-)-3,9-二甲基-6-[3-甲基-5-(三氟甲基)-1-苯并噻吩-2-基]-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:290-292℃。[α]D=-22.4°(c=0.5,DMSO).IR,1H NMR和13C NMR数据与在实施例29中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,60.39;H,3.97;F,12.46,N,9.19;S,7.01。实测值:C,59.79;H,3.93;N,9.16;S,7.21。
实施例30
6-(4-氟-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
Mp:276-283℃。IR(KBr,cm-1):3193,1690,1510,1392,1314,1045,1036.1H NMR(DMSO-d6,500MHz):δ11.01(br s,1H),7.41(m,1H),7.37(m,1H),7.10(m,1H),6.94-6.93(s,1H),6.93-6.91(s,1H),4.77-4.68(q,J=6.8Hz,1H),3.51(d,J=12.5Hz,1H),2.83(d,J=12.3Hz,1H),2.48(s,3H),2.09(s,3H),1.44-1.38(d,J=6.6Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.42,167.19,156.71(d,J=250.0Hz),155.39(d,J=9.8Hz),154.77,154.74,148.96,148.90,148.21,142.34,141.88,134.12(d,J=19.0Hz),131.57,126.60(d,J=8.3Hz),123.11,122.97,118.51,116.77,116.72,115.42,113.05,112.96,108.83(d,J=16.1Hz),108.23(d,J=3.4Hz),72.86,72.75,37.24,22.66,22.65,16.32,15.99,10.91ppm。元素分析计算值:C,67.51;H,4.64;F,4.85,N,10.74。实测值:C,66.69;H,4.85;N,10.65。
实施例31
(-)-6-(4-氟-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:284-288℃。[α]D=-20.0°(c=0.5,IPA-MeOH-DMSO 1∶1∶1).IR(KBr,cm-1):3193,1690,1510,1392,1314,1045,1036.1H NMR(DMSO-d6,500MHz):δ11.01(br s,1H),7.41(m,1H),7.37(m,1H),7.10(m,1H),6.94-6.93(s,1H),6.93-6.91(s,1H),4.77-4.68(q,J=6.8Hz,1H),3.51(d,J=12.5Hz,1H),2.83(d,J=12.3Hz,1H),2.48(s,3H),2.09(s,3H),1.44-1.38(d,J=6.6Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.42,167.19,156.71(d,J=250.0Hz),155.39(d,J=9.8Hz),154.77,154.74,148.96,148.90,148.21,142.34,141.88,134.12(d,J=19.0Hz),131.57,126.60(d,J=8.3Hz),123.11,122.97,118.51,116.77,116.72,115.42,113.05,112.96,108.83(d,J=16.1Hz),108.23(d,J=3.4Hz),72.86,72.75,37.24,22.66,22.65,16.32,15.99,10.91ppm。元素分析计算值:C,67.51;H,4.64;F,4.85,N,10.74。实测值:C,67.41;H,4.76;N,10.86。
实施例32
(+)-6-(4-氟-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:283-285℃。[α]D=+21.8°(c=0.5,IPA-MeOH-DMSO 1∶1∶1).IR,1H NMR和13C NMR数据与在实施例32中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,67.51;H,4.64;F,4.85,N,10.74。实测值:C,67.48;H,4.78;N,10.89。
实施例33
6-[5-氯-3-(二氟甲基)-1-苯并噻吩-2-基]-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
Mp:242-245℃。IR(KBr,cm-1):3056,1692,1508,1390,1302,1087.1H NMR(DMSO-d6,500MHz):δ11.10(br s,1H),8.16(m,1H),8.01(m,1H),7.59-7.57(m,1H),7.16-7.01(t,J=53.8Hz,1H),7.00-6.99(s,1H),6.96(s,1H),4.73-4.69(q,J=4.8Hz,1H),3.57(d,J=12.5Hz,1H),2.93-2.90(d,1H),2.10-2.09(s,3H),1.41-1.37(d,J=6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.40,167.15,155.31,155.26,150.55,150.44,146.52,142.07,141.74,137.90,137.87,137.46,137.40,134.44,134.37,132.20,132.19,130.70,130.68,126.95-126.88(t,J=25.4Hz),126.39,124.95,124.25,124.17,122.78,117.00,116.92,113.25,113.16,111.71-111.61(t,J=233.9Hz),72.91,72.77,37.53,22.64,22.60,16.31,15.99ppm。元素分析计算值:C,57.46;H,3.51;Cl,7.71;F,8.26;N,9.14;S,6.97。实测值:C,57.44;H,3.53;Cl,7.73;N,9.12;S,6.94。
实施例34
(-)-6-[5-氯-3-(二氟甲基)-1-苯并噻吩-2-基]-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:213-215℃。[α]D=-24.0°(c=0.5,MeOH-CHCl31∶1).IR(KBr,cm-1):3056,1692,1508,1390,1302,1087.1H NMR(DMSO-d6,500MHz):δ11.10(br s,1H),8.16(m,1H),8.01(m,1H),7.59-7.57(m,1H),7.16-7.01(t,J=53.8Hz,1H),7.00-6.99(s,1H),6.96(s,1H),4.73-4.69(q,J=4.8Hz,1H),3.57(d,J=12.5Hz,1H),2.93-2.90(d,1H),2.10-2.09(s,3H),1.41-1.37(d,J=6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.40,167.15,155.31,155.26,150.55,150.44,146.52,142.07,141.74,137.90,137.87,137.46,137.40,134.44,134.37,132.20,132.19,130.70,130.68,126.95-126.88(t,J=25.4Hz),126.39,124.95,124.25,124.17,122.78,117.00,116.92,113.25,113.16,111.71-111.61(t,J=233.9Hz),72.91,72.77,37.53,22.64,22.60,16.31,15.99ppm。元素分析计算值:C,57.46;H,3.51;Cl,7.71;F,8.26;N,9.14;S,6.97。实测值:C,57.10;H,3.56;Cl,7.87;N,9.14;S,7.04。
实施例35
(+)-6-[5-氯-3-(二氟甲基)-1-苯并噻吩-2-基]-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:185-187℃。[α]D=+19.6°(c=0.5,MeOH-CHCl31∶1).IR,1H NMR和13C NMR数据与在实施例35中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,57.46;H,3.51;Cl,7.71;F,8.26;N,9.14;S,6.97。实测值:C,56.99;H,3.54;Cl,7.45;N,8.66;S,6.58。
实施例36
(+)-6-(5-氯-3-甲基-1-苯并噻吩-2-基)-9-甲基-3-丙基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:259-268℃。[α]D=+37.5°(c=0.5,DMSO).IR(KBr,cm-1):3045,1706,1506,1352,1290.1H NMR(DMSO-d6,400MHz):δ11.07(br s,1H),8.02(d,J=8.5Hz,1H),7.87(s,1H),7.46(d,J=8.5Hz,1H),6.96-6.94(s,1H),6.86-6.85(s,1H),4.60(m,1H),3.54(d,J=12.3Hz,1H),2.87(d,J=12.4Hz,1H),2.09-2.08(s,3H),2.04-2.00(s,3H),1.70(m,2H),1.42(m,2H),0.90-0.83(m,3H)ppm。13C NMR(DMSO-d6,100MHz):167.01,166.77,154.74,152.38,142.27,142.20,142.13,141.57,138.47,138.38,137.47,133.71,133.52,131.99,131.95,131.55,131.27,129.75,125.71,124.52,124.29,124.21,122.16,116.72,113.03,112.96,76.10,75.92,37.23,32.11,31.89,22.73,22.70,17.69,13.69,13.64,13.60,13.49ppm。元素分析计算值:C,63.78;H,4.91;Cl,7.84;N,9.30;S,7.09。实测值:C,62.80;H,5.16;Cl,7.89;N,9.27;S,7.19.
实施例37
(-)-6-(5-氯-3-甲基-1-苯并噻吩-2-基)-9-甲基-3-丙基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:265-272℃。[α]D=-38.5°(c=0.5,DMSO).IR,1H NMR和13C NMR数据与在实施例37中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,63.78;H,4.91;Cl,7.84;N,9.30;S,7.09。实测值:C,62.30;H,5.07;Cl,7.79;N,9.16;S,7.21。
实施例38
(+)-6-(7-氟-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:282-285℃。[α]D=+28.0°(c=0.5,DMSO).IR(KBr,cm-1):3196,3117,1699,1506,1306,784.1H NMR(DMSO-d6,500MHz):δ11.07(br s,1H),7.69-7.68(m,1H),7.48(m,1H),7.32(m,1H),6.98-6.97(s,1H),6.89-6.87(s,1H),4.73-4.69(q,J=6.8Hz,1H),3.56(d,J=12.5Hz,1H),2.88(d,J=12.5Hz,1H),2.09(s,3H),2.07-2.02(s,3H),1.42-1.37(d,J=6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.44,167.22,156.74(d,J=244.1Hz),154.90,154.86,152.36,152.27,144.41(d,J=7.8Hz),144.41,144.35,142.50,142.22,137.28,133.80,133.69,133.08,131.76,131.75,126.37,126.36(d,J=10.7Hz),125.36(d,J=18.6Hz),124.30,124.12,119.22(d,J=2.9Hz),116.61,113.15,113.04,110.94(d,J=18.1Hz),72.92,72.77,37.25,22.74,22.72,16.30,15.95,14.11,14.06ppm。元素分析计算值:C,64.85;H,4.45;F,4.66;N,10.31;S,7.87。实测值:C,64.30;H,4.56;N,10.26;S,7.65。
实施例39
(-)-6-(7-氟-3-甲基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:282-285℃。[α]D=-21.7°(c=0.5,DMSO).IR,1H NMR和13C NMR数据与在实施例39中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,64.85;H,4.45;F,4.66;N,10.31;S,7.87。实测值:C,64.11;H,4.62;N,10.17;S,7.55。
实施例40
(-)-6-(5-氯-3-乙基-1-苯并呋喃-2-基)-3-乙基-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:229-231℃。[α]D=-39.0°(c=0.64,MeOH-CHCl31∶1).IR(KBr,cm-1):2970,1708,1610,1505,1405,1294,1258,1107,1055.1H NMR(DMSO-d6,400MHz):δ11.06(s,2H),7.86(s,2H),7.59(d,1H,J=8.6Hz),7.58(d,1H,J=8.6Hz),7.39(d,2H,J=8.7Hz),6.94(s,1H),6.93(s,1H),6.89(s,2H),4.58(dd,1H,J=7.7,4.5Hz),4.52(dd,1H,J=7.5,4.3Hz),3.52(d,2H,J=12.4Hz),2.94(m,2H),2.91(m,2H),2.83(d,2H,J=12.4Hz),2.09(s,6H),1.87(m,1H),1.77(m,2H),1.70(m,1H),1.24(t,3H,J=7.4Hz),1.21(t,3H,J=7.4Hz),0.98(t,2H,J=7.3Hz),0.92(t,3H,J=7.3Hz)ppm。13C NMR(DMSO-d6,100MHz):166.89,166.66,154.73,152.40,149.43,149.35,149.11,142.02,141.30,134.10,133.92,131.43,131.20,130.55,127.60,125.71,125.68,123.27,123.15,120.16,120.14,116.82,116.76,113.21,113.16,112.98,112.93,77.37,77.18,37.28,23.58,23.27,22.66,17.16,17.11,14.45,14.40,9.19,9.15ppm。元素分析计算值:C,66.13;H,5.09;Cl,8.13;N,9.64。实测值:C,66.12;H,5.10;Cl,8.10;N,9.69。
实施例41
(+)-6-(5-氯-3-乙基-1-苯并呋喃-2-基)-3-乙基-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:229-231℃。[α]D=+32.7°(c=0.71,MeOH-CHCl31∶1).IR,1H NMR和13C NMR数据与在实施例41中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,66.13;H,5.09;Cl,8.13;N,9.64。实测值:C,66.19;H,5.03;Cl,8.09;N,9.79。
实施例42
(+)-6-(3,5-二乙基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:194-196℃。[α]D=+17.2°(c=0.6,MeOH-CHCl31∶1).IR(KBr,cm-1):2966,1710,1621,1594,1508,1371,1299,1102.1H NMR(DMSO-d6,400MHz):δ11.07(s,2H),7.87(d,2H,J=8.2Hz),7.68(s,1H),7.67(s,1H),7.30(d,2H,J=8.3Hz),6.95(s,1H),6.94(s,1H),6.83(s,1H),6.82(s,1H),4.70(q,1H,J=6.7Hz),4.66(q,1H,J=6.7Hz),3.54(d,2H,J=12.4Hz),2.85(d,1H,J=12.3Hz),2.84(d,1H,J=12.3Hz),2.76(q,4H,J=7.6Hz),2.68(m,2H),2.64(m,2H),2.08(s,6H),1.39(d,3H,J=6.8Hz),1.36(d,3H,J=6.8Hz),1.26(t,6H,J=7.5Hz),1.06(t,3H,J=7.5Hz),1.02(t,3H,J=7.5Hz)ppm。13C NMR(DMSO-d6,100MHz):167.38,167.19,154.56,152.51,152.41,142.10,141.81,140.40,140.38,139.98,139.94,138.41,138.36,136.99,136.97,135.85,135.84,133.75,131.55,131.54,126.13,125.02,124.91,122.45,121.40,116.76,116.67,113.00,112.94,72.92,72.77,37.24,28.45,22.70,22.69,20.37,20.33,16.28,16.23,16.09,14.61,14.48ppm。元素分析计算值:C,69.58;H,5.84;N,9.74;S,7.43。实测值:C,69.38;H,5.84;N,9.71;S,7.36。
实施例43
(-)-6-(3,5-二乙基-1-苯并噻吩-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:194-196℃。[α]D=-23.0°(c=0.6,MeOH-CHCl31∶1).IR,1H NMR和13C NMR数据与在实施例43中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,69.58;H,5.84;N,9.74;S,7.43。实测值:C,69.39;H,5.83;N,9.64;S,7.32。
实施例44
(-)-3-乙基-6-(3-乙基-5-甲氧基-1-苯并呋喃-2-基)-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:215-217℃。[α]D=-35.1°(c=0.6,MeOH-CHCl31∶1).IR(KBr,cm-1):2970,1696,1616,1596,1506,1474,1373,1334,1215.1H NMR(DMSO-d6,400MHz):δ11.05(s,2H),7.44(d,1H,J=8.9Hz),7.43(d,1H,J=8.9Hz),7.23(s,1H),7.22(s,1H),6.97(d,1H,J=8.9Hz),6.96(d,1H,J=8.9Hz),6.93(s,1H),6.92(s,1H),6.85(s,2H),4.58(dd,1H,J=8.1,4.6Hz),4.52(dd,1H,J=7.7,4.4Hz),3.84(s,6H),3.50(d,2H,J=12.4Hz),2.94(m,2H),2.91(m,2H),2.83(d,2H,J=12.5Hz),2.08(s,6H),1.87(m,1H),1.77(m,2H),1.69(m,1H),1.26(t,3H,J=7.5Hz),1.24(t,3H,J=7.6Hz),0.98(t,3H,J=7.3Hz),0.92(t,3H,J=7.3Hz)ppm。13C NMR(DMSO-d6,100MHz):166.92,166.69,155.85,154.67,149.40,148.88,148.65,148.57,141.95,141.25,134.06,133.88,131.30,131.08,129.51,123.79,123.47,123.36,116.89,116.84,114.75,114.71,112.93,112.88,112.18,112.12,102.64,102.62,77.38,77.18,55.88,37.26,23.58,23.28,22.68,17.32,17.27,14.50,14.46,9.22,9.17ppm。元素分析计算值:C,69.59;H,5.84;N,9.74。实测值:C,69.65;H,5.97;N,9.87。
实施例45
(+)-3-乙基-6-(3-乙基-5-甲氧基-1-苯并呋喃-2-基)-9-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:215-217℃。[α]D=+31.7°(c=0.56,MeOH-CHCl31∶1).IR,1H NMR和13C NMR数据与在实施例45中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,69.59;H,5.84;N,9.74。实测值:C,69.47;H,5.88;N,9.67。
实施例46
(+)-6-(4-氟-5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:237-238℃。[α]D=+33.9°(c=0.8,MeOH-CHCl31∶1).IR(KBr,cm-1):2936,1705,1619,1510,1437,1377,1326,1257,1043.1H NMR(DMSO-d6,400MHz):δ11.06(s,2H),7.34(d,2H,J=8.9Hz),7.24(t,2H,J=8.6Hz),6.94(s,1H),6.93(s,1H),6.92(s,1H),6.90(s,1H),4.76(q,1H,J=6.8Hz),4.68(q,1H,J=6.8Hz),3.88(s,6H),3.52(d,1H,J=12.4Hz),3.51(d,1H,J=12.4Hz),2.83(d,1H,J=12.2Hz),2.82(d,1H,J=12.3Hz),2.50(s,3H),2.46(s,3H),2.08(s,6H),1.43(d,3H,J=6.7Hz),1.38(d,3H,J=6.8Hz)ppm。13C NMR(DMSO-d6,100MHz):167.48,167.25,154.82,154.79,149.27(d,J=8.1Hz),149.10(d,J=1.5Hz),149.05,148.99,148.97(d,J=1.5Hz),145.44(d,J=248.7Hz),142.56,142.37,141.89,134.25,134.09,131.59,123.13,112.98,119.43(d,J=16.1Hz),119.42(d,J=16.2Hz),116.83,116.77,115.55(d,J=3.2Hz),115.52(d,J=3.1Hz),113.73(d,J=2.8Hz),113.07,112.99,107.21(d,J=4.5Hz),72.89,72.78,57.67,37.25,22.71,22.70,16.35,16.03,10.97(d,J=2.2Hz),10.95(d,J=2.2Hz)ppm。元素分析计算值:C,65.55;H,4.78;F,4.51;N,9.97。实测值:C,65.67;H,4.74;N,9.95。
实施例47
(-)-6-(4-氟-5-甲氧基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:237-238℃。[α]D=-37.4°(c=0.75,MeOH-CHCl3 1∶1).IR,1H NMR和13C NMR数据与在实施例47中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,65.55;H,4.78;F,4.51;N,9.97。实测值:C,65.41;H,4.73;N,9.93。
实施例48
(-)-6-(5-羟基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:285-289℃。[α]D=-32.3°(c=1,MeOH-CHCl3 1∶1).IR(KBr,cm-1):3378,3200,1690,1665,1189.1H NMR(DMSO-d6,500MHz):δ11.00(br s,1H),9.26(br s,1H),7.32(d,J=8.6Hz,1H),6.95(d,1H),6.94-6.93(s,1H),6.87-6.85(s,1H),6.82(dd,J=2.0,8.6Hz,1H),4.77-4.68(q,J=7.0Hz,1H),3.48(d,J=12.5Hz,1H),2.81(d,J=12.3Hz,1H),2.33-2.30(s,3H),2.07(s,3H),1.43-1.38(d,J=6.8Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.42,167.20,154.56,154.53,153.53,149.48,149.45,148.67,148.53,147.99,147.97,142.22,141.76,134.16,134.00,131.35,130.65,123.25,123.11,117.24,117.20,116.83,114.92,112.95,112.86,111.71,104.38,72.87,72.77,37.19,22.65,16.33,16.02,9.68ppm。元素分析计算值:C,67.86;H,4.92;N,10.79。实测值:C,67.08;H,5.00;N,10.32。
实施例49
(+)-6-(5-羟基-3-甲基-1-苯并呋喃-2-基)-3,9-二甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:263-288℃。[α]D=+30.2°(c=1,MeOH-CHCl3 1∶1).IR,1H NMR和13C NMR数据与在实施例49中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,67.86;H,4.92;N,10.79。实测值:C,66.99;H,4.98;N,10.36。
实施例50
(+)-9-乙基-6-(3-乙基-5-甲氧基-1-苯并呋喃-2-基)-3-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例2中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:226-228℃。[α]D=+30.4°(c=1,MeOH-CHCl3 1∶1).IR(KBr,cm-1):3071,1705,1509,1481,1212.1H NMR(DMSO-d6,400MHz):δ11.03(br s,1H),7.43(d,J=8.9Hz,1H),7.22(d,1H),6.95(dd,J1=2.3Hz,J2=8.9Hz,1H),6.92(s,1H),6.82-6.80(s,1H),4.76-4.67(q,J=6.8Hz,1H),3.55(d,J=12.5Hz,1H),2.95(m,2H),2.80(d,J=12.4Hz,1H),2.44(m,1H),2.36(m,1H),1.42-1.37(d,J=6.7Hz,3H),1.24(t,J=7.4Hz,3H),1.07(t,J=7.4Hz,3H)ppm。13C NMR(DMSO-d6,100MHz):167.44,167.22,158.70,155.85,149.35,148.88,148.57,142.11,141.73,134.46,134.37,131.43,129.51,123.73,123.30,116.72,114.69,112.19,102.65,72.88,72.78,55.89,36.32,29.57,29.52,16.34,16.09,14.59,14.53,10.67,10.61ppm。元素分析计算值:C,69.59;H,5.84;N,9.74。实测值:C,68.87;H,5.94;N,9.67。
实施例51
(-)-6-(5-氯-3-甲基-1-苯并噻吩-2-基)-9-乙基-3-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:270-272℃。[α]D=-19.0°(c=1,MeOH-CHCl3 1∶1).IR(KBr,cm-1):3050,1705,1505,1310,1080.1H NMR(DMSO-d6,500MHz):δ11.04(br s,1H),8.03(d,J=8.6Hz,1H),7.89-7.87(d,J=2.0Hz,1H),7.46(dd,J1=2.0Hz,J2=8.6Hz,1H),6.96-6.95(s,1H),6.84-6.82(s,1H),4.72-4.68(q,J=6.8Hz,1H),3.58(d,J=12.5Hz,1H),2.83(d,J=12.5Hz,1H),2.49(m,1H),2.38(m,1H),2.04-1.99(s,3H),1.40-1.37(d,J=6.8Hz,3H),1.07(t,J=7.4Hz,3H)ppm。13C NMR(DMSO-d6,125MHz):167.41,167.17,158.75,158.73,152.33,152.24,142.31,142.25,142.18,142.13,138.44,138.42,137.48,137.46,134.11,134.03,131.94,131.65,131.60,129.76,129.73,125.67,124.47,124.29,124.22,122.20,116.63,116.58,113.15,113.07,72.91,72.75,36.30,29.58,29.54,16.26,15.97,13.73,13.67,10.59,10.53ppm。元素分析计算值:C,63.08;H,4.60;Cl,8.10;N,9.59;S,7.32。实测值:C,62.88;H,4.52;Cl,8.13;N,9.48;S,7.22。
实施例52
(+)-6-(5-氯-3-甲基-1-苯并噻吩-2-基)-9-乙基-3-甲基-1,10-二氢[1,4]噁嗪并[3,2-h][2,3]苯并二氮-2(3H)-酮
标题化合物的制备类似于在实施例1中描述的方法。
手性色谱条件与在实施例3和4中描述的方法类似。
Mp:271-273℃。[α]D=+19.0°(c=1,MeOH-CHCl3 1∶1).IR,1H NMR和13C NMR数据与在实施例52中对于另一种对映异构体描述的那些数据相同。元素分析计算值:C,63.08;H,4.60;Cl,8.10;N,9.59;S,7.32。实测值:C,62.85;H,4.57;Cl,8.24;N,9.53;S,7.30。
药理学研究
在GABAAα1,α2和α5亚单位上的效果。
方法
化合物在稳定地表达人类GABAA受体的α2α2或α5亚单位与β2(短)和γ2(长)亚单位结合的HEK-293(人胚肾)细胞上测试,因此形成五聚体异质(heteropentameric)GABAA受体。细胞维持在三种抗生素选择的存在下-新霉素、博来霉素和嘌呤霉素-在包含10%(v/v)胎牛血清的达尔贝科(Dulbecco)培养基(DMEM)中。按照制造商的说明书,通过使用荧光蓝色FMP染料(Molecular Devices)监测膜电位。在实验前一天,将细胞转移至96-孔板(密度为50,000细胞/孔)。18-24小时后,洗涤细胞并用测试化合物加上FMP染料培养。40分钟后,开始记录在FlexStation3板读数器(Molecular Devices,USA)上的荧光信号。在监测基准线的30秒之后,加入荧光GABA,诱发报告跨细胞质膜的膜电位去极化的荧光信号。记录GABA诱导的响应90秒。通过减去平均基线值并计算通过GABA诱导的荧光信号曲线下方的面积计算数据。通过使用SoftMax Pro软件(Molecular Devices,USA)非线性回归获得的对数浓度-响应曲线,确定测试化合物对于α5的IC50值和对于α2的EC50值。
表1.符合式I的实验化合物在表达各种类型的GABAA受体的HEK 293细胞中对GABA响应的效果。
α1和α5表达为GABA EC50%,α2表达为在GABA EC20作为内标物运行的100nmol/L TPA-023最大效果%
根据表1中显示的结果,本发明式(I)的化合物显著增强了在表达GABAAα2亚单位细胞中的GABA响应,同时抑制GABA在表达α5亚单位的细胞中的效果,并在含有α1的GABAA受体上具有弱的或可忽略的效果。如果EC50/IC50值≥10μmol/L,则认为效果是弱的。
药理活性
促认知效力
方法
在小鼠中的新对象识别试验
新对象识别试验评价小鼠在另外的熟悉的环境中检测新事物的能力。随后短的探索期,小鼠在24小时之后不能区别熟悉的和新的对象。在短探索期之前给药促认知药剂可以显著增加在下一(保留)天探索新对象花费的时间。鉴别指数的增强被认为是促认知效果。结果示于图1和图2中。
在大鼠中的径向迷宫试验
八臂迷宫工作记忆试验评价大鼠短期记忆。在学习试验约15天后,动物可以获得访问每个臂仅一次的能力。NMDA拮抗剂(例如氯胺酮,苯环利定)破坏这种能力-动物产生更多错误即,访问臂超过一次。在试验前给药促认知药剂显著改善在该试验中减少的表现。结果示于图3中。结果显示本发明的化合物在实验室动物中带来显著的记忆功能的改善。
抗精神病活性
方法
在小鼠中的前脉冲抑制试验
健康啮齿动物和人类对于强听觉刺激的惊吓反应由先前呈现的弱刺激降低。弱刺激在惊恐反应上的效果被称为前脉冲抑制(PPI)。降低的脉冲抑制是患有精神分裂症和其他精神障碍的患者注意力处理(感觉运动门控)缺陷的标志特征。苯环利定(PCP),N-甲基D-天冬氨酸(NMDA)-类型谷氨酸受体拮抗剂的急性给药破坏啮齿动物中的PPI且该效果可以被临床有效的抗精神病药物阻止。结果示于图4中。结果显示本发明的化合物发挥抗精神病活性。
抗焦虑活性
方法
小鼠亮-暗试验
亮暗装置包含亮(明亮地照明)和暗隔室。小开口连接两部分。在5分钟试验中,试验小鼠各自置于亮隔室中并允许探索整个装置。通过红外光束水平线和竖直线的中断自动测量动物活动。在亮区域花费的时间增加(在亮处水平线时间增加)解释为抗焦虑效果。结果示于图5中。
大鼠社会关系试验
社会关系试验是用于测量啮齿动物中抗焦虑的或引起焦虑行为的模型。当一对不熟悉的大鼠被一起放置于开放的场地中时,动物显示出特别的社交行为(嗅,跟随,修饰,在其它大鼠上下爬行)。抗焦虑化合物比如苯并二氮类增加社会关系花费的时间。在我们的实验中,在药物治疗30分钟后大鼠被交付于焦虑的社会关系试验中。社交关系试验由在接受相同药理学治疗的两只动物之间10分钟的社交相遇组成。结果示于图6中。结果显示本发明的化合物证明了显著的抗焦虑有效性。
- 还没有人留言评论。精彩留言会获得点赞!