嵌合抗原受体的制作方法
本发明涉及嵌合抗原受体(CAR),其结合癌抗原双唾液酸神经节苷脂(disialoganglioside)(GD2)。表达此类CAR的T细胞在癌症疾病,例如神经母细胞瘤的治疗中是有用的。
发明背景
双唾液酸神经节苷脂(GD2,pubchem:6450346)是一种含唾液酸的鞘糖脂,主要在细胞表面上表达。该碳水化合物抗原的功能尚未完全理解;然而,认为其在肿瘤细胞对细胞外基质蛋白的附着中发挥重要作用。GD2在神经母细胞瘤(neuroblastoma)上密集,同质且几乎普遍表达的。在正常组织中,GD2的表达很大程度上限制在皮肤黑色素细胞,和外周疼痛纤维髓鞘。在CNS中,GD2似乎是胚胎抗原,但发现在分散的少突胶质细胞中和在垂体后叶中暗淡地表达。这使得GD2非常适合用于靶向抗肿瘤疗法。
抗GD2抗体已经在神经母细胞瘤的治疗中广泛地测试。两个克隆和它们的衍生物是目前临床使用的:3F814和3F8。在同种型转换为IgG2a(14g2a)和最终与人IgG1嵌合以形成ch4.18后,已经测试了作为小鼠IgG3的另一个克隆14.187。后者抗体在随机化研究中已经产生了明确的效力:US Children’s Oncology Group报道了在具有高风险神经母细胞瘤的儿童中ch14:18的随机化III期研究,所述儿童在最初治疗后已经实现了放射学缓解(radiological remission)。在这些患者中,在ch14:18组(arm)中,EFS中存在20%的改善,其中平均随访2.1年。重要地,神经毒性是这些试剂的主要剂量限制毒性,所述神经毒性最常见作为慢性疼痛诱导神经病,而不太常见作为眼肌麻痹(ophthalmoplegia)。
这些治疗性mAb继续被完善:已经描述了衍生于ch14.18的IL-2免疫细胞因子。这是相当毒性的试剂,对微量残存疾病具有一些效果,但无一针对大体积的疾病(bulky disease)。Ch14.18已经完全人源化且其Fc经突变以抑制补体活化。Ch14.18的这一人源化版本在临床研究中但仅非常有限的数据是可用的。也描述了3F8抗体的人源化。尽管来自GD2血清疗法的临床数据是令人鼓舞的,但是持续的完全缓解仍然有限,且除了在最小程度疾病背景中外,对于抗体在临床上有用的作用没有证据。
因此,对于治疗神经母细胞瘤和其它表达GD2的癌症的改进的治疗方法存在需要。
嵌合抗原受体(CAR)
嵌合抗原受体是常见形式为将单克隆抗体(mAb)的特异性移植到T细胞的效应功能的蛋白质。它们通常的形式是I型跨膜域蛋白的修饰,具有抗原识别氨基末端,间隔区,跨膜域、与它们全部连接的复合胞内域(endodomain),其传输T细胞存活和活化信号(见图1a)。
这些分子的最常见形式是识别靶抗原的来源于单克隆抗体的单链可变片段(scFv)通过间隔区和跨膜域融合至信号传导胞内域的融合物。响应scFv对其靶标的识别,此类分子导致T细胞的活化。当T细胞表达此类CAR时,它们识别并杀伤表达所述靶抗原的靶细胞。针对肿瘤相关抗原已经开发了几种CAR,且使用此类表达CAR的T细胞的过继转移方法目前在临床试验中用于多种癌症的治疗。
已经描述了针对GD2的嵌合抗原受体,其抗原结合域基于scFv14g2a(WO 2013/040371和Yvon等人(2009,Clin Cancer Res 15:5852-5860))。
表达14g2a-CD28-OX40-ζCAR的人T细胞被证明具有一些抗肿瘤活性,但不能完全地根除该疾病(Yvon等人(2009)如上文)。
本发明人寻求制造具有改进的特性的备选GD2-靶向CAR。
附图简述
图1-嵌合抗原受体(CAR)设计。
(a)CAR的一般性架构:结合域识别抗原;间隔区将结合域从细胞表面升高;跨膜域将蛋白锚定到膜上而胞内域传输信号。(b)至(d):CAR胞内域的不同代和排列:(b)初始设计通过FcεR1-γ或CD3胞内域仅传输ITAM信号,而后来的设计以顺式(in cis)传输额外的(c)一种或(d)两种共刺激信号。
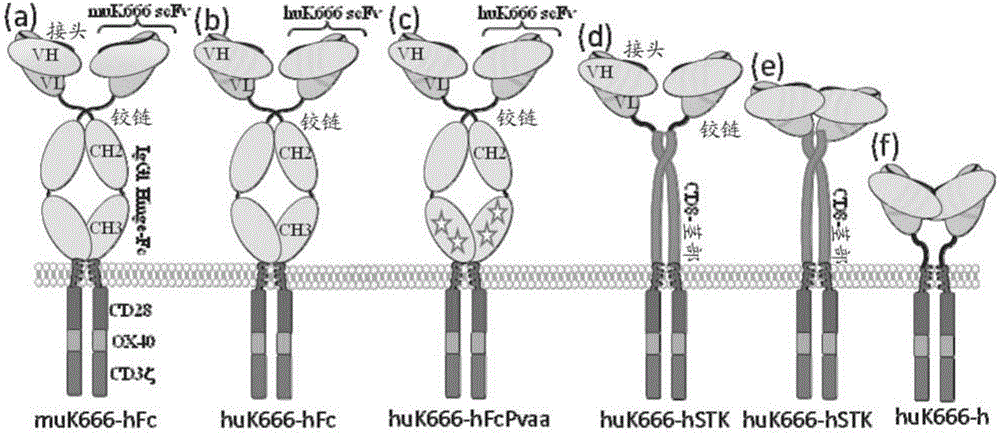
图2-构建的抗GD2CARs的变体:(a)使用小鼠KM666抗体作为scFv与人IgG1间隔区和CD28-OX40-Zeta胞内域的抗GD2CAR;(b)使用Nakamura人源化的抗体huKM666与(a)为相同形式的抗GD2CAR;(c)与(b)相同的形式,除了Fc域经修饰以去除Fc受体识别基序;(d)与(c)相同的形式,除了间隔区为IgG1铰链-CD8茎部;(e)与(c)相同的形式,除了间隔区为仅CD8茎部;(f)与(c)相同的形式,除了间隔区为仅IgG1铰链。
图3-基于muKM666和huKM666的CAR的比较。(a)来自3个正常供体的外周血T细胞上的表达;(b)这些facs图的平均荧光强度示作柱状图;(c)使用非转导的,经muKM666和经huKM666转导的T细胞作为效应细胞针对A204(GD2阴性),和LAN-1(GD2阳性)靶标的铬释放测定;(d)来自相同激发(challenge)的IL-2产生;(e)来自相同激发的干扰素-gamma产生;和(f)来自相同激发的倍数增殖(fold-proliferation)。
图4.(a)允许CD34标志物基因与CAR的1:1共表达的逆转录病毒构建体;(b)相对于CD34标志物基因的CAR表达(HA标签)的流式细胞分析;(c)非转导的T细胞和使用3种不同CAR变体转导的T细胞针对GD2阳性靶标(LAN-1),和GD2阴性靶标(A204)的铬释放测定;(d)干扰素-gamma释放;(e)IL-2释放;和(f)相同靶标和效应细胞的增殖。
图5-将FcR结合破坏突变引入Fc间隔区:(a)引入的突变;(b)通过抗Fc染色确认的CAR表达:非转导的,wt和突变的;(c)使用非转导的,wt Fc和突变的Fc抗GD2CAR T细胞对GD2阴性和GD2阳性靶标的杀伤;(d)使用表达FcR的细胞系THP-1对非转导的,wt Fc和突变的Fc抗GD2T细胞的活化;响应非转导的,wt Fc和突变的Fc CAR T细胞由THP-1细胞系的IL-1Beta释放。
图6-表达基因盒的优化
(a)引入以下盒中的图谱优化:SAR或CHS4;(b)具有使用wt或密码子优化的开放读码框的不同修饰的CAR的代表性表达。SAR构建体给出表达的紧密峰(tight peak),其为所需的。(c)来自3个正常供体的该FACS数据的条形图表示。
图7-不同胞内域的比较
比较了三种不同的嵌合抗原受体。受体都由huK666scFv,突变以去除FcR结合的IgG1的Fc域和CD8跨膜域构成。CAR“28tmZ”具有CD3Zeta胞内域;“28Z”具有复合CD28-CD3Zeta胞内域;“28OXZ”具有包含CD28,OX40和CD3Zeta的复合胞内域。使用这些构建体用相似滴度的逆转录病毒载体转导来正常供体的外周血T细胞。比较了这些不同T细胞系,连同非转导的T细胞作为对照。使用A204细胞(GD2阴性的横纹肌肉瘤细胞系),和LAN-1细胞(GD2阳性的神经母细胞瘤细胞系)激发T细胞。增殖和细胞因子释放表明受体活性为28tmZ<28Z<28OXZ。
图8-与iCasp9自杀基因共表达
(a)使用FMD-2A序列,iCasp9与抗GD2CAR的共表达;(b)单独和使用CID处理后的NT T细胞,经GD2CAR转导的T细胞和经iCasp9-2A-GD2CART细胞中的CAR表达;(c)使用或不使用CID处理的未转导的,经GD2CAR转导的和经iCasp9-2A-GD2CAR转导的T细胞对GD2阳性(LAN-1)和阴性(A204)靶标的杀伤。5位正常供体T细胞的平均值。
图9-与RQR8自杀基因的共表达
(a)将CAR huK666Fc与RQR8分选自杀基因(sort-suicide gene)在逆转录病毒载体中共表达。(b)使用该逆转录病毒载体转导T细胞并通过使用多克隆抗Fc和单克隆抗体QBend10染色转导的细胞确认CAR和RQR8的共表达。(c)在利妥昔单抗(Rituximab)和补体的存在下,可以将来自这些T细胞的CAR阳性群体耗竭。(d)使用利妥昔单抗耗竭的T细胞不再识别表达GD2的靶标。
图10-(a)表达GM3合酶和GD2合酶的双顺反子载体。(b)使用该载体转导的SupT1细胞成为GD2阳性(非转导的空心图;转导的灰色图)。
图11-在以下群体(cohort)中小鼠中的单个肿瘤的生长曲线:左上:具有表达GD2的CT26肿瘤的小鼠,接受抗GD2CAR脾细胞;右上:表达GD2的CT26肿瘤,接受假(mock)转导的脾细胞;左下:GD2阴性(wt)CD26肿瘤与抗GD2CAR脾细胞;和右下:表达GD2的CT26肿瘤,不接受脾细胞。
图12-氨基酸序列
A.图2中示作(a)的抗GD2CAR(muKM666-HCH2CH3-CD28OXZ–SEQ ID No.26)
B.图2中示作(b)的抗GD2CAR(huKM666-HCH2CH3-CD28OXZ–SEQ ID No.27)
C.图2中示作(c)的抗GD2CAR(huKM666-HCH2CH3pvaa-CD28OXZ–SEQ ID No.28)
D.图2中示作(d)的抗GD2CAR(huKM666-HSTK-CD28OXZ–SEQ ID No.29)
E.图2中示作(e)的抗GD2CAR(huKM666-STK-CD28XOXZ-SEQ ID No.30)
F.图2中示作(e)的抗GD2CAR(huKM666-HNG-CD28OXZ–SEQ ID No.31)
G.图2(c)中所示的抗GD2CAR但具有第1代胞内域(huKM666-HCH2CH3pvaa-CD28tmZ–SEQ ID No.32)
H.图2(c)中所示的抗GD2CAR但具有第2代胞内域(huMK666-HCH2CH3pvaa-CD28Z–SEQ ID No.33)
I.与iCasp9自杀基因共表达的抗GD2CAR-SEQ ID No.34
J.与RQR8自杀基因共表达的抗GD2CAR-SEQ ID No.35
图13-GD2的结构
图14-huK666和14g2a CARs的比较。(a)构建体的图谱
测试:在原代T细胞中测试了两种构建体。两种都是编码与FMD-2A样序列共表达的RQR8和第2代GD2CAR的逆转录病毒载体。构建体之间仅有的差异为在一个中,scFv为huK666而在另一个中为14g2a。使用这些构建体转导的T细胞使用A204(GD2阴性横纹肌肉瘤细胞系),和LAN-1(GD2阳性细胞系)之任一以1:1激发。(b)在24小时,从上清测量干扰素-gamma。huK666CAR T细胞产生更多的IF-G。(c)一周后对T细胞计数,huK666表现出更多增殖。
图15-基于huK666或14g2a的第2代CAR与神经母细胞瘤细胞系LAN1之间共培养的流式细胞分析。(a)实验的设置。共培养一周后,收获细胞并通过流式细胞术分析。CD45表达允许区分淋巴样细胞和非淋巴样细胞,其中CD45-细胞为LAN-1细胞。使用CD3/QBEND/10进一步染色允许对CAR T细胞的计数。(b)单独T细胞;(c)NT T细胞和LAN-1细胞;(d)huK666-28-Z CAR T细胞和LAN-1细胞;(e)14g2a-28-Z CAR T细胞和LAN-1细胞。在14g2a CAR T细胞共培养中看到了LAN-1残留物。
发明简述
本发明人已经构建了靶向GD2的新的嵌合抗原受体(CAR),其包含基于K666抗体的GD2结合域。
抗GD2抗体14g2a可以视为黄金标准,因为其用作治疗性抗体且是CAR研究中迄今测试的唯一scFv(PMID:18978797)。本发明人比较了基于14g2a和huK666的第二代形式的CAR,因为这是在临床研究中最广泛使用的CAR形式。我们发现huK666CAR T细胞比14g2a等同物释放更多IFN-γ,增殖更好且杀伤更完全。
因此,在本发明的第一个方面中提供包含双唾液酸神经节苷脂(GD2)结合域的嵌合抗原受体(CAR),其包含
a)具有互补决定区(CDRs)的重链可变区(VH),所述CDR具有以下序列:
CDR1–SYNIH(SEQ ID No.1);
CDR2–VIWAGGSTNYNSALMS(SEQ ID No.2)
CDR3–RSDDYSWFAY(SEQ ID No.3);和
b)具有CDRs的轻链可变区(VH),所述CDR具有以下序列:
CDR1–RASSSVSSSYLH(SEQ ID No.4);
CDR2–STSNLAS(SEQ ID No.5)
CDR3–QQYSGYPIT(SEQ ID No.6)
GD2结合域可以包含具有如SEQ ID No.9或SEQ ID NO 10所示序列的VH域;或具有如SEQ ID No 11或SEQ ID No.12所示序列或具有至少90%序列同一性的其变体的VL域,,所述变体保留了i)结合GD2和ii)诱导T细胞信号传导的能力。
GD2结合域可以包含如SEQ ID No 7或SEQ ID No.8所示的序列,或具有至少90%序列同一性的其变体,其保留了i)结合GD2和ii)诱导T细胞信号传导的能力。
跨膜域可以包含如SEQ ID No.13所示的序列或具有至少90%序列同一性的其变体,其保留了i)结合GD2和ii)诱导T细胞信号传导的能力。
GD2结合域和所述跨膜域可以通过间隔区连接。
间隔区可以包含以下之一:人IgG1Fc域;IgG1铰链;IgG1铰链-CD8茎部;或CD8茎部。
间隔区可以包含IgG1铰链-CD8茎部;或CD8茎部。
间隔区可以包含IgG1Fc域或其变体。
间隔区可以包含IgG1Fc域,其包括如SEQ ID No.23或SEQ ID No.24所示的序列或具有至少80%序列同一性的其变体。
CAR可以包含细胞内T细胞信号传导域或与细胞内T细胞信号传导域相关。
细胞内T细胞信号传导域可以包含一个或多个以下胞内域:CD28胞内域;OX40和CD3-Zeta胞内域。
细胞内T细胞信号传导域可以包含所有以下胞内域:CD28胞内域;OX40和CD3-Zeta胞内域。
CAR可以包含SEQ ID No.26至35任一项所示的序列,或具有至少80%序列同一性但保留了i)结合GD2和ii)诱导T细胞信号传导的能力的其变体。
在第二个方面中,本发明提供核酸序列,其编码根据本发明的第一个方面的CAR。
核酸序列可以是密码子优化的。
核酸序列可以包含如SEQ ID No 25所示的序列或具有至少90%序列同一性的其变体。
核酸可以也编码自杀基因。
在第三个方面中,本发明提供载体,其包含根据本发明的第二个方面的核酸序列。
在第四个方面中,本发明提供细胞,其表达根据本发明的第一个方面的CAR。所述细胞可以是细胞溶解性免疫细胞,如T细胞或天然杀伤(NK)细胞。
细胞可以共表达根据本发明的第一个方面的CAR和自杀基因。
自杀基因可以是,例如iCasp9或RQR8。
在第五个方面中,本发明提供用于制造根据本发明的第四个方面的细胞的方法,其包括将根据本发明的第二个方面的核酸导入细胞中。
在第六个方面中,本发明提供药物组合物,其包含根据本发明的第三个方面的载体,或根据本发明的第二个方面的细胞,连同药学上可接受的载体,稀释剂或赋形剂。
在第七个方面中,本发明提供用于治疗癌症的方法,其包括向受试者施用根据本发明的第三个方面的载体或根据本发明的第四个方面的细胞的步骤。
癌症可以是神经母细胞瘤。
在第八个方面中,本发明提供根据本发明的第三个方面的载体或根据本发明的第四个方面的细胞,用于治疗癌症中的用途。
在第九个方面中,本发明提供根据本发明的第三个方面的载体或根据本发明的第四个方面的细胞在制造用于治疗癌症的药物中的用途。
在第十个方面中,本发明提供用于制造表达GD2的细胞的方法,其包括将编码GM3合酶的核酸和编码GD2合酶的核酸导入细胞中。
在第十一个方面中,本发明提供表达GD2的细胞,其包含编码GM3合酶的异源性核酸和编码GD2合酶的异源性核酸。
在第十二个方面中,本发明提供用于体外刺激根据本发明的第四个方面的细胞的方法,其包括使得所述细胞与根据本发明的第十一个方面的表达GD2的细胞接触的步骤。
在第十三个方面,本发明提供表达CAR的表达基因盒,所述CAR包括支架附着区(scaffold attachment region)(SAR)。
表达基因盒可以表达根据本发明的第一个方面的CAR。
发明详述
嵌合抗原受体(CAR)
嵌合抗原受体,也称为嵌合T细胞受体,人工T细胞受体和嵌合免疫受体,是工程化的受体,其将任意特异性嫁接到免疫效应细胞上。在经典的CAR中,将单克隆抗体嫁接到T细胞上。可以使用例如逆转录病毒将编码CAR的核酸转移到T细胞中。以这种方式,可以产生大量癌症特异性的T细胞用于过继细胞转移。该方法的I期临床研究表现出效力。
CAR的靶抗原结合域通常经由间隔区和跨膜域融合至信号传导胞内域。当所述CAR结合靶抗原时,这导致活化信号传输至它在上面表达的T细胞。
本发明的CAR包含GD2结合域,其基于KM666单克隆抗体(Nakamura等人,(2001)Cancer Immunol.Immunother.50:275-284)。
本发明的CAR包含GD2结合域,其包含
a)具有互补决定区(CDRs)的重链可变区(VH),所述CDR具有以下序列:
CDR1–SYNIH(SEQ ID No.1);
CDR2–VIWAGGSTNYNSALMS(SEQ ID No.2)
CDR3–RSDDYSWFAY(SEQ ID No.3);和
b)具有CDRs的轻链可变区(VH),所述CDR具有以下序列:
CDR1–RASSSVSSSYLH(SEQ ID No.4);
CDR2–STSNLAS(SEQ ID No.5)
CDR3–QQYSGYPIT(SEQ ID No.6)。
将一个或多个突变(取代,添加或缺失)引入所述或每个CDR而不负面影响GD2结合活性可以是可能的。每个CDR可以例如具有一个,两个或三个氨基酸突变。
本发明的CAR可以包含以下氨基酸序列之一:
SEQ ID No.7(鼠KM666序列)
QVQLKESGPVLVAPSQTLSITCTVSGFSLASYNIHWVRQPPGKGLEWLGVIWAGGSTNYNSALMSRLSISKDNSKSQVFLQMNSLQTDDTAMYYCAKRSDDYSWFAYWGQGTLVTVSASGGGGSGGGGSGGGGSENVLTQSPAIMSASPGEKVTMTCRASSSVSSSYLHWYQQKSGASPKVWIYSTSNLASGVPGRFSGSGSGTSYSLTISSVEAEDAATYYCQQYSGYPITFGAGTKVEVKR
SEQ ID No.8(人源化的KM666序列)
QVQLQESGPGLVKPSQTLSITCTVSGFSLASYNIHWVRQPPGKGLEWLGVIWAGGSTNYNSALMSRLTISKDNSKNQVFLKMSSLTAADTAVYYCAKRSDDYSWFAYWGQGTLVTVSSGGGGSGGGGSGGGGSENQMTQSPSSLSASVGDRVTMTCRASSSVSSSYLHWYQQKSGKAPKVWIYSTSNLASGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQYSGYPITFGQGTKVEIKR
本发明的CAR可以包含以下VH序列之一:
SEQ ID No.9(鼠KM666VH序列)
QVQLKESGPVLVAPSQTLSITCTVSGFSLASYNIHWVRQPPGKGLEWLGVIWAGGSTNYNSALMSRLSISKDNSKSQVFLQMNSLQTDDTAMYYCAKRSDDYSWFAYWGQGTLVTVSA
SEQ ID No.10(人源化的KM666VH序列)
QVQLQESGPGLVKPSQTLSITCTVSGFSLASYNIHWVRQPPGKGLEWLGVIWAGGSTNYNSALMSRLTISKDNSKNQVFLKMSSLTAADTAVYYCAKRSDDYSWFAYWGQGTLVTVSS
本发明的CAR可以包含以下VL序列之一:
SEQ ID No.11(鼠KM666VL序列)
ENVLTQSPAIMSASPGEKVTMTCRASSSVSSSYLHWYQQKSGASPKVWIYSTSNLASGVPGRFSGSGSGTSYSLTISSVEAEDAATYYCQQYSGYPITFGAGTKVEVK
SEQ ID No.12(人源化的KM666VH序列)
ENQMTQSPSSLSASVGDRVTMTCRASSSVSSSYLHWYQQKSGKAPKVWIYSTSNLASGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQYSGYPITFGQGTKVEIK
本发明的CAR可以包含如SEQ ID No.7,8,9,10,11或12所示的序列的变体,具有至少80,85,90,95,98或99%序列同一性,只要所述变体序列保留了结合GD2的能力(当与互补VL或VH域结合时,若适当的话)。
两个多肽序列之间的百分比同一性可以通过例如BLAST的程序容易地确定,其在http://blast.ncbi.nlm.nih.gov免费可用。
跨膜域
本发明的CAR还可以包含跨越膜的跨膜域。其可以包含疏水alpha螺旋。跨膜域可以来源于CD28,其给予良好的受体稳定性。
跨膜域可以包含如SEQ ID No.13所示的序列。
SEQ ID No.13
FWVLVVVGGVLACYSLLVTVAFIIFWV
细胞内T细胞信号传导域(胞内域)
胞内域是CAR的信号传输部分。抗原识别后,受体簇集且信号传输至细胞。最普遍使用的胞内域组分是CD3-zeta的,其含有3个ITAMs。在抗原结合后,其传输活化信号至T细胞。CD3-zeta可以不提供完全有能力的活化信号,可以需要另外的共刺激信号。例如,嵌合CD28和OX40可以与CD3-Zeta一起使用以传输增殖/存活信号,或所有三种可以一起使用。
本发明的CAR的胞内域可以包含CD28胞内域和OX40及CD3-Zeta胞内域。
本发明的CAR的跨膜和细胞内T细胞信号传导域(胞内域)可以包含如SEQ ID No.14,15,16,17或18所示的序列,或具有至少80%序列同一性的其变体。
SEQ ID No.14(CD28胞内域)
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAY
SEQ ID No.15(CD40胞内域)
RSRDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKI
SEQ ID No.16(CD3zeta胞内域)
RSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
SEQ ID No.17(CD28Z)
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
SEQ ID No.18(CD28OXZ)
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKIRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
变体序列可以与SEQ ID No.13,14,15,16,17或18具有至少80%,85%,90%,95%,98%或99%序列同一性,只要所述序列提供有效的跨膜域/细胞内T细胞信号传导域。
信号肽
本发明的CAR可以包含信号肽,使得当CAR表达在细胞如T细胞内时,初生蛋白被引导至内质网和随后到细胞表面,在那里其被表达。
信号肽的核心可以含有一长段疏水性氨基酸,其具有形成单个α螺旋的倾向。信号肽可以以短的,带正电的氨基酸段开始,其帮助转位期间执行多肽的正确拓扑结构。在信号肽的末端,通常是由信号肽酶识别并切割的氨基酸段。信号肽可以在转位期间或转位完成后切割,以生成游离的信号肽和成熟蛋白。接着,游离的信号肽被特定蛋白酶消化。
信号肽可以在分子的氨基末端。
本发明的CAR可以具有以下通式:
信号肽-GD2结合域-间隔域-跨膜域-细胞内T细胞信号传导域
信号肽可以包含SEQ ID No.19或具有5,4,3,2或1个氨基酸突变(插入,取代或添加)的其变体,只要信号肽仍然发挥功能以引起CAR的细胞表面表达。
SEQ ID No.19:METDTLLLWVLLLWVPGSTG
SEQ ID No.19的信号肽是紧密并高度有效的。预测它在末端甘氨酸之后产生约95%的切割,产生由信号肽酶的有效移除。
间隔区
本发明的CAR可以包含间隔区序列以连接GD2结合域与跨膜域并在空间上分开GD2结合域与胞内域。柔性间隔区允许GD2结合域在不同方向定向使得能够进行GD2结合。
间隔区序列可以例如包含IgG1Fc区,IgG1铰链或CD8茎部,或其组合。或者该接头可以包含备选序列,其具有与IgG1Fc区,IgG1铰链或CD8茎部相似的长度和/或结构域间隔特性。
可以改变人IgG1间隔区以去除Fc结合基序。
这些间隔区的氨基酸序列的例子在以下给出:
SEQ ID No.20(人IgG1铰链-CH2CH3)
AEPKSPDKTHTCPPCPAPPVAGPSVFLFPPKPKDTLMIARTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKKD
SEQ ID No.21(人CD8茎部):
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDI
SEQ ID No.22(人IgG1铰链):
AEPKSPDKTHTCPPCPKDPK
SEQ ID No.23(IgG1铰链-Fc)
AEPKSPDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKKDPK
SEQ ID No.24(IgG1铰链-Fc经修饰以去除Fc结合基序)
AEPKSPDKTHTCPPCPAPPVA*GPSVFLFPPKPKDTLMIARTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKKDPK
修饰的残基用下划线标出;*表示缺失。
GD2
GD2是在神经外胚层来源的肿瘤(包括人神经母细胞瘤和黑素瘤)上表达的双唾液酸神经节苷脂,在正常组织上具有高度限制的表达,主要在人的小脑和外周神经上。
GD2的相对肿瘤特异性表达使得其为用于免疫疗法的合适靶标。
核酸序列
本发明的第二个方面涉及核酸序列,其编码本发明的第一个方面的CAR。
核酸序列可以能够编码具有如SEQ ID No.26-35任一项所示的氨基酸序列的CAR。
核酸序列可以包含以下序列:
SEQ ID No.25逆转录病毒基因盒的DNA序列,包括与RQR8自杀基因共表达的抗GD2CAR,具有密码子优化的框和SAR区以增强表达
传密码子的简并性可以具有不同的核酸序列。核酸序列可以与如SEQ ID No.25所示的序列具有至少80,85,90,95,98或99%同一性,只要其编码如本发明的第一个方面所定义的CAR。
自杀基因
由于T细胞嫁接且是自主的,在抗GD2CAR T细胞的接受体中选择性删除CAR T细胞的方式是理想的。自杀基因是遗传上可编码的机制,其导致面对不可接受的毒性时对输注的T细胞的选择性破坏。对于自杀基因,最早的临床经验是用疱疹病毒胸苷激酶(HSV-TK),其使得T细胞对于更昔洛韦(Ganciclovir)易感。HSV-TK是高度有效的自杀基因。然而,预先形成的免疫应答可以将其限于具有相当大的免疫抑制的临床环境,如单倍相合造血干细胞(haploidentical stem cell)移植。可诱导半胱天冬酶(caspase)9(iCasp9)是一种通过使用经修饰的FKBP12置换半胱天冬酶9的活化域构建的自杀基因。iCasp9由在其它方面为惰性的小分子二聚化化学诱导子(CID)活化。最近,在单倍相合HSCT的环境中测试了iCasp9并可以终止GvHD。iCasp9的最大限制依赖于临床级别的专有CID的可用性。iCasp9和HSV-TK两者都是细胞内蛋白,所以当用作单独的转基因时,它们已经与标志物基因共表达以允许对转导细胞的选择
iCasp9可以包含如SEQ ID No.36所示的序列或具有至少80,90,95或98%序列同一性的变体。
SEQ ID No.36
MLEGVQVETISPGDGRTFPKRGQTCVVHYTGMLEDGKKVDSSRDRNKPFKFMLGKQEVIRGWEEGVAQMSVGQRAKLTISPDYAYGATGHPGIIPPHATLVFDVELLKLESGGGSGVDGFGDVGALESLRGNADLAYILSMEPCGHCLIINNVNFCRESGLRTRTGSNIDCEKLRRRFSSLHFMVEVKGDLTAKKMVLALLELAQQDHGALDCCVVVILSHGCQASHLQFPGAVYGTDGCPVSVEKIVNIFNGTSCPSLGGKPKLFFIQACGGEQKDHGFEVASTSPEDESPGSNPEPDATPFQEGLRTFDQLDAISSLPTPSDIFVSYSTFPGFVSWRDPKSGSWYVETLDDIFEQWAHSEDLQSLLLRVANAVSVKGIYKQMPGCFNFLRKKLFFKTSAS
本发明人最近描述了称为RQR8的新的标志物/自杀基因,其可以使用抗体QBEnd10检测且表达细胞被治疗性抗体利妥昔单抗(Rituximab)裂解。
RQR8可以包含如SEQ ID No.37所示的序列或具有至少80,90,95或98%序列同一性的变体。
SEQ ID No.37
MGTSLLCWMALCLLGADHADACPYSNPSLCSGGGGSELPTQGTFSNVSTNVSPAKPTTTACPYSNPSLCSGGGGSPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRNRRRVCKCPRPVV
自杀基因可以与CAR作为单个多肽表达,例如通过使用两个序列之间的自剪切肽。
载体
本发明还提供载体,其包含根据本发明的核酸序列。此类载体可以用于将核酸序列引入宿主细胞中使得其表达并产生根据本发明的第一个方面的分子。
载体可以是例如质粒或病毒载体,如逆转录病毒载体或慢病毒载体。
载体可以能够转染或转导T细胞。
载体可以包含编码自杀基因如iCasp9或RQR8的核酸序列。
宿主细胞
本发明还提供宿主细胞,其包含根据本发明的核酸。宿主细胞可以能够表达根据本发明的第一个方面的CAR。
宿主细胞可以是溶细胞性免疫细胞,如人T细胞或自然杀伤(NK)细胞。
可以通过使用编码CAR的核酸转导或转染T细胞制成能够表达根据本发明的CAR的T细胞。
可以离体生成CAR T细胞。T细胞可以来自患者或供体的外周血单核细胞(PBMC)。在使用编码CAR的核酸转导前,可以活化和/或扩增T细胞,例如通过使用抗CD3单克隆抗体处理。
药物组合物
本发明还涉及药物组合物,其含有本发明的载体或表达CAR的T细胞连同药学上可接受的载体,稀释剂或赋形剂,以及可选地一种或多种另外的药学上活性的多肽和/或化合物。此类配制剂可以是例如为适合用于静脉内输注的形式。
治疗方法
表达本发明的CAR分子的T细胞能够杀伤癌细胞,例如神经母细胞瘤细胞。可以离体或从患者自身的外周血(第一方),或在来自供体外周血的造血干细胞移植物(第二方)的背景中,或来自无关联供体的外周血(第三方)中创建表达CAR的T细胞。或者,CAR T细胞可以来源于可诱导祖细胞或胚胎祖细胞离体向T细胞的分化。在这些情况下,通过许多方法的一种引入编码CAR的DNA或RNA生成CAR T细胞,所述方法包括使用病毒载体转导,使用DNA或RNA转染。
表达本发明的CAR分子的T细胞可以用于癌症疾病的治疗,特别是GD2表达相关的癌症疾病。
癌症可以是外胚层肿瘤(ectodermal tumour)。
与升高的GD2表达水平相关的癌症的例子为:神经母细胞瘤,黑色瘤,成神经管细胞瘤,软组织肉瘤,骨肉瘤,和小细胞肺癌例如NSCLC。
用于疾病的治疗的方法涉及本发明的载体或T细胞的治疗性用途。在这方面,可以将载体或T细胞施用至患有存在的疾病或状况的受试者,以减轻,降低或改善与疾病相关的至少一种症状和/或减慢,降低或阻断疾病的进展。本发明的方法可以导致或促进T细胞介导的对表达GD2细胞,如癌细胞的杀伤。
表达GD2的细胞
本发明还提供用于制造表达GD2的细胞的方法,其包括将编码GM3合酶的核酸和编码GD2合酶的核酸引入细胞中的步骤。
例如,可以通过使用载体,如质粒或病毒载体转染或转导引入核酸。
本发明还涉及表达GD2的细胞,其包含编码GM3合酶的异源性核酸和编码GD2合酶的异源性核酸。
核酸可以是“异源性”,就其通常不存在于细胞中而言。其为人工引入的重组核酸序列。
细胞可以来自细胞系。
细胞可以用于刺激培养中的GD2CAR T细胞,如本发明的T细胞。
本发明将通过实施例的方式进一步描述,其是为了起到帮助本领域的普通技术人员实施本发明,而不意图以任何方式限制本发明的范围。
实施例
实施例1-使用人源化的抗体huK666作为结合物
使用如Nakamura等人(2001-如上文)所描述的来自小鼠抗体KM666或其人源化版本hu666的序列,使用scFv构建了CAR(以上图2中变体(a)和(b))。比较这些受体的表达/稳定性并发现对于两种受体相等。接着,测试了当由不表达或表达GD2的靶细胞激发时,使用这些受体转导的T细胞的杀伤,细胞因子分泌和增殖。得出的结论是两种受体的杀伤是相似的,但基于人源化scFc的受体导致更好的IL2产生和增殖(图3)。
实施例2-测试不同间隔区形式对表达和功能的影响
生成了具有Fc间隔区,铰链,铰链-CD8茎部和CD8茎部的抗GD2CAR(分别为图2(b),(d),(e)和(f))。将这些CARs与标志物基因,截短的CD34共表达与2A口蹄疫自剪切肽强制1:1的形式以允许精确比较(图4a)。此外,使用氨基末端HA标签标记huK666scFv以允许转基因相对于CAR表达的比较。
对使用这些构建体转导的正常供体T细胞的流式细胞分析表明了以下顺序的较明亮的CAR表达:Fc>铰链-茎部=茎部>铰链(图4b)。
使用铬释放测定比较了对GD2阳性靶标相对于GD2阴性靶标的杀伤。这允许以下顺序的杀伤效率:Fc>铰链-茎部=茎部>铰链(图4c)。
比较了当使用GD2阳性或阴性靶标激发CAR T细胞时,干扰素-gamma释放和IL-2释放。在具有Fc,铰链-茎部和茎部的CARs中,干扰素-gamma释放相似,但在铰链变体中较少。检测到IL2释放为以下顺序:Fc,茎部,铰链-茎部,铰链(图4d和e)。
实施例3-FcR突变消除了非特异性活性
来自以上实施例的整体数据提示Fc间隔区总体表现最好。然而,Fc域在体内可以引起来自表达Fc受体的细胞的非特异性活性。为了消除该效果,如图5(a)中所示将突变引入Fc区中。这些突变对CAR表达没有不利影响,如图5(b)中所示。
另外,证明了这些突变对CAR杀伤功能没有影响(图5(c))。最后,证明了在对表达FcR的靶标(称为THP1的单核细胞样系)的非特异性杀伤,和由这些单核细胞的IL-1Beta释放方面,这些突变具有期望的效果(图5e)。
实施例4-表达基因盒的优化
考虑到受体表达的优化,测试了以下项:(a)将支架附接区(SAR)纳入盒中;(b)将鸡beta血红蛋白染色质绝缘子(CHS4)纳入3’LTR中和(c)对开放阅读框的密码子优化(图6a)。表明了SAR的纳入改善表达的性质,密码子优化亦然,而CHS4影响不大(图6b)。将SAR和密码子优化组合叠加地改进了表达(图6c)。
实施例5-不同胞内域的比较
生成了具有三种不同胞内域的构建体:具有CD3-zeta胞内域的CD28跨膜域(CD28tmZ);具有CD28胞内域和CD3-zeta胞内域的CD28跨膜域(CD28Z),和CD28跨膜域,CD28胞内域,OX30胞内域以及CD3-zeta胞内域(CD28OXZ),其中CAR以Fc间隔区的形式。注意到增殖,IFNγ释放和IL2释放以CD28tmZ<CD28Z<CD28OXZ的顺序增加(图7)。
实施例6-与iCasp9自杀基因共表达
将iCasp9自杀基因与抗GD2CAR共表达(图8a-CAR以Fc间隔区的形式,随意选择CD28OXZ以证明功能)。尽管与iCasp9共表达,CAR可以良好表达(图8b)。使用小分子二聚化剂(dimerizer)活化iCasp9导致CAR阳性T细胞的删除(图8b)。暴露于该二聚化剂的iCasp9-GD2CAR T细胞当暴露于二聚化剂时,失去了它们的GD2特异性(图8c)。
实施例7-与RQR8自杀基因共表达
将抗GD2CAR与RQR8分选自杀基因(sort-suicide gene)共表达(图9a-CAR以Fc间隔区的形式,随意选择CD28Z以证明功能)。共表达受体和CAR是可能的(图9b)。使用利妥昔单抗和补体对RQR8自杀基因功能的活化导致转导的T细胞的删除和GD2识别的丧失(图9c和d)。
实施例8-GD2合酶和GM3合酶的表达导致任意细胞系中GD2表达
为了刺激培养中的GD2CAR T细胞,为了具有理想的GD2-或GD2+靶标,且为了能够生成同基因细胞用于小动物模型,期望的是能够在细胞系上转基因表达GD2。GD2不是蛋白质,并且需要由一组复杂的酶合成。这里表明了仅两种酶:GM3合酶和GM2合酶的转基因表达导致在至今转导的所有细胞系中明亮的GD2表达(图10)。
实施例9-抗GD2CAR的体内功能
如上文所述CT26细胞系经工程化以表达GD2(命名为CT26克隆#7或缩写为CT25#7)。将2x105个野生型(wt)或GD2阳性细胞接种到C57BL/6小鼠(与CT26同基因)体侧。肿瘤攻击后10天,制备假转导的和抗GD2CAR转导的同基因脾细胞。将小鼠分为以下4个群体:具有表达GD2的CT26肿瘤的小鼠,接受抗GD2CAR脾细胞;表达GD2的CT26肿瘤,接受假转导的脾细胞;GD2阴性(wt)CD26肿瘤与抗GD2CAR脾细胞;和表达GD2的CT26肿瘤,不接受脾细胞。使用数显卡尺以3维测量肿瘤并以此估算体积。图11示出了肿瘤的生长曲线。仅接受抗GD2CAR T细胞小鼠中的GD2阳性肿瘤具有很少的生长或没有生长。
实施例10-比较包含基于huK666和14g2a的抗原结合域的CAR的功能
CAR的抗原结合域可以影响其功能。在本研究中,与具有基于14g2a的抗原结合域的等同CAR比较具有基于huK666的抗原结合域的本发明的CAR的功能。
抗体14g2a可以视为针对GD2的黄金标准抗体,因为其用作治疗性mAb且是在CAR研究中测试的唯一scFv。
基于huK666或14g2a构建并表达了第二代CAR。它们的结构示于图14a中。
通过使用编码GD2CAR、gag/pol和包膜蛋白RD114的质粒瞬时转染293T细胞产生了逆转录病毒。3天后收获上清并用于在Retronectin包被的平板上与相同滴度的逆转录病毒转导PHA/IL2活化的PBMCs。CAR仅在它们的抗原结合域中不同。在两种情况下,都使用IgG Fc片段将结合域连接到膜,并含有来自CD28和CD3-zeta的细胞内活化基序。转导后六天,通过流式细胞术确认CAR表达,并将PBMCs与GD2阳性Lan1细胞(GD2阳性细胞系)或GD2阴性A204细胞(GD2阴性横纹肌肉瘤细胞系)以1:1比率培养。一天后,来自这些共培养的上清通过ELISA测定干扰素-γ水平,并在6天后通过流式细胞术评估T细胞增殖。
结果示于图14和图15中。24小时后,从上清测量干扰素-gamma。证明了huK666CAR产生更多的IFN-γ(图14b)。一周后对T细胞计数,且证明了huK666CAR具有更多的增殖(图14c)。
与神经母细胞瘤细胞系LAN1共培养一周后,收获细胞并通过流式细胞术分析。CD45表达允许区分淋巴样细胞和非淋巴样细胞,其中CD45-细胞为LAN-1细胞。使用CD3/QBEND/10进一步染色允许对CAR T细胞计数。发现huK666CAR T细胞比14g2a等同物增殖更好且杀伤更完全(图15)。
以上说明书中提及的所有出版物通过提述并入本文。本发明描述的方法和系统的各种修改和变化对于本领域的技术人员将是显而易见的而不脱离本发明的范围和精神。尽管已经与特定的优选实施方案相关联描述本发明,应当理解作为要求保护的本发明不应当过度限于这些特定实施方案。实际上,对于实现本发明所描述的模式的各种修改对于分子生物学,细胞免疫学或相关领域的技术人员是显而易见的,并意图在所附权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!