类胡萝卜素双加氧酶和在微生物和植物中以生物技术制备衍生自藏红花的化合物的方法与流程
本发明涉及新型类胡萝卜素双加氧酶和在微生物和植物中生物制备衍生自藏红花的具有高附加值的化合物的方法。
本发明特别涉及在体外系统、大肠杆菌(e.coli)的工程菌株和植物组织中制备藏红花的阿朴类胡萝卜素(apocarotenoids)的基因、蛋白质和方法。更具体地,本发明涉及编码具有裂解类胡萝卜素的双加氧酶活性的酶(类胡萝卜素裂解双加氧酶:ccd)的藏红花基因ccd2的分离和表征。该基因在积累玉米黄质的工程微生物(如大肠杆菌)或富含玉米黄质的植物组织(例如玉米胚乳)中的过表达决定了藏红花酸二醛和藏红花酸的分别产生。本发明还涉及用于研究所述双加氧酶活性的体外测定法的开发。
背景技术:
藏红花(crocussativusl.)(鸢尾科(iridaceae))是多年生、三倍体、无性繁殖的不育株,种植在西班牙到克什米尔的温和地区(1)。其干燥柱头构成了香料藏红花,其价格在2,000至7,0000€/kg的范围内,通常被认为是世界上最昂贵的香料。藏红花的高价是由与采收柱头有关的必要的手工劳动而造成的:1kg干燥藏红花需要的手工采收约150,000朵花(http://www.europeansaffron.eu/)(1)。藏红花的柱头积累了一系列阿朴类胡萝卜素化合物:导致柱头的红色的藏红花酸及其糖基化形式(藏红花素);导致藏红花苦味的藏红花苦甙;和造成了藏红花的刺鼻香味的藏红花(2)。除了作为添加到食品中的高价成分之外,藏红花的阿朴类胡萝卜素化合物还具有化妆品和医学应用(1),作为非限制性实例,包括藏红花酸和藏红花素被证实的对于视网膜退化性疾病的保护功效(3,4)。考虑到这些应用并考虑到目前通过昂贵的提取方法制备藏红花阿朴类胡萝卜素的高成本,通过在具有高生产率的微生物系统或植物中的生物合成中涉及的酶的表达以经济的生物技术制备藏红花阿朴类胡萝卜素的方法的开发有着工业价值。此类化合物的生物合成从双加氧酶(ccd,类胡萝卜素裂解双加氧酶)在玉米黄质的7,8和7'8'位置的对称裂解开始(图1)。玉米黄质裂解的两种产物(即3-oh-β-环柠檬醛(3-oh-β-cyclocitral)和藏红花酸二醛)被脱氢和糖基化,分别产生了藏红花苦甙和藏红花素。负责糖基化反应的葡萄糖基转移酶在藏红花和栀子(gardenia)中有所报道(5)(6)。对于第一生物合成步骤,一些作者报道称,被称作zcd的酶在7,8/7',8'位置处对称裂解玉米黄质,产生了藏红花酸二醛(7),这与后续工作(8)的观察结果相矛盾。zcd的三维结构的模型显示,zcd是不完全的酶,缺乏保守的β-螺旋桨结构(9)的叶片vii,这与zcd缺乏酶活性一致(8)。因此,由于生物合成途径的第一种酶(即负责对称裂解玉米黄质的7,8和7'8'位置的ccd)的鉴定仍然不确定,目前不可能通过生物技术方法制备藏红花的阿朴类胡萝卜素化合物,特别是藏红花酸和藏红花素。
技术实现要素:
本发明的目的是提供新型类胡萝卜素双加氧酶和在微生物和植物中生物制备衍生自藏红花的具有高附加值的化合物的方法。
本发明的上述和其它目的通过根据相应的独立权利要求所述的编码类胡萝卜素双加氧酶的基因、以该方式编码的酶和制备藏红花素前体的方法来实现,并将在下文的描述中变得明显。
附图说明
从以下详细描述的一些优选实施方案并参考附图可以更好地理解本发明,其中相应的附图说明如下:
图1藏红花中的阿朴类胡萝卜素的生物合成途径。对阿朴类胡萝卜素的生物合成所提出的生物合成途径。通过ccd活性在7,8和7',8'位置裂解玉米黄质。利用醛脱氢酶将裂解产物c20(藏红花酸二醛)转化为藏红花酸,然后利用至少两种udpg糖基转移酶的活性转变为藏红花素。利用udpg-糖基转移酶将产物c10(3-oh-β-环柠檬醛)转化为藏红花苦甙,然后转化成藏红花醛。
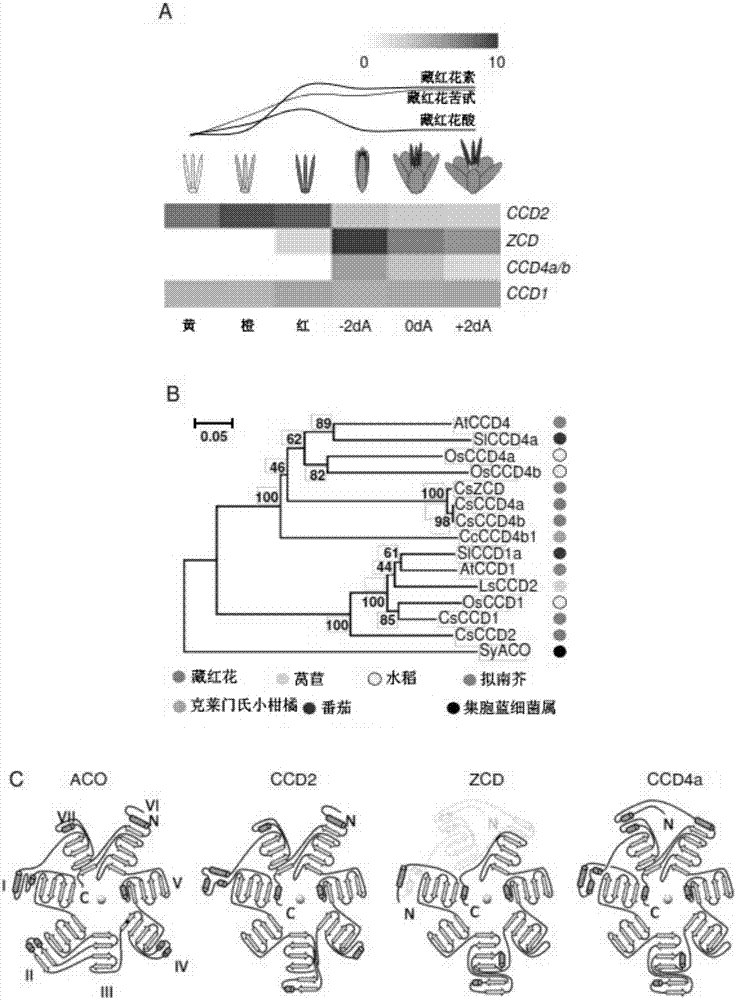
图2藏红花ccd的表达和结构特征。(a)在藏红花的柱头发育过程中各种ccd的表达。上图,即“热图(heatmap)”,显示了不同阿朴类胡萝卜素的积累动力学;(b)通过邻位相连法测定的藏红花ccd(cs)、拟南芥(arabidopsis)(at)、水稻(os)、番茄(sl)、莴苣(ls)、克莱门氏小柑橘(clementine)(cc)和集胞蓝细菌属(synechocystis)(sy)的系统进化关系;(c)集胞蓝细菌属(synechocystis)的aco(阿朴类胡萝卜素裂解加氧酶)和藏红花(crocussativus)的ccd2、zcd和ccd4a的三维模型。zcd缺少β-螺旋桨结构的叶片vii(阴影)。
图3在大肠杆菌中表达的ccd2转化玉米黄质并形成藏红花酸二醛。(a)采用空载体pthio1-dan(c-)或采用相同载体(其中ccd2或zcd被克隆)转化积累番茄红素、β-胡萝卜素或玉米黄质的大肠杆菌细胞。应注意只在表达ccd2的细胞中的玉米黄质的褪色。(b)在20℃下孵育16h后,在表达玉米黄质和ccd2的细胞中的对阿朴类胡萝卜素的hplc-hrms分析。它们产生藏红花酸二醛,其色谱质量和迁移率与标准品(authenticstandard)相同。
图4体外亲和力测定。(a)在体外测定中从表达ccd2的大肠杆菌的提取物中裂解玉米黄质。(b)没有从ccd2体外裂解的底物。(c)从ccd2体外裂解的底物和裂解的位置。
现在参照附图详细描述本发明。
具体实施方式
通过文献(10)中报道的rna-seq454titanium技术对从藏红花的柱头分离出的rna进行测序(图2a)。使用邻位相连法(11)(图2b)研究了藏红花、拟南芥、水稻和集胞蓝细菌属的基因家族ccd1和ccd4之间的进化关系,同时使用网络服务器raptorx(12)(图2c)模拟ccd蛋白。通过采用表达载体pthio-dan1-ccd2、pthio-dan1-zcd和pthio-dan1(空载体,用于对照)将被工程化为积累番茄红素、β-胡萝卜素和玉米黄质的大肠杆菌的特定菌株进行转化来实现细菌中的测定,如文献(13)(14)(15)(图3)中所示。通过在载体pbi121中克隆ccd2的编码序列(16)并通过使用文献(17)中已有的方案,以根癌土壤杆菌(agrobacteriumtumefaciens)介导的方式转化玉米胚乳。使用大肠杆菌菌株bl21(p-gro7)测定ccd2的体外活性:制备粗蛋白提取物,并与适合的底物和先前报道的提取物(14)(图4)孵育。使用与高压液相色谱(hplc)系统和二极管阵列检测器(dad)(thermofisherscientific)联用的质谱平台ltq-orbitrap对类胡萝卜素和阿朴类胡萝卜素进行鉴定和定量的所有分析;使用具有反相的c30柱进行色谱分离,而选择apci(大气压化学电离)源进行正离子化(18)。
将参照以下通过非限制性解释提供的示例更好地对本发明进行说明。
示例1.藏红花的柱头中表达的基因ccd2的鉴定:当藏红花酸、藏红花苦甙和藏红花素的生物合成基本上完成时,转录物ccd4和zcd在开花期表达。只有ccd2在发育的早期阶段表达,其积极地合成阿朴类胡萝卜素(图2a)(19)。藏红花的ccd2蛋白是新的ccds亚家族的成员,其类似于但不同于ccd1(图2b)。ccd2具有形成β螺旋桨结构的保留在所有ccd中的所有7个叶片,而zcd缺少叶片vii(图2c)。
示例2.在以基因方式修饰为积累玉米黄质的细菌大肠杆菌中表达的基因ccd2将玉米黄质转化为藏红花酸二醛产物而基因zcd不具有这种性质的证明。
将基因ccd2和zcd的编码序列克隆到载体pthio-dan1中,然后以阿拉伯糖诱导大肠杆菌的可诱导型表达。重组蛋白在积累番茄红素、β-胡萝卜素和玉米黄质的三种大肠杆菌菌株中表达(图3a)(13)(14)。同时在ccd2或zcd表达后,积累番茄红素和β-胡萝卜素的大肠杆菌菌株中没有观察到褪色和裂解产物(图3a),但是在积累玉米黄质的大肠杆菌菌株的菌株中ccd2的表达导致了细菌细胞的明显褪色(图3a)。与高分辨率质谱(lc-hrms)联用的hplc分析显示了对应藏红花酸二醛的297.1847的m/z比的峰,其证明了与其底物的标准品相同的色谱迁移率(图3b)。色谱的峰和藏红花酸典型的m/z比(329.1747)也是可辨别的。在相同系统中表达的zcd不产生任何的褪色或任何裂解产物(图3a-b)。
示例3.在玉米胚乳和/或拟南芥(arabidopsisthaliana)细胞中表达的基因ccd2将玉米黄质转化为藏红花酸产物的证明。在已知的启动子35s的控制下将编码ccd2和zcd的序列克隆到二元载体pbi121中。由此得到的载体被用于转化含有玉米黄质的玉米胚乳和拟南芥细胞。与采用含有zcd或β-葡糖醛酸糖苷酶组分的载体转化的胚乳相比,采用ccd2转化的胚乳显示出褪色,这是类胡萝卜素裂解活性的标志。对表达ccd2的植物细胞进行的lc-hrms分析没有证实3-oh-β-阿朴-8'-胡萝卜素醛或藏红花酸二醛的存在,但是出现了等于329.1747的对应于藏红花酸m/z比的新峰,其证明了与该底物的标准品相同的色谱迁移率。这种转化是由于玉米胚乳(表1)和拟南芥细胞中的藏红花二醛向藏红花酸的转化引起的。在表达zcd或β-葡糖醛酸糖苷酶的玉米胚乳中没有产生玉米黄质的裂解产物。
示例4.研究ccd2对各种类胡萝卜素的特异性的体外测定的开发和用途。由于基因修饰的大肠杆菌菌株只能产生有限数量的不同类胡萝卜素,我们基于表达ccd2的大肠杆菌的半纯化提取物开发并采用了体外测定以研究该酶对各种类胡萝卜素的特异性。在该测定中,ccd2不裂解β-胡萝卜素、紫黄素或β-阿朴-8'-胡萝卜素醛,而是裂解产生3-oh-β-阿朴-8'-胡萝卜素醛的玉米黄质,即在7',8'位置单裂解的产物(图4)。相反,zcd不裂解任何类胡萝卜素,甚至不裂解玉米黄质。随后,在体外基于玉米黄质的由ccd2形成的3-oh-β-阿朴-8'-胡萝卜素由ccd2裂解,产生藏红花素,表明大肠杆菌的提取物能够将ccd2产物(藏红花酸二醛)转化为藏红花酸。
表1:玉米胚乳中以表达各种酶的质粒转化的类胡萝卜素和阿朴类胡萝卜素的相对含量
通过内标物标准化的离子的峰面积表示更丰富的类胡萝卜素和阿朴类胡萝卜素。所示数据代表4次生物重复的平均值±sd。n.d.=不可检测;*=p值0.05;**=p值0.01。
引用文献
(1)fernandezja&pandalaisg(2004)biology,biotechnologyandbiomedicineofsaffron.recentresearchdevelopmentsinplantscience.vol.2:127-159.
(2)caballero-ortegah,pereda-mirandar,&abdullaevfi(2007)hplcquantificationofmajoractivecomponentsfrom11differentsaffron(crocussativusl.)sources.foodchemistry100(3):1126-1131.
(3)yamauchim,tsurumak,imais,nakanishit,umigain,shimazawam,harah:crocetinpreventsretinaldegenerationinducedbyoxidativeandendoplasmicreticulumstressesviainhibitionofcaspaseactivity.europeanjournalofpharmacology2011650(1):110-119.
(4)qiy,chenl,zhangl,liuwb,chenxy,yangxg:crocinpreventsretinalischaemia/reperfusioninjury-inducedapoptosisinretinalganglioncellsthroughthepi3k/aktsignallingpathway.experimentaleyeresearch2013107(44-51).
(5)moragaar,nohalespf,perezja,&gomez-gomezl(2004)glucosylationofthesaffronapocarotenoidcrocetinbyaglucosyltransferaseisolatedfromcrocussativusstigmas.planta219(6):955-966.
(6)nagatoshim,等人(2012)ugt75l6andugt94e5mediatesequentialglucosylationofcrocetintocrociningardeniajasminoides.febslett586(7):1055-1061.
(7)bouvierf,suirec,muttererj,&camarab(2003)oxidativeremodelingofchromoplastcarotenoids:identificationofthecarotenoiddioxygenasecsccdandcszcdgenesinvolvedincrocussecondarymetabolitebiogenesis.plantcell15(1):47-62.
(8)rubioa,等人(2008)cytosolicandplastoglobule-targetedcarotenoiddioxygenasesfromcrocussativusarebothinvolvedinbeta-iononerelease.jbiolchem283(36):24816-24825.
(9)suix,kiserpd,lintigj,&palczewskik(2013)structuralbasisofcarotenoidcleavage:frombacteriatomammals.archbiochembiophys539(2):203-213.
(10)alagnaf,等人(2009)comparative454pyrosequencingoftranscriptsfromtwoolivegenotypesduringfruitdevelopment.bmcgenomics10(1):399.
(11)saitoun&neim(1987)theneighbor-joiningmethod:anewmethodforreconstructingphylogenetictrees.molbiolevol4(4):406-425.
(12)kallbergm,等人(2012)template-basedproteinstructuremodelingusingtheraptorxwebserver.natprotoc7(8):1511-1522.
(13)prado-cabreroa,scherzingerd,avalosj,&al-babilis(2007)retinalbiosynthesisinfungi:characterizationofthecarotenoidoxygenasecarxfromfusariumfujikuroi.eukaryotcell6(4):650-657
(14)aldera,holdermanni,beyerp,&al-babilis(2008)carotenoidoxygenasesinvolvedinplantbranchingcatalyseahighlyspecificconservedapocarotenoidcleavagereaction.biochemj416(2):289-296.
(15)trautmannd,beyerp,&al-babilis(2013)theorfslr0091ofsynechocystissp.pcc6803encodesahigh-lightinducedaldehydedehydrogenaseconvertingapocarotenalsandalkanals.febsj280(15):3685-3696.
(16)jeffersonra(1987)assayingchimericgenesinplants:thegusgenefusionsystem.plantmolbiolreporter5:387-405.
(17)reyesfc,sunb,guoh,gruisdf,&oteguims(2010)agrobacteriumtumefaciens-mediatedtransformationofmaizeendospermasatooltostudyendospermcellbiology.plantphysiol153(2):624-631
(18)fantinie,falconeg,frusciantes,gilibertol,&giulianog(2013)dissectionoftomatolycopenebiosynthesisthroughvirus-inducedgenesilencing.plantphysiol163(2):986-998.
(19)moragaar,ramblajl,ahrazemo,granella,&gomez-gomezl(2009)metaboliteandtargettranscriptanalysesduringcrocussativusstigmadevelopment.phytochemistry70(8):1009-1016.
- 还没有人留言评论。精彩留言会获得点赞!