选择性地活化调节性T细胞用于治疗自身免疫病的分子的制作方法
免疫系统必须能够区分自身和非自身。当区分自身/非自身失败时,免疫系统破坏身体的细胞和组织并因此导致自身免疫病。调节性T细胞主动地阻遏免疫系统的活化和阻止病理性的自身反应性和作为结果的自身免疫病。开发选择性活化调节性T细胞的药物和方法用于治疗自身免疫病是密集研究的主题,且直到本发明的开发之前,主要是不成功的。
调节性T细胞(Treg)是一类CD4+CD25+T细胞,其阻遏其他免疫细胞的活性。Treg是免疫系统内稳态的中心,并在维持对自身抗原的耐受性和调节对外来抗原的免疫应答中起主要作用。多种自身免疫病和炎性疾病,包括1型糖尿病(T1D)、系统性红斑狼疮(SLE)、和移植物抗宿主病(GVHD),已经显示具有Treg细胞数目或Treg功能的缺陷。因此,在开发加强Treg细胞的数目和/或功能的疗法方面存在极大兴趣。
正在研究的用于自身免疫病的一种治疗方法是自体的、离体(ex vivo)扩增的Treg细胞的移植(Tang,Q.,等人,2013,Cold Spring Harb.Perspect.Med.,3:1-15)。尽管这一方法已经在治疗疾病的动物模型和在数个早期人类临床试验中显示出希望,其要求用患者自身的T细胞的个性化治疗,是有创的,并是技术上复杂的。另一种方法是用低剂量白介素-2(1L-2)治疗。Treg细胞特征性地表达高组成水平的高亲和力IL-2受体IL2Rαβγ,其包括亚基IL2RA(CD25)、IL2RB(CD 122)和IL2RG(CD 132),且Treg细胞生长已经显示依赖于IL-2(Malek,T.R.,等人,2010,Immunity,33:153-65)。低剂量IL-2治疗慢性GVHD(Koreth,J.,等人,2011,N Engl J Med.,365:2055-66)和HCV相关的自身免疫血管炎患者的临床试验(Saadoum,D.,等人,2011,N Engl J Med.,365:2067-77)已经表明增加的Treg水平和临床效力的迹象。已经开始了研究IL-2在多种其他自身免疫病和炎性疾病中的效力的新的临床试验。
在这些试验中使用的IL-2的重组形式Proleukin(由Prometheus Laboratories,San Diego,CA销售),伴有高的毒性。Proleukin被批准用于治疗转移性黑素瘤和转移性肾癌,但其副作用如此严重,以致其使用仅在具有使用重症监护的医院环境中被推荐(http://www.proleukin.com/assets/pd/proleukin.pdf)。直到Treg细胞的最近表征,IL-2被认为是免疫系统刺激物,活化T细胞和其他免疫细胞以消灭癌细胞。由于Treg细胞因其表达IL2Rαβγ而比许多其他免疫细胞类型响应于更低浓度的IL-2,IL-2在自身免疫病中的临床试验已经采用了低剂量的IL-2以靶向Treg细胞(Klatzmann D,2015 Nat Rev Immunol.15:283-94)。然而,即使这些低剂量导致安全性和耐受性问题,且使用的治疗已经采取了每日皮下注射(长期或以间歇5天的治疗过程)。因此,对以下的自身免疫病疗法存在需求:其加强Treg细胞数目和功能,比IL-2更特异性地靶向Treg细胞,更安全和更可耐受,且较不频繁地施用。
改进基于IL-2的疗法的治疗指数的一种方法是使用IL-2的变体,其相对于其他免疫细胞对Treg细胞是选择性的。IL-2受体在包括T细胞、NK细胞、嗜酸性粒细胞和单核细胞的多种不同免疫细胞类型上表达,且这一宽的表达谱可能促进其对免疫系统的多效作用和高的系统毒性。IL-2受体以三种形式存在:(1)低亲和力受体IL2RA,其不发信号;(2)中等亲和力受体(IL2Rβγ),包括IL2RB和IL2RG,在常规T细胞(Tcons)、NK细胞、嗜酸性粒细胞和单核细胞中广泛表达;和(3)高亲和力受体(IL2Rαβγ),包括IL2RA、IL2RB和IL2RG,在活化的T细胞上瞬时表达和在Treg细胞上组成型表达。已经开发了相对于IL2Rβγ对IL2Rαβγ选择性的IL-2变体(Shanafelt,A.B.,等人,2000,Nat Biotechnol.18:1197-202;Cassell,D.J.,等人,2002,Curr Pharm Des.,8:2171-83)。这些变体具有减少其对IL2RB的亲和力的氨基酸取代。由于IL-2具有对IL2RG不可检测的亲和力,这些变体因此具有对IL2Rβγ受体复合物减少的亲和力和减少的活化表达IL2Rβγ的细胞的能力,但保留结合IL2RA的能力和结合并活化IL2Rαβγ受体复合物的能力。基于表达IL2Rβγ的NK细胞是对毒性的主要贡献者的假设,这些变体之一IL2/N88R(Bay 50-4798),以作为免疫系统刺激物的低毒性形式的IL-2被临床测试。Bay 50-4798显示相对于NK细胞选择性地刺激活化的T细胞的增殖,并在癌症患者(Margolin,K.,等人,2007,Clin Cancer Res.,13:3312-9)和HIV患者(Davey,R.T.,等人,2008,J Interferon Cytokine Res.,28:89-100)的I/II临床试验中被评价。这些试验显示,Bay 50-4798比Proleukin显著地更安全和更可耐受,并显示,其增加了患者中CD4+T细胞和CD4+CD25+T细胞的水平。然而,CD4+T细胞和CD4+CD25+T细胞的增加不指示Treg细胞的增加,因为Treg的鉴定要求除了CD4和CD25以外的另外的标志物,且因为Treg细胞是CD4+CD25+细胞的一小部分。在这些试验之后,本领域中的研究更充分地确立了Treg细胞的身份并表明,Treg细胞选择性地表达IL2Rαβγ(在Malek,T.R.,等人,2010,Immunity,33:153-65中综述)。基于这一新的研究成果,现在可理解,IL2Rαβγ选择性激动剂应对Treg细胞是选择性的。
改进基于IL-2的疗法的治疗指数的第二种方法是优化该分子的药代动力学以最大地刺激Treg细胞。IL-2作用的早期研究表明,体外的人类T细胞增殖的IL-2刺激要求暴露于有效浓度的IL-2至少5-6小时(Cantrell,D.A.,等人,1984,Science,224:1312-1316)。当施用于人类患者时,IL-2具有非常短的血浆半衰期:对于静脉施用85分钟和对于皮下施用3.3小时(Kirchner,G.I.,等人,1998,Br J Clin Pharmacol.46:5-10)。由于其短的半衰期,维持循环中的IL-2处在或高于刺激T细胞增殖持续必要的持续时间必需的水平使高剂量成为必需,这导致峰值IL-2水平显著高于Treg细胞的EC50或将要求频繁施用(图1)。这些高IL-2峰值水平可活化IL2Rβγ受体并具有其他非预定的或不利的作用。具有比IL-2更长的循环半衰期的IL-2类似物可在比IL-2低的浓度和较低峰值水平实现靶药物浓度持续指定的时间段。因此,此类IL-2类似物将要求比IL-2低的剂量或较不频繁施用来有效刺激Treg细胞。事实上,在用具有14小时的循环半衰期的IgG-IL2融合蛋白给药的猕猴中,与等摩尔剂量的IL-2相比刺激了Treg的稳健得多的增加(Bell,等人,2015,J Autoimmun.56:66-80)。IL-2药物的较不频繁皮下施用也将对于患者更可耐受。具有这些特征的治疗将在临床上转化为改进的药理学效力、减少的毒性、和改进的患者对疗法的顺应性。
延长治疗蛋白的半衰期的一种方法是将分子的治疗活性部分融合到另一蛋白(诸如IgG的Fc区)以增加循环半衰期。治疗蛋白与IgG Fc的融合通过增加蛋白的流体动力学半径来实现此,从而减少肾清除,和经由新生儿Fc受体(FcRn)-介导的融合蛋白再循环,从而延长循环半衰期。治疗蛋白与白蛋白(Sleep,D.,等人,2013,Biochem Biophys Acta.,1830:5526-34)和非免疫原性氨基酸聚合物蛋白(Schlapschy,M.,等人,2007,Protein Eng Des Sel.20:273-84;Schellenberger,V.,等人,2009,Nat Biotechnol.27:1186-90)的融合已经被采用以增加循环半衰期。然而,此类融合蛋白以确保IL2选择性激动剂融合伴侣的稳健生物活性的方式的构建可以是不可预测的,尤其是在IL-2选择性激动剂的情形中,IL-2选择性激动剂是在结合受体亚基之一方面有缺陷的小蛋白,且必须组装三种受体亚基的复合物以活化受体(Wang,X.,等人,2005,Science 310:1159-63)。
其他研究者已经使用野生型IL-2或具有C125S取代的IL-2创建了多种IL-2融合蛋白来提升稳定性。Morrison和同事(Penichet,M.L.,等人,1997,Hum Antibodies.8:106-18)创建了IgG融合到野生型IL-2的融合蛋白,以增加IL-2的循环半衰期和将IL-2靶向于特定抗原,目的是加强对抗原的免疫应答。这一融合蛋白由包括重(H)和轻(L)链的完整抗体分子组成,其中N-末端H链部分融合到C-末端IL-2蛋白部分。这种IgG-IL-2融合蛋白具备Fc效应物功能。IgG Fc蛋白的关键效应物功能是补体依赖性细胞毒性(CDC)和抗体依赖性细胞毒性(ADCC)。IgG-IL-2融合蛋白在IL-2生物测定中是高度活性的并显示具备CDC活性。因此,Penichet等人教导了使用抗体-IL2融合蛋白来将IL-2活性靶向于被该抗体识别的抗原,目的是加强对抗原的体液介导的和细胞介导的免疫应答。以类似的方式,Gillies和同事已经构建了用于癌症免疫疗法的许多IgG-IL-2融合蛋白,利用融合蛋白的抗体部分以靶向肿瘤抗原,和IL-2部分以刺激对肿瘤细胞的免疫应答(在Sondel,P.M.,等人,2012,Antibodies,1:149-71中综述)。这些教导与本发明的技术相当不同,本发明技术中促进免疫阻遏性Treg细胞的生长和活性的IL-2选择性激动剂与效应物功能缺陷性Fc蛋白部分融合,目的是增加系统暴露。
Strom和其同事已经构建了IL-2融合到Fc蛋白的N末端的融合蛋白,目的是消除表达高亲和力IL-2受体的活化T细胞(Zheng,X.X.,等人,1999,J Immunol.1999,163:4041-8)。这一融合蛋白显示在T1D的T细胞转移小鼠模型中抑制自身免疫糖尿病的发展。IL2-Fc融合蛋白当被移植到对疾病较不易感的雄性NOD小鼠时,显示抑制来自T1D易感雌性NOD小鼠的促进疾病的T细胞的功能。他们还表明,IL-2-Fc融合蛋白可体外杀伤表达高亲和力IL-2受体的细胞。这些研究者还比较了从效应物功能充足的IgG2b Fc和突变的效应物功能缺陷性IgG2b Fc衍生的Fc构建的IL2-Fc融合蛋白。只有包含效应物功能充足的Fc的IL2-Fc融合蛋白在阻止疾病发作方面有效。如此,这些研究者教导,具有效应物功能的IL2-Fc融合蛋白可消除导致疾病的活化的T细胞,且Fc效应物功能对其治疗活性是必需的。这些教导与本发明的技术相当不同,本发明的技术中促进免疫阻遏性Treg细胞的生长和活性的IL-2选择性激动剂与效应物功能缺陷性Fc蛋白部分融合,目的是增加系统暴露和优化Treg扩张。Strom和同事的其他研究教导在促进移植物耐受中使用IL2-Fc融合蛋白(Zheng,X.X.,等人,2003,Immunity,19:503-14)。在这一研究中,IL2-Fc融合蛋白在“三重疗法”中使用,其中将其与IL15-Fc受体拮抗剂和雷帕霉素组合。再次地,这些研究者教导,IL2-Fc融合蛋白必须具有Fc效应物功能以有效,且还教导,这一IL-2-Fc融合蛋白必须与两种其他分子组合以有效。
本发明提供了新的治疗剂,IL2选择性激动剂-Fc融合蛋白,其组合了IL2选择性激动剂对Treg细胞的高的分子选择性和长的循环半衰期。在开发这一分子的过程中,有惊人的和意外的发现,其揭示了对于生物活性必要的蛋白的结构元素和设计特征,并且其导致了开发满足期望的治疗特征的数种新蛋白。
发明简述
本发明提供了在IL2αβγ选择性激动剂蛋白(IL2选择性激动剂)与IgG Fc蛋白之间的融合蛋白。IL2选择性激动剂部分通过选择性地活化受体的IL2αβγ形式,从而选择性地刺激Treg,来提供治疗活性。Fc部分提供与IL-2或IL2选择性激动剂蛋白的循环半衰期相比延长的循环半衰期。Fc部分通过增加融合蛋白的分子大小到大于60,000道尔顿来增加循环半衰期,60,000道尔顿是大分子被肾的肾小球过滤的近似截止值,并通过经由新生儿Fc受体(FcRn)蛋白(结合和再循环IgG的受体)再循环融合蛋白,从而延长其循环半衰期。Fc部分还将缺乏Fc效应物功能,诸如补体依赖性细胞毒性(CDC)和抗体依赖性细胞毒性(ADCC),使得融合蛋白能够选择性地活化Treg以加强Treg功能并扩大Treg数目。两种蛋白部分以如下方式融合:维持IL2选择性激动剂的稳健生物活性和使得Fc部分能够促进延长的循环半衰期并从而有效加强Treg功能和数目。Treg的这一加强将阻遏过剩的自身免疫或炎性应答,并将在治疗自身免疫病和炎性疾病中有益。本发明的蛋白可以是单体或经由Fc部分或结构域中的半胱氨酸残基的二聚体形成的二聚体(dimeric forming dimer)。
更具体地,本发明提供了融合蛋白,包含:N-末端人类IL-2变体蛋白部分、和C-末端IgG Fc蛋白部分,其中所述IL-2融合蛋白具有选择性地活化高亲和力IL-2受体并因而选择性地活化人类调节性T细胞的能力。IL-2的变体包括相对于人类IL2蛋白(SEQ ID NO:1)具有选自由以下组成的组的取代的那些变体:N88R、N88I、N88G、D20H、Q126L和Q126F。此外,IL-2变体蛋白任选地包含具有取代C125S的人类IL-2。优选地,本发明的蛋白是融合的,其中IL-2变体蛋白和IgG Fc蛋白二者具有N-末端和C-末端,且其中所述人类IL-2变体蛋白在其C-末端被融合至IgG Fc蛋白的N-末端。还优选地,IL-2变体结构域和Fc结构域经由位于IL-2变体蛋白部分和IgG Fc蛋白部分之间的接头肽连接或融合。IgG Fc蛋白部分或结构域将优选地缺乏Fc效应物功能或包含减少融合蛋白的Fc部分的效应物功能的一个或更多个氨基酸取代。
本发明的一个实例是蛋白,所述蛋白包含:相对于人类IL-2(SEQ ID NO:1)具有氨基酸取代N88R和C125S的IL-2变体蛋白、SEQ ID NO:15中所列的接头肽、和SEQ ID NO:2中所列的人类IgG1Fc蛋白,其中所述融合蛋白具有选择性地活化高亲和力IL-2受体并因而选择性地活化人类调节性T细胞的能力。本发明的可选的蛋白包含:相对于人类IL-2(SEQ ID NO:1)具有氨基酸取代N88R和C125S的IL-2变体蛋白、SEQ ID NO:15中所列的接头肽、和SEQ ID NO:3中所列的人类IgG2Fc蛋白。
本发明的更具体实施方案是包含两个相同的链的二聚体蛋白,其中每条链包含N-末端人类IL-2变体蛋白部分和C-末端IgG Fc蛋白部分,其中:N-末端人类IL-2变体蛋白部分具有N-末端和C-末端,以选自由以下组成的组的至少一种取代不同于SEQ ID NO:1中的人类IL-2野生型的:N88R、N88I、N88G、D20H、Q126L和Q126F,与序列ID No.1具有97%序列同一性;且,具有通过结合Treg细胞上的IL2Rαβγ活化那些细胞的能力;N-末端人类IL-2变体蛋白在其C-末端连接到6至20个之间氨基酸残基的氨基酸接头的N-末端,其中所述接头还具有C-末端;且,氨基酸接头的C-末端连接于与例如SEQ ID NO:3(IgG2)或SEQ ID No.2(IgG1N297A)具有97%序列同一性且包含半胱氨酸残基的IgG Fc蛋白部分的N-末端;且其中两条链经由半胱氨酸残基彼此连接,所述半胱氨酸残基形成IgG Fc蛋白部分的链间二硫键。本发明的二聚体可在IL-2部分的C125S处被进一步取代。本发明的蛋白优选地包含由甘氨酸残基、丝氨酸残基、和甘氨酸和丝氨酸残基的混合物的组组成的氨基酸接头。接头可包含12至17个丝氨酸残基和甘氨酸残基的混合物,优选地甘氨酸残基与丝氨酸残基的比率在3:1-5:1的范围中,例如4:1比例。
本发明还提供了在包含药学上可接受的载体的药物组合物中的以上组合物。
本发明还提供了编码本文描述的蛋白的核酸。核酸优选地可操作地连接于表达盒,所述表达盒可被设计用于与宿主细胞基因组重组或被引入独立复制质粒或染色体外核酸。
本发明还提供了在有相应需要的患者中选择性地活化人类调节性T细胞的方法,该方法包括以治疗有效剂量施用包含所描述的组合物的药物组合物,直到人类调节性T细胞浓度达到期望水平。
测量人类血液样品中Treg细胞的数目的方法,通过将人类血细胞与以1nM与0.01nM之间的浓度的权利要求1所述的融合蛋白接触,和然后通过流式细胞术检测结合该蛋白的细胞。
附图简述
图1是单剂量的IL-2或具有增加的半衰期的IL2-Fc融合蛋白后,循环半衰期、峰值药物水平、生物有效浓度、和刺激Treg细胞增殖必需的持续时间之间的关系的示意图。虚线代表皮下注射后IL-2随时间的血液水平,且实线代表IL2-Fc融合蛋白随时间的血液水平。水平点线指示活化表达IL2Rαβγ和IL2Rβγ的细胞分别必需的浓度(EC50值)。双头箭头指示暴露于在刺激细胞增殖必需的EC50的IL-2的持续时间(5-6hr)。
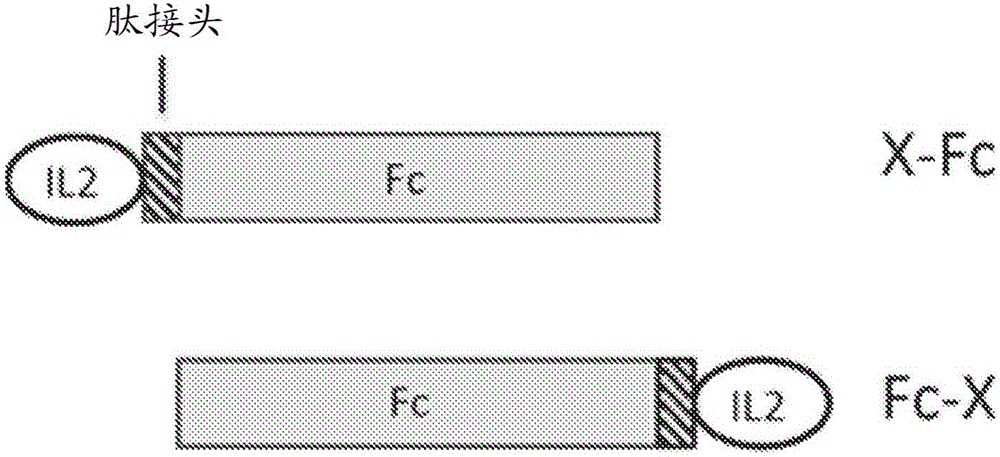
图2显示Fc融合蛋白的设计构型。融合伴侣(X),可被融合在Fc蛋白的N末端(X-Fc)或C-末端(Fc-X)。接头肽可插入在X和Fc之间。
图3显示如通过流式细胞术测量的,CD4+T细胞中IL-2和N88RL9AG1刺激的STAT5磷酸化的剂量响应。细胞在37℃用在上方所示的浓度的IL-2或N88RFc处理10分钟,固定,透化,用抗体染色,并然后经历流式细胞术分析,如实施例3中描述的。显示了被门控为CD4+的细胞,且细胞关于CD25和pSTAT5被进一步门控,如在4个象限的每个中所示的。每个象限中的数字指示每个门控中CD4+细胞的百分比。在上方象限中的细胞代表CD25表达细胞的最高1-2%,即富集Treg细胞的群体,且右边象限中的细胞是pSTAT5+。A.N88RL9AG1以高选择性仅刺激CD25高细胞,而IL-2大范围地刺激CD25-/低和CD25高细胞二者,低至皮摩尔浓度。B.D20HL0G2不具有pSTAT5刺激活性。在两个独立实验中未观察到pSTAT5活化。C.对照,显示D20H/IL2在CD25高细胞中刺激pSTAT5,而D20HL0G2不。绘图以假彩色模式展示。以10-8M的浓度测试两种蛋白。
图4显示,用N88RL9AG1处理的CD4+T细胞在表达高水平FOXP3的细胞中表现pSTAT5水平的刺激。细胞用4×10-9M IL-2或N88RL9AG1处理和然后如实施例3中描述的分析。用N88RL9AG1处理的pSTAT5+细胞的大多数也是FOXP3+,而用IL-2处理的pSTAT5+细胞是FOXP3-和FOXP3+二者,大多数是FOXP3-。
图5显示在HEK293细胞中产生的不同Fc融合构建体的蛋白产率。蛋白在优化的瞬时表达系统中平行表达并如实施例1中描述的纯化。结果表示为来自30ml培养物的纯化蛋白的最终产率。A.N88R/IL2-Fc融合蛋白的蛋白产率随着肽接头长度增加而增加。B.wtIL2-Fc融合蛋白的产率仅被15个残基肽接头轻微增强。D20H/IL2-Fc融合蛋白的较高产率以X-Fc而非Fc-X构型获得。
图6显示IL-2生物活性对N88R/IL2-Fc融合蛋白中肽接头长度的依赖性。(A)CD25高CD4+T细胞(Treg)中的pSTAT5信号随着肽接头长度增加而增加。(B)在CD25-/低细胞中未观察到对任一种N88R/IL2-Fc蛋白显著的pSTAT5信号。10-8M IL-2内部对照的pSTAT5信号在两个小图中由黑色三角形指示。
图7显示D20H/IL2-Fc融合蛋白在人类Treg中的生物活性。D20HL15AG1的效力实质上小于N88RL15AG1的,且D20HL15AG1(X-Fc构型)和AG1L15D20H(Fc-X构型)具有相似的效力。所有三种蛋白具有15个残基的肽接头。
图8显示具有和不具有15个残基的肽接头的wt IL-2-Fc pSTAT5活性的生物活性。在Treg(A)和在CD25-/低细胞(B)二者中,IL-2生物活性仅被15个残基的肽接头中度地增强。
图9.IL-2和IL-2选择性激动剂蛋白对人类PBMC中7种不同免疫细胞类型的选择性。与wt IL-2和WTL15AG1相比,N88RL15AG1对于Treg是高度选择性的,且在多种细胞类型中显示比N88R/IL2更大的选择性。
发明详述
引言
本发明是新的治疗融合蛋白,所述融合蛋白包含三种关键蛋白元件:(1)工程化的IL-2细胞因子,其已被修饰以对Treg细胞高度选择性,(2)效应物功能缺陷性Fc蛋白,其将增加蛋白的循环半衰期,和(3)两个部分之间的接头肽,其对于融合蛋白的高生物活性是必需的。构成本发明的融合蛋白通过最初未预料到的发现开发,所述发现违反现有技术中对IL-2融合蛋白的教导,且通向这些分子的研究已经定义了对其生物和治疗活性重要的关键结构-活性关系。由本发明定义的分子将使得通过刺激阻遏自身免疫和炎症病理学的T细胞的小亚群产生的新机制,能够安全和有效地治疗自身免疫病。这种打破范例的治疗可潜在地治疗许多不同的自身免疫病。
定义
如本文使用的“与序列ID No.1至少百分比(例如97%)序列同一性”是指两个或更多个核酸或多肽的序列相同的程度。目标序列与第二序列之间跨评价窗(例如跨目标序列的长度)的同一性百分比可通过以下计算:比对序列,确定评价窗内与相同残基相对的残基(核苷酸或氨基酸)的数目,允许引入缺口以使同一性最大化,除以感兴趣的序列或第二序列(无论哪个更大)落入评价窗的残基的总数目,并乘以100。当计算实现特定同一性百分比所需的相同残基的数目时,分数将舍入到最接近的整数。同一性百分比可使用多种计算机程序计算。例如,计算机程序诸如BLAST2、BLASTN、BLASTP、Gapped BLAST等生成比对并提供感兴趣的序列之间的同一性百分比。Karlin和Altschul的算法(Karlin和Altschul,Proc.Natl.Acad.ScL USA 87:22264-2268,1990),在Karlin和Altschul,Proc.Natl.Acad.ScL USA 90:5873-5877,1993中修改,被并入到Altschul等人的NBLAST和XBLAST程序中(Altschul,等人,J.Mol.Biol.215:403-410,1990)。为了比较目的,为了获得带缺口的比对,利用Gapped BLAST,如在Altschul等人(Altschul,等人.Nucleic Acids Res.25:3389-3402,1997)中描述的。当利用BLAST和Gapped BLAST程序时,可使用各自程序的缺省参数。可使用PAM250或BLOSUM62矩阵。用于进行BLAST分析的软件可通过美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)公开获得。对于这些程序,参见具有URL全球网址的Web站点:"ncbi.nlm.nih.gov"。在特定实施方案中,使用BLAST2利用由NCBI提供的缺省参数计算同一性百分比。
“N-末端”是指与携带羧酸基的羧基末端相对的,肽或多肽的携带氨基的末端。
“C末端”是指与携带氨基的氨基末端相对的,肽或多肽的携带羧酸基的末端。
“C-末端IgG Fc蛋白部分”是指衍生自两个相同蛋白片段的融合蛋白的部分,所述两个相同蛋白片段各自具有IgG分子的两个重链的铰链区、第二恒定结构域、和第三恒定结构域,且所述C-末端IgG Fc蛋白部分由经由铰链区彼此二硫键键合的羧基末端重链组成。其在功能上定义为IgG分子与补体蛋白C1q和IgG-Fc受体(FcγR)相互作用的部分,介导补体依赖性细胞毒性(CDC)和抗体依赖性细胞毒性(ADCC)效应物功能。序列可被修饰以减少效应物功能,增加循环半衰期,和消除糖基化位点。
IL2变体
本发明的IL-2变体蛋白是IL-2αβγ选择性激动剂。在功能上它们相对于IL2Rβγ受体复合物选择性地活化IL2Rαβγ受体复合物。其衍生自野生型IL-2蛋白,所述野生型IL-2蛋白在结构上定义为与序列ID No.1的野生型IL-2具有至少95%序列同一性,在功能上由优先活化Treg细胞的能力定义。该蛋白还可在功能上由其选择性活化Treg中IL-2受体信号转导的能力定义,如由Treg细胞中与CD4+CD25-/低T细胞或NK细胞相比磷酸化STAT5蛋白的水平测量的,或由植物凝集素刺激的T细胞相对于NK细胞的选择性活化测量的。
“N-末端人类IL-2变体蛋白部分”是指衍生自如以上在结构上和在功能上定义的野生型IL-2蛋白的融合蛋白的N-末端结构域。
“C末端”是指与携带氨基的氨基末端相对,肽或多肽的携带羧酸基的末端。
Treg
“Treg”或“Treg细胞”是指调节性T细胞。调节性T细胞是一类T细胞,其阻遏其他免疫细胞的活性,并使用流式细胞术由细胞标志物表型CD4+CD25+FOXP3+定义。由于FOXP3是细胞内蛋白并要求细胞固定和透化来染色,可使用细胞表面表型CD4+CD25+CD127-用于定义活的Treg。Treg还包括多种Treg亚类,诸如tTreg(胸腺衍生的)和pTreg(外周衍生的,从外周中的幼稚T细胞分化)。所有Treg表达IL2Rαβγ受体,不产生其自身的IL-2并且生长依赖于IL-2,且本领域技术人员将认识到,两种类型将被IL2Rαβγ选择性激动剂选择性地活化。
肽接头
“肽接头”定义为位于构成融合蛋白的两个蛋白之间,使得肽接头不衍生自任一伴侣蛋白的氨基酸序列。肽接头被掺入融合蛋白中作为间隔物,以促进正确的蛋白折叠和组分蛋白部分的稳定性,以改进蛋白表达,或以使得两种融合伴侣的更好的生物活性成为可能(Chen,等人,2013,Adv Drug Deliv Rev.65(10):1357-69)。肽接头可分为非结构化柔性肽或刚性结构化肽的类别。
Fc融合蛋白
“Fc融合蛋白”是通过重组DNA技术制造的蛋白,其中哺乳动物IgG蛋白的Fc结构域的翻译阅读框被融合到另一蛋白("Fc融合伴侣")以产生新的单个重组多肽。Fc融合蛋白通常作为二硫键连接的二聚体产生,其由位于铰链区的二硫键连接在一起。
功能活化
“生物活性”是指在定量的基于细胞的体外测定中生物活性的测量结果。
“Treg细胞的功能活化”定义为Treg中IL-2介导的响应。对于Treg细胞的功能活化的测定读出值包括pSTAT5的刺激、Treg细胞增殖、和Treg效应物蛋白的水平的刺激。
设计和构建
对于设计和构建Fc融合蛋白存在多种选项,且这些设计选项中的选择在以下展示以允许生成具有期望的生物活性和药物特征的分子。关键设计选项是:(1)IL2选择性激动剂的性质、(2)Fc蛋白部分的选择、(3)融合蛋白中融合伴侣的构型、和(4)在Fc和融合伴侣蛋白之间的连接处的氨基酸序列。
一般方法
通常,本发明的融合蛋白的制备可由本文公开的程序和由公认的重组DNA技术实现,所述公认的重组DNA技术包括例如,聚合酶链式反应(PCR)、质粒DNA的制备、用限制性酶裂解DNA、寡核苷酸的制备、DNA的连接、mRNA的分离、将DNA引入适当的细胞、转化或转染宿主、宿主的培养。另外,可以使用离液剂和熟知的电泳、离心和色谱方法分离和纯化融合分子。关于这些方法的公开内容一般参见,Sambrook等人,Molecular Cloning:A Laboratory Manual(第二版(1989);和Ausubel等人,Current Protocols in Molecular Biology,John Wiley&Sons,New York(1989)。
编码本发明融合蛋白的基因包括限制性酶消化和连接作为用于产生编码所需融合物的DNA的基本步骤。DNA片段的末端可需要在连接之前修饰,且这可通过用填充突出端、核酸酶(例如,ExoIII)缺失片段的末端部分、定点诱变或通过PCR添加新的碱基对来实现。可使用多连接子和衔接子来促进所选片段的连接。表达构建体通常以使用数轮限制性酶切、连接和大肠杆菌转化的阶段组装。适合于构建表达构建体的许多克隆载体是本领域已知的(lambda.ZAP和pBLUESCRIPT SK-1,Stratagene,LaJolla,Calif,pET,Novagen Inc.,Madison,Wis-引自Ausubel等人,1999)并且特定的选择对于本发明不是关键的。克隆载体的选择将受被选择用于将表达构建体引入宿主细胞中的基因转移系统的影响。在每个阶段结束时,可通过限制性酶切、DNA测序、杂交和PCR分析来分析所得的构建体。
定点诱变通常用于通过本领域已知的方法将特定突变引入编码本发明的融合蛋白的基因中。参见例如,美国专利申请公布2004/0171154;Storici等人,2001,Nature Biotechnology 19:773-776;Kren等人,1998,Nat.Med.4:285-290;和Calissano和Macino,1996,Fungal Genet.Newslett.43:15-16。可在本发明中使用任何定点诱变程序。存在许多可用于制备本发明的变体的商业试剂盒。
可以根据本发明使用各种启动子(转录起始调节区)。合适的启动子的选择取决于所提议的表达宿主。可以使用来自异源来源的启动子,只要它们在所选宿主中有功能。
可以使用各种信号序列来促进本文所述的蛋白的表达。选择或设计信号序列用于有效分泌并且也可以使用表达宿主中的加工。与TCR编码序列或小鼠IL-2编码序列同源的信号序列可用于哺乳动物细胞。其它合适的信号序列/宿主细胞对包括用于在枯草芽孢杆菌(B.subtilis)中分泌的枯草芽孢杆菌sacB信号序列和用于巴斯德毕赤酵母(P.pastoris)分泌的酿酒酵母(Saccharomyces cerevisiae)α-交配因子或巴斯德毕赤酵母酸性磷酸酶phoI信号序列。信号序列可以通过编码信号肽酶裂解位点的序列直接连接到蛋白编码序列,或通过短核苷酸桥连接。
已经鉴定了用于真核蛋白表达系统的用于增强转录和翻译的元件。例如,将花椰菜花叶病毒(CaMV)启动子1000bp放置在异源启动子的任一侧可在植物细胞中将转录水平提高10至400倍。表达构建体还应包括合适的翻译起始序列。修饰表达构建体以包括用于正确翻译起始的Kozak共有序列可将翻译水平增加10倍。
将表达盒连接到与正在使用的宿主相容的合适载体。载体必须能够适应编码待表达的融合蛋白的DNA序列。合适的宿主细胞包括真核和原核细胞,优选地可容易地被转化并在培养基中表现出快速生长的那些细胞。特别优选的宿主细胞包括原核细胞如大肠杆菌(E.coli)、枯草芽孢杆菌等,以及真核细胞如动物细胞和酵母菌株,例如酿酒酵母。通常优选哺乳动物细胞,特别是HEK、J558、NSO、SP2-O或CHO。其它合适的宿主包括例如昆虫细胞例如Sf9。使用常规培养条件。参见Sambrook,上文。然后可以选择稳定的转化或转染的细胞系。体外转录-翻译系统也可以用作表达系统。
可以通过用于转染细胞的标准技术将编码期望的融合蛋白的核酸引入宿主细胞。术语“转染(transfecting)”或“转染(transfection)”旨在包括将核酸引入宿主细胞的所有常规技术,包括磷酸钙共沉淀、DEAE-葡聚糖介导的转染、脂质转染、电穿孔、显微注射、病毒转导和/或整合。用于转染宿主细胞的合适方法可见于Sambrook等人,上文和其他实验室教科书。
可选地,人们可使用合成基因构建用于本文所述的蛋白的全部或部分构建。这要求体外合成设计的编码感兴趣的多肽分子的多核苷酸分子。基因合成可以使用多种技术进行,诸如Tian等人描述的基于多重微芯片的技术(Tian,等人,Nature 432:1050-1054)和其中合成寡核苷酸并在光可编程微流体芯片(photo-programmable microfluidic chip)上组装的类似技术。
本发明的融合蛋白从收获的宿主细胞或从培养基分离。使用标准蛋白纯化技术从培养基或从收获的细胞分离感兴趣的蛋白。特别地,纯化技术可用于从多种方法大规模(即至少毫克量)表达和纯化期望的融合蛋白,所述方法包括滚瓶、旋转瓶、组织培养板、生物反应器或发酵罐。
IL2选择性激动剂部分
具有取代N88R的IL-2是IL2Rαβγ受体的IL2选择性激动剂的示例性情况(Shanafelt,A.B.,等人,2000,Nat Biotechnol.18:1197-202)。IL2/N88R缺乏与IL2Rβ受体亚基和IL2Rβγ受体复合物的结合,但能够与wt IL-2一样有效地与IL2Rαβγ受体复合物结合并刺激表达IL2Rαβγ的PHA活化的T细胞的增殖,尽管表现出刺激表达IL2Rβγ的NK细胞增殖的能力降低3,000倍。具有相似活性谱的其他IL2Rαβγ选择性激动剂包括具有取代N88I、N88G和D20H的IL-2,且具有取代Q126L和Q126F(与IL2RG亚基的接触残基)的其它IL2变体也具有IL2Rαβγ选择性激动剂活性(Cassell,D.J.,等人,2002,Curr Pharm Des.,8:2171-83)。本领域技术人员将认识到,这些IL2选择性激动剂分子的任一种可以取代IL2/N88R部分,期望Fc融合蛋白将具有相似的活性。所有上述突变可以在wt IL-2或具有取代C125S的wt IL-2的背景下进行,取代C125S是通过消除未配对的半胱氨酸残基而促进IL-2稳定性的取代。本发明还可以与改善生产或稳定性而不显着影响IL-2受体活化活性的其它突变或截短一起使用。
本发明的变体任选地包括应用于氨基酸和核酸序列的保守取代的变体。关于特定核酸序列,保守修饰的变体是指编码相同或基本相同的氨基酸序列的那些核酸,或当所述核酸不编码氨基酸序列时,指基本相同的序列。具体地,简并密码子取代可以通过产生其中一个或更多个选择的(或所有)密码子的第三位置被混合的碱基和/或脱氧肌苷残基取代的序列来实现(Batzer等人.,Nucleic Acid Res.19:5081(1991);Ohtsuka等人,J.Biol.Chem.260:2605-2608(1985);Rossolini等人,Mol.Cell.Probes 8:91-98(1994))。由于遗传密码的简并性,大量功能相同的核酸编码任何给定的蛋白。例如,密码子GCA、GCC、GCG和GCU都编码氨基酸丙氨酸。因此,在其中丙氨酸被密码子指定的每个位置处,该密码子可被更改为所描述的不改变编码的多肽的相应密码子中的任一个。此类核酸变异是沉默变异,其是一种类型的保守修饰的变异。本文的编码多肽的每个核酸序列也描述核酸的每个可能的沉默变异。技术人员将认识到,核酸中的每个密码子(除了AUG和TGG之外,AUG通常是甲硫氨酸的唯一密码子,TGG通常是色氨酸的唯一密码子)可被修饰以产生功能上相同的分子。因此,编码多肽的核酸的每个沉默变异隐含在每个所述序列中。
对于氨基酸序列的保守取代,技术人员将认识到,改变、添加或缺失编码的序列中的单个氨基酸或小百分比的氨基酸的对核酸、肽、多肽或蛋白序列的单独的取代、缺失或添加是保守修饰的变体,其中改变导致氨基酸取代为化学上相似的氨基酸。提供功能相似的氨基酸的保守取代表是本领域公知的。此类保守修饰的变体是本发明的多态变体、种间同源物和等位基因以外的但不排除本发明的多态变体、种间同源物和等位基因。
以下组各自含有彼此保守取代的氨基酸:
1)丙氨酸(A)、甘氨酸(G);
2)丝氨酸(S)、苏氨酸(T);
3)天冬氨酸(D)、谷氨酸(E);
4)天冬酰胺(N)、谷氨酰胺(Q);
5)半胱氨酸(C)、甲硫氨酸(M);
6)精氨酸(R)、赖氨酸(K)、组氨酸(H);
7)异亮氨酸(I)、亮氨酸(L)、缬氨酸(V);和
8)苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W)。
FC蛋白部分
关键的设计选择是Fc蛋白部分的性质。Fc融合蛋白的主要治疗应用是(1)赋予融合伴侣蛋白免疫球蛋白Fc效应物功能;或(2)增加融合伴侣蛋白的循环半衰期(Czajkowsky,等人,2012,EMBO Mol Med.4:1015-28)。IgG蛋白的主要效应物功能是分别由Fc结合补体蛋白C1q和IgG-Fc受体(FcγR)介导的功能,即补体依赖性细胞毒性(CDC)和抗体依赖性细胞毒性(ADCC)。当治疗性蛋白用于引导或增强对特定抗原靶或细胞的免疫应答时,这些效应物功能是重要的。本发明的融合蛋白仅设计用于增加IL2选择性激动剂部分的循环半衰期,并且效应物功能是不需要的,甚至可以是有毒的,因此是明确不希望的。例如,具有效应物功能充足的Fc的IL2选择性激动剂-Fc融合蛋白可潜在地杀死本发明的融合蛋白正试图激活和扩增的Treg细胞,与自身免疫病的治疗目标完全相反。存在四种在效应物功能(CDC、ADCC)、循环半衰期和稳定性方面不同的人类IgG亚类(Salfeld,J.G.,2007,Nature Biotechnology 25:1369-72)。IgG1具有Fc效应物功能,是最丰富的IgG亚类,并且是美国FDA批准的治疗性蛋白质中最常用的亚类。IgG2缺乏Fc效应物功能,但是与其它IgG2分子发生二聚化,并且由于铰链区中的二硫键的混杂(scrambling)而易于不稳定。IgG3具有Fc效应物功能,并且具有极长的刚性铰链区。IgG4缺乏Fc效应物功能,具有比其它亚类更短的循环半衰期,并且IgG4二聚体是生物化学不稳定的,因为在铰链区中仅有一个二硫键,导致不同IgG4分子之间的H链交换。技术人员将认识到,来自IgG2和IgG4的Fc蛋白部分不具有效应物功能并且可以用于本发明。技术人员还将认识到,在本领域中已经描述了,使得IgG2Fc的铰链区可以被修饰以防止聚集,或者IgG4Fc的铰链区可以被修饰以稳定二聚体的Fc序列修饰。可选地,已产生IgG1的效应物功能缺陷变体。一个这样的变体在N297位置(N-连接的糖基化位点的位置)具有氨基酸取代。该天冬酰胺残基的取代去除糖基化位点并显著降低ADCC和CDC活性(Tao,M.H.,等人,1989,J Immunol.143:2595-2601)。该变体被用作本文中的发明中的示例性情况。另一种效应物功能缺陷型IgG1变体是IgG1(L234F/L235E/P331S)(Oganesyan,等人,2008,Acta Crystallogr D Biol Crystallogr.64:700-4),其突变C1q和FcγR结合位点中的氨基酸,并且本领域技术人员将考虑使用这些或类似的Fc变体来产生效应物缺陷和稳定的IL2SA-Fc融合蛋白。本领域技术人员还将认识到,被改造为稳定的单体而非二聚体的Fc蛋白部分的形式(Dumont,J.A.,等人,2006,BioDrugs 20:151-60;Liu Z,等人,J Biol Chem.2015 20;290:7535-62)也可以与本发明的IL-2选择性激动剂组合。此外,技术人员将认识到,包括与Fc H链多肽组合的IL-2-Fc H链多肽并使用双特异性抗体技术组装的功能性单体异二聚体(Zhu Z等,1997 Protein Sci.6:781-8)也可以与本发明的IL-2选择性激动剂组合。已经用完整的IgG抗体分子制备了一些IL-2Fc融合蛋白,在IgG部分中具有(Penichet,M.L.,等人,1997,Hum Antibodies.8:106-18)或不具有(Bell,等人,2015,J Autoimmun.56:66-80)抗原特异性。此外,技术人员将认识到,缺少一些或所有铰链区的Fc变体可以用于本发明。
Fc融合蛋白可以以两种构型制备,在本文中表示为X-Fc和Fc-X,在X-Fc中融合伴侣蛋白X位于N末端且Fc位于C末端,在Fc-X中Fc在N末端,且融合伴侣蛋白在C末端(图2)。文献中有一些实例表明,不同的融合伴侣可对N或C末端Fc融合有不同的偏好。例如,已经显示FGF21对Fc-X构型具有强烈的偏好。Fc-FGF21具有与FGF21本身基本相同的受体激活生物活性,而FGF21-Fc具有1000倍降低的生物活性(Hecht,等人,2012,PLoS One.7(11):e49345)。已经为了各种应用制备了许多IL-2Fc融合蛋白,并且已经报道了这些蛋白以Fc-X(Gillies,等人,1992,Proc Natl Acad Sci,89:1428-32;Bell,等人,2015,J Autoimmun.56:66-80)和X-Fc(Zheng,X.X.,等人,1999,J Immunol.163:4041-8)构型直接与Fc融合时具有良好的IL-2生物活性。Gavin,等人(US 20140286898A1)描述了呈Fc-X构型的包含IL-2和某些IL-2变体的Fc融合蛋白,其具有与游离IL-2细胞因子类似的生物活性,但是与之相比,Zheng等人的结果相反(Zheng,X.X.,等人,1999,J Immunol.1999,163:4041-8)发现,呈X-Fc构型的IL-2变体融合蛋白具有降低的生物活性或无生物活性。因此,Gavin等人通常教导远离N-末端IL-2Fc融合蛋白。影响融合蛋白构型选择的另一个因素是对循环半衰期的影响。文献中的重复发现是,呈Fc-X构型的IL-2融合蛋白具有相对低的循环半衰期,远低于人类IgG1在人类中的21天半衰期或当前FDA-批准的Fc融合蛋白的半衰期(表I)。已报道呈Fc-X构型的IgG-IL2融合蛋白具有相对短的循环半衰期,在小鼠中大约为数小时(Gillies S.D.,2002 Clin Cancer Res.,8:210-6;Gillies,S.D.,US 2007/0036752 A2;Bell C.J.,2015J Autoimmun.56:66-80)和在人类中大约为3.3小时(Ribas A.,J 2009 Transl Med.7:68)和3.7小时(King D.M,2004 J Clin Oncol.,22:4463-73),且据报道Fc-IL2融合蛋白在小鼠中具有12.5小时的循环半衰期(Zhu E.F.,Cancer Cell.2015,13;27(4):489-501)。Fc部分的C末端和IL-2部分之间的蛋白水解促成短的循环半衰期(Gillies S.D.,2002 Clin Cancer Res.,8:210-6;Zhu E,F.,2015 Cancer Cell.27:489-501)。由于这些相对短的半衰期,我们已经集中在呈X-Fc构型的IL2选择性激动剂Fc融合蛋白。
接头
在Fc和融合伴侣蛋白之间的连接处的氨基酸序列可以是(1)两个蛋白序列的直接融合,或(2)具有介于其间的接头肽的融合。在目前由美国FDA批准用于临床使用的10种Fc融合蛋白(表I)中,8种是融合伴侣蛋白与Fc的直接融合,而2种具有接头肽,因此许多Fc融合蛋白可以是有功能的而无接头肽。连接肽被包括作为两个蛋白部分之间的间隔物。接头肽可促进正确的蛋白折叠和组分蛋白部分的稳定性,改进蛋白表达,和使得组分蛋白部分的更好的生物活性成为可能(Chen,等人,2013,Adv Drug Deliv Rev.65:1357-69)。在许多融合蛋白中使用的肽接头被设计为非结构化柔性肽。对天然蛋白中独立结构域之间的接头肽的长度、序列和构象的研究为柔性肽接头的设计提供了理论基础(Argos,1990,J Mol Biol.211:943-58)。Argos提供了指导:长的柔性接头肽包括小的非极性残基如甘氨酸和小的极性残基如丝氨酸和苏氨酸,多个甘氨酸残基使得能够形成高度柔性的构象,且丝氨酸或苏氨酸提供极性表面积以限制肽内或与组分融合蛋白部分的疏水相互作用。文献中描述的许多肽接头富含甘氨酸和丝氨酸,例如序列GGGGS的重复,尽管本领域技术人员将认识到,也可使用遵循Argos的一般性建议(Argos,1990,J Mol Biol.20;211(4):943-58)的其它序列。例如,本文所述的蛋白之一含有包括甘氨酸和丙氨酸的接头肽(SEQ ID NO 15)。具有完全延伸的β-链构象的柔性接头肽将具有每个残基约3.5埃的端对端长度。因此,5、10、15或10个残基的接头肽将分别具有17.5埃、35埃、52.5埃或70埃的最大完全延伸长度。肽接头的最大端对端长度也可以是用于限定本发明中肽接头的特征的指导。本发明中接头肽的目标是使得能够获得单独融合蛋白部分的适当构象和取向,以允许IL-2选择性激动剂部分与其同源受体啮合,并允许Fc部分结合到FcRn以使融合蛋白再循环和延长的循环半衰期。由于影响这些相互作用的因素难以预测,所以对接头肽的要求和适当长度必须以经验地测试和确定。许多Fc融合蛋白不需要接头肽,如由表I中列出的10种美国FDA批准的Fc融合蛋白中的缺少这种肽的8种所证明的。相比之下,GLP-1和Fc的融合体Dulaglutide含有15个残基的肽接头,其对生物活性具有强烈影响(Glaesner,美国专利7,452,966 B2)。本领域对IL-2-Fc融合蛋白的先前研究表明,接头肽对于生物活性不是必需的。已报道以Fc-X方向含有wt IL-2或具有取代C125S的IL-2的IL-2融合蛋白具有与游离IL-2细胞因子类似的IL-2生物活性,其不具有(Gillies,等人,1992,Proc Natl Acad Sci,89:1428-32;Gavin,等人,美国专利申请20140286898 A1)或具有(Bell,等人,2015,J Autoimmun.56:66-80)肽接头。在X-Fc方向,Zheng等人报道了呈X-Fc构型的IL-2融合蛋白的IL-2生物活性,其基本上与IL-2本身不可区分(Zheng,X.X.,等人.,1999,J Immunol.1999,163:4041-8)。这种广泛的现有技术教导,IL-2蛋白与Fc的融合将不需要接头肽以具有高IL-2生物活性。然而,Gavin等人报道,含有具有改变的受体选择性的某些IL-2变体的X-Fc构象的Fc融合蛋白在没有肽接头或具有5个残基的肽接头的情况下具有降低的生物活性或无生物活性(Gavin等人,美国专利申请20140286898A1)。
生物测定
稳健的和定量的生物测定对于候选蛋白的生物活性的表征是必需的。这些测定应测量IL2受体的活化,测量Treg中活化的下游功能性后果,并测量活化的Treg的治疗相关结果和功能。这些测定可用于测量IL2选择性激动剂分子的治疗活性和效力,并且还可用于测量动物或人中IL2选择性激动剂的药效学。一种测定测量信号转导蛋白STAT5的磷酸化,用对磷酸化蛋白(pSTAT5)特异的抗体的流式细胞术测量。STAT5磷酸化是IL-2信号转导途径中的必要步骤。STAT5对于Treg发育是必需的,并且在CD4+CD25+细胞中表达的组成型活化形式的STAT5足以在IL-2的不存在下产生Treg细胞(Mahmud,S.A.,等人,2013,JAKSTAT 2:e23154)。因此,Treg细胞中磷酸化的STAT5(pSTAT5)的测量将被本领域技术人员认为是这些细胞中IL-2活化的反映,并且将预测在适当暴露时间和条件给予的IL-2治疗的其他生物学结果。另一种用于功能活化的测定测量IL-2刺激的Treg细胞增殖。本领域技术人员将认识到,Treg增殖可以通过以下测量:将氚化胸苷掺入纯化的Treg细胞中,通过流式细胞术测量的混合细胞群中Treg细胞数量的增加,以及CD4+CD25+FOXP3+或CD4+CD25+CD127-标志物表型的频率,通过Treg细胞中增殖相关细胞周期蛋白(诸如Ki-67)的增加的表达,或通过由流式细胞术测量Treg细胞中活体荧光染料诸如羧基荧光素琥珀酰亚胺酯(CFSE)的细胞分裂相关稀释度。用IL-2功能性活化Treg的另一种测定是Treg的增加的稳定性。pTreg细胞被一些人认为是不稳定的,并且具有分化成Th1和Th17效应物T细胞的潜力。IL-2活化Treg可以稳定Treg并防止这种分化(Chen,Q.,等人,2011,J Immunol186:6329-37)。IL-2刺激Treg的另一个结果是刺激Treg功能性效应物分子诸如CTLA4、GITR、LAG3、TIGIT、IL-10、CD39和CD73的水平,其有助于Treg的免疫抑制活性。
为了开发IL2选择性激动剂Fc蛋白,我们最初集中在呈X-Fc构型的蛋白,因为已经报道了呈Fc-X构型的IL-2融合蛋白的短循环半衰期。产生和测试的前两种蛋白(一种具有接头肽且一种没有接头肽)意外地显示,具有肽接头的蛋白具有IL-2生物活性,并且没有肽接头的蛋白没有可检测的生物活性。两种蛋白都显示出对IL2RA的高结合亲和力,表明两种蛋白均被正确折叠。这些结果表明,接头肽是IL-2受体活化和生物活性所必需的。然后产生一系列另外的类似物以消除其它变量并测试该假设。这些研究的结果导致发现这种治疗性蛋白的关键结构-活性关系,并产生具有所需活性和药物属性的新分子。
配制
本发明的融合蛋白的药物组合物被定义为根据常规方法配制用于胃肠外(特别是静脉内或皮下)递送。通常,药物制剂将包括本发明的融合蛋白与药学上可接受的载体诸如盐水、缓冲盐水、5%葡萄糖水溶液等组合。制剂可以还包括一种或更多种赋形剂、防腐剂、增溶剂、缓冲剂、防止小瓶表面上的蛋白损失的白蛋白等。配制方法是本领域公知的并且公开于例如,Remington:The Science and Practice of Pharmacy,Gennaro,ed.,Mack Publishing Co.,Easton,Pa.,19.sup.th ed.,1995。
作为说明,药物制剂可以作为试剂盒提供,所述试剂盒包括含有本发明的融合蛋白的容器。治疗性蛋白可以以用于单次或多次剂量的可注射溶液的形式、作为在注射前重构的无菌粉末、或作为预填充注射器提供。这样的试剂盒还可包括关于药物组合物的适应症和用法的书面信息。此外,这样的信息可以包括本发明的融合蛋白在已知对本发明的融合蛋白过敏的患者中禁忌的陈述。
本发明的IL-2选择性激动剂融合蛋白可以掺入组合物,包括药物组合物中。这样的组合物通常包括蛋白和药学上可接受的载体。如本文所用的,术语“药学上可接受的载体”包括但不限于与药物施用相容的盐水、溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。补充的活性化合物(例如,抗生素)也可掺入组合物中。
将药物组合物配制成与其预期的施用途径相容。本发明的IL-2选择性激动剂融合蛋白可能通过胃肠外途径施用。肠胃外施用途径的实例包括例如静脉内、皮内和皮下。用于肠胃外施用的溶液或悬浮液可包括以下组分:无菌稀释剂,例如注射用水、盐水溶液、聚乙二醇、甘油、丙二醇或其它合成溶剂;抗细菌剂如苄醇或对羟基苯甲酸甲酯;抗氧化剂如抗坏血酸或硫酸氢钠;螯合剂诸如乙二胺四乙酸;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐;和用于调节张力的试剂如氯化钠或葡萄糖。可以用酸或碱诸如磷酸二氢钠和/或磷酸氢二钠、盐酸或氢氧化钠调节pH(例如,至约7.2-7.8的pH,例如7.5)。胃肠外制剂可以包封在安瓿、一次性注射器或由玻璃或塑料制成的多剂量小瓶中。
适于注射使用的药物组合物包括无菌水溶液或分散体和用于临时制备无菌的可注射溶液或分散体的无菌粉末。对于静脉内施用,合适的载体包括生理盐水、抑菌水或磷酸盐缓冲盐水(PBS)。在所有情况下,组合物应当是无菌的,并且应当是流动的到存在易于注射性的程度。它在制造和储存条件下应该是稳定的,并且必须防止微生物例如细菌和真菌的污染作用。载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其合适的混合物的溶剂或分散介质。在分散体的情况下,可以通过使用表面活性剂,例如聚山梨醇酯或吐温来促进所需粒径的保持。通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等,可以实现防止微生物的作用。在许多情况下,优选在组合物中包含等渗剂,例如糖、多元醇如甘露醇、山梨醇、氯化钠。
无菌可注射溶液可通过以下来制备:将所需量的活性化合物根据需要与上述成分中的一种或组合一起掺入合适的溶剂中,然后过滤灭菌。通常,通过将活性化合物掺入无菌载体中制备分散体,所述无菌载体包含碱性分散介质和来自上面列举的那些的所需其它成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,其产生活性成分加上来自其先前无菌过滤的溶液的任何另外的所需成分的粉末。
在一个实施方案中,用保护IL-2选择性激动剂融合蛋白免于从体内快速消除的载体制备IL-2选择性激动剂融合蛋白,例如控释制剂,包括植入物和微囊化递送系统。可以使用生物可降解的生物相容性聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。这样的制剂可使用标准技术制备。
药物组合物可以与施用说明书一起包括在容器、包装或分配器中。
施用
本发明的融合蛋白将优选地通过胃肠外途径施用。皮下途径是优选的途径,但是也可使用静脉内、肌内和皮下施用。对于皮下或肌内途径,可以使用贮库(depot)和贮库制剂。对于某些疾病,可使用专门的给药途径。例如,对于炎性眼病,可使用眼内注射。融合蛋白可以以约0.1至10mcg/ml总体积的浓度使用,尽管可使用0.01mcg/ml至100mcg/ml范围内的浓度。
剂量的确定在本领域普通技术人员的水平内。在治疗期间每天或每周给药,或者可以另一间歇性频率给药。静脉内施用将通过快速浓注或经一至数小时的典型时间段输注。也可使用缓释制剂。通常,本发明的融合蛋白的治疗有效量是足以在治疗的状况中产生临床显著改变的量,所述临床显著改变诸如循环Treg细胞的临床显著改变、存在于患病组织内的Treg细胞的临床显著改变、或疾病症状的临床显著改变。
从细胞培养测定和动物研究获得的数据可用于配制用于人类的剂量范围。这种化合物的剂量优选在具有很少或没有毒性的循环浓度范围内,包括半最大有效浓度(EC50;即实现Treg细胞半数最大刺激的测试化合物的浓度)。剂量可根据所使用的剂型和利用的施用路径而在该范围内变动。对于本发明方法中使用的任何化合物,治疗有效剂量可最初从细胞培养测定估计。可在动物模型中配制剂量以实现包括如在细胞培养中确定的EC50的循环血浆浓度范围。此类信息可用来更精确地确定在人类中的有用的剂量。可例如通过酶联免疫吸附测定法测量血浆中的水平。
如本文定义的,IL-2选择性激动剂融合蛋白的治疗有效量(即有效剂量)取决于所选择的多肽和给药频率。例如,可施用在大约0.001至0.1mg/kg患者体重范围内的单剂量的量;在一些实施方案中,可施用约0.005、0.01、0.05mg/kg。组合物可每天一次至每周一次或更多次、或每月一次或更多次施用;包括每隔一天一次。本领域技术人员将理解,某些因素可影响有效治疗受试者所需的剂量和时机,包括但不限于疾病或紊乱的严重性、先前的治疗、受试者的一般健康状况和/或年龄、存在于患者中的Treg细胞的水平、和存在的其它疾病。此外,用治疗有效量的本发明的IL-2选择性激动剂融合蛋白治疗受试者很可能是一系列治疗。
自身免疫病
已经注意到可从本发明的治疗受益的一些疾病。然而,Treg细胞在自身免疫病中的作用是非常活跃的研究领域,并且另外的疾病将可能被鉴定为可通过本发明治疗。自身免疫病定义为其中免疫系统攻击其自身蛋白、细胞和组织的人类疾病。自身免疫病的综合列表和综述可以在The Autoimmune Diseases(Rose和Mackay,2014,Academic Press)中找到。
其他融合蛋白
因为本发明中Fc蛋白部分的目的仅仅是为了增加循环半衰期,本领域技术人员将认识到,利用本发明中发现的结构-活性关系,IL-2选择性激动剂部分可融合到其它蛋白的N-末端以实现相同的增加分子大小和降低肾清除率的目标。IL2选择性激动剂可与血清白蛋白的N末端融合(Sleep,D.,等人,2013,Biochim Biophys Acta.1830:5526-34),这两者都相对于IL-2部分增加融合蛋白的流体动力学半径,并且也被FcRN再循环。技术人员还将认识到,本发明的IL2选择性激动剂部分也可与重组非免疫原性氨基酸聚合物的N-末端融合。为此目的开发的非免疫原性氨基酸聚合物的两个实例是XTEN聚合物,A、E、G、P、S和T氨基酸的链(Schellenberger,V.,等人,2009,Nat Biotechnol.27:1186-90)),以及PAS聚合物,P、A和S氨基酸残基的链(Schlapschy,M.,等人,2007,Protein Eng Des Sel.20:273-84)。
本说明书中引用的所有出版物和专利申请通过引用并入本文,如同每个单独出版物或专利申请被具体和单独地指明通过引用并入。
虽然为了清楚理解的目的通过说明和实例相当详细地描述了前述发明,但是本领域普通技术人员将容易明白,根据本发明的教导,可以对其进行某些改变和修改,而不偏离所附权利要求的精神或范围。
实施例
以下实施例仅通过说明的方式而绝非通过限制的方式来提供。本领域技术人员将容易地认识到,多种非关键参数可被改变或修改以产生基本相似的结果。
实施例1.IL-2选择性激动剂-IgG Fc融合蛋白的克隆、表达和纯化
通过DNA合成和PCR组装构建编码N88RL9AG1的cDNA(SEQ ID NO 4)。N88RL9AG1构建体包括小鼠IgG1信号序列、具有取代N88R和C125S的成熟人类IL-2(SEQ ID NO 1)序列、9个氨基酸的接头肽序列(SEQ ID NO 15)和包含取代N297A的人类IgG1的Fc区域(SEQ ID NO 2)。N88R/IL2是IL2选择性激动剂,其具有减少的对IL2RB的结合和对IL2Rαβγ受体表达细胞的选择性激动剂活性(Shanafelt,A.B.,等人,2000,Nat Biotechnol.18:1197-202)。消除IgG1Fc上N297处的N-连接的糖基化位点降低了Fc效应物功能(Tao,M.H.,等人,1989,J Immunol.143:2595-2601)。D20HL0G2包括小鼠IgG1信号序列、具有取代D20H和C125S的IL-2(SEQ ID NO 1)和源自人类IgG2的Fc蛋白部分(SEQ ID NO 3)。已报道D20H IL-2变体具有类似于N88R的选择性激动剂活性(Cassell,D.J.,等人,2002,Curr Pharm Des.,8:2171-83)。
使用限制性位点HindIII和NotI将这些cDNA克隆到pcDNA3.1(+)(Life Technologies,Carlsbad,CA)中。将含有该构建体的纯化表达载体质粒瞬时转染到HEK293细胞中。在转染前24小时将HEK293细胞接种到摇瓶中,并使用无血清的化学成分确定的培养基培养。将DNA表达构建体瞬时转染到0.1升悬浮HEK293细胞中。24小时后,计数细胞以获得生存力和活细胞计数。在第5天收获培养物,并通过在3000×g离心15分钟使条件培养基上清液澄清。通过以下纯化蛋白:使上清液在蛋白A柱(GE Healthcare)上运行,用0.25%乙酸(pH 3.5)洗脱,用1M Tris(pH 8.0)中和洗脱的蛋白,并对30mM HEPES,pH 7,150mM NaCl透析。然后将样品无菌过滤通过0.2μm膜过滤器,并在还原和非还原条件下通过SDS PAGE分析。蛋白作为二硫键连接的二聚体迁移。使用计算的消光系数为1.11mg/ml cm-1通过吸光度确定蛋白浓度,并将等分试样保存在-80℃。
细胞因子N88R/IL2和D20H/IL2是SEQ ID NO 1的变体,并且基本上如美国专利6,955,807B1中所述在大肠杆菌中产生,除了添加另外的突变C125S以提高稳定性。
实施例2.确定N88RL9AG1和D20HL0G2的受体结合活性。
为了确定N88RL9AG1和D20HL0G2是否被正确折叠,使用Biacore T-200仪器(GE Healthcare)通过表面等离子体共振(SPR)确定它们对IL-2受体亚基IL2RA和IL2RB的亲和力。IL2RA和IL2RB细胞外结构域蛋白和IL-2蛋白(R&D Systems,Minneapolis,MN)通过NHS/EDC偶合固定在CM-5Biacore芯片上,至分别为30和484的最终RU(共振单位)值。在50μl/分钟的流速下,在范围从0.6nM至45nM的5种浓度的IL2和N88RL9AG1测量与IL2RA结合的动力学。在10μl/分钟的流速下,对于IL2在范围从16.7nM至450nM的5种浓度和对于Fc融合蛋白在范围从14nM至372nM的5种浓度测量与IL2RB结合的动力学。使用Biacore评价软件版本2.0,从动力学常数计算解离常数(Kd),假设IL-2为1:1拟合,N88RL9AG1和D20HL0G2为二价拟合。通过使用稳态结合值的Biacore评价软件计算平衡Kd值。
对于IL-2和N88RL9AG1二者检测与IL2RA的结合。N88RL9AG1的Rmax值为14.43,比IL2的Rmax值2.62高5.5倍,这与N88RL9AG1(82,916g/M)具有比IL-2(15,444g/M)更大的分子量的事实一致。IL-2的kon、koff和Kd值在从公布的SPR值预计的范围内(表II)。如通过动力学和平衡方法二者确定的,N88RL9AG1的亲和力比IL2的亲和力高约2倍。检测IL2与IL2RB的结合,Rmax为6.19。对kon、koff和Kd确定的值在文献中报道的范围内。报道的值为3.1×10-8M(IL2RA)和5.0×10-7M(IL2RB)(Myszka,D.G.,等人,1996,Protein Sci.5:2468-78);5.4×10-8M(IL2RA)和4.5×10-7(IL2RB)(Shanafelt,A.B.,等人,2000,Nat Biotechnol.18:1197-202);和6.6×10-9M(IL2RA)和2.8×10-7M(IL2RB)(Ring,A.M.,等人,2012,Nat Immunol.13:1187-95)。基本上没有检测到N88RL9AG1与IL2RB的结合,在测试的最高浓度检测到轻微的结合(Rmax=0.06),远低于基于IL2和N88RL9AG1之间的分子量差异并基于IL2RA结合结果预期的结合。还测试了D20HL0G2蛋白与IL2RA的结合,发现其具有8.3×10-9M的Kd,类似于N88RL9AG1的Kd。因此,SPR结合研究表明,N88RL9AG1和D20HL0G2蛋白二者都结合IL2RA,表明蛋白被正确折叠。
实施例3.N88RL9AG1和D20HL0G2对T细胞的生物活性。
通过测量特定T细胞子集中的磷酸化STAT5(pSTAT5)水平来确定N88RL9AG1和D20HL0G2对T细胞的生物活性。使用针对磷酸化的STAT5肽的抗体通过流式细胞术在固定和透化的细胞中测量pSTAT5的水平。Treg细胞组成性表达CD25,并且在CD25表达水平的前1%中的细胞对于Treg细胞是高度富集的(Jailwala,P.,等人,2009,PLoS One.2009;4:e6527;Long,S.A.,等人,2010,Diabetes 59:407-15)。因此,流式细胞术数据被门控到CD25高(CD25表达细胞的前1-2%)和CD25-/低组中,分别用于Treg和CD4效应物T细胞亚群。
将冷冻保存的CD4+T细胞(Astarte Biologics,Seattle,WA)解冻,在含有1%人类AB血清(Mediatech,Manassas,VA)的X-VIVO 15(Lonza,Allendale,NJ)培养基中洗涤并允许在37℃恢复2小时。然后将细胞以0.1ml以5×106个细胞/ml的浓度分配到15×75mm试管中。用不同浓度的IL-2或Fc融合蛋白在37℃处理细胞10分钟。然后将细胞用Cytofix固定缓冲液在37℃固定10分钟,在冰上用Perm Buffer III(BD Biosciences,Santa Clara,CA)透化处理30分钟,并然后洗涤。然后用抗CD4-Pacific Blue(BD Biosciences,Santa Clara,CA)、抗CD25-AF488(eBioscience,San Diego,CA)和抗pSTAT5-AF547(BD Biosciences)抗体的混合物以制造商推荐的浓度在20℃染色细胞30分钟,洗涤,并在LSRII仪器(BD Biosciences)上获得流式细胞术数据。使用Flowjo分析软件(Flowjo,Ashland,OR)分析数据。
在该测定中N88RL9AG1的结果表明,与IL-2相比,N88RL9AG1对Treg群体具有显著的选择性(图3A)。N88RL9AG1活化小于1%的CD4+细胞,对CD25高细胞具有非常强的选择性。相比之下,IL-2以40nM的浓度活化超过80%的CD4+T细胞,高比例的pSTAT5+细胞表达低水平CD25或不表达CD25。即使在测试的最低浓度4pM,1L-2仍在CD25-/低细胞和CD25高细胞中刺激显著的pSTAT5水平。
然后在CD4+T细胞pSTAT5测定中测试D20HL0G2的活性。出乎意料地,D20HL0G2在该测定中没有活性(图3B)。以10-8M D20H/IL2细胞因子(未与Fc融合的变体IL-2细胞因子)的另外的对照显示了对CD25高细胞的稳健的和选择性的pSTAT5活化(图3C)。考虑到D20HL0G2以类似于IL-2和N88RL9AG1的Kd结合IL2RA,表明其被正确折叠,对于D20HL0G2,缺乏活性是特别令人惊讶的。
为了证实由N88RL9AG1选择性活化的CD25高细胞是Treg,将活化的细胞对于pSTAT5和FOXP3(Treg细胞的另一种分子标志物)共染色。将CD4+细胞用4nM IL-2或N88RL9AG1处理,如以上对于pSTAT5染色所述的固定和透化,然后在室温用1ml FOXP3 Perm Buffer(BioLegend,San Diego,CA)处理30分钟,且然后洗涤并重悬浮于FOXP3 Perm Buffer中。用抗FOXP3-eFluor450、抗CD25-AF488(eBioscience,San Diego,CA)和抗-pSTAT5-AF547(BD Biosciences)抗体的混合物在20℃将透化细胞染色30分钟,洗涤并通过流式细胞术分析。该实验的结果表明,高比例的具有活化的STAT5(pSTAT5+细胞)的N88RL9AG1处理的细胞也表达高水平的FOXP3。该结果提供了活化的细胞对Treg细胞高度富集的进一步证据。相比之下,IL-2处理的pSTAT5+细胞是FOXP3+和FOXP3-二者的,大多数是FOXP3-细胞。
实施例4.确定对生物活性重要的结构-活性关系。
实施例3中描述的意想不到的结果表明,用N88RL9AG1而不是用D20HL0G2检测到的IL2生物活性是由于接头肽的存在。为了验证这一发现并消除其它变量(诸如Fc部分的同种型和IL-2部分中的选择性突变)的贡献,设计和产生了都使用IgG1 N297A Fc的一组类似物(表III)。
构建cDNA,并如实施例1所述表达和纯化蛋白,除了在所有构建体中缺失Fc的C-末端赖氨酸残基,并且生产细胞培养物的体积为30ml而不是100ml。以良好的产率回收所有蛋白。事实上,N88R/IL2系列分子的产率的比较表明随着肽接头长度的增加蛋白产率增加的明显趋势,其中N88RL20AG1(具有最长的肽接头)回收率比N88RL0AG1(无肽接头)高6.8倍(图5A)。含有连接肽的蛋白的产率增加的基础还不清楚,但是可能是由于表达水平增加、分泌速率增加、蛋白稳定性增加或纯化效率增加。有趣的是,WTL15AG1的产率仅略高于WTL0AG1的产率(1.8倍),相比之下与N88RL0AG1相比N88RL15AG1的产率高4.5倍。D20HL15AG1产率与N88RL15AG1产率相似,表明IL-2选择性突变对产量没有显著影响,并且这两种蛋白都具有比AG1L15D20H显著更高的产率(分别为4.3倍和3.4倍)(图5B)。总之,这些结果表明,增加肽接头长度与含有N88R/TL2的Fc融合蛋白的更高的蛋白产率相关,含有wt IL-2的Fc融合蛋白的产率对接头肽的存在敏感性低得多,且产生了呈X-Fc构型的IL-2-Fc融合蛋白。
基本上如实施例3所述,在人类T细胞pSTAT5生物测定中测试这些纯化的蛋白,除了使用人类CD3+T细胞(阴性选择)代替CD4+细胞,并且将细胞与测试蛋白孵育20分钟而不是10分钟。
来自N88R/IL2系列分子的结果显示,富集Treg的群体中的生物活性受肽接头长度显著影响(图6A)。Treg群体中的pSTAT5信号(%pSTAT5+细胞)随着肽接头长度的增加而逐渐增加。这种增加的生物活性反映在10-8M测试蛋白的最大pSTAT5信号和EC 50值(表IV)。具有最长肽接头的蛋白N88RL20AG1,显示最大pSTAT5信号相对于N88RL0AG1增加4.2倍。因为N88RL0AG1 pSTAT5信号在其最高浓度(10-8M)没有达到IL-2活化的50%,所以不可能确定含有接头肽的蛋白相对于N88RL0AG1的EC50的改善倍数。然而,基于N88RL20AG1 EC50和测试的N88RL0AG1的最高浓度,可以估计,N88RL20AG1将比N88RL0AG1表现出低>100倍的EC50。
如所预期的,在CD25-/低群体上,基本上没有任一种N88R/IL2分子的可检测活性,而在54.2%的CD25-/低细胞中10-8M IL-2刺激pSTAT5活性(图6B)。
WTL0AG1和WTL15AG1的比较显示,与N88R/IL2-Fc融合蛋白相比,接头肽对wt IL-2-Fc融合蛋白具有小得多的显著影响(图7)。在Treg亚群中,WTL0AG1和WTL15AG1都具有显著的生物活性,且事实上刺激了比IL-2高约2倍的pSTAT5磷酸化的最大水平。然而,WTL0AG1和WTL15AG1也在CD25-/低细胞中以高约10倍的浓度刺激大的pSTAT5信号。WTL1SAG1和WTL0AG1在Treg和CD25-/低细胞群体二者中显示出EC50值大约10倍的差异。
D20HL15AG1在Treg中的最大pSTAT5信号显著小于N88RL15AG1的(图8)。这表明,实施例3中用D20HL0G2缺乏任何可检测的活性部分地是由于与N88R/IL2部分相比,在Fc融合蛋白的背景中D20H/IL2部分的活性较低。AG1L15D20H的活性略高于D20HL15AG1,表明,Fc融合蛋白中的IL-2部分的构型(即,X-Fc相对Fc-X)对Treg生物活性没有重大影响。
总之,这些结果定义了最佳生物活性所必需的N88R/IL2-Fc融合蛋白的关键特征。N88R/IL2-Fc蛋白需要接头肽以获得最佳Treg生物活性,具有随着接头肽长度的增加而增加生物活性的趋势。第二,与其他人的研究一致,接头肽对含有wt IL-2的Fc融合蛋白的生物活性具有更温和的作用。对于接头肽的这些不同要求可能是N88R/IL2缺乏与IL2RB结合的事实的结果,这可能导致对于受体啮合的更严格的要求并且增加对来自Fc融合蛋白伴侣的空间阻碍的敏感性。这些结果还定义了最有效的IL2选择性激动剂-Fc融合蛋白。
实施例5.人类PBMC中IL2选择性激动剂-Fc融合蛋白的选择性
为了确定N88R/IL2-Fc融合蛋白在更广泛的生物环境中的选择性,开发了测量粗制未分级的人类PBMC中所有关键免疫细胞类型的STAT5活化的测定。通过Ficoll-Hypaque离心从正常志愿者分离人类PBMC。将106个PBMC悬浮在具有葡萄糖(Lonza)和10%FBS(Omega)的X-VIVO15培养基中,并在37℃用10-8M测试蛋白处理20分钟。然后根据制造商的说明用Foxp3/转录因子染色缓冲液组(EBIO)处理细胞。然后如实施例3所述用Cytofix缓冲液固定细胞并用Perm缓冲液III透化。然后将固定的和透化的细胞用1%FBS/PBS洗涤,并在室温在黑暗中用抗体混合物染色60分钟。然后将染色的细胞在1%FBS/PBS中洗涤,重悬于PBS中,并在Fortessa流式细胞仪(BD Biosciences)上分析。抗体混合物由以下组成:抗CD4-PerCP-Cy5.5(BD,#560650)、抗pSTAT5-AF-488(BD,#612598)、抗CD25-PE(BD,#560989)、CD56-PE-CF594(BD,#562328)、抗FOXP3-AF647(BD,#560889)、抗CD3-V450(BD,560366)和抗CD8-BV650(Biolegend,#301041)。这种染色程序使得能够监测7种关键免疫细胞类型中的pSTAT5水平。
细胞表型定义如下:Treg细胞:CD3+、CD4+、Foxp3+、CD25高、CD8-、CD56-;活化的CD4Teff细胞:CD3+、CD4+、Foxp3-、CD25高、CD8-、CD56-;CD4Teff细胞:CD3+、CD4+、Foxp3-、CD25低、CD8-、CD56-;NKT细胞:CD3+、CD4-、Foxp3-、CD25低、CD8-、CD56+;NK细胞:CD3-、CD4-、Foxp3-、CD25低、CD8-、CD56+;B细胞:CD3-、CD4-、Foxp3-、CD25低、CD8-、CD56-。
在该测定中以10-8M的浓度测试蛋白。如图9所示并总结在表V中的结果显示,与wt IL2和WTL15AG1相比,N88RL15AG1显示出显著的选择性,wt IL2和WTL15AG1两者在所有细胞群体的大部分中活化pSTAT5。N88RL15AG1在接近于wt IL-2的水平刺激Treg群体中的pSTAT5信号,不显著活化其他细胞类型,NK细胞除外。另外的分析(未显示)显示,pSTAT5+NK细胞是CD25高,其是NK-CD56亮(NK-CD56bright)细胞特有的,NK-CD56亮细胞是也具有免疫调节活性的NK细胞亚群(Poli,A,等人,2009Immunology.126(4):458-65)。用N88R/IL2时具有低水平pSTAT5信号的几种细胞类型(活化的CD4Teff细胞、CD4Teff细胞、NK T细胞和NK细胞)用N88RL15AG1时表现出没有或较低的pSTAT5信号。这些结果证明N88RL15AG1在复杂生物环境中对Treg的活性和高选择性。
表格
表I.美国FDA批准的Fc融合蛋白及其特征
表I
表II.IL-2Fc融合蛋白对IL2RA和IL2RB亚基的亲和力表II
nd:未检测到结合
表III
表IV
表V
人类PBMC中7种免疫细胞类型中pSTAT5+细胞的百分比。细胞用列标题中所示的蛋白处理和如实施例6中所述地分析。
- 还没有人留言评论。精彩留言会获得点赞!