用于过继免疫疗法的具有嵌合受体的靶向细胞毒性细胞的制作方法
相关申请
本申请要求2014年9月17日提交的pct申请号pct/cn2014/086694和2014年11月7日提交的pct申请号pct/cn2014/090578的优先权。这些申请各自的全部内容通过引用并入本文。
发明背景
使用基因转移技术,t细胞可以被遗传修饰以在其表面上稳定地表达抗体结合结构域,其赋予t细胞特异性,所述特异性独立于主要组织相容性复合体(mhc)所施加的约束。嵌合抗原受体(car)代表在t细胞(cart细胞)上表达的合成蛋白,其将抗体的抗原识别片段(例如scfv或单链可变区片段)与cd3-ζ链的胞内结构域融合。在与表达scfv的同源抗原的靶细胞相互作用时,在t细胞上表达的car可以触发导致靶细胞杀伤(也称为靶细胞裂解)的t细胞活化。当与额外的共刺激信号例如cd137或cd28的胞内结构域组合时,这些受体也能够产生增殖。然而,与正常t细胞受体(tcr)应答不同,这种增殖的一些似乎是抗原独立的(miloneetal.,2009,molther17(8):1453-64)。人工受体不完全再现由天然tcr结合到与mhc分子复合的抗原肽所产生的细胞内信号转导(brocker,2000,blood96(5):1999-2001)。在不存在高水平的细胞因子如il-2的情况下过继转移时,信号传导缺陷可以限制cart细胞的长期存活(loetal.,2010,clincancerres16(10):2769-80)。它们还具有改变的调节,其可能在一些抗癌应用中是有益的(loskogetal.,2006,leukemia20(10):1819-28),但是这些调节缺陷也导致了控制它们对也表达抗原(甚至在极低水平)的正常组织的“脱靶”活性的潜在挑战。这些“脱靶”效应是对基于car的疗法的严重限制,并且已导致在car-修饰的t细胞的早期i期评估期间可能的死亡(morganetal.,2010,molther18(4):843-51)。
因此,本领域需要用于构建克服当前基于car的治疗剂的限制的car的替代方法。本发明解决了本领域中的这种未满足的需求。
概述
在第一方面,本发明的特征在于纯化的或非天然存在的自然杀伤细胞免疫功能受体-嵌合抗原受体(nkr-car)多肽,其包含一个,两个或全部细胞外抗原结合结构域,跨膜结构域,例如nkr跨膜结构域和胞质结构域,例如nkr胞质结构域。在一个实施方案中,nkr-car多肽包含细胞外抗原结合结构域,以及以下的一个或两个:跨膜结构域,例如nkr跨膜结构域;或胞质结构域,例如nkr胞质结构域。在一个实施方案中,所述nkr-car多肽包含细胞外抗原结合结构域;跨膜结构域和nkr胞质结构域。在一个实施方案中,nkr-car多肽包含胞外抗原结合结构域,nkr跨膜结构域和胞质结构域。在一个实施方案中,nkr-car多肽包含胞外抗原结合结构域,nkr跨膜结构域和胞质结构域。
在一个实施方案中,所述nkr-car多肽包含kir-car,例如actkir-car或inhkir-car,ncr-car,例如actncr-car,slamf-car,例如inhslamf-car,fcr-car,例如,cd16-car,例如actcd16-car或cd64-car,例如actcd64-car,或ly49-car,例如actly49-car或inhly49-car。
在一个实施方案中,nkr-car多肽包含杀伤细胞免疫球蛋白样受体嵌合抗原受体(kir-car),其中kir-car包含来自kir的跨膜结构域(kir跨膜结构域)或包含来自kir的功能信号传导结构域的胞质结构域(kir胞质结构域)的一个或两者。在一个实施方案中,kir跨膜结构域包含选自以下的蛋白质的跨膜结构域:kir2ds2,kir2dl3,kir2dl1,kir2dl2,kir2dl4,kir2dl5a,kir2dl5b,kir2ds1,kir2ds3,kir2ds4,kir2ds5,kir3dl1,kir3ds1,kir3dl2,kir3dl3,kir2dp1和kir3dp1。在一个实施方案中,kir胞质结构域包含选自以下的蛋白质的功能信号传导结构域:kir2ds2,kir2dl3,kir2dl1,kir2dl2,kir2dl4,kir2dl5a,kir2dl5b,kir2ds1,kir2ds3,kir2ds4,kir2ds5,kir3dl1,kir3ds1,kir3dl2,kir3dl3,kir2dp1和kir3dp1。在一个实施方案中,kir-car进一步包含kird0结构域,kird1结构域和/或kird2结构域中的一个或多个。
在一个实施方案中,所述nkrcar多肽包含天然细胞毒性受体嵌合抗原受体(ncr-car),其中所述ncr-car包含来自ncr的跨膜结构域(ncr跨膜结构域)或包含来自ncr的功能信号传导结构域的胞质结构域(ncr胞质结构域)中的一个或两个。在一个实施方案中,ncr跨膜结构域包含选自nkp46,nkp30和nkp44的蛋白质的跨膜结构域。在一个实施方案中,其中ncr胞质结构域包含选自nkp46,nkp30和nkp44的蛋白质的功能信号传导结构域。
在一个实施方案中,nkrcar多肽包含信号传导淋巴细胞活化分子家族嵌合抗原受体(slamf-car),其中slamf-car包含来自slamf的跨膜结构域(slamf跨膜结构域)或包含来自slamf的功能信号传导结构域的胞质结构域(slamf胞质结构域)。在一个实施方案中,slamf跨膜结构域包含选自slam,cd48,cd229,2b4,cd84,ntb-a,cracc,blame和cd2f-10的蛋白质的跨膜结构域。在一个实施方案中,slamf胞质结构域包含选自slam,cd48,cd229,2b4,cd84,ntb-a,cracc,blame,和cd2f-10的蛋白质的功能信号传导结构域。
在一个实施方案中,nkrcar多肽包含fc受体嵌合抗原受体(fcr-car),其中fcr-car包含来自选自cd16或cd64的fcr的跨膜结构域或包含来自选自cd16或cd64的fcr的功能信号传导结构域的胞质结构域的一个或两者。
在一个实施方案中,nkrcar多肽包含ly49受体嵌合抗原受体(ly49-car),其中ly49-car包含来自ly49的跨膜结构域(ly49跨膜结构域)或包含来自ly49的功能信号传导结构域的胞质结构域(ly49胞质结构域)的一个或两者。在一个实施方案中,ly49跨膜结构域包含选自ly49a,ly49c,ly49h和ly49d的蛋白质的跨膜结构域。在一个实施方案中,ly49胞质结构域包含选自ly49a,ly49c,ly49h和ly49d的蛋白质的功能信号传导结构域。
在一个实施方案中,nkr-car多肽的跨膜结构域是nkr跨膜结构域,其中nkr跨膜结构域包含选自以下的蛋白质的跨膜结构域:kir2ds2,kir2dl3,nkp46,kir,ncr,slamf,fcr和ly49。在一个实施方案中,跨膜结构域包含:i)seqidno:357,358或359的氨基酸序列;ii)包含seqidno:357,358或359的氨基酸序列的至少一个,两个或三个修饰但不超过5个修饰的氨基酸序列;或iii)与seqidno:357,358或359具有95-99%序列同一性的氨基酸序列。
在一个实施方案中,nkr-car多肽的编码的跨膜结构域是跨膜结构域,例如本文所述的tcar的跨膜结构域,包含选自以下组成的组的蛋白质的跨膜结构域:tcrζ,fcrγ,fcrβ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(也称为“icos”),fcεri,cd66d,dap10,dap12,t细胞受体的α,β或ζ链,mhci类分子,tnf受体蛋白,免疫球蛋白样蛋白,细胞因子受体,整联蛋白,激活nk细胞受体,btla,toll配体受体,cd28,cd3ε,cd45,cd4,cd5,cd8(cd8α或cd8β),cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,cd154,ox40,cd2,cd7,cd27,cd28,cd30,cd40,cds,icam-1,lfa-1(cd11a/cd18),4-1bb(cd137),b7-h3,cds,icam-1,icos(cd278),gitr,baffr,light,hvem(lightr),kirds2,slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,nkg2d,nkg2c,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,pag/cbp,cd19a,和与cd83特异性结合的配体,或其任何组合。
在一个实施方案中,nkr-car多肽的胞质结构域是nkr胞质结构域,其包含选自kir2ds2,kir2dl3,nkp46,kir,ncr,slamf,fcr和ly49的蛋白质的一个或多个功能信号传导结构域。在一个实施方案中,胞质结构域包含:i)seqidno:360,361或362的氨基酸序列;ii)包含seqidno:360,361或362的氨基酸序列的至少一个,两个或三个修饰但不超过20个,10个或5个修饰的氨基酸序列;或iii)与seqidno:360,361具有95-99%序列同一性的氨基酸序列。
在一个实施方案中,nkr-car多肽的胞质结构域包含胞内信号传导结构域或衔接分子,例如dap12。在一个实施方案中,nkr-car多肽的编码的胞质结构域包含衔接分子,例如dap12或fcεrγ。在一个实施方案中,胞质结构域包含:i)编码的衔接分子包含seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86的氨基酸序列;ii)对seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86具有至少一个,两个或三个修饰但不超过20个,10个或5个修饰的氨基酸序列;或iii)与seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86具有95-99%同一性的氨基酸序列。在一个实施方案中,nkr-car包含本文所述的抗原结合结构域,cd8跨膜结构域和包含dap12的胞质结构域。
在一个实施方案中,nkr-car多肽的胞质结构域是例如本文所述的tcar的胞质结构域,其包含选自下组的蛋白质的一个或多个功能信号传导结构域:tcrζ,fcrγ,fcrβ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(也称为“icos”),fcεri,cd66d,dap10,dap12,t细胞受体的α,β或ζ链,mhci类分子,tnf受体蛋白,免疫球蛋白样蛋白,细胞因子受体,整联蛋白,激活nk细胞受体,btla,toll配体受体,cd28,cd3ε,cd45,cd4,cd5,cd8(cd8α或cd8β),cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,cd154,ox40,cd2,cd7,cd27,cd28,cd30,cd40,cds,icam-1,lfa-1(cd11a/cd18),4-1bb(cd137),b7-h3,cds,icam-1,icos(cd278),gitr,baffr,light,hvem(lightr),kirds2,slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,nkg2d,nkg2c,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,pag/cbp,cd19a,和与cd83特异性结合的配体,或其任何组合。
在一个实施方案中,nkr-car多肽还包含前导序列或信号序列,例如包含seqidno:1的氨基酸序列。在一个实施方案中,nkr-car包含跨膜结构域和细胞外抗原结合结构域,并且还包含置于所述跨膜结构域和所述细胞外抗原结合结构域之间的铰链结构域。在一个实施方案中,铰链结构域选自gs铰链,cd8铰链,igg4铰链,igd铰链,kir2ds2铰链,kir铰链,ncr铰链,slamf铰链,cd16铰链,cd64铰链和ly49铰链。在一个实施方案中,铰链结构域包含:i)seqidno:5,2,3或4的氨基酸序列;ii)包含seqidno:5,2,3或4的氨基酸序列的至少一个,两个或三个修饰但不超过5个修饰的氨基酸序列;或iii)与seqidno:5,2,3或4的氨基酸序列具有95-99%同一性的氨基酸序列。
在一个实施方案中,跨膜结构域和胞质结构域共同包含:i)seqidno:333的氨基酸413-487或seqidno:335的氨基酸386-454或seqidno:371的氨基酸序列;ii)对seqidno:333的氨基酸413-487或seqidno:335的氨基酸386-454或seqidno:371有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与seqidno:333的氨基酸413-487或seqidno:335的氨基酸386-454或seqidno:371具有95-99%同一性的氨基酸序列。
在任何前述实施方案中,nkr-car是活化性nkr-car,并且细胞外抗原结合结构域是本文,例如表4中所述的抗原结合结构域。在任何前述实施方案中,细胞外抗原结合结构域是结合间皮素的非鼠抗原结合结构域。在一个实施方案中,结合间皮素的细胞外非鼠抗原结合结构域包含结合间皮素的人或人源化抗原结合结构域。在一个实施方案中,结合间皮素的人或人源化抗原结合结构域提供于表4中。
在一个实施方案中,结合间皮素的人抗原结合结构域包含:表4中所列的任何人抗间皮素重链氨基酸序列的重链互补决定区1(hccdr1),重链互补决定区2(hccdr2)和重链互补决定区3(hccdr3);和/或表4中所列的任何人抗间皮素轻链氨基酸序列的轻链互补决定区1(lccdr1),轻链互补决定区2(lccdr2)和轻链互补决定区3(lccdr3)。在一个实施方案中,结合间皮素的人抗原结合结构域包含:重链可变区,其包含:i)表4中列出的任何人抗间皮素重链可变区的氨基酸序列;ii)对表4中所列的任何人抗间皮素重链可变区的氨基酸序列具有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与表4中所列的任何人抗间皮素重链可变区的氨基酸序列具有95-99%同一性的氨基酸序列;和/或轻链可变区,其包含:i)表4中所列的任何人抗间皮素轻链可变区的氨基酸序列;ii)对表4中列出的任何人抗间皮素轻链可变区的氨基酸序列具有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与表4中所列的任何人抗间皮素轻链可变区的氨基酸序列具有95-99%同一性的氨基酸序列。在一个实施方案中,结合间皮素的人抗原结合结构域包含:i)seqidno:230-253中任一个的氨基酸序列;ii)对seqidno:230-253中任一个具有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与seqidno:230-253中任一个具有95-99%同一性的氨基酸序列。在这样的实施方案中,nkr-car进一步包含例如跨膜和胞质结构域,其共同包含seqidno:371的氨基酸序列,具有对seqidno:371的至少一个,两个或三个修饰但不超过10个或5个修饰的氨基酸序列,或与seqidno:371具有至少95-99%序列同一性的氨基酸序列。
在第一方面,本发明的特征在于编码本文所述的自然杀伤细胞免疫功能受体-嵌合抗原受体(nkr-car)多肽的纯化的或非天然存在的核酸分子,例如包含一个,两个或全部细胞外抗原结合结构域,跨膜结构域(例如nkr跨膜结构域)和胞质结构域(例如nkr胞质结构域)。在一个实施方案中,编码nkr-car的核酸分子包含细胞外抗原结合结构域和以下的一者或两者:跨膜结构域(例如nkr跨膜结构域);或胞质结构域(例如nkr胞质结构域)。在一个实施方案中,编码nkr-car的核酸分子包含细胞外抗原结合结构域;跨膜结构域和nkr胞质结构域。在一个实施方案中,编码nkr-car的核酸分子包含胞外抗原结合结构域,nkr跨膜结构域和胞质结构域。在一个实施方案中,编码nkr-car的核酸分子包含胞外抗原结合结构域,nkr跨膜结构域和胞质结构域。
在一个实施方案中,核酸分子编码包含kir-car的nkr-car,例如actkir-car或inhkir-car,ncr-car,例如actncr-car,slamf-car,例如inhslamf-car,fcr-car,例如cd16-car,例如actcd16-car或cd64-car,例如actcd64-car或ly49-car,例如actly49-car或inhly49-car。
在一个实施方案中,编码的kir-car包含来自kir的跨膜结构域(kir跨膜结构域)或包含来自kir的功能信号传导结构域的胞质结构域(kir胞质结构域)中的一者或两者。在一个实施方案中,kir跨膜结构域包含选自以下的蛋白质的跨膜结构域:kir2ds2,kir2dl3,kir2dl1,kir2dl2,kir2dl4,kir2dl5a,kir2dl5b,kir2ds1,kir2ds3,kir2ds4,kir2ds5,kir3dl1,kir3ds1,kir3dl2,kir3dl3,kir2dp1和kir3dp1。在一个实施方案中,kir胞质结构域包含选自以下的蛋白质的功能信号传导结构域:kir2ds2,kir2dl3,kir2dl1,kir2dl2,kir2dl4,kir2dl5a,kir2dl5b,kir2ds1,kir2ds3,kir2ds4,kir2ds5,kir3dl1,kir3ds1,kir3dl2,kir3dl3,kir2dp1和kir3dp1。在一个实施方案中,kir-car进一步包含kird0结构域,kird1结构域和/或kird2结构域中的一个或多个。
在一个实施方案中,编码的ncr-car包含来自ncr的跨膜结构域(ncr跨膜结构域)或包含来自ncr的功能信号传导结构域的胞质结构域(ncr胞质结构域)中的一个或两个。在一个实施方案中,ncr跨膜结构域包含选自nkp46,nkp30和nkp44的蛋白质的跨膜结构域。在一个实施方案中,其中ncr胞质结构域包含选自nkp46,nkp30和nkp44的蛋白质的功能信号传导结构域。
在一个实施方案中,编码的slamf-car包含来自slamf的跨膜结构域(slamf跨膜结构域)或包含来自slamf的功能信号传导结构域的胞质结构域(slamf胞质结构域)中的一个或两个。在一个实施方案中,slamf跨膜结构域包含选自slam,cd48,cd229,2b4,cd84,ntb-a,cracc,blame和cd2f-10的蛋白质的跨膜结构域。在一个实施方案中,slamf胞质结构域包含选自slam,cd48,cd229,2b4,cd84,ntb-a,cracc,blame和cd2f-10的蛋白质的功能信号传导结构域。
在一个实施方案中,编码的fcr-car包含来自选自cd16或cd64的fcr的跨膜结构域或包含来自选自cd16或cd64的fcr的功能信号传导结构域的胞质结构域中的一个或两个。
在一个实施方案中,编码的ly49-car包含来自ly49的跨膜结构域(ly49跨膜结构域)或包含来自ly49的功能信号传导结构域的胞质结构域(ly49胞质结构域)中的一个或两个。在一个实施方案中,ly49跨膜结构域包含选自ly49a,ly49c,ly49h和ly49d的蛋白质的跨膜结构域。在一个实施方案中,ly49胞质结构域包含选自ly49a,ly49c,ly49h和ly49d的蛋白质的功能信号传导结构域。
在一个实施方案中,nkr-car的编码的跨膜结构域是nkr跨膜结构域,其中nkr跨膜结构域包含选自kir2ds2,kir2dl3,nkp46,kir,ncr,slamf,fcr,和ly49的蛋白质的跨膜结构域。在一个实施方案中,nkr-car的编码的跨膜结构域包含seqidno:357,358或359的氨基酸序列;包含seqidno:357,358或359的氨基酸序列的至少一个,两个或三个修饰但不超过5个修饰的氨基酸序列;或与seqidno:357,358或359具有95-99%序列同一性的氨基酸序列。在一个实施方案中,编码nkr-car的核酸分子包含核酸序列,其包含seqidno:347的核苷酸803-875,或其具有95-99%序列同一性的核酸序列,其编码跨膜结构域。
在一个实施方案中,nkr-car多肽的编码的跨膜结构域是例如如本文所述的tcar的跨膜结构域,其包含选自下组的蛋白质的跨膜结构域:tcrζ,fcrγ,fcrβ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(也称为“icos”),fcεri,cd66d,dap10,dap12,t细胞受体的α,β或ζ链,mhci类分子,tnf受体蛋白,免疫球蛋白样蛋白,细胞因子受体,整联蛋白,激活nk细胞受体,btla,toll配体受体,cd28,cd3ε,cd45,cd4,cd5,cd8(cd8α或cd8β),cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,cd154,ox40,cd2,cd7,cd27,cd28,cd30,cd40,cds,icam-1,lfa-1(cd11a/cd18),4-1bb(cd137),b7-h3,cds,icam-1,icos(cd278),gitr,baffr,light,hvem(lightr),kirds2,slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,nkg2d,nkg2c,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,pag/cbp,cd19a,和与cd83特异性结合的配体,或其任何组合。
在一个实施方案中,nkr-car的编码的胞质结构域是nkr胞质结构域,其中nkr胞质结构域包含选自kir2ds2,kir2dl3,nkp46,kir,ncr,slamf,fcr和ly49的蛋白质的一个或多个功能信号传导结构域。在一个实施方案中,编码的胞质结构域包含:i)seqidno:360,361或362的氨基酸序列;ii)包含seqidno:360,361或362的氨基酸序列的至少一个,两个或三个修饰但不超过20个,10个或5个修饰的氨基酸序列;或iii)与seqidno:360,361具有95-99%序列同一性的氨基酸序列。在一个实施方案中,编码nkr-car的核酸分子包含含有seqidno:343的核苷酸831-947,seqidno:345的核苷酸833-1060或seqidno:347的核苷酸876-949的核酸序列,或其具有95-99%序列同一性的核酸序列,其编码胞质结构域。
在一个实施方案中,nkr-car多肽的编码的胞质结构域包含胞内信号传导结构域或衔接分子,例如dap12。在一个实施方案中,nkr-car多肽的编码的胞质结构域包含衔接分子,例如dap12或fcεrγ。在一个实施方案中,编码的胞质结构域包含:i)编码的衔接分子包含seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86的氨基酸序列;ii)对seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86具有至少一个,两个或三个修饰但不超过20个,10个或5个修饰的氨基酸序列;或iii)与seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86具有95-99%同一性的氨基酸序列。在一个实施方案中,编码nkr-car的核酸分子包含核酸序列,其包含包含seqidno:332的核苷酸1-339或seqidno:334的核苷酸1-258的核苷酸,或其包含95-99%同一性的核酸序列,所述核酸编码衔接分子。在一个实施方案中,nkr-car包含本文所述的抗原结合结构域,cd8跨膜结构域和包含dap12的胞质结构域。
在一个实施方案中,nkr-car多肽的编码的胞质结构域是例如本文所述的tcar的胞质结构域,其包含选自以下的蛋白质的一个或多个功能信号传导结构域:tcrζ,fcrγ,fcrβ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(也称为“icos”),fcεri,cd66d,dap10,dap12,t细胞受体的α,β或ζ链,mhci类分子,tnf受体蛋白,免疫球蛋白样蛋白,细胞因子受体,整联蛋白,激活nk细胞受体,btla,toll配体受体,cd28,cd3ε,cd45,cd4,cd5,cd8(cd8α或cd8β),cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,cd154,ox40,cd2,cd7,cd27,cd28,cd30,cd40,cds,icam-1,lfa-1(cd11a/cd18),4-1bb(cd137),b7-h3,cds,icam-1,icos(cd278),gitr,baffr,light,hvem(lightr),kirds2,slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,nkg2d,nkg2c,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,pag/cbp,cd19a,和与cd83特异性结合的配体,或其任何组合。
在一个实施方案中,编码nkr-car的核酸分子还包含编码seqidno:1的氨基酸序列的前导序列或信号序列。
在一个实施方案中,编码的nkr-car包含通过铰链结构域连接到跨膜结构域的细胞外抗原结合结构域。在一个实施方案中,铰链结构域选自gs铰链,cd8铰链、igg4铰链,igd铰链,kir2ds2铰链,kir铰链,ncr铰链,slamf铰链,cd16铰链,cd64铰链和ly49铰链。在一个实施方案中,编码的铰链结构域包含:i)seqidno:5,2,3或4的氨基酸序列;ii)包含seqidno:5,2,3或4的氨基酸序列的至少一个,两个或三个修饰但不超过5个修饰的氨基酸序列;或iii)与seqidno:5,2,3或4的氨基酸序列具有95-99%同一性的氨基酸序列。在一个实施方案中,编码nkr-car的核酸分子包含核酸序列,其包含seqidno:356,16,13,14或15的核酸序列或其具有95-99%同一性的核酸序列,其编码铰链结构域。
在一个实施方案中,编码的跨膜结构域和编码的胞质结构域共同包含:i)seqidno:333的氨基酸413-487或seqidno:335的氨基酸386-454或seqidno:371的氨基酸序列;ii)对seqidno:333的氨基酸413-487或seqidno:335的氨基酸386-454或seqidno:371具有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与seqidno:333的氨基酸413-487或seqidno:335的氨基酸386-454或seqidno:371具有95-99%同一性的氨基酸序列。在一个实施方案中,编码nkr-car的核酸分子包含核酸序列,其包含seqidno:332的核苷酸1237-1464或seqidno:334的核苷酸1156-1365或其具有95-99%同一性的序列,其共同编码跨膜和胞质结构域。
在另一方面,本发明的特征在于核酸分子,例如纯化的或非天然存在的核酸,例如包含dna或rna序列(例如mrna)的核酸,其包含编码本文所述的nkr-car的序列。
在一个实施方案中,核酸分子还包含编码与所述nkr-car相互作用的衔接分子或胞内信号传导结构域的核酸序列。在一个实施方案中,编码的衔接分子包含dap12或fcεrγ的功能信号传导结构域。在一个实施方案中,编码的衔接分子包含seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86的氨基酸序列;对seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86具有至少一个,两个或三个修饰但不超过20个,10个或5个修饰的氨基酸序列;或与seqidno:333的氨基酸1-113或seqidno:335的氨基酸1-86具有95-99%同一性的氨基酸序列。在一个实施方案中,编码nkr-car的核酸分子包含包含seqidno:332的核苷酸1-339或seqidno:334的核苷酸1-258的核酸序列,或其包含95-99%同一性的核酸序列,其编码衔接分子。
在一个实施方案中,核酸分子还包含编码tcar或第二nkr-car的核酸序列。在一个实施方案中,编码的tcar或编码的第二nkr-car包含结合不是间皮素的靶抗原的抗原结合结构域。
在一个实施方案中,编码nkr-car的核酸分子还包含编码选自t2a,p2a,e2a和f2a的肽裂解位点的核酸序列,其中编码肽裂解位点的核酸连接编码nkr-car的核酸序列与第二核酸序列,例如编码衔接分子的核酸序列。在一个实施方案中,核酸序列编码肽切割位点,其编码seqidno:57,58,59或60的氨基酸序列;或与其具有95-99%序列同一性的氨基酸序列。
在一个实施方案中,核酸编码活化性nkr-car,编码的细胞外抗原结合结构域是本文所述的例如表4中的抗原结合结构域。在任何前述实施方案中,编码的细胞外抗原结合结构域是结合间皮素的非鼠抗原结合结构域。在一个实施方案中,结合间皮素的编码的细胞外非鼠抗原结合结构域包含结合间皮素的人或人源化抗原结合结构域。在一个实施方案中,结合间皮素的人或人源化抗原结合结构域提供于表4中。
在一个实施方案中,结合间皮素的编码的人抗原结合结构域包含:表4中所列的任何人抗间皮素重链氨基酸序列的重链互补决定区1(hccdr1),重链互补决定区2(hccdr2)和重链互补决定区3(hccdr3);和/或表4中所列的任何人抗间皮素轻链氨基酸序列的轻链互补决定区1(lccdr1),轻链互补决定区2(lccdr2)和轻链互补决定区3(lccdr3)。在一个实施方案中,结合间皮素的编码的人抗原结合结构域包含:重链可变区,其包含:i)表4中所列的任何人抗间皮素重链可变区的氨基酸序列;ii)对表4中所列的任何人抗间皮素重链可变区的氨基酸序列具有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与表4中所列的任何人抗间皮素重链可变区的氨基酸序列具有95-99%同一性的氨基酸序列;和/或轻链可变区,其包含:i)表4中所列的任何人抗间皮素轻链可变区的氨基酸序列;ii)对表4中列出的任何人抗间皮素轻链可变区的氨基酸序列具有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与表4中所列的任何人抗间皮素轻链可变区的氨基酸序列具有95-99%同一性的氨基酸序列。在一个实施方案中,结合间皮素的编码的人抗原结合结构域包含:i)seqidno:230-253中任一个的氨基酸序列;ii)对seqidno:230-253中任一个具有至少一个,两个或三个修饰但不超过30,20或10个修饰的氨基酸序列;或iii)与seqidno:230-253中任一个具有95-99%同一性的氨基酸序列。在这样的实施方案中,nkr-car进一步包含例如跨膜和胞质结构域,其共同包含seqidno:371的氨基酸序列,对seqidno:371具有至少一个,两个或三个修饰但不超过10或5个修饰的氨基酸序列或与seqidno:371具有至少95-99%序列同一性的氨基酸序列。
在另一方面,本发明的特征在于包含编码本文所述的nkr-car的核酸分子的载体。在一个实施方案中,载体是dna载体或rna载体。在一个实施方案中,载体选自质粒,慢病毒载体,腺病毒载体和逆转录病毒载体。在一个实施方案中,载体还包含编码本文所述的衔接分子或胞内信号传导结构域的核酸序列。在一个实施方案中,载体还包含本文所述的启动子,例如ef-1启动子,例如包含seqidno:11的序列。
在另一方面,本发明的特征在于细胞,例如免疫效应细胞,例如细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系,其包含本文所述的nkr-car,编码本文所述的nkr-car的核酸分子,本文所述的载体或本文所述的nkr-car复合体。
在一个实施方案中,细胞毒性细胞还包含与所述nkr-car相互作用的衔接分子或胞内信号传导结构域。
在另一方面,本发明的特征在于制备本文所述的细胞,例如包含本文所述的nkr-car的免疫效应细胞,例如细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系的方法,其包括将包含编码本文所述的nkr-car的序列的核酸(例如mrna)引入细胞毒性细胞中。在一个实施方案中,所述方法还包括在细胞毒性细胞中制备本文所述的nkr-car。在一个实施方案中,所述方法包括制备本文所述的细胞群体,例如免疫效应细胞群体,其包含本文所述的nkr-car。
在另一方面,本发明的特征在于治疗受试者的方法,例如在哺乳动物中提供抗肿瘤免疫的方法,包括对哺乳动物施用有效量的本文所述的细胞或本文所述的细胞群,例如包含本文所述的nkr-car的细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系。
在另一方面,本发明的特征在于治疗患有与肿瘤抗原(例如本文所述的肿瘤抗原)的表达相关的疾病(例如,增生性疾病,癌前状况和与肿瘤抗原的表达相关的非癌相关适应证)的受试者的方法,包括向受试者施用有效量的包含例如本文所述nkr-car的细胞。在一个实施方案中,nkr-car是活化性nkr-car,并且细胞外抗原结合结构域是本文例如在表4中所述的抗原结合结构域。在一个实施方案中,所述方法还包括施用包含例如,如本文所述tcar的细胞。
在一个实施方案中,与肿瘤抗原的表达相关的疾病是癌症,例如本文所述的癌症。在一个实施方案中,癌症是实体瘤,例如本文所述的实体瘤。
在一个实施方案中,所述疾病或病症与间皮素的表达相关,例如间皮瘤(例如,恶性胸膜间皮瘤),肺癌(例如非小细胞肺癌,小细胞肺癌,鳞状细胞肺癌或大细胞肺癌),胰腺癌(例如胰腺导管腺癌),卵巢癌,结肠直肠癌和膀胱癌,或其任何组合。在一个实施方案中,所述疾病是胰腺癌,例如转移性胰腺导管腺癌(pda),例如在至少一种在先标准治疗中进展的受试者中的胰腺癌。在一个实施方案中,所述疾病是间皮瘤(例如,恶性胸膜间皮瘤),例如在至少一种在先标准治疗进展的受试者中的间皮瘤。在一个实施方案中,所述疾病是卵巢癌,例如浆液性上皮性卵巢癌,例如在至少一种标准治疗的先前方案之后发展的受试者中的卵巢癌。
前述组合物和方法的另外的特征和实施方案包括以下的一种或多种:
在另一方面,本发明的特征在于纯化的或非天然存在的kir-car,其包含细胞外抗原结合结构域和跨膜结构域,例如kir跨膜结构域或胞质结构域,例如含有itim的胞质结构域或kir-胞质结构域。在一个实施方案中,kir-car包含细胞外抗原结合结构域,跨膜结构域和含有itim的胞质结构域或kir胞质结构域。
在一个实施方案中,所述跨膜结构域可与dap12的跨膜结构域相互作用,例如结合。在一个实施方案中,所述跨膜结构域包含带正电荷的部分,例如包含带正电荷的部分(例如侧链)的氨基酸残基。在一个实施方案中,所述跨膜结构域包含kir跨膜结构域。
在一个实施方案中,所述kir-car是活化kir-car。在一个实施方案中,所述kir-car包含kir跨膜结构域。在一个实施方案中,所述kir-car是抑制性kir-car。在一个实施方案中,所述kir-car包含kir-胞质结构域。在一个实施方案中,所述kir-car包含细胞外抗原结合结构域和跨膜结构域,例如包含带正电荷的部分的跨膜结构域,例如包含带正电荷的部分(例如侧链)的氨基酸残基,或kir跨膜结构域。
在一个实施方案中,本文所述的kir-car包含包含scfv的抗原结合结构域。在一个实施方案中,所述抗原结合结构域包含单vh结构域,例如骆驼,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列的单vh结构域,或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子。在一个实施方案中,所述抗原结合结构域包含纳米抗体。在一个实施方案中,所述抗原结合结构域包含骆驼vhh结构域。
在一个实施方案中,kir-car是活化kir-car,并且细胞外抗原结合结构域是本文,例如在表4中所述的抗原结合结构域。
在一个实施方案中,本文所述的kir-car包含胞外铰链结构域。在一个实施方案中,胞外铰链结构域不同于kir铰链结构域,例如不同于kir2ds2铰链结构域。在一个实施方案中,胞外铰链结构域来源于天然分子。在一个实施方案中,胞外铰链结构域来源于除kir之外的天然分子。在一个实施方案中,胞外铰链结构域包含非天然存在的多肽序列。在一个实施方案中,胞外铰链结构域包含来自人cd8-α的细胞外铰链。在一个实施方案中,胞外铰链结构域包含合成的细胞外铰链。在一个实施方案中,胞外铰链结构域长度小于50,20或10个氨基酸。在一个实施方案中,胞外铰链结构域具有比kir2ds2铰链结构域更少的氨基酸。
在一个实施方案中,本文所述的kir-car是actkir-car。在一个实施方案中,所述actkir-car包含跨膜结构域,其包含带正电荷的部分,例如包含带正电荷的部分的氨基酸残基,例如带正电荷的侧链或actkir跨膜结构域。在一个实施方案中,所述actkir-car可以与含有itam的多肽或衔接分子相互作用并促进其信号传导。在一个实施方案中,所述actkir-car可与dap12多肽相互作用并促进其信号传导。在一个实施方案中,所述actkir-car包含kird结构域。在一个实施方案中,所述actkir-car包含kird1结构域。在一个实施方案中,所述actkir-car包含kird2结构域。在一个实施方案中,所述actkir-car不包含kird结构域。在一个实施方案中,所述actkir-car包含kir2ds2跨膜结构域。在一个实施方案中,所述actkir-car进一步包含kir2ds2胞质结构域。在一个实施方案中,所述actkir-car不包含kird结构域。
在一个实施方案中,本文所述的kir-car的抗原结合结构域结合存在于靶细胞例如癌细胞上的抗原。在一个实施方案中,所述抗原结合结构域结合在靶细胞(例如癌细胞)上比非靶细胞(例如非癌细胞,例如与靶细胞相同类型的非癌细胞)更高水平表达的抗原。在一个实施方案中,所述抗原结合结构域结合本文所述的抗原,例如本文所述的肿瘤抗原。在一个实施方案中,肿瘤抗原在实体瘤,例如本文所述的实体瘤,例如间皮瘤(例如恶性胸膜间皮瘤),肺癌(例如非小细胞肺癌,小细胞肺癌,鳞状细胞肺癌或大细胞肺癌),胰腺癌(例如胰腺导管腺癌),卵巢癌,结肠直肠癌和膀胱癌或其任何组合上表达。
在一个实施方案中,本文所述的kir-car是inhkir-car。在一个实施方案中,inhkir-car包含inhkir跨膜结构域。在一个实施方案中,inhkir-car包含含有itim的胞质结构域,例如inhkir胞质结构域,例如kir2dl或kir3dl胞质结构域。在一个实施方案中,inhkir-car包含除kir跨膜外的跨膜,例如来自pd-1,ctla4或来自il-1(cd85)的含itim的受体,siglec,lmir(cd300)和/或slam基因家族受体的跨膜结构域。在一个实施方案中,inhkir-car包含来自除kir以外的抑制性受体的胞质结构域,例如来自pd-1,ctla4或来自t(cd85)的含itimil的受体,siglec,lmir(cd300)和/或slam基因家族受体。在一个实施方案中,inhkir-car包含来自除kir以外的抑制性受体的跨膜和胞质结构域,例如独立地来自pd-1,ctla4或来自il-1(cd85)的含itim的受体,siglec,lmir(cd300)和/或slam基因家族受体的跨膜和胞质结构域。在一个实施方案中,所述胞质结构域包含itim。在一个实施方案中,inhkir-car包含kird结构域。在一个实施方案中,inhkir-car包含kird0结构域。在一个实施方案中,inhkir-car包含kird1结构域。在一个实施方案中,inhkir-car包含kird2结构域。在一个实施方案中,inhkir-car不包含kird结构域。
在一个实施方案中,本文所述的inhkir-car的抗原结合结构域结合不存在于靶细胞例如癌细胞上的抗原。在一个实施方案中,所述抗原结合结构域结合在非靶细胞(例如非癌细胞)上比靶细胞(例如,癌细胞,例如与靶细胞相同类型的癌细胞)更高水平表达的抗原。在一个实施方案中,所述抗原结合结构域结合桥粒核心糖蛋白1/3(dsg1/3)。在一个实施方案中,提供了inhcar,例如,inhtcar或inhnkr-car,例如inhkir-car,和actcar,例如acttcar或actnkr-car,例如actkir-car,其中inhcar包含靶向桥粒核心糖蛋白1/3(dsg1/3)的抗原结合结构域并且actcar包含靶向除dsg1/3以外的抗原(例如egfr)的抗原结合结构域。在一个实施方案中,该对用于治疗表达egfr的癌症,例如肺或结肠的腺癌。在一个实施方案中,癌细胞表达比非癌细胞更少的dsg1/3。在一个实施方案中,该组合可以最小化car介导的对胃肠道(即口腔粘膜)的皮肤细胞或鳞状细胞的攻击。在一个实施方案中,所述抗原结合结构域结合肝配蛋白受体或密蛋白。
在另一方面,本发明的特征在于核酸,例如纯化的或非天然存在的核酸,例如包含dna或rna序列(例如mrna)的核酸,其包含(a)编码kir-car,例如本文所述的第一kir-car的序列。在一个实施方案中,所述kir-car,例如所述第一kir-car,是actkir-car,例如本文所述的actkir-car。在一个实施方案中,核酸编码actkir-car,编码的细胞外抗原结合结构域是本文例如在表4中所述的抗原结合结构域。在一个实施方案中,所述kir-car,例如所述第一kir-car,是inhkir-car,例如本文所述的inhkir-car。
在一个实施方案中,所述核酸包含dna序列。在一个实施方案中,所述核酸包含rna序列,例如mrna序列。
在一个实施方案中,所述核酸包含编码kir-car例如actkir-car的序列和编码抑制性分子的序列,所述抑制性分子包含:inhkir胞质结构域;跨膜结构域,例如kir跨膜结构域;和抑制剂胞质结构域,例如itim结构域,例如inhkiritim结构域。在一个实施方案中,抑制性分子是天然存在的inhkir,或与天然存在的inhkir具有至少50,60,70,80,85,90,95或99%同源性或相差不超过1,2,3,4,5,6,7,8,9,10,15,或20个残基。
在一个实施方案中,所述核酸包含编码kir-car例如actkir-car的序列和编码抑制性分子的序列,所述抑制性分子包含:slam家族胞质结构域;跨膜结构域,例如slam家族跨膜结构域;和抑制剂胞质结构域,例如slam家族结构域,例如slam家族itim结构域。在一个实施方案中,抑制性分子是天然存在的slam家族成员,或与天然存在的slam家族成员具有至少50,60,70,80,85,90,95或99%同源性或相差不超过1,2,3,4,5,6,7,8,9,10,15,或20个残基的序列。
在一个实施方案中,本文所述的核酸还包含(b)序列,其编码本文所述的第二kir-car,例如不同于所述第一kir-car的第二kir-car。在一个实施方案中,(a)和(b)设置在相同的核酸分子上,例如相同的载体,例如相同的病毒载体,例如慢病毒载体上。在一个实施方案中,(a)和(b)之一设置在第一核酸分子,例如第一载体,例如病毒载体,例如慢病毒载体上,另一个置于第二核酸分子,例如第二载体,例如病毒载体,例如慢病毒载体上。在一个实施方案中,所述第一kir-car和所述第二kir-car是actkir-car。在一个实施方案中,单独的任一kir-car的衔接不足以引发实质水平的激活。在一个实施方案中,第一和第二actkir-car的衔接给出了累加的或协同的活化水平。在一个实施方案中,所述第一kir-car和所述第二kir-car是inhkir-car。在一个实施方案中,所述第一kir-car和所述第二kir-car中的一种是actkir-car,另一种是inhkir-car。在一个实施方案中,所述actkir-car是本文所述的actkir-car。在一个实施方案中,所述inhkir-car是本文所述的inhkir-car。在一个实施方案中,本文所述的核酸包含本文所述的actkir-car和本文所述的inhkir-car。
在一个实施方案中,核酸还包含(c)编码胞内信号传导结构域的序列,例如衔接分子,其可以产生激活信号。在一个实施方案中,所述胞内信号传导结构域包含itam基序。在一个实施方案中,所述序列编码包含dap12胞内信号传导结构域的dap12多肽。在一个实施方案中,所述dap12多肽还包含跨膜结构域。在一个实施方案中,所述dap12多肽还包含胞外结构域。在一个实施方案中,(a),(b)和(c)中的每一个存在于相同的核酸分子,例如载体,例如病毒载体,例如慢病毒载体上。在一个实施方案中,(a),(b)和(c)之一编码在第一核酸分子例如载体,例如病毒载体,例如慢病毒载体上并且(a),(b)和(c)的第二和第三个编码在第二核酸分子,例如载体,例如病毒载体,例如慢病毒载体上。在一个实施方案中,(a)存在于第一核酸分子,例如载体,例如病毒载体,例如慢病毒载体上,并且(b)和(c)存在于第二核酸分子,例如载体,例如病毒载体,例如慢病毒载体上。在另一个实施方案中,(b)存在于第一核酸分子,例如载体,例如病毒载体,例如慢病毒载体上,并且(a)和(c)存在于第二核酸分子,例如载体,例如病毒载体,例如慢病毒载体。在一个实施方案中,(c)存在于第一核酸分子,例如载体,例如病毒载体,例如慢病毒载体上,并且(b)和(a)存在于第二核酸分子,例如载体,例如病毒载体,例如慢病毒载体上。在一个实施方案中,(a),(b)和(c)中的每一个存在于不同的核酸分子上,例如不同的载体,例如病毒载体,例如慢病毒载体上。
在一个实施方案中,(i)所述第一kir-car和所述第二kir-car之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域,(ii)所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,并且另一个不同于scfv,(iii)当存在于细胞表面时,所述第一kir-car和所述第二kir-car的抗原结合结构域相互结合,比两者都是scfv抗原结合结构域时更少,(iv)其中,当存在于细胞表面时,所述第一kir-car的抗原结合结构域与其同源抗原的结合不由于所述第二kir-car的存在而显著减少,(v)所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含单vh结构域,例如骆驼科动物,鲨鱼或七鳃鳗单vh结构域或来源于人或小鼠序列,或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vi)所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个包含单vh结构域,例如骆驼,鲨鱼或七鳃鳗单vh结构域,或源自人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vii)所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,以及另一个包含纳米抗体,或(viii)所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个包含骆驼科vhh结构域。
在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个不是scfv。在一个实施方案中,当存在于细胞表面时,所述第一kir-car和所述第二kir-car的抗原结合结构域彼此结合的程度小于两者均为scfv抗原结合结构域时。在一个实施方案中,当存在于细胞表面上时,所述第一kir-car的抗原结合结构域与其同源抗原的结合不由于所述第二kir-car的存在而显著降低。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个包含纳米抗体。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个包含骆驼科vhh结构域。
在一个实施方案中,核酸包含编码tcar的序列。在一个实施方案中,所述tcar包含来自与cd3(例如,cd3ζ链,cd3ε链,cd3γ链,cd3δ链)的t细胞受体复合体的抗原结合结构域和活化胞质结构域。在一个实施方案中,所述tcar包含来自共刺激受体例如,cd28,cd137,cd27,icos或ox40的共刺激结构域。
在一个实施方案中,(i)所述kir-car和所述tcar之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域,(ii)所述kir-car和所述tcar之一的抗原结合结构域是scfv,并且另一个不同于scfv,(iii)当存在于细胞表面时,所述kir-car和所述tcar的抗原结合结构域相互结合,比两者都是scfv抗原结合结构域时更少,(iv)当存在于细胞表面时,所述kir-car的抗原结合结构域与其同源抗原的结合不由于所述第二tcar的存在而显著减少,(v)所述kir-car和所述tcar之一的抗原结合结构域包含单vh结构域,例如骆驼科动物,鲨鱼或七鳃鳗单vh结构域或来源于人或小鼠序列,或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vi)所述kir-car和所述tcar之一的抗原结合结构域是scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或源自人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vii)所述kir-car和所述tcar之一的抗原结合结构域是scfv,以及另一个包含纳米抗体,或(viii)其中,所述kir-car和所述tcar之一的抗原结合结构域是scfv,另一个包含骆驼科vhh结构域。在一个实施方案中,所述kir-car和所述tcar之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域。
在一个实施方案中,所述kir-car和所述tcar之一的抗原结合结构域是scfv,另一个不是scfv。在一个实施方案中,当存在于细胞表面上时,所述kir-car和所述tcar的抗原结合结构域彼此结合小于如果两者都是scfv抗原结合结构域时。在一个实施方案中,当存在于细胞表面上时,所述kir-car的抗原结合结构域与其同源抗原的结合不由于所述第二tcar的存在而显著降低。在一个实施方案中,所述kir-car和所述tcar之一的的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh区,或源自人或小鼠序列,或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述kir-car和所述tcar之一的抗原结合结构域是scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述kir-car和所述tcar之一的抗原结合结构域是scfv,另一个包含纳米抗体。在一个实施方案中,所述kir-car和所述tcar之一的抗原结合结构域是scfv,另一个包含骆驼科vhh结构域。
在一个实施方案中,所述kir-car和所述tcar之一的抗原结合结构域结合间皮素,另一个结合不同的抗原结合结构域,例如结合相同的靶标(间皮素)或不同的靶标(例如在基底细胞上的除间皮素以外的靶标,例如,fap;前列腺癌细胞上除间皮素以外的靶标,例如雄激素受体,or51e2,psma,psca,pdgrf-β,tarp,globoh,mad-ct-1或mad-ct-2;卵巢癌细胞上的除间皮素以外的靶标,例如tn,prss21,cd171,lewisy,叶酸受体α,claudin6,globoh或精子蛋白17)。
在另一方面,本发明的特征在于细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系的细胞(例如nk92),其包含(a)本文所述的第一kir-car。在一个实施方案中,所述细胞毒性细胞是t细胞。在一个实施方案中,所述细胞毒性细胞是nk细胞。在一个实施方案中,所述细胞毒性细胞来自nk细胞系,例如nk92细胞。在一个实施方案中,所述第一kir-car是本文所述的actkir-car。在一个实施方案中,所述第一kir-car是本文所述的inhkir-car。
在一个实施方案中,所述细胞毒性细胞包含kir-car,例如actkir-car,和抑制性分子,其包含:inhkir胞质结构域;跨膜结构域,例如kir跨膜结构域;和抑制剂胞质结构域,例如itim结构域,例如inhkiritim结构域。在一个实施方案中,抑制性分子是天然存在的inhkir,或与天然存在的inhkir具有至少50,60,70,80,85,90,95或99%同源性或相差不超过1,2,3,4,5,6,7,8,9,10,15,或20个残基的序列。
在一个实施方案中,所述细胞毒性细胞包含kir-car,例如actkir-car,和抑制性分子,其包含:slam家族胞质结构域;跨膜结构域,例如slam家族跨膜结构域;和抑制剂胞质结构域,例如slam家族结构域,例如slam家族itim结构域。在一个实施方案中,抑制性分子是天然存在的slam家族成员,或与天然存在的slam家族成员具有至少50,60,70,80,85,90,95或99%同源性或相差不超过1,2,3,4,5,6,7,8,9,10,15,或20个残基的序列。
在一个实施方案中,细胞毒性细胞还包含(b)本文所述的第二kir-car,例如不同于所述第一kir-car的第二kir-car。在一个实施方案中,所述kir-car和所述第二kir-car中的一种是actkir-car,另一种是inhkir-car。在一个实施方案中,所述actkir-car是本文所述的actkir-car。在一个实施方案中,所述inhkir-car中的一种是本文所述的inhkir-car。在一个实施方案中,本文所述的细胞毒性细胞包含本文所述的actkir-car和本文所述的inhkir-car。
在一个实施方案中,细胞毒性细胞还包含胞内信号传导结构域,例如衔接分子,其可产生激活信号,例如对所述细胞是外源的,所述细胞可产生激活信号。在一个实施方案中,所述胞内信号传导结构域包含itam基序。在一个实施方案中,所述胞内信号传导结构域包含含有dap12胞内信号传导结构域的dap12多肽。在一个实施方案中,所述dap12多肽还包含跨膜结构域。在一个实施方案中,所述dap12多肽还包含胞外结构域。
在一个实施方案中,细胞毒性细胞包含本文所述的第一和第二kir-car,其中(i)所述第一kir-car和所述第二kir-car之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域,(ii)所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个不是scfv,(iii)当存在于细胞表面时,所述第一kir-car和所述第二kir-car的抗原结合结构域彼此结合的程度小于如果两者都是scfv抗原结合结构域时,(iv)当存在于细胞表面时,所述第一kir-car与其同源抗原的结合基本上不被所述第二kir-car的存在减少,(v)所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或源自人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vi)所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,并且另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vii)其中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,另一个包含纳米抗体,或(viii)所述第一kir-car和所述第二kir-car之一的结合结构域包含scfv,另一个包含骆驼科vhh结构域。
在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个不是scfv。在一个实施方案中,当存在于细胞表面时,所述第一kir-car和所述第二kir-car的抗原结合结构域彼此结合的程度小于如果两者都是scfv抗原结合结构域时。在一个实施方案中,当存在于细胞表面上时,所述第一kir-car的抗原结合结构域与其同源抗原的结合不由于所述第二kir-car的存在而显著降低。在一个实施方案中,所述第一kir-car和所述第二kir-car中的一种的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,另一个包含纳米抗体。在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,另一个包含骆驼科vhh结构域。
在一个实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域结合间皮素,并且另一个结合不同的抗原结合结构域,例如结合相同的靶标(间皮素)或不同的靶标(例如,除基质细胞上的间皮素之外的靶标,例如fap;前列腺癌细胞上除间皮素以外的靶标,例如雄激素受体,or51e2,psma,psca,pdgrf-β,tarp,globoh,mad-ct-1,或mad-ct-2;除卵巢癌细胞上的间皮素以外的靶,例如tn,prss21,cd171,lewisy,叶酸受体α,claudin6,globoh或精子蛋白17)。
在一个实施方案中,细胞毒性细胞包含如本文所述的kir-car并且还包含tcar。在一个实施方案中,所述tcar包含抗原结合结构域和主刺激结构域。在一个实施方案中,所述tcar包括共同刺激结构域。
在一个实施方案中,细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系,例如nk92细胞,包含本文所述的核酸;或由本文所述的核酸编码的kir-car。在一个实施方案中,所述细胞毒性细胞是t细胞。在一个实施方案中,所述细胞毒性细胞是nk细胞。在一个实施方案中,所述细胞毒性细胞来自nk细胞系,例如nk92。
在另一方面,本发明特征在于制备本文所述细胞的方法,包括将本文所述的核酸引入细胞毒性细胞中。在一个实施方案中,所述方法包括在细胞毒性细胞中形成本文所述的kir-car。
在另一方面,本发明的特征在于治疗受试者的方法,例如在哺乳动物中提供抗肿瘤免疫的方法,包括对哺乳动物施用有效量的本文所述的细胞。在一个实施方案中,所述细胞是自体的。在一个实施方案中,所述细胞是同种异体的。在一个实施方案中,所述细胞是t细胞,例如自体t细胞。在一个实施方案中,细胞是同种异体t细胞。在一个实施方案中,所述细胞是nk细胞,例如自体nk细胞。在一个实施方案中,细胞是同种异体nk细胞。在一个实施方案中,所述细胞是来自nk细胞系的细胞,例如nk92。在一个实施方案中,所述哺乳动物是人。在一个实施方案中,所述方法进一步包括评价所述哺乳动物,例如人的所述治疗的副作用。在一个实施方案中,所述副作用包括急性呼吸窘迫综合征,发热性中性粒细胞减少症,低血压,脑病,肝转氨酶异常,癫痫或巨噬细胞活化综合征。在一个实施方案中,所述方法进一步包括用本文所述的试剂,例如抗细胞因子剂,例如肿瘤坏死因子拮抗剂,例如tnf-ig融合物,例如依那西普,il-6拮抗剂,例如il-6受体拮抗剂,例如抗il6受体抗体,例如托珠单抗或皮质类固醇治疗所述人。在一个实施方案中,治疗包括对所述人施用抗il6受体抗体。
在一个实施方案中,与肿瘤抗原的表达相关的疾病是癌症,例如本文所述的癌症。在一个实施方案中,癌症是实体瘤,例如本文所述的实体瘤,例如间皮瘤(例如恶性胸膜间皮瘤),肺癌(例如非小细胞肺癌,小细胞肺癌,鳞状细胞肺癌或大细胞肺癌),胰腺癌(例如胰腺导管腺癌),卵巢癌,结肠直肠癌和膀胱癌或其任何组合。在一个实施方案中,所述疾病是胰腺癌,例如转移性胰腺导管腺癌(pda),例如在至少一种在先标准治疗中进展的受试者中的胰腺癌。在一个实施方案中,所述疾病是间皮瘤(例如,恶性胸膜间皮瘤),例如在至少一种在先标准治疗进展的受试者中的间皮瘤(例如,恶性胸膜间皮瘤)。在一个实施方案中,所述疾病是卵巢癌,例如浆液性上皮性卵巢癌,例如在至少一种在先标准治疗进展的受试者中的卵巢癌。
在一个实施方案中,所述方法包括治疗患有与间皮素或cd19的表达相关的疾病的哺乳动物,例如人。在一个实施方案中,所述方法包括治疗患有与不希望的细胞增殖相关的病症例如癌症的哺乳动物,例如人。在一个实施方案中,所述病症是胰腺癌,间皮瘤,肺癌,卵巢癌,白血病或淋巴瘤。
在另一方面,本发明的特征在于纯化的或非天然存在的ncr-car,例如活化ncr-car,其包含细胞外抗原结合结构域,跨膜结构域,例如包含带正电荷的部分,例如包含带正电荷的部分(例如带正电荷的侧链)的氨基酸残基的跨膜结构域或ncr跨膜结构域,和胞质结构域(例如ncr胞质结构域)。
在一个实施方案中,所述ncr-car包含跨膜结构域,其包含带正电荷的部分,例如包含带正电荷的部分的氨基酸残基,例如带正电荷的侧链,例如ncr跨膜结构域,例如nkp30,nkp44或nkp46胞质结构域。在一个实施方案中,所述ncr-car包含可与包含例如dap12,fcrγ或cd3ζ胞质结构域的衔接分子或细胞内信号传导分子相互作用的胞质结构域。在一个实施方案中,所述ncr-car例如nkp30-car包含可与衔接分子或细胞内信号传导分子例如dap12相互作用的跨膜结构域。在一个实施方案中,所述ncr-car包含nkp46-car。在一个实施方案中,所述nkp46-car包含跨膜结构域,其包含带正电荷的部分,例如包含带正电荷的部分的氨基酸残基,例如带正电荷的侧链或例如ncr跨膜结构域,其可以与衔接分子或细胞内信号传导分子,例如具有fcrγ或cd3ζ胞质结构域的信号传导分子相互作用。在一个实施方案中,本文所述的所述ncr-car进一步包含位于所述跨膜结构域和所述细胞外抗原结合结构域之间的铰链结构域。
在一个实施方案中,ncr-car是激活ncr-car,并且细胞外抗原结合结构域是本文所述的抗原结合结构域,例如在表4中。
在另一方面,本发明的特征在于核酸,例如纯化的或非天然存在的核酸,例如包含dna或rna序列(例如mrna)的核酸,其包含编码本文所述的ncr-car的序列。在一个实施方案中,所述核酸包含编码nkp30-car和任选地衔接分子或细胞内信号传导分子(例如dap12)的序列。在一个实施方案中,所述ncr-car例如nkp46-car包含跨膜结构域,其包含带正电荷的部分,例如包含带正电荷的部分的氨基酸残基,例如带正电荷的侧链或ncr跨膜结构域,其可以与衔接分子或细胞内信号分子例如fcrγ或cd3ζ分子相互作用。在一个实施方案中,所述核酸还包含编码衔接分子或细胞内信号分子的序列,其例如包含dap12,fcrγ或cd3ζ。
在一个实施方案中,核酸编码actncr-car,并且编码的细胞外抗原结合结构域是本文所述的抗原结合结构域,例如在表4中。
在另一方面,本发明的特征在于包含本文所述的ncr-car的细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系。在一个实施方案中,细胞毒性细胞还包含衔接分子或细胞内信号分子,其例如包含dap12,fcrγ或cd3ζ胞质结构域。在一个实施方案中,细胞毒性细胞包含nkp30-car和任选地衔接分子或细胞内信号分子,例如dap12。在一个实施方案中,所述nkp46-car包含可与衔接分子或细胞内信号分子(例如fcrγ或cd3ζ分子)相互作用的跨膜结构域。
在另一方面,本发明的特征在于制备本文所述的细胞的方法,包括将包含编码本文所述的ncr-car的序列的核酸引入细胞毒性细胞中。在一个实施方案中,所述方法包括在细胞毒性细胞中形成本文所述的ncr-car。
在另一方面,本发明的特征在于治疗受试者的方法,例如在哺乳动物中提供抗肿瘤免疫的方法,包括对哺乳动物施用有效量的本文所述的细胞,例如包含本文所述的ncr-car的本文所述的权利要求的细胞。
在另一方面,本发明的特征在于治疗患有与肿瘤抗原,例如本文所述的肿瘤抗原的表达相关的疾病(例如,增生性疾病,癌前状况和与肿瘤抗原的表达相关的非癌相关适应证)的受试者的方法,包括向受试者施用有效量的包含ncr-car的细胞,例如如本文所述。在一个实施方案中,ncr-car是激活ncr-car,并且细胞外抗原结合结构域是本文所述的抗原结合结构域,例如在表4中。
在一个实施方案中,与肿瘤抗原的表达相关的疾病是癌症,例如本文所述的癌症。在一个实施方案中,癌症是实体瘤,例如本文所述的实体瘤,例如间皮瘤(例如恶性胸膜间皮瘤),肺癌(例如非小细胞肺癌,小细胞肺癌,鳞状细胞肺癌或大细胞肺癌),胰腺癌(例如胰腺导管腺癌),卵巢癌,结肠直肠癌和膀胱癌或其任何组合。在一个实施方案中,所述疾病是胰腺癌,例如转移性胰腺导管腺癌(pda),例如在至少一种在先标准治疗中进展的受试者中。在一个实施方案中,所述疾病是间皮瘤(例如,恶性胸膜间皮瘤),例如在至少一种在先标准治疗进展的受试者中。在一个实施方案中,所述疾病是卵巢癌,例如浆液性上皮性卵巢癌,例如在至少一种在先标准治疗进展的受试者中。
在另一方面,本发明的特征在于纯化的或非天然存在的slamf-car,例如抑制性slamf-car,其包含细胞外抗原结合结构域,跨膜结构域,例如包含带正电荷的部分,例如包含带正电荷的部分的氨基酸残基,例如带正电荷的侧链的跨膜结构域,例如slamf跨膜结构域和slamf胞质结构域。在一个实施方案中,所述slamf-car包含slamf,cd48,cd229,2b4,cd84,ntb-a,cracc,blame或cd2f-10胞质结构域。在一个实施方案中,所述slamf-car进一步包含位于所述跨膜结构域和所述细胞外抗原结合结构域之间的铰链结构域。
在另一方面,本发明的特征在于核酸,例如纯化或非天然存在的核酸,例如包含dna或rna序列(例如mrna)的核酸,其包含编码本文所述的slamf-car的序列。
在另一方面,本发明的特征在于包含本文所述的slamf-car的细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系。
在另一方面,本发明的特征在于制备包含本文所述的slamf-car的细胞毒性细胞的方法,包括将包含编码本文所述的slamf-car的序列的核酸引入细胞毒性细胞中。在一个实施方案中,所述方法包括在细胞毒性细胞中形成本文所述的slamf-car。
在另一方面,本发明的特征在于治疗受试者的方法,例如在哺乳动物中提供抗肿瘤免疫的方法,包括对哺乳动物施用有效量的包含本文所述slamf-car的细胞。
在另一方面,本发明的特征在于纯化的或非天然存在的fcr-car,例如cd16-car,例如活化性cd16-car或cd64-car,例如活化性cd64-car,其包含胞外抗原结合结构域,跨膜结构域和cd16或cd64胞质结构域。在一个实施方案中,所述fcr-car是cd16-car。在一个实施方案中,所述fcr-car是cd64-car。在一个实施方案中,所述fcr-car可以与衔接分子或细胞内信号传导分子例如fcrγ或cd3ζ结构域相互作用,例如通过跨膜结构域,例如包含带正电荷部分,例如包含带正电荷的部分的氨基酸残基,例如带正电荷的侧链的跨膜结构域或例如cd16或cd64跨膜结构域。在一个实施方案中,所述fcr-car进一步包含位于所述跨膜结构域和所述细胞外抗原结合结构域之间的铰链结构域。
在另一方面,本发明的特征在于纯化的或非天然存在的核酸,例如包含dna或rna序列的核酸,例如包含编码本文所述的fcr-car的序列的mrna。在一个实施方案中,核酸还包含衔接分子或细胞内信号分子,其包含细胞质激活结构域,例如fcrγ或cd3ζ胞质结构域。在一个实施方案中,所述fcr-car和所述胞质激活结构域位于分开的核酸分子上,例如分开的载体,例如分开的病毒载体,例如分开的慢病毒载体上。
在另一方面,本发明的特征在于包含本文所述的fcr-car的细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系。在一个实施方案中,细胞毒性细胞还包含胞质激活结构域,例如fcrγ或cd3ζ胞质结构域。
在另一方面,本发明的特征在于制备包含本文所述的fcr-car的细胞的方法,包括将包含编码本文所述的fcr-car的序列的核酸引入细胞毒性细胞中。在一个实施方案中,所述方法包括在细胞毒性细胞中形成本文所述的fcr-car。
在另一方面,本发明的特征在于治疗受试者的方法,例如在哺乳动物中提供抗肿瘤免疫的方法,包括对哺乳动物施用有效量的包含本文所述的fcr-car的细胞。
在另一方面,本发明的特征在于纯化的或非天然存在的ly49-car,其包含细胞外抗原结合结构域和跨膜结构域,例如ly49跨膜结构域或胞质结构域,例如含有itim的胞质结构域,例如ly49-胞质结构域。在一个实施方案中,ly49-car包含跨膜结构域和ly49-胞质结构域。在一个实施方案中,所述ly49-car是激活ly49-car,例如ly49d或ly49h。在一个实施方案中,所述ly49-car包含带正电荷的跨膜结构域,例如带正电荷的ly49跨膜结构域。在一个实施方案中,所述ly49-car可以与含有itam的胞质结构域例如dap12相互作用。在一个实施方案中,所述ly49-car包含ly49跨膜结构域。在一个实施方案中,所述kir-car是抑制性ly49-car,例如ly49a或ly49c。在一个实施方案中,所述ly49-car包含含有itim的胞质结构域,例如ly49-胞质结构域。在一个实施方案中,所述ly49-car包含独立于ly49a-ly49w选择的ly49-跨膜结构域或ly49-胞质结构域。在一个实施方案中,所述ly49-car进一步包含位于所述跨膜结构域和所述细胞外抗原结合结构域之间的铰链结构域。
在另一方面,本发明的特征在于核酸,例如纯化的或非天然存在的核酸,例如包含dna或rna序列(例如mrna)的核酸,其包含编码本文所述的ly49-car的序列。在一个实施方案中,核酸还包含胞质激活结构域,例如dap12胞质结构域。在一个实施方案中,所述ly49-car和所述细胞质激活结构域设置在分开的核酸分子上,例如分开的载体,例如分开的病毒载体,例如分开的慢病毒载体上。
在另一方面,本发明的特征在于包含本文所述的ly49-car的细胞毒性细胞,例如天然或非天然存在的t细胞,nk细胞或细胞毒性t细胞或nk细胞系。在一个实施方案中,细胞毒性细胞还包含细胞质激活结构域,例如dap12胞质结构域。
在另一方面,本发明的特征在于制备包含本文所述ly49-car的细胞的方法,包括将包含编码本文所述ly49-car的序列的核酸引入细胞毒性细胞中。
在另一方面,本发明的特征在于制备包含本文所述的ly49-car的细胞的方法,包括在细胞毒性细胞中形成本文所述的ly49-car。
在另一方面,本发明的特征在于治疗受试者的方法,例如在哺乳动物中提供抗肿瘤免疫的方法,包括对哺乳动物施用有效量的本文所述的细胞,例如包含本文所述的ly49-car的细胞。
在另一方面,本发明的特征在于包括例如细胞毒性细胞的细胞,其包含含有抗原结合结构域的第一非天然存在的嵌合膜包埋受体,和含有抗原结合结构域的第二非天然存在的嵌合膜包埋受体,其中,(i)所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域,(ii)所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含scfv,另一个不同于scfv,(iii)当存在于细胞表面时,所述第一和所述第二非天然存在的嵌合膜包埋受体的抗原结合结构域彼此结合小于如果两者都是scfv抗原结合结构域时,(iv)当存在于细胞表面时,所述第一非天然存在的嵌合膜包埋受体的抗原结合结构域与其同源抗原的结合不由于所述第二非天然存在的嵌合膜包埋的受体的存在而显著降低,(v)所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vi)所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃单vh结构域,或源自人或小鼠序列或非抗体支架,例如,纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域,(vii)所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含scfv,另一种包含纳米抗体,和(viii)所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含scfv,另一个包含骆驼科vhh结构域。在一个实施方案中,所述细胞是t细胞。在一个实施方案中,所述细胞是nk细胞。在一个实施方案中,所述细胞来自nk细胞系,例如nk92。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体中的一种是tcar。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体都是tcar。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体中的一种是nkr-car,例如kir-car。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体都是nkr-car,例如kir-car。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域不包含轻链可变结构域和重链可变结构域。在一个实施方案中,当存在于细胞表面上时,所述第一和所述第二非天然存在的嵌合膜包埋受体的抗原结合结构域彼此结合的程度小于如果两者均为scfv抗原结合结构域时的程度。在一个实施方案中,当存在于细胞表面上时,所述第一非天然存在的嵌合膜包埋受体的抗原结合结构域与其同源抗原的结合不由于所述第二非天然存在的嵌合膜包埋受体的存在而显著降低。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或源自人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含scfv,另一种包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或源自人或小鼠序列或非抗体支架,例如纤连蛋白,例如纤连蛋白iii型抗体样分子的单vh结构域。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含scfv,另一个包含纳米抗体。在一个实施方案中,所述第一和所述第二非天然存在的嵌合膜包埋受体之一的抗原结合结构域包含scfv,另一个包含骆驼科vhh结构域。在一个实施方案中,本发明包含核酸,例如纯化或非天然存在的核酸,其包含编码第一和第二非天然存在的嵌合膜包埋的受体的序列,所述受体包含本文所述的抗原结合结构域。在一个实施方案中,本发明包括制备本文所述细胞的方法,包括将本文所述的核酸导入细胞。在一个实施方案中,本发明包括制备本文所述细胞的方法,包括在细胞毒性细胞中形成本文所述的第一和所述第二非天然存在的嵌合膜包埋的受体。在一个实施方案中,本发明包括治疗受试者的方法,例如在哺乳动物中提供抗肿瘤免疫的方法,包括给予哺乳动物有效量的本文所述的细胞。
在另一方面,本发明的特征在于包含本文所述的细胞或核酸的试剂盒。
在另一方面,本发明的特征在于编码kir-car(杀伤细胞免疫球蛋白受体样嵌合抗原受体)的分离的核酸序列,其中所述分离的核酸序列包含抗原结合结构域和kir或其片段的核酸序列。在一个实施方案中,抗原结合结构域选自鼠抗体,人源化抗体,人抗体,嵌合抗体及其片段。在一个实施方案中,所述片段是fab或scfv。在一个实施方案中,抗原结合结构域是本文所述的抗原结合结构域,例如在表4中。在一个实施方案中,kir选自活化kir,抑制性kir及其任何组合。在一个实施方案中,至少一个铰链区已从活化kir中去除。
在另一方面,本发明的特征在于分离的kir-car(杀伤细胞免疫球蛋白受体样嵌合抗原受体),其包含抗原结合结构域和kir或其片段。在一个实施方案中,抗原结合结构域选自鼠抗体,人源化抗体,人抗体,嵌合抗体及其片段。在一个实施方案中,所述片段是fab或scfv。在一个实施方案中,抗原结合结构域是本文所述的抗原结合结构域,例如在表4中。在一个实施方案中,kir选自活化kir,抑制性kir及其任何组合。在一个实施方案中,至少一个铰链区已从活化kir中去除。
另一方面,本发明的特征在于包含至少两种kir-car的组合物,其中第一kir-car包含抗原结合结构域和活化kir或其片段,第二kir-car包含抗原结合结构域和抑制性kir或其片段。在一个实施方案中,第一kir-car中的抗原结合结构域对存在于肿瘤上的抗原(例如本文所述的抗原结合结构域,例如表4中)是特异的并且第二kir-car中的抗原结合结构域对存在于正常细胞上的抗原是特异性的。
在另一方面,本发明的特征在于包含至少两种kir-car的遗传修饰的t细胞,其中所述第一kir-car包含抗原结合结构域和活化kir或其片段,所述第二kir-car包含抗原结合结构域和抑制性kir或其片段。在一个实施方案中,第一kir-car中的抗原结合结构域对存在于肿瘤上的抗原(例如本文所述的抗原结合结构域,例如表4中)是特异的并且第二kir-car中的抗原结合结构域对存在于正常细胞上的抗原是特异性的。在一个实施方案中,细胞是t细胞。
在另一方面,本发明的特征在于在哺乳动物中提供抗肿瘤免疫的方法,所述方法包括向哺乳动物施用有效量的包含至少两种kir-car的细胞,其中所述第一kir-car包含抗原结合结构域和活化kir或其片段,并且所述第二kir-car包含抗原结合结构域和抑制性kir或其片段。在一个实施方案中,第一kir-car中的抗原结合结构域对存在于肿瘤上的抗原(例如本文所述的抗原结合结构域,例如表4中)是特异的并且第二
kir-car中的抗原结合结构域对存在于正常细胞上的抗原是特异性的,从而控制细胞的脱靶活性。在一个实施方案中,细胞是t细胞。
在另一方面,本发明的特征在于治疗患有与肿瘤抗原(例如本文所述的肿瘤抗原)的表达相关的疾病(例如,与肿瘤抗原的表达相关的增生性疾病,癌前状况和非癌相关适应证)的受试者的方法,包括向哺乳动物施用有效量的包含至少两种kir-car的细胞,其中所述第一kir-car包含抗原结合结构域和活化kir或其片段,并且所述第二kir-car包含抗原结合结构域和抑制性kir或其片段。在一个实施方案中,第一kir-car包含本文所述的抗原结合结构域,例如在表4中。
在一个实施方案中,与肿瘤抗原的表达相关的疾病是癌症,例如本文所述的癌症。在一个实施方案中,癌症是实体瘤,例如本文所述的实体瘤,例如间皮瘤(例如恶性胸膜间皮瘤),肺癌(例如非小细胞肺癌,小细胞肺癌,鳞状细胞肺癌或大细胞肺癌),胰腺癌(例如胰腺导管腺癌),卵巢癌,结肠直肠癌和膀胱癌或其任何组合。在一个实施方案中,所述疾病是胰腺癌,例如转移性胰腺导管腺癌(pda),例如在至少一种在先标准治疗中进展的受试者中。在一个实施方案中,所述疾病是间皮瘤(例如,恶性胸膜间皮瘤),例如在至少一种在先标准治疗进展的受试者中。在一个实施方案中,所述疾病是卵巢癌,例如浆液性上皮性卵巢癌,例如在至少一种在先标准治疗后进展的受试者中。
除非另有定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。尽管与本文所述相似或等同的方法和材料可用于本发明的实践或测试中,但合适的方法和材料如下所述。本文提及的所有出版物,专利申请,专利和其它参考文献通过引用整体并入。此外,材料,方法和实施例仅仅是说明性的,而不是限制性的。标题,副标题或编号或字母元件,例如(a),(b),(i)等仅仅是为了便于阅读而给出。在本文件中使用标题或编号或字母元件不要求按字母顺序执行步骤或元件,或者步骤或元件必须彼此是离散的。
从说明书和附图以及从权利要求书中,本发明的其它特征,目的和优点将是显而易见的。
附图说明
当结合附图阅读时,将更好地理解本发明的优选实施方案的以下详细描述。为了说明本发明的目的,在附图中示出了目前优选的实施方案。然而,应当理解,本发明不限于附图中所示的实施方案的精确布置和手段。
图1,包括图1a和1b,是一系列示意图,显示了天然存在的抑制和活化kir(图1a)和基于scfv的活化kir-car(图1b)的结构。
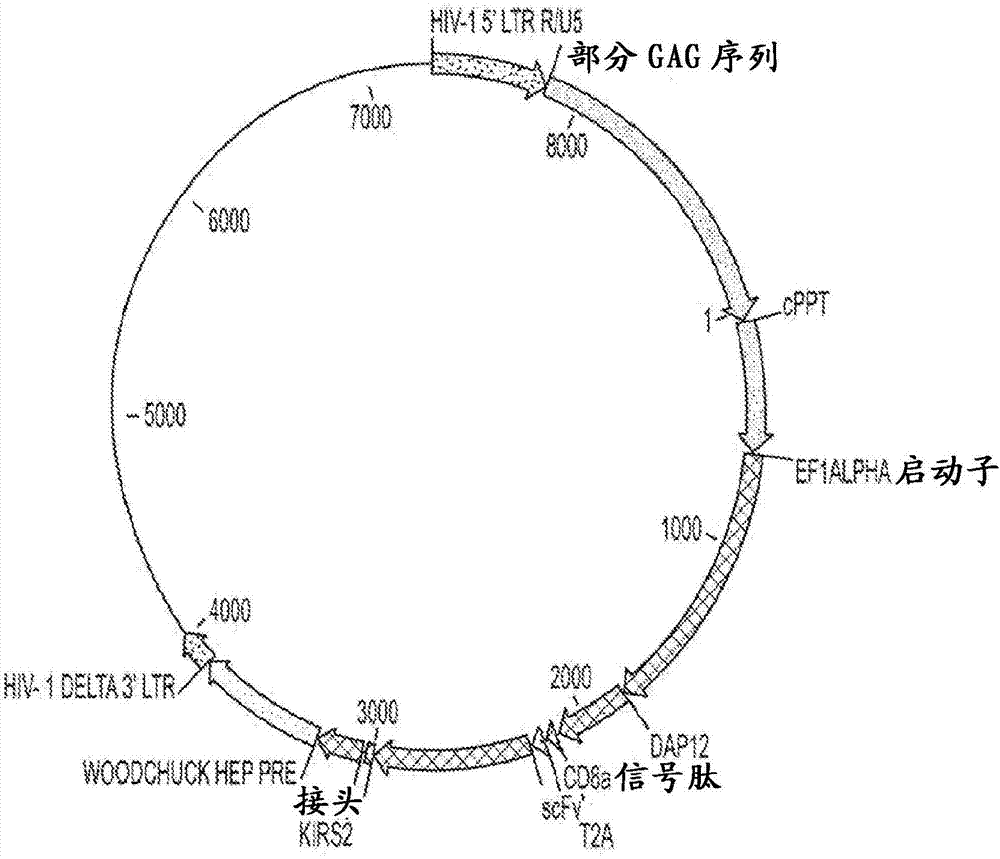
图2是用于与dap12信号分子组合递送基于活化kir的car的慢病毒载体的示意图。
图3是显示间皮素特异性actkir-car可以在原代人t细胞的表面上有效表达的图像。用抗cd3/抗cd28微珠刺激人t细胞,并用所示的car转导或模拟物转导并离体扩增。使用生物素化的山羊抗小鼠f(ab)2特异性多克隆igg(jacksonimmunologics)检测表达,然后用链霉抗生物素蛋白-pe进行染色。
图4表明,表达ss1actkir-car的t细胞对工程化以表达间皮素配体(kt-meso)的靶k562细胞表现出细胞毒活性。用抗cd3/抗cd28微珠刺激人t细胞,用所示的car转导或者模拟物转导并离体扩增。将105个表达间皮素的cfse-标记的k562细胞(kt-meso)或野生型对照k562与不同比例的表达car的t细胞在37℃,5%co2下温育16小时。然后通过流式细胞术使用countbright珠和活力染色(7aad)计数k562靶细胞。通过从没有效应t细胞的过夜培养后剩余的活的k562的数目中减去与效应t细胞温育后剩余的活靶细胞的数目,然后除以在没有效应t细胞的情况下过夜培养后剩余的活的k562的数目,计算裂解的k562细胞的百分比(裂解百分比)。
图5包括图5a和5b,是一系列示意图,显示其中除去kir2ds2铰链的激活kircar(kir2scar)。基于图5a中所示的tcr激活的动力学分离模型,认为间皮素特异性ss1kircar具有太长的铰链而不允许允许适当的分离。因此,认为使间皮素特异性kircar铰链更短可以改善功能。图5b是显示ss1scfv与kir跨膜结构域融合而没有来自kir2ds2的两个ig样结构域作为铰链的示意图。
图6包括图6a和6b,是一系列图像,表明与通过将ss1scfv融合到全长野生型kir2ds2上形成的car相比,基于ss1scfv的kirs2car对表达间皮素的靶细胞表现出增强的细胞溶解活性。用cd3/28微珠刺激原代人t细胞,然后用ss1-kir2ds2活化性kir-car,ss1-kirs2活化性kircar,ss1-zetacar进行慢病毒转导。模拟物非转导t细胞(ntd)用作对照。扩增t细胞直至对数期生长结束。使用生物素化的山羊抗小鼠f(ab)2特异性多克隆抗体,接着链霉亲和素-pe检测,通过流式细胞术测定ss1特异性car的表面表达,如图6a所示。如图6b所示,将具有或不具有间皮素并用cfse染色的k562靶细胞与图6a中表征的效应t细胞混合,如使用范围为10:1至1:1变化的效应t细胞与靶比例所示。使用流式细胞术评估靶k562细胞裂解以确定活的cfse+细胞的%,如对于图4所述。显示的数据是与没有效应细胞的靶细胞相比计算的%靶细胞裂解。
图7,包括图7a和7b,是显示cd19actkir-car和ss1inhkir-car的共表达的一系列图像。用所示的kircar或非转导的(ndt)转导jurkatnfat-gfp报道细胞,并与具有或不具有所示的cd19和间皮素抗原的靶细胞1:1混合。结果显示在jurkat和靶细胞混合后24小时的gfp表达(图7a)。图7b显示通过用间皮素-fc融合蛋白和对fmc63抗cd19scfv独特型特异的单克隆抗体染色测定的间皮素和cd19独特型的表面表达。
图8,包括图8a,8b和8c,是一系列图像,其阐明野生型pd-1与基于活化kir的car或靶向间皮素的基于tcr-ζ的car的共表达。用cd3/28微珠刺激原代人t细胞,然后用ss1-kirs2激活kircar或ss1-zetacar进行慢病毒转导。模拟物非转导细胞(ntd)用作阴性对照。将t细胞扩增9天,并通过用间皮素-fc接着用与pe缀合的山羊抗人fc特异性抗体染色来测定表面car表达(图8a)。使用cak1抗间皮素特异性单克隆抗体对k562细胞系(野生型[wt],表达间皮素的[meso]或间皮素和pd-l1共表达[meso-pdl1])进行染色以确认靶细胞上的间皮素表达(图8b)。使用btxecm830电穿孔仪用10ug体外转录的编码野生型pd1的rna(pd1+)或模拟转染(pd1-),电穿孔如图8a所示转导的原代人t细胞。使用与apc缀合的抗-pd1单克隆抗体表示pd-1的表面表达(图8c)。
图9是证明共表达野生型pd-1与基于活化kir的car和靶向间皮素的基于tcr-ζ的car组合导致pd-1配体1(pdl-1)依赖性抑制间皮素特异性活化kir-car细胞毒性的图像。用cd3/28微珠刺激原代人t细胞,然后用ss1-kirs2激活kircar,ss1-zetacar或模拟转导(ntd)进行慢病毒转导。将t细胞扩增9天,随后使用btxecm830电穿孔仪用10ug体外转录的编码野生型pd1的rna(pd1+)或模拟转染(pd1-)电穿孔5x106t细胞。如图8所示测定ss1特异性car和pd-1的表面表达。将没有间皮素或表达间皮素的具有或不具有pdl-1的k562靶细胞与所示的不同t细胞条件混合,使用变化的效应物t细胞与靶标比例为30:1至1:1,如所示。使用钙黄绿素am染料方法评估靶k562细胞裂解,以在温育4小时后定量剩余的活细胞。显示的数据是与没有效应细胞的靶细胞相比计算的%靶细胞裂解。
图10是显示来自供体的t细胞的干扰素-γ(ifn-γ)和白细胞介素-2产生的图像,所述供体表达间皮素特异性激活的基于kir的car(ss1-kirs2)或具有或不具有共刺激结构域的基于tcr-ζ的car(ss1-z,ss1-28z或ss1-bbz)。刺激原代人t细胞,然后用指示的活化kircar或基于tcr-ζ的car进行慢病毒转导。扩增后,将转导的t细胞与k562(kwt)或k562-间皮素细胞(kmeso)以2:1的比例混合。对于多个独立供体中指示的细胞因子,刺激24小时后,通过elisa测定上清液中细胞因子浓度。重复测量anova显示对ifn-γ(p=0.002)和il-2(p=0.0156)具有显著的car作用。对于ifn-γ,ss1-kirs2/dap12(ss1kir)对模拟物(后验配对t检验,p=0.0162)。对于il-2,ss1-kir对ss1-28z(后验配对t检验,p=0.0408)。
图11是通过基于多路luminex的免疫测定(cytokinehuman10-plexpanel,lifetechnologies)评估的上清液中细胞因子浓度的热图。使用r统计软件中的热图包工具,产生在供体和条件之间对每种细胞因子的最低浓度归一化后相对浓度的热图。
图12,包括图12a-12b,描述了具有强的细胞毒活性的基于间皮素特异性kir的嵌合抗原受体(kir-car)工程化t细胞的构建。用cd3/28微珠刺激原代人t细胞,然后用表达gfp和dsred(对照)或dap12和dsred(dap12)的慢病毒载体转导。将细胞离体扩增直到对数期生长结束。使用btxecm830电穿孔仪,用10μg体外转录的编码ss1-kirs2的rna对来自每个转导群体的5x106个t细胞进行电穿孔。通过流式细胞术,使用生物素化的山羊抗小鼠f(ab)2特异性多克隆抗体,随后用链霉亲和素-pe检测的ss1-kirs2来评估dsred和ss1-kirs2的表达。图12a的上图显示了用于鉴定表达dsred的t细胞的门控策略,其然后如图的下面部分所示分析ss1-kirs2表达。图12b显示了如使用4小时51cr释放测定评估的,图12a中表征的细胞介导针对野生型k562细胞(k562-wt)或表达间皮素的k562细胞(k562-间皮素)的细胞毒性的能力。
图13显示内源性tcr的表达不受ss1-kirs2和dap12表达的影响。用10μg体外转录的编码ss1-kirs2的rna或转染的模拟物用btxecm830电穿孔仪电穿孔5x106个原代人t细胞。温育过夜后,使用生物素化的山羊抗小鼠f(ab)2特异性多克隆抗体,随后链霉亲和素-pe,对转染的t细胞进行ss1-kirs2的表达染色。使用对tcr的这个vβ链特异的pe-缀合的单克隆抗体评估vβ13.1的表达。
图14说明了间皮素特异性基于kir的car(ss1-kirs2)刺激t细胞增殖的能力,所述t细胞增殖是抗原依赖性的但不依赖于额外的cd28共刺激。用cd3/28微珠刺激原代人t细胞,然后用ss1-kirs2和dap12或间皮素特异性tcr-ζcar(ss1-zeta)进行慢病毒转导。模拟物非转导细胞(ntd)用作阴性对照。将无间皮素(k562wt)或表达间皮素(k562-间皮素)的k562靶细胞与如所示的不同t细胞条件混合,效应t细胞与靶细胞的比例为2:1。将用k562-间皮素刺激的t细胞进一步分成具有或不具有1ug/ml的单克隆抗cd28激动剂抗体(克隆9.3)的条件。通过流式细胞术在所示时间点使用基于珠的计数来计算活的t细胞的数量,以计算抗原刺激后的群体倍增数。
图15,包括图15a,15b,15c,15d和15e,阐明了与具有cd28或cd137(4-1bb)共刺激结构域的第二代基于tcr-ζ的car相比,间皮素特异性kir-car修饰的t细胞在体内显示出增强的抗肿瘤活性。图15a显示了实验,其中nod-scid-c-/-(nsg)小鼠皮下植入2x106个表达间皮素的间皮瘤衍生的细胞(em-meso细胞)。在肿瘤植入后20天,将每只动物静脉内注射用抗-cd3/抗-cd28刺激珠刺激的5x106个t细胞,随后用一系列基于cd3ζ的car(具有或不具有共刺激结构域)(ss1-ζ,ss1-bbζ和ss1-28ζ)或间皮素特异性基于kir的car,ss1-kirs2与dap12进行慢病毒转导。模拟物转导的t细胞(ntd)用作对照。在指定时间通过测径器测量肿瘤体积(n=每组7只小鼠)。图15b显示kir-car的体内活性不依赖于在血液,脾或肿瘤中的t细胞植入。在实验结束时通过流式细胞术评估人cd45+t细胞的频率,并且数据表示为血液,脾和肿瘤消化物中总的活细胞的百分比。图15c显示在ss1-28ζ和ss1-kirs2/dap12cart细胞治疗组中观察到cd3+til的可比较频率。使用与图15a所示相同的模型。在第30天(cart输注后10天),通过流式细胞术评价cd3+人淋巴细胞在肿瘤中的频率。图15d显示dap12-修饰的t细胞需要间皮素特异性的基于kir的car用于肿瘤根除。使用与图15a所示相同的模型。在第20天静脉内注射表达dap12和dsred(dap12),ss1-28z或ss1-kirs2和dap12(ss1-kirs2)的4百万个t细胞,并通过测径器测量随时间推移评估肿瘤体积。箭头指示用于功能和表型分析的til分离的时间。图15e显示从图15d中所述的小鼠分离的til的抗原特异性细胞毒性活性。通过与以所示e-t比表达em-meso细胞或emp细胞(缺乏间皮素表达的亲本em细胞)的萤火虫萤光素酶共培养18小时来评估抗原特异性细胞毒性。
图16,包括图16a和16b,证明具有cd19特异性的基于kir的car可以触发抗原特异性靶细胞细胞毒性。在抗cd3/抗cd28珠激活后,用表达dap12的双顺反子慢病毒载体以及基于cd19特异性kir的car(其中fmc63衍生的scfv与全长kir2ds2融合(cd19-kir2ds2))或通过经由短接头[gly]4-ser接头将fmc63scfv融合至kir2ds2的跨膜和胞质结构域而产生的基于kir的car(cd19-kirs2)转导t细胞。将转导的t细胞培养直到对数期生长结束,并且通过流式细胞术使用生物素化的山羊抗小鼠f(ab)2多克隆抗体,随后用sa-pe评估cd19特异性基于kir的car的表达。将具有(k562-cd19)或不具有(k562-wt)cd19表达的51cr-标记的k562靶细胞以不同的t细胞与靶细胞比例(e:t比)混合。通过测量在4小时释放到上清液中的51cr的分数来测定细胞毒性。还包括模拟物转导的(ntd)或用对cd19(cd19-z)特异的基于cd3ζ的car转导的对照t细胞分别作为阴性和阳性对照。
图17,包括图17a和17b,显示了cd19-kirs2体内活性。在第0天通过尾静脉注射1百万个nalm-6cbg肿瘤细胞(表达cd19的白血病细胞系),静脉内植入nod-scid-c-/-(nsg)小鼠。t细胞用抗cd3/抗cd28刺激珠刺激,然后在第1天用一系列具有或不具有共刺激结构域(cd19z,19bbz)的cd19特异性基于cd3ζ的car或cd19特异性基于kir的car,具有dap12的cd19-kirs2(19kirs2)进行慢病毒转导。模拟物非转导的t细胞(ntd)用作对照。将t细胞扩增直到离体对数期生长终止,并在白血病细胞系注射后第5天静脉内注射,每只小鼠2百万个cart细胞。通过生物发光成像评估肿瘤负荷。分析5只动物的每种t细胞条件。图17a显示了在第5天(在t细胞注射之前的基线)和在白血病细胞植入后第15天的个体动物的个体生物发光光子通量。图17b显示了每个治疗组随时间的中值总通量。
图18显示了具有间皮素特异性的基于nkp46的ncrcar触发抗原特异性细胞毒性。在抗cd3/抗cd28珠激活后,用表达dap12和ss1-kirs2(对照)或fcεrγ和间皮素特异性基于nkp46的car(ss1-nkp46)或fcεrγ和间皮素特异性nkp46car(其中天然nkp46胞外结构域被截短(ss1-tnkp46))的双顺反子慢病毒载体转导t细胞。如图18a所示,使用生物素化的山羊抗小鼠f(ab)2多克隆抗体,接着使用sa-pe通过流式细胞术评价间皮素特异性car的表达。将t细胞与表达间皮素的51cr-标记的k562靶细胞以效应t细胞与靶k562细胞的不同比例(e:t比)混合。通过测量与自发释放相比在4小时释放到上清液中的51cr分数,测定细胞毒性,如图18b所示。
图19显示了用于图21-23所示实验的受体的示意图。
图20显示了表达kir2dl3配体hla-cw的k562-meso细胞系的产生和表征。用hla-cw3等位基因转导k562细胞(k562)或表达间皮素的k562细胞(k562-meso),随后通过荧光激活细胞分选获得具有间皮素表达(k562-meso-hlacw)或无间皮素表达(k562-hlacw)的表达hla-cw的k562细胞。使用识别hla-a,b和c等位基因的apc-缀合的单克隆抗体(克隆w6/32)通过流式细胞术评估hla-cw3表达。
图21显示了ss1-kirs2和kir2dl3在原代人t细胞中的共表达。用cd3/28微珠刺激原代人t细胞,然后用ss1-kirs2和dap12(ss1-kirs2)或转导的模拟物(ntd)与野生型kir2dl3组合进行慢病毒转导。扩增t细胞直到对数期生长结束。间皮素特异性car和kir2dl3的表面表达通过用间皮素-fc,随后pe-缀合的山羊抗人fc和针对kir2dl3胞外域的单克隆抗体染色来测定。
图22表明与kircar共表达的kir2dl3可以抑制靶细胞上hla-cw存在下的抗原特异性细胞毒性。如图21所述产生和表征的t细胞与51-cr标记的靶k562细胞混合,如图22所述产生和表征所述51-cr标记的靶k562细胞。通过与无效应细胞的靶细胞相比,测量在4小时时释放到上清液中的51cr的比例来确定细胞毒性。
图23显示了图24所示实验中使用的受体的示意图。
图24表明不能在t细胞表面上共表达两种基于scfv的嵌合受体,同时保留每种受体各自的结合特异性。使用编码ss1-kir2dl3的慢病毒载体转导jurkatt细胞。随后在载体的不同稀释度下用编码cd19-kir2ds2的第二慢病毒载体转导这些细胞。使用间皮素-fc,随后pe-缀合的山羊抗人fc评估ss1特异性scfv的表达。使用对fmc63独特型特异性的pe-缀合的单克隆抗体评估cd19特异性scfv表达。
图25是证明cd19特异性car的表达也降低共表达ss1-zeta-mcherry融合car的细胞表面上间皮素结合位点的表达的图像。用cd3/28微珠刺激原代人t细胞,然后用带有c末端mcherry融合体(ss1z-mch)或fmc63衍生的cd19特异性41bb-zetacar(19bbz)的ss1scfvzetacar单独或组合进行慢病毒转导。将模拟物转导的细胞用作对照。扩增t细胞直至对数期生长结束,并且在用间皮素-fc,随后与缀合至fitc的山羊抗人fc特异性多克隆抗体染色后,通过流式细胞术测定dsred以及表面car表达。
图26是证明ss1scfv的结合位点的互斥表达不是fmc63scfv所特有的图。用cd3/28微珠刺激原代人t细胞,随后用ss1scfvzetacar或各种cd19特异性41bb-zetacar(19bbz[fmc63scfv,214dscfv]或具有交替vh和vl取向的bl22scfvcar[h2l和l2h])进行慢病毒转导。ntd代表用作染色对照的模拟物转导的细胞。此外,单独的一组t细胞用ss1scfvzetacar和如上所述的不同cd19特异性car共转导。扩增t细胞直至对数期生长结束,通过用生物素化蛋白l(识别κ轻链),随后链霉亲和素apc同时用间皮素-fc,然后用与pe缀合的山羊抗人fc特异性多克隆抗体染色测定表面car表达。共转导的细胞显示,用其它scfv-car也观察到用基于fmc63的car观察到的互斥表达。
图27包括图27a和27b,描述了当两个scfv分子在细胞表面上共表达时(图27a)scfv结合的丢失的推定机制以及当基于骆驼的单vhh结构域的car在t细胞表面上与基于scfv的car组合表达时这种相互作用的推定的避免。
图28展示了基于骆驼科单vhh结构域的car可以在t细胞表面上与基于scfv的car组合表达,没有可感知的受体相互作用。在nfat依赖性启动子(nf-gfp)下表达gfp的jurkatt细胞用间皮素特异性激活的car(ss1-car),cd19特异性激活的(19-car)或使用egfr特异性的骆驼科vhh结构域产生的car(vhh-car)转导。在用激活car转导后,然后用识别cd19(19-pd1)的另外的抑制性car转导细胞以产生共表达活化和抑制性car(ss1+19pd1,19+19pd1或vhh+19pd1)的细胞。将转导的jurkatt细胞与1)缺乏所有靶抗原(k562),2)仅表达间皮素(k-meso),cd19(k-19)或egfr(a431),3)表达egfr和间皮素(a431-间皮素)或cd19(a431-cd19)的组合或4)表达cd19和间皮素(k-19/meso)的组合的不同细胞系共培养24小时。包括无刺激细胞(nostim)或含有1ug/mlokt3(okt3)的k562的附加条件也分别被包括作为nfat激活的阴性和阳性对照。通过流式细胞术评估gfp表达,其作为nfat活化的标记。
图29显示了kir2ds2序列注释。图29中提供的核苷酸序列称为seqidno:342。图29中提供的氨基酸序列称为seqidno:343。
图30显示了kir2dl3序列注释。图30中提供的核苷酸序列称为seqidno:344。图30中提供的氨基酸序列称为seqidno:345。
图31显示了nkp46序列注释。图31中提供的核苷酸序列称为seqidno:346。图31中提供的氨基酸序列称为seqidno:347。
图32显示了ss1-kirs2序列注释。图32中提供的核苷酸序列称为seqidno:348。图32中提供的氨基酸序列称为seqidno:349。
图33显示了ss1-kir2ds2序列注释。图33中提供的核苷酸序列称为seqidno:350。图33中提供的氨基酸序列称为seqidno:351。
图34显示了ss1-tnkp46序列注释。图34中提供的核苷酸序列称为seqidno:352。图34中提供的氨基酸序列称为seqidno:353。
图35显示了ss1-kirl3序列注释。图35中提供的核苷酸序列称为seqidno:354。图35中提供的氨基酸序列称为seqidno:355。
图36显示间皮素特异性cd3ζ和基于kir的car对表达间皮素的间皮瘤衍生细胞(em-meso细胞)具有相似的抗原特异性体外细胞毒性。用抗cd3/cd28刺激珠刺激原代人t细胞,并用表达ss1-kirs2间皮素特异性car的慢病毒载体转导。扩增后,将t细胞与表达em-meso的51cr-标记的k562细胞以指定的效应物与靶(e:t)比例混合。测定%裂解。
图37显示来自28ζcart治疗的小鼠的til通过用表达间皮素的间皮瘤衍生细胞(em-meso细胞)的刺激而丧失ifnγ分泌。用2x106em-meso细胞皮下注射scid–γc-/-(nsg)小鼠。在第16天静脉内注射用所示的car转导的5x106个原代人t细胞。在cart细胞输注后18天,用cd45磁珠分离til,并以指定的效应物与靶标(e:t)比例与em-meso混合。通过elisa在上清液中测定细胞因子浓度。
图38显示ss1-kirs2/dap12t细胞在体内介导强的抗肿瘤活性。用表达间皮素的2x106个间皮瘤衍生的细胞(em-meso细胞)皮下注射nod-scid–γc-/-(nsg)小鼠。在第20天静脉内注射用所示的car转导的5x106个原代人t细胞。在指定的时间通过测径器测量肿瘤体积。
图39包括图39a,39b和39c,是显示间皮素特异性car的结构的示意图。图39a表示间皮素特异性多链kir-car。图39b表示含有dap12的间皮素特异性单链kir-car。图39c表示含有cd28和cd3ζ信号传导结构域的间皮素特异性car。
图40显示了基于间皮素的car构建体(包括多链kirs/dap12和单链dap12构建体)的体内抗肿瘤活性。
图41显示了通过流式细胞术分析检测的基于间皮素的kir-car在人原代t细胞上的表面表达。
图42包括图42a和42b,显示了基于间皮素的kir-car对不表达间皮素的靶细胞(k562)(图42a)或工程化以表达间皮素的靶细胞(k562-meso)(图42b)的抗原特异性细胞毒活性。
图43包括图43a和43b,显示当在表达间皮素的靶细胞(k562-meso,黑色条形)或不表达间皮素的对照靶细胞(k562,中空条形)的存在下培养时,基于间皮素的kir-car的细胞因子产生。图43a显示ifn-γ产生;图43b显示il-2细胞因子产生。
图44包括图44a,44b,44c,44d和44e,显示了单个载体上的各种构型,例如,其中u6调节的shrna在ef1α调节的car编码元件的上游或下游。在图44a和44b所示示例性构建体中,通过u6和ef1α启动子以相同方向进行转录。在图44c和44d所示的示例性构建体中,通过u6和ef1α启动子在不同方向发生转录。在图44e中,shrna(和相应的u6启动子)在第一载体上,car(和相应的ef1α启动子)在第二载体上。
图45描绘了两种示例性rcar构型的结构。抗原结合成员包含抗原结合结构域,跨膜结构域和开关结构域。细胞内结合成员包含开关结构域,共刺激信号传导结构域和一级信号传导结构域。这两种构型证明本文所述的第一和第二开关结构域可以相对于抗原结合成员和细胞内结合成员处于不同的取向。本文进一步描述了其它rcar构型。
图46显示在细胞培养系统中通过低剂量的rad001增强表达car的转导的t细胞的增殖。在不同浓度的rad001存在下,将cart与nalm-6细胞共培养。在共培养4天后评估car阳性cd3阳性t细胞(黑色)和总t细胞(灰色)的数量。
图47描绘了以0.3,1,3和10mg/kg(mpk)每日rad001给药或载体给药的nalm6-luc细胞的肿瘤生长测量。圆圈表示载体;方块表示10mg/kg剂量的rad001;三角形表示3mg/kg剂量的rad001,倒三角形表示1mg/kg剂量的rad001;菱形表示0.3mg/kg剂量的rad001。
图48,包括图48a和48b,显示了药代动力学曲线,其显示具有nalm6肿瘤的nsg小鼠的血液中rad001的量。图48a显示rad001的第一剂量后的第0天pk。图48b显示了在最终rad001剂量后的第14天pk。菱形表示10mg/kg剂量的rad001;方块表示1mg/kg剂量的rad001;三角形表示3mg/kg剂量的rad001;x表示10mg/kg剂量的rad001。
图49,包括图49a和49b,显示了使用和不使用rad001给药的人源化cd19cart细胞的体内增殖。低剂量的rad001(0.003mg/kg)每天导致cart细胞增殖的增强,高于hucar19增殖的正常水平。图49a显示cd4+cart细胞;图49b显示cd8+cart细胞。圆圈表示pbs;正方形表示huctl019;三角形表示具有3mg/kgrad001的huctl019;倒三角形表示具有0.3mg/kgrad001的huctl019;菱形表示具有0.03mg/kgrad001的huctl019;圆圈表示具有0.003mg/kgrad001的huctl019。
详述
一方面,本发明提供了用于调节t细胞或其它细胞毒性细胞例如nk细胞的特异性和活性的组合物和方法。在一个实施方案中,提供了嵌合抗原受体(car),例如基于nk细胞受体(nkr)的nk细胞受体car(nkr-car),例如kir-car,ncr-car,slamf-car,fcr-car或ly49-car。在一个实施方案中,本发明提供一种类型的嵌合抗原受体(car),其中car被称为nkr,例如“kir-car”,其是car设计,其包含在自然杀伤(nk)细胞中发现的受体的组分。在一个实施方案中,nk受体包括但不限于杀伤细胞免疫球蛋白样受体(kir)。kir可以发挥激活kir或抑制kir的功能。
本发明的nkr-car例如kir-car的一个优点是nkr-car例如kir-car提供了调节细胞毒性细胞例如t细胞的特异性,以控制工程化t细胞的脱靶活性的方法。在一些情况下,本发明的kir-car不需要共刺激而增殖。
nkr-car可以通过衔接蛋白(例如,含有itam的衔接蛋白)递送信号。在一个实施方案中,本发明的kir-car包含活化kir,其通过与含有膜蛋白dap12的基于免疫酪氨酸的激活基序(itam)的相互作用递送其信号,dap12由这些蛋白的跨膜结构域内的残基介导。
在一个实施方案中,nkr-car可以通过抑制基序递送抑制信号。在一个实施方案中,本发明的kir-car包含抑制性kir,其通过与基于免疫酪氨酸的抑制基序(itim)的相互作用递送其信号。携带含有itim的胞质结构域的kir消除了激活信号,导致抑制nk细胞溶解和细胞因子产生活性。然而,本发明不应限于抑制性kir。相反,具有与抑制性信号相关的胞质结构域的任何抑制性蛋白质可用于构建本发明的car。
因此,本发明提供了包含nkr-car例如kir-car的组合物,包含nkr-car的载体,包含nkr-car例如kir-car的组合物,包装在病毒颗粒中的载体,和包含nkr-car,例如kit-car的重组t细胞或其他细胞毒性细胞。本发明还包括制备经遗传修饰的t细胞或其他细胞毒性细胞(例如nk细胞)或培养的nk细胞(例如nk92细胞)的方法,所述细胞表达nkr-car,例如kir-car(kir-cart),其中所表达的nkr-car例如kir-car包含具有来自nkr(例如kir)的细胞内信号分子的特异性抗体的抗原识别结构域。例如,在一些实施方案中,细胞内信号传导分子包括但不限于kiritam,kiritim等。
因此,本发明提供了调节经修饰以表达nkr-car例如kir-car的t细胞或其它细胞毒性细胞的特异性和活性的组合物和方法。本发明还提供了包含多种类型的nkr-car例如kir-car(例如活化nkr-car,例如kir-car和抑制nkr-car,例如kir-car)的细胞,其中多个nkr-car类型,例如kir-car参与调节t细胞活化的信号传导。在这方面,有效地控制和调节nkr-car细胞毒性细胞例如kir-cart细胞是有益的,使得它们杀死肿瘤细胞而不影响正常旁观者细胞。因此,在一个实施方案中,本发明还提供杀死癌细胞,同时使正常非癌细胞的消耗最小化,从而改善nkr-car例如kir-car治疗的特异性的方法。
在一个实施方案中,nkr-car例如kir-car方法包括在细胞上表达的多种类型的car的物理分离,其中多种类型的nkr-car例如kir-car与其靶抗原的结合是nkr-car细胞毒性细胞,例如kir-cart细胞活化所需的。例如,在kir-car方法中,来自多种类型的kir-car的每种kir-car具有不同的胞内信号传导结构域。例如,当多种类型的kir-car用于诱导kir-cart细胞活化时,第一类型的kir-car仅可包含来自活化性kir的胞内结构域,第二类型的car可仅包含来自抑制性kir的胞内结构域。以这种方式,通过活化kir-car(actkir-car)与感兴趣的恶性细胞上的抗原的接合来产生t细胞的条件激活。当t细胞遇到正常细胞时,具有针对存在于正常但非恶性细胞上的抗原的抗原结合结构域的抑制性kir-car(inhkir-car)提供来自actkir-car的激活作用的抑制。
在一个实施方案中,本发明提供了工程化以表达至少两种nkr-car例如至少两种kir-car的t细胞或其它细胞毒性细胞,其中第一nkr-car例如kir-car是actnkr-car,例如actkir-car,并且第二nkr-car例如kir-car是inhnkr-car,例如inhkir-car。在一个实施方案中,本发明提供了inhnkr-car,例如inhkir-car,其中inhnkr-car,例如inhkir-car与正常细胞的结合导致细胞毒性细胞的抑制,例如抑制kir-cart细胞活性。在一个实施方案中,inhnkr-car,例如inhkir-car与非癌细胞相关的抗原的结合导致nkr-car细胞毒性细胞(例如kir-cart细胞)的死亡。
在一个实施方案中,本发明的inhnkr-car,例如actkir-car可以与现有car组合使用,以调节car的活性。示例性car已经在pct/us11/64191中描述,其全部内容通过引用并入本文。
还已经发现,在具有包含抗原结合结构域(cmer)的多个嵌合膜包埋受体的细胞中,cmer的抗原结合结构域之间的相互作用可能是不期望的,例如因为相互作用抑制一种或多种的抗原结合结构域结合其同源抗原或可能产生具有未知同源抗原的新结合位点的能力。因此,本文公开了具有第一和第二非天然存在的cmer的细胞,其中抗原结合结构域使这种相互作用最小化。本文还公开了编码第一和第二非天然存在的此类cmer的核酸,以及制备和使用此类细胞和核酸的方法。在一个实施方案中,所述第一种和所述第二种非天然存在的cmer之一的抗原结合结构域包含scfv,另一种包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来自人或小鼠序列或非抗体支架的单vh结构域。
定义
除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。虽然与本文所述的那些类似或等同的任何方法和材料可以用于本发明的实践和/或用于本发明的测试,但是本文描述了优选的材料和方法。在描述和要求保护本发明时,将根据其如何定义使用以下术语,其中提供了定义。
还应当理解,本文所使用的术语仅用于描述特定实施方案的目的,而不意在限制。
冠词“一”和“一个”在本文中用于指该冠词的一个或多于一个(即至少一个)语法对象。作为示例,“一个元件”是指一个元件或多于一个元件。
当涉及可测量值例如量,持续时间等时,本文使用的“约”意在涵盖特定值的±20%或±10%的变化,在一些情况下±5%,在一些情况下±1%,在一些情况下为±0.1%,因为这些变化适于实施所公开的方法。
术语“衔接分子”,如该术语在本文所用,是指具有允许与两个或更多个分子相互作用的序列的多肽,并且在实施方案中,促进细胞毒性细胞的活化或失活。例如,在dap12的情况下,这包括通过跨膜结构域内的电荷相互作用与活化kir相互作用,以及通过胞质结构域内的磷酸化itam序列与信号分子如zap70或syk相互作用。
本文使用的术语“抗原”或“ag”定义为引发免疫应答的分子。这种免疫应答可涉及抗体产生,或特异性免疫活性细胞的活化,或两者。本领域技术人员将理解,任何大分子,包括几乎所有的蛋白质或肽,都可以用作抗原。此外,抗原可以来源于重组或基因组dna。本领域技术人员将理解,包含编码引发免疫应答的蛋白质的核苷酸序列或部分核苷酸序列的任何dna因此编码如本文所用的术语“抗原”。此外,本领域技术人员将理解,抗原不需要仅由基因的全长核苷酸序列编码。很明显,本发明包括但不限于使用多于一个基因的部分核苷酸序列,并且这些核苷酸序列以各种组合排列以编码引起所需免疫应答的多肽。此外,本领域技术人员将理解,抗原根本不需要由“基因”编码。显而易见的是,抗原可以是合成的或可以来源于生物样品。这样的生物样品可以包括但不限于组织样品,肿瘤样品,细胞或生物流体。
本文所用的术语“抗肿瘤效应”是指生物效应,其可以表现为肿瘤体积的减少,肿瘤细胞数目的减少,转移数目的减少,预期寿命的增加,或改善与癌性病症相关的各种生理症状。“抗肿瘤效应”也可以表现为本发明的肽,多核苷酸,细胞和抗体首先预防肿瘤发生的能力。
本文使用的术语“单采血液成分术”是指体外过程,通过该过程将供体或患者的血液从供体或患者中移出并穿过分离所选择的特定成分并将剩余部分返回到供体或患者的循环系统的装置,例如通过自家输血。因此,在“单采血液成分术样品”的上下文中,是指使用单采血液成分术获得的样品。
根据本发明,术语“自身抗原”是指被免疫系统识别为好像其为外来的任何自身抗原。自身抗原包括但不限于细胞蛋白,磷蛋白,细胞表面蛋白,细胞脂质,核酸,糖蛋白,包括细胞表面受体。
本文使用的术语“自身免疫性疾病”定义为由自身免疫应答引起的病症。自身免疫性疾病是对自身抗原的不适当和过度反应的结果。自身免疫性疾病的实例包括但不限于阿狄森氏病,斑秃,强直性脊柱炎,自身免疫性肝炎,自身免疫性腮腺炎,克罗恩氏病,糖尿病(i型),营养不良性大疱性表皮松解,附睾炎,肾小球肾炎,格雷夫斯病,格-巴二氏综合征,桥本氏病,溶血性贫血,系统性红斑狼疮,多发性硬化,重症肌无力,寻常型天疱疮,牛皮癣,风湿热,类风湿性关节炎,结节病,硬皮病,干燥综合征,脊柱关节病,甲状腺炎,血管炎,白癜风,粘液性水肿,恶性贫血,溃疡性结肠炎等。
如本文所使用的,术语“自体的”意指来源于个体的任何物质,其随后被重新引入相同的个体。
本文所用的术语“同种异体的”是指来源于与引入该物质的个体相同物种的不同动物的任何物质。当一个或多个基因座处的基因不相同时,认为两个或更多个个体彼此是同种异体的。在一些方面,来自相同物种的个体的同种异体材料可以在遗传上充分不同以发生抗原性相互作用。在一个实施方案中,同种异体是指来源于相同物种的不同动物的移植物。
“嵌合抗原受体”或“car”,如该术语在本文所用,是指与来自例如t细胞或nk细胞的细胞免疫功能受体或衔接分子共享结构和功能特性的嵌合多肽。car包括tcar和nkr-car。在实施方案中,car包含结合同源抗原(例如本文所述的肿瘤抗原)的抗原结合结构域。在结合同源抗原后,car可以活化或失活其所处的细胞毒性细胞,或调节细胞的抗肿瘤活性或调节细胞的免疫应答。
在一些实施方案中,car多肽构建体中的结构域在相同的多肽链中,例如,包含嵌合融合蛋白。在一些实施方案中,car多肽构建体中的结构域不彼此连续,例如在不同的多肽链中,例如如本文所述的rcar中提供的。
如本文所用的术语“自然杀伤细胞免疫功能受体-嵌合抗原受体”或“nkr-car”是指与自然杀伤细胞免疫功能受体(nkr)或来自nk细胞的衔接分子共有功能和结构特性的car。在实施方案中,nkr-car包含抗原结合结构域,跨膜结构域(例如nkr跨膜结构域)和/或胞质结构域(例如nkr胞质结构域)中的两个或全部。
如本文所用的术语“fc受体-嵌合抗原受体”或“fcr-car”是指与fc受体(fcr)共有功能和结构特性的car。如本文所用的术语“杀伤细胞免疫球蛋白样受体-嵌合抗原受体”或“kir-car”是指与杀伤细胞免疫球蛋白样受体(kir)共有功能和结构特性的car。
如本文所用的术语“ly49受体-嵌合抗原受体”或“ly49-car”是指与ly49受体(ly49)共有功能和结构特性的car。
如本文所用的术语“天然细胞毒性受体-嵌合抗原受体”或“ncr-car”是指与天然细胞毒性受体(ncr)共享功能和结构特性的car。
如本文所用的术语“信号传导淋巴细胞活化分子家族-嵌合抗原受体”或“slam-car”或“slamf-car”是指与slam或slamf共享功能和结构特性的car。
如本文所用的术语“基于t细胞的嵌合抗原受体”或“tcar”是指与来自t细胞的细胞免疫功能受体或衔接分子共享功能和结构特性的car。在实施方案中,tcar包含抗原结构域,一级胞内信号传导结构域和任选的一个或多个共刺激信号传导结构域。
本文所用的术语“抗体”是指来源于与靶抗原特异性结合的免疫球蛋白分子的蛋白质或多肽序列。抗体可以是来源于天然来源或来自重组来源的完整免疫球蛋白,并且可以是完整免疫球蛋白的免疫反应性部分。抗体可以是多克隆或单克隆,多链或单链或完整的免疫球蛋白,并且可以来自天然来源或来自重组来源。抗体通常是免疫球蛋白分子的四聚体。本文所述的抗体分子可以多种形式存在,其中抗体的抗原结合部分表达为连续多肽链的一部分,包括例如单结构域抗体片段(sdab),单链抗体(scfv)和人源化或人抗体,例如,如本文所述。
术语“抗体片段”是指完整抗体或其重组变体的至少一部分,并且是指完整抗体的抗原决定可变区,其足以赋予抗体片段与靶标,例如抗原的识别和特异性结合。抗体片段的实例包括但不限于单链结构域抗体(sdab),fab,fab’,f(ab’)2,和fv片段,线性抗体,scfv抗体,scfv抗体片段,线性抗体,单结构域抗体例如sdab(vl或vh),骆驼科vhh结构域和由抗体片段形成的多特异性抗体,所述抗体片段为例如包含通过在铰链区的二硫键连接的两个fab片段的二价片段,和抗体的分离的cdr或其它表位结合片段。也可以将抗原结合片段掺入单结构域抗体,最大抗体,微型抗体,纳米抗体,胞内抗体,双抗体,三抗体,四抗体,v-nar和双scfv中(参见例如hollingerandhudson,naturebiotechnology23:1126-1136,2005)。抗原结合片段也可以移植到基于多肽例如iii型纤连蛋白(fn3)的支架中(参见美国专利号6,703,199,其描述了纤连蛋白多肽微抗体)。
术语“scfv”是指包含至少一个包含轻链可变区的抗体片段和至少一个包含重链可变区的抗体片段的融合蛋白,其中轻链和重链可变区通过短的柔性多肽接头连续连接,并且能够表达为单链多肽,并且其中所述scfv保留其所源自的完整抗体的特异性。除非另有说明,如本文所使用的,scfv可以具有任何顺序的vl和vh可变区,例如相对于多肽的n末端和c末端,scfv可以包含vl-接头-vh或可以包含vh-接头-vl。
本文所用的术语“互补决定区”或“cdr”是指赋予抗原特异性和结合亲和力的抗体可变区内的氨基酸序列。例如,一般来说,在每个重链可变区(例如hcdr1,hcdr2和hcdr3)中有三个cdr,并且在每个轻链可变区(lcdr1,lcdr2和lcdr3)中有三个cdr。给定cdr的精确氨基酸序列边界可以使用多种公知方案中的任何一种来确定,包括kabatetal.(1991),“sequencesofproteinsofimmunologicalinterest,”5thed.publichealthservice,nationalinstitutesofhealth,bethesda,md描述的那些方案(“kabat”编号方案),al-lazikanietal.,(1997)jmb273,927-948(“chothia”编号方案)或其组合。根据kabat编号方案,在一些实施方案中,重链可变结构域(vh)中的cdr氨基酸残基编号为31-35(hcdr1),50-65(hcdr2)和95-102(hcdr3)和轻链可变结构域(vl)中的cdr氨基酸残基编号为24-34(lcdr1),50-56(lcdr2),和89-97(lcdr3)。根据chothia编号方案,在一些实施方案中,vh中的cdr氨基酸编号为26-32(hcdr1),52-56(hcdr2)和95-102(hcdr3);vl中的cdr氨基酸残基编号为26-32(lcdr1),50-52(lcdr2)和91-96(lcdr3)。在组合的kabat和chothia编号方案中,在一些实施方案中,cdr对应于作为kabatcdr,chothiacdr或两者的一部分的氨基酸残基。例如,在一些实施方案中,cdr对应于vh(例如哺乳动物vh,例如人vh)中的氨基酸残基26-35(hcdr1),50-65(hcdr2)和95-102(hcdr3);和vl(例如哺乳动物vl,例如人vl)中的氨基酸残基24-34(lcdr1),50-56(lcdr2),和89-97(lcdr3)。
包含抗体或其抗体片段的本发明的car组合物的部分可以多种形式存在,其中抗原结合结构域表达为连续多肽链的一部分,包括例如单结构域抗体片段(sdab),单链抗体(scfv)和人源化或人抗体(harlowetal.,1999,in:usingantibodies:alaboratorymanual,coldspringharborlaboratorypress,ny;harlowetal.,1989,in:antibodies:alaboratorymanual,coldspringharbor,newyork;houstonetal.,1988,proc.natl.acad.sci.usa85:5879-5883;birdetal.,1988,science242:423-426)。在一个方面,本发明的car组合物的抗原结合结构域包含抗体片段。在另一方面,car包含含有scfv的抗体片段。
如本文所用,术语“结合结构域”或“抗体分子”(本文中也称为“抗靶标(例如间皮素)结合结构域”)是指蛋白质,例如免疫球蛋白链或其片段,其包含至少一个免疫球蛋白可变结构域序列。术语“结合结构域”或“抗体分子”包括抗体和抗体片段。在一个实施方案中,抗体分子是多特异性抗体分子,例如其包含多个免疫球蛋白可变结构域序列,其中所述多个序列的第一免疫球蛋白可变结构域序列对第一表位具有结合特异性,并且所述多个序列的第二免疫球蛋白可变结构域序列对第二表位具有结合特异性。在一个实施方案中,多特异性抗体分子是双特异性抗体分子。双特异性抗体对不超过两种抗原具有特异性。双特异性抗体分子的特征在于对第一表位具有结合特异性的第一免疫球蛋白可变结构域序列和对第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。
本文所用的“抗体重链”是指存在于处于天然存在的构象的所有抗体分子中的两种类型多肽链中较大的一种。
本文所用的“抗体轻链”是指存在于处于天然存在的构象的所有抗体分子中的两种类型的多肽链中较小者。κ和λ轻链是指两种主要的抗体轻链同种型。
本文所用的术语“合成抗体”或“重组抗体”是指使用重组dna技术产生的抗体分子,例如由本文所述的噬菌体表达的抗体分子。该术语也应理解为是指通过合成编码抗体分子的dna分子产生的抗体分子,该dna分子表达抗体蛋白或指定抗体的氨基酸序列,其中dna或氨基酸序列已使用本领域可获得和熟知的合成dna或氨基酸序列技术获得。
本文所用的术语“癌症”定义为以异常细胞的快速和不受控制的生长为特征的疾病。癌细胞可以局部扩散或通过血流和淋巴系统扩散到身体的其他部分。各种癌症的实例包括但不限于乳腺癌,前列腺癌,卵巢癌,宫颈癌,皮肤癌,胰腺癌,结肠直肠癌,肾癌,肝癌,脑癌,淋巴瘤,白血病,肺癌,神经胶质瘤,等等。术语“肿瘤”和“癌症”在本文中可互换使用,例如,两个术语涵盖实体和液体肿瘤,例如弥漫性或循环肿瘤。如本文所用,术语“癌症”或“肿瘤”包括癌前病变以及恶性癌症和肿瘤。
术语“组合”是指一种剂量单位形式的固定组合,或组合施用,其中本发明的化合物和组合伴侣(例如如下所述的另一种药物,也称为“治疗剂”或“共同药剂“)可以在相同时间独立施用或在时间间隔内单独施用,特别是其中这些时间间隔允许组合伴侣显示共同的例如协同效应。单一组分可以包装在药盒中或单独包装。一种或两种组分(例如,粉末或液体)可以在施用前重构或稀释至所需剂量。本文所用的术语“共同施用”或“组合施用”等意在包括向有需要的单个受试者(例如患者)施用所选择的组合伴侣,并且旨在包括其中所述药剂不一定通过相同的给药途径施用或同时给药的治疗方案。本文所用的术语“药物组合”是指由多于一种活性成分的混合或组合产生的产物,并且包括活性成分的固定和非固定组合。术语“固定组合”是指活性成分,例如本发明的化合物和组合伴侣以单个实体或剂量的形式同时施用于患者。术语“非固定组合”是指活性成分,例如本发明的化合物和组合伴侣作为分离的实体同时,并行或没有特定时间限制地顺序施用于患者,其中所述施用在患者体内提供治疗有效水平的两种化合物。后者也适用于鸡尾酒疗法,例如,施用三种或更多种活性成分。
如本文所用,术语“保守序列修饰”意指不显著影响或改变含有氨基酸序列的抗体的结合特征的氨基酸修饰。这种保守修饰包括氨基酸取代,添加和缺失。可以通过本领域已知的标准技术,例如定点诱变和pcr介导的诱变,将修饰引入本发明的抗体中。保守氨基酸取代是其中氨基酸残基被具有相似侧链的氨基酸残基替换的取代。具有相似侧链的氨基酸残基家族在本领域中已经定义。这些家族包括具有碱性侧链(例如赖氨酸,精氨酸,组氨酸),酸性侧链(例如天冬氨酸,谷氨酸),不带电的极性侧链(例如甘氨酸,天冬酰胺,谷氨酰胺,丝氨酸,苏氨酸,酪氨酸,半胱氨酸,色氨酸),非极性侧链(例如丙氨酸,缬氨酸,亮氨酸,异亮氨酸,脯氨酸,苯丙氨酸,甲硫氨酸),β-分支侧链(例如苏氨酸,缬氨酸,异亮氨酸)和芳族侧链(例如,酪氨酸,苯丙氨酸,色氨酸,组氨酸)的氨基酸。因此,例如,本发明抗体的cdr区内的一个或多个氨基酸残基可以被来自相同侧链家族的其他氨基酸残基替换,并且可以使用本文所述的功能测定法测试改变的抗体结合frβ的能力。
“组成型”启动子是当与编码或指定基因产物的多核苷酸有效连接时,使得在细胞的大多数或所有生理条件下在细胞中产生基因产物的核苷酸序列。
应用于衔接分子和信号传导结构域的细胞质和细胞内,在本文中可互换使用。
如该术语在本文中使用的,“来源于”表示第一和第二分子之间的关系。它一般是指在第一分子和第二分子之间的结构相似性,并且不暗示或包括对来源于第二分子的第一分子的过程或来源的限制。例如,在来源于cd3ζ分子的胞内信号传导结构域的情况下,胞内信号传导结构域保持足够cd3ζ结构使得其具有所需的功能,即,在适当的条件下产生信号的能力。它不暗示或包括对产生胞内信号传导结构域的具体过程的限制,例如,它并不意味着,为了提供胞内信号传导结构域,必须从cd3ζ序列开始并缺失不需要的序列,或施加突变,以得到胞内信号传导结构域。
术语“刺激”指的是通过刺激分子(例如,tcr/cd3复合体)与其同源配体结合,从而介导信号转导事件的初次应答,诸如,但由不限于,经tcr/cd3复合体的信号转导。刺激可介导某些分子的改变的表达,例如tgf-β的下调,和/或细胞骨架结构的重组等。
术语“刺激性分子”是指由t细胞表达的提供一级细胞质信号传导序列的分子,该信号传导序列以刺激性方式调节用于t细胞信号传导途径的至少一些方面的tcr复合体的一级活化。在一个方面,一级信号是通过例如tcr/cd3复合体与负载有肽的mhc分子的结合启动,并且其导致介导t细胞应答,包括,但不限于增殖、活化、分化等。以刺激方式起作用的一级细胞质信号传导序列(也称为“一级信号传导结构域”)可以含有被称为基于免疫受体酪氨酸的活化基序或itam的信号传导基序。特别地用于本发明的含有itam的一级细胞质信号传导序列的实例包括,但不限于来源于下述的那些:tcrζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b、cd278(也称作“icos”)、fcεri、cd66d、dap10和dap12。在本发明的特异性car中,在本发明的任一个或更多个car中的胞内信号传导结构域包括细胞内信号传导序列,例如cd3-ζ的初级信号传导序列。在本发明的特异性car中,cd3-ζ的初级信号传导序列是如seqidno:9中提供的序列或来自非人类种类例如小鼠、啮齿类动物、猴、猿等的等同残基。在本发明的特异性car中,cd3-ζ的初级信号传导序列是如seqidno:10中提供的序列或来自非人类种类例如小鼠、啮齿类动物、猴、猿等的等同残基。
术语“抗原呈递细胞”或“apc”是指其表面上呈递与主要组织相容性复合体(mhc的)复合的外来抗原的免疫系统细胞,比如辅助细胞(例如,b-细胞、树突细胞等)。t-细胞可以使用其t-细胞受体(tcr)识别这些复合体。apc加工抗原且将其呈递给t-细胞。
如本文所用的术语“胞内信号传导结构域”,是指分子的细胞内部分。胞内信号传导结构域可以产生促进含car细胞(例如cart细胞或表达car的nk细胞)的免疫效应子功能的信号。免疫效应子功能的实例(例如在cart细胞或表达car的nk细胞中)包括细胞溶解活性和辅助活性,包括细胞因子的分泌。在实施方案中,细胞内信号结构域转导效应子功能信号并指导细胞进行特化功能。虽然可以使用整个胞内信号传导结构域,但在许多情况下,不必使用整个链。就使用胞内信号传导结构域的截短部分而言,此类截短部分可用于代替完整链,只要其转导效应子功能信号即可。术语胞内信号传导结构域因此意在包括足以转导效应子功能信号的胞内信号传导结构域的任何截短部分。
在一个实施方案中,胞内信号传导结构域可以包括一级胞内信号传导结构域。示例性的一级胞内信号传导结构域包括来源于负责初次刺激或抗原依赖性刺激的分子的那些。在一个实施方案中,胞内信号传导结构域可以包括共刺激胞内结构域。示例性的共刺激胞内信号传导结构域包括来源于负责共刺激信号或抗原独立的刺激的分子的那些。例如,在表达car的免疫效应细胞,例如cart细胞或表达car的nk细胞的情况下,一级胞内信号传导结构域可以包含t细胞受体的细胞质序列,并且共刺激胞内信号传导结构域可以包含来自共同受体或共刺激性分子的细胞质序列。
一级胞内信号传导结构域可以包括被称为基于免疫受体酪氨酸的活化基序或itam的信号传导基序。含有itam的一级细胞质信号传导序列的实例包括,但不限于来源于下述的那些:cd3ζ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(“icos”),fcεri,cd66d,dap10和dap12。
术语“ζ”或备选地“ζ链”、“cd3-ζ”或“tcrζ”定义为如genbanacc.no.bag36664.1提供的蛋白质或来自非人类种类(例如小鼠、啮齿类动物、猴子、猿等)的等同残基,且“ζ刺激结构域”或备选地“cd3-ζ刺激结构域”或“tcr-ζ刺激结构域”定义为来自ζ链的胞质结构域的氨基酸残基,其足以在功能上传递t细胞活化所需的起始信号。在一个方面,ζ的胞质结构域包括genbankacc.no.bag36664.1的残基52至164或作为其功能性同源物的来自非人类种类(例如小鼠、啮齿类动物、猴子、猿等)的等同残基。在一个方面,“ζ刺激结构域”或“cd3-ζ刺激结构域”是作为seqidno:9提供的序列。在一个方面,“ζ刺激结构域”或“cd3-ζ刺激结构域”是如seqidno:10提供的序列。
术语“共刺激分子”是指t细胞上的同源结合配偶体,其与共刺激配体特异性结合从而介导t细胞的共刺激反应,例如但不限于增殖。共刺激分子是有效免疫应答所需的除抗原受体或其配体之外的细胞表面分子。共刺激分子包括但不限于mhci类分子,tnf受体蛋白,免疫球蛋白样蛋白,细胞因子受体,整联蛋白,信号传导淋巴细胞活化分子(slam蛋白),激活nk细胞受体,btla,toll配体受体,ox40,cd2,cd7,cd27,cd28,cd30,cd40,cds,icam-1,lfa-1(cd11a/cd18),4-1bb(cd137),b7-h3,cds,icam-1,icos(cd278),gitr,baffr,light,hvem(lightr),kirds2,slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd19,cd4,cd8α,cd8β,il2rβ,il2rγ,il7rα,itga4,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,nkg2d,nkg2c,tnfr2,trance/rankl,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),cd69,slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,lat,gads,slp-76,pag/cbp,cd19a和与cd83特异性结合的配体。
共刺激胞内信号传导结构域是指共刺激分子的细胞内部分。胞内信号传导结构域可以包括分子的全部细胞内部分或全部天然胞内信号传导结构域、或其功能片段。
术语“4-1bb”是指具有如genbankacc.no.aaa62478.2提供的氨基酸序列的tnfr超家族的成员,或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基;并且“4-1bb共刺激结构域”被定义为genbankacc.no..aaa62478.2的氨基酸残基214-255,或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基。在一个方面,“4-1bb共刺激结构域”为如seqidno:14提供的序列或来自非人类物种例如小鼠、啮齿类动物、猴子、猿等的等同残基。
正如本文中使用的那样,术语“免疫效应细胞”,是指参与免疫应答,例如,促进免疫效应子应答的细胞。免疫效应细胞的实例包括t细胞,例如,α/β的t细胞和γ/δt细胞、b细胞、自然杀伤(nk)细胞、自然杀伤t(nkt)细胞、肥大细胞和骨髓源性吞噬细胞。
正如本文中使用的那样,术语“免疫效应子功能或免疫效应子应答”是指免疫效应细胞,例如增强或促进靶细胞的免疫攻击的功能或反应。例如,免疫效应子功能或应答是指促进靶细胞的杀伤或者抑制生长或增殖的t细胞或nk细胞的属性。在t细胞的情况下,一级刺激和共刺激是免疫效应子功能或应答的实例。
术语“效应子功能”是指细胞的特化功能。例如,t细胞的效应子功能可以是溶细胞活性或辅助活性,包括细胞因子的分泌。
术语“编码”是指多核苷酸比如基因、cdna、或mrna中的核苷酸的特异性序列在生物学过程中作为合成其它聚合物和大分子的模板的固有特性,该聚合物以及大分子具有确定的核苷酸序列(例如,rrna、trna和mrna)或确定的氨基酸序列及由其得到的生物学特性。因此,如果与所述基因对应的mrna的转录和翻译在细胞或其它生物系统中产生蛋白质,则基因编码蛋白质。其核苷酸序列与mrna序列相同且通常被提供在序列表中的编码链和用作转录基因或cdna的模板的非编码链这两者都可以被称为编码该基因或cdna的蛋白或其他产物。
除非另有说明,否则“编码氨基酸序列的核苷酸序列”包括作为彼此的简并形式且编码相同氨基酸序列的所有核苷酸序列。编码蛋白质和rna的核苷酸序列可以包括内含子。
术语“有效量”或“治疗有效量”在本文中可互换地使用,并且是指如本文中所述有效地实现特定生物学结果的化合物、制剂、物质或组合物的量。这样的结果可以包括但不限于通过本领域任何合适的方法测定的病毒感染的抑制。
如本文所用的“内源的”是指来自或在生物体、细胞、组织或系统内部产生的任何物质。
如本文所用的“外源的”是指从生物体、细胞、组织或系统外部引入或产生的任何物质。
本文使用的术语“表达”定义为由其启动子驱动的特定核苷酸序列的转录和/或翻译。
术语“表达”是指由启动子驱动的特定核苷酸序列的转录和/或翻译。
术语“转移载体”是指包括分离的核酸且可用于将所分离的核酸递送至细胞内部的物质组合物。大量载体是本领域已知的,包括,但不限于线性多核苷酸、与离子或两亲性化合物有关的多核苷酸、质粒和病毒。因此,术语“转移载体”包括自主复制的质粒或病毒。该术语也应当被解释为进一步包括非质粒和促进核酸转移到细胞中的非病毒化合物,比如例如聚赖氨酸化合物、脂质体等。病毒转移载体的实例包括,但不限于腺病毒载体、腺伴随病毒载体、逆转录病毒载体、慢病毒(lentiviral)载体等。
"表达载体”是指包含重组多核苷酸的载体,其包含有效连接要表达的核苷酸序列的表达控制序列。表达载体包含足够的用于表达的顺式作用元件;用于表达的其它元件可以由宿主细胞提供或在体外表达系统中。表达载体包括本领域已知的所有那些,如被掺入重组多核苷酸的粘粒、质粒(例如,裸的或包含在脂质体中)和病毒(例如,慢病毒、逆转录病毒、腺病毒和腺伴随病毒)。
本文所用的术语“载体”是指可用于递送和/或表达核酸分子的任何载体。其可以是如本文所述的转移载体或表达载体。
本文所用的术语“同源的”或“同一性”是指两个聚合分子之间,例如两个核酸分子之间,例如两个dna分子或两个rna分子之间,或两个多肽分子之间的亚基序列同一性。当两个分子两者中的亚基位置被相同的单体亚基占据时;例如,如果两个dna分子的每一个中的位置被腺嘌呤占据,则它们在该位置是同源的。两个序列之间的同源性是匹配或同源位置数目的直接函数;例如,如果两个序列中的位置的一半(例如,长度为10个亚基的聚合物中的5个位置)是同源的,则这两个序列是50%同源的;如果90%的位置(例如,10个中的9个)是匹配或同源的,则两个序列是90%同源的。
非人(例如鼠)抗体的“人源化”形式是嵌合免疫球蛋白,免疫球蛋白链或其片段(例如fv,fab,fab’,f(ab’)2或抗体的其他抗原结合子序列),其含有来自非人免疫球蛋白的最小序列。大多数情况下,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体的互补决定区(cdr)的残基被来自非人物种(供体抗体)例如小鼠、大鼠或兔的具有所需的特异性,亲和力和能力的cdr的残基替换。在一些情况下,人免疫球蛋白的fv构架区(fr)残基被相应的非人残基替换。此外,人源化抗体可以包含既不在受体抗体中也不在输入的cdr或构架序列中发现的残基。进行这些修饰以进一步改进和优化抗体性能。通常,人源化抗体将包含基本上所有至少一个,通常两个可变结构域,其中所有或基本上所有cdr区对应于非人免疫球蛋白的cdr区,并且所有或基本上所有fr区是人免疫球蛋白序列的那些fr区。人源化抗体最佳地还将包含通常是人免疫球蛋白的免疫球蛋白恒定区(fc)的至少一部分。更多细节参见jonesetal.,nature,321:522-525,1986;reichmannetal.,nature,332:323-329,1988;presta,curr.op.struct.biol.,2:593-596,1992。
“完全人”是指免疫球蛋白,例如抗体或抗体片段,其中整个分子是人源的或由与人形式的抗体或免疫球蛋白相同的氨基酸序列组成。
如本文所用,“指导材料”包括可用于传达本发明的组合物和方法的有用性的出版物,记录,图表或任何其它表达介质。本发明的试剂盒的指导材料可以例如固定到含有本发明的核酸,肽和/或组合物的容器中,或者与含有核酸,肽和/或组合物的容器一起运输。或者,指导材料可以与容器分开地装运,目的是指导材料和化合物由接受者协同使用。
术语“分离的”意指从天然状态改变或除去。例如,天然存在于活动物中的核酸或肽不是“分离的”,但是与其天然状态的共存材料部分或完全分离的相同核酸或肽是“分离的”。分离的核酸或蛋白质可以以基本上纯化的形式存在,或可以存在于非天然环境,例如宿主细胞中。
在本发明的上下文中,使用通常出现的核酸碱基的以下缩写。“a”是指腺苷,“c”是指胞嘧啶,“g”是指鸟苷,“t”是指胸苷,“u”是指尿苷。
除非另有说明,“编码氨基酸序列的核苷酸序列”包括彼此是简并形式并且编码相同氨基酸序列的所有核苷酸序列。短语编码蛋白质或rna的核苷酸序列还可包括内含子,其程度为编码蛋白质的核苷酸序列在一些形式中可含有内含子。
如本文所用的“慢病毒”是指逆转录病毒家族的种类。慢病毒在逆转录病毒中是独特的,因为其能够感染非分裂细胞;它们可以将大量的遗传信息递送到宿主细胞的dna中,从而它们是基因递送载体的最有效方法之一。hiv、siv和fiv都是慢病毒的实例。来源于慢病毒的载体提供在体内实现显著水平的基因转移的手段。
术语“慢病毒载体”是指来源于慢病毒基因组的至少一部分的载体,特别地包括自我灭活性慢病毒载体,如milone等人,mol.ther.17(8):1453–1464(2009)中提供的。可用于临床中的慢病毒载体的其它实例包括,但不限于例如来自oxfordbiomedica的
在scfv的上下文中使用的术语“柔性多肽接头”或“接头”是指由氨基酸组成的肽接头,例如单独或组合使用的甘氨酸和/或丝氨酸残基,以连接可变重链区和可变轻链区。在一个实施方案中,柔性多肽接头是gly/ser接头并且包含氨基酸序列(gly-gly-gly-ser)n(seqidno:38)。其中n是等于或大于1的正整数。例如,n=1,n=2,n=3,n=4,n=5和n=6,n=7,n=8,n=9和n=10。在一个实施方案中,所述柔性多肽接头包括但不限于(gly4ser)4(seqidno:27)或(gly4ser)3(seqidno:28)。在另一个实施方案中,接头包括多个重复的(gly2ser),(glyser)或(gly3ser)(seqidno:29)。还包括在本发明范围内的是wo2012/138475中描述的接头,其通过引用并入本文)。
如本文所用的术语“nk细胞免疫功能受体”或“nkr”是指在nk细胞中表达的内源性天然存在的跨膜蛋白,其可与抗原呈递细胞上的配体接合并调节nk细胞免疫功能应答,例如,其可以调节nk细胞的细胞溶解活性或细胞因子分泌。nkr可以有助于激活(激活nkr或actnkr)或抑制(抑制性nkr或inhnkr)。通常,nkr包含胞外配体结合结构域(ecd),跨膜结构域(tm)和细胞内胞质结构域(icd)。nkr包括受体的杀伤免疫球蛋白样受体(kir)家族如kir2ds2,nk细胞受体(ncr)受体家族受体如nkp46(ncr1),信号传导淋巴细胞活化受体(slam)家族(slamf)受体例如2b4,以及fc结合受体例如igg结合受体cd16(fcriii)。由nkr调节的nk细胞免疫功能应答的实例包括靶细胞杀伤(通常称为细胞毒性或细胞溶解),细胞因子分泌和/或增殖。通常,适用于本文所述的方法和组合物的nkr是人nkr(或hnkr)。在一个实施方案中,还包括小鼠中的ly49受体家族,其通过趋同进化出现以提供与鼠nk和t细胞中的kir相同功能。
术语“有效连接”是指调节序列和异源核酸序列之间的功能性连接,其导致异源核酸序列的表达。例如,当第一核酸序列与第二核酸序列处于功能性关系时,第一核酸序列与第二核酸序列有效连接。例如,如果启动子影响编码序列的转录或表达,则启动子有效连接编码序列。通常,有效连接的dna序列是邻接的,并且在结合两个蛋白编码区时必需在同一读码框中。
免疫原性的组合物的“肠胃外”施用包括例如皮下(s.c.)、静脉内(i.v.)、肌肉内(i.m.)或胸骨内注射、或输注技术。
本文可互换使用的术语“核酸”,“核酸分子”或“多核苷酸”被定义为核苷酸链。此外,核酸是核苷酸的聚合物。因此,本文所用的核酸和多核苷酸是可互换的。本领域技术人员具有一般知识,即核酸是多核苷酸,其可以水解成单体“核苷酸”。单体核苷酸可以水解成核苷。如本文所使用的,多核苷酸包括但不限于通过本领域可用的任何方法获得的所有核酸序列,包括但不限于重组手段,即使用普通克隆技术和pcrtm等从重组文库或细胞基因组克隆核酸序列,以及通过合成方法。在实施方案中,本文的核酸是脱氧核糖核酸(dna)或核糖核酸(rna),或其dna或rna的组合及其单链或双链形式的聚合物。术语“核酸”包括基因,cdna或mrna。在一个实施方案中,核酸分子是合成的(例如化学合成的)或重组的。除非明确地限定,否则该术语包括含有天然核苷酸的类似物或衍生物的核酸,所述类似物或衍生物具有与参考核酸类似的结合性质,并且以与天然存在核苷酸类似的方式代谢。除非另有说明,否则特定的核酸序列也隐含地包括其保守修饰的变体(例如,简并密码子取代)、等位基因、直向同源物、snp和互补序列以及明确指定的序列。特别地,简并密码子取代可以通过产生序列而实现,所述序列中一个或更多个所选择的(或所有的)密码子的三个位置被混合碱基和/或去氧肌苷残基取代(batzer等人,nucleicacidres.
19:5081(1991);ohtsuka等人,j.biol.chem.260:2605-2608(1985);和
rossolini等人,mol.cell.probes8:91-98(1994))。
本文所用的术语“肽”、“多肽”和“蛋白质”可互换地使用,并且是指由肽键共价连接的氨基酸残基组成的化合物。蛋白质或肽必须含有至少两个氨基酸,并且对于可以包括蛋白质或肽的序列的氨基酸的最大数量没限制。多肽包括含有彼此通过肽键结合的两个或多个氨基酸的任何肽或蛋白质。正如本文中使用的那样,该术语是指短链(其在本领域通常也称为例如肽、寡肽和寡聚物)以及较长链(其在本领域通常也称为蛋白质,其存在多种类型)。“多肽”包括例如生物学活性片段、基本上同源的多肽、寡肽、同型二聚体、异二聚体、多肽的变体、修饰的多肽、衍生物、类似物、融合蛋白等。多肽包括天然肽、重组肽、合成胎或其组合。
如本文所用的术语“启动子”被定义为被细胞的合成机构识别的、或被引入了合成机构、启动多核苷酸序列的特异性转录所需要的dna序列。
如本文所用的术语“启动子/调节序列”是指有效连接启动子/调节序列的基因产物的表达所需的核酸序列。在某些情况下,该序列可以是核心启动子序列,并且在其它情况下,该序列也可包括增强子序列及表达基因产物所需的其它调控元件。启动子/调节序列可以例如是以组织特异性方式表达基因产物的序列。
“可诱导的”启动子是当有效连接编码或指定基因产物的多核苷酸时,基本上仅当细胞中存在对应于启动子的诱导物时,才引起基因产物在细胞中产生的核苷酸序列。
“组织特异性的”启动子是当有效连接编码或指定基因的多核苷酸时,基本上仅当细胞为组织类型的细胞时才引起基因产物在细胞中产生的核苷酸序列。
“信号转导途径”是指在将信号从细胞的一部分传递到细胞的另一部分中发挥作用的多种信号转导分子之间的生化关系。短语“细胞表面受体”包括能够接收信号并跨细胞膜传递信号的分子和分子复合体。
术语“受试者”意欲包括其中可引发免疫应答的活的生物体(例如哺乳动物)。
如本文所用,“基本上纯化的”细胞是基本上不含其它细胞类型的细胞。基本上纯化的细胞还指已经与其通常与其天然存在状态相关的其它细胞类型分离的细胞。在一些情况下,基本上纯化的细胞群体是指同源的细胞群体。在其它情况下,该术语简单地指已经与细胞分离的细胞,后者细胞在其天然状态下与前者细胞天然结合。在一些实施方案中,细胞在体外培养。在其他实施方案中,细胞不在体外培养。
如本文所用,5’帽(也称为rna帽,rna7-甲基鸟苷帽或rnam7g帽)是转录开始后不久已经添加到真核信使rna的“前”或5’末端的经修饰的鸟嘌呤核苷酸。5’帽由与首先转录的核苷酸连接的末端基团组成。其存在对于核糖体的识别和保护免于rna酶的作用是至关重要的。帽添加与转录偶联,并且共转录地发生,使得每个都影响另一个。在转录开始后不久,合成的mrna的5’端通过与rna聚合酶结合的帽-合成复合体结合。该酶复合体催化mrna加帽所需的化学反应。合成作为多步生化反应进行。可以修饰加帽部分以调节mrna的功能性,例如其稳定性或翻译效率。
如本文所用,“体外转录的rna”是指已经在体外合成的rna,优选mrna。通常,体外转录的rna是从体外转录载体产生的。体外转录载体包含用于产生体外转录的rna的模板。
如本文所用,“多聚(a)”是通过聚腺苷酸化连接至mrna的一系列腺苷。在用于瞬时表达的构建体的优选实施方案中,多聚a在50和5000之间(seqidno:30),优选大于64,更优选大于100,最优选大于300或400。可以化学或酶促修饰多聚(a)序列以调节mrna功能,例如定位,稳定性或翻译的效率。
如本文所用,“多聚腺苷酸化”是指聚腺苷酰基部分或其修饰的变体与信使rna分子的共价连接。在真核生物中,大多数信使rna(mrna)分子在3’端聚腺苷酸化。3’聚(a)尾是通过酶聚腺苷酸聚合酶的作用添加到前mrna的长的腺嘌呤核苷酸序列(通常几百个)。在高等真核生物中,将多聚(a)尾添加到含有特定序列(聚腺苷酸化信号)的转录物上。多聚(a)尾和与其结合的蛋白有助于保护mrna免受外切核酸酶降解。多聚腺苷酸化对于转录终止,mrna从核中的输出和翻译也是重要的。多聚腺苷酸化在dna转录成rna后立即在核中发生,但是另外也可以在细胞质中稍后发生。在转录终止后,mrna链通过与rna聚合酶结合的内切核酸酶复合体的作用裂解。切割位点通常的特征在于在切割位点附近存在碱基序列aauaaa。在mrna已经切割后,将腺苷残基添加到切割位点处的游离3’端。
如本文所用,“瞬时的”是指非整合的转基因在数小时,数天或数周的时间内的表达,其中表达时间段小于如果整合到基因组中或包含在宿主细胞中的稳定的质粒复制子内基因表达的时间段。
本文所用的术语“治疗的”是指治疗和/或预防。通过抑制,缓解或根除疾病状态获得治疗效果。
如本文所用的术语“转染的”或“转化的”或“转导的”是指将外源核酸转移或引入宿主细胞的过程。“转染的”或“转化的”或“转导的”细胞是已经用外源核酸转染,转化或转导的细胞。细胞包括原代受试细胞及其后代。
如本文所用,术语“治疗”是指增殖性疾病的进展,严重性和/或持续时间的减轻或改善,或由施用一种或多种疗法(例如,一种或多种治疗剂,例如本发明的car)引起的增生性疾病的一种或多种症状(优选地,一种或多种更可辨别的症状)的改善。在具体实施方案中,术语“治疗”是指改善增生性疾病的至少一个可测量的生理参数,例如肿瘤的生长,不一定由患者辨别。在其它实施方案中,术语“治疗”是指通过身体方式,例如通过例如可辨别症状的稳定化,生理上通过例如身体参数的稳定化或两者来抑制增殖性疾病的进展。在其它实施方案中,术语“治疗”是指肿瘤大小或癌细胞计数的减少或稳定化。
本文所用的术语“预防”是指预防或保护性治疗疾病或疾病状态。
本文所用的术语“肿瘤抗原”是指全部地或以片段形式(例如mhc/肽)在癌或肿瘤细胞表面上被表达的分子(通常为蛋白质、碳水化合物或脂质),并且其用于将药理学作用剂优先靶向癌或肿瘤细胞。在某些实施方案中,肿瘤抗原为由正常细胞和癌细胞表达的标记物,例如谱系标记物例如在b细胞上的cd19或cd123。在某些实施方案中,肿瘤抗原为在癌细胞中与正常细胞相比过表达的细胞表面分子,例如与正常细胞相比1倍过表达、2倍过表达、3倍或以上过表达。在某些实施方案中,肿瘤抗原为癌细胞中被不适当地合成的细胞表面分子,例如,与正常细胞上被表达的分子相比含有缺失、添加或突变的分子。在某些实施方案中,肿瘤抗原应当全部或以片段形式(例如,mhc/肽)被专一性地表达在癌细胞的细胞表面上,而不是在正常细胞的表面上合成或表达。
在某些实施方案中,本发明的car包括包含结合mhc呈递肽的抗原结合结构域(例如,抗体或抗体片段)的car。通常,来源于内源蛋白质的肽填充主要组织相容性复合体(mhc)的i类分子的口袋,并且被cd8+t淋巴细胞上的t细胞受体(tcrs)识别。mhci类复合体由全部有核细胞组成型表达。在癌症中,病毒特异性和/或肿瘤特异性肽/mhc复合体代表免疫疗法的独特类型的细胞表面靶点。已经描述了在人类白细胞抗原(hla)-a1或hla-a2的情形中来源于病毒或肿瘤抗原的tcr-样抗体靶向肽(参见,例如sastry等人,jvirol.201185(5):1935-1942;sergeeva等人,blood,2011117(16):4262-4272;verma等人,jimmunol2010184(4):2156-2165;willemsen等人,genether20018(21):1601-1608;dao等人,scitranslmed20135(176):176ra33;tassev等人,cancergenether201219(2):84-100)。例如,tcr-样抗体可以从筛选库比如人scfv噬菌体展示文库鉴别。
如本文所用的短语“在转录控制下”或“有效连接”是指启动子相对于多核苷酸处于正确的位置和取向,以控制通过rna聚合酶的转录起始和多核苷酸的表达。
“载体”是包含分离的核酸并且可以用于将分离的核酸递送至细胞内部的物质组合物。许多载体是本领域已知的,包括但不限于线性多核苷酸,与离子或两亲化合物结合的多核苷酸,质粒和病毒。因此,术语“载体”包括自主复制质粒或病毒。该术语还应当解释为包括促进核酸转移到细胞中的非质粒和非病毒化合物,例如聚赖氨酸化合物,脂质体等。病毒载体的实例包括但不限于腺病毒载体,腺伴随病毒载体,逆转录病毒载体,慢病毒载体等。
本文所用的术语“特异性结合”是指抗体或配体,其识别并结合样品中存在的同源结合伴侣蛋白,但是该抗体或配体基本上不识别或结合样品中的其他分子。
术语“刺激”是指通过刺激分子与其同源配体结合从而介导信号转导事件(例如但不限于经由适当的nk受体的信号转导)诱导的初次应答。
“异种”指来自不同物种的动物的移植物。
术语“特异性结合”是指抗体或配体,其识别并结合存在于样品中的同源结合伴侣(例如,存在于t细胞上的刺激和/或共刺激分子)蛋白,但是该抗体或配体基本上不识别或结合样品中的其他分子。
本文所用的“可调节嵌合抗原受体(rcar)”是指一组多肽,通常在最简单的实施方案中两个多肽,当在免疫效应细胞中时,其为靶细胞,通常是癌细胞提供特异性,并具有可调节的细胞内信号产生。在一些实施方案中,rcar包含至少一个细胞外抗原结合结构域,跨膜和细胞质信号传导结构域(本文也称为“胞内信号传导结构域”),其包含如本文在car分子的上下文中所定义的来源于刺激分子和/或共刺激分子的功能信号传导结构域。在一些实施方案中,rcar中的多肽组不彼此连续,例如在不同的多肽链中。在一些实施方案中,rcar包括二聚化开关,其在二聚化分子存在时可将多肽彼此偶联,例如可将抗原结合结构域偶联至胞内信号传导结构域。在一些实施方案中,rcar在如本文所述的细胞(例如,免疫效应细胞),例如rcar表达细胞(本文中也称为“rcarx细胞”)中表达。在一个实施方案中,rcarx细胞是t细胞,并且被称为rcart细胞。在一个实施方案中,rcarx细胞是nk细胞,并且被称为rcarn细胞。rcar可以为表达rcar的细胞提供对靶细胞(通常是癌细胞)的特异性,并且具有可调节的细胞内信号产生或增殖,其可以优化rcar表达细胞的免疫效应物特性。在实施方案中,rcar细胞至少部分地依赖于抗原结合结构域以向包含由抗原结合结构域结合的抗原的靶细胞提供特异性。
正如本文中使用的那样,术语“膜锚”或“膜系链结构域(membranetetheringdomain)”是指足够将细胞外或胞内结构域锚固于质膜的多肽或部分例如肉豆蔻基基团。
正如本文中使用的那样,术语“开关结构域”,例如当涉及rcar时,是指在二聚化分子存在下与另一个开关结构域缔合的实体,通常为基于多肽的实体。该缔合导致与第一开关结构域连接(例如融合)的第一实体和与第二开关结构域连接(例如融合)的第二实体的功能性偶联。第一和第二开关结构域一起被称为二聚化开关。在实施方案中,第一和第二开关结构域是彼此相同的,例如它们是具有相同一级氨基酸序列的多肽,并且一起被称为均二聚化开关。在实施方案中,第一和第二开关结构域是彼此不同的,例如它们是具有不同的一级氨基酸序列的多肽,并且一起被称为异源二聚化开关。在实施方案中,所述开关在细胞内。在实施方案中,所述开关在细胞外。在实施方案中,所述开关结构域是基于多肽的实体,例如基于fkbp或frb,并且所述二聚化分子是小分子,例如雷帕系物。在实施方案,开关结构域是基于多肽的实体,例如结合myc肽的scfv,并且二聚化分子为多肽、其片段或多肽的多聚体,例如结合一个或更多个mycscfvs的myc配体或myc配体的多聚体。在实施方案中,开关结构域是基于多肽的实体,例如myc受体,并且二聚化分子是抗体或其片段,例如myc抗体。
正如本文中使用的那样,术语“二聚化分子”,例如当涉及rcar时,是指促进第一开关结构域与第二开关结构域结合的分子。在实施方案中,二聚化分子并没有天然存在于受试者中,或者没有以导致显著二聚化的浓度存在。在实施方案中,二聚化分子为小分子,例如雷帕霉素或雷帕系物,例如rad001。
术语“生物等同的”是指要产生与参考剂量或参考量的参考化合物(例如rad001)产生的效果等同的效果所需要的不同于参考化合物(例如rad001)的作用剂的量。在一个实施方案中,所述的效果是mtor抑制的水平,例如正如通过p70s6激酶抑制测量的那样,例如正如在体内或体外试验中评价的那样,例如如通过本文所述试验测量的那样,例如boulay试验或通过western印迹测量磷酸化的s6水平。在一个实施方案中,所述作用是pd-1阳性/pd-1阴性免疫效应细胞,例如t细胞或nk细胞的比率的改变,如通过细胞分选测量的那样。在一个实施方案中,mtor抑制剂的生物等同量或剂量是获得与参考化合物的参考剂量或参考量相同水平的p70s6激酶抑制的量或剂量。在一个实施方案中,mtor抑制剂的生物等同量或剂量是获得与参考化合物的参考剂量或参考量相同水平的pd-1阳性/pd-1阴性免疫效应细胞,例如t细胞或nk细胞的比率改变的量或剂量。
当与mtor抑制剂例如变构的mtor抑制剂(例如rad001或雷帕霉素)或有催化活性的mtor抑制剂一起使用时,术语“低的增强免疫的剂量”是指例如正如p70s6激酶活性的抑制所测量的那样,部分(而不是完全)抑制mtor活性的mtor抑制剂的剂量。本文讨论了用于评价mtor活性的方法,例如通过抑制p70s6激酶。该剂量不足以导致完全免疫抑制,但足以增强免疫应答。在一个实施方案中,低的增强免疫的剂量的mtor抑制剂导致pd-1阳性免疫效应细胞,例如t细胞或nk细胞数量减少和/或pd-1阴性免疫效应细胞,例如t细胞或nk细胞数量增加,或pd-1阴性t细胞/pd-1阳性免疫效应细胞,例如t细胞或nk细胞之比增加。
在一个实施方案中,低的增强免疫的剂量的mtor抑制剂导致幼稚免疫效应细胞,例如t细胞或nk细胞的数量增加。在一个实施方案中,低的增强免疫的剂量的mtor抑制剂导致下述中的一个或更多个:
例如在记忆t细胞例如记忆t细胞前体上一个或更多个下述标记物的表达增加:cd62l高,cd127高,cd27+和bcl2,;
例如在记忆t细胞例如记忆t细胞前体上klrg1的表达减少;和
记忆性t细胞前体,例如具有以下特征中的任一个或组合的细胞数目的增加:增加的cd62l高,增加的cd127高,增加的cd27+,减少的klrg1和增加的bcl2;
其中例如与非治疗的受试者相比,上述存在的变化中任一个例如至少短暂出现。
本文使用的“难治的”是指对治疗没有反应的疾病,例如癌症。在实施方案中,难治性癌症可以在治疗之前或开始时对治疗有抗性。在其他实施方案中,难治性癌症可在治疗期间变得抗性。难治性癌症也称为耐药性癌症。
本文使用的“复发性”或“复发”是指在一段改善或反应后,例如在疗法,例如癌症疗法的先前治疗后,疾病(例如癌症)或疾病(例如癌症)的体征和症状的返回或再出现。应答性的初始阶段可以涉及癌细胞的水平降低到低于某一阈值,例如低于20%,1%,10%,5%,4%,3%,2%或1%。再出现可以涉及癌细胞的水平升高超过某一阈值,例如高于20%,1%,10%,5%,4%,3%,2%或1%。例如,在b-all的情况下,再出现可能涉及例如在完全应答后血液,骨髓(>5%)或任何髓外部位中的胚细胞再现。在这种情况下,完全应答可能涉及<5%bm胚细胞。更一般地,在一个实施方案中,应答(例如,完全应答或部分应答)可以涉及不存在可检测的mrd(最小残留疾病)。在一个实施方案中,应答性的初始期持续至少1,2,3,4,5或6天;至少1周,2周,3周或4周;至少1,2,3,4,6,8,10或12个月;或至少1年,2年,3年,4年或5年。
在一些实施方案中,包括cd19抑制剂(例如cd19car疗法)的疗法可以复发或难以治疗。复发或抗性可由cd19损失(例如抗原丢失突变)或降低cd19水平(例如,由cd19阴性克隆的克隆选择引起)的其它cd19改变引起。包含此类cd19损失或改变的癌症在本文中称为“cd19阴性癌症”或“cd19阴性复发性癌症”)。应当理解,cd19阴性癌症不需要cd19的100%损失,而是足够降低以降低cd19疗法的有效性,使得癌症复发或变得难治。在一些实施方案中,cd19阴性癌症源自cd19car疗法。
范围∶在整个公开中,本发明的各个方面都可以以范围形式存在。应当理解,范围形式的描述仅仅为方便和简洁起见,而不应当被看作是对本发明的范围不可改变的限制。因此,范围的描述应当被认为特别地公开了所有可能的子范围以及该范围内的单独数值。例如,范围的描述比如从1至6就应当被认为具体地公开了子范围比如1至3、1至4、1至5、2至4、2至6、3至6等,以及该范围内的单独数值,例如1、2、2.7、3、4、5、5.3、和6。不考虑范围的宽度,这均适用。
nkr-cars
本文公开了用于调节细胞毒性细胞例如t细胞或nk细胞例如具有非天然存在的嵌合抗原受体(car)的细胞毒性细胞的特异性和活性的组合物和方法。在一个实施方案中,car是nkr-car。nkr-car是与nk细胞免疫功能受体(或nkr)共享功能和结构特性的car。nkr和nkr-car在本文中,例如在下面的部分中描述。如下所讨论,多种nkr可以作为nkr-car的基础。
nk细胞免疫功能受体(nkrs)和nk细胞
如本文所讨论的,nk细胞免疫功能受体(或nkr)是指在nk细胞中表达的内源性天然存在的跨膜蛋白,其可与抗原呈递细胞上的配体接合并调节nk细胞免疫功能应答,例如,它可以调节nk细胞的细胞溶解活性或细胞因子分泌。
nk细胞是在来自淋巴祖细胞的骨髓中发育的单核细胞,并且形态特征和生物学性质通常包括簇决定簇(cd)cd16,cd56和/或cd57的表达;在细胞表面上不存在α/β或γ/δtcr复合体;结合并杀死不能表达“自身”主要组织相容性复合体(mhc)/人白细胞抗原(hla)蛋白的靶细胞的能力;以及杀死表达激活nk受体的配体的肿瘤细胞或其他患病细胞的能力。nk细胞的特征在于它们结合和杀死几种类型的肿瘤细胞系的能力,而不需要先前的免疫或活化。nk细胞还可以释放对免疫系统发挥调节作用的可溶性蛋白质和细胞因子;并且可以经历多轮细胞分裂并产生具有与亲本细胞相似的生物学性质的子细胞。在被干扰素和/或细胞因子激活时,nk细胞通过需要nk细胞和靶细胞之间直接的物理接触的机制介导肿瘤细胞和被细胞内病原体感染的细胞的裂解。靶细胞的裂解涉及细胞毒性颗粒从nk细胞释放到结合靶的表面上,以及穿透靶细胞膜并诱导细胞凋亡或程序性细胞死亡的效应蛋白例如穿孔蛋白和粒酶b。正常的,健康的细胞被保护免受nk细胞的溶解。nk细胞活性受涉及刺激和抑制信号的复杂机制调节。
简言之,nk细胞的裂解活性受各种细胞表面受体调节,所述细胞表面受体在与靶细胞上的配体相互作用时转导阳性或阴性细胞内信号。通过这些受体传递的阳性和阴性信号之间的平衡决定靶细胞是否被nk细胞裂解(杀死)。nk细胞刺激信号可以由天然细胞毒性受体(ncr)如nkp30,nkp44和nkp46;以及nkg2c受体,nkg2d受体,某些激活性杀伤细胞免疫球蛋白样受体(kir)和其他激活性nk受体介导介导(lanier,annualreviewofimmunology2005;23:225-74)。nk细胞抑制信号可以由受体如ly49,cd94/nkg2a以及某些抑制性kir介导,其识别主要组织相容性复合体(mhc)i类分子(karreetal.,nature1986;319:675-8;ohlenetal,science1989;246:666-8)。这些抑制性受体结合存在于其他细胞上的mhci类分子(包括hlai类)的多态性决定簇,并抑制nk细胞介导的裂解。
kir-cars
本文公开了包含抗原结合结构域和杀伤细胞免疫球蛋白样受体结构域(kir-car)的嵌合抗原受体(car)分子。在一个实施方案中,本发明的kir-car在免疫效应细胞(例如t细胞或nk细胞)的表面上表达。
基于kir-car的nkcars
被称为杀伤细胞免疫球蛋白样受体的kir已经在人和非人灵长类动物中表征,并且是存在于淋巴细胞的某些亚型(包括nk细胞和一些t细胞)上的多形1型跨膜分子。kir与mhci类分子的α1和2结构域中的决定簇相互作用,并且如本文别处所述,不同的kir对nk细胞是刺激性的或抑制性的。
本文所述的nkr-car包括kir-car,其与kir共享功能和结构性质。
kir是在nk细胞上发现的细胞表面蛋白家族。它们通过与在所有细胞类型上表达的mhci类分子相互作用来调节这些细胞的杀伤功能。这种相互作用允许它们检测病毒感染的细胞或肿瘤细胞。大多数kir是抑制性的,意味着它们对mhc的识别抑制了表达它们的nk细胞的细胞毒性活性。只有有限数量的kir具有激活细胞的能力。
kir基因家族具有在位于染色体19(19q13.4)上的白细胞受体复合体(lrc)的100-200kb区域内编码的至少15个基因座(kir2dl1,kir2dl2/l3,kir2dl4,kir2dl5a,kir2dl5b,kir2ds1,kir2ds2,kir2ds3,kir2ds4,kir2ds5,kir3dl1/s1,kir3dl2,kir3dl3和两个假基因kir2dp1和kir3dp1)。lrc构成快速进化的免疫基因的大的,1mb和密集簇,其含有编码具有独特的ig样胞外结构域的其他细胞表面分子的基因。此外,延伸的lrc含有编码跨膜衔接分子dap10和dap12的基因。
kir基因的长度从4至16kb(全基因组序列)不同,并且可以包含4至9个外显子。kir基因根据其结构特征分类为属于三个组之一:(1)i型kir2d基因,其编码具有d1和d2构象的两个胞外结构域蛋白;(2)结构上发散的ii型kir2d基因,其编码具有d0和d2构象的两个胞外结构域蛋白;和最后(3)编码具有三个细胞外ig样结构域(d0,d1和d2)的蛋白质的kir3d基因。
i型kir2d基因,其包括假基因kir2dp1以及kir2dl1-3和kir2ds1-5基因,具有8个外显子以及假外显子3序列。这种假外显子在i型kir2d中失活。在一些情况下,这是由于位于内含子2-外显子3剪接位点上的核苷酸取代,其中其核苷酸序列显示与kir3d外显子3序列的高度同一性并且具有特征性三碱基对缺失。在其他情况下,过早的终止密码子启动外显子3的差异剪接。在i型kir2d组的基因中,kir2dl1和kir2dl2在外显子7中共有缺失,将它们与该外显子中的所有其它kir区分开,这导致较短的外显子7序列。类似地,在i型kir2d内,kir2dl1-3与kir2ds1-5的区别仅在于它们在外显子9中的胞质尾编码区的长度。kir2dp1假基因结构与kir2dl1-3的不同之处在于由于单个碱基对缺失,前者具有较短的外显子4序列。
ii型kir2d基因包括kir2dl4和kir2dl5。与kir3d和i型kir2d不同,ii型kir2d特征性地缺失了对应于所有其它kir中外显子4的区域。此外,ii型kir2d基因与i型kir2d基因的不同之处在于前者具有翻译的外显子3,而i型kir2d基因在其位置具有非翻译的假外显子3序列。在ii型kir2d基因内,kir2dl4通过其外显子1序列的长度与kir2dl5(以及其它kir基因)进一步不同。在kir2dl4中,发现外显子1长6个核苷酸,并且具有不同于其它kir基因中存在的起始密码子的起始密码子。该起始密码子与kir2dl4中对应于存在于其它kir基因中的起始密码子的第二个潜在起始密码子相比,与“kozak转录起始共有序列”更一致。
kir3d基因具有9个外显子并且包括结构相关的kir3dl1,kir3ds1,kir3dl2和kir3dl3基因。kir3dl2核苷酸序列是所有kir基因中最长的,在全基因组序列中跨越16,256bp,在cdna中跨越1,368bp。在kir3d组内,四个kir基因在外显子9中编码胞质尾区的区域的长度不同。kir蛋白的胞质尾的长度可以从14个氨基酸残基长(在一些kir3ds1等位基因中)到108个氨基酸酸残基长(在kir2dl4蛋白质中)。另外,kir3ds1与kir3dl1或kir3dl2的不同之处在于前者具有更短的外显子8序列。kir3dl3不同于其他kir序列,因为它完全缺乏外显子6。观察到的最极端的kir基因结构差异是kir3dp1的。该基因片段完全缺乏外显子6至9,偶尔也缺乏外显子2。存在的基因的剩余部分(外显子1,3,4和5)与其他kir3d序列,特别是kir3dl3序列共有高水平的序列同一性。
kir蛋白在其细胞外区域上具有特征性ig样结构域,其在一些kir蛋白中参与hlai类配体结合。它们还具有功能相关的跨膜和胞质区,因为它们限定转导到nk细胞的信号类型。kir蛋白可以具有两个或三个ig样结构域(因此是kir2d或kir3d)以及短或长的胞质尾(表示为kir2ds或kir2dl)。根据存在的膜远端ig样结构域的起源,将两个结构域kir蛋白质细分为两个组。i型kir2d蛋白(kir2dl1,kir2dl2,kir2dl3,kir2ds1,kir2ds2,kir2ds3,kir2ds4和kir2ds5)具有起源于kir3dd1ig样结构域但缺乏d0结构域的膜远端ig样结构域。该d1ig样结构域主要由相应kir基因的第四外显子编码。ii型kir2d蛋白kir2dl4和kir2dl5具有与kir3d蛋白中存在的d0结构域类似序列的膜远端ig样结构域,然而,ii型kir2d缺少d1结构域。长细胞质尾通常含有两个基于免疫酪氨酸的抑制基序(itim),其将抑制信号转导到nk细胞。短的胞质尾部在其跨膜区具有带正电荷的氨基酸残基,这允许它们与能够产生激活信号的dap12信号分子缔合。例外的是kir2dl4,其仅含有一个n末端itim。此外,kir2dl4在其跨膜结构域中还具有带电残基(精氨酸),该特征允许该受体引发抑制性信号和激活信号。kir通过在识别潜在靶细胞表面上的mhci类配体时递送抑制性或激活信号来控制人类nk细胞的应答。
kir蛋白的长度在306至456个氨基酸残基之间变化。尽管蛋白质长度的差异主要是存在的ig样结构域的数量的结果,但细胞质区域长度多样性也是影响因素。大多数kir蛋白的前导肽是21个氨基酸残基长。然而,不同的起始密码子的存在在kir2dl4蛋白中产生相应更长的前导肽。
ii型kir2d蛋白和kir3d蛋白中存在的d0ig样结构域的长度为约96个氨基酸残基。i型kir2d和kir3d蛋白的d1结构域长102个氨基酸残基,而所有kir蛋白的d2结构域长98个氨基酸残基。茎区的长度从大多数kir蛋白中存在的24个氨基酸残基变化到发散的kir3dl3蛋白中的仅7个氨基酸残基。对于大多数kir蛋白,跨膜区长20个氨基酸残基,但是由于外显子7中的三个碱基对缺失,kir2dl1和kir2dl2蛋白上的一个残基更短。最后,kir蛋白的胞质区显示更大的长度变化,从一些kir3ds1等位基因中的23个氨基酸残基至存在于kir3dl2蛋白中的96个氨基酸残基。
人类kir多肽(homosapiens)的氨基酸序列可在ncbi数据库中获得,参见例如登录号np_037421.2(gi:134268644),np_703144.2(gi:46488946),np_001229796.1(gi:338968852),np_001229796.1(gi:338968852),np_006728.2(gi:134268642),np_065396.1(gi:11968154),np_001018091.1(gi:66267727),np_001077008.1(gi:134133244),np_036444.1(gi:6912472),np_055327.1(gi:7657277),np_056952.2(gi:71143139),np_036446.3(gi:116517309),np_001074239.1(gi:124107610),np_002246.5(gi:124107606),np_001074241.1(gi:124107604),np_036445.1(gi:6912474)。
kir的命名基于胞外结构域(分别具有两个和三个胞外ig结构域的kir2d和kir3d)的数目以及细胞质尾部是长(kir2dl或kir3dl)还是短(kir2ds或kir3ds)。在单个个体中存在的nk群体内,给定kir的存在或不存在从一种nk细胞到另一种nk细胞变化。在人类中,还存在相对高水平的kir基因的多态性,某些kir基因存在于一些但不是所有个体中。nk细胞上的kir等位基因的表达是随机调节的,这意味着在给定的个体中,给定的淋巴细胞可以表达一种,两种或更多种不同的kir,这取决于个体的基因型。单个个体的nk细胞通常表达kir的不同组合,提供具有对mhci类分子的不同特异性的nk细胞的所有组成成分。
某些kir基因产物当与适当的配体结合时引起淋巴细胞活性的刺激。激活kir都具有带有带电荷的跨膜残基的短胞质尾区,其与具有将刺激信号转导到nk细胞的基于免疫受体酪氨酸的激活基序(itam)的衔接分子相关联。相比之下,抑制性kir具有包含基于免疫受体酪氨酸的抑制基序(itim)的长细胞质尾,其在其mhci类配体接合时将抑制信号转导至nk细胞。已知的抑制性kir包括kir2dl和kir3dl亚家族的成员。具有两个ig结构域(kir2dl)的抑制性kir识别hla-c同种异
型:kir2dl2(以前称为p58.2)和密切相关的等位基因产物kir2dl3都识别“第1组”hla-c同种异型(包括hla-cw1,-3,-7和-8),而kir2dl1(p58.1)识别“第2组”hla-c同种异型(如hla-cw2,-4,-5和-6)。kir2dl1的识别由hla-c等位基因中80位的lys残基的存在决定。kir2dl2和kir2dl3识别由hla-c中80位的asn残基的存在决定。重要的是,绝大多数hla-c等位基因在位置80具有asn或lys残基。因此,kir2dl1,-2和-3基本上识别人类中发现的所有hla-c同种异型。一个具有三个ig结构域的kir——kir3dl1(p70)——识别hla-bw4等位基因共有的表位。最后,kir3dl2(p140)——具有三个ig结构域的分子的同源二聚体——识别hla-a3和-a11。
然而,本发明不应限于包含含有itim的胞质尾区的抑制性kir。相反,具有与抑制性信号相关的胞质结构域的任何抑制性蛋白质可用于构建本发明的car。抑制性蛋白质的非限制性实例包括但不限于ctla-4,pd-1等。已知这些蛋白质抑制t细胞活化。
因此,本发明提供了kir-car,其包含与kir或其片段融合的包含靶特异性结合元件(或者称为抗原结合结构域)的胞外结构域。在一个实施方案中,kir是包含与衔接分子缔合的短细胞质尾的激活kir,所述衔接分子具有将刺激信号转导至nk细胞的免疫受体酪氨酸激活基序(itam)(本文中别处称为actkir-car)。在一个实施方案中,kir是抑制性kir,其包含含有基于免疫受体酪氨酸的抑制基序(itim)的长细胞质尾区,其转导抑制信号(在本文中别处称为inhkir-car)。在一些情况下,当构建actkir-car时希望去除铰链区用于激活kir。这是因为本发明部分基于这样的发现:其中kir2ds2铰链被去除以产生kir2scar的激活kircar,与包含全长野生型kir2ds2的actkir-car相比,该kirs2car表现出增强的细胞溶解活性。
编码本发明所需分子的核酸序列可以使用本领域已知的重组方法获得,例如通过从表达基因的细胞中筛选文库,通过从已知包括其的载体衍生基因,或通过使用标准技术直接从含有其的细胞和组织中分离。或者,可以合成产生而不是克隆目的基因。
本发明包括表达可以直接转导入细胞的kir-car的逆转录病毒和慢病毒载体构建体。本发明还包括可以直接转染到细胞中的rna构建体。用于产生用于转染的mrna的方法涉及使用特别设计的引物的体外转录(ivt)模板,然后是多聚a添加,以产生含有3’和5’非翻译序列(“utr”),5’帽和/或内部核糖体进入位点(ires),待表达的基因和多聚a尾(通常长度为50-2000个碱基)的构建体。这样产生的rna可以有效地转染不同种类的细胞。在一个实施方案中,模板包括kir-car的序列。
在一个实施方案中,kir-car包含抗原结合结构域和kir跨膜结构域。在一个实施方案中,kir-car包含抗原结合结构域和kir胞内结构域,例如inhkir胞内结构域。
如本文所用的术语kird结构域,是指kir的d0,d1或d2结构域。
如本文所用的术语kird结构域,是指具有kir的d结构域的结构和功能特性的多肽结构域。
kird0结构域,如该术语在本文所用的,是指kir的d0结构域。在一个实施方案中,kir-car的kird0结构域与参考序列例如天然存在的kird0结构域或本文所述的kird0结构域具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的kird0结构域与参考序列(例如天然存在的kird0结构域或本文所述的kird0结构域)之间的差异不超过其残基的15%,10%,5%,2%或1%。在实施方案中,kir-car的kird0结构域与参考序列(例如天然存在的kird0结构域或本文所述的kird0结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的kird0结构域与参考序列(例如天然存在的kird0结构域或本文所述的kird0结构域)没有区别或具有100%的同源性。
如本文所用的术语kird1结构域是指具有kir的d1结构域的结构和功能特性的多肽结构域。在一个实施方案中,kir-car的kird1结构域与参考序列例如天然存在的kird1结构域或本文所述的kird1结构域具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的kird1结构域与参考序列(例如天然存在的kird1结构域或本文所述的kird1结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,kir-car的kird1结构域与参考序列(例如天然存在的kird0结构域本文所述的或kird1结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的kird1结构域与参考序列(例如天然存在的kird1结构域或本文所述的kird1结构域)没有区别或具有100%的同源性。
如本文所用的术语kird2结构域,是指具有kir的d2结构域的结构和功能特性的多肽结构域。在一个实施方案中,kir-car的kird2结构域与参考序列例如天然存在的kird2结构域或本文所述的kird2结构域具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的kird2结构域与参考序列(例如天然存在的kird2结构域或本文所述的kird2结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,kir-car的kird2结构域与参考序列(例如天然存在的kird2结构域或本文所述的kird2结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的kird2结构域与参考序列(例如天然存在的kird2结构域或本文所述的kird2结构域)没有区别或具有100%的同源性。
如本文所用的术语kir铰链或茎结构域,是指具有kir的铰链或茎结构域的结构和功能特性的多肽结构域。在一个实施方案中,kir-car的kir铰链或茎结构域与参考序列(例如天然存在的kir铰链或茎结构域或本文所述的kir铰链或茎结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的kir铰链或茎结构域与参考序列(例如天然存在的kir铰链或茎结构域或本文所述的kir铰链或茎结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,kir-car的kir铰链或茎结构域与参考序列(例如天然存在的kir铰链或茎结构域或本文所述的kir铰链或茎结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的kir铰链或茎结构域与参考序列(例如天然存在的kir铰链或茎结构域或本文所述的kir铰链或茎结构域)没有区别或具有100%的同源性。
如本文所用的术语kir跨膜结构域,是指具有kir的跨膜结构域的结构和功能特性的多肽结构域。在一个实施方案中,kir-car的kir跨膜结构域与参考序列(例如天然存在的kir跨膜结构域或本文所述的kir跨膜结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的kir跨膜结构域与参考序列(例如天然存在的kir跨膜结构域或本文所述的kir跨膜结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,kir-car的kir跨膜结构域与参考序列(例如天然存在的kir跨膜结构域或本文所述的kir跨膜结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的kir跨膜结构域与参考序列(例如天然存在的kir跨膜结构域或本文所述的kir跨膜结构域)没有区别或具有100%的同源性。
如本文所用的术语kir胞内结构域,是指具有kir的胞内结构域的结构和功能特性的多肽结构域。kir胞内结构域包含抑制性kir胞内结构域(本文称为inhkir胞内结构域)和激活kir胞内结构域(本文称为actkir胞内结构域)。在一个实施方案中,inhkir胞内结构域包含itim序列。在一个实施方案中,kir-car的kir胞内结构域与参考序列(例如天然存在的kir胞内结构域或本文所述的kir胞内结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的kir胞内结构域与参考序列(例如天然存在的kir胞内结构域或本文所述的kir胞内结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,kir-car的kir胞内结构域与参考序列(例如天然存在的kir胞内结构域或本文所述的kir胞内结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的kir胞内结构域与参考序列(例如天然存在的kir胞内结构域或本文所述的kir胞内结构域)没有区别或具有100%的同源性。
ncrs
本文所述的nkr-car包括ncr-car,其与ncr共享功能和结构性质。
自然杀伤(nk)细胞是专门破坏肿瘤和病毒感染细胞的细胞毒性淋巴细胞。与细胞毒性t淋巴细胞不同,nk细胞不表达抗原特异性受体。转化细胞的识别通过大量细胞表面受体与靶细胞上的表面标志物的结合而发生。nk细胞表面受体可以根据它们是否激活或抑制nk细胞介导的细胞毒性来区分。不同受体之间的许多相互作用似乎导致nk和靶细胞之间的突触的形成。激活和抑制信号在突触处的整合决定了nk细胞是否在靶细胞上发挥其细胞溶解功能。在激活受体中,ig样分子家族称为天然细胞毒性受体(ncr)。这些天然细胞毒性受体包括nkp30,nkp44和nkp46分子。ncr是肿瘤细胞识别中nk细胞的关键激活受体。所有三种ncr参与肿瘤和病毒感染细胞的清除。在后者中,抗病毒活性由nkp44与流感病毒或仙台病毒的血凝素的相互作用起始。nkp46通过结合流感病毒血凝素或仙台病毒血凝素-神经氨酸酶而靶向病毒感染的细胞。相反,已经显示nk细胞介导的细胞毒性通过nkp30与人巨细胞病毒蛋白pp65结合而受到抑制(参见例如arnon,et.al.,nat.immunol.(2005)6:515-523)。
人ncr多肽(智人)的氨基酸序列可在ncbi数据库中获得,参见例如登录号np_004819.2(gi:153945782),o14931.1(gi:47605770),o95944.2(gi:251757303),o76036.1(gi:47605775),np_001138939.1(gi:224586865),和/或np_001138938.1(gi:224586860)。
在一个实施方案中,ncr-car包含抗原结合结构域和ncr跨膜结构域。在一个实施方案中,kir-car包含抗原结合结构域和ncr胞内结构域。
如本文所用的术语ncr胞外结构域,是指具有ncr的胞外结构域的结构和功能特性的多肽结构域。在一个实施方案中,ncr-car的ncr胞外结构域与参考序列(例如天然存在的ncr胞外结构域或本文所述的ncr胞外结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ncr-car的ncr胞外结构域与参考序列(例如天然存在的ncr胞外结构域或本文所述的ncr胞外结构域)之间的差异不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ncr-car的ncr胞外结构域与参考序列(例如天然存在的ncr胞外结构域或本文所述的ncr胞外结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ncr-car的ncr胞外结构域与参考序列(例如天然存在的ncr胞外结构域或本文所述的ncr胞外结构域)没有区别或具有100%的同源性。
如本文所用的术语ncr铰链或茎结构域,是指具有ncr的铰链或茎结构域的结构和功能特性的多肽结构域。在一个实施方案中,ncr-car的ncr铰链或茎结构域与参考序列(例如天然存在的ncr铰链或茎结构域或本文所述的ncr铰链或茎结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ncr-car的ncr铰链或茎结构域与参考序列(例如天然存在的ncr铰链或茎结构域或本文所述的ncr铰链或茎结构域)之间的差异不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ncr-car的ncr铰链或茎结构域与参考序列(例如天然存在的ncr铰链或茎结构域或本文所述的ncr铰链或茎结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ncr-car的ncr铰链或茎结构域与参考序列(例如天然存在的ncr铰链或茎结构域或本文所述的ncr铰链或茎结构域)没有区别或具有100%的同源性。
如本文所用的术语ncr跨膜结构域,是指具有ncr的跨膜结构域的结构和功能特性的多肽结构域。在一个实施方案中,ncr-car的ncr跨膜结构域与参考序列(例如天然存在的ncr跨膜结构域或本文所述的ncr跨膜结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ncr-car的ncr跨膜结构域与参考序列(例如天然存在的ncr跨膜结构域或本文所述的ncr跨膜结构域)之间的差异不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ncr-car的ncr跨膜结构域与参考序列(例如天然存在的ncr跨膜结构域或本文所述的ncr跨膜结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ncr-car的ncr跨膜结构域与参考序列(例如天然存在的ncr跨膜结构域或本文所述的ncr跨膜结构域)没有区别或具有100%的同源性。
如本文所用的术语ncr胞内结构域,是指具有ncr的胞内结构域的结构和功能特性的多肽结构域。在一个实施方案中,ncr-car的ncr胞内结构域与参考序列(例如天然存在的ncr胞内结构域或本文所述的ncr胞内结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ncr-car的ncr胞内结构域与参考序列(例如天然存在的ncr胞内结构域或本文所述的ncr胞内结构域)之间的差异不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ncr-car的ncr胞内结构域与参考序列(例如天然存在的ncr胞内结构域或本文所述的ncr胞内结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ncr-car的ncr胞内结构域与参考序列(例如天然存在的ncr胞内结构域或本文所述的ncr胞内结构域)没有区别或具有100%的同源性。
slam受体
本文所述的nkr-car包括slamf-car,其与slamf共享功能和结构性质。
免疫细胞受体的信号传导淋巴细胞活化分子(slam)家族与免疫球蛋白(ig)超家族的分子的cd2家族密切相关。slam家族(slamf)目前包括名为slam,cd48,cd229,2b4,cd84,ntb-a,cracc,blame和cd2f-10的九个成员。通常,slam分子具有2至4个胞外ig结构域,跨膜区段和细胞内富含酪氨酸的区域。分子在多种免疫细胞类型上差异表达。几个是自身配体,slam已被确定为人类麻疹病毒受体。已知几种小的含sh2的衔接蛋白与slam家族成员的胞内结构域结合并调节受体信号传导,包括sh2d1a(也称为slam相关蛋白[sap])和sh2d1b(也称为eat2)。例如,在t和nk细胞中,活化的slam家族受体变为酪氨酸磷酸化的并募集衔接子sap和随后的src激酶fyn。随后的信号转导级联影响t细胞-抗原呈递细胞和nk细胞-靶细胞相互作用的结果。
人类slam受体多肽(智人)的氨基酸序列可在ncbi数据库中获得,参见例如登录号np_057466.1(gi:7706529),np_067004.3(gi:19923572),np_003028.1(gi:4506969),np_001171808.1(gi:296434285),np_001171643.1(gi:296040491),np_001769.2(gi:21361571),np_254273.2(gi:226342990),np_064510.1(gi:9910342)和/或np_002339.2(gi:55925578)。
在一个实施方案中,slamf-car包含抗原结合结构域和slamf跨膜结构域。在一个实施方案中,slamf-car包含抗原结合结构域和slamf胞内结构域。
如本文所用的术语slamf胞外结构域是指具有slamf的胞外结构域的结构和功能特性的多肽结构域。在一个实施方案中,slamf-car的slamf胞外结构域与参考序列(例如天然存在的slamf胞外结构域或本文所述的slamf胞外结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,slamf-car的slamf胞外结构域与参考序列(例如天然存在的slamf胞外结构域或本文所述的slamf胞外结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,slamf-car的slamf胞外结构域与参考序列(例如天然存在的slamf胞外结构域或本文所述的slamf胞外结构域)相差不超过5,4,3,2或1个残基。在实施方案中,slamf-car的slamf胞外结构域与参考序列(例如天然存在的slamf胞外结构域或本文所述的slamf胞外结构域)没有区别或具有100%的同源性。
如本文所用的术语slamf铰链或茎结构域,是指具有slamf的铰链或茎结构域的结构和功能特性的多肽结构域。在一个实施方案中,slamf-car的slamf铰链或茎结构域与参考序列(例如天然存在的slamf铰链或茎结构域或本文所述的slamf铰链或茎结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,slamf-car的slamf铰链或茎结构域与参考序列(例如天然存在的slamf铰链或茎结构域或本文所述的slamf铰链或茎结构域)不超过其残基的15%,10%,5%,2%或1%。在实施方案中,slamf-car的slamf铰链或茎结构域与参考序列(例如天然存在的slamf铰链或茎结构域或本文所述的slamf铰链或茎结构域)相差不超过5,4,3,2或1个残基。在实施方案中,slamf-car的slamf铰链或茎结构域与参考序列(例如天然存在的slamf铰链或茎结构域或本文所述的slamf铰链或茎结构域)没有区别或具有100%的同源性。
如本文所用的术语slamf跨膜结构域,是指具有slamf的跨膜结构域的结构和功能特性的多肽结构域。在一个实施方案中,slamf-car的slamf跨膜结构域与参考序列(例如天然存在的slamf跨膜结构域或本文所述的slamf跨膜结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,slamf-car的slamf跨膜结构域与参考序列(例如天然存在的slamf跨膜结构域或本文所述的slamf跨膜结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,slamf-car的slamf跨膜结构域与参考序列(例如天然存在的slamf跨膜结构域或本文所述的slamf跨膜结构域)相差不超过5,4,3,2或1个残基。在实施方案中,slamf-car的slamf跨膜结构域与参考序列(例如天然存在的slamf跨膜结构域或本文所述的slamf跨膜结构域)没有区别或具有100%的同源性。
如本文所用的术语slamf胞内结构域,是指具有slamf的胞内结构域的结构和功能特性的多肽结构域。在一个实施方案中,slamf-car的slamf胞内结构域与参考序列(例如天然存在的slamf胞内结构域或本文所述的slamf胞内结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,slamf-car的slamf胞内结构域与参考序列(例如天然存在的slamf胞内结构域或本文所述的slamf胞内结构域)相差不超过其残基不的15%,10%,5%,2%或1%。在实施方案中,slamf-car的slamf胞内结构域与参考序列(例如天然存在的slamf胞内结构域或本文所述的slamf胞内结构域)相差不超过5,4,3,2或1个残基。在实施方案中,slamf-car的slamf胞内结构域与参考序列(例如天然存在的slamf胞内结构域或本文所述的slamf胞内结构域)没有区别或具有100%的同源性。
fc结合受体
本文所述的nkr-car包括基于fc受体的car,fcr-car,例如cd16-ca和cd64-car,其与cd16和cd64共享功能和结构特性。
激活后,nk细胞大量产生细胞因子和趋化因子,同时表现出强的细胞溶解活性。nk细胞的激活可通过nk细胞受体与靶细胞上的配体的直接结合而发生,如直接的肿瘤细胞杀伤所见,或通过结合与携带抗原的细胞结合的抗体的fc部分通过fc受体(cd16;fcγriii)的交联。这种cd16接合(cd16交联)通过经由cd16相关衔接子链fcrγ或cd3ζ之一或两者产生的细胞内信号启动nk细胞应答。触发cd16导致γ或ζ链的磷酸化,其继而募集酪氨酸激酶syk和zap-70,启动信号转导的级联,导致快速和有效的效应子功能。最广为人知的效应子功能是释放携带毒性蛋白质的细胞质颗粒,以通过抗体依赖性细胞毒性的过程杀死附近的靶细胞。cd16交联还导致细胞因子和趋化因子的产生,其反过来激活和协调一系列免疫应答。
然而,与t和b淋巴细胞不同,认为nk细胞使用种系编码的激活受体而对靶识别仅有有限的能力(bottinoetal.,currtopmicrobiolimmunol.298:175-182(2006);stewartetal.,currtopmicrobiolimmunol.298:1-21(2006))。nk细胞表达活化fc受体cd16,其识别igg包被的靶细胞,从而扩宽靶识别(ravetch&bolland,annurevimmunol.19:275-290(2001);laniernat.immunol.9(5):495-502(2008);bryceson&long,curropinimmunol.20(3):344-352(2008))。几种nk细胞激活受体的表达和信号转导活性需要物理结合的衔接子,其通过基于免疫受体酪氨酸的激活基序(itam)转导信号。在这些衔接子中,fcrγ和cd3ζ链可以与cd16和天然细胞毒性受体(ncr)缔合为二硫键连接的同二聚体或异二聚体,并且认为这些链被所有成熟nk细胞表达。
cd16(人)的氨基酸序列可在ncbi数据库中获得,参见例如登录号np_000560.5(gi:50726979),np_001231682.1(gi:348041254)。
在一个实施方案中,fcr-car包含抗原结合结构域和fcr跨膜结构域。在一个实施方案中,fcr-car包含抗原结合结构域和fcr胞内结构域。
如本文所用的术语“cd16胞外结构域”是指具有cd16的胞外结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd16-car的cd16胞外结构域与参考序列(例如天然存在的cd16胞外结构域或本文所述的cd16胞外结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd16-car的cd16胞外结构域与参考序列(例如,天然存在的cd16胞外结构域或本文所述的cd16胞外结构域)的残基相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,cd16-car的cd16胞外结构域与参考序列(例如天然存在的cd16胞外结构域或本文所述的cd16胞外结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd16-car的cd16胞外结构域与参考序列(例如天然存在的cd16胞外结构域或本文所述的cd16胞外结构域)没有区别或具有100%的同源性。
如本文所用的术语cd16铰链或茎结构域是指具有cd16的铰链或茎结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd16-car的cd16铰链或茎结构域与参考序列(例如天然存在的cd16铰链或茎结构域或本文所述的cd16铰链或茎结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd16-car的cd16铰链或茎结构域与参考序列(例如天然存在的cd16铰链或茎结构域或本文所述的cd16铰链或茎结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,cd16-car的cd16铰链或茎结构域与参考序列(例如天然存在的cd16铰链或茎结构域或本文所述的cd16铰链或茎结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd16-car的cd16铰链或茎结构域与参考序列(例如天然存在的cd16铰链或茎结构域或本文所述的cd16铰链或茎结构域)没有区别或具有100%的同源性。
如本文所用的术语cd16跨膜结构域是指具有cd16的跨膜结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd16-car的cd16跨膜结构域与参考序列(例如天然存在的cd16跨膜结构域或本文所述的cd16跨膜结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd16-car的cd16跨膜结构域与参考序列(例如天然存在的cd16跨膜结构域或本文所述的cd16跨膜结构域)的残基相差不超过15%,10%,5%,2%或1%。在实施方案中,cd16-car的cd16跨膜结构域与参考序列(例如天然存在的cd16跨膜结构域或本文所述的cd16跨膜结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd16-car的cd16跨膜结构域与参考序列(例如天然存在的cd16跨膜结构域或本文所述的cd16跨膜结构域)没有区别或具有100%的同源性。
如本文所用的术语cd16胞内结构域是指具有cd16的胞内结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd16-car的cd16胞内结构域与参考序列(例如天然存在的cd16胞内结构域或本文所述的cd16胞内结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd16-car的cd16胞内结构域与参考序列(例如天然存在的cd16胞内结构域或本文所述的cd16胞内结构域)的残基相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,cd16-car的cd16胞内结构域与参考序列(例如天然存在的cd16胞内结构域或本文所述的cd16胞内结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd16-car的cd16胞内结构域与参考序列(例如天然存在的cd16胞内结构域或本文所述的cd16胞内结构域)没有区别或具有100%的同源性。
如本文所用的术语cd64胞外结构域是指具有cd64的胞外结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd64-car的cd64胞外结构域与参考序列(例如天然存在的cd64胞外结构域或如本文所述的cd64胞外结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd64-car的cd64胞外结构域与参考序列(例如天然存在的cd64胞外结构域或如本文所述的cd64胞外结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,cd64-car的cd64胞外结构域与参考序列(例如天然存在的cd64胞外结构域或如本文所述的cd64胞外结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd64-car的cd64胞外结构域与参考序列(例如天然存在的cd64胞外结构域或如本文所述的cd64胞外结构域)没有区别或具有100%的同源性。
如本文所用的术语cd64铰链或茎结构域是指具有cd64的铰链或茎结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd64-car的cd64铰链或茎结构域与参考序列(例如天然存在的cd64铰链或茎结构域或本文所述的cd64铰链或茎结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd64-car的cd64铰链或茎结构域与参考序列(例如天然存在的cd64铰链或茎结构域或本文所述的cd64铰链或茎结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,cd64-car的cd64铰链或茎结构域与参考序列(例如天然存在的cd64铰链或茎结构域或本文所述的cd64铰链或茎结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd64-car的cd64铰链或茎结构域与参考序列(例如天然存在的cd64铰链或茎结构域或本文所述的cd64铰链或茎结构域)没有区别或具有100%的同源性。
如本文所用的术语cd64跨膜结构域是指具有cd64的跨膜结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd64-car的cd64跨膜结构域与参考序列(例如天然存在的cd64跨膜结构域或本文所述的cd64跨膜结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd64-car的cd64跨膜结构域与参考序列(例如天然存在的cd64跨膜结构域或本文所述的cd64跨膜结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,cd64-car的cd64跨膜结构域与参考序列(例如天然存在的cd64跨膜结构域或本文所述的cd64跨膜结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd64-car的cd64跨膜结构域与参考序列(例如天然存在的cd64跨膜结构域或本文所述的cd64跨膜结构域)没有区别或具有100%的同源性。
如本文所用的术语cd64胞内结构域是指具有cd64的胞内结构域的结构和功能特性的多肽结构域。在一个实施方案中,cd64-car的cd64胞内结构域与参考序列(例如天然存在的cd64胞内结构域或本文所述的cd64胞内结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,cd64-car的cd64胞内结构域与参考序列(例如天然存在的cd64胞内结构域或本文所述的cd64胞内结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,cd64-car的cd64胞内结构域与参考序列(例如天然存在的cd64胞内结构域或本文所述的cd64胞内结构域)相差不超过5,4,3,2或1个残基。在实施方案中,cd64-car的cd64胞内结构域与参考序列(例如天然存在的cd64胞内结构域或本文所述的cd64胞内结构域)没有区别或具有100%的同源性。
ly49和相关的杀伤细胞凝集素样受体
本文所述的nkr-car包括ly49-car,其与ly49共有功能和结构特性。
ly49受体来源于小鼠中至少23个鉴定的基因(ly49a-w)。这些受体在小鼠nk细胞和t细胞中与kir在人类中共享许多相同的作用,尽管它们具有不同的结构(c型凝集素超家族的ii型整合膜蛋白),并且它们如人类kirs还含有相当程度的遗传变异。ly49和kir受体之间显著的功能相似性表明这些受体组独立地然而会聚性进化,在nk细胞和t细胞中执行相同的生理功能。
像人类中的kir,不同的ly49受体识别不同的mhci类等位基因,并且在nk细胞亚群上差异表达。原始原型ly49受体ly49a和ly49c具有带有两个基于免疫酪氨酸的抑制基序(itim)的胞质结构域,类似于抑制性kir如kir2dl3。已经鉴定这些结构域募集磷酸酶shp-1,并且像抑制性kir一样,用于限制nk细胞和t细胞的活化。除了抑制性ly49分子之外,几种家族成员例如ly49d和ly49h已经失去了含有itim的结构域,并且相反获得了与信号转导衔接分子dap12相互作用的能力,与人类中的激活kir如kir2ds2相似。
ly49家族成员的氨基酸序列可在ncbi数据库中获得,参见例如登录号aaf82184.1(gi:9230810),aaf99547.1(gi:9801837),np_034778.2(gi:133922593),np_034779.1(gi:6754462),np_001095090.1(gi:197333718),np_034776.1(gi:21327665),aak11559.1(gi:13021834)和/或np_038822.3(gi:9256549)。
在一个实施方案中,ly49-car包含抗原结合结构域和ly49跨膜结构域。在一个实施方案中,ly49-car包含抗原结合结构域和ly49胞内结构域。
如本文所用的术语ly49胞外结构域是指具有ly49的胞外结构域的结构和功能特性的多肽结构域。在一个实施方案中,ly49-car的ly49胞外结构域与参考序列(例如天然存在的ly49胞外结构域或本文所述的ly49胞外结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ly49-car的ly49胞外结构域与参考序列(例如天然存在的ly49胞外结构域或本文所述的ly49胞外结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ly49-car的ly49胞外结构域与参考序列(例如天然存在的ly49胞外结构域或本文所述的ly49胞外结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ly49-car的ly49胞外结构域与参考序列(例如天然存在的ly49胞外结构域或本文所述的ly49胞外结构域)没有区别或具有100%的同源性。
如本文所用的术语ly49铰链或茎结构域是指具有ly49的铰链或茎结构域的结构和功能特性的多肽结构域。在一个实施方案中,ly49-car的ly49铰链或茎结构域与参考序列(例如天然存在的ly49铰链或茎结构域或本文所述的ly49铰链或茎结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ly49-car的ly49铰链或茎结构域与参考序列(例如天然存在的ly49铰链或茎结构域或本文所述的ly49铰链或茎结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ly49-car的ly49铰链或茎结构域与参考序列(例如天然存在的ly49铰链或茎结构域或本文所述的ly49铰链或茎结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ly49-car的ly49铰链或茎结构域与参考序列(例如天然存在的ly49铰链或茎结构域或本文所述的ly49铰链或茎结构域)没有区别或具有100%的同源性。
如本文所用的术语ly49跨膜结构域是指具有ly49的跨膜结构域的结构和功能特性的多肽结构域。在一个实施方案中,ly49-car的ly49跨膜结构域与参考序列(例如天然存在的ly49跨膜结构域或本文所述的ly49跨膜结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ly49-car的ly49跨膜结构域与参考序列(例如天然存在的ly49跨膜结构域或本文所述的ly49跨膜结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ly49-car的ly49跨膜结构域与参考序列(例如天然存在的ly49跨膜结构域或本文所述的ly49跨膜结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ly49-car的ly49跨膜结构域与参考序列(例如天然存在的ly49跨膜结构域或本文所述的ly49跨膜结构域)没有区别或具有100%的同源性。
如本文所用的术语ly49胞内结构域是指具有ly49的胞内结构域的结构和功能特性的多肽结构域。在一个实施方案中,ly49-car的ly49胞内结构域与参考序列(例如天然存在的ly49胞内结构域或本文所述的ly49胞内结构域)具有至少70,80,85,90,95或99%的同源性。在实施方案中,ly49-car的ly49胞内结构域与参考序列(例如天然存在的ly49胞内结构域或本文所述的ly49胞内结构域)相差不超过其残基的15%,10%,5%,2%或1%。在实施方案中,ly49-car的ly49胞内结构域与参考序列(例如天然存在的ly49胞内结构域或本文所述的ly49胞内结构域)相差不超过5,4,3,2或1个残基。在实施方案中,ly49-car的ly49胞内结构域与参考序列(例如天然存在的ly49胞内结构域或本文所述的ly49胞内结构域)没有区别或具有100%的同源性。
胞内信号传导结构域或衔接分子,例如dap12
一些nkr-car与其他分子,例如包含胞内信号传导结构域的分子,例如itam相互作用。在一个实施方案中,胞内信号传导结构域是dap12。
dap12因其结构特征和推测的功能而如此命名。某些细胞表面受体缺乏内在功能,假设它可能与另一个蛋白质配偶体(建议是12kd蛋白质)相互作用。信号传导的机制可能涉及itam信号。
基于与cd3的假设关系(参见olcese,etal.(1997)j.immunol.158:5083-5086),itam序列的存在(参见thomas(1995)j.exp.med.181:1953-1956),某些大小预测(参见olcese;和takase,etal.(1997)j.immunol.159:741-747)和其他特征从序列数据库鉴定了dap12。特别地,假设跨膜结构域包含带电残基,其将允许与其推定的受体配偶体kircd94蛋白和可能的其它类似蛋白的相应跨膜片段的盐桥。参见daeron,etal.(1995)immunity3:635-646。
事实上,许多已知的kir,mir,ilt和cd94/nkg2受体分子实际上可以与作为功能性受体复合体的一部分的辅助蛋白发挥功能。参见olcese,etal.(1997)j.immunol.158:5083-5086;和takase,etal.(1997)j.immunol.159:741-747。
如本文所用的术语dap12结构域是指具有dap12的胞质结构域的结构和功能特性的多肽结构域,并且通常包括itam结构域。在一个实施方案中,kir-car的dap12结构域与参考序列(例如天然存在的dap12或本文所述的dap12)具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的dap12结构域与参考序列(例如天然存在的dap12或本文所述的dap12)的残基相差不超过15%,10%,5%,2%或1%。在实施方案中,kir-car的dap12结构域与参考序列(例如天然存在的dap12或本文所述的dap12)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的dap12结构域与参考序列(例如天然存在的dap12或本文所述的dap12)没有不同或具有100%的同源性。
dap10部分通过其与dap12的同源性和其他特征鉴定。特别地,与显示itam激活基序的dap12相反,dap10展示itim抑制基序。通过其与dap12的功能关联来鉴定mdl-1。
例如dap12或dap10及其辅助受体之间的功能相互作用可允许在通常在截短的受体形式中不存在的受体中使用结构组合。因此,通过诸如dap12和dap10的辅助蛋白传导信号的机制允许对其它kir样受体复合体,例如与kir,mir,ilt和cd94nkg2型受体的有趣的工程化。可以构建完整受体的截短形式,其与dap12或dap10相互作用以形成功能信号传导复合体。
dap12的灵长类动物核苷酸序列对应于seqidno:332的核苷酸1至339;氨基酸序列对应于seqidno:333的氨基酸1至113。信号序列看起来从met(-26)延伸到gln(-1)或ala1;成熟蛋白应该从约ala1(或gln2),胞外结构域从约ala1到pro14;胞外结构域在7和9处包含两个半胱氨酸,这可能允许与附加的同型或异型辅助蛋白的二硫键;跨膜区域从约gly15或val16延伸至约gly39;和itam基序从tyr65至leu79(yxxl-6/8x-yxxl)(seqidno:341)。鉴定lva03aest并用于提取其他重叠序列。参见作为人dap12的一部分的genbank人est;一些,但不是全部,包括genbank登录号aa481924;h39980;w60940;n41026;r49793;w60864;w92376;h12338;t52100;aa480109;h12392;w74783;和t55959。
抑制性nkr-cars
本发明提供了通过一类cart细胞治疗来限制非癌细胞消耗的组合物和方法。如本文所公开的,一种类型的cart细胞治疗包括使用nk受体,包括但不限于称为杀伤细胞免疫球蛋白样受体(kir)的nk细胞的激活和抑制性受体。因此,本发明提供了使用nkr-car例如kir-car的组合物和方法,包括但不限于活化nkr-car(actnkr-car),例如活化kir-car(actkir-car)和抑制性nkr-car(inhnkr-car),例如抑制性kir-car(inhkir-car)。
在一些实施方案中,inhkir-car的kir是抑制性kir,其包含含有基于免疫受体酪氨酸的抑制基序(itim)的长细胞质尾区,其转导抑制信号(在本文中称为inhkir-car)。
在一些实施方案中,inhkir-car包含除kir之外的抑制性分子的胞质结构域。在一些实施方案中,这些抑制性分子可降低细胞产生免疫效应应答的能力。抑制性分子的胞质结构域可以例如通过融合与kir的跨膜结构域偶联。示例性抑制分子示于表1中:
在一些实施方案中,inhkir-car包含pd1胞质结构域。如本文所用的术语pd1胞质结构域是指具有pd1的胞质结构域的结构和功能特性的多肽结构域。在一个实施方案中,kir-car的pd1胞质结构域与参考序列(例如天然存在的pd1胞质结构域或本文所述的pd1胞质结构域)(seqidno:338)具有至少70,80,85,90,95或99%的同源性。在实施方案中,kir-car的pd1胞质结构域与参考序列(例如天然存在的pd1胞质结构域或本文所述的pd1胞质结构域)的残基相差不超过15%,10%,5%,2%或1%。在实施方案中,kir-car的pd1胞质结构域与参考序列(例如天然存在的pd1胞质结构域或本文所述的pd1胞质结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的pd1胞质结构域与参考序列(例如天然存在的pd1胞质结构域或本文所述的pd1胞质结构域)没有区别或具有100%的同源性。
在一些实施方案中,inhkir-car包含ctla-4胞质结构域。如本文所用的术语,ctla-4胞质结构域是指具有ctla-4的胞质结构域的结构和功能特性的多肽结构域。在一个实施方案中,kir-car的ctla-4胞质结构域与参考序列(例如天然存在的ctla-4胞质结构域或本文所述的ctla-4胞质结构域)(seqidno:339)具有至少70,80,85,90,95或99%同源性。在实施方案中,kir-car的ctla-4胞质结构域与参考序列(例如天然存在的ctla-4胞质结构域或本文所述的ctla-4胞质结构域)的残基相差不超过15%,10%,5%,2%或1%。在实施方案中,kir-car的ctla-4胞质结构域与参考序列(例如天然存在的ctla-4胞质结构域或本文所述的ctla-4胞质结构域)相差不超过5,4,3,2或1个残基。在实施方案中,kir-car的ctla-4胞质结构域与参考序列(例如天然存在的ctla-4胞质结构域或本文所述的ctla-4胞质结构域)没有区别或具有100%的同源性。
在一个实施方案中,inhnkr-car(例如inhkir-car)在与非靶标或旁观者细胞上的抗原接合时使包含inhnkr-car的细胞毒性细胞失活。虽然下面的大部分描述涉及inhkir-car,但是本发明包括其它inhnkr-car的类似应用。
在一个实施方案中,当结合至其靶标时,表达actkir-car的t细胞表现出抗肿瘤性质,而当inhkir-car与其靶标结合时,表达inhkir-car的t细胞导致细胞活性的抑制。
不管kir-car的类型如何,kir-car被工程化以包含具有融合至胞质结构域的抗原结合结构域的胞外结构域。在一个实施方案中,当在t细胞中表达时,kir-car能够基于抗原特异性重定向抗原识别。示例性抗原是cd19,因为这种抗原在b细胞淋巴瘤上表达。然而,cd19也在正常b细胞上表达,因此包含抗cd19结构域的car可导致正常b细胞的消耗。正常b细胞的消耗可使受治疗的受试者易感染,因为b细胞通常在感染控制中帮助t细胞。本发明提供了在kir-cart细胞治疗期间限制正常组织消耗的组合物和方法。在一个实施方案中,本发明提供了使用kir-cart细胞疗法来治疗癌症和其它病症,同时限制健康旁观者细胞的消耗的方法。
在一个实施方案中,本发明包括控制或调节kir-cart细胞活性。在一个实施方案中,本发明包括涉及遗传修饰t细胞以表达多种类型的kir-car的组合物和方法,其中kir-cart细胞活化依赖于多种类型的kir-car与其靶受体的结合。对多种类型的kir-car的结合的依赖性改善了kir-cart细胞的裂解活性的特异性,从而降低了消耗正常健康组织的潜力。
在另一个实施方案中,本发明包括涉及用抑制性kir-car遗传修饰t细胞的组合物和方法。在一个实施方案中,抑制性kir-car包含识别与正常,非癌性细胞相关的抗原的细胞外抗原结合结构域和抑制性胞质结构域。
在一个实施方案中,本发明提供了双重kir-car,其中t细胞被遗传修饰以表达inhkir-car和actkir-car。在一个实施方案中,inhkir-car与正常的非癌细胞的结合导致双重kir-cart细胞的抑制。例如,在一个实施方案中,inhkir-car与正常的非癌细胞的结合导致双重kir-cart细胞的死亡。在另一个实施方案中,inhkir-car与正常的非癌细胞的结合导致抑制actkir-car的信号转导。在另一个实施方案中,inhkir-car与正常的非癌细胞的结合导致诱导阻止actkir-cart细胞表现出其抗肿瘤活性的信号转导信号。因此,包含本发明的至少一种inhkir-car和至少一种actkir-car的双重kir-car提供了调节双重kir-cart细胞的活性的机制。
在一个实施方案中,本发明提供了使用kir-cart细胞疗法治疗癌症和其它病症,同时使正常健康组织的消耗最小化的方法。癌症可以是血液恶性肿瘤,实体瘤,原发性或转移性肿瘤。可使用本发明的组合物和方法治疗的其它疾病包括病毒,细菌和寄生虫感染以及自身免疫性疾病。
胞外铰链结构域
如本文所用的术语胞外铰链结构域是指设置在跨膜结构域和抗原结合结构域之间的nkr-car的多肽序列。在一个实施方案中,胞外铰链结构域允许距离细胞外表面和抗原结合结构域足够的距离以及使细胞和抗原结合结构域之间的位阻最小化的柔性。在一个实施方案中,胞外铰链结构域足够短或柔软,使得它不干扰包括nkr-car的细胞与具有抗原的细胞(例如靶细胞)的接合。在一个实施方案中,胞外铰链结构域的长度为2至20,5至15,7至12或8至10个氨基酸。在一个实施方案中,铰链结构域包含至少50,20或10个残基。在实施方案中,铰链的长度为10至300个,10至250个或10至200个残基。在一个实施方案中,铰链从细胞延伸的距离足够短,使得铰链不妨碍与靶细胞的表面的接合。在一个实施方案中,铰链从细胞毒性细胞的表面延伸小于20,15或10纳米。因此,铰链的适合性可以受线性长度,氨基酸残基的数量和铰链的柔性的影响。igg4铰链的长度可以长达200个氨基酸,但是其从细胞毒性细胞的表面延伸的距离由于ig结构域折叠而较小。约43个氨基酸的cd8α铰链在约8nm长度上是相当线性的。相比之下,igg4c2和c3铰链的长度为约200个氨基酸,但与细胞毒性细胞表面的距离与cd8α铰链相当。尽管不希望受理论束缚,但是延伸的相似性受到柔性的影响。
在一些情况下,胞外铰链结构域是例如来自人类蛋白质的铰链,其片段或短的寡肽或多肽接头。
在一些实施方案中,铰链是人工序列。在一个实施方案中,铰链是包含甘氨酸-丝氨酸双联体的短寡肽接头。
在一些实施方案中,铰链是天然存在的序列。在一些实施方案中,铰链可以是人ig(免疫球蛋白)铰链或其片段。在一个实施方案中,例如,铰链包含(例如,由其组成)igg4铰链的氨基酸序列(seqidno:3)。在一个实施方案中,例如,铰链包含(例如,由其组成)igd铰链的氨基酸序列(seqidno:4)。在一些实施方案中,铰链可以是人cd8铰链或其片段。在一个实施方案中,例如,铰链包含(例如,由其组成)cd8铰链的氨基酸序列(seqidno:2)。示例性铰链结构域的另外的序列提供在表5中。
tcars
在一些实施方案中,本发明的car细胞疗法包含与tcar组合的nkr-car。在实施方案中,本发明的car细胞疗法包含本文所述的
nkr-car表达细胞,进一步包含例如表达tcar。在备选的实施方案中,本发明的car细胞疗法包括表达本文所述的nkr-car的第一细胞和表达tcar的第二细胞。
在一个实施方案中,tcar包含与胞内结构域例如胞质结构域融合的抗原结合结构域。在实施方案中,胞质结构域包含胞内信号传导结构域,并且当其融合的胞外结构域(例如抗原结合结构域)结合反配体时产生细胞内信号。胞内信号传导结构域可以包括一级胞内信号传导结构域和共刺激信号传导结构域。在一个实施方案中,可以构建tcar分子用于在免疫效应细胞例如t细胞或nk细胞中表达,使得tcar分子包含结构域,例如一级胞内信号传导结构域,共刺激信号传导结构域,抑制性结构域等,其来源于通常与免疫细胞相关的多肽。例如,用于在免疫效应细胞例如t细胞或nk细胞中表达的tcar可以包含4-1bb结构域和cd3ζ结构域。在这种情况下,4-1bb和cd3ζ结构域都源自与免疫效应细胞例如t细胞或nk细胞相关的多肽。在另一个实施方案中,可以构建用于在免疫效应细胞例如t细胞或nk细胞中表达的tcar分子,使得tcar分子包含来源于通常不与免疫效应细胞相关的多肽的结构域。或者,用于在nk细胞中表达的tcar可以包含来源于t细胞的4-1bb结构域和cd3ζ结构域(参见例如wo2013/033626,通过引用并入本文)。
以下部分与本文所述的nkr-car和tcar的构建和表达及其使用方法相关。
抗原结合结构域
本文所述的car,例如本文所述的kir-car和tcar,包括胞外区中的抗原结合结构域。本文使用的术语“抗原结合结构域”是指对靶抗原(通常是靶细胞,例如癌细胞上的抗原)具有亲和力的分子。示例性的抗原结合结构域包含多肽,例如抗体分子(其包括抗体及其抗原结合片段,例如免疫球蛋白,单结构域抗体(sdab)和scfv)或非抗体支架,例如纤连蛋白等。在实施方案中,抗原结合结构域是单一多肽。在实施方案中,抗原结合结构域包含一个,两个或更多个多肽。
抗原结合结构域的选择可以取决于限定靶细胞表面的配体或受体的类型和数目。例如,可以选择抗原结合结构域以识别作为与特定疾病状态相关的靶细胞上的细胞表面标记物的配体或受体。可以作为配体或受体的细胞表面标记物的实例包括与特定疾病状态相关的细胞表面标记物,例如用于病毒性疾病,细菌性疾病、寄生虫感染,自身免疫性疾病和与不想要的细胞增殖相关的疾病例如癌症,例如本文所述的癌症相关的细胞表面标记物。
在本公开的上下文中,“肿瘤抗原”或“增殖性病症抗原”或“与增殖性病症相关的抗原”是指特异性增殖性病症所共有的抗原。在某些方面,本发明的增殖性病症抗原来源于癌症,包括但不限于原发性或转移性黑素瘤,胸腺瘤,淋巴瘤,肉瘤,肺癌(例如nsclc或sclc),肝癌,非霍奇金淋巴瘤,霍奇金淋巴瘤,白血病,多发性骨髓瘤,成胶质细胞瘤,神经母细胞瘤,子宫癌,子宫颈癌,肾癌,甲状腺癌,膀胱癌,肾癌和腺癌如乳腺癌,前列腺癌,卵巢癌,胰腺癌,结肠癌等。在一些实施方案中,癌症是b细胞急性淋巴细胞性白血病(“ball”),t细胞急性淋巴细胞白血病(“tall”),急性淋巴性白血病(all),急性骨髓性白血病(aml);一种或多种慢性白血病,包括但不限于慢性骨髓性白血病(cml),慢性淋巴细胞性白血病(cll);额外的血液癌症或血液病症,包括但不限于b细胞幼淋巴细胞白血病,胚细胞浆细胞样树突状细胞瘤,伯基特淋巴瘤,弥漫性大b细胞淋巴瘤,滤泡淋巴瘤,毛细胞白血病,小细胞或大细胞滤泡淋巴瘤,恶性淋巴增殖性病症,malt淋巴瘤,套细胞淋巴瘤,边缘区淋巴瘤,多发性骨髓瘤,骨髓发育不良和骨髓增生异常综合征,非霍奇金淋巴瘤,浆母细胞淋巴瘤,浆细胞样树突状细胞瘤,瓦尔登斯特伦巨球蛋白血症。
在一个实施方案中,肿瘤抗原包含由源自哺乳动物的癌症肿瘤的肿瘤浸润性淋巴细胞(til)免疫识别的一种或多种抗原性癌症表位。
肿瘤抗原是由引发免疫应答,特别是t细胞介导的免疫应答的肿瘤细胞产生的蛋白质。本发明的抗原结合结构域的选择将取决于待治疗的癌症的具体类型。肿瘤抗原是本领域熟知的,并且包括例如国际申请pct/us2015/020606中描述的肿瘤抗原。在实施方案中,肿瘤抗原选自神经胶质瘤相关抗原,癌胚抗原(cea),egfrviii,白细胞介素-11受体α(il-11ra),白细胞介素-13受体亚基α-2(il-13ra或cd213a2),表皮生长因子受体(egfr),b7h3(cd276),kit(cd117),碳酸酐酶(ca-ix),cs-1(也称为cd2子集1),细胞表面相关的粘蛋白1(muc1),bcma,由断裂点簇区域(bcr)和abelson鼠白血病病毒癌基因同源物1(abl)组成的癌基因融合蛋白bcr-abl,受体酪氨酸蛋白激酶erbb2(her2/neu),β-人绒毛膜促性腺激素,甲胎蛋白,间变性淋巴瘤激酶(alk),cd19,cd123,细胞周期蛋白b1,凝集素反应性afp,fos相关抗原1,肾上腺素受体β3(adrb3),甲状腺球蛋白,酪氨酸酶;肝配蛋白a型受体2(epha2),晚期糖基化终末产物受体(rage-1),肾ubiquitous1(ru1),肾ubiquitous2(ru2),滑膜肉瘤,x断点2(ssx2),a激酶锚定蛋白4(akap-4),淋巴细胞特异性蛋白酪氨酸激酶(lck),顶体蛋白原结合蛋白sp32(oy-tes1),配对盒蛋白pax-5(pax5),t细胞识别的鳞状细胞癌抗原3(sart3),c型凝集素样分子-1(cll-1或clecl1),岩藻糖基gm1,globoh糖神经酰胺的六糖部分(globoh),mn-caix,上皮细胞粘附分子(epcam),evt6-aml,转谷氨酰胺酶5(tgs5),人端粒酶逆转录酶(htert),胎盘特异性聚唾液酸1(plac1),肠羧基酯酶,lewisy抗原,唾液酰基路易斯粘附分子(sle),淋巴细胞抗原6复合体,基因座k9(ly6k),突变的热休克蛋白70-2(muthsp70-2),m-csf,v-myc禽骨髓母细胞瘤病毒癌基因神经母细胞瘤衍生同源物(mycn),ras同源物家族成员c(rhoc),酪氨酸酶相关蛋白2(trp-2),细胞色素p4501b1(cyp1b1),ccctc-结合因子(锌指蛋白)-样(boris或brotheroftheregulatorofimprintedsites),prostase,前列腺特异性抗原(psa),配对盒蛋白pax-3(pax3),前列腺酸性磷酸酶(pap),癌/睾丸抗原1(ny-eso-1),癌/睾丸抗原2(lage-1a),lmp2,神经细胞粘附分子(ncam),肿瘤蛋白p53(p53),p53突变体,大鼠肉瘤(ras)突变体,糖蛋白100(gp100),prostein,or51e2,pannexin3(panx3),前列腺特异性膜抗原(psma),前列腺干细胞抗原,高分子量黑素瘤相关抗原(hmwmaa),甲型肝炎病毒细胞受体1(havcr1),血管内皮生长因子受体2(vegfr2),血小板衍生生长因子受体β(pdgfr-β),legumain,人乳头瘤病毒e6(hpve6),人乳头瘤病毒e7(hpve7),存活蛋白,端粒酶,精子蛋白17(spa17),阶段特异性胚胎抗原-4(ssea-4),酪氨酸酶,tcrγ替代可读框蛋白(tarp),肾母细胞瘤蛋白(wt1),前列腺癌肿瘤抗原-1(pcta-1),黑素瘤细胞凋亡抑制剂(ml-iap),mage,黑素瘤相关抗原1(mage-a1),黑素瘤癌睾丸抗原-1(mad-ct-1),黑素瘤癌睾丸抗原-2(mad-ct-2),由t细胞识别的黑素瘤抗原1(melana/mart1),x抗原家族,成员1a(xage1),突变的延长因子2(elf2m),erg(tmprss2ets融合基因),n-乙酰葡糖氨基转移酶v(na17),中性粒细胞弹性蛋白酶,肉瘤易位断裂点,乳腺分化抗原(ny-br-1),肝配蛋白b2,cd22,cd24,cd30,cd33,cd38,cd44v6,cd97,cd171,cd179a,雄激素受体,胰岛素生长因子(igf)-i,igf-ii,igf-i受体,神经节苷脂gd2(gd2),o-乙酰-gd2神经节苷脂(oacgd2),神经节苷脂gd3(aneu5ac(2-8)aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer),神经节苷脂gm3(aneu5ac(2-3)bdgalp(1-4)bdglcp(1-1)cer),g蛋白偶联受体c类5组成员d(gprc5d),g蛋白偶联受体20(gpr20),x染色体开放阅读框61(cxorf61),叶酸受体(frα),叶酸受体β,受体酪氨酸激酶–样孤儿受体1(ror1),fms样酪氨酸激酶3(flt3),肿瘤相关糖蛋白72(tag72),tn抗原(tnag或(galnacα-ser/thr)),,血管生成素结合细胞表面受体2(tie2),肿瘤内皮标志物1(tem1或cd248),肿瘤内皮标志物7相关(tem7r),密蛋白6(cldn6),促甲状腺激素受体(tshr),uroplakin2(upk2),间皮素,蛋白酶丝氨酸21(testisin或prss21),表皮生长因子受体(egfr),成纤维细胞激活蛋白α(fap),嗅觉受体51e2(or51e2),位于染色体12p上的ets易位变异基因6(etv6-aml),cd79a;cd79b;cd72;白细胞相关免疫球蛋白样受体1(lair1);iga受体的fc片段(fcar或cd89);白细胞免疫球蛋白样受体亚家族a成员2(lilra2);cd300分子样家族成员f(cd300lf);c型凝集素结构域家族12成员a(clec12a);骨髓基质细胞抗原2(bst2);egf样模块含有粘蛋白样激素受体样2(emr2);淋巴细胞抗原75(ly75);磷脂酰肌醇蛋白聚糖-3(gpc3);fc受体样5(fcrl5);和免疫球蛋白λ样多肽1(igll1)。在优选的实施方案中,肿瘤抗原选自叶酸受体(fra),间皮素,egfrviii,il-13ra,cd123,cd19,cd33,bcma,gd2,cll-1,ca-ix,muc1,her2,及其任何组合。
在一个实施方案中,肿瘤抗原包含一个或多个与恶性肿瘤相关的抗原性癌症表位。恶性肿瘤表达许多可以作为免疫攻击的靶抗原的蛋白质。这些分子包括但不限于组织特异性抗原,例如黑素瘤中的mart-1,酪氨酸酶和gp100以及前列腺癌中的前列腺酸性磷酸酶(pap)和前列腺特异性抗原(psa)。其他靶抗原包括转化相关分子,例如癌基因her-2/neu/erbb-2。另一组靶抗原是癌胚抗原,例如癌胚抗原(cea)。在b细胞淋巴瘤中,肿瘤特异性独特型免疫球蛋白构成对个体肿瘤独特的真正的肿瘤特异性免疫球蛋白抗原。b细胞分化抗原如cd19,cd20和cd37是b细胞淋巴瘤中靶抗原的其它候选物。
肿瘤抗原的非限制性实例包括以下:分化抗原如mart-1/melana(mart-i),gp100(pmel17),酪氨酸酶,trp-1,trp-2和肿瘤特异性多谱系抗原如mage-1,mage-3,bage,gage-1,gage-2,p15;过表达的胚抗原如cea;过表达的癌基因和突变的肿瘤抑制基因如p53,ras,her-2/neu;由染色体易位产生的独特的肿瘤抗原;例如bcr-abl,e2a-prl,h4-ret,igh-igk,myl-rar;和病毒抗原,例如eb病毒抗原ebva和人乳头瘤病毒(hpv)抗原e6和e7。其它大的基于蛋白质的抗原包括tsp-180,mage-4,mage-5,mage-6,rage,ny-eso,p185erbb2,p180erbb-3,c-met,nm-23h1,psa,tag-72,ca19-9,ca72-4,cam17.1,numa,k-ras,β-联蛋白,cdk4,mum-1,p15,p16,43-9f,5t4,791tgp72,甲胎蛋白,β-hcg,bca225,btaa,ca125,ca15-3\ca27.29\bcaa,ca195,ca242,ca-50,cam43,cd68\p1,co-029,fgf-5,g250,ga733\epcam,htgp-175,m344,ma-50,mg7-ag,mov18,nb/70k,ny-co-1,rcas1,sdccag16,ta-90\mac-2结合蛋白\亲环蛋白c相关蛋白,taal6,tag72,tlp,和tps。
根据所要靶向的抗原,本发明的car可被工程化以包括对所需抗原靶标特异的适当的抗原结合结构域。
来源于抗体分子的抗原结合结构域
抗原结合结构域可以来源于抗体分子,例如一种或多种单克隆抗体,多克隆抗体,重组抗体,人抗体,人源化抗体,单结构域抗体,例如来自例如人或骆驼科动物来源的重链可变结构域(vh),轻链可变结构域(vl)和可变结构域(vhh)。在一些情况下,有利的是抗原结合结构域来源于与car将最终所用的物种相同的物种,例如用于人,有益的是car(例如本文所述的kir-car)的抗原结合结构域包含人或人源化抗原结合结构域。可以使用本领域已知的技术获得抗体。
在某些方面,scfv与前导序列相邻并在相同的可读框中。在一个方面,前导序列是作为seqidno:1提供的氨基酸序列。
在一个方面,抗原结合结构域是片段,例如单链可变片段(scfv)。在一个方面,抗原结合结构域是fv,fab,(fab’)2或双功能(例如双特异性)杂交抗体(例如,lanzavecchiaetal.,eur.j.immunol.17,105(1987))。一方面,本发明的抗体及其片段以野生型或增强的亲和力结合肿瘤抗原蛋白或其片段。
在一些情况下,scfv可以根据本领域已知的方法制备(参见例如birdetal.,(1988)science242:423-426和hustonetal.,(1988)proc.natl.acad.sci.usa85:5879-5883)。如上文和其他地方所述,scfv分子可以通过使用柔性多肽接头将vh和vl区连接在一起而产生。在一些实施方案中,scfv分子包含具有优化的长度和/或氨基酸组成的柔性多肽接头。柔性多肽接头长度可以极大地影响scfv的可变区如何折叠和相互作用。实际上,如果使用短的多肽接头(例如,在5-10个氨基酸之间),则防止链内折叠。还需要链间折叠以使两个可变区一起形成功能性表位结合位点,例如,接头方向和大小的例子参见例如hollingeretal.1993procnatlacad.sci.u.s.a.90:6444-6448,美国专利申请公开号2005/0100543,2005/0175606,2007/0014794,和pct公开号wo2006/020258和wo2007/024715,将其通过引用并入本文。
scfv可以包含至少1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,25,30,35,40,45,50个或更多个位于其vl和vh区之间的氨基酸残基的接头。接头序列可以包含任何天然存在的氨基酸。在一个实施方案中,scfv的肽接头由单独或组合使用的氨基酸如甘氨酸和/或丝氨酸残基组成,以将可变重链和可变轻链区连接在一起。在一个实施方案中,柔性多肽接头是gly/ser接头,并且例如包含氨基酸序列(gly-gly-gly-ser)n,其中n是等于或大于1的正整数(seqidno:40)。例如,n=1,n=2,n=3.n=4,n=5和n=6,n=7,n=8,n=9和n=10。在一个实施方案中,柔性多肽接头包括但不限于(gly4ser)4(seqidno:27)或(gly4ser)3(seqidno:28)。在另一个实施方案中,接头包括(gly2ser),(glyser)或(gly3ser)的多个重复(seqidno:29)。
在一些实施方案中,抗原结合结构域是单结构域抗原结合(sdab)分子。sdab分子包括其互补决定区是单结构域多肽的一部分的分子。实例包括但不限于重链可变结构域,天然缺乏轻链的结合分子,来源于常规4-链抗体的单结构域,工程化结构域和除了来源于抗体的那些的单结构域支架(例如,下文更详细描述)。sdab分子可以是本领域任何sdab分子,或任何未来的单结构域分子。sdab分子可以来自任何物种,包括但不限于小鼠,人,骆驼,美洲驼,鱼,鲨鱼,山羊,兔和牛。该术语还包括来自除骆驼科和鲨鱼以外的物种的天然存在的单结构域抗体分子。
在一个方面,sdab分子可以来源于在鱼中发现的免疫球蛋白的可变区,例如来源于在鲨鱼血清中发现的称为新型抗原受体(nar)的免疫球蛋白同种型的sdab分子。产生来源于nar可变区的单结构域分子(“ignar”)的方法描述于wo03/014161和streltsov(2005)proteinsci.14:2901-2909。
根据另一方面,sdab分子是已知为缺少轻链的重链的天然存在的单结构域抗原结合分子。这样的单结构域分子公开于例如wo9404678和hamers-casterman,c.etal.(1993)nature363:446-448。为了清楚起见,来自天然缺乏轻链的重链分子的这种可变结构域在本文中称为vhh或纳米抗体,以将其与四链免疫球蛋白的常规vh区分开。这种vhh分子可以源自骆驼科物种,例如骆驼,美洲驼,单峰骆驼,羊驼和大羊驼。除了骆驼科以外的其他物种可以产生天然缺乏轻链的重链分子;这样的vhh在本发明的范围内。
在某些实施方案中,sdab分子是包含一个或多个缺失互补可变结构域或免疫球蛋白恒定区(例如fc区)的单结构域分子(例如,纳米抗体)的单链融合多肽,其结合一个或多个靶抗原。
sdab分子可以是重组的,cdr移植的,人源化的,骆驼化的,去免疫的和/或体外产生的(例如通过噬菌体展示选择的)。
在一个实施方案中,抗原结合结构域部分包含人抗体或其片段。
在一些实施方案中,非人抗体是人源化的,其中修饰抗体的特定序列或区域以增加与人中天然产生的抗体的相似性。在一个实施方案中,抗原结合结构域是人源化的。
非人抗体可以使用本领域已知的多种技术进行人源化,例如cdr-移植(参见例如欧洲专利号ep239,400;国际公开号wo91/09967;和美国专利号5,225,539,5,530,101,和5,585,089,每个通过引用整体并入本文),贴面或表面重建(参见例如欧洲专利号ep592,106和ep519,596;padlan,1991,molecularimmunology,28(4/5):489-498;studnickaetal.,1994,proteinengineering,7(6):805-814;androguskaetal.,1994,pnas,91:969-973,其各自通过引用整体并入本文),链改组(参见例如美国专利号5,565,332,其是通过引用将其全部内容并入本文),以及例如在如下文献中公开的技术:美国专利申请公开号us2005/0042664,美国专利申请公开号us2005/0048617,美国专利号6,407,213,美国专利号5,766,886,国际公开号wo9317105,tanetal.,2002,j.immunol.,169:1119-25;caldasetal.,2000,proteineng.,13(5):353-60;moreaetal.,2000,methods,20:267-79;bacaetal.,1997,j.biol.chem.,272:10678-84;roguskaetal.,1996,proteineng.,9(10):895-904;coutoetal.,1995,cancerres.,55:5973s-5977;coutoetal.,1995,cancerres.,55(8):1717-22;sandhu1994gene,150(2):409-10;和pedersenetal.,1994,j.mol.biol.,235(3):959-73,其各自通过引用整体并入本文。通常,构架区中的构架残基将被来自cdr供体抗体的相应残基取代以改变,例如改善抗原结合。这些构架取代通过本领域熟知的方法鉴定,例如通过对cdr和构架残基的相互作用进行建模以鉴定对抗原结合和序列比较重要的构架残基,以鉴定在特定位置不寻常的构架残基。(参见例如queen等人,美国专利号5,585,089;和riechmann等人,1988,nature,332:323,其通过引用整体并入本文)。在优选的实施方案中,人源化抗体分子包含本文所述的序列,例如本文所述的可变轻链和/或可变重链,例如表4中所述的人源化可变轻链和/或可变重链。
人源化抗体具有从非人源引入其中的一个或多个氨基酸残基。这些非人氨基酸残基通常称为“输入”残基,其通常取自“输入”可变结构域。因此,人源化抗体包含一个或多个来自非人免疫球蛋白分子的cdr和来自人的构架区。抗体的人源化是本领域公知的,并且可以基本上按照winter及其同事的方法(jonesetal.,nature,321:522-525(1986);riechmannetal.,nature,332:323-327(1988);verhoeyenetal.,science,239:1534-1536(1988)),通过将啮齿类cdr或cdr序列用人抗体的相应序列取代,即cdr-移植(ep239,400;pct公开号wo91/09967;和美国专利号4,816,567;6,331,415;5,225,539;5,530,101;5,585,089;6,548,640,,其内容通过引用整体并入本文)。在这样的人源化嵌合抗体中,基本上小于完整的人可变结构域已被来自非人物种的相应序列取代。实际上,人源化抗体通常是人抗体,其中一些cdr残基和可能一些构架(fr)残基被来自啮齿动物抗体中类似位点的残基取代。抗体的人源化还可以通过贴面或表面重建(ep592,106;ep519,596;padlan,1991,molecularimmunology,28(4/5):489-498;studnickaetal.,proteinengineering,7(6):805-814(1994);和roguskaetal.,pnas,91:969-973(1994))或链改组(美国专利号5,565,332)实现,其内容通过引用整体并入本文。
在一些实施方案中,使用具有一个或多个本文公开的vh和/或vl序列的抗体进一步制备的本发明的抗体,可以用作工程化经修饰抗体的起始材料,该修饰抗体可以具有与起始抗体相比改变的性质。在各种实施方案中,通过修饰一个或两个可变区(即vh和/或vl)内,例如一个或多个cdr区内和/或一个或多个构架区内的一个或多个氨基酸来工程化抗体。
在另一方面,抗原结合结构域是t细胞受体(“tcr”)或其片段,例如单链tcr(sctcr)。制备此类tcr的方法是本领域已知的。参见例如willemsenraetal,genetherapy7:1369–1377(2000);zhangtetal,cancergenether11:487–496(2004);aggenetal,genether.19(4):365-74(2012)(将参考文献全部并入本文)。例如,可以改造sctcr,其含有来自通过接头(例如,柔性肽)连接的t细胞克隆的vα和vβ基因。这种方法对于本身是细胞内的癌相关靶标非常有用,然而,这种抗原(肽)的片段通过mhc呈递在癌细胞的表面上。
在实施方案中,本文所述的nkr-car或tcar分子包含抗原结合结构域,该抗原结合结构域包含特异性结合本文所述的肿瘤抗原的scfv。在表4中提供了特异性结合本文所述的肿瘤抗原的scfv的氨基酸序列。在一些实施方案中,表4中提供的scfv序列的cdr加下划线。给定cdr的精确氨基酸序列边界可以使用许多众所周知的编号方案中的任一种来确定,包括kabat或chothia描述的那些,或kabat和chothia编号方案的组合。
表4中提供的scfv序列包含连接scfv的可变重链和可变轻链的接头序列。接头序列可以是本文所述的任何接头序列,例如表5中提供的接头序列。
还注意到,表4中提供的一些scfv序列还包含前导序列,例如seqidno:1的氨基酸序列,而表4中提供的一些scfv序列不包含前导序列,例如seqidno:1的氨基酸序列。表4中提供的具有或不具有前导序列,例如seqidno:1的scfv序列也包括在本发明中。普通技术人员可以容易地使用表4中提供的序列来产生具有或不具有前导序列(例如seqidno:1的氨基酸序列)的car的scfv或抗原结合结构域。
表4:示例性抗原结合结构域
在一个实施方案中,抗间皮素的抗原结合结构域是表4中描述的抗间皮素结合结构域的抗原结合部分,例如cdr,例如ss1,m1,m2,m3,m4,m5,m6,m7,m8,m9,10,m11,m12,m13,m14,m15,m16,m17,m18,m19,m20,m21,m22,m23,或m24,例如ss1,m5或m11。在一个实施方案中,抗间皮素的抗原结合结构域是表4中描述的人抗间皮素结合结构域的人抗原结合部分,例如cdr,例如m1,m2,m3,m4,m5,m6,m7,m8,m9,10,m11,m12,m13,m14,m15,m16,m17,m18,m19,m20,m21,m22,m23,或m24,例如m5或m11。在一个实施方案中,结合间皮素的抗原结合结构域是根据通过引用并入本文的wo2015/090230的表2-3的抗原结合结构域。
在一个实施方案中,结合间皮素的人抗原结合结构域结合与鼠抗原结合结构域ss1结合的表位相同的表位(在表4中提供)。在一个实施方案中,结合间皮素的人抗原结合结构域结合与鼠抗原结合结构域ss1结合的表位不同的表位(在表4中提供)。如wo2015/090230(通过引用并入本文)中所述,表4中描述的m-5和m-11人抗间皮素结合结构域结合不同于ss1的表位的表位。
在一个实施方案中,抗cll-1的抗原结合结构域是可获自r&d,ebiosciences,abcam的抗体的抗原结合部分,例如cdr;例如pe-cll1-hucat#353604(biolegend),和pe-cll1(clec12a)cat#562566(bd)。在一个实施方案中,针对cll-1的抗原结合部分是表4中所述的抗cll-1结合结构域的抗原结合部分,例如cdr,例如139115,139116,139117,139118,139119,139120,139121,139121,139122,146259,146261,146262,146263,146264或181286。
在一个实施方案中,抗cd123的抗原结合结构域是表4中描述的抗cd123结合结构域的抗原结合部分,例如cdr,例如cd123-1,cd123-2,cd123-3,cd123-4,或hzcar1-32。在一个实施方案中,抗cd123的抗原结合结构域是根据wo2014/130635(通过引用并入本文)的表1-2的抗原结合结构域。在一个实施方案中,抗cd33的抗原结合结构域是例如brossetal.,clincancerres7(6):1490-1496(2001)(gemtuzumabozogamicin,hp67.6),caronetal.,cancerres52(24):6761-6767(1992)(lintuzumab,hum195),lapusanetal.,investnewdrugs30(3):1121-1131(2012)(ave9633),aigneretal.,leukemia27(5):1107-1115(2013)(amg330,cd33bite),dutouretal.,advhematol2012:683065(2012),和pizzitolaetal.,leukemiadoi:10.1038/lue.2014.62(2014)中描述的抗体的抗原结合部分,例如cdr。在一个实施方案中,针对cd33的抗原结合部分是表4中描述的抗cd33结合结构域的抗原结合部分,例如cdr,例如141643,141644,141645,141646,141647,141648,141649,141650,141651,2213或my96。
在一个实施方案中,抗gd2的抗原结合结构域是在例如mujooetal.,cancerres.47(4):1098-1104(1987);cheungetal.,cancerres45(6):2642-2649(1985),cheungetal.,jclinoncol5(9):1430-1440(1987),cheungetal.,jclinoncol16(9):3053-3060(1998),handgretingeretal.,cancerimmunolimmunother35(3):199-204(1992)中描述的抗体的抗原结合部分,例如cdr。在一些实施方案中,抗gd2的抗原结合结构域是选自以下的抗体的抗原结合部分:mab14.18,14g2a,ch14.18,hu14.18,3f8,hu3f8,3g6,8b6,60c3,10b8,me36.1和8h9,参见例如wo2012033885,wo2013040371,wo2013192294,wo2013061273,wo2013123061,wo2013074916,和wo201385552。在一些实施方案中,抗gd2的抗原结合结构域是美国公开号20100150910或pct公开号wo2011160119中描述的抗体的抗原结合部分。
在一个实施方案中,针对bcma的抗原结合结构域是在例如wo2012163805,wo200112812和wo2003062401中描述的抗体的抗原结合部分,例如cdr。在一个实施方案中,针对bcma的抗原结合部分是表4中描述的抗-bcma结合结构域的抗原结合部分,例如cdr,例如139100,139101,139102,139103,139104,139105,139106,139107,139108,139109,139110,139111,139112,139113,139114,149362,149363,149364,149365,149366,149367,149368,149369,ebc1978-a4,ebc1978-g1,ebbc1978-c7,ebbc1978-d10,ebbc1978-a10,ebbc1978-d4,ebbc1978-g4,ebbc1979-c1,ebbc1979-c12,ebbc1980-g4,ebbc1980-d2,ebbc1980-a2,ebbc1981-c3,huscfvbcma1或huscfvbcma2。
在一个实施方案中,针对wt-1的抗原结合结构域是例如daoetal.,scitranslmed5(176):176ra33(2013);或wo2012/135854中描述的抗体的抗原结合部分,例如cdr。在一个实施方案中,针对wt1的抗原结合结构域是表4中描述的抗-wt1结合结构域的抗原结合部分,例如cdr,例如esk1,wt1-2,wt1-3,wt1-4,wt1-5,wt1-6或wt1-7。
在一个实施方案中,抗cldn6的抗原结合结构域是抗体imab027(ganymedpharmaceuticals)的抗原结合部分,例如cdr,参见例如clinicaltrial.gov/show/nct02054351。在一个实施方案中,抗cldn6的抗原结合结构域是表4中所述的抗cldn6结合结构域的抗原结合部分,例如cdr,例如mumab64a,mab206-lcc或mab206-subg。
在一个实施方案中,抗原结合结构域包含来自上文所列抗体的一个,两个,三个(例如全部三个)重链cdr:hccdr1,hccdr2和hccdr3,和/或来自上文所列抗体的一个,两个,三个(例如全部三个)轻链cdr:lccdr1,lccdr2和lccdr3。在一个实施方案中,抗原结合结构域包含上文所列抗体的重链可变区和/或可变轻链区。
非抗体支架
在实施方案中,抗原结合结构域包含非抗体支架,例如纤连蛋白,锚蛋白,结构域抗体,脂笼蛋白,小模块免疫药物,maxybody,蛋白a或affilin。非抗体支架具有结合细胞上的靶抗原的能力。在实施方案中,抗原结合结构域是在细胞上表达的天然存在的蛋白质的多肽或其片段。在一些实施方案中,抗原结合结构域包含非抗体支架。可以使用多种非抗体支架,只要所得多肽包括至少一个特异性结合靶细胞上的靶抗原的结合区。
非抗体支架包括:纤连蛋白(novartis,ma),锚蛋白(molecularpartnersag,zurich,switzerland),结构域抗体(domantis,ltd.,cambridge,ma和ablynxnv,zwijnaarde,belgium),脂笼蛋白(pierisproteolabag,freying,germany),小模块免疫药物(trubionpharmaceuticalsinc.,seattle,wa),maxybodies(avidia,inc.,mountainview,ca),蛋白a(affibodyag,sweden)和affilin(γ-晶状体蛋白或泛素)(scilproteinsgmbh,halle,germany)。
纤连蛋白支架可以基于纤连蛋白iii型结构域(例如纤连蛋白iii型的第十个模块(10fn3结构域))。纤连蛋白iii型结构域具有分布在两个β片层之间的7或8个β链,其本身彼此包装以形成蛋白质的核心,并且还包含将β链彼此连接并暴露于溶剂的环(类似于cdr)。在β片层夹心的每个边缘处存在至少三个这样的环,其中边缘是垂直于β链方向的蛋白质的边界(参见us6,818,418)。由于这种结构,该非抗体支架模拟与抗体的性质和亲和力相似的抗原结合特性。这些支架可用于体外环随机化和改组策略,其类似于体内抗体的亲和力成熟过程。
锚蛋白技术基于使用具有锚蛋白衍生的重复模块的蛋白质作为带有可变区的支架,所述可变区可用于结合不同靶标。锚蛋白重复模块是由两个反平行α-螺旋和β-转角组成的33个氨基酸的多肽。可变区的结合通常通过使用核糖体展示来优化。
avimer来源于含有天然a结构域的蛋白如her3。这些结构域被自然用于蛋白质-蛋白质相互作用,并且在人类中超过250种蛋白质在结构上基于a结构域。avimers由通过氨基酸接头连接的许多不同的“a结构域”单体(2-10个)组成。可以使用在例如美国专利申请公开号20040175756;20050053973;20050048512;和20060008844中描述的方法制备可以结合靶抗原的avimer。
亲和体(affibody)亲和配体是小的,简单的蛋白,其由基于蛋白a的igg结合结构域之一的支架的三螺旋束组成。蛋白a是来自细菌金黄色葡萄球菌的表面蛋白。该支架结构域由58个氨基酸组成,其中13个被随机化以产生具有大量配体变体的亲和体文库(参见例如us5,831,012)。亲和体分子模拟抗体,与150kd的抗体的分子量相比,它们具有6kda的分子量。尽管其小尺寸,亲和体分子的结合位点与抗体的结合位点相似。
蛋白质表位模拟物(pem)是中等大小,环状,肽样分子(mw1-2kda),模拟蛋白质的β发夹二级结构,主要二级结构参与蛋白质-蛋白质相互作用。
错配的抗原结合结构域
已经发现具有多个各自包含抗原结合结构域的嵌合膜包埋受体(cmer)的细胞,cmer的抗原结合结构域之间的相互作用可能是不期望的,例如,因为它抑制一种或多种抗原结合结构域结合其同源抗原。因此,本文公开了包含当在相同细胞中表达时使这种相互作用最小化的抗原结合结构域的第一和第二非天然存在的cmer。在一个实施方案中,多个cmer包含两个tcar。在一个实施方案中,多个cmer包含tcar和另一cmer。在一个实施方案中,多个cmer包含两个nkr-car。在一个实施方案中,多个cmer包含nkr-car和另一cmer。在实施方案中,多个cmer包含tcar和nkr-car。
在一些实施方案中,要求保护的本发明包含第一和第二cmer,其中所述第一cmer和所述第二cmer之一的抗原结合结构域不包含可变轻链结构域和可变重链结构域。在一些实施方案中,所述第一cmer和所述第二cmer之一的所述抗原结合结构域是scfv,另一个不是scfv。在一些实施方案中,所述第一cmer和所述第二cmer之一的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或源自人或小鼠序列或非抗体支架的单vh结构域。在一些实施方案中,所述第一cmer和所述第二cmer之一的所述抗原结合结构域包含纳米抗体。在一些实施方案中,所述第一cmer和所述第二cmer之一的所述抗原结合结构域包含骆驼科vhh结构域。
在一些实施方案中,所述第一cmer和所述第二cmer之一的抗原结合结构域包含scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列的单vh结构域。在一些实施方案中,所述第一cmer和所述第二cmer之一的抗原结合结构域包含scfv,而另一个包含纳米抗体。在一些实施方案中,所述第一cmer和所述第二cmer之一的抗原结合结构域包含scfv,另一个包含骆驼科vhh结构域。
在一些实施方案中,当存在于细胞表面上时,所述第一cmer的抗原结合结构域与其同源抗原的结合不由于所述第二cmer的存在而显著降低。在一些实施方案中,在所述第二cmer存在下,所述第一cmer的抗原结合结构域与其同源抗原的结合为在不存在所述第二cmer的情况下所述第一cmer的抗原结合结构域与其同源抗原结合的85%,90%,95%,96%,97%,98%或99%。
在一些实施方案中,当存在于细胞表面上时,所述第一cmer和所述第二cmer的所述抗原结合结构域彼此的结合比两者都是scfv抗原结合结构域时更少。在一些实施方案中,所述第一cmer和所述第二cmer的抗原结合结构域彼此的结合比如果两者都是scfv抗原结合结构域时小85%,90%,95%,96%,97%,98%或99%。
在一些实施方案中,要求保护的本发明包含第一和第二kir-car,其中所述第一kir-car和所述第二kir-car之一的的抗原结合结构域不包含可变轻结构域和可变重链结构域。在一些实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域是scfv,另一个不是scfv。在一些实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架的单vh结构域。在一些实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含纳米抗体。在一些实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含骆驼科vhh结构域。
在一些实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列的单vh结构域。在一些实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,另一个包含纳米抗体。在一些实施方案中,所述第一kir-car和所述第二kir-car之一的抗原结合结构域包含scfv,另一个包含骆驼科vhh结构域。
在一些实施方案中,当存在于细胞表面上时,所述第一kir-car的抗原结合结构域与其同源抗原的结合不由于所述第二kir-car的存在而显著降低。在一些实施方案中,在所述第二kir-car存在下,所述第一kir-car的抗原结合结构域与其同源抗原的结合为在不存在所述第二kir-car的情况下所述第一kir-car的抗原结合结构域与其同源抗原的结合的85%,90%,95%,96%,97%,98%或99%。
在一些实施方案中,当存在于细胞表面上时,所述第一kir-car和所述第二kir-car的所述抗原结合结构域彼此结合小于两者都是scfv抗原结合结构域时的结合。在一些实施方案中,所述第一kir-car和所述第二kir-car的所述抗原结合结构域彼此结合比如果两者均为scfv时小85%,90%,95%,96%,97%,98%或99%。
在一些实施方案中,要求保护的发明包含第一和第二tcar,其中所述第一tcar和所述第二tcar之一的抗原结合结构域不包含可变轻结构域和可变重结构域。在一些实施方案中,所述第一tcar和所述第二tcar之一的抗原结合结构域是scfv,而另一个不是scfv。在一些实施方案中,所述第一tcar和所述第二tcar之一的抗原结合结构域包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列或非抗体支架的单vh结构域。在一些实施方案中,所述第一tcar和所述第二tcar之一的抗原结合结构域包含纳米抗体。在一些实施方案中,所述第一tcar和所述第二tcar之一的所述抗原结合结构域包含骆驼科vhh结构域。
在一些实施方案中,所述第一tcar和所述第二tcar之一的所述抗原结合结构域包含scfv,另一个包含单vh结构域,例如骆驼科,鲨鱼或七鳃鳗单vh结构域,或来源于人或小鼠序列的单vh结构域。在一些实施方案中,所述第一tcar和所述第二tcar之一的所述抗原结合结构域包含scfv,另一个包含纳米抗体。在一些实施方案中,所述第一tcar和所述第二tcar之一的所述抗原结合结构域包含scfv,另一个包含骆驼科vhh结构域。
在一些实施方案中,当存在于细胞表面上时,所述第一tcar的抗原结合结构域与其同源抗原的结合不由于所述第二tcar的存在而显著降低。在一些实施方案中,在所述第二tcar存在下,所述第一tcar的抗原结合结构域与其同源抗原的结合为在所述第二tcar不存在时所述第一tcar的抗原结合结构域与其同源抗原的结合的85%,90%,95%,96%,97%,98%或99%。
在一些实施方案中,当存在于细胞表面上时,所述第一tcar和所述第二tcar的所述抗原结合结构域彼此的结合小于如果两者都是scfv抗原结合结构域时的结合。在一些实施方案中,所述第一tcar和所述第二tcar的所述抗原结合结构域彼此的结合比如果两者均为scfv抗原结合结构域时的结合小85%,90%,95%,96%,97%,98%或99%。
双特异性car
在一个实施方案中,本文所述的抗原结合结构域,例如本文所述的nkr-car或tcar,包含多特异性抗体分子,例如双特异性抗体分子。双特异性抗体具有对不超过两个抗原的特异性。双特异性抗体分子的特征在于对第一表位具有结合特异性的第一免疫球蛋白可变结构域序列,和对第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。在一个实施方案中,第一和第二表位在同一个抗原,例如,相同的蛋白质(或多聚体蛋白质的亚基)上。在一个实施方案中,第一和第二表位重叠。在一个实施方案中,第一和第二表位不重叠。在一个实施方案中,第一和第二表位是在不同的抗原,例如,不同的蛋白质(或多聚体蛋白质的不同亚基)上。在一个实施方案中,双特异性抗体分子包含对第一表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列和对第二表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列。在一个实施方案中,双特异性抗体分子包含对第一表位具有结合特异性的半抗体和对第二表位具有结合特异性的半抗体。在一个实施方案中,双特异性抗体分子包含具有对第一表位的结合特异性的半抗体,或其片段,和具有对第二表位的结合特异性的半抗体,或其片段。在一个实施方案中,双特异性抗体分子包含具有对第一表位的结合特异性的scfv或其片段和具有对第二表位的结合特异性的scfv或其片段。
在某些实施方案中,抗体分子是多特异性(例如,双特异性或三特异性)抗体分子。用于产生双特异性或异二聚体抗体分子的方案在本领域中是已知的;包括但不限于,例如,us5731168中描述的“孔中旋钮”方法;例如,wo09/089004,wo06/106905和wo2010/129304中描述的静电控制fc配对;例如,wo07/110205中描述的链交换工程化结构域(seed)异二聚体形成;如,例如,wo08/119353,wo2011/131746,和wo2013/060867中描述的fab臂交换;例如,us4433059中描述的双抗体缀合物,例如,使用具有胺反应性基团和巯基反应性基团的异双功能试剂,通过抗体交联产生双特异性结构;例如,us4444878中描述的通过两条重链之间二硫键的还原和氧化循环,重组来自不同抗体的半抗体(重-轻链对或fab),产生双特异性抗体决定簇;例如,us5273743中所述的三功能抗体,例如,通过巯基反应性基团交联的三fab’片段;例如,us5534254中所述的生物合成结合蛋白,例如,通过c末端尾部,优选通过二硫化物或胺反应性化学交联交联的scfv对;如例如,us5582996中描述的双功能抗体,例如,通过已经取代了恒定结构域的亮氨酸拉链(例如,c-fos和c-jun)二聚化的具有不同结合特异性的fab片段;如例如,us5591828中所述的双特异性和寡特异性单价和寡价受体,例如,两个抗体的vh-ch1区(两个fab片段),它们通过一个抗体的ch1区和另一抗体的vh区(通常具有结合的轻链)之间的多肽间隔区连接;例如,us5635602中描述的双特异性dna抗体缀合物,例如,通过dna的双链片段交联抗体或fab片段;如例如,us5637481中所述的双特异性融合蛋白,例如,含两个scfv(它们之间具有亲水螺旋肽接头)和完整恒定区的表达构建体;如描述于例如,us5837242的多价和多特异性结合蛋白,例如,具有第一结构域和第二结构域的多肽的二聚体,所述第一结构域具有ig重链可变区的结合区,所述第二结构域具有ig轻链可变区的结合区,通常称作双抗体(高阶结构也被包括用于产生双特异性,三特异性,或四特异性分子);微抗体构建体,其具有连接的vl和vh链,所述vl和vh链用肽间隔区进一步连接抗体铰链区和ch3区,其可以被二聚化以形成双特异性/多价分子,如例如,us5837821所述;用短肽接头连接(例如,5个或10个氨基酸)或无接头在任一方向连接的vh和vl结构域,其可以形成二聚体以形成双特异性双抗体;三聚体和四聚体,如描述于例如,us5844094;通过肽键连接的vh结构域(或家族成员中vl结构域)的串,在c末端的交联基团与vl结构域进一步连接,以形成一系列的fvs(或scfv),如描述在例如,us5864019;和单链结合多肽,通过肽接头连接的vh和vl结构域通过非共价或化学交联成多价结构,使用scfv或双抗体型形式,形成例如,均二价、异二价、三价和四价结构,如,例如,us5869620所述。另外的示例性多特异性和双特异性分子和制备它们的方法见,例如,us5910573,us5932448,us5959083,us5989830,us6005079,us6239259,us6294353,us6333396,us6476198,us6511663,us6670453,us6743896,us6809185,us6833441,us7129330,us7183076,us7521056,us7527787,us7534866,us7612181,us2002004587a1,us2002076406a1,us2002103345a1,us2003207346a1,us2003211078a1,us2004219643a1,us2004220388a1,us2004242847a1,us2005003403a1,us2005004352a1,us2005069552a1,us2005079170a1,us2005100543a1,us2005136049a1,us2005136051a1,us2005163782a1,us2005266425a1,us2006083747a1,us2006120960a1,us2006204493a1,us2006263367a1,us2007004909a1,us2007087381a1,us2007128150a1,us2007141049a1,us2007154901a1,us2007274985a1,us2008050370a1,us2008069820a1,us2008152645a1,us2008171855a1,us2008241884a1,us2008254512a1,us2008260738a1,us2009130106a1,us2009148905a1,us2009155275a1,us2009162359a1,us2009162360a1,us2009175851a1,us2009175867a1,us2009232811a1,us2009234105a1,us2009263392a1,us2009274649a1,ep346087a2,wo0006605a2,wo02072635a2,wo04081051a1,wo06020258a2,wo2007044887a2,wo2007095338a2,wo2007137760a2,wo2008119353a1,wo2009021754a2,wo2009068630a1,wo9103493a1,wo9323537a1,wo9409131a1,wo9412625a2,wo9509917a1,wo9637621a2,wo9964460a1。以上引用的申请的内容通过引用以其整体并入本文。
在双特异性抗体分子的每个抗体或抗体片段(例如,scfv)内,vh可以在vl的上游或下游。在一些实施方案中,上游抗体或抗体片段(例如,scfv)与它的vl(vl1)上游的vh(vh1)一起排列,下游抗体或抗体片段(例如,scfv)与它的vh(vh2)上游的vl(vl2)一起排列,使得总的双特异性抗体分子具有排列vh1-vl1-vl2-vh2。在其他实施方案中,上游抗体或抗体片段(例如,scfv)与它的vh(vh1)上游的vl(vl1)一起排列,下游抗体或抗体片段(例如,scfv)与它的vl(vl2)上游的vh(vh2)一起排列,使得总的双特异性抗体分子具有排列vl1-vh1-vh2-vl2。任选地,接头设置在两个抗体或抗体片段(例如,scfv)之间,例如,如果构建体排列为vh1-vl1-vl2-vh2,那么在vl1和vl2之间,如果构建体排列为vl1-vh1-vh2-vl2,那么在vh1和vh2之间。所述接头可以是如本文所述接头,例如,(gly4-ser)n接头,其中n是1,2,3,4,5,或6,优选4(seqidno:63)。在一般情况下,两个scfv之间的接头应该足够长,以避免两个scfv的结构域之间错配。任选地,接头被布置在第一scfv的vl和vh之间。任选地,接头布置在第二scfv的vl和vh之间。在具有多个接头的构建体中,任何两个或更多个接头可以是相同或不同的。因此,在一些实施方案中,双特异性car包含vls,vhs,和任选如本文所述排列中的一个或多个接头。
在一个方面,双特异性抗体分子的特征在于第一免疫球蛋白可变结构域序列,例如scfv,其对本文所述的肿瘤抗原具有结合特异性,例如包含如本文所述的scfv,例如如表4所述,或包含来自本文所述scfv的轻链cdr和/或重链cdr和对不同抗原上的第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。在一些方面,第二免疫球蛋白可变结构域序列对在肿瘤上表达的抗原(例如本文所述的肿瘤抗原)具有结合特异性。
示例性car序列
在实施方案中,本文所述的nkr-car或tcar可以包含表5中提供的一种或多种序列。
表5.car的各种组分的序列(aa-氨基酸序列,na-核酸序列)
本文进一步提供nkr-car的示例性序列和nkr-car的组分。
包含结合间皮素的抗原结合结构域和包含kir2ds2结构域的胞质结构域的kir-car的核酸序列提供于下文。本文所述的任何抗原结合结构域可以替代下文提供的间皮素抗原结合结构域。
ss1kir2ds2基因序列(seqidno:327)
gtgcacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaatttcacacaggaaacagctatgaccatgattacgccaagcgcgcaattaaccctcactaaagggaacaaaagctggagctgcaagcttaatgtagtcttatgcaatactcttgtagtcttgcaacatggtaacgatgagttagcaacatgccttacaaggagagaaaaagcaccgtgcatgccgattggtggaagtaaggtggtacgatcgtgccttattaggaaggcaacagacgggtctgacatggattggacgaaccactgaattgccgcattgcagagatattgtatttaagtgcctagctcgatacaataaacgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtggcgcccgaacagggacctgaaagcgaaagggaaaccagagctctctcgacgcaggactcggcttgctgaagcgcgcacggcaagaggcgaggggcggcgactggtgagtacgccaaaaattttgactagcggaggctagaaggagagagatgggtgcgagagcgtcagtattaagcgggggagaattagatcgcgatgggaaaaaattcggttaaggccagggggaaagaaaaaatataaattaaaacatatagtatgggcaagcagggagctagaacgattcgcagttaatcctggcctgttagaaacatcagaaggctgtagacaaatactgggacagctacaaccatcccttcagacaggatcagaagaacttagatcattatataatacagtagcaaccctctattgtgtgcatcaaaggatagagataaaagacaccaaggaagctttagacaagatagaggaagagcaaaacaaaagtaagaccaccgcacagcaagcggccgctgatcttcagacctggaggaggagatatgagggacaattggagaagtgaattatataaatataaagtagtaaaaattgaaccattaggagtagcacccaccaaggcaaagagaagagtggtgcagagagaaaaaagagcagtgggaataggagctttgttccttgggttcttgggagcagcaggaagcactatgggcgcagcctcaatgacgctgacggtacaggccagacaattattgtctggtatagtgcagcagcagaacaatttgctgagggctattgaggcgcaacagcatctgttgcaactcacagtctggggcatcaagcagctccaggcaagaatcctggctgtggaaagatacctaaaggatcaacagctcctggggatttggggttgctctggaaaactcatttgcaccactgctgtgccttggaatgctagttggagtaataaatctctggaacagattggaatcacacgacctggatggagtgggacagagaaattaacaattacacaagcttaatacactccttaattgaagaatcgcaaaaccagcaagaaaagaatgaacaagaattattggaattagataaatgggcaagtttgtggaattggtttaacataacaaattggctgtggtatataaaattattcataatgatagtaggaggcttggtaggtttaagaatagtttttgctgtactttctatagtgaatagagttaggcagggatattcaccattatcgtttcagacccacctcccaaccccgaggggacccgacaggcccgaaggaatagaagaagaaggtggagagagagacagagacagatccattcgattagtgaacggatctcgacggtatcgattagactgtagcccaggaatatggcagctagattgtacacatttagaaggaaaagttatcttggtagcagttcatgtagccagtggatatatagaagcagaagtaattccagcagagacagggcaagaaacagcatacttcctcttaaaattagcaggaagatggccagtaaaaacagtacatacagacaatggcagcaatttcaccagtactacagttaaggccgcctgttggtgggcggggatcaagcaggaatttggcattccctacaatccccaaagtcaaggagtaatagaatctatgaataaagaattaaagaaaattataggacaggtaagagatcaggctgaacatcttaagacagcagtacaaatggcagtattcatccacaattttaaaagaaaaggggggattggggggtacagtgcaggggaaagaatagtagacataatagcaacagacatacaaactaaagaattacaaaaacaaattacaaaaattcaaaattttcgggtttattacagggacagcagagatccagtttggctgcatacgcgtcgtgaggctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccgagaagttggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataagtgcagtagtcgccgtgaacgttctttttcgcaacgggtttgccgccagaacacaggtaagtgccgtgtgtggttcccgcgggcctggcctctttacgggttatggcccttgcgtgccttgaattacttccacctggctgcagtacgtgattcttgatcccgagcttcgggttggaagtgggtgggagagttcgaggccttgcgcttaaggagccccttcgcctcgtgcttgagttgaggcctggcctgggcgctggggccgccgcgtgcgaatctggtggcaccttcgcgcctgtctcgctgctttcgataagtctctagccatttaaaatttttgatgacctgctgcgacgctttttttctggcaagatagtcttgtaaatgcgggccaagatctgcacactggtatttcggtttttggggccgcgggcggcgacggggcccgtgcgtcccagcgcacatgttcggcgaggcggggcctgcgagcgcggccaccgagaatcggacgggggtagtctcaagctggccggcctgctctggtgcctggcctcgcgccgccgtgtatcgccccgccctgggcggcaaggctggcccggtcggcaccagttgcgtgagcggaaagatggccgcttcccggccctgctgcagggagctcaaaatggaggacgcggcgctcgggagagcgggcgggtgagtcacccacacaaaggaaaagggcctttccgtcctcagccgtcgcttcatgtgactccacggagtaccgggcgccgtccaggcacctcgattagttctcgtgcttttggagtacgtcgtctttaggttggggggaggggttttatgcgatggagtttccccacactgagtgggtggagactgaagttaggccagcttggcacttgatgtaattctccttggaatttgccctttttgagtttggatcttggttcattctcaagcctcagacagtggttcaaagtttttttcttccatttcaggtgtcgtgagctagaatggggggacttgaaccctgcagcaggctcctgctcctgcctctcctgctggctgtaagtggtctccgtcctgtccaggcccaggcccagagcgattgcagttgctctacggtgagcccgggcgtgctggcagggatcgtgatgggagacctggtgctgacagtgctcattgccctggccgtgtacttcctgggccggctggtccctcgggggcgaggggctgcggaggcagcgacccggaaacagcgtatcactgagaccgagtcgccttatcaggagctccagggtcagaggtcggatgtctacagcgacctcaacacacagaggccgtattacaaagtcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccgggatcccaggtacaactgcagcagtctgggcctgagctggagaagcctggcgcttcagtgaagatatcctgcaaggcttctggttactcattcactggctacaccatgaactgggtgaagcagagccatggaaagagccttgagtggattggacttattactccttacaatggtgcttctagctacaaccagaagttcaggggcaaggccacattaactgtagacaagtcatccagcacagcctacatggacctcctcagtctgacatctgaagactctgcagtctatttctgtgcaagggggggttacgacgggaggggttttgactactggggccaagggaccacggtcaccgtctcctcaggtggaggcggttcaggcggcggtggctctagcggtggtggatcggacatcgagctcactcagtctccagcaatcatgtctgcatctccaggggagaaggtcaccatgacctgcagtgccagctcaagtgtaagttacatgcactggtaccagcagaagtcaggcacctcccccaaaagatggatttatgacacatccaaactggcttctggagtcccaggtcgcttcagtggcagtgggtctggaaactcttactctctcacaatcagcagcgtggaggctgaagatgatgcaacttattactgccagcagtggagtaagcaccctctcacgtacggtgctgggacaaagttggaaatcaaagctagcacgcgtggtggcggaggttctggaggtgggggttcccagggggcctggccacatgagggagtccacagaaaaccttccctcctggcccacccaggtcccctggtgaaatcagaagagacagtcatcctgcaatgttggtcagatgtcaggtttgagcacttccttctgcacagagaggggaagtataaggacactttgcacctcattggagagcaccatgatggggtctccaaggccaacttctccatcggtcccatgatgcaagaccttgcagggacctacagatgctacggttctgttactcactccccctatcagttgtcagctcccagtgaccctctggacatcgtcatcacaggtctatatgagaaaccttctctctcagcccagccgggccccacggttttggcaggagagagcgtgaccttgtcctgcagctcccggagctcctatgacatgtaccatctatccagggagggggaggcccatgaacgtaggttctctgcagggcccaaggtcaacggaacattccaggccgactttcctctgggccctgccacccacggaggaacctacagatgcttcggctctttccgtgactctccctatgagtggtcaaactcgagtgacccactgcttgtttctgtcacaggaaacccttcaaatagttggccttcacccactgaaccaagctccaaaaccggtaaccccagacacctgcatgttctgattgggacctcagtggtcaaaatccctttcaccatcctcctcttctttctccttcatcgctggtgctccaacaaaaaaaatgctgctgtaatggaccaagagcctgcagggaacagaacagtgaacagcgaggattctgatgaacaagaccatcaggaggtgtcatacgcataagtcgacaatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaagctgacgtcctttccatggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcctggaattcgagctcggtacctttaagaccaatgacttacaaggcagctgtagatcttagccactttttaaaagaaaaggggggactggaagggctaattcactcccaacgaagacaagatctgctttttgcttgtactgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtagtagttcatgtcatcttattattcagtatttataacttgcaaagaaatgaatatcagagagtgagaggaacttgtttattgcagcttataatggttacaaataaagcaatagcatcacaaatttcacaaataaagcatttttttcactgcattctagttgtggtttgtccaaactcatcaatgtatcttatcatgtctggctctagctatcccgcccctaactccgcccagttccgcccattctccgccccatggctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctacgcttttgcgtcgagacgtacccaattcgccctatagtgagtcgtattacgcgcgctcactggccgtcgttttacaacgtcgtgactgggaaaaccctggcgttacccaacttaatcgccttgcagcacatccccctttcgccagctggcgtaatagcgaagaggcccgcaccgatcgcccttcccaacagttgcgcagcctgaatggcgaatggcgcgacgcgccctgtagcggcgcattaagcgcggcgggtgtggtggttacgcgcagcgtgaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttcccttcctttctcgccacgttcgccggctttccccgtcaagctctaaatcgggggctccctttagggttccgatttagtgctttacggcacctcgaccccaaaaaacttgattagggtgatggttcacgtagtgggccatcgccctgatagacggtttttcgccctttgacgttggagtccacgttctttaatagtggactcttgttccaaactggaacaacactcaaccctatctcggtctattcttttgatttataagggattttgccgatttcggcctattggttaaaaaatgagctgatttaacaaaaatttaacgcgaattttaacaaaatattaacgtttacaatttcccaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgg
包含结合间皮素的抗原结合结构域和包含kirs2结构域的胞质结构域的kir-car的核酸序列提供于下文。本文所述的任何抗原结合结构域可以替代下文提供的间皮素抗原结合结构域。
ss1kirs2基因序列(seqidno:328)
gtgcacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaatttcacacaggaaacagctatgaccatgattacgccaagcgcgcaattaaccctcactaaagggaacaaaagctggagctgcaagcttaatgtagtcttatgcaatactcttgtagtcttgcaacatggtaacgatgagttagcaacatgccttacaaggagagaaaaagcaccgtgcatgccgattggtggaagtaaggtggtacgatcgtgccttattaggaaggcaacagacgggtctgacatggattggacgaaccactgaattgccgcattgcagagatattgtatttaagtgcctagctcgatacaataaacgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtggcgcccgaacagggacctgaaagcgaaagggaaaccagagctctctcgacgcaggactcggcttgctgaagcgcgcacggcaagaggcgaggggcggcgactggtgagtacgccaaaaattttgactagcggaggctagaaggagagagatgggtgcgagagcgtcagtattaagcgggggagaattagatcgcgatgggaaaaaattcggttaaggccagggggaaagaaaaaatataaattaaaacatatagtatgggcaagcagggagctagaacgattcgcagttaatcctggcctgttagaaacatcagaaggctgtagacaaatactgggacagctacaaccatcccttcagacaggatcagaagaacttagatcattatataatacagtagcaaccctctattgtgtgcatcaaaggatagagataaaagacaccaaggaagctttagacaagatagaggaagagcaaaacaaaagtaagaccaccgcacagcaagcggccgctgatcttcagacctggaggaggagatatgagggacaattggagaagtgaattatataaatataaagtagtaaaaattgaaccattaggagtagcacccaccaaggcaaagagaagagtggtgcagagagaaaaaagagcagtgggaataggagctttgttccttgggttcttgggagcagcaggaagcactatgggcgcagcctcaatgacgctgacggtacaggccagacaattattgtctggtatagtgcagcagcagaacaatttgctgagggctattgaggcgcaacagcatctgttgcaactcacagtctggggcatcaagcagctccaggcaagaatcctggctgtggaaagatacctaaaggatcaacagctcctggggatttggggttgctctggaaaactcatttgcaccactgctgtgccttggaatgctagttggagtaataaatctctggaacagattggaatcacacgacctggatggagtgggacagagaaattaacaattacacaagcttaatacactccttaattgaagaatcgcaaaaccagcaagaaaagaatgaacaagaattattggaattagataaatgggcaagtttgtggaattggtttaacataacaaattggctgtggtatataaaattattcataatgatagtaggaggcttggtaggtttaagaatagtttttgctgtactttctatagtgaatagagttaggcagggatattcaccattatcgtttcagacccacctcccaaccccgaggggacccgacaggcccgaaggaatagaagaagaaggtggagagagagacagagacagatccattcgattagtgaacggatctcgacggtatcgattagactgtagcccaggaatatggcagctagattgtacacatttagaaggaaaagttatcttggtagcagttcatgtagccagtggatatatagaagcagaagtaattccagcagagacagggcaagaaacagcatacttcctcttaaaattagcaggaagatggccagtaaaaacagtacatacagacaatggcagcaatttcaccagtactacagttaaggccgcctgttggtgggcggggatcaagcaggaatttggcattccctacaatccccaaagtcaaggagtaatagaatctatgaataaagaattaaagaaaattataggacaggtaagagatcaggctgaacatcttaagacagcagtacaaatggcagtattcatccacaattttaaaagaaaaggggggattggggggtacagtgcaggggaaagaatagtagacataatagcaacagacatacaaactaaagaattacaaaaacaaattacaaaaattcaaaattttcgggtttattacagggacagcagagatccagtttggctgcatacgcgtcgtgaggctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccgagaagttggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataagtgcagtagtcgccgtgaacgttctttttcgcaacgggtttgccgccagaacacaggtaagtgccgtgtgtggttcccgcgggcctggcctctttacgggttatggcccttgcgtgccttgaattacttccacctggctgcagtacgtgattcttgatcccgagcttcgggttggaagtgggtgggagagttcgaggccttgcgcttaaggagccccttcgcctcgtgcttgagttgaggcctggcctgggcgctggggccgccgcgtgcgaatctggtggcaccttcgcgcctgtctcgctgctttcgataagtctctagccatttaaaatttttgatgacctgctgcgacgctttttttctggcaagatagtcttgtaaatgcgggccaagatctgcacactggtatttcggtttttggggccgcgggcggcgacggggcccgtgcgtcccagcgcacatgttcggcgaggcggggcctgcgagcgcggccaccgagaatcggacgggggtagtctcaagctggccggcctgctctggtgcctggcctcgcgccgccgtgtatcgccccgccctgggcggcaaggctggcccggtcggcaccagttgcgtgagcggaaagatggccgcttcccggccctgctgcagggagctcaaaatggaggacgcggcgctcgggagagcgggcgggtgagtcacccacacaaaggaaaagggcctttccgtcctcagccgtcgcttcatgtgactccacggagtaccgggcgccgtccaggcacctcgattagttctcgtgcttttggagtacgtcgtctttaggttggggggaggggttttatgcgatggagtttccccacactgagtgggtggagactgaagttaggccagcttggcacttgatgtaattctccttggaatttgccctttttgagtttggatcttggttcattctcaagcctcagacagtggttcaaagtttttttcttccatttcaggtgtcgtgagctagaatggggggacttgaaccctgcagcaggctcctgctcctgcctctcctgctggctgtaagtggtctccgtcctgtccaggcccaggcccagagcgattgcagttgctctacggtgagcccgggcgtgctggcagggatcgtgatgggagacctggtgctgacagtgctcattgccctggccgtgtacttcctgggccggctggtccctcgggggcgaggggctgcggaggcagcgacccggaaacagcgtatcactgagaccgagtcgccttatcaggagctccagggtcagaggtcggatgtctacagcgacctcaacacacagaggccgtattacaaagtcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccgggatcccaggtacaactgcagcagtctgggcctgagctggagaagcctggcgcttcagtgaagatatcctgcaaggcttctggttactcattcactggctacaccatgaactgggtgaagcagagccatggaaagagccttgagtggattggacttattactccttacaatggtgcttctagctacaaccagaagttcaggggcaaggccacattaactgtagacaagtcatccagcacagcctacatggacctcctcagtctgacatctgaagactctgcagtctatttctgtgcaagggggggttacgacgggaggggttttgactactggggccaagggaccacggtcaccgtctcctcaggtggaggcggttcaggcggcggtggctctagcggtggtggatcggacatcgagctcactcagtctccagcaatcatgtctgcatctccaggggagaaggtcaccatgacctgcagtgccagctcaagtgtaagttacatgcactggtaccagcagaagtcaggcacctcccccaaaagatggatttatgacacatccaaactggcttctggagtcccaggtcgcttcagtggcagtgggtctggaaactcttactctctcacaatcagcagcgtggaggctgaagatgatgcaacttattactgccagcagtggagtaagcaccctctcacgtacggtgctgggacaaagttggaaatcaaagctagcggtggcggaggttctggaggtgggggttcctcacccactgaaccaagctccaaaaccggtaaccccagacacctgcatgttctgattgggacctcagtggtcaaaatccctttcaccatcctcctcttctttctccttcatcgctggtgctccaacaaaaaaaatgctgctgtaatggaccaagagcctgcagggaacagaacagtgaacagcgaggattctgatgaacaagaccatcaggaggtgtcatacgcataagtcgacaatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaagctgacgtcctttccatggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcctggaattcgagctcggtacctttaagaccaatgacttacaaggcagctgtagatcttagccactttttaaaagaaaaggggggactggaagggctaattcactcccaacgaagacaagatctgctttttgcttgtactgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtagtagttcatgtcatcttattattcagtatttataacttgcaaagaaatgaatatcagagagtgagaggaacttgtttattgcagcttataatggttacaaataaagcaatagcatcacaaatttcacaaataaagcatttttttcactgcattctagttgtggtttgtccaaactcatcaatgtatcttatcatgtctggctctagctatcccgcccctaactccgcccagttccgcccattctccgccccatggctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctacgcttttgcgtcgagacgtacccaattcgccctatagtgagtcgtattacgcgcgctcactggccgtcgttttacaacgtcgtgactgggaaaaccctggcgttacccaacttaatcgccttgcagcacatccccctttcgccagctggcgtaatagcgaagaggcccgcaccgatcgcccttcccaacagttgcgcagcctgaatggcgaatggcgcgacgcgccctgtagcggcgcattaagcgcggcgggtgtggtggttacgcgcagcgtgaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttcccttcctttctcgccacgttcgccggctttccccgtcaagctctaaatcgggggctccctttagggttccgatttagtgctttacggcacctcgaccccaaaaaacttgattagggtgatggttcacgtagtgggccatcgccctgatagacggtttttcgccctttgacgttggagtccacgttctttaatagtggactcttgttccaaactggaacaacactcaaccctatctcggtctattcttttgatttataagggattttgccgatttcggcctattggttaaaaaatgagctgatttaacaaaaatttaacgcgaattttaacaaaatattaacgtttacaatttcccaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgg
包含结合间皮素的抗原结合结构域和包含kir2dl3结构域的胞质结构域的kir-car的核酸序列提供于下文。本文所述的任何抗原结合结构域可以替代下文提供的间皮素抗原结合结构域。
ss1kir2dl3基因序列(seqidno:329)
gtgcacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaatttcacacaggaaacagctatgaccatgattacgccaagcgcgcaattaaccctcactaaagggaacaaaagctggagctgcaagcttaatgtagtcttatgcaatactcttgtagtcttgcaacatggtaacgatgagttagcaacatgccttacaaggagagaaaaagcaccgtgcatgccgattggtggaagtaaggtggtacgatcgtgccttattaggaaggcaacagacgggtctgacatggattggacgaaccactgaattgccgcattgcagagatattgtatttaagtgcctagctcgatacaataaacgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtggcgcccgaacagggacctgaaagcgaaagggaaaccagagctctctcgacgcaggactcggcttgctgaagcgcgcacggcaagaggcgaggggcggcgactggtgagtacgccaaaaattttgactagcggaggctagaaggagagagatgggtgcgagagcgtcagtattaagcgggggagaattagatcgcgatgggaaaaaattcggttaaggccagggggaaagaaaaaatataaattaaaacatatagtatgggcaagcagggagctagaacgattcgcagttaatcctggcctgttagaaacatcagaaggctgtagacaaatactgggacagctacaaccatcccttcagacaggatcagaagaacttagatcattatataatacagtagcaaccctctattgtgtgcatcaaaggatagagataaaagacaccaaggaagctttagacaagatagaggaagagcaaaacaaaagtaagaccaccgcacagcaagcggccgctgatcttcagacctggaggaggagatatgagggacaattggagaagtgaattatataaatataaagtagtaaaaattgaaccattaggagtagcacccaccaaggcaaagagaagagtggtgcagagagaaaaaagagcagtgggaataggagctttgttccttgggttcttgggagcagcaggaagcactatgggcgcagcctcaatgacgctgacggtacaggccagacaattattgtctggtatagtgcagcagcagaacaatttgctgagggctattgaggcgcaacagcatctgttgcaactcacagtctggggcatcaagcagctccaggcaagaatcctggctgtggaaagatacctaaaggatcaacagctcctggggatttggggttgctctggaaaactcatttgcaccactgctgtgccttggaatgctagttggagtaataaatctctggaacagattggaatcacacgacctggatggagtgggacagagaaattaacaattacacaagcttaatacactccttaattgaagaatcgcaaaaccagcaagaaaagaatgaacaagaattattggaattagataaatgggcaagtttgtggaattggtttaacataacaaattggctgtggtatataaaattattcataatgatagtaggaggcttggtaggtttaagaatagtttttgctgtactttctatagtgaatagagttaggcagggatattcaccattatcgtttcagacccacctcccaaccccgaggggacccgacaggcccgaaggaatagaagaagaaggtggagagagagacagagacagatccattcgattagtgaacggatctcgacggtatcgattagactgtagcccaggaatatggcagctagattgtacacatttagaaggaaaagttatcttggtagcagttcatgtagccagtggatatatagaagcagaagtaattccagcagagacagggcaagaaacagcatacttcctcttaaaattagcaggaagatggccagtaaaaacagtacatacagacaatggcagcaatttcaccagtactacagttaaggccgcctgttggtgggcggggatcaagcaggaatttggcattccctacaatccccaaagtcaaggagtaatagaatctatgaataaagaattaaagaaaattataggacaggtaagagatcaggctgaacatcttaagacagcagtacaaatggcagtattcatccacaattttaaaagaaaaggggggattggggggtacagtgcaggggaaagaatagtagacataatagcaacagacatacaaactaaagaattacaaaaacaaattacaaaaattcaaaattttcgggtttattacagggacagcagagatccagtttggctgcatacgcgtcgtgaggctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccgagaagttggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataagtgcagtagtcgccgtgaacgttctttttcgcaacgggtttgccgccagaacacaggtaagtgccgtgtgtggttcccgcgggcctggcctctttacgggttatggcccttgcgtgccttgaattacttccacctggctgcagtacgtgattcttgatcccgagcttcgggttggaagtgggtgggagagttcgaggccttgcgcttaaggagccccttcgcctcgtgcttgagttgaggcctggcctgggcgctggggccgccgcgtgcgaatctggtggcaccttcgcgcctgtctcgctgctttcgataagtctctagccatttaaaatttttgatgacctgctgcgacgctttttttctggcaagatagtcttgtaaatgcgggccaagatctgcacactggtatttcggtttttggggccgcgggcggcgacggggcccgtgcgtcccagcgcacatgttcggcgaggcggggcctgcgagcgcggccaccgagaatcggacgggggtagtctcaagctggccggcctgctctggtgcctggcctcgcgccgccgtgtatcgccccgccctgggcggcaaggctggcccggtcggcaccagttgcgtgagcggaaagatggccgcttcccggccctgctgcagggagctcaaaatggaggacgcggcgctcgggagagcgggcgggtgagtcacccacacaaaggaaaagggcctttccgtcctcagccgtcgcttcatgtgactccacggagtaccgggcgccgtccaggcacctcgattagttctcgtgcttttggagtacgtcgtctttaggttggggggaggggttttatgcgatggagtttccccacactgagtgggtggagactgaagttaggccagcttggcacttgatgtaattctccttggaatttgccctttttgagtttggatcttggttcattctcaagcctcagacagtggttcaaagtttttttcttccatttcaggtgtcgtgagctagaatggggggacttgaaccctgcagcaggctcctgctcctgcctctcctgctggctgtaagtggtctccgtcctgtccaggcccaggcccagagcgattgcagttgctctacggtgagcccgggcgtgctggcagggatcgtgatgggagacctggtgctgacagtgctcattgccctggccgtgtacttcctgggccggctggtccctcgggggcgaggggctgcggaggcagcgacccggaaacagcgtatcactgagaccgagtcgccttatcaggagctccagggtcagaggtcggatgtctacagcgacctcaacacacagaggccgtattacaaagtcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccgggatcccaggtacaactgcagcagtctgggcctgagctggagaagcctggcgcttcagtgaagatatcctgcaaggcttctggttactcattcactggctacaccatgaactgggtgaagcagagccatggaaagagccttgagtggattggacttattactccttacaatggtgcttctagctacaaccagaagttcaggggcaaggccacattaactgtagacaagtcatccagcacagcctacatggacctcctcagtctgacatctgaagactctgcagtctatttctgtgcaagggggggttacgacgggaggggttttgactactggggccaagggaccacggtcaccgtctcctcaggtggaggcggttcaggcggcggtggctctagcggtggtggatcggacatcgagctcactcagtctccagcaatcatgtctgcatctccaggggagaaggtcaccatgacctgcagtgccagctcaagtgtaagttacatgcactggtaccagcagaagtcaggcacctcccccaaaagatggatttatgacacatccaaactggcttctggagtcccaggtcgcttcagtggcagtgggtctggaaactcttactctctcacaatcagcagcgtggaggctgaagatgatgcaacttattactgccagcagtggagtaagcaccctctcacgtacggtgctgggacaaagttggaaatcaaagctagcggtggcggaggttctggaggtgggggttcccagggggcctggccacatgagggagtccacagaaaaccttccctcctggcccacccaggtcccctggtgaaatcagaagagacagtcatcctgcaatgttggtcagatgtcaggtttcagcacttccttctgcacagagaagggaagtttaaggacactttgcacctcattggagagcaccatgatggggtctccaaggccaacttctccatcggtcccatgatgcaagaccttgcagggacctacagatgctacggttctgttactcactccccctatcagttgtcagctcccagtgaccctctggacatcgtcatcacaggtctatatgagaaaccttctctctcagcccagccgggccccacggttctggcaggagagagcgtgaccttgtcctgcagctcccggagctcctatgacatgtaccatctatccagggagggggaggcccatgaacgtaggttctctgcagggcccaaggtcaacggaacattccaggccgactttcctctgggccctgccacccacggaggaacctacagatgcttcggctctttccgtgactctccatacgagtggtcaaactcgagtgacccactgcttgtttctgtcacaggaaacccttcaaatagttggctttcacccactgaaccaagctccgaaaccggtaaccccagacacctgcatgttctgattgggacctcagtggtcatcatcctcttcatcctcctcctcttctttctccttcatcgctggtgctgcaacaaaaaaaatgctgttgtaatggaccaagagcctgcagggaacagaacagtgaacagggaggactctgatgaacaagaccctcaggaggtgacatatgcacagttgaatcactgcgttttcacacagagaaaaatcactcacccttctcagaggcccaagacacccccaacagatatcatcgtgtacacggaacttccaaatgctgagccctgagtcgacaatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaagctgacgtcctttccatggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcctggaattcgagctcggtacctttaagaccaatgacttacaaggcagctgtagatcttagccactttttaaaagaaaaggggggactggaagggctaattcactcccaacgaagacaagatctgctttttgcttgtactgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtagtagttcatgtcatcttattattcagtatttataacttgcaaagaaatgaatatcagagagtgagaggaacttgtttattgcagcttataatggttacaaataaagcaatagcatcacaaatttcacaaataaagcatttttttcactgcattctagttgtggtttgtccaaactcatcaatgtatcttatcatgtctggctctagctatcccgcccctaactccgcccagttccgcccattctccgccccatggctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctacgcttttgcgtcgagacgtacccaattcgccctatagtgagtcgtattacgcgcgctcactggccgtcgttttacaacgtcgtgactgggaaaaccctggcgttacccaacttaatcgccttgcagcacatccccctttcgccagctggcgtaatagcgaagaggcccgcaccgatcgcccttcccaacagttgcgcagcctgaatggcgaatggcgcgacgcgccctgtagcggcgcattaagcgcggcgggtgtggtggttacgcgcagcgtgaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttcccttcctttctcgccacgttcgccggctttccccgtcaagctctaaatcgggggctccctttagggttccgatttagtgctttacggcacctcgaccccaaaaaacttgattagggtgatggttcacgtagtgggccatcgccctgatagacggtttttcgccctttgacgttggagtccacgttctttaatagtggactcttgttccaaactggaacaacactcaaccctatctcggtctattcttttgatttataagggattttgccgatttcggcctattggttaaaaaatgagctgatttaacaaaaatttaacgcgaattttaacaaaatattaacgtttacaatttcccaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgg
包含结合cd19的抗原结合结构域和包含kir2ds2结构域的胞质结构域的kir-car的核酸序列提供于下文。
cd19kir2ds2构建体序列(seqidno:330)
gtgcacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaatttcacacaggaaacagctatgaccatgattacgccaagcgcgcaattaaccctcactaaagggaacaaaagctggagctgcaagcttaatgtagtcttatgcaatactcttgtagtcttgcaacatggtaacgatgagttagcaacatgccttacaaggagagaaaaagcaccgtgcatgccgattggtggaagtaaggtggtacgatcgtgccttattaggaaggcaacagacgggtctgacatggattggacgaaccactgaattgccgcattgcagagatattgtatttaagtgcctagctcgatacaataaacgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtggcgcccgaacagggacctgaaagcgaaagggaaaccagagctctctcgacgcaggactcggcttgctgaagcgcgcacggcaagaggcgaggggcggcgactggtgagtacgccaaaaattttgactagcggaggctagaaggagagagatgggtgcgagagcgtcagtattaagcgggggagaattagatcgcgatgggaaaaaattcggttaaggccagggggaaagaaaaaatataaattaaaacatatagtatgggcaagcagggagctagaacgattcgcagttaatcctggcctgttagaaacatcagaaggctgtagacaaatactgggacagctacaaccatcccttcagacaggatcagaagaacttagatcattatataatacagtagcaaccctctattgtgtgcatcaaaggatagagataaaagacaccaaggaagctttagacaagatagaggaagagcaaaacaaaagtaagaccaccgcacagcaagcggccgctgatcttcagacctggaggaggagatatgagggacaattggagaagtgaattatataaatataaagtagtaaaaattgaaccattaggagtagcacccaccaaggcaaagagaagagtggtgcagagagaaaaaagagcagtgggaataggagctttgttccttgggttcttgggagcagcaggaagcactatgggcgcagcctcaatgacgctgacggtacaggccagacaattattgtctggtatagtgcagcagcagaacaatttgctgagggctattgaggcgcaacagcatctgttgcaactcacagtctggggcatcaagcagctccaggcaagaatcctggctgtggaaagatacctaaaggatcaacagctcctggggatttggggttgctctggaaaactcatttgcaccactgctgtgccttggaatgctagttggagtaataaatctctggaacagattggaatcacacgacctggatggagtgggacagagaaattaacaattacacaagcttaatacactccttaattgaagaatcgcaaaaccagcaagaaaagaatgaacaagaattattggaattagataaatgggcaagtttgtggaattggtttaacataacaaattggctgtggtatataaaattattcataatgatagtaggaggcttggtaggtttaagaatagtttttgctgtactttctatagtgaatagagttaggcagggatattcaccattatcgtttcagacccacctcccaaccccgaggggacccgacaggcccgaaggaatagaagaagaaggtggagagagagacagagacagatccattcgattagtgaacggatctcgacggtatcgattagactgtagcccaggaatatggcagctagattgtacacatttagaaggaaaagttatcttggtagcagttcatgtagccagtggatatatagaagcagaagtaattccagcagagacagggcaagaaacagcatacttcctcttaaaattagcaggaagatggccagtaaaaacagtacatacagacaatggcagcaatttcaccagtactacagttaaggccgcctgttggtgggcggggatcaagcaggaatttggcattccctacaatccccaaagtcaaggagtaatagaatctatgaataaagaattaaagaaaattataggacaggtaagagatcaggctgaacatcttaagacagcagtacaaatggcagtattcatccacaattttaaaagaaaaggggggattggggggtacagtgcaggggaaagaatagtagacataatagcaacagacatacaaactaaagaattacaaaaacaaattacaaaaattcaaaattttcgggtttattacagggacagcagagatccagtttggctgcatacgcgtcgtgaggctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccgagaagttggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataagtgcagtagtcgccgtgaacgttctttttcgcaacgggtttgccgccagaacacaggtaagtgccgtgtgtggttcccgcgggcctggcctctttacgggttatggcccttgcgtgccttgaattacttccacctggctgcagtacgtgattcttgatcccgagcttcgggttggaagtgggtgggagagttcgaggccttgcgcttaaggagccccttcgcctcgtgcttgagttgaggcctggcctgggcgctggggccgccgcgtgcgaatctggtggcaccttcgcgcctgtctcgctgctttcgataagtctctagccatttaaaatttttgatgacctgctgcgacgctttttttctggcaagatagtcttgtaaatgcgggccaagatctgcacactggtatttcggtttttggggccgcgggcggcgacggggcccgtgcgtcccagcgcacatgttcggcgaggcggggcctgcgagcgcggccaccgagaatcggacgggggtagtctcaagctggccggcctgctctggtgcctggcctcgcgccgccgtgtatcgccccgccctgggcggcaaggctggcccggtcggcaccagttgcgtgagcggaaagatggccgcttcccggccctgctgcagggagctcaaaatggaggacgcggcgctcgggagagcgggcgggtgagtcacccacacaaaggaaaagggcctttccgtcctcagccgtcgcttcatgtgactccacggagtaccgggcgccgtccaggcacctcgattagttctcgtgcttttggagtacgtcgtctttaggttggggggaggggttttatgcgatggagtttccccacactgagtgggtggagactgaagttaggccagcttggcacttgatgtaattctccttggaatttgccctttttgagtttggatcttggttcattctcaagcctcagacagtggttcaaagtttttttcttccatttcaggtgtcgtgagctagaatggggggacttgaaccctgcagcaggctcctgctcctgcctctcctgctggctgtaagtggtctccgtcctgtccaggcccaggcccagagcgattgcagttgctctacggtgagcccgggcgtgctggcagggatcgtgatgggagacctggtgctgacagtgctcattgccctggccgtgtacttcctgggccggctggtccctcgggggcgaggggctgcggaggcagcgacccggaaacagcgtatcactgagaccgagtcgccttatcaggagctccagggtcagaggtcggatgtctacagcgacctcaacacacagaggccgtattacaaagtcgagggcggcggagagggcagaggaagtcttctaacatgcggtgacgtggaggagaatcccggccctaggatggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccgggatccgacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaaccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtcccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggagcaagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcggaggggggactaagttggaaataacaggtggcggtggctcgggcggtggtgggtcgggtggcggcggatctgaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagcctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggattcgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccacatactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaagttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaacattattactacggtggtagctatgctatggactactggggtcaaggaacctcagtcaccgtctcctcagctagcacgcgtggtggcggaggttctggaggtgggggttcccagggggcctggccacatgagggagtccacagaaaaccttccctcctggcccacccaggtcccctggtgaaatcagaagagacagtcatcctgcaatgttggtcagatgtcaggtttgagcacttccttctgcacagagaggggaagtataaggacactttgcacctcattggagagcaccatgatggggtctccaaggccaacttctccatcggtcccatgatgcaagaccttgcagggacctacagatgctacggttctgttactcactccccctatcagttgtcagctcccagtgaccctctggacatcgtcatcacaggtctatatgagaaaccttctctctcagcccagccgggccccacggttttggcaggagagagcgtgaccttgtcctgcagctcccggagctcctatgacatgtaccatctatccagggagggggaggcccatgaacgtaggttctctgcagggcccaaggtcaacggaacattccaggccgactttcctctgggccctgccacccacggaggaacctacagatgcttcggctctttccgtgactctccctatgagtggtcaaactcgagtgacccactgcttgtttctgtcacaggaaacccttcaaatagttggccttcacccactgaaccaagctccaaaaccggtaaccccagacacctgcatgttctgattgggacctcagtggtcaaaatccctttcaccatcctcctcttctttctccttcatcgctggtgctccaacaaaaaaaatgctgctgtaatggaccaagagcctgcagggaacagaacagtgaacagcgaggattctgatgaacaagaccatcaggaggtgtcatacgcataagtcgacaatcaacctctggattacaaaatttgtgaaagattgactggtattcttaactatgttgctccttttacgctatgtggatacgctgctttaatgcctttgtatcatgctattgcttcccgtatggctttcattttctcctccttgtataaatcctggttgctgtctctttatgaggagttgtggcccgttgtcaggcaacgtggcgtggtgtgcactgtgtttgctgacgcaacccccactggttggggcattgccaccacctgtcagctcctttccgggactttcgctttccccctccctattgccacggcggaactcatcgccgcctgccttgcccgctgctggacaggggctcggctgttgggcactgacaattccgtggtgttgtcggggaagctgacgtcctttccatggctgctcgcctgtgttgccacctggattctgcgcgggacgtccttctgctacgtcccttcggccctcaatccagcggaccttccttcccgcggcctgctgccggctctgcggcctcttccgcgtcttcgccttcgccctcagacgagtcggatctccctttgggccgcctccccgcctggaattcgagctcggtacctttaagaccaatgacttacaaggcagctgtagatcttagccactttttaaaagaaaaggggggactggaagggctaattcactcccaacgaagacaagatctgctttttgcttgtactgggtctctctggttagaccagatctgagcctgggagctctctggctaactagggaacccactgcttaagcctcaataaagcttgccttgagtgcttcaagtagtgtgtgcccgtctgttgtgtgactctggtaactagagatccctcagacccttttagtcagtgtggaaaatctctagcagtagtagttcatgtcatcttattattcagtatttataacttgcaaagaaatgaatatcagagagtgagaggaacttgtttattgcagcttataatggttacaaataaagcaatagcatcacaaatttcacaaataaagcatttttttcactgcattctagttgtggtttgtccaaactcatcaatgtatcttatcatgtctggctctagctatcccgcccctaactccgcccagttccgcccattctccgccccatggctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctacgcttttgcgtcgagacgtacccaattcgccctatagtgagtcgtattacgcgcgctcactggccgtcgttttacaacgtcgtgactgggaaaaccctggcgttacccaacttaatcgccttgcagcacatccccctttcgccagctggcgtaatagcgaagaggcccgcaccgatcgcccttcccaacagttgcgcagcctgaatggcgaatggcgcgacgcgccctgtagcggcgcattaagcgcggcgggtgtggtggttacgcgcagcgtgaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttcccttcctttctcgccacgttcgccggctttccccgtcaagctctaaatcgggggctccctttagggttccgatttagtgctttacggcacctcgaccccaaaaaacttgattagggtgatggttcacgtagtgggccatcgccctgatagacggtttttcgccctttgacgttggagtccacgttctttaatagtggactcttgttccaaactggaacaacactcaaccctatctcggtctattcttttgatttataagggattttgccgatttcggcctattggttaaaaaatgagctgatttaacaaaaatttaacgcgaattttaacaaaatattaacgtttacaatttcccaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgg
包含结合cd19的抗原结合结构域和包含pd1结构域的胞质结构域的抑制性car的核酸序列提供于下文。
cd19-pd1嵌合car序列(seqidno:331)
tgatgcggtattttctccttacgcatctgtgcggtatttcacaccgcatatggtgcactctcagtacaatctgctctgatgccgcatagttaagccagccccgacacccgccaacacccgctgacgcgccctgacgggcttgtctgctcccggcatccgcttacagacaagctgtgaccgtctccgggagctgcatgtgtcagaggttttcaccgtcatcaccgaaacgcgcgagacgaaagggcctcgtgatacgcctatttttataggttaatgtcatgataataatggtttcttagacgtcaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattcaacatttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaaacgctggtgaaagtaaaagatgctgaagatcagttgggtgcacgagtgggttacatcgaactggatctcaacagcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatgagcacttttaaagttctgctatgtggcgcggtattatcccgtattgacgccgggcaagagcaactcggtcgccgcatacactattctcagaatgacttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaattatgcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaaggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggagctgaatgaagccataccaaacgacgagcgtgacaccacgatgcctgtagcaatggcaacaacgttgcgcaaactattaactggcgaactacttactctagcttcccggcaacaattaatagactggatggaggcggataaagttgcaggaccacttctgcgctcggcccttccggctggctggtttattgctgataaatctggagccggtgagcgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatctacacgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaagcattggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaatttaaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgttcttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgctgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcccaatacgcaaaccgcctctccccgcgcgttggccgattcattaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaattaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctcgtatgttgtgtggaattgtgagcggataacaatttcacacaggaaacagctatgaccatgattacgccaagctctaatacgactcactatagggagacaagcttgcatgcctgcaggtcgacatggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccggacatccagatgacacagactacatcctccctgtctgcctctctgggagacagagtcaccatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcagaaaccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtcccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctggagcaagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttcggaggggggactaagttggaaataacaggtggcggtggctcgggcggtggtgggtcgggtggcggcggatctgaggtgaaactgcaggagtcaggacctggcctggtggcgccctcacagagcctgtccgtcacatgcactgtctcaggggtctcattacccgactatggtgtaagctggattcgccagcctccacgaaagggtctggagtggctgggagtaatatggggtagtgaaaccacatactataattcagctctcaaatccagactgaccatcatcaaggacaactccaagagccaagttttcttaaaaatgaacagtctgcaaactgatgacacagccatttactactgtgccaaacattattactacggtggtagctatgctatggactactggggtcaaggaacctcagtcaccgtctcctcagctagcacgcgtggtggcggaggttctggaggtgggggttccaccctggtggttggtgtcgtgggcggcctgctgggcagcctggtgctgctagtctgggtcctggccgtcatctgctcccgggccgcacgagggacaataggagccaggcgcaccggccagcccctgaaggaggacccctcagccgtgcctgtgttctctgtggactatggggagctggatttccagtggcgagagaagaccccggagccccccgtgccctgtgtccctgagcagacggagtatgccaccattgtctttcctagcggaatgggcacctcatcccccgcccgcaggggctcagctgacggccctcggagtgcccagccactgaggcctgaggatggacactgctcttggcccctctgaggatccccgggtaccgagctcgaattcaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaactagtggcgcc
本发明还提供了包含本文所述的nkr-car例如kir-car的核酸分子和编码的氨基酸序列,并且还包含与nkr-car相互作用以便于信号转导以激活car表达细胞,例如以增加car表达细胞的增殖或细胞毒性活性的衔接分子。本文所述的任何抗原结合结构域可以替代下文提供的nkr-car构建体中的抗原结合结构域。
dap12的核酸序列如下:
atggggggacttgaaccctgcagcaggttcctgctcctgcctctcctgctggctgtaagtggtctccgtcctgtccaggtccaggcccagagcgattgcagttgctctacggtgagcccgggcgtgctggcagggatcgtgatgggagacctggtgctgacagtgctcattgccctggccgtgtacttcctgggccggctggtccctcgggggcgaggggctgcggaggcagcgacccggaaacagcgtatcactgagaccgagtcgccttatcaggagctccagggtcagaggtcggatgtctacagcgacctcaacacacagaggccgtattacaaatga
(seqidno:367)
dap12的氨基酸序列如下:
mgglepcsrflllplllavsglrpvqvqaqsdcscstvspgvlagivmgdlvltvliala
vyflgrlvprgrgaaeaatrkqritetespyqelqgqrsdvysdlntqrpyyk
(seqidno:368)
fcerg的核酸序列如下:
atgattccagcagtggtcttgctcttactccttttggttgaacaagcagcggccctgggagagcctcagctctgctatatcctggatgccatcctgtttctgtatggaattgtcctcaccctcctctactgccgactgaagatccaagtgcgaaaggcagctataaccagctatgagaaatcagatggtgtttacacgggcctgagcaccaggaaccaggagacttacgagactctgaagcatgagaaaccaccacagtag
(seqidno:369)
fcerg的氨基酸序列如下:
mipavvllllllveqaaalgepqlcyildailflygivltllycrlkiqvrkaaitsyek
sdgvytglstrnqetyetlkhekppq
(seqidno:370)
本文还提供了包含nkr-car和衔接分子的多链nkr-car的核酸序列。在这样的构建体中,nkr-car的核酸序列和衔接分子通过编码肽裂解位点(例如t2a)的核酸序列连接。这些核酸分子在切割前翻译为单链多肽,并且本文还提供了单链多肽的氨基酸序列。
包含结合间皮素的抗原结合结构域(例如ss1)和kirs2胞质结构域以及通过肽切割位点t2a连接的dap12衔接分子的nkr-car的核酸和氨基酸序列提供如下:
dap12-t2a-ss1-kirs2(seqidno:332)
1464bpdna
dap12-t2a-ss1-kirs2(seqidno:333)
488aa蛋白质
序列
包含结合间皮素的抗原结合结构域(例如ss1)和tnkp46胞质结构域以及通过肽切割位点t2a连接的fcεrγ衔接分子的nkr-car的核酸和氨基酸序列提供如下:
fcerg-t2a-ss1-tnkp46(seqidno:334)
1365bpdna
序列
fcerg-t2a-ss1-tnkp46(seqidno:335)
455aa蛋白质
序列
包含结合cd19的抗原结合结构域和kirs2胞质结构域以及通过肽切割位点t2a连接的dap1衔接分子的nkr-car的核酸和氨基酸序列提供如下:
dap12-t2a-cd19-kirs2(seqidno:336)
1470bpdna
序列
dap12-t2a-cd19-kirs2(seqidno:337)
489aa蛋白质
序列
在一个实施方案中,跨膜结构域是kir2ds2跨膜结构域。kir2ds2跨膜结构域的氨基酸序列如下:
vligtsvvkipftillffll(seqidno:357)
在一个实施方案中,跨膜结构域是kir2dl3跨膜结构域。kir2dl3跨膜结构域的氨基酸序列如下:
vligtsvviilfilllffll(seqidno:358)
在一个实施方案中,跨膜结构域是nkp46跨膜结构域。nkp46跨膜结构域的氨基酸序列如下:
llrmglaflvlvalvwflvedwls(seqidno:359)
在一个实施方案中,胞质结构域来源于kir2ds2,例如天然存在的kirs2ds2,如图29所示。kir2ds2衍生的胞质结构域(本文也称为kirs2结构域)的氨基酸序列如下:
hrwcsnkknaavmdqepagnrtvnsedsdeqdhqevsya(seqidno:360)
在一个实施方案中,胞质结构域来源于kir2dl3,例如天然存在的kir2dl3,如图30所示。kir2dl3来源的胞质结构域(本文也称为kirl3结构域)的氨基酸序列如下:
hrwccnkknavvmdqepagnrtvnredsdeqdpqevtyaqlnhcvftqrkithpsqrpktpptdiivytelpnaep(seqidno:361)
在一个实施方案中,胞质结构域来源于nkp46,例如天然存在的nkp46,如图31所示。nkp46衍生的胞质结构域(本文也称为tnkp46或tnkp46结构域)的氨基酸序列如下:
rkrtrerasrastwegrrrlntqtl(seqidno:362)
在一个实施方案中,跨膜和胞质结构域一起包含下面提供的氨基酸序列:
vligtsvvkipftillffllhrwcsnkknaavmdqepagnrtvnsedsdeqdhqevsya(seqidno:371)
本文还提供了包含结合间皮素的人抗原结合结构域的kir-car的核酸和氨基酸序列。例如,下文提供了包含前导序列,人间皮素-特异性抗原结合结构域m5和kirs2胞质结构域的kir-car的核酸序列。加下划线的序列表示m5scfv的序列,其可以容易地与本文所述的任何其它抗原结合结构域(例如人抗间皮素scfv)互换。
atggccttaccagtgaccgccttgctcctgccgctggccttgctgctccacgccgccaggccgggatcccaagtccaactcgttcaatcaggcgcagaagtcgaaaagcccggagcatcagtcaaagtctcttgcaaggcttccggctacaccttcacggactactacatgcactgggtgcgccaggctccaggccagggactggagtggatgggatggatcaacccgaattccgggggaactaactacgcccagaagtttcagggccgggtgactatgactcgcgatacctcgatctcgactgcgtacatggagctcagccgcctccggtcggacgataccgccgtgtactattgtgcgtcgggatgggacttcgactactgggggcagggcactctggtcactgtgtcaagcggaggaggtggatcaggtggaggtggaagcgggggaggaggttccggcggcggaggatcagatatcgtgatgacgcaatcgccttcctcgttgtccgcatccgtgggagacagggtgaccattacttgcagagcgtcccagtccattcggtactacctgtcgtggtaccagcagaagccggggaaagccccaaaactgcttatctatactgcctcgatcctccaaaacggcgtgccatcaagattcagcggttcgggcagcgggaccgactttaccctgactatcagcagcctgcagccggaagatttcgccacgtactactgcctgcaaacctacaccaccccggacttcggacctggaaccaaggtggagatcaaggctagcggtggcggaggttctggaggtgggggttcctcacccactgaaccaagctccaaaaccggtaaccccagacacctgcatgttctgattgggacctcagtggtcaaaatccctttcaccatcctcctcttctttctccttcatcgctggtgctccaacaaaaaaaatgctgctgtaatggaccaagagcctgcagggaacagaacagtgaacagcgaggattctgatgaacaagaccatcaggaggtgtcatacgcataa
(seqidno:363)
下文提供了包含前导序列,人间皮素特异性抗原结合结构域m5和kirs2胞质结构域的kir-car的氨基酸序列。加下划线的序列表示m5scfv的序列,其可以容易地与本文所述的任何其它抗原结合结构域(例如人抗间皮素scfv)互换。
malpvtalllplalllhaarpgsqvqlvqsgaevekpgasvkvsckasgytftdyymhwvrqapgqglewmgwinpnsggtnyaqkfqgrvtmtrdtsistaymelsrlrsddtavyycasgwdfdywgqgtlvtvssggggsggggsggggsggggsdivmtqspsslsasvgdrvtitcrasqsiryylswyqqkpgkapklliytasilqngvpsrfsgsgsgtdftltisslqpedfatyyclqtyttpdfgpgtkveikasggggsggggssptepssktgnprhlhvligtsvvkipftillffllhrwcsnkknaavmdqepagnrtvnsedsdeqdhqevsya
(seqidno:364)
在另一个实例中,下文提供了包含前导序列,人间皮素-特异性抗原结合结构域m5和kirs2胞质结构域并且还包含肽切割位点和衔接分子dap12序列的多链kir-car的核酸序列。加下划线的序列表示m5scfv的序列,其可以容易地与本文所述的任何其它抗原结合结构域(例如人抗间皮素scfv)互换。粗体序列表示dap12序列,而斜体序列表示肽切割位点t2a。
下文提供了包含前导序列,人间皮素-特异性抗原结合结构域m5和kirs2胞质结构域并且还包含肽切割位点和衔接分子dap12序列的多链kir-car的氨基酸序列。加下划线的序列表示m5scfv的序列,其可以容易地与本文所述的任何其它抗原结合结构域(例如人抗间皮素scfv)互换。粗体序列表示dap12序列,而斜体序列表示肽切割位点t2a。
胞质结构域
本文描述的car的胞质结构域,例如nkr-car或tcar,包括胞内信号传导结构域。胞内信号传导结构域能够激活已引入car的免疫效应细胞的至少一种正常效应子功能。
用于本发明的car的细胞内传导结构域的实例包括t细胞受体(tcr)的细胞质序列和协同作用以在抗原受体接合后启动信号转导的共同受体,以及这些序列的任何衍生物或变体和具有相同功能能力的任何重组序列。
已知通过tcr单独生成的信号不足以充分激活免疫效应细胞,例如t细胞或nk细胞,并且还需要次级和/或共刺激信号。因此,免疫效应细胞活化(例如,t细胞活化或nk细胞活化)可以说由两种不同类型的细胞质信号传导序列介导:通过tcr(一级胞内信号传导结构域)引发抗原依赖性主要激活的那些,以及以抗原非依赖性方式起作用以提供次级或共刺激信号的那些(次级胞质结构域,例如共刺激结构域)。
一级胞内信号传导结构域
在一些实施方案中,当胞外结构域(例如其融合的抗原结合结构域)结合同源抗原时,一级胞内信号传导结构域产生细胞内信号。它来源于主要的刺激分子,例如,其包含主要刺激分子的细胞内序列。它包括足够的主要刺激分子序列以产生细胞内信号,例如当其融合的抗原结合结构域结合同源抗原时。
主要的刺激分子是这样的分子,其在结合同源配体时介导免疫效应应答,例如在其表达的细胞中。通常,其产生依赖于与包含抗原的同源配体结合的细胞内信号。tcr/cd3复合体是示例性主要刺激分子;它在结合到同源配体时产生细胞内信号,例如加载有肽的mhc分子。通常,例如在tcr/cd3主要刺激分子的情况下,一级胞内信号传导结构域产生细胞内信号取决于主要刺激分子与抗原的结合。
主要刺激可以介导某些分子的改变的表达,例如tgf-β的下调和/或细胞骨架结构的重组等。刺激,例如在共刺激的情况下,可导致t细胞的免疫效应子功能的优化,例如增加。刺激,例如在t细胞的上下文中,可以介导t细胞应答,例如增殖,激活,分化等。
在一个实施方案中,一级胞内信号传导结构域包含信号基序,例如基于免疫受体酪氨酸的活化基序或itam。一级胞内信号传导结构域可以包含含有来自tcrζ(cd3ζ),fcrγ,fcrβ,cd3γ,cd3δ,cd3ε,cd5,cd22,cd79a,cd79b,cd278(也称为“icos”),fcεri,dap10,dap12和cd66d的胞质信号传导序列的itam。
示例性的含有itam的一级胞内信号传导结构域在表2中提供。
在一个实施方案中,一级胞内信号传导结构域包含修饰的itam结构域,例如与天然itam结构域相比,其具有改变(例如增加或减少的)活性的突变的itam结构域。在一个实施方案中,一级胞内信号传导结构域包含修饰的含itam的一级胞内信号传导结构域,例如优化和/或截短的含有itam的一级胞内信号传导结构域。在一个实施方案中,一级胞内信号传导结构域包含一个,两个,三个,四个或更多个itam基序。
一级胞内信号传导结构域包含主要刺激分子(例如cd3zeta-genbankacc号bag36664.1)的功能片段或类似物。它可以包含整个细胞内区域或细胞内区域的片段,当与其融合的抗原结合结构域或通过二聚化开关偶联的抗原结合结构域结合同源抗原时,所述整个细胞内区域或细胞内区域的片段足以产生细胞内信号。在实施方案中,一级胞内信号传导结构域与天然存在的主要刺激分子例如表2中公开的主要刺激分子(例如人类(genbankacc.no.bag36664.1)或其他哺乳动物,例如非人类物种,例如啮齿动物,猴,猿或鼠细胞内主要刺激分子)具有至少70,75,80,85,90,95,98或99%的序列同一性。在实施方案中,一级胞内信号传导结构域与seqidno:9或seqidno:10具有至少70,75,80,85,90,95,98或99%的序列同一性。
在实施方案中,一级胞内信号传导结构域与天然存在的人类主要刺激分子,例如本文公开的天然存在的人类主要刺激分子的相应残基具有至少70,75,80,85,90,95,96,97,98或99%同一性,或相差不超过30,25,20,15,10,5,4,3,2,或1个氨基酸残基。
tcar的胞内信号传导结构域本身可以包含一级胞内信号传导结构域,例如cd3-ζ信号传导结构域,或者可以与在tcar背景中有用的任何其它所需的胞内信号传导结构域组合。例如,tcar的胞内信号传导结构域可以包含一级胞内信号传导结构域,例如cd3ζ链部分和一个或多个共刺激信号传导结构域。以下提供共刺激信号传导结构域的例子。
共刺激信号传导结构域
在一个实施方案中,当胞外结构域例如与其融合的抗原结合结构域或通过二聚化开关偶联的抗原结合结构域结合同源配体时,共刺激信号传导结构域产生细胞内信号。它来源于共刺激分子。它包括足够的主要共刺激分子序列以产生细胞内信号,例如当胞外结构域例如与其融合的抗原结合结构域或通过二聚化开关偶联的抗原结合结构域结合同源配体时。
共刺激分子是促进免疫效应反应的除抗原受体或其反配体之外的细胞表面分子。在某些情况下,它们需要有效或增强的免疫应答。通常,共刺激分子产生细胞内信号,在实施方案中,所述信号依赖于与不同于抗原(例如由t细胞的抗原结合结构域识别的抗原)的同源配体的结合。通常,来自主要刺激分子和共刺激分子的信号传导有助于免疫效应应答,并且在一些情况下,两者都是有效或增强的免疫效应应答产生所需的。
共刺激信号传导结构域包含共刺激分子(例如4-1bb,cd28,cd27和icos)的功能片段或类似物。它可以包含足以产生细胞内信号的共刺激分子的整个细胞内区域或细胞内区域的片段,例如,当其融合的抗原结合结构域或通过二聚化开关偶联的抗原结合结构域结合同源抗原时。在实施方案中,共刺激信号传导结构域与本文所述的天然存在的共刺激分子(例如人或其他哺乳动物,例如非人类物种,例如啮齿动物,猴,猿或鼠的细胞内共刺激分子)具有至少70,75,80,85,90,95,98或99%的序列同一性。在实施方案中,共刺激结构域与seqidno:7,seqidno:8,seqidno:36,或seqidno:38具有至少70,75,80,85,90,95,98或99%的序列同一性。
表3中提供了示范性共刺激信号传导结构域(细胞内信号传导转导结构域)。
在实施方案中,共刺激信号传导结构域与天然存在的人类主要刺激分子,例如本文公开的天然存在的人共刺激分子(例如表3中提供)的相应残基具有至少70,75,80,85,90,95,96,97,98,或99%的同一性,或者不超过30,25,20,15,10,5,4,3,2,或1个氨基酸残基。
tcar胞质结构域内的细胞内信号传导序列可以以随机或指定的顺序相互连接。任选地,短的寡聚或多肽接头,例如长度在2至10个氨基酸(例如,2,3,4,5,6,7,8,9或10个氨基酸)之间的接头可以在细胞内信号传导序列之间形成连接。在一个实施方案中,甘氨酸-丝氨酸双联体可用作合适的接头。在一个实施方案中,单个氨基酸,例如丙氨酸,甘氨酸可用作合适的接头。
在一个方面,胞内信号传导结构域被设计为包含两个或多个,例如2,3,4,5或更多个共刺激信号传导结构域。在一个实施方案中,两个或多个,例如2,3,4,5或更多个共刺激信号传导结构域通过接头分子例如本文所述的接头分子分离。在一个实施方案中,胞内信号传导结构域包含两个共刺激信号传导结构域。在一些实施方案中,接头分子是甘氨酸残基。在一些实施方案中,接头是丙氨酸残基。
在一个方面,胞内信号传导结构域被设计为包含cd3-ζ的信号传导结构域和4-1bb的信号传导结构域。一方面,4-1bb的信号传导结构域是包含seqidno:7的氨基酸序列的信号传导结构域。一方面,4-1bb的信号传导结构域由seqidno:18的核酸序列编码。一方面,cd3-ζ的信号传导结构域是包含seqidno:9(突变体cd3-ζ)或seqidno:10(野生型人cd3-ζ)的氨基酸序列的信号传导结构域。
一方面,胞内信号传导结构域被设计为包含cd3-ζ的信号传导结构域和cd27的信号传导结构域。一方面,cd27的信号传导结构域包含seqidno:8的氨基酸序列。一方面,cd27的信号传导结构域由seqidno:19的核酸序列编码。一方面,cd3-ζ的信号传导结构域是包含seqidno:9(突变体cd3-ζ)或seqidno:10(野生型人cd3-ζ)的氨基酸序列的信号传导结构域。
在一个方面,胞内信号传导结构域被设计为包含cd3-ζ的信号传导结构域和cd28的信号传导结构域。一方面,cd28的信号传导结构域包含seqidno:36的氨基酸序列。一方面,cd28的信号传导结构域由seqidno:37的核酸序列编码。在一个方面,cd3-ζ的信号传导结构域是包含seqidno:9(突变体cd3-ζ)或seqidno:10(野生型人cd3-ζ)的氨基酸序列的信号传导结构域。
在一个方面,胞内信号传导结构域被设计为包含cd3-ζ的信号传导结构域和icos的信号传导结构域。一方面,icos的信号传导结构域包含seqidno:38的氨基酸序列。一方面,icos的信号传导结构域由seqidno:39的核酸序列编码。一方面,cd3-ζ的信号传导结构域是包含seqidno:9(突变体cd3-ζ)或seqidno:10(野生型人cd3-ζ)的氨基酸序列的信号传导结构域。
跨膜结构域
关于跨膜结构域,在各种实施方案中,可以将car设计成包含附着于car的胞外结构域的跨膜结构域。如前所述,本文描述的nkr-car的跨膜结构域可以是nkr的跨膜结构域,例如kir跨膜结构域,ncr跨膜结构域,slamf跨膜结构域,fcr跨膜结构域,例如cd16跨膜结构域或cd64跨膜结构域或ly49跨膜结构域。或者,本文所述的nkr-car或tcar的跨膜结构域可以是以下所述的跨膜结构域中的任一种。
跨膜结构域可以来源于天然或重组来源。如果来源是天然的,则该结构域可以来源于任何膜结合或跨膜蛋白。在一个方面,每当car结合到靶标上时,跨膜结构域能够向胞内结构域发信号。本发明中特别有用的跨膜结构域可至少包括例如t细胞受体的α,β或ζ链,cd28,cd3ε,cd45,cd4,cd5,cd8(例如,cd8α,cd8β),cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137,cd154的跨膜区。在一些实施方案中,跨膜结构域可以至少包括例如kirds2,ox40,cd2,cd27,lfa-1(cd11a,cd18),icos(cd278),4-1bb(cd137),gitr,cd40,baffr,hvem(lightr),slamf7,nkp80(klrf1),nkp44,nkp30,nkp46,cd160,cd19,il2rβ,il2rγ,il7rα,itga1,vla1,cd49a,itga4,ia4,cd49d,itga6,vla-6,cd49f,itgad,cd11d,itgae,cd103,itgal,cd11a,lfa-1,itgam,cd11b,itgax,cd11c,itgb1,cd29,itgb2,cd18,lfa-1,itgb7,tnfr2,dnam1(cd226),slamf4(cd244,2b4),cd84,cd96(tactile),ceacam1,crtam,ly9(cd229),cd160(by55),psgl1,cd100(sema4d),slamf6(ntb-a,ly108),slam(slamf1,cd150,ipo-3),blame(slamf8),selplg(cd162),ltbr,pag/cbp,nkg2d,nkg2c,和cd19的跨膜区。
跨膜结构域可以包括与跨膜区相邻的一个或多个另外的氨基酸,例如与衍生跨膜的蛋白质的细胞外区域相关的一个或多个氨基酸(例如,1,2,3,4,5,6,7,8,9,10至多达15个氨基酸的细胞外区)和/或一个或多个与衍生跨膜蛋白的蛋白质的细胞内区域相关的另外的氨基酸(例如,1,2,3,4,5,6,7,8,9,10至多15个氨基酸的细胞内区域)。在一个方面,跨膜结构域是与使用car的其它结构域之一相关联的跨膜结构域。在一些情况下,跨膜结构域可以通过氨基酸取代来选择或修饰,以避免这些结构域与相同或不同表面膜蛋白的跨膜结构域的结合,例如使与受体复合体的其它成员的相互作用最小化。在一个方面,跨膜结构域能够与car表达细胞例如cart细胞表面上的另一car同源二聚化。在不同的方面,可以修饰或取代跨膜结构域的氨基酸序列,以便使与存在于相同car表达细胞例如cart细胞中的天然结合配偶体的结合结构域的相互作用最小化。
在一些情况下,跨膜结构域可以通过铰链(例如来自人类蛋白质的铰链)连接到car的细胞外区域,例如car的抗原结合结构域。例如,在一个实施方案中,铰链可以是人ig(免疫球蛋白)铰链,例如igg4铰链或cd8a铰链。在一个实施方案中,铰链或间隔区包含seqidno:2的氨基酸序列(例如由seqidno:2的氨基酸序列组成)。一方面,跨膜结构域包含seqidno:6的跨膜结构域(例如由seqidno:6的跨膜结构域组成)。
一方面,铰链或间隔区包含igg4铰链。例如,在一个实施方案中,铰链或间隔区包含氨基酸序列seqidno:3的铰链。在一些实施方案中,铰链或间隔区包含由seqidno:14的核苷酸序列编码的铰链。
在一个方面,铰链或间隔区包含igd铰链。例如,在一个实施方案中,铰链或间隔区包含氨基酸序列seqidno:4的铰链。在一些实施方案中,铰链或间隔区包含由seqidno:15的核苷酸序列编码的铰链。
在一个方面,跨膜结构域可以是重组的,在这种情况下,它将主要包含疏水残基,如亮氨酸和缬氨酸。在一个方面,可以在重组跨膜结构域的每个末端发现苯丙氨酸,色氨酸和缬氨酸的三联体。
任选地,长度为2至10个氨基酸的短的寡肽或多肽接头可以在car的跨膜结构域和细胞质区域之间形成连接。甘氨酸-丝氨酸双联体提供了特别合适的接头。例如,一方面,接头包含seqidno:5的氨基酸序列。在一些实施方案中,接头由核苷酸序列seqidno:16编码。
在一个方面,铰链或间隔区包含kir2ds2铰链。
嵌合tcr
在一个方面,本文所述的抗原结合结构域,例如本文所述的抗体或抗体片段(例如如表4中所提供的)可以接枝到t细胞受体(“tcr”)链的一个或多个恒定结构域,例如tcrα或tcrβ链,以产生特异性结合所需肿瘤抗原的嵌合tcr。不受理论的束缚,相信嵌合tcr将在抗原结合时通过tcr复合体发出信号。这样的嵌合tcr可以通过本领域已知的方法产生(例如,willemsenraetal,genetherapy2000;7:1369–1377;zhangtetal,cancergenether2004;11:487–496;aggenetal,genether.2012apr;19(4):365-74)。
在一个实施方案中,本文所述的nkr-car表达细胞,例如本文所述的表达kir-car的细胞还包含嵌合tcr。在备选实施方案中,本文所述的nkr-car表达细胞与表达嵌合tcr的细胞组合施用。在这样的实施方案中,嵌合tcr的抗原结合结构域可以结合与本文所述的nkr-car,例如kir-car相同的肿瘤抗原,或可以结合与本文所述的nkr-car,例如kir-car不同的肿瘤抗原。
分裂car
在一些实施方案中,car表达细胞使用分裂car。分裂car方法在出版物wo2014/055442和wo2014/055657中有更详细的描述,其通过引用并入本文。简而言之,分裂car系统包括表达具有第一抗原结合结构域和共刺激结构域(例如4-1bb)的第一car的细胞,并且该细胞还表达具有第二抗原结合结构域和胞内信号传导结构域(例如,cd3ζ)的第二car。当细胞遇到第一抗原时,共刺激结构域被激活,并且细胞增殖。当细胞遇到第二抗原时,胞内信号传导结构域被激活,细胞杀伤活性开始。因此,car表达细胞仅在两种抗原存在下完全活化。在实施方案中,第一抗原结合结构域识别本文所述的肿瘤抗原,并且第二抗原结合结构域识别本文所述的不同肿瘤抗原。
调节嵌合抗原受体的策略
有多种方式可以调节car活性。在一些实施方案中,可以控制car活性的可调节car是期望的,以优化car疗法的安全性和功效。例如,使用例如与二聚化结构域融合的胱天蛋白酶诱导细胞凋亡(参见例如,dietal.,nengl.j.med.2011nov.3;365(18):1673-1683),可以在本发明的car疗法中用作安全开关。在另一个实例中,car表达细胞还可以表达诱导型胱天蛋白酶-9(icaspase-9)分子,其在施用二聚体药物(例如,rimiducid(也称为ap1903(bellicumpharmaceuticals)或ap20187(ariad))时导致胱天蛋白酶-9的激活和细胞凋亡。icaspase-9分子含有在cid存在下介导二聚化的二聚化(cid)结合结构域的化学诱导剂。这导致car表达细胞的可诱导和选择性消耗。在一些情况下,icaspase-9分子由与car编码载体分开的核酸分子编码,在一些情况下,icaspase-9分子由与car编码载体相同的核酸分子编码。icaspase-9可以提供安全开关,以避免car表达细胞的任何毒性。参见例如songetal.cancergenether.2008;15(10):667-75;clinicaltrialid.no.nct02107963;和distasietal.n.engl.j.med.2011;365:1673-83。
用于调节本发明的car疗法的备选策略包括利用失活或关闭car活化的小分子或抗体,例如,通过缺失car表达细胞,例如通过诱导抗体依赖性细胞介导的细胞毒性(adcc)。例如,本文所述的car表达细胞还可以表达由能够诱导细胞死亡,例如adcc或补体诱导的细胞死亡的分子识别的抗原。例如,本文所述的car表达细胞也可以表达能够被抗体或抗体片段靶向的受体。这些受体的实例包括epcam,vegfr,整联蛋白(例如整联蛋白αvβ3,α4,αι3/4β3,α4β7,α5β1,ανβ3,αν),tnf受体超家族成员(例如trail-r1,trail-r2),pdgf受体,干扰素受体,叶酸受体,gpnmb,icam-1,hla-dr,cea,ca-125,muc1,tag-72,il-6受体,5t4,gd2,gd3,cd2,cd3,cd4,cd5,cd11,cd11a/lfa-1,cd15,cd18/itgb2,cd19,cd20,cd22,cd23/lge受体,cd25,cd28,cd30,cd33,cd38,cd40,cd41,cd44,cd51,cd52,cd62l,cd74,cd80,cd125,cd147/basigin,cd152/ctla-4,cd154/cd40l,cd195/ccr5,cd319/slamf7,和egfr及其截短形式(例如,保留一个或多个细胞外表位但缺少胞质结构域内一个或多个区域的形式)。
例如,本文所述的car表达细胞还可以表达截短的表皮生长因子受体(egfr),其缺少信号传导能力,但保留由能够诱导adcc的分子(例如西妥昔单抗
在其它实施方案中,本文所述的car表达细胞还可以表达由t细胞消耗剂识别的靶蛋白。在一个实施方案中,靶蛋白是cd20,t细胞消耗剂是抗cd20抗体,例如利妥昔单抗。在这样的实施方案中,一旦需要减少或消除car表达细胞,例如减轻car诱导的毒性,则施用t细胞消耗剂。在其它实施方案中,t细胞消耗剂是如本文实施例中所述的抗cd52抗体,例如阿仑珠单抗。
在其它实施方案中,可调节car(rcar)包含一组多肽,在最简单的实施方案中通常为两个,其中本文所述的标准car的组分,例如抗原结合结构域和胞内信号传导结构域分配在分开的多肽或成员上。在一些实施方案中,该组多肽包括二聚化开关,其在二聚化分子的存在下可将多肽彼此偶联,例如可将抗原结合结构域偶联至胞内信号传导结构域。本文和国际公开号wo2015/090229(其全部内容通过引用并入本文)中提供了这种可调节car的附加说明和示例性构造。
在一个方面,rcar包括两个多肽或成员∶1)胞内信号传导成员,包括胞内信号传导结构域,例如本文所述一级胞内信号传导结构域和第一开关结构域;2)抗原结合成员,其包含例如特异性结合本文所述的肿瘤抗原的抗原结合结构域,和第二开关结构域。任选地,rcar包含本文所述的跨膜结构域。在一个实施方案中,跨膜结构域可以被设置在胞内信号传导成员上、抗原结合成员上或两者上。(除非另有说明,否则当本文描述rcar的成员或元件时,顺序可以如所提供的那样,但是也包括其它顺序。换句话说,在一个实施方案中,顺序为如本文列出的那样,但是在其它实施方案中,顺序可以是不同的。例如,跨膜区域一侧上的成员顺序可以与实例不同,例如,开关结构域相对于胞内信号传导结构域的布置可以不同,例如是颠倒的)。
在一个实施方案中,第一和第二开关结构域可以形成胞内或胞外二聚化开关。在一个实施方案中,二聚化开关可以是同型二聚化开关,例如其中第一和第二开关结构域相同,或异源二聚化开关,例如其中第一和第二开关结构域彼此不同。
在实施方案中,rcar可以包含“多重开关”。多重开关可以包括异源二聚化开关结构域或同型二聚化开关结构域。多重开关在第一成员例如抗原结合成员和第二成员例如胞内信号传导成员上独立地包括多个开关结构域,例如2、3、4、5、6、7、8、9或10个。在一个实施方案中,第一成员可以包括多个第一开关结构域,例如基于fkbp的开关结构域,并且第二成员可以包括多个第二开关结构域,例如基于frb的开关结构域。在一个实施方案中,第一成员可以包括第一和第二开关结构域,例如基于fkbp的开关结构域和基于frb的开关结构域,并且第二成员可以包括第一和第二开关结构域,例如基于fkbp的开关结构域和基于frb的开关结构域。
在一个实施方案中,胞内信号传导成员包括一个或更多个胞内信号传导结构域,例如一级胞内信号传导结构域和一个或更多个共刺激信号传导结构域。
在一个实施方案中,抗原结合成员可以包括一个或更多个胞内信号传导结构域,例如一个或更多个共刺激信号传导结构域。在一个实施方案中,抗原结合成员包括多个,例如2个或3个本文所述共刺激信号传导结构域,例如选自4-1bb、cd28、cd27、icos和ox40,且在实施方案中,没有一级胞内信号传导结构域。在一个实施方案中,抗原结合成员从胞外至胞内方向包括下述共刺激信号传导结构域:4-1bb-cd27;4-1bb-cd27;cd27-4-1bb;4-1bb-cd28;cd28-4-1bb;ox40-cd28;cd28-ox40;cd28-4-1bb;或4-1bb-cd28。在这样的实施方案中,胞内结合成员包含cd3ζ结构域。在一个这样的实施方案中,rcar包括(1)抗原结合成员,包括例如抗原结合结构域、跨膜结构域和两个共刺激结构域和第一开关结构域;和(2)胞内信号传导结构域,包括跨膜结构域或膜系链结构域和至少一个一级胞内信号传导结构域及第二开关结构域。
一个实施方案提供rcar,其中抗原结合成员没有系链至car细胞的表面。这允许具有胞内信号传导成员的细胞方便地与一个或更多个抗原结合结构域配对,而不用编码该抗原结合成员的序列转化该细胞。在这样的实施方案中,rcar包含:1)胞内信号传导成员,包括:第一开关结构域、跨膜结构域、胞内信号传导结构域,例如一级胞内信号传导结构域和第一开关结构域;和2)抗原结合成员,包括:例如抗原结合结构域,和第二开关结构域,其中所述抗原结合成员不包括跨膜结构域或膜系链结构域,且任选地不包括胞内信号传导结构域。在某些实施方案中,rcar可以进一步包括3)第二抗原结合成员,包括;例如与不同于抗原结合结构域所结合的抗原结合的第二抗原结合结构域;和第二开关结构域。
本文还提供rcar,其中所述抗原结合成员包含双特异性活化和靶向能力。在该实施方案中,抗原结合成员可以包括多个,例如2、3、4、或5个抗原结合结构域,例如scfvs,其中每个抗原结合结构域与靶抗原(例如不同抗原或相同抗原,例如相同抗原上的相同或不同的表位)结合。在一个实施方案中,多个抗原结合结构域串联,任选地是设置在每个抗原结合结构域之间的接头或铰链区。本文中描述了合适的接头和铰链区。
一个实施方案提供具有允许开关增殖的构型的rcar。在该实施方案中,rcar包括∶1)胞内信号传导成员,其包含∶任选的跨膜结构域或膜系链结构域;一个或更多个共刺激信号传导结构域,例如选自4-1bb、cd28、cd27、icos和ox40,和开关结构域;和2)抗原结合成员,其包含:抗原结合结构域,跨膜结构域和一级胞内信号传导结构域,例如cd3ζ结构域,其中所述抗原结合成员不包括开关结构域,或者不包括与胞内信号传导成员上的开关结构域二聚化的开关结构域。在一个实施方案中,抗原结合成员不包括共刺激信号传导结构域。在一个实施方案中,胞内信号传导成员包括来自同型二聚化开关的开关结构域。在一个实施方案中,胞内信号传导成员包括异源二聚化开关的第一开关结构域,并且rcar包括第二胞内信号传导成员,该成员包括异源二聚化开关的第二开关结构域。在这样的实施方案中,第二胞内信号传导成员包括与胞内信号传导成员相同的胞内信号传导结构域。在一个实施方案中,二聚化开关为胞内的。在一个实施方案中,二聚化开关为胞外的。
在本文所述的任一个rcar构型中,第一和第二开关结构域包含如本文所述的基于fkbp-frb的开关。
本文还提供包括本文所述的rcar的细胞。被工程化以表达rcar的任何细胞都可以被用作rcarx细胞。在一个实施方案中,rcarx细胞为t细胞,且被称为rcart细胞。在一个实施方案中,rcarx细胞为nk细胞,且被称为rcarn细胞。
本文还提供包含编码rcar序列的核酸和载体。可以把编码多种rcar元件的序列配置在相同核酸分子上,例如相同质粒或载体,例如病毒载体,例如慢病毒载体。在一个实施方案中,(i)编码抗原结合成员的序列和(ii)编码胞内信号传导成员的序列可以存在于相同核酸例如载体上。可以通过使用单独的启动子或通过使用双顺反子转录产品(其可以通过切割单个翻译产物或翻译两个不同的蛋白产物导致产生两个蛋白质)来实现相应蛋白质的产生。在一个实施方案中,把编码可切割肽的序列例如p2a或f2a序列设置在(i)和(ii)之间。在一个实施方案中,把编码ires(例如emcv或ev71ires)的序列设置在(i)和(ii)之间。在这些实施方案中,(i)和(ii)作为单rna被转录。在一个实施方案中,使第一启动子与(i)有效连接,且使第二启动子与(ii)有效连接,使得(i)和(ii)作为分开的mrna被转录。
备选地,可以把编码rcar的多种元件的序列设置在不同的核酸分子上,例如不同的质粒或载体,例如病毒载体,例如慢病毒载体。例如,(i)编码抗原结合成员的序列可以存在于第一核酸例如第一载体上,和(ii)编码胞内信号传导成员的序列可以存在于第二核酸例如第二载体上。
二聚化开关
二聚化开关可以是非共价的或共价的。在一个非共价的二聚化开关中,二聚化分子促进开关结构域之间的非共价相互作用。在共价的二聚化开关中,二聚化分子促进开关结构域之间的共价相互作用。
在一个实施方案中,rcar包含基于fkbp/frap或fkbp/frb的二聚化开关。fkbp12(fkbp或fk506结合蛋白)是充当天然产物免疫抑制药物雷帕霉素的初始细胞内靶的丰富的细胞质蛋白。雷帕霉素结合fkbp和所述大的pi3k同源物frap(raft,mtor)。frb为frap的93个氨基酸的部分,其足以结合fkbp-雷帕霉素复合体(chen,j.,zheng,x.f.,brown,e.j.&schreiber,s.l.(1995)identificationofan11-kdafkbp12-rapamycin-bindingdomainwithinthe289-kdafkbp12-rapamycin-associatedproteinandcharacterizationofacriticalserineresidue.procnatlacadsciusa92:4947-51.)。
在实施方案中,基于fkbp/frap,例如fkbp/frb的开关可以使用二聚化分子,例如雷帕霉素或雷帕霉素类似物。
fkbp的氨基酸序列如下∶
dvpdyaslggpsspkkkrkvsrgvqvetispgdgrtfpkrgqtcvvhytgmledgkkfdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellkletsy(seqidno:43)
在实施方案中,fkbp开关结构域可以包含fkbp的片段,其在雷帕霉素或雷帕系物存在性具有结合frb或其片段或类似物的能力,例如,seqidno:43的加下划线的部分,其是:
vqvetispgdgrtfpkrgqtcvvhytgmledgkkfdssrdrnkpfkfmlgkqevirgweegvaqmsvgqrakltispdyaygatghpgiipphatlvfdvellklets(seqidno:44)
fkbp的氨基酸序列如下∶
ilwhemwhegleeasrlyfgernvkgmfevleplhammergpqtlketsfnqaygrdlmeaqewcrkymksgnvkdltqawdlyyhvfrrisk(seqidno:45)
在本文中使用的术语“基于fkbp/frap,例如,基于fkbp/frb的开关”是指一种二聚化开关,包括:第一开关结构域和第二开关结构域,第一开关结构域包含fkbp片段或其类似物,具有在雷帕霉素或雷帕系物例如,rad001存在下与frb或其片段或类似物结合的能力,并且与seqidno:54或55的fkbp序列具有至少70,75,80,85,90,95,96,97,98,或99%的同一性,或相差不超过30,25,20,15,10,5,4,3,2,或1个氨基酸残基;第二开关结构域包含frb片段或其类似物,具有在雷帕霉素或雷帕系物存在下与frb或其片段或类似物结合的能力,并且与seqidno:45的frb序列具有至少70,75,80,85,90,95,96,97,98,或99%的同一性,或相差不超过30,25,20,15,10,5,4,3,2,或1个氨基酸残基。在一个实施方案中,本文所述的rcar包含含有seqidno:43所公开的氨基酸残基(或seqidno:44)的一个开关结构域,以及含有seqidno:45所公开的氨基酸残基的一个开关结构域。
在实施方案中,fkbp/frb二聚化开关包括修饰的frb开关结构域,其显示出在基于frb的开关结构域,例如,修饰的frb开关结构域,基于fkbp的开关结构域和二聚化分子,例如,雷帕霉素或雷帕系物,例如rad001之间改变的,例如,增强的复合体形成。在一个实施方案中,修饰的frb开关结构域包含一个或更多个突变,例如2、3、4、5、6、7、8、9或10个以上选自在氨基酸位置l2031、e2032、s2035、r2036、f2039、g2040、t2098、w2101、d2102、y2105和f2108的突变,其中所述野生型氨基酸突变成任何其它天然存在的氨基酸。在一个实施方案中,突变体frb包括在e2032的突变,其中e2032突变成苯丙氨酸(e2032f)、甲硫氨酸(e2032m)、精氨酸(e2032r)、缬氨酸(e2032v)、酪氨酸(e2032y)、异亮氨酸(e2032i),例如seqidno:46或亮氨酸(e2032l),例如seqidno:47。在一个实施方案中,突变体frb包括在t2098处的突变,其中t2098突变成苯丙氨酸(t2098f)或亮氨酸(t2098l),例如seqidno:48。在一个实施方案中,突变体frb包括在e2032和t2098处的突变,其中e2032突变成任何氨基酸,且其中t2098突变成任何氨基酸,例如seqidno:49。在一个实施方案中,突变体frb包括e2032i和t2098l突变,例如seqidno:50。在一个实施方案中,突变体frb包括e2032l和t2098l突变,例如seqidno:51。
表6.具有对于二聚化分子增加的亲和力的示例性的突变体frb
其它合适的二聚化开关包括基于gyrb-gyrb的二聚化开关、基于赤霉素的二聚化开关、标记/结合剂二聚化开关和卤代-标记/snap-标记二聚化开关。按照本文提供的指导,这样的开关和相关二聚化分子对本领域技术人员将是显而易见的。
二聚化分子
二聚化分子促进开关结构域之间的缔合。在二聚化分子相互作用或开关结构域之间的缔合的存在下,允许与第一开关结构域缔合的(例如融合的)多肽和与第二开关结构域缔合的(例如融合的)多肽之间的信号转导。例如,如在本文所述系统中测量的那样,在非限制水平的二聚化分子的存在下,信号转导增加1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2、5、10、50、100倍。
雷帕霉素和雷帕霉素类似物(有时称为雷帕系物)例如rad001可用作本文所述基于fkbp/frb二聚化开关中的二聚化分子。在一个实施方案中,二聚化分子可以选自雷帕霉素(西罗莫司)、rad001(依维莫司)、zotarolimus、坦罗莫司、ap-23573(雷达罗莫司)、biolimus和ap21967。适用于基于fkbp/frb二聚化开关的另一种雷帕霉素类似物被进一步描述在名称为“组合疗法”的部分中或名称为“与低剂量mtor抑制剂组合”的子部分中。
car与趋化因子受体的共同表达
在实施方案中,本文所述的car表达细胞,例如nkr-car表达细胞,例如表达kir-car的细胞进一步包含趋化因子受体分子。趋化因子受体ccr2b或cxcr2在t细胞中的转基因表达增强了对分泌ccl2-或cxcl1的实体瘤(包括黑素瘤和神经母细胞瘤)的运输(craddocketal.,jimmunother.2010oct;33(8):780-8和kershawetal.,humgenether.2002nov1;13(16):1971-80)。因此,不希望受理论束缚,认为在car表达细胞中表达的识别由肿瘤例如实体瘤分泌的趋化因子的趋化因子受体,可以改善car表达细胞归巢到肿瘤中,促进car表达细胞浸润到肿瘤,并增强car表达细胞的抗肿瘤功效。趋化因子受体分子可以包含天然存在的或重组的趋化因子受体或其趋化因子结合片段。适于在本文所述的car表达细胞中表达的趋化因子受体分子包括cxc趋化因子受体(例如cxcr1,cxcr2,cxcr3,cxcr4,cxcr5,cxcr6,或cxcr7),cc趋化因子受体(例如ccr1,ccr2,ccr3,ccr4,ccr5,ccr6,ccr7,ccr8,ccr9,ccr10,或ccr11),cx3c趋化因子受体(例如cx3cr1),xc趋化因子受体(例如xcr1)或其趋化因子结合片段。在一个实施方案中,基于肿瘤分泌的趋化因子选择要用本文所述的car表达的趋化因子受体分子。在一个实施方案中,本文所述的car表达细胞进一步包含,例如表达ccr2b受体或cxcr2受体。在一个实施方案中,本文所述的car和趋化因子受体分子在相同的载体上或在两个不同的载体上。在本文所述的car和趋化因子受体分子在相同载体上的实施方案中,car和趋化因子受体分子各自由两种不同的启动子控制,或者在同一启动子的控制下。
编码car的核酸构建体
本发明还提供编码本文所述的一种或多种car构建体的核酸分子。一方面,提供核酸分子作为信使rna转录物。一方面,提供核酸分子作为dna构建体。
在一个实施方案中,编码本文所述的nkr-car的核酸分子还包含编码胞内信号传导结构域或衔接分子的核酸序列。
本发明还提供了插入本发明的dna的载体。来源于逆转录病毒如慢病毒的载体是实现长期基因转移的合适工具,因为它们允许转基因的长期稳定整合及其在子细胞中的增殖。慢病毒载体相对于来源于癌逆转录病毒例如鼠白血病病毒的载体具有增加的优点,因为它们可以转导非增殖细胞,例如肝细胞。它们还具有低免疫原性的附加优点。逆转录病毒载体也可以是例如γ逆转录病毒载体。γ逆转录病毒载体可以包括例如启动子,包装信号(ψ),引物结合位点(pbs),一个或多个(例如两个)长末端重复序列(ltr)和感兴趣的转基因,例如编码car的基因。γ逆转录病毒载体可能缺乏病毒结构基因,如gag,pol和env。示例性的γ逆转录病毒载体包括鼠白血病病毒(mlv),脾脏病灶形成病毒(sffv)和骨髓增生性肉瘤病毒(mpsv)以及由其衍生的载体。其他γ逆转录病毒载体描述于例如tobiasmaetzigetal.,“gammaretroviralvectors:biology,technologyandapplication”viruses.2011jun;3(6):677–713。
在另一个实施方案中,包含编码本发明所需car的核酸的载体是腺病毒载体(a5/35)。在另一个实施方案中,编码car的核酸的表达可以使用转座子如睡美人,crisper,cas9和锌指核酸酶来完成。参见下面的juneetal.2009naturereviewsimmunology9.10:704-716,将其通过引用并入本文。
总之,编码car的天然或合成核酸的表达通常通过将编码car多肽或其部分的核酸有效连接至启动子,并将构建体整合到表达载体中来实现。载体可以适用于复制和整合真核生物。典型的克隆载体含有转录和翻译终止子,起始序列和可用于调节所需核酸序列表达的启动子。
本发明的表达构建体也可以使用标准的基因递送方案用于核酸免疫和基因治疗。用于基因递送的方法是本领域已知的。参见例如美国专利号5,399,346,5,580,859,5,589,466,,其全部内容通过引用并入本文。在另一个实施方案中,本发明提供了一种基因治疗载体。
核酸可以克隆到多种类型的载体中。例如,可以将核酸克隆到载体中,包括但不限于质粒,噬菌粒,噬菌体衍生物,动物病毒和粘粒。特别感兴趣的载体包括表达载体,复制载体,探针产生载体和测序载体。
此外,表达载体可以以病毒载体的形式提供给细胞。病毒载体技术在本领域中是众所周知的,并且描述于例如sambrooketal.,2012,molecularcloning:alaboratorymanual,volumes1-4,coldspringharborpress,ny)和其他病毒学和分子生物学手册。可用作载体的病毒包括但不限于逆转录病毒,腺病毒,腺伴随病毒,疱疹病毒和慢病毒。通常,合适的载体包含在至少一个生物体中起作用的复制起点,启动子序列,方便的限制性内切核酸酶位点和一个或多个选择标记(例如wo01/96584;wo01/29058和美国专利号6,326,193)。
已经开发了许多基于病毒的系统用于将基因转移到哺乳动物细胞中。例如,逆转录病毒为基因递送系统提供了便利的平台。可以使用本领域已知的技术将所选择的基因插入载体并包装在逆转录病毒颗粒中。然后可以将重组病毒分离并在体内或离体递送至受试者的细胞。许多逆转录病毒系统是本领域已知的。在一些实施方案中,使用腺病毒载体。许多腺病毒载体是本领域已知的。在一个实施方案中,使用慢病毒载体。
额外的启动子元件,例如增强子调节转录起始的频率。通常,它们位于起始位点上游30-110bp的区域,尽管最近已经显示了许多启动子在起始位点的下游含有功能元件。启动子元件之间的间隔通常是柔性的,因此当元件相对于彼此反转或移动时,启动子功能被保留。在胸苷激酶(tk)启动子中,在活性开始下降之前,启动子元件之间的间距可以增加到50bp。根据启动子,似乎单独的元件可以协同或独立地起作用以激活转录。
能够在哺乳动物t细胞中表达car转基因的启动子的实例是ef1a启动子。天然ef1a启动子驱动延伸因子-1复合体的α亚基的表达,所述复合体负责将氨酰基trna酶促递送至核糖体。ef1a启动子已被广泛用于哺乳动物表达质粒,并且已被证明能有效驱动克隆到慢病毒载体中的转基因的car表达。参见,例如,miloneetal.,mol.ther.17(8):1453–1464(2009)。一方面,ef1a启动子包含作为seqidno:11提供的序列。
启动子的一个例子是立即早期巨细胞病毒(cmv)启动子序列。该启动子序列是能够驱动与其有效连接的任何多核苷酸序列的高水平表达的强组成型启动子序列。然而,也可以使用其他组成型启动子序列,包括但不限于猿猴病毒40(sv40)早期启动子,小鼠乳腺肿瘤病毒(mmtv),人免疫缺陷病毒(hiv)长末端重复(ltr)启动子,momulv启动子,禽白血病病毒启动子,eb病毒立即早期启动子,劳斯肉瘤病毒启动子,延伸因子-1α启动子,以及人基因启动子,例如但不限于肌动蛋白启动子,肌球蛋白启动子,血红蛋白启动子和肌酸激酶启动子。此外,本发明不应限于使用组成型启动子。也可以考虑诱导型启动子作为本发明的一部分。诱导型启动子的使用提供了分子开关,其能够启动有效连接的多核苷酸序列的表达(当期望这种表达时),或者当不希望表达时关闭表达。诱导型启动子的实例包括但不限于金属硫蛋白启动子,糖皮质激素启动子,孕酮启动子和四环素启动子。
在一个实施方案中,载体是慢病毒载体。在一个实施方案中,载体还包含启动子。在一个实施方案中,启动子是ef-1启动子。
在一个实施方案中,载体是体外转录的载体,例如转录本文所述的核酸分子的rna的载体。在一个实施方案中,载体中的核酸序列还包含多聚(a)尾,例如本文所述的多聚a尾,例如包含约150个腺苷碱基。在一个实施方案中,载体中的核酸序列还包含3’utr。
启动子的另一个例子是磷酸甘油酸激酶(pgk)启动子。在实施方案中,截短的pgk启动子(例如,当与野生型pgk启动子序列比较时,具有一个或多个,例如1,2,5,10,100,200,300或400个核苷酸缺失的pgk启动子)可能是需要的。示例性pgk启动子的核苷酸序列在下面提供。
wtpgk启动子
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacgagggaccgcgacaggcagacgctcccatgatcactctgcacgccgaaggcaaatagtgcaggccgtgcggcgcttggcgttccttggaagggctgaatccccgcctcgtccttcgcagcggccccccgggtgttcccatcgccgcttctaggcccactgcgacgcttgcctgcacttcttacacgctctgggtcccagccgcggcgacgcaaagggccttggtgcgggtctcgtcggcgcagggacgcgtttgggtcccgacggaaccttttccgcgttggggttggggcaccataagct
(seqidno:52)
示例性截短的pgk启动子:
pgk100:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtg
(seqidno:53)
pgk200:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacg
(seqidno:54)
pgk300:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacgagggaccgcgacaggcagacgctcccatgatcactctgcacgccgaaggcaaatagtgcaggccgtgcggcgcttggcgttccttggaagggctgaatccccg
(seqidno:55)
pgk400:
acccctctctccagccactaagccagttgctccctcggctgacggctgcacgcgaggcctccgaacgtcttacgccttgtggcgcgcccgtccttgtcccgggtgtgatggcggggtgtggggcggagggcgtggcggggaagggccggcgacgagagccgcgcgggacgactcgtcggcgataaccggtgtcgggtagcgccagccgcgcgacggtaacgagggaccgcgacaggcagacgctcccatgatcactctgcacgccgaaggcaaatagtgcaggccgtgcggcgcttggcgttccttggaagggctgaatccccgcctcgtccttcgcagcggccccccgggtgttcccatcgccgcttctaggcccactgcgacgcttgcctgcacttcttacacgctctgggtcccagccg
(seqidno:56)
载体还可以包括例如促进分泌的信号序列,聚腺苷酸化信号和转录终止子(例如,来自牛生长激素(bgh)基因)),允许附加复制和在原核生物中复制的元件(例如sv40起点和cole1或本领域已知的其他元件)和/或允许选择的元件(例如,氨苄青霉素抗性基因和/或zeocin标记)。
为了评估car多肽或其部分的表达,待引入细胞的表达载体还可以含有选择标记基因或报道基因或两者,以便于从细胞群体中鉴定和选择试图通过病毒载体转染或感染的表达细胞。在其他方面,选择标记可以携带在单独的dna片段上并用于共转染过程。选择标记和报告基因都可以侧翼为适当的调控序列以使得能够在宿主细胞中表达。有用的选择标记包括例如抗生素抗性基因,例如neo等。
报告基因用于鉴定潜在转染的细胞并用于评估调节序列的功能。通常,报道基因是不存在于受体生物或组织中或由受体生物体或组织表达的基因,并且其编码多肽,所述多肽的表达由一些易于检测的性质(例如酶活性)表现出来。在dna被引入受体细胞后的合适时间测定报道基因的表达。合适的报道基因可以包括编码萤光素酶,β-半乳糖苷酶,氯霉素乙酰转移酶,分泌的碱性磷酸酶的基因或绿色荧光蛋白基因(例如,ui-tei等,2000febsletters479:79-82)。合适的表达系统是公知的,并且可以使用已知技术制备或商业获得。通常,具有显示报告基因表达的最高水平的最小5’侧翼区的构建体被鉴定为启动子。这样的启动子区域可以连接到报告基因,并用于评估调节启动子驱动的转录能力的试剂。
在一个实施方案中,载体可以进一步包含编码第二car,例如第二nkr-car,tcar或抑制性car的核酸。在一个实施方案中,第二car包括结合靶抗原(例如本文所述的肿瘤抗原)的抗原结合结构域。在实施方案中,由第一car结合的抗原与由第二car结合的抗原相同。或者,由第一car结合的抗原是与第二car结合的抗原不同的抗原。例如,第一car结合间皮素,而第二car结合不同的肿瘤抗原或存在于正常细胞上的抗原。
在一个实施方案中,载体包含编码本文所述的nkr-car的核酸和编码tcar的核酸。在一个实施方案中,tcar包含结合肿瘤抗原的抗原结合结构域,例如与nkr-car结合的不同肿瘤抗原。在一个实施方案中,tcar包含抗原结合结构域,跨膜结构域和胞内信号传导结构域,其中胞内信号传导结构域包含本文所述的一级胞内信号传导结构域,例如cd3ζ或提供于表2,以及任选的一个或多个本文描述的共刺激信号传导结构域,例如4-1bb,cd28,cd27,icos或表3中提供。
在一个实施方案中,载体包含编码本文所述的nkr-car的核酸和编码抑制性car的核酸。在一个实施方案中,抑制性car包含结合在正常细胞(例如也表达nkr-car识别的抗原的正常细胞)而不是癌细胞上发现的抗原的抗原结合结构域。在一个实施方案中,抑制性car包含抑制性分子的抗原结合结构域,跨膜结构域和胞内结构域。例如,抑制性car的胞内结构域可以是pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,i类mhc,ii类mhc,gal9,腺苷和tgfrβ的胞内结构域。
在实施方案中,载体可以包含两个或更多个编码car,例如本文所述的nkr-car和第二个car,例如第二个nkr-car,抑制性car或特异性结合于第一nkr-car识别的抗原以外的抗原的tcar的核酸序列。在这样的实施方案中,编码car的两个或多个核酸序列由相同构架中的单个核酸分子并且作为单个多肽链编码。在这方面,两个或更多个car可以例如被一个或多个肽切割位点(例如,自身切割位点或细胞内蛋白酶的底物)分开。
在实施方案中,包含编码所述nkr-car的核酸序列的载体可进一步包含编码衔接分子的核酸序列。在这样的实施方案中,两个或多个核酸序列由相同构架中的单个核酸分子和作为单个多肽链编码。在该实施方案中,nkr-car和衔接分子可以被一个或多个肽切割位点(例如,自身切割位点或细胞内蛋白酶的底物)分离,其中nkr-car,衔接分子和肽切割位点在相同的构架中,并且被编码为单个多肽链。
肽切割位点的实例包括以下,其中gsg残基是任选的:
t2a:(gsg)egrgslltcgdveenpgp(seqidno:57)
p2a:(gsg)atnfsllkqagdveenpgp(seqidno:58)
e2a:(gsg)qctnyallklagdvesnpgp(seqidno:59)
f2a:(gsg)vkqtlnfdllklagdvesnpgp(seqidno:60)
将基因导入细胞和表达的方法是本领域已知的。在表达载体的上下文中,可以通过本领域任何方法将载体容易地引入宿主细胞,例如哺乳动物,细菌,酵母或昆虫细胞。例如,表达载体可以通过物理,化学或生物手段转移到宿主细胞中。
多核苷酸可以使用许多不同方法中的任何一种引入靶细胞,例如可商购的方法,包括但不限于电穿孔(amaxanucleofector-ii(amaxabiosystems,cologne,germany)),(ecm830(btx)(harvardinstruments,boston,mass.)或genepulserii(amaxanucleofector-ii(amaxabiosystems,cologne,germany)),(ecm830(btx)(harvardinstruments,boston,mass.),multiporator(eppendort,hamburggermany),使用脂质转染的阳离子脂质体介导的转染,聚合物包封,肽介导的转染或生物射弹颗粒递送系统如“基因枪”(参见,例如,nishikawa,etal.humgenether.,12(8):861-70(2001)。
将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀,脂转染,粒子轰击,显微注射,电穿孔等。用于产生包含载体和/或外源核酸的细胞的方法是本领域公知的。参见例如sambrooketal.,2012,molecularcloning:alaboratorymanual,volumes1-4,coldspringharborpress,ny)。
将感兴趣的多核苷酸引入宿主细胞的生物学方法包括使用dna和rna载体。病毒载体,特别是逆转录病毒载体,已经成为将基因插入到哺乳动物例如人细胞中的最广泛使用的方法。其他病毒载体可来源于慢病毒,痘病毒,单纯疱疹病毒i,腺病毒和腺伴随病毒等。参见例如美国专利号5,350,674和5,585,362。
用于将多核苷酸引入宿主细胞的化学方法包括胶体分散系统,例如大分子复合体,纳米胶囊,微球,珠粒和基于脂质的系统,包括水包油乳液,胶束,混合胶束和脂质体。在体外和体内用作递送载体的示例性胶体系统是脂质体(例如,人造膜囊泡)。
在使用非病毒递送系统的情况下,示例性递送载体是脂质体。考虑使用脂质制剂将核酸引入宿主细胞(体外,离体或体内)。在另一方面,核酸可以与脂质结合。与脂质结合的核酸可以包封在脂质体的水性内部,散布在脂质体的脂质双层内,通过与脂质体和寡核苷酸相结合的连接分子连接到脂质体上,被截留在脂质体中,与脂质体复合,分散在含有脂质的溶液中,与脂质混合,与脂质组合,作为悬浮液包含在脂质中,包含在胶束中或与胶束复合,或以其它方式与脂质结合。脂质,脂质/dna或脂质/表达载体结合的组合物不限于溶液中的任何特定结构。例如,它们可以存在于双层结构中,作为胶束或具有“塌陷”结构。它们也可以简单地散布在溶液中,可能形成尺寸或形状不均匀的聚集体。脂质是可能是天然存在的或合成的脂质的脂肪物质。例如,脂质包括天然存在于细胞质中的脂肪液滴以及含有长链脂肪族烃及其衍生物如脂肪酸,醇,胺,氨基醇和醛的化合物类别。在使用非病毒递送系统的情况下,示例性递送载体是脂质体。考虑使用脂质制剂将核酸引入宿主细胞(体外,离体或体内)。在另一方面,核酸可以与脂质结合。与脂质结合的核酸可以包封在脂质体的水性内部,散布在脂质体的脂质双层内,通过与脂质体和寡核苷酸相结合的连接分子连接到脂质体上,截留在脂质体中,与脂质体复合,分散在含有脂质的溶液中,与脂质混合,与脂质组合,作为悬浮液包含在脂质中,包含在胶束中或与胶束复合,或以其它方式与脂质结合。脂质,脂质/dna或脂质/表达载体相关组合物不限于溶液中的任何特定结构。例如,它们可以存在于双层结构中,作为胶束或具有“塌陷”结构。它们也可以简单地散布在溶液中,可能形成尺寸或形状不均匀的聚集体。脂质是可能是天然存在的或合成的脂质的脂肪物质。例如,脂质包括天然存在于细胞质中的脂肪液滴以及含有长链脂肪族烃及其衍生物如脂肪酸,醇,胺,氨基醇和醛的化合物类别。
可以从商业来源获得适合使用的脂质。例如,二肉豆蔻酰磷脂酰胆碱(“dmpc”)可以从sigma,st.louis,mo获得;磷酸二鲸蜡酯(“dcp”)可从k&klaboratories(plainview,ny)获得;胆固醇(“choi”)可以从calbiochem-behring获得;二肉豆蔻酰磷脂酰甘油(“dmpg”)和其他脂质可以从avantipolarlipids,inc.(birmingham,al.)获得。脂质在氯仿或氯仿/甲醇中的储备溶液可以在约-20℃下储存。使用氯仿作为唯一的溶剂,因为它比甲醇更容易蒸发。“脂质体”是包含通过产生封闭的脂质双层或聚集体形成的各种单层和多层脂质载体的通用术语。脂质体可以表征为具有磷脂双层膜和内水性介质的囊泡结构。多层脂质体具有通过水性介质分离的多个脂质层。当磷脂悬浮在过量的水溶液中时,它们自发形成。脂质组分在闭合结构形成之前经历自我重排,并将水和溶解的溶质夹在脂质双层之间(ghoshetal.,1991glycobiology5:505-10)。然而,也包括在溶液中具有与正常囊泡结构不同的结构的组合物。例如,脂质可以呈现胶束结构,或仅作为脂质分子的不均匀聚集物存在。还考虑了lipofectamine-核酸复合体。
不管用于将外源核酸引入宿主细胞或以其他方式将细胞暴露于本发明的抑制剂的方法,为了确认宿主细胞中重组dna序列的存在,可以进行多种测定。此类测定包括例如本领域技术人员熟知的“分子生物学”测定,例如southern和northern印迹,rt-pcr和pcr;例如通过免疫学手段(elisa和western印迹)检测特定肽的存在或不存在,或通过本文所述的测定来鉴定属于本发明范围内的试剂的“生物化学”测定。
本发明还提供了包含car编码核酸分子的载体。一方面,car载体可以直接转导入细胞,例如免疫效应细胞,例如t细胞或nk细胞。一方面,载体是克隆或表达载体,例如载体,包括但不限于一种或多种质粒(例如,表达质粒,克隆载体,微环,微型载体、双微型染色体),逆转录病毒和慢病毒载体构建体。一方面,载体能够在哺乳动物免疫效应细胞例如哺乳动物t细胞或哺乳动物nk细胞中表达car构建体。一方面,哺乳动物t细胞是人t细胞。
rna转染
本文公开了用于产生体外转录的rnacar,例如rnankr-car的方法。本发明还包括可直接转染入细胞的编码nkr-car的rna构建体。在一个实施方案中,编码nkr-car的rna构建体还包含编码本文所述的tcar的核酸序列。用于产生用于转染的mrna的方法可以涉及具有特别设计的引物的模板的体外转录(ivt),随后是多聚a加入,以产生含有3’和5’非翻译序列(“utr”)的构建体,5’帽和/或内部核糖体进入位点(ires),待表达的核酸和通常长度为50-2000个碱基(seqidno:35)的多聚a尾。如此产生的rna可以有效地转染不同种类的细胞。在一个方面,模板包括nkr-car的序列。
在一个方面,nkr-car由信使rna(mrna)编码。在一个方面,将编码nkr-car的mrna引入用于产生nkr-car细胞的t细胞中。在一个方面,将编码nkr-car的mrna引入nk细胞以产生nkr-car细胞。
在一个实施方案中,体外转录的rnankr-car可以作为瞬时转染的形式引入细胞。使用聚合酶链反应(pcr)生成的模板通过体外转录产生rna。使用合适的引物和rna聚合酶,来自任何来源的目标dna可以通过pcr直接转化成用于体外mrna合成的模板。dna的来源可以是例如基因组dna,质粒dna,噬菌体dna,cdna,合成dna序列或任何其它合适的dna来源。在一个实施方案中,用于体外转录的所需模板是本发明的nkr-car。例如,rnankr-car的模板包含含有抗肿瘤抗体的单链可变结构域的细胞外区域;铰链区,跨膜结构域(例如kir的跨膜结构域)。在一个实施方案中,用于体外转录的所需模板包括在单独模板上的kir-car和dap12。在一个实施方案中,用于体外转录的所需模板包含相同模板上的kir-car和dap12。dap12的模板包含跨膜结构域和细胞内区域。
在一个实施方案中,用于pcr的dna含有可读框。该dna可以来自生物体基因组的天然存在的dna序列。在一个实施方案中,核酸可以包括一些或所有的5’和/或3’非翻译区(utr)。核酸可以包括外显子和内含子。在一个实施方案中,用于pcr的dna为人核酸序列。在另一个实施方案中,用于pcr的dna为包括5’和3’utr的人核酸序列。dna可以备选地为通常在天然存在生物体中不表达的人工dna序列。示例性的人工dna序列为含有连接在一起形成编码融合蛋白的可读框的基因部分的序列。连接在一起的dna部分可以来自单个生物体或多于一个生物体。
pcr用于产生用于转染的mrna的体外转录的模板。进行pcr的方法是本领域所熟知的。把用于pcr的引物设计成具有与用作pcr模板的dna的区域基本上互补的区域。如本文所用的“基本上互补的”是指核苷酸的序列,其中引物序列中大多数或所有的碱基都是互补的或一个或更多个碱基是非互补的或错配的。基本上互补的序列能够与目标dna靶在用于pcr的退火条件下退火或杂交。可以把引物设计成与dna模板的任何部分基本上互补。例如,可以把引物设计成扩增在细胞中通常转录的核酸的部分(可读框),包括5’和3’utr。也可以把引物设计成扩增编码目的特定结构域的核酸的部分。在一个实施方案中,把引物设计成扩增人cdna的编码区,包括5’和3’utrs的全部或部分。可以通过本领域熟知的合成方法产生用于pcr的引物。“正向引物”是含有与要被扩增的dna序列上游的dna模板上的核苷酸基本上互补的核苷酸区域的引物。“上游的”在本文用于指相对于编码链的待扩增的dna序列的5’位。“反向引物”为含有与要被扩增的dna序列下游的双链dna模板基本上互补的核苷酸区域的引物。“下游的”在本文用于指相对于编码链的要扩增的dna序列的3位。
用于pcr的任何dna聚合酶都可以用于本文公开的方法中。试剂和聚合酶为从多个来源市售获得的。
也可以使用具有促进稳定性和/或翻译效率的能力的化学结构。rna优选地具有5’和3’utr。在一个实施方案中,5’utr的长度在1个和3000个核苷酸之间。可以通过不同的方法改变添加到编码区的5’和3’utr序列的长度,所述方法包括但不限于设计用于退火到utr的不同区域的pcr引物。使用该方法,本领域普通技术人员可以改变在转染转录的rna之后获得最佳翻译效率所需的5’和3’utr长度。
5’和3’utr可以是对于目的核酸来说天然存在的、内源性的5’和3’utr。备选地,可以通过将utr序列掺入到正向和反向引物中或通过模板的任何其它修饰加入不是目的核酸内源的utr序列。使用不是目的核酸内源的utr序列可以用于改变rna的稳定性和/或翻译效率。例如,众所周知3’utr序列中的富含au的元件可以降低mrna的稳定性。因此,可以基于本领域熟知的utr的性质来选择或设计3’utr以提高转录的rna的稳定性。
在一个实施方案中,5’utr可含有内源性核酸的kozak序列。备选地,当通过如上所述pcr加入不是目的核酸内源的5’utr时,可以通过加入5’utr序列来重新设计共有kozak序列。kozak序列可以提高一些rna转录物的翻译效率,但是似乎并非是确保所有rna有效翻译所需的。本领域已知许多mrna需要kozak序列。在其它实施方案中,5’utr可以是rna病毒的5’utr,所述病毒的rna基因组在细胞中是稳定的。在其它实施方案中,多种核苷酸类似物可用于3’或5’utr中以阻止mrna的核酸外切酶降解。
为了能够在不需基因克隆下从dna模板合成rna,应当把转录的启动子连接到待转录的序列的dna模板上游。当把充当rna聚合酶启动子的序列添加到正向引物的5’端时,rna聚合酶启动子变得掺入待转录的可读框的pcr产物上游中。在一个优选的实施方案中,启动子为如本文在别处描述的t7聚合酶启动子。其它有用的启动子包括但不限于t3和sp6rna聚合酶启动子。用于t7、t3和sp6启动子的共有核苷酸序列是本领域已知的。
在一个优选的实施方案中,mrna具有决定核糖体结合、翻译起始和细胞中mrna稳定性的5’端和3’聚(a)尾部上的帽。在环状dna模板上,例如质粒dna上,rna聚合酶产生不适于真核细胞中表达的多联体产物。在3’utr末端线性化的质粒dna的转录产生正常尺寸mrna,其即使在转录后聚腺苷酸化,在真核转染中也不是有效的。
在线性dna模板上,噬菌体t7rna聚合酶可以使转录物的3’端延伸超出模板的最后一个碱基(schenbornandmierendorf,nucacidsres.,13:6223-36(1985);nachevaandberzal-herranz,eur.j.biochem.,270:1485-65(2003)。
将一段聚a/t序列整合到dna模板中的常规方法为分子克隆。然而,整合到质粒dna中的聚a/t序列可以引起质粒不稳定,这就是为什么从细菌细胞得到的质粒dna模板通常是高度污染的,具有缺失及其它畸变。这使得克隆过程不仅费力而且费时,但通常不可靠。这就是为什么非常期望一种允许用一段聚a/t3序列而非克隆来构建dna模板的方法的原因。
可以通过使用含有聚t尾(例如100t尾部)(seqidno:31)的反向引物(尺寸可以为50-5000t(seqidno:32)),或在pcr之后通过任何其它方法(包括,但不限于dna连接或体外重组),在pcr期间产生所述的转录dna模板的聚a/t段。聚(a)尾也给rna提供稳定性并且减少其降解。通常,聚(a)尾部的长度与转录的rna的稳定性正相关。在一个实施方案中,聚(a)尾在100和5000个腺苷(seqidno:33)之间
可以在体外转录之后,使用聚(a)聚合酶比如大肠杆菌聚(a)聚合酶(e-pap),进一步延伸rna的聚(a)尾部。在一个实施方案中,聚(a)尾部的长度从100个核苷酸增加至在300至400个核苷酸(seqidno:34)之间,导致rna的翻译效率提高约两倍。另外,将不同的化学基团连接至3’端可以提高mrna稳定性。这样的连接可以含有修饰的/人工的核苷酸、适体及其它化合物。例如,可以使用聚(a)聚合酶将atp类似物掺入到聚(a)尾部中。atp类似物可以进一步提高rna的稳定性。
5’帽也给rna分子提供稳定性。在一个优选的实施方案中,通过本文公开的方法产生的rna包括5’帽。使用本领域已知的(cougot,等人,trendsinbiochem.sci.,29:436-444(2001);stepinski,等人,rna,7:1468-95(2001);elango,等人,biochim.biophys.res.commun.,330:958-966(2005))和本文所述的技术提供5’帽。
通过本文公开的方法产生的rna也可以含有内部核糖体进入位点(ires)序列。ires序列可以是任何病毒、染色体或人工设计的序列,其引发帽独立性核糖体结合于mrna和促进翻译的起始。可以包括适于细胞电穿孔的任何溶质,其可以含有有助于细胞渗透性和生存力的因子,比如糖、肽、脂质、蛋白质、抗氧化剂和表面活性剂。
可以使用大量不同方法中的任一种把rna引入到靶细胞中,所述方法为例如市售可获得的方法,其包括但不限于电穿孔(amaxanucleofector-ii(amaxabiosystems,cologne,germany))、(ecm830(btx)(harvardinstruments,boston,mass.)或genepulserii(biorad,denver,colo.)、multiporator(eppendort,hamburggermany)、使用脂质转染的阳离子脂质体介导的转染、聚合物包封、肽介导的转染、或生物弹粒子递送系统比如“基因枪”(参见例如nishikawa,等人humgenether.,12(8):861-70(2001)。
编码所需分子的核酸序列可以使用本领域已知的重组方法获得,例如通过从表达该基因的细胞筛选文库,通过从已知包含该基因的载体衍生基因,或使用标准技术通过从含有所述基因的细胞和组织直接分离。或者,感兴趣的基因可以合成产生,而不是克隆产生。
非病毒递送方法
在一些方面中,非病毒方法可用于递送编码本文所述的car例如nkr-car或tcar的核酸到细胞或组织或受试者中。
在一些实施方案中,非病毒方法包括使用转座子(也称为转座元件)。在一些实施方案中,转座子是一段dna,其可以自身插入在基因组中的位置,例如,能够自我复制和插入其拷贝到基因组的一段dna,或一段dna片段,其可以从更长的核酸剪接出来并插入在基因组中另一个地方。例如,转座子包含由用于转座的基因侧翼的反向重复序列组成的dna序列。
使用转座子的核酸递送的示范性方法包括睡美人转座子系统(sbts)和piggybac(pb)转座子系统。见,例如,aronovichetal.hum.mol.genet.20.r1(2011):r14-20;singhetal.cancerres.15(2008):2961–2971;huangetal.mol.ther.16(2008):580–589;grabundzijaetal.mol.ther.18(2010):1200–1209;kebriaeietal.blood.122.21(2013):166;williams.moleculartherapy16.9(2008):1515–16;belletal.nat.protoc.2.12(2007):3153-65;anddingetal.cell.122.3(2005):473-83,所有这些都通过引用并入本文。
所述sbts包括两个组件:1)含有转基因的转座子和2)转座酶的来源。转座酶可以将来自载体质粒(或其他供体dna)的转座子转座到靶dna,诸如宿主细胞染色体/基因组。例如,转座酶结合至所述载体质粒/供体dna,从质粒中切割出转座子(包括转基因),并将其插入到宿主细胞的基因组中。见,例如,aronovich等,如上。
示例性转座子包括基于pt2的转座子。见,例如,grabundzijaetal.nucleicacidsres.41.3(2013):1829-47;和singhetal.cancerres.68.8(2008):2961–2971,所有这些都通过引用并入本文。示例性转座酶包括tc1/mariner型转座酶,例如,sb10转座酶或sb11转座酶(超活性转座酶,其可以例如,从巨细胞病毒启动子表达)。见,例如,aronovich等;kebriaei等人;和grabundzija等,所有这些都通过引用并入本文。
使用所述sbts允许转基因,例如,编码本文中所述的car的核酸有效整合和表达。本文提供了例如,使用转座子系统如sbts,产生细胞,例如,t细胞或nk细胞的方法,所述细胞稳定表达本文所述的car。
根据本文所述方法,在一些实施方案中,将含有sbts组件的一种或多种核酸,例如,质粒递送到细胞(例如,t细胞或nk细胞)。例如,通过标准的核酸(例如,质粒dna)递送方法,例如,本文描述的方法,例如,电穿孔,转染或脂转染递送核酸。在一些实施方案中,核酸含有包含转基因,例如,编码本文中所述的car的核酸的转座子。在一些实施方案中,核酸含有包含转基因的转座子(例如,编码本文中所述的car的核酸)以及编码转座酶的核酸序列。在其他实施方案中,提供有两个核酸的系统,例如,双质粒系统,例如,其中第一质粒含有包含转基因的转座子,并且第二质粒含有编码转座酶的核酸序列。例如,第一和第二核酸共同递送到宿主细胞中。
在一些实施方案中,通过使用sbts的基因插入与使用核酸酶的基因编辑(例如,锌指核酸酶(zfn),转录活化子样效应核酸酶(talens),crispr/cas系统或工程化的大范围核酸酶重新工程化的归巢内切核酸酶)的组合,产生表达本文所述的car的细胞,例如,t或nk细胞。
在一些实施方案中,使用递送的非病毒方法允许细胞例如,t细胞或nk细胞重新编程,并指导细胞输注到受试者。非病毒载体的优点包括但不限于容易和相对低成本产生满足患者群体所需的足够量,贮存过程中的稳定性和缺失免疫原性。
在使用非病毒递送系统的其它实施方案中,示例性递送载体是脂质体。预期使用脂质制剂将核酸引入到宿主细胞(体外,离体或体内)。在另一个方面,核酸可能与脂质结合。与脂质结合的核酸可以被包封在脂质体的水性内部、散布在脂质体的脂质双层内、经由与脂质体和寡核苷酸两者缔合的连接分子附着在脂质体上、俘获在脂质体中、与脂质体复合、分散在含有脂质的溶液中、与脂质混合、与脂质组合、呈悬浮液含在脂质中、含有胶束或与胶束复合、或以其它方式与脂质缔合。脂质、脂质/dna或与脂质/表达载体缔合的组合物不限于在溶液中的任何特定结构。例如,它们可以以双层结构、呈胶束存在或具有“塌陷(collapsed)”的结构。它们也可以仅简单地散布在溶液中,可能形成尺寸或形状不均匀的聚集体。脂质为脂肪物质,其可以天然存在或是合成脂质。例如,脂质包括细胞质中天然存在的脂肪滴以及含有长链脂肪族烃及其衍生物的化合物种类,比如脂肪酸、醇、胺、氨基醇和醛。
适于使用的脂质可以从商业来源得到。例如,二肉豆蔻基磷脂酰胆碱(“dmpc”)可以得自sigma,st.louis,mo;磷酸三十二烷基酯(“dcp”)可以得自k&klaboratories(plainview,ny);胆固醇(“choi”)可以得自calbiochem-behring;二肉豆蔻基磷脂酰甘油(“dmpg”)及其它脂质可以得自avantipolarlipids,inc.(birmingham,al.)。脂质在氯仿或氯仿/甲醇中的贮存液可以储存在约-20℃。氯仿用作唯一溶剂,因为其比甲醇更容易蒸发。“脂质体”是包括通过产生封闭脂质双层或聚集体形成的多种单层或多层脂质载体的通称。脂质体可以表征为具有磷脂双层膜和内部水介质的囊状结构。多层脂质体具有多个被水性介质分开的脂质层。当磷脂悬浮在过量的水溶液中时,它们自发地形成。脂质组分在形成封闭结构之前进行自我重排且在脂质双层之间俘获水和溶解的溶质(ghosh等人,1991glycobiology5:505-10)。然而,也包括在溶液中具有与正常囊状结构不同的结构的组合物。例如,脂质可以采用胶束结构或仅仅作为脂质分子的非均匀聚集体存在。还预期lipofectamine-核酸复合体。
细胞来源
在扩增和基因修饰之前,细胞来源例如,免疫效应细胞,例如t细胞或nk细胞从受试者获得的。术语“受试者”意味着包括其中可以引发免疫应答的活生物体(例如哺乳动物)。受试者的实例包括人类、狗、猫、小鼠、大鼠及其转基因物种。t细胞可以从大量来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸膜积液、脾组织和肿瘤。
在本发明的某些实施方案中,可以使用本领域可获得的任何数量的免疫效应细胞(例如,t细胞或nk细胞)系。在本发明的某些实施方案中,可以使用任何数量的本领域技术人员已知的技术,例如ficolltm分离,从收集自受试者的血液单位获得t细胞。在一个优选实施方案中,通过单采血液成分术获得来自个体的循环血液的细胞。单采血液成分术制品通常含有淋巴细胞,包括t细胞,单核细胞,粒细胞,b细胞,其他有核白细胞,红细胞和血小板。在一个实施方案中,可以洗涤通过单采血液成分术收集的细胞以除去血浆级分并将细胞置于合适的缓冲液或培养基中用于随后的加工步骤。在本发明的一个实施方案中,用磷酸缓冲盐水(pbs)洗涤细胞。在备选实施方案中,洗涤溶液缺乏钙并且可能缺少镁,或者可能缺少许多(如果不是全部)二价阳离子。在不存在钙下的初始活化步骤导致放大的活化。如本领域普通技术人员应当容易地理解的,洗涤步骤可以通过本领域技术人员已知的方法完成,比如通过根据制造商的说明使用半自动化的“流通”离心机(例如,cobe2991细胞处理器、baxtercytomate、或haemoneticscellsaver5)。在洗涤之后,可以将细胞再悬浮在多种生物相容性缓冲液中,比如例如不含ca、不含mgpbs、plasmalytea、或含或不含缓冲剂的其它盐溶液。备选地,可以除去单采血液成分术样品的不期望组分,并将细胞直接再悬浮在培养基中。
认识到本申请的方法可以利用包含5%或更少,例如2%的人ab血清的培养基条件,并采用公知的培养基条件和组合物,例如在smithetal.,“exvivoexpansionofhumantcellsforadoptiveimmunotherapyusingthenovelxeno-freectsimmunecellserumreplacement”clinical&translationalimmunology(2015)4,e31;doi:10.1038/cti.2014.31中所述。
在另一个实施方案中,通过裂解红细胞并消耗单核细胞,例如通过percollt梯度离心或通过逆流离心淘洗,从外周血淋巴细胞分离t细胞。可以通过阳性或阴性选择技术进一步分离t细胞的特定亚群,例如cd3+,cd28+,cd4+,cd8+,cd45ra+,和cd45ro+t细胞。例如,在一个实施方案中,通过与抗-cd3/抗-cd28(例如3×28)缀合的珠,例如
通过负选择富集t细胞群体可以用针对负选择细胞特有的表面标记的抗体的组合来完成。一种方法是通过负磁性免疫粘附或流式细胞术进行的细胞分选和/或选择,其使用针对存在于负选择的细胞上的细胞表面标记的单克隆抗体的混合物。例如,为了通过负选择来富集cd4+细胞,单克隆抗体混合物通常包括针对cd14,cd20,cd11b,cd16,hla-dr和cd8的抗体。在某些实施方案中,可能需要富集或正选择通常表达cd4+,cd25+,cd62lhi,gitr+,和foxp3+的调节性t细胞。或者,在某些实施方案中,通过抗c25缀合的珠粒或其它类似的选择方法消耗t调节细胞。
本文描述的方法可以包括,例如,使用例如本文所述的负选择技术,选择免疫效应细胞,例如,t细胞的特定亚群,其是t调节细胞耗尽的群体,cd25+耗尽的细胞。优选地,调节性t耗尽细胞群包含少于30%,25%,20%,15%,10%,5%,4%,3%,2%,1%cd25+细胞。
在一个实施方案中,使用抗cd25抗体或其片段,或cd25结合配体il-2从所述群体去除调节性t细胞,例如,cd25+t细胞。在一个实施方案中,所述抗cd25抗体或其片段,或cd25结合配体缀合到基质,例如,珠子,或以其它方式涂布在基质,例如,珠子上。在一个实施方案中,所述抗cd25抗体或其片段缀合到如本文所述基质上。
在一个实施方案中,使用来自miltenyitm的cd25耗尽试剂从所述群体去除所述调节性t细胞,例如,cd25+t细胞。在一个实施方案中,细胞对cd25耗尽试剂的比率为1e7细胞对20ul,或1e7细胞对15ul,或1e7细胞对10ul,或1e7细胞对5ul,或1e7细胞对2.5ul,或1e7细胞对1.25ul。在一个实施方案中,例如,对于调节性t细胞,例如,cd25+耗尽,使用大于500万个细胞/ml。在进一步的方面,使用600,700,800,或900百万个细胞/ml的细胞浓度。
在一个实施方案中,待被耗尽的免疫效应细胞群体包含大约6x109个cd25+t细胞。在其它方面中,待被耗尽的免疫效应细胞群体包括约1x109到1x1010cd25+t细胞,和两者之间的任何整数值。在一个实施方案中,所得的群体t调节耗尽的细胞具有2x109t调节细胞,例如,cd25+细胞,或更少(例如,1x109,5x108,1x108,5x107,1x107,或更少的cd25+细胞)。
在一个实施方案中,使用clinimac系统,利用耗尽管路设置,例如,管路162-01,从所述群体去除所述调节性t细胞,例如,cd25+细胞。在一个实施方案中,clinimac系统在耗尽设置上,例如,depletion2.1上运行。
不希望受特定理论的束缚,在单采血液成分术前或在制造car表达细胞产品过程中,降低受试者中免疫细胞的负调节子(例如,减少不希望的免疫细胞例如,treg细胞的数量)的水平可以降低受试者复发的风险。例如,耗尽treg细胞的方法在本领域中是公知的。减少treg细胞的方法包括但不限于环磷酰胺,抗gitr抗体(本文中描述的抗gitr抗体),cd25–耗尽,以及它们的组合。
在一些实施方案中,制造方法包括在制造car表达细胞之前减少treg细胞的数目(例如,耗尽)。例如,制造方法包括用抗gitr抗体和/或抗cd25抗体(或其片段,或cd25-结合配体)接触样品,例如,单采血液分离术样品,例如,以在制造car表达细胞(例如,t细胞,nk细胞)产品前耗尽treg细胞。
在一个实施方案中,在收集细胞用于car表达细胞产品制造前,受试者用减少treg细胞的一种或多种疗法预处理,从而减少受试者对car表达细胞治疗复发的风险。在一个实施方案中,减少treg细胞的方法包括但不限于,对受试者施用环磷酰胺,抗gitr抗体,cd25-耗竭,或它们的组合的一种或多种。环磷酰胺,抗gitr抗体,cd25-耗竭,或它们的组合的一种或多种的施用可以在car表达细胞产物的输注之前,期间或之后发生。
在一个实施方案中,在收集细胞用于car表达细胞产品制造前,受试者用环磷酰胺预处理,从而减少受试者对car表达细胞治疗复发的风险。在一个实施方案中,在收集细胞用于car表达细胞产品制造前,受试者用抗gitr抗体预处理,从而减少受试者对car表达细胞治疗复发的风险。
在一个实施方案中,要去除的细胞群不是调节性t细胞或肿瘤细胞,而是否则不利地影响cart细胞,例如表达cd14,cd11b,cd33,cd15或潜在的免疫抑制细胞表达的其他标记的细胞的扩增和/或功能的细胞。在一个实施方案中,这种细胞可以设想为与调节性t细胞和/或肿瘤细胞同时除去,或所述耗尽后去除,或以另一顺序。
本文描述的方法可以包括一个以上的选择步骤,例如,一个以上的耗尽步骤。例如,使用针对负选择的细胞特有的表面标志物的抗体的组合,通过负选择对t细胞群体的富集可以实现。一种方法是通过负磁免疫粘附或流式细胞术进行细胞分选和/或选择,所述负磁免疫粘附或流式细胞术使用针对存在于负选择的细胞上的细胞表面标志物的单克隆抗体的混合物。例如,为了通过负选择富集cd4+细胞,单克隆抗体混合物可包括针对cd14,cd20,cd11b,cd16,hla-dr,和cd8的抗体。
本文描述的方法可以进一步包括从群体中除去表达肿瘤抗原,例如不包含cd25的肿瘤抗原,例如,cd19,cd30,cd38,cd123,cd20,cd14或cd11b的细胞,从而提供t调节性耗尽的,例如,cd25+耗尽的和肿瘤抗原耗尽的细胞群体,其适用于表达car,例如,本文所述的car。在一个实施方案中,肿瘤抗原表达细胞与t调节性,例如,cd25+细胞同时除去。例如,抗cd25抗体或其片段,以及抗肿瘤抗原抗体,或其片段,可以连接到相同的基质,例如,珠子,其可被用来除去细胞或抗cd25抗体或其片段,或抗肿瘤抗原抗体,或其片段可以附着到单独的小珠,其混合物可以用来除去细胞。在其他实施方案中,去除t调节细胞,例如,cd25+细胞,和去除肿瘤抗原表达细胞是顺序的,并且可以例如以任一顺序发生。
还提供了一些方法,其包括从群体中除去细胞,所述细胞表达检查点抑制剂,例如,本文所述的检查点抑制剂,例如,一种或多种pd1+细胞,lag3+细胞,和tim3+细胞,以由此提供t调节耗尽的,例如,cd25+耗尽的细胞,和检查点抑制耗尽的细胞,例如,pd1+,lag3+和/或tim3+耗尽的细胞。示例性检查点抑制剂包括b7-h1,b7-1,cd160,p1h,2b4,pd1,tim3,ceacam(例如,ceacam-1,ceacam-3和/或ceacam-5),lag3,tigit,ctla-4,btla和lair1。在一个实施方案中,检查点抑制剂表达细胞与t调节,例如,cd25+细胞同时被去除。例如,抗cd25抗体或其片段,以及抗检查点抑制剂抗体,或其片段,可以附着到相同的珠子,所述珠子可以被用来除去细胞,或抗cd25抗体,或其片段,以及抗检查点抑制剂抗体,或其片段可以附着到单独的珠子,所述珠子的混合物可以用来除去细胞。在其他实施方案中,去除t调节细胞,例如,cd25+细胞,和除去检查点抑制剂表达细胞是顺序的,并且可以例如以任一顺序发生。
在一个实施方案中,可以选择表达下述的一种或多种的t细胞群:ifn-γ、tnfα、il-17a、il-2、il-3、il-4、gm-csf、il-10、il-13、粒酶b和穿孔蛋白或其它适合的分子例如其它细胞因子。用于筛选细胞表达的方法可以例如通过pct公开号wo2013/126712中描述的方法确定。
为了通过阳性或阴性选择分离所需细胞群,可以改变细胞和表面(例如颗粒如珠粒)的浓度。在某些实施方案中,可能需要显著降低其中珠粒和细胞混合在一起的体积(即,增加细胞的浓度),以确保细胞和珠粒的最大接触。例如,在一个实施方案中,使用的浓度为20亿个细胞/ml。在一个实施方案中,使用的浓度为10亿个细胞/ml。在另一个实施方案中,使用大于1亿个细胞/ml。在另一个实施方案中,使用1,1.5,2,2.5,3,3.5,4,4.5或5千万个细胞/ml的细胞浓度。在另一个实施方案中,使用75,80,85,90,95或100百万个细胞/ml的细胞浓度。在另外的实施方案中,可以使用1.25或1.50亿个细胞/ml的浓度。使用高浓度可以引起细胞产率提高、细胞活化和细胞扩增。进一步,使用高细胞浓度能够更有效地捕获可能弱表达目的靶抗原的细胞,比如cd28-阴性t细胞,或者从其中存在许多肿瘤细胞的样品(即,白血病血液、肿瘤组织等)更有效地捕获细胞。这样的细胞群可以具有治疗价值,并且将是期望得到的。例如,使用高浓度的细胞能够更有效地选择通常具有较弱cd28表达的cd8+t细胞。
在一个相关的实施方案,可能期望使用较低的细胞浓度。通过显著地稀释t细胞和表面(例如,粒子比如珠)的混合物,使粒子和细胞之间的相互作用最小化。这选择表达大量的期望结合粒子的抗原的细胞。例如,cd4+t细胞表达较高水平的cd28,并且在稀浓度中比cd8+t细胞更有效地被捕获。在一个实施方案,使用的细胞浓度为5×106/ml。在其它实施方案,使用的浓度可以为约1×105/ml至1×106/ml及其中任何整数值。
在其它实施方案,可以在2-10℃或在室温下在旋转器中以可变速率培养细胞可变的时间长度。
也可以在洗涤步骤之后冷冻用于刺激的t细胞。不希望受到理论的束缚,冷冻和随后的解冻步骤通过在细胞群中除去粒细胞及在一定程度上除去单核细胞来提供更均匀的产物。在除去血浆和血小板的洗涤步骤之后,将细胞悬浮在冷冻液中。虽然许多冷冻液和参数是本领域已知的且将适用于该情形,但是一种方法包括使用含有20%dmso和8%人血清白蛋白的pbs,或含有10%葡聚糖和5%葡萄糖、20%人血清白蛋白和7.5%dmso、或31.25%plasmalyte-a、31.25%葡萄糖5%、0.45%nacl、10%葡聚糖40和5%葡萄糖、20%人血清白蛋白和7.5%dmso的培养基,或含有例如hespan和plasmalyte的其它合适的细胞冷冻培养基,然后将细胞以1°/分钟的速率冷冻至-80℃并贮存在液氮贮槽的汽相中。可以使用控制冷冻的其它方法以及在-20℃下或在液氮中立即不受控制的冷冻。
在某些实施方案,将冷藏保存的细胞解冻并如本文所述洗涤,并且允许在室温下静置1小时,之后使用本发明的方法活化。
本发明的上下文中还涉及在可能需要如本文所述的扩增细胞之前的时间从受试者收集血样或单采血液成分术产物。因而,要扩增的细胞来源可以在任何必须的时间点收集,并且分离和冷冻期望的细胞比如t细胞用于随后用于许多将受益于t胞疗法的疾病或病症(如本文所述那些)的t细胞疗法中。在一个实施方案,血样或单采血液成分术是从一般健康受试者采集的。在某些实施方案,血样或单采血液成分术是从处于发展为疾病的风险中但还没有发展为疾病的一般健康受试者采集的,并且分离和冷冻目的细胞用于随后使用。在某些实施方案,t细胞可以扩增、冷冻和在随后时间使用。在某些实施方案,可以在诊断如本文所述的特定疾病之后不久但在任何治疗之前,从患者采集样品。在一个进一步的实施方案,在许多相关的治疗模式之前,从受试者的血样或单采血液成分术分离细胞,所述治疗模式包括但不限于用如下作用剂治疗:比如那他珠单抗(natalizumab)、艾法珠单抗(efalizumab)、抗病毒剂、化疗、放射、免疫抑制剂比如环孢菌素、硫唑嘌呤、甲氨蝶呤、麦考酚酯和fk506、抗体、或其它免疫烧蚀剂(immunoablativeagents)比如campath、抗cd3抗体、环磷酰胺、氟达拉滨、环孢菌素、fk506、雷帕霉素、麦考酚酸、类固醇、fr901228和照射。这些药物抑制钙依赖性磷酸酶钙调磷酸酶(环孢菌素和fk506)或抑制对生长因子诱导的信号传导重要的p70s6激酶(雷帕霉素)(liuetal.,cell66:807-815,1991;hendersonetal.,immun.73:316-321,1991;biereretal.,curr.opin.immun.5:763-773,1993)。在另一个实施方案中,为患者分离细胞并冷冻用于以后与骨髓或干细胞移植(例如,之前,同时或之后),t细胞消融治疗(使用化学治疗剂如氟达拉滨,外部光辐射治疗(xrt),环磷酰胺或抗体如okt3或campath)结合使用。在另一个实施方案中,在b细胞消融治疗例如与cd20反应的药剂如rituxan之后,将细胞事先分离并且可以冷冻用于随后治疗。
在本发明的一个进一步的实施方案,在给受试者留下功能性t细胞的治疗之后直接从患者获得t细胞。在这点上,已经观察到在一些癌症治疗之后,特别地用损害免疫系统的药物治疗之后,在患者通常从治疗恢复期间的治疗后不久,获得的t细胞的质量可能是最佳的或对其在离体扩增的能力有所改善。同样地,在使用本文所述方法离体处理之后,这些细胞可以对于增强移植和体内扩增处于优选的状态。因此,在本发明的上下文之内预期在该恢复期收集血细胞,包括t细胞、树突细胞或造血谱系的其它细胞。进一步,在某些实施方案,可以使用转移(例如,用gm-csf转移)和调节方案产生受试者中的条件,其中特别地在治疗之后的定义时间窗期间,特定细胞类型的再增殖、再循环、再生和/或扩增是有利的。示例性的细胞类型包括t细胞、b细胞、树突细胞及免疫系统的其它细胞。
在一个实施方案中,表达car分子,例如,本文所述的car分子的免疫效应细胞,是从已接受了低的免疫增强剂量的mtor抑制剂的受试者获得的。在一个实施方案中,免疫效应细胞,例如,t细胞的群体被工程化以表达car,在足够的时间之后被收获,或低的免疫增强剂量的mtor抑制剂的足够给药后被收获,以使得受试者中或从受试者收获的pd1阴性免疫效应细胞,例如,t细胞的水平,或pd1阴性免疫效应细胞(例如,t细胞)/pd1阳性免疫效应细胞(例如,t细胞)的比率至少暂时增加了。
在其他实施方案中,已经或将被工程化以表达car的免疫效应细胞,例如,t细胞群,可以通过用一定量的mtor抑制剂接触离体处理,所述mtor抑制剂增加pd1阴性免疫效应细胞,例如,t细胞的数目,或增加pd1阴性免疫效应细胞(例如,t细胞)/pd1阳性免疫效应细胞(例如,t细胞)的比率。
在一个实施方案中,t细胞群体是diaglycerol激酶(dgk)缺陷的。dgk缺陷型细胞包括不表达dgkrna或蛋白质,或具有降低的或抑制的dgk活性的细胞。可通过遗传方法来生成dgk缺陷的细胞,例如,施用rna干扰剂,例如,sirna,shrna,mirna,以减少或防止dgk表达。备选地,可通过用本文所述dgk抑制剂处理来产生dgk缺陷型细胞。
在一个实施方案中,t细胞群体是ikaros缺陷的。ikaros缺陷型细胞包括不表达ikarosrna或蛋白质的细胞,或具有降低的或抑制的ikaros活性的细胞,可通过遗传方法来生成ikaros缺陷的细胞,例如,施用rna干扰剂,例如,sirna,shrna,mirna,以减少或防止ikaros表达。备选地,可以通过用ikaros抑制剂,例如,来那度胺处理来产生ikaros缺陷的细胞。
在实施方案中,t细胞群体是dgk缺陷和ikaros缺陷的,例如,不表达dgk和ikaros,或具有降低或抑制的dgk和ikaros活性。此类dgk和ikaros缺陷的细胞可通过任何本文所述的方法产生。
在一个实施方案中,所述nk细胞得自受试者。在另一实施方案中,nk细胞是nk细胞系,例如,nk-92细胞系(conkwest)。
同种异体的car免疫效应细胞
在本文所述的实施方案中,免疫效应细胞可以是同种异体的免疫效应细胞,例如t细胞或nk细胞。例如,细胞可以是同种异体t细胞,例如功能性t细胞受体(tcr)和/或人类白细胞抗原(hla)(例如i类hla和/或ii类hla)表达不足的同种异体t细胞。
缺乏功能性tcr的t细胞可以例如被工程化使得其在其表面上不表达任何功能性tcr,被工程化为使得其不表达包含功能性tcr的一个或多个亚基(例如,经工程化使得其不表达(或表现出降低的表达)tcrα,tcrβ,tcrγ,tcrδ,tcrε和/或tcrζ)或被工程化,使得其在其表面上产生非常少的功能性tcr。或者,t细胞可以表达基本上受损的tcr,例如通过表达tcr的一个或多个亚基的突变或截短形式。术语“基本上受损的tcr”是指该tcr不会在宿主中引起不利的免疫反应。
本文所述的t细胞可以例如工程化以使得其在表面上不表达功能性hla。例如,本文所述的t细胞可以工程化以使得细胞表面表达hla(例如1类hla和/或ii类hla)下调。在一些方面,hla的下调可以通过减少或消除β-2微球蛋白(b2m)的表达来实现。
在某些实施方案中,t细胞可以缺乏功能性tcr和功能性hla(例如i类hla和/或ii类hla)。
缺乏功能性tcr和/或hla表达的修饰的t细胞可以通过任何合适的方法获得,包括一个或更多个tcr或hla的亚基的基因敲除(knockout)或基因敲减(knockdown)。例如,t细胞可以包括使用sirna、shrna、簇状的规则间隔的短回文重复序列(crispr)、转录活化因子样效应物核酸酶(talen)或锌指核酸内切酶(zfn)的tcr和/或hla的基因敲减。
在某些实施方案中,同种异体细胞可以是不表达或以低水平表达抑制性分子的细胞,例如通过本文所述任何方法。例如,细胞可以是不表达或以低水平表达抑制性分子的细胞,例如可以降低表达car的细胞建立免疫效应物应答的能力。抑制性分子的实例包括pd1、pd-l1、ctla4、tim3、ceacam(例如,ceacam-1、ceacam-3和/或ceacam-5)、lag3、vista、btla、tigit、lair1、cd160、2b4、cd80、cd86、b7-h3(cd276)、b7-h4(vtcn1)、hvem(tnfrsf14或cd270)、kir、a2ar、i类mhc、ii类mhc、gal9、腺苷、和tgfrβ。抑制性分子的抑制,例如通过在dna、rna或蛋白水平的抑制,可以优化表达car的细胞性能。在实施方案中,可以使用如本文所述的抑制性核酸,例如抑制性核酸,例如dsrna例如sirna或shrna,簇状的规则间隔的短回文重复序列(crispr)、转录活化因子样效应物核酸酶(talen)或锌指核酸内切酶(zfn)。
抑制tcr或hla的sirna和shrna
在一些实施方案中,可以在细胞中使用靶向编码tcr和/或hla和/或本文所述的抑制性分子(例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhc类ii,gal9,腺苷和tgfrβ)的核酸的sirna或shrna来抑制tcr表达和/或hla表达。
可以使用任何常规表达系统,例如比如慢病毒表达系统获得sirna和shrnas在t细胞中的表达。
下调tcr组分表达的示例性的shrnas描述在例如us公开号2012/0321667中。下调i类hla和/或ii类hla基因表达的示例性的sirna和shrna描述在例如美国公开号∶us2007/0036773中。
抑制tcr或hla的crispr
如本文中使用的“crispr”或“tcr和/或hla的crispr”或“抑制tcr和/或hla的crispr”是指簇状的规则间隔的短回文重复序列组或包括该重复序列组的系统。正如本文中使用的那样,“cas”是指crispr-相关的蛋白。“crispr/cas”系统指来源于crispr和cas的系统,其可用于沉默或突变tcr和/或hla基因,和/或本文所述的抑制性分子(例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷,和tgfrβ)。
天然存在的crispr/cas系统在约40%的测序的真核生物基因组和90%的测序的古细菌中存在。grissa等人(2007)bmcbioinformatics8:172.。该系统为一种原核免疫系统类型,其赋予对外来遗传元件(比如质粒和噬菌体)的抗性且提供一种形式的获得性免疫。barrangou等人(2007)science315:1709-1712;marragini等人(2008)science322:1843-1845。
crispr/cas系统已经修饰用于真核生物比如小鼠或灵长类中的基因编辑(沉默、增强或改变特异性基因)。wiedenheft等人(2012)nature482:331-8。这通过向真核细胞中引入含有特异性设计的crispr和一种或多种合适的cas来实现。
crispr序列,有时称为crispr基因座,包括交替重复序列和间隔区。在一种天然存在的crispr中,间隔区通常包括细菌的外源序列,比如质粒或噬菌体序列;在tcr和/或hlacrispr/cas系统中,间隔区来源于tcr或hla基因序列。
使来自crispr基因座的rna组成型表达并且通过cas蛋白质加工成小rna。这些包括侧接了重复序列的间隔区。rna指导其它cas蛋白质在rna或dna水平沉默外源性遗传元件。horvath等人(2010)science327:167-170;makarova等人(2006)biologydirect1:7。因此,类似于sirna,间隔区充当rna分子的模板。pennisi(2013)science341:833-836。
由于这些天然出现在许多不同类型的细菌中,crispr的精确排列和结构、cas基因的功能和数量以及其产物在各种物种与物种之间多少有些不同。haft等人(2005)ploscomput.biol.1:e60;kunin等人(2007)genomebiol.8:r61;mojica等人(2005)j.mol.evol.60:174-182;bolotin等人(2005)microbiol.151:2551-2561;pourcel等人(2005)microbiol.151:653-663;andstern等人(2010)trends.genet.28:335-340。例如,cse(cas亚型,大肠杆菌)蛋白质(例如,casa)形成功能性复杂的级联,其将crisprrna转录物加工成级联保留的间隔区-重复单元。brouns等人(2008)science321:960-964。在其它原核生物中,cas6加工crispr转录物。基于crispr的噬菌体在大肠杆菌中的灭活需要级联和cas3,而不需要cas1或cas2。在激烈热球菌(pyrococcusfuriosus)及其它原核生物中的cmr(casramp模块)蛋白质与小crisprrna形成识别和切割互补的靶rna的功能性复合体。更简单的crispr系统依赖于蛋白质cas9,其为具有两个活性切割位点的核酸酶,针对双螺旋的每条链各有一个。组合cas9和修饰的crispr基因座rna可用于基因编辑的系统。pennisi(2013)science341:833-836。
因此,crispr/cas系统可用于编辑tcr和/或hla基因(添加或缺失碱基对),或引入提前终止,其从而降低tcr和/或hla的表达。crispr/cas系统可以备选地使用,如rna干扰,以可逆的方式关闭tcr和/或hla基因。在哺乳动物细胞中,例如rna可以将cas蛋白质引导至tcr和/或hla启动子,在空间上阻断rna聚合酶。
可以使用本领域已知的技术,例如在美国公开号20140068797和cong(2013)science339:819-823中所述的技术,产生抑制tcr和/或hla的人工crispr/cas系统。也可产生本领域已知的抑制tcr和/或hla的其它人工crispr/cas系统,例如在tsai(2014)naturebiotechnol.,32:6569-576,美国专利号8,871,445;8,865,406;8,795,965;8,771,945;和8,697,359中描述的。
抑制tcr和/或hla的talen
“talen”或“hla和/或tcr的talen”或“抑制hla和/或tcr的talen”是指转录激活子样效应子核酸酶——一种人工核酸,其可用于编辑hla和/或tcr基因,和/或本文所述的抑制性分子(例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷,和tgfrβ)。
通过使tal效应物dna结合结构域与dna切割结构域融合来人工产生talen。可以把转录活化剂样效应(tales)工程化以结合任何期望的dna序列,包括hla或tcr基因的一部分。通过把工程化的tale与dna切割结构域组合,可以产生对于任何期望的dna序列(包括hla或tcr序列)特异性的限制性内切酶。然后,这些可以被引入到细胞中,其中它们可用于基因组编辑。boch(2011)naturebiotech.29:135-6;和boch等人(2009)science326:1509-12;moscou等人(2009)science326:3501。
tale是由黄单胞菌属(xanthomonas)细菌分泌的蛋白质。dna结合结构域含有重复的、高度保守的33-34个氨基酸序列,第12和13个氨基酸除外。这两个位置是高度可变的,显示与特异性核苷酸识别的强相关性。因此,它们可以被工程化以结合期望的dna序列。
为了产生talen,将tale蛋白质融合至核酸酶(n),其为野生型或突变的foki核酸内切酶。已经对foki进行了一些突变以使其用于talen;这些例如改善了切割的特异性或活性。cermak等人(2011)nucl.acidsres.39:e82;miller等人(2011)naturebiotech.29:143-8;hockemeyer等人(2011)naturebiotech.29:731-734;wood等人(2011)science333:307;doyon等人(2010)naturemethods8:74-79;szczepek等人(2007)naturebiotech.25:786-793;和guo等人(2010)j.mol.biol.200:96。
foki结构域起二聚体的作用,需要两个构建体,所述构建体具有针对具有合适的方向和间距的靶基因组中的位点的独特dna结合结构域。在taledna结合结构域和foki切割结构域之间的氨基酸残基数量和两个个体talen结合位点之间的碱基数量似乎是获得获得高水平活性的重要参数。miller等人(2011)naturebiotech.29:143-8。
可在细胞内使用hla或tcrtalen以产生双链断裂(dsb)。如果修复机制经由非同源端结合不适当地修复所述断裂,则可以在所述断裂位点处引入突变。例如,不合适的修复可能引入移码突变。备选地,可以把外源dna与talen一起引入到细胞中;取决于外源dna的序列和染色体的序列,该方法可被用于校正hla或tcr基因中的缺陷或将这样的缺陷引入到wthla或tcr基因中,从而减少hla或tcr的表达。
使用本领域已知的任何方法,包括使用模块组分的各种方案,可以构建对hla或tcr中的序列特异的talen。zhang等人(2011)naturebiotech.29:149-53;geibler等人(2011)plosone6:e19509。
抑制hla和/或tcr的锌指核酸酶
“zfn”或“锌指核酸酶”或“hla和/或tcr的zfn”或“抑制hla和/或tcr的zfn”是指锌指核酸酶——一种人工核酸酶,其可用于编辑hla和/或tcr基因,和/或本文所述的抑制性分子(例如pd1,pd-l1,pd-l2,ctla4,tim3,ceacam(例如,ceacam-1,ceacam-3和/或ceacam-5),lag3,vista,btla,tigit,lair1,cd160,2b4,cd80,cd86,b7-h3(cd276),b7-h4(vtcn1),hvem(tnfrsf14或cd270),kir,a2ar,mhci类,mhcii类,gal9,腺苷和tgfrβ)。
类似于talen,zfn包括与dna-结合结构域融合的foki核酸酶结构域(或其衍生物)。在zfn的情况下,dna-结合结构域包含一个或更多个锌指。carroll等人(2011)geneticssocietyofamerica188:773-782;和kim等人(1996)proc.natl.acad.sci.usa93:1156-1160。
锌指是被一个或更多个锌离子稳定的小蛋白结构基序。锌指可以包括例如cys2his2,并且可以识别约3-bp序列。可以把具有已知特异性的多种锌指组合来产生多指多肽,其识别约6、9、12、15或18-bp序列。可以利用多种选择和模块装配技术来产生识别特定序列的锌指(及其组合),包括噬菌体展示、酵母菌单杂交系统、细菌单杂交系统和细菌二杂交系统及哺乳动物细胞。
类似于talen,zfn必须二聚化才能切割dna。因此,要求一对zfn来靶向非回文结构的dna位点。两个单个的zfn必须与dna的相对链结合,并且其核酸酶被适当地间隔隔开。bitinaite等人(1998)proc.natl.acad.sci.usa95:10570-5。
也类似于talen,zfn可以在dna中产生双链断裂,如果没有适合地修复,则其可以产生移码突变,导致细胞中hla和/或tcr的表达和数量降低。zfn也可以被用于同源重组,以在hla或tcr的基因中突变。
使用本领域已知的任何方法可以构建对hla和/或tcr中的序列特异性的zfn。cathomen等人(2008)mol.ther.16:1200-7;和guo等人(2010)j.mol.biol.400:96;美国专利公开2011/0158957;和美国专利公开2012/0060230。
端粒酶表达
虽然不希望受任何特定理论的束缚,在一些实施方案中,由于在t细胞端粒缩短,治疗性t细胞具有在患者中短期持久性;相应地,用端粒酶基因转染能延长t细胞的端粒和改善患者中t细胞的持久性。见carljune,“adoptivetcelltherapyforcancerintheclinic”,journalofclinicalinvestigation,117:1466-1476(2007)。因此,在一个实施方案中,免疫效应细胞,例如,t细胞,异位表达端粒酶亚基,例如,端粒酶催化亚基,例如,tert,例如,htert。在一些方面,本公开内容提供了生产car表达细胞的方法,其包括将细胞与编码端粒酶亚基,例如,端粒酶催化亚基,例如,tert,例如,htert的核酸接触。该细胞可以在与编码car的构建体接触之前,同时或之后与所述核酸接触。
在一个方面,本公开内容描述了制备免疫效应细胞(例如,t细胞,nk细胞)群的方法。在一个实施方案中,该方法包括:提供免疫效应细胞(例如,t细胞或nk细胞)群,将免疫效应细胞群与编码car的核酸接触;和将免疫效应细胞群与编码端粒酶亚基例如,htert的核酸在允许car和端粒酶表达的条件下接触。
在一个实施方案中,编码端粒酶亚基的核酸是dna。在一个实施方案中,编码端粒酶亚基的核酸包含能够驱动端粒酶亚基的表达的启动子。
在实施方案中,htert具有genbank蛋白质idaac51724.1的氨基酸序列((meyersonetal.,“hest2,theputativehumantelomerasecatalyticsubunitgene,isup-regulatedintumorcellsandduringimmortalization”cellvolume90,issue4,22august1997,pages785–795)如下:
mpraprcravrsllrshyrevlplatfvrrlgpqgwrlvqrgdpaafralvaqclvcvpwdarpppaapsfrqvsclkelvarvlqrlcergaknvlafgfalldgarggppeafttsvrsylpntvtdalrgsgawglllrrvgddvlvhllarcalfvlvapscayqvcgpplyqlgaatqarppphasgprrrlgcerawnhsvreagvplglpapgarrrggsasrslplpkrprrgaapepertpvgqgswahpgrtrgpsdrgfcvvsparpaeeatslegalsgtrhshpsvgrqhhagppstsrpprpwdtpcppvyaetkhflyssgdkeqlrpsfllsslrpsltgarrlvetiflgsrpwmpgtprrlprlpqrywqmrplflellgnhaqcpygvllkthcplraavtpaagvcarekpqgsvaapeeedtdprrlvqllrqhsspwqvygfvraclrrlvppglwgsrhnerrflrntkkfislgkhaklslqeltwkmsvrgcawlrrspgvgcvpaaehrlreeilakflhwlmsvyvvellrsffyvtettfqknrlffyrksvwsklqsigirqhlkrvqlrelseaevrqhrearpalltsrlrfipkpdglrpivnmdyvvgartfrrekraerltsrvkalfsvlnyerarrpgllgasvlglddihrawrtfvlrvraqdpppelyfvkvdvtgaydtipqdrlteviasiikpqntycvrryavvqkaahghvrkafkshvstltdlqpymrqfvahlqetsplrdavvieqssslneassglfdvflrfmchhavrirgksyvqcqgipqgsilstllcslcygdmenklfagirrdglllrlvddfllvtphlthaktflrtlvrgvpeygcvvnlrktvvnfpvedealggtafvqmpahglfpwcgllldtrtlevqsdyssyartsirasltfnrgfkagrnmrrklfgvlrlkchslfldlqvnslqtvctniykilllqayrfhacvlqlpfhqqvwknptfflrvisdtaslcysilkaknagmslgakgaagplpseavqwlchqafllkltrhrvtyvpllgslrtaqtqlsrklpgttltaleaaanpalpsdfktild(seqidno:61)
在一个实施方案中,htert具有与seqidno:61的序列有至少80%,85%,90%,95%,96%,97%,98%,或99%同一性的序列。在一个实施例中,htert具有seqidno:61的序列。在一个实施方案中,htert包含n末端、c-末端、或两端的缺失(例如,不超过5,10,15,20,或30个氨基酸的缺失)。在一个实施方案中,htert包含n末端、c-末端、或两端的转基因氨基酸序列(例如,不超过5,10,15,20,或30个氨基酸)。
在一个实施方案中,htert由genbank登录号af018167的核酸序列编码(meyersonetal.,“hest2,theputativehumantelomerasecatalyticsubunitgene,isup-regulatedintumorcellsandduringimmortalization”cellvolume90,issue4,22august1997,pages785–795):
在一个实施方案中,htert由具有与seqidno:62的序列有至少80%,85%,90%,95%,96%,97%,98%,或99%同一性的序列的核酸编码。在一个实施方案中,htert是由seqidno:62的核酸编码。
细胞的活化和扩增
通常可以使用例如美国专利6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041;和美国专利公开号20060121005中所述的方法进行细胞的活化和扩增。
通常,本发明的t细胞通过与连接有刺激cd3/tcr复合体相关的信号的作用剂和刺激t细胞表面上的共刺激性分子的配体的表面接触进行扩增。特别地,可以如本文所述的刺激t细胞群,比如通过与抗-cd3抗体或其抗原结合片段、或固定在表面上的抗-cd2抗体接触,或通过与钙离子载体协同与蛋白激酶c活化剂(例如苔藓抑素)接触。为了共刺激t细胞表面上的辅助分子,使用结合辅助分子的配体。例如,可以在适于刺激t细胞增殖的条件下,使t细胞群与抗-cd3抗体和抗cd28抗体接触。为了刺激cd4+t细胞或cd8+t细胞的增殖,可以使用抗-cd3抗体和抗-cd28抗体。可以如本领域已知的其它常用方法那样使用抗-cd28抗体的实例,包括9.3、b-t3、xr-cd28(diaclone,
在某些实施方案,可以通过不同的方案提供用于t细胞的初次刺激信号和共刺激信号。例如,提供每种信号的作用剂可以在溶液中或被偶联至表面。当与表面偶联时,可以把所述作用剂偶联到相同的表面(即,“顺式”形式)或单独的表面(即,“反式”形式)。备选地,可以把一种作用剂偶联到表面,且另一种作用剂可以在溶液中。在一个实施方案,提供共刺激信号的作用剂与细胞表面结合,且提供一级活化信号的作用剂在溶液中或被偶联至表面。在某些实施方案,两种作用剂都可以在溶液中。在另一个实施方案,作用剂可以呈可溶性形式,然后被交联至表面,比如表达将会与该作用剂结合的fc受体或抗体或其它结合剂的细胞。在这点上,关于人工抗原呈递细胞(aapcs),参见例如美国专利申请公开号:20040101519和20060034810,考虑其在本发明中用于活化和扩增t细胞。
在一个实施方案,把两种作用剂都固定在珠上,在相同的珠上,即“顺式”,或在不同的珠上,即“反式”。例如,提供一级活化信号的作用剂是抗cd3抗体或其抗原结合片段,并且提供共刺激信号的作用剂是抗-cd28抗体或其抗原结合片段;并且两种作用剂以等同的分子数量被共同固定在相同珠上。在一个实施方案,使用与所述珠结合的每种抗体的1:1的比率,用于cd4+t细胞扩增和t细胞生长。在本发明的某些实施方案,使用与所述珠结合的抗cd3:cd28抗体的比率,使得与使用1:1的比率观察的扩增相比,观察到t细胞扩增的增加。在一个特别的实施方案,与使用1:1的比率观察的扩增相比,观察到约1至约3倍的增加。在一个实施方案,与所述珠结合的cd3:cd28抗体的比率范围为100:1至1:100及其中所有整数值。在本发明的一个方面,与粒子结合的抗-cd28抗体比抗cd3抗体多,即cd3:cd28的比率小于1。在某些实施方案,与珠结合的抗cd28抗体与抗cd3抗体的比率大于2:1。在一个特别的实施方案,使用1:100的与珠结合的抗体的cd3:cd28比率。在另一个实施方案,使用1:75的与珠结合的抗体的cd3:cd28比率。在一个进一步的实施方案,使用1:50的与珠结合的抗体cd3:cd28比率。在另一个实施方案,使用1:30的与珠结合的抗体的cd3:cd28比率。在一个优选的实施方案,使用1:10的与珠结合的抗体的cd3:cd28比率。在另一个实施方案,使用的与珠结合的抗体的1:3cd3:cd28比率。在还有一个实施方案中,使用3:1的与珠结合的抗体cd3:cd28比率。
可以使用1:500至500:1及其间任何整数值的粒子与细胞的比率来刺激t细胞或其它靶细胞。正如本领域普通技术人员可以容易地理解的那样,粒子与细胞的比率可以取决于相对于靶细胞的粒子尺寸。例如,小尺寸珠可能仅结合少数细胞,而较大珠可结合许多细胞。在某些实施方案,细胞与粒子的比率范围为1:100至100:1及其中任何整数值,并且在进一步的实施方案,也可以使用包括1:9至9:1的及其中任何整数值的比率来刺激t细胞。导致t细胞刺激的抗-cd3-和抗-cd28偶联的粒子与t细胞的比率可以如上所述变化,然而某些优选值包括1:100、1:50、1:40、1:30、1:20、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1和15:1,一个优选的比率为至少1:1的粒子/t细胞。在一个实施方案,使用1:1或更小的粒子与细胞的比率。在一个特别的实施方案,优选的粒子:细胞比率为1:5。在进一步的实施方案,粒子与细胞的比率可以根据刺激的天数变化。例如,在一个实施方案,在第一天,粒子与细胞的比率为1:1至10:1,并且此后每天或每隔一天向细胞中加入另外的粒子,直到10天,最终比率为1:1至1:10(基于加入当天的细胞计数)。在一个特别的实施方案,在刺激的第一天,粒子与细胞的比率为1:1,并在刺激的第三天和第五天调节为1:5。在另一个实施方案,以每日或每隔一天为基准加入粒子至刺激的第一天最终比为1:1,且在刺激的第三天和第五天为1:5。在一个特别的实施方案,在刺激的第一天,粒子与细胞的比率为2:1,并在刺激的第三天和第五天调节为1:10。在另一个实施方案,以每日或每隔一天为基准加入粒子至刺激的第一天最终比为1:1,且在刺激的第三天和第五天为1:10。本领域技术人员应当理解多种其它比率都可以适用于本发明。特别地,比率将根据粒径及细胞尺寸和类型而变化。在一个实施方案,在第一天,最典型的使用比率为约1:1、2:1和3:1左右。
在本发明的进一步的实施方案,将细胞比如t细胞与作用剂包被的珠混合,接着分离珠和细胞,然后培养细胞。在备选的实施方案,在培养之前,作用剂-包被的珠和细胞没有分离,而是一起培养。在一个进一步的实施方案,首先通过施加力(比如磁力)浓缩珠和细胞,导致细胞表面标记物的连接增加,从而诱导细胞刺激。
例如,可以通过允许附着了抗-cd3和抗-cd28的顺磁性的珠(3x28珠)与t细胞接触来连接细胞表面蛋白。在一个实施方案,将细胞(例如104至109个t细胞)和珠(例如,比率1:1的
在一个实施方案中,通过例如本文所述的方法扩增用编码car,例如,本文所述的nkr-car的核酸转导的细胞。在一个实施方案中,将细胞在培养中扩增几个小时(例如,约2,3,4,5,6,7,8,9,10,15,18,21小时)到约14天(例如,1,2,3,4,5,6,7,8,9,10,11,12,13或14天)。在一个实施方案中,细胞被扩增4至9天。在一个实施方案中,细胞被扩增8天或更短,例如,7,6或5天。在一个实施方案中,所述细胞,例如,本文所述的nkr-car细胞在培养中扩增5天,所得细胞比相同的培养条件下培养扩增9天的相同的细胞更有效。效力可以通过例如,由不同的t细胞的功能,例如增殖,靶细胞杀伤,细胞因子的产生,活化,迁移,或它们的组合来定义。在一个实施方案中,相比于在相同培养条件下扩增9天的相同细胞,扩增了5天的细胞,例如,本文所述的nkr-car细胞显示细胞倍增的至少1、2、3或4倍增加。在一个实施方案中,所述细胞,例如,表达本文所述的nkr-car的细胞培养扩增了5天,并且相比于在相同培养条件下扩增9天的相同细胞,所得的细胞显示出更高的促炎细胞因子产生,例如,ifn-γ和/或gm-csf的水平。在一个实施方案中,相比于在相同培养条件下扩增9天的相同细胞,扩增了5天的细胞,例如,本文所述的nkr-car细胞显示出促炎细胞因子产生,例如,ifn-γ和/或gm-csf的水平以pg/ml计至少1、2、3、4、5、10倍或更多倍的增加。
在本发明的一个实施方案中,混合物可以培养数小时(约3小时)至约14天,或之间的任何小时整数值。在另一个实施方案中,混合物可以培养21天。在本发明的一个实施方案中,将珠粒和t细胞一起培养约八天。在另一个实施方案中,珠粒和t细胞一起培养2-3天。也可能需要几个刺激循环,使得t细胞的培养时间可以为60天或以上。适于t细胞培养的条件包括合适的培养基(例如,极限必需培养基或rpmi培养基1640或x-vivo15,(lonza)),其可以含有增殖和生存所必需的因子,包括血清(例如胎牛血清或人血清)、白介素-1(il-2)、胰岛素、ifn-γ、il-4、il-7、gm-csf、il-10、il-12、il-15、tgfβ和tnf-α或本领域技术人员已知用于细胞生长的任何其它添加剂。用于细胞生长的其它添加剂包括,但不限于表面活性剂、plasmanate和还原剂比如n-乙酰基半胱氨酸和2-巯基乙醇。培养基可以包括rpmi1640、aim-v、dmem、mem、α-mem、f-12、x-vivo15和x-vivo20、optimizer,具有加入的氨基酸、丙酮酸钠和维生素、无血清或补充有适合量的血清(或血浆)或定义的激素组、和/或足以使t细胞生长和扩增的量的细胞因子。抗生素,例如青霉素和链霉素,仅包括在实验培养物中,而不在输注到受试者中的细胞培养物中。靶细胞保持在载体生长必需的条件下,例如适合的温度(例如37℃)和气氛(例如,空气加5%co2)。
在一个实施方案中,将细胞在合适的培养基(如,本文中所描述的培养基)中扩增,所述培养基包括导致细胞在14天的扩增期间增加至少200倍(例如,200倍,250倍,300倍,350倍)的一种或多种白介素,例如,如通过本文所述的方法如流式细胞术测定。在一个实施方案中,将细胞在il-15和/或il-7(例如il-15和il-7)存在下扩增。
在实施方案中,本文描述的方法,例如,car表达细胞的制造方法,包括例如,用抗cd25抗体或其片段,或cd25-结合配体il-2从细胞群体除去调节性t细胞,例如,cd25+t细胞。从细胞群体除去调节性t细胞,例如,cd25+t细胞的方法在本文中描述。在实施方案中,这些方法,例如,制造方法,进一步包括将细胞群(例如,其中调节性t细胞,例如cd25+t细胞已耗尽的细胞群;或已预先接触抗cd25抗体,或其片段,或cd25-结合配体的细胞群)与il-15和/或il-7接触。例如,细胞群(例如,已经预先接触抗cd25抗体,其片段,或cd25-结合配体的细胞群)在il-15和/或il-7的存在下扩增。
在一些实施方案中,在制造car表达细胞期间,本文所述的car表达细胞与包含白介素-15(il-15)多肽,白介素15受体α(il-15ra)多肽,或il-15多肽和il-15ra多肽例如,hetil-15的组合的组合物离体接触。在实施方案中,本文所述的car表达细胞与包含il-15多肽的组合物在制造car表达细胞期间例如,离体接触。在实施方案中,本文所述的car表达细胞与包含il-15多肽和il-15ra多肽的组合的组合物在制造car表达细胞期间,例如,离体接触。在实施方案中,本文所述的car表达细胞与包含hetil-15的组合物在制造car表达细胞期间,例如,离体接触。
在一个实施方案中,本文描述的car表达细胞与包含hetil-15的组合物在离体扩增期间接触。在一个实施方案中,本文描述的car表达细胞与包含il-15多肽的组合物在离体扩增期间接触。在一个实施方案中,本文描述的car表达细胞与包含il-15多肽和il-15ra多肽的组合物在离体扩增期间接触。在一个实施方案中,接触导致淋巴细胞亚群例如,cd8+t细胞的存活和增殖。
已经暴露于不同刺激时间的t细胞可以显示出不同的特征。例如,典型的血液或单采血液成分术外周血单核细胞产物具有大于细胞毒性或抑制t细胞群(tc,cd8+)的辅助t细胞群(th,cd4+)。通过刺激cd3和cd28受体的离体t细胞扩增产生t细胞群,该细胞群在约第8-9天前主要由th细胞组成,而在约第8-9天之后,t细胞群包括越来越大的tc细胞群。因此,根据治疗的目的,向受试者输注主要包括th细胞的t细胞群可能是有利的。类似地,如果已经分离了tc细胞的抗原特异性亚组,则使该亚组在更大程度上扩增可能是有益的。
进一步,除了cd4和cd8标记物之外,其它表型标记物显著变化,但大部分在细胞扩增过程中可再重现。因此,这样的可重现性使能够针对特定目的裁剪活化的t细胞产物。
备选地或与本文公开的方法组合,公开了用于以下一种或多种的方法和组合物:检测和/或定量car表达细胞(例如体外或体内(例如临床监测));免疫细胞扩增和/或活化;和/或car特异性选择,其涉及使用car配体。在一个示例性实施方案中,car配体是结合car分子的抗体,例如结合car的细胞外抗原结合结构域的抗体(例如,结合抗原结合结构域的抗体,例如抗独特型抗体;或结合细胞外结合结构域的恒定区的抗体)。在其它实施方案中,car配体是car抗原分子(例如本文所述的car抗原分子)。
一方面,公开了一种用于检测和/或定量car表达细胞的方法。例如,car配体可用于在体外或体内检测和/或定量car表达细胞(例如,临床监测患者中car表达细胞或对患者给药)。该方法包括:
提供car配体(任选地,标记的car配体,例如包括标签,珠,放射性或荧光标记的car配体);
获取car表达细胞(例如,获取含有car表达细胞的样品,例如制造样品或临床样品);
在发生结合的条件下使car表达细胞与car配体接触,从而检测存在的car表达细胞的水平(例如,量)。car表达细胞与car配体的结合可以使用标准技术如facs,elisa等检测。
另一方面,公开了扩增和/或激活细胞(例如免疫效应细胞)的方法。该方法包括:
提供car表达细胞(例如,第一car表达细胞或瞬时表达car细胞);
在发生免疫细胞扩增和/或增殖的条件下使所述car表达细胞与car配体例如本文所述的car配体接触,从而产生活化和/或扩增的细胞群体。
在某些实施方案中,car配体存在于(例如,固定化或连接到)基质,例如非天然存在的基质上。在一些实施方案中,基质是非细胞基质。非细胞基质可以是选自例如平板(例如,微量滴定板),膜(例如硝酸纤维素膜),基质,芯片或珠粒的固相支持体。在实施方案中,car配体存在于基质(例如,在基质表面上)。car配体可以固定,附着或共价或非共价结合(例如交联)至基质。在一个实施方案中,将car配体连接(例如共价连接)到珠粒上。在上述实施方案中,免疫细胞群可以在体外或离体扩增。该方法还可以包括在car分子的配体存在下培养免疫细胞群体,例如使用本文所述的任何方法。
在其它实施方案中,扩增和/或活化细胞的方法还包括添加第二刺激分子例如cd28。例如,car配体和第二刺激分子可固定在基质例如一个或多个珠粒上,从而提供增加的细胞扩增和/或活化。
另一方面,提供了一种用于选择或富集car表达细胞的方法。该方法包括使car表达细胞与本文所述的car配体接触;并基于car配体的结合选择细胞。
在其它实施方案中,提供了用于消耗,减少和/或杀死car表达细胞的方法。该方法包括使car表达细胞与本文所述的car配体接触;并基于car配体的结合靶向细胞,从而减少car表达细胞的数量和/或杀死car表达细胞。在一个实施方案中,car配体与毒性剂(例如毒素或细胞消融性药物)偶联。在另一个实施方案中,抗独特型抗体可以引起效应细胞活性,例如adcc或adc活性。
可以在本文公开的方法中使用的示例性抗car抗体描述于例如wo2014/190273和jjenaetal.,“chimericantigenreceptor(car)-specificmonoclonalantibodytodetectcd19-specifictcellsinclinicaltrials”,plosmarch20138:3e57838,其内容通过引用并入。在一个实施方案中,抗独特型抗体分子识别抗cd19抗体分子,例如抗cd19scfv。例如,抗独特型抗体分子可以竞争与cd19特异性carmab克隆号136.20.1(描述于jenaetal.,plosmarch20138:3e57838)的结合;可以具有与cd19特异性carmab克隆号136.20.1相同的cdr(例如,全部vhcdr1,vhcdr2,chcdr3,vlcdr1,vlcdr2和vlcdr3中的一个或多个,使用kabat定义,chothia定义或kabat定义和chothia定义的组合);可以具有如cd19特异性carmab克隆号136.20.1的一个或多个(例如2个)可变区,或可以包含cd19特异性carmab克隆号136.20.1。在一些实施方案中,抗独特型抗体根据jena等所述的方法制备。在另一个实施方案中,抗独特型抗体分子是wo2014/190273中描述的抗独特型抗体分子。在一些实施方案中,抗独特型抗体分子具有与wo2014/190273的抗体分子如136.20.1相同的cdr(例如,vhcdr1,vhcdr2,chcdr3,vlcdr1,vlcdr2和vlcdr3中的一个或多个,例如全部);可以具有wo2014/190273的抗体分子的一个或多个(例如2个)可变区,或者可以包含wo2014/0273的抗体分子,例如136.20.1。在其它实施方案中,抗car抗体结合car分子的细胞外结合结构域的恒定区,例如如wo2014/190273中所述。在一些实施方案中,抗car抗体结合car分子的细胞外结合结构域的恒定区,例如重链恒定区(例如ch2-ch3铰链区)或轻链恒定区。例如,在一些实施方案中,抗car抗体竞争与wo2014/190273中描述的2d3单克隆抗体的结合,具有与2d3相同的cdr(例如,vhcdr1,vhcdr2,chcdr3,vlcdr1,vlcdr2和vlcdr3的一个或多个,例如全部),或具有2d3的一个或多个(例如2个)可变区,或包含如wo2014/190273中所述的2d3。
在一些方面和实施方案中,本文的组合物和方法针对t细胞的特定子集进行了优化,例如如2014年7月31日提交的美国系列号62/031,699中所述,其内容通过引用整体并入本文。在一些实施方案中,与对照t细胞(例如表达相同构建体的不同类型的t细胞(例如,cd8+或cd4+))相比,t细胞的优化子集显示增强的持续性。
在一些实施方案中,cd4+t细胞包含本文所述的car,所述car包含适于cd4+t细胞(例如,为例如导致增强的持久性而优化)的胞内信号传导结构域,例如icos结构域。在一些实施方案中,cd8+t细胞包含本文所述的car,所述car包含适于cd8+t细胞(例如,为例如导致增强的持久性而优化)的胞内信号传导结构域,例如4-1bb结构域,cd28结构域或icos结构域以外的另一共刺激结构域。在一些实施方案中,本文所述的car包含本文所述的抗原结合结构域,例如包含与本文所述的肿瘤抗原特异性结合的抗原结合结构域的car。
在一方面,本文描述了治疗受试者,例如患有癌症的受试者的方法。该方法包括向所述受试者施用有效量的:
1)包含car的cd4+t细胞(carcd4+)
其包含:
抗原结合结构域,例如本文所述的抗原结合结构域,例如特异性结合本文所述的肿瘤抗原的抗原结合结构域;
跨膜结构域;和
胞内信号传导结构域,例如第一共刺激结构域,例如icos结构域;和
2)包含car的cd8+t细胞(carcd8+),其包含:
抗原结合结构域,例如本文所述的抗原结合结构域,例如特异性结合本文所述的肿瘤抗原的抗原结合结构域;
跨膜结构域;和
胞内信号传导结构域,例如第二共刺激结构域,例如4-1bb结构域,cd28结构域或除icos结构域之外的另一共刺激结构域;
其中carcd4+和carcd8+彼此不同。
任选地,所述方法还包括施用:
3)包含car的第二cd8+t细胞(第二carcd8+),其包含:
抗原结合结构域,例如本文所述的抗原结合结构域,例如特异性结合本文所述的肿瘤抗原的抗原结合结构域;
跨膜结构域;和
胞内信号传导结构域,其中第二carcd8+包含不存在于carcd8+上的胞内信号传导结构域,例如共刺激信号传导结构域,并且任选地不包含icos信号传导结构域。
car活性测定
一旦构建本文所述的car,例如,nkr-car,则可以使用多种试验来评价分子的活性,比如但不限于在抗原刺激后扩增t细胞的能力、在不存在再刺激下维持t细胞扩增和在适合的体外和动物模型中的抗癌活性。用于评价nkr-car的效应的试验在下文进一步详细描述。
可以使用对原代t细胞中nkr-car表达的蛋白质印迹分析来检测单体和二聚体的存在。参见,例如milone等人,moleculartherapy17(8):1453-1464(2009)。非常简要地,让表达car的t细胞(cd4+和cd8+t细胞的1:1混合物)在体外扩增超过10天,随后在还原条件下进行细胞溶解和sds-page。使用对car组分(例如nkr组分,例如kir组分)特异性的抗体,通过蛋白质印迹检测car。在非还原条件下,将相同的t细胞亚群用于sds-page分析,以允许评估共价二聚体形成。
可以通过流式细胞测量术测量抗原刺激后car+t细胞的体外扩增。例如,用αcd3/αcd28aapc刺激cd4+和cd8+t细胞的混合物,接着在要被分析的启动子的控制下用表达gfp的慢病毒载体转导。示例性的启动子包括cmvie基因、ef-1α、泛素c或磷酸甘油激酶(pgk)启动子。在第6天,通过流式细胞测量术测量cd4+和/或cd8+t细胞亚组中培养物的gfp荧光。参见,例如milone等人,moleculartherapy17(8):1453-1464(2009)。备选地,在第0天,用αcd3/αcd28包被的磁珠刺激cd4+和cd8+t细胞的混合物,并在第1天使用表达car的双顺反子慢病毒载体用car转导以及使用2a核醣体跳跃序列用egfp转导。用表达肿瘤抗原的k562细胞,野生型k562细胞(k562野生型)或不表达肿瘤抗原的阴性对照细胞再刺激培养物。每隔一天,向培养物中加入100iu/ml的外源性il-2。通过流式细胞术,使用基于珠的计数对gfp+t细胞计数。参见,例如milone等人,moleculartherapy17(8):1453-1464(2009)。
也可以测量在不存在再刺激下保持的car+t细胞扩增。参见,例如milone等人,moleculartherapy17(8):1453-1464(2009)。简而言之,在第0天用αcd3/αcd28包被的磁珠刺激,并在第1天用指定的car转导,在培养的第8天,使用coultermultisizeriii粒子计数器、nexcelomcellometervision或milliporescepter测量平均t细胞体积(fl)。
动物模型也可用于测量car表达细胞的活性。例如,可以在免疫缺陷小鼠中使用异种移植模型,其使用人间皮素特异性kir-car+t细胞治疗表达间皮素的原发性人类癌症,例如间皮瘤或卵巢癌。参见例如miloneetal.,moleculartherapy17(8):1453-1464(2009)。简言之,在建立肿瘤后,将小鼠随机分为治疗组。施用不同数量的表达car的t细胞。可以在各个时间点监测car表达细胞的car表达和增殖/持续性。以每周间隔评估动物的肿瘤进展。使用对数秩检验比较组的存活曲线。可以评估剂量依赖性car治疗反应。见,例如,miloneetal.,moleculartherapy17(8):1453-1464(2009)。
之前已经描述了对car表达细胞的细胞增殖和细胞因子产生的评价,例如milone等人,moleculartherapy17(8):1453-1464(2009)。简而言之,在微量滴定板中通过将洗涤的t细胞与表达cd19(k19)或cd32和cd137(kt32-bbl)的k562细胞混合,直至最终t细胞:k562比率为2:1,来评价car-介导的增殖,k562细胞在使用前用γ照射辐射。将抗-cd3(克隆okt3)和抗-cd28(克隆9.3)单克隆抗体添加到含有kt32-细胞的培养物中,作为刺激t-细胞增殖的阳性对照,因为这些信号支持长期cd8+t细胞离体扩增。如制造商所描述的,使用countbrighttm荧光珠(invitrogen,carlsbad,ca)和流式细胞术对培养物中的t细胞计数。通过gfp表达,使用以egfp-2a连接的表达car的慢病毒载体工程化的t细胞来鉴定car+t细胞。对于不表达gfp的car+t细胞,用生物素化的重组的肿瘤抗原和二级抗生物素蛋白-pe缀合物检测car+t细胞。也用特异性单克隆抗体(bdbiosciences)同时检测t细胞上的cd4+和cd8+表达。根据制造商的说明,使用人类th1/th2细胞因子细胞计数珠阵列试剂盒(bdbiosciences,sandiego,ca),或使用luminex30-plex试剂盒(invitrogen)对再刺激之后24小时收集的上清液进行细胞因子测量。使用bdfortessa流式细胞仪评价荧光,并根据制造商的说明分析数据。类似的实验可以用cd123carts进行。
可以通过标准51cr-释放测定评价细胞毒性。参见,例如milone等人,moleculartherapy17(8):1453-1464(2009)。简而言之,在37℃下,在频繁搅拌下,给靶细胞(例如,表达肿瘤抗原的k562系和原代肿瘤细胞)负载51cr(如nacro4,newenglandnuclear,boston,ma)2小时,在完全rpmi中洗涤2次,并铺板到微量滴定板中。在各孔中,在完全rpmi中,以可变的效应物细胞:靶细胞(e:t)比率,使效应物t细胞与靶细胞混合。还制备了仅含有培养基(自发释放,sr)或氚-x100洗涤剂的1%溶液(总释放,tr)的另外的孔。在37℃下培养4小时之后,收集来自每个孔的上清液。然后,使用γ粒子计数器(packardinstrumentco.,waltham,ma)测量释放的51cr。每个条件至少一式三份进行,并使用下式计算溶解的百分数∶溶解%=(er-sr)/(tr-sr),其中er代表每种实验条件下释放的平均51cr。
成像技术可用于在荷瘤动物模型中评价car的特异性运输和增殖。此类测定法已被描述于,例如,barrettetal.,humangenetherapy22:1575-1586(2011)。简单地说,nod/scid/γc–/–(nsg)小鼠用nalm-6细胞静脉内注射,7天后用以car构建体电穿孔后4小时的t细胞注射。该t细胞用慢病毒构建体稳定地转染以表达萤火虫萤光素酶,并且对小鼠成像用于生物发光。备选地,可以如下测定nalm-6异种移植模型中car+t细胞的单次注射的治疗效果和特异性:nsg小鼠注射经转导而稳定表达萤火虫萤光素酶的nalm-6,7天后接着单次尾静脉注射用car电穿孔的t细胞。将动物在注射后不同点时间成像。例如,可以产生在第5天(治疗前2天)和第8天(car+pbl后24小时)代表性小鼠中萤火虫萤光素酶阳性白血病的光子密度热图。
其它试验,包括本文实施例部分中所述的那些试验以及本领域已知的那些试验,也可以被用于评价本发明的car构建体。
治疗应用
本发明包括经修饰以表达nkr-car,例如kir-car或多种类型的nkr-car(例如kir-car)的细胞(例如,t细胞或nk细胞),其中每个nkr-car,例如kir-car,将特异性抗体的抗原识别结构域与nkr(例如kir)的组分组合。
在一个实施方案中,本发明的kir-car包含活化kir,其通过与含有基于免疫酪氨酸的活化基序(itam)的膜蛋白dap12的相互作用传递其信号,所述相互作用由这些蛋白质的跨膜结构域内的残基介导。
在一个实施方案中,本发明的kir-car包含抑制性kir,其通过与细胞质信号传导蛋白如shp-1,shp-2和vav家族蛋白直接或间接相互作用的一个或多个基于免疫酪氨酸的抑制基序(itim)传递其信号。带有含有itim的胞质结构域的kir消除激活信号,导致nk细胞溶解和细胞因子产生活性的抑制。在一些情况下,表达本发明的kir-car的经修饰的t细胞可以引发kir-car介导的t细胞应答。在一个实施方案中,结合多于一种类型的抗原的依赖性允许经修饰的t细胞表现出更高的特异性,以在结合肿瘤细胞而不是正常旁观者细胞时引发反应。
本发明提供多种类型的kir-car的用途,以将原代t细胞的特异性重定向到肿瘤抗原。因此,本发明还提供了一种刺激对哺乳动物中的靶细胞群体或组织的t细胞介导的免疫应答的方法,包括向哺乳动物施用表达多种类型的kir-car的t细胞的步骤,其中每种类型的kir-car包含与预定靶标特异性相互作用的结合部分。在一个实施方案中,细胞包含含有活化kir的第一kir-car(actkir-car)和包含抑制性kir的第二kir-car(inhkir-car)。
不希望受任何特定理论的约束,由kir-car修饰的t细胞引起的抗肿瘤免疫应答可能是主动或被动免疫应答。此外,kir-car介导的免疫应答可能是过继性免疫治疗方法的一部分,其中kir-car修饰的t细胞诱导对kir-car中抗原结合结构域特异性的免疫应答。
可以治疗的癌症包括没有血管化或尚未基本上血管化的肿瘤以及血管化的肿瘤。癌症可以包括非实体肿瘤(例如血液肿瘤,例如白血病和淋巴瘤),或者可以包括实体瘤。用本发明的car治疗的癌症的类型包括但不限于癌,胚细胞瘤和肉瘤,以及某些白血病或淋巴恶性肿瘤,良性和恶性肿瘤以及恶性肿瘤例如肉瘤,癌和黑素瘤。还包括成人肿瘤/癌症和儿科肿瘤/癌症。在一个实施方案中,待治疗的癌症是实体瘤,例如在本文所述的实体瘤。
血液癌是血液或骨髓的癌症。血液(或血源性)癌的实例包括白血病,包括急性白血病(如急性淋巴细胞白血病,急性粒细胞白血病,急性骨髓性白血病和成髓细胞性,前髓细胞性,骨髓单核细胞性,单核细胞性和红白血病),慢性白血病(如慢性髓细胞性(粒细胞)白血病,慢性骨髓性白血病和慢性淋巴细胞性白血病),真性红细胞增多症,淋巴瘤,霍奇金病,非霍奇金淋巴瘤(无痛和高级别形式),多发性骨髓瘤,瓦尔登斯特伦巨球蛋白血症,重链疾病,骨髓增生异常综合征,毛细胞白血病和骨髓增生异常。
实体瘤是通常不含囊肿或液体区域的异常组织块。实体瘤可以是良性或恶性的。不同类型的实体瘤根据形成它们的细胞类型命名(如肉瘤,癌和淋巴瘤)。实体瘤例如肉瘤和癌的例子包括纤维肉瘤,粘液肉瘤,脂肪肉瘤,软骨肉瘤,骨肉瘤和其他肉瘤,滑膜瘤,间皮瘤,尤因氏肿瘤,平滑肌肉瘤,横纹肌肉瘤,结肠癌,淋巴恶性肿瘤,胰腺癌,乳腺癌,肺癌,卵巢癌,前列腺癌,肝细胞癌,鳞状细胞癌,基底细胞癌,腺癌,汗腺癌,甲状腺髓样癌,甲状腺乳头状癌,嗜铬细胞瘤,皮脂腺癌,乳头状癌,乳头状腺癌,髓样癌,支气管原癌,肾细胞癌,肝癌,胆管癌,绒毛膜癌,肾母细胞瘤,宫颈癌,睾丸肿瘤,精原细胞瘤,膀胱癌,黑素瘤和cns肿瘤(如神经胶质瘤(如脑干胶质瘤和混合神经胶质瘤)),成胶质细胞瘤(也称为多形性胶质母细胞瘤)、星形细胞瘤,cns淋巴瘤,生殖细胞瘤,髓母细胞瘤,许旺细胞瘤,颅咽管瘤,室管膜瘤,松果体瘤,血管母细胞瘤,听神经瘤,少突胶质细胞瘤,脑膜瘤,神经母细胞瘤,视网膜母细胞瘤和脑转移瘤)。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达cd19car(例如具有本文所述的抗cd19结合结构域)的免疫效应细胞(例如t细胞,nk细胞)治疗癌症的方法,其中所述癌细胞表达cd19。在一个实施方案中,待治疗的癌症是all(急性淋巴细胞白血病),cll(慢性淋巴细胞白血病),dlbcl(弥漫性大b细胞淋巴瘤),mcl(套细胞淋巴瘤)或mm(多发性骨髓瘤)。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达egfrviiicar的免疫效应细胞(例如,t细胞,nk细胞)来治疗癌症的方法,所述egfrviiicar例如具有本文所述的抗egrfviii结合结构域,其中所述癌细胞表达egfrviii。在一个实施方案中,待治疗的癌症是成胶质细胞瘤。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达间皮素car(例如具有本文所述的抗间皮素结合结构域)的免疫效应细胞(例如,t细胞,nk细胞)治疗癌症的方法,其中癌细胞表达间皮素。在一个实施方案中,待治疗的癌症是实体瘤,例如本文所述的实体瘤,例如间皮瘤,胰腺癌,肺癌或卵巢癌。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达例如具有本文所述的抗cd123结合结构域的cd123car的免疫效应细胞(例如,t细胞,nk细胞)治疗癌症的方法,其中所述癌细胞表达cd123。在一个实施方案中,待治疗的癌症是aml。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达例如具有本文所述的抗cll-1结合结构域的cll-1car的免疫效应细胞(例如,t细胞,nk细胞)来治疗癌症的方法,其中所述癌细胞表达cll-1。在一个实施方案中,待治疗的癌症是aml。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达例如具有本文所述的抗cd33结合结构域的cd33car的免疫效应细胞(例如,t细胞,nk细胞)治疗癌症的方法,其中所述癌细胞表达cd33。在一个实施方案中,待治疗的癌症是aml。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达例如具有本文所述的抗gd2结合结构域的gd2car的免疫效应细胞(例如,t细胞,nk细胞)治疗癌症的方法,其中所述癌细胞表达gd2。在一个实施方案中,待治疗的癌症是神经母细胞瘤。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达邻乙酰基-gd2car的免疫效应细胞(例如,t细胞,nk细胞)来治疗癌症的方法,其中所述癌细胞表达邻乙酰基-gd2。在一个实施方案中,待治疗的癌症是神经母细胞瘤或黑素瘤。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达例如具有本文所述的抗-bcma结合结构域的bcmacar的免疫效应细胞(例如,t细胞,nk细胞)来治疗癌症的方法,其中所述癌细胞表达bcma。在一个实施方案中,待治疗的癌症是多发性骨髓瘤。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达例如具有本文所述的抗cldn6结合结构域的cldn6car的免疫效应细胞(例如,t细胞,nk细胞)来治疗癌症的方法,其中所述癌细胞表达cldn6。在一个实施方案中,待治疗的癌症是实体瘤,例如本文所述的实体瘤,例如卵巢癌,肺癌或乳腺癌。
在一个实施方案中,本公开提供了通过向有需要的受试者提供经工程化以表达例如具有本文所述的抗wt1结合结构域的wt1car的免疫效应细胞(例如,t细胞,nk细胞)来治疗癌症的方法,其中所述癌细胞表达wt1。
在一个实施方案中,本发明的kir-car细胞例如t细胞或nk细胞的抗原结合结构域被设计为治疗特定的癌症。在一个实施方案中,修饰本发明的kir-car细胞,例如t细胞或nk细胞,以表达靶向第一抗原的第一actkir-car和靶向第二抗原的第二inhir-car,其中第一抗原在特定肿瘤或癌症上表达,并且第二抗原不在特定肿瘤或癌症上表达。以这种方式,通过将actkir-car(或携带针对感兴趣的恶性细胞上的抗原的scfv的标准tcr-ζcar)和携带例如针对存在于正常但不是恶性组织的抗原的scfv的inhkir-car的衔接产生的t细胞的条件活化提供了当kir-cart细胞遇到正常细胞时对来自actkir-car的激活信号的抑制。作为抑制性car的有用靶标的抗原的实例包括肝配蛋白受体(pasquale,2010,natrevcancer10(3):165-80)和密蛋白(singhetal.,2010,joncol,2010:541957),其由正常组织的上皮细胞表达,但通常由癌症选择性地丧失(例如epha7)。
间皮素表达疾病和病症的治疗应用
本发明提供用于治疗与间皮素表达相关的疾病和病症的组合物和方法。与间皮素表达相关的疾病或病症的实例包括间皮瘤(例如胸膜间皮瘤,腹膜间皮瘤,心包间皮瘤),胰腺癌或卵巢癌。与间皮素表达相关的疾病或病症是本文所述的实体瘤。
恶性间皮瘤是一种类型的癌症,其发生在衬在身体内部器官的细胞薄层,称为间皮。有三种公认的间皮瘤类型。胸膜间皮瘤(例如恶性胸膜间皮瘤或mpm)是最常见的疾病形式,占大约70%的病例,并发生在称为胸膜的肺的内衬里中。腹膜间皮瘤发生在腹腔内衬里,称为腹膜。心包间皮瘤起源于心包膜,其内衬在心脏。
如果受试者暴露于石棉,受试者可能面临患间皮瘤的风险。暴露于石棉和吸入石棉颗粒可引起间皮瘤。在大多数情况下,直到暴露发生许多年后暴露于石棉的受试者中才会出现间皮瘤症状。
胸膜间皮瘤的症状包括例如下背部疼痛或侧胸痛以及呼吸急促。其他症状包括吞咽困难,持续咳嗽,发烧,体重减轻或疲劳。一些患者经历的另外症状是肌肉无力,感觉能力丧失,咳血,面部和手臂肿胀,以及嘶哑。在疾病的早期阶段,如1期间皮瘤,症状可能很轻微。患者通常在胸部的一个区域报告似乎从不消失的疼痛,体重减轻和发烧。
腹膜间皮瘤起源于腹部,因此症状通常包括腹痛,体重减轻,恶心和呕吐。流体积聚可能发生在腹部以及是癌症的结果。腹膜间皮瘤起源于腹部,并会频繁扩散至包括肝,脾或肠在内的其他器官。严重的腹痛是患者首次体验的最常见的病诉。也可能存在不适水平,在腹部积聚液体。腹膜间皮瘤的其他症状可能包括排便困难,恶心和呕吐,发热和脚肿。
心包间皮瘤是间皮瘤最不常见的形式。心包间皮瘤,顾名思义,涉及心脏。这种罕见类型的间皮瘤癌症侵袭心包膜,其是包围心脏的包囊。随着癌症的进展,心脏不能有效地向身体输送氧气,导致健康状况进一步下降,速度越来越快。与心包间皮瘤最常见的症状模仿心脏病发作的症状:恶心,胸部疼痛和呼吸急促。
受益于根据本发明的治疗的受试者包括具有间皮瘤的受试者或疑似患有间皮瘤的受试者,例如由本文所述的一种或多种症状的存在和/或暴露于石棉所证明。在具体实施方案中,间皮瘤是胸膜间皮瘤(例如恶性胸膜间皮瘤)。在其他方面,可以对具有癌前病症例如胸膜斑,良性间皮瘤或间皮细胞性增生的受试者进行治疗。
与间皮素相关的疾病或病症的另一个例子是胰腺癌。可用本文所述方法治疗的胰腺癌包括但不限于外分泌胰腺癌和内分泌胰腺癌。外分泌胰腺癌包括但不限于腺癌,腺泡细胞癌,腺鳞癌,胶质癌,具有破骨细胞样巨细胞的未分化癌,肝细胞癌,导管内乳头状粘液性肿瘤,粘液性囊性肿瘤,胰腺母细胞瘤,浆液性囊腺瘤,印戒细胞癌,实体和假乳突肿瘤,胰腺导管癌和未分化癌。在一些实施方案中,外分泌胰腺癌是胰腺导管癌。内分泌胰腺癌包括但不限于胰岛素瘤和胰高血糖素瘤。
在一些实施方案中,胰腺癌是早期胰腺癌,非转移性胰腺癌,原发性胰腺癌,切除的胰腺癌,晚期胰腺癌,局部晚期胰腺癌,转移性胰腺癌,不可切除胰腺癌,缓解胰腺癌,复发性胰腺癌,辅助治疗中的胰腺癌或新辅助治疗中的胰腺癌中的任何一种。在一些实施方案中,胰腺癌是局部晚期胰腺癌,不可切除的胰腺癌或转移性胰腺导管癌。在一些实施方案中,胰腺癌对基于吉西他滨的疗法是有抗性的。在一些实施方案中,胰腺癌对于基于吉西他滨的疗法是难治性的。
在其他方面,与间皮素表达相关的病症是卵巢癌。根据肿瘤的组织学分类卵巢癌。表面上皮间质肿瘤,也称为卵巢上皮癌,是卵巢癌最常见的类型。它包括浆液性肿瘤(包括浆液性乳头状囊腺癌),子宫内膜样肿瘤和粘液性囊腺癌。
本文描述的方法可用于治疗卵巢癌的各个阶段,例如i期,ii期,iii期或iv期。可以进行分期,例如当卵巢癌被去除时。卵巢癌分期如下:
i期癌症仅限于一个或两个卵巢。如果涉及卵巢中的一个或两个并且扩散到子宫和/或输卵管或骨盆中的其他部位,则该癌是ii期。如果涉及一个或两个卵巢并且已经扩散到淋巴结或骨盆外部的其他部位但仍在腹腔内,例如肠或肝的表面,则该癌是iii期癌症。如果涉及一个或两个卵巢并且癌症扩散到腹部外部或肝脏内部,则该癌症是iv期癌症。
在一些实施方案中,卵巢癌对一种或多种化学治疗剂具有抗性。在一些实施方案中,卵巢癌对于一种或多种化学治疗剂是难治的。
可以用本文所述的car组合物治疗的其它癌症包括例如脑癌,膀胱癌,乳腺癌,子宫颈癌,结肠直肠癌,肝癌,肾癌,淋巴瘤,白血病,肺癌(例如肺腺癌),黑素瘤,转移性黑色素瘤,间皮瘤,神经母细胞瘤,卵巢癌,前列腺癌,胰腺癌,肾癌,皮肤癌,胸腺瘤,肉瘤,非霍奇金淋巴瘤,霍奇金淋巴瘤,子宫癌及其任何组合。
本发明提供了抑制间皮素的细胞群增殖或减少其表达的方法,所述方法包括使包含间皮素表达细胞的细胞群与结合间皮素表达细胞的本发明的间皮素car表达细胞接触。在一个具体实施方案中,本发明提供了抑制表达间皮素的癌细胞群的增殖或减少表达间皮素的癌细胞群的方法,所述方法包括使表达间皮素的癌细胞群与结合间皮素表达细胞的本发明的间皮素car表达细胞接触。在另一个实施方案中,本发明提供了抑制表达间皮素的癌细胞群的增殖或减少癌细胞群的方法,所述方法包括使表达间皮素的癌细胞群与结合间皮素表达细胞的本发明的间皮素car表达细胞接触。在某些实施方案中,相对于阴性对照,本发明的间皮素car表达细胞将具有间皮瘤或与间皮素表达细胞相关的另一种癌症的受试者或动物模型中细胞和/或癌细胞的数量,数目,量或百分比降低至少25%,至少30%,至少40%,至少50%,至少65%,至少75%,至少85%,至少95%或至少99%。在一个方面,受试者是人。
本发明还提供了用于预防,治疗和/或管理与表达间皮素的细胞(例如间皮瘤)相关的病症的方法,所述方法包括向需要的受试者施用与间皮素表达细胞结合的本发明的间皮瘤car表达细胞。在一个方面,受试者是人。
本发明提供了用于预防与间皮素表达细胞相关的癌症复发的方法,所述方法包括向有需要的受试者施用与间皮素表达细胞结合的本发明的间皮素car表达细胞。在另一个实施方案中,所述方法包括向有需要的受试者施用与有效量的另一种疗法组合的有效量的结合间皮素表达细胞的本发明的间皮素car表达细胞。
一方面,本发明涉及包含有效连接到启动子以在哺乳动物免疫效应细胞中表达的编码间皮素car的序列的载体。一方面,本发明提供了表达间皮素car的重组免疫效应细胞,用于治疗表达间皮素的肿瘤。一方面,本发明的间皮素car表达细胞能够使肿瘤细胞与在其表面表达的至少一种本发明的间皮素car接触,使得间皮素car表达细胞响应于抗原被激活,并且car表达细胞靶向癌细胞,并且抑制癌的生长。
一方面,本发明涉及抑制表达间皮素的癌细胞生长的方法,包括使肿瘤细胞与间皮素car表达细胞接触,使得car表达细胞响应于抗原被激活并靶向癌细胞,其中癌的生长被抑制。一方面,活化的cart靶向并杀死癌细胞。
一方面,本发明涉及治疗受试者的癌症的方法。该方法包括向受试者施用间皮素car表达细胞,使得在受试者中的癌症被治疗。可以通过本发明的间皮素car表达细胞治疗的癌症的实例是与间皮素的表达相关的癌症。一方面,与间皮素的表达相关的癌症选自间皮瘤,胰腺癌,卵巢癌和肺癌。
本发明包括一种类型的细胞疗法,其中对免疫效应细胞例如t细胞或nk细胞进行基因修饰以表达嵌合抗原受体(car),并且将表达car的细胞输注到需要其的接受者。输注的细胞能够杀死接受者的肿瘤细胞。与抗体疗法不同,car-修饰的免疫效应细胞能够在体内复制,导致可能引起持久肿瘤控制的长期持续性。在各个方面,向患者或其后代施用的细胞,在向患者施用所述细胞之后,在患者中保持至少四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月、两年、三年、四年或五年。
本发明还包括一种类型的细胞疗法,其中免疫效应细胞(例如通过体外转录的rna)被修饰,以短暂地表达嵌合抗原受体(car),且所述表达car的细胞被输注到需要其的接受者。输注的细胞能够杀死接受者的癌细胞。因此,在各个方面,向患者施用的细胞,在所述细胞被施用到所述患者之后,存在少于一个月,例如三周、两周、一周。
不希望受任何特定理论的约束,由car修饰的免疫效应细胞引起的抗癌免疫反应可能是主动或被动免疫应答,或者可能是由于直接对间接的免疫应答。一方面,car转导的t细胞应答表达间皮素的人类癌细胞而表现出特异性促炎细胞因子分泌和有效的溶细胞活性,并且介导旁观者杀死并介导已建立的人肿瘤的消退。例如,表达间皮素的肿瘤的异质区域内的少抗原肿瘤细胞可能易于被间皮素重定向的t细胞间接破坏,所述间皮素重定向的t细胞已预先针对相邻的抗原阳性癌细胞反应。
在一个方面,本发明的完全人携带scfv的car-修饰的免疫效应细胞可以是用于哺乳动物中离体免疫和/或体内治疗的疫苗类型。在一个方面,哺乳动物为人类。
关于离体免疫接种,在将细胞施用到哺乳动物之前在体外出现下述之一:i)细胞扩增,ii)向细胞中引入编码kir-car的核酸,和/或iii)冷藏细胞。
离体过程是本领域熟知的,并且如下更完全地讨论。简而言之,从哺乳动物(优选人类)分离细胞,并用表达本文公开的kir-car的载体基因修饰(即,体外转导或转染)。可以将kir-car-修饰的细胞施用到哺乳动物接受者以提供治疗益处。哺乳动物接受者可以是人类,并且kir-car-修饰的细胞可以对于接受者是自体的。备选地,所述细胞可以对于接受者是同种异体的、同源的或异种的。
用于离体扩增造血干细胞和祖细胞的方法被描述在美国专利号5,199,942中,将其引入本文作为参考,可以应用于本发明的细胞。其它的合适的方法是本领域已知的,因此本发明不限于离体扩增细胞的任何特定的方法。简而言之,t细胞的离体培养和扩增包括:(1)从外周血液采集或骨髓外植体,从哺乳动物收集cd34+造血干细胞和祖细胞;和(2)离体扩增这样的细胞。除了美国专利号5,199,942中描述的细胞生长因子之外,其它因子比如flt3-l、il-1、il-3和c-kit配体可用于细胞的培养和扩增。
除了在离体免疫方面使用基于细胞的疫苗之外,本发明还提供用于体内免疫以引发针对患者抗原的免疫应答的组合物和方法。
通常,如本文所述活化和扩增的细胞可用于治疗和预防在免疫受损的个体中出现的疾病。特别地,本发明的kir-car修饰的t细胞用于治疗癌症。在某些实施方案中,本发明的细胞用于治疗患癌症风险的患者。因此,本发明提供了用于治疗或预防癌症的方法,包括向有需要的受试者施用治疗有效量的本发明的kir-car修饰的t细胞。
本发明的kir-car修饰的t细胞可以单独或作为与稀释剂和/或其它成分如il-2或其它细胞因子或细胞群组合的药物组合物施用。简而言之,本发明的药物组合物可以包含本文所述的靶细胞群,与一种或多种药学上或生理上可接受的载体,稀释剂或赋形剂组合。这样的组合物可以包含缓冲液,例如中性缓冲盐水,磷酸缓冲盐水等;碳水化合物如葡萄糖,甘露糖,蔗糖或葡聚糖,甘露醇;蛋白质;多肽或氨基酸,如甘氨酸;抗氧化剂;螯合剂如edta或谷胱甘肽;佐剂(例如氢氧化铝);和防腐剂。本发明的组合物优选经配制用于静脉内施用。
本发明还提供了用于抑制间皮素表达细胞群增殖或减少间皮素表达细胞群的方法,所述方法包括使包含间皮素表达细胞的细胞群与间皮素car表达细胞(例如结合表达间皮素的细胞的本发明的nkr-car)接触。在具体方面,本发明提供了抑制表达间皮素的癌细胞的群体增殖或减少该群体的方法,所述方法包括使表达间皮素的癌细胞群与结合间皮素表达细胞的本发明的间皮素car表达细胞接触。一方面,本发明提供了抑制表达间皮素的癌细胞群体的增殖或减少该群体的方法,所述方法包括使表达间皮素的癌细胞群与结合表达间皮素的癌细胞的本发明的间皮素car表达细胞接触。在某些方面,相对于阴性对照,本发明的间皮素car表达细胞将具有间皮瘤或与间皮素表达细胞相关的另一种癌症的受试者或动物模型中细胞和/或癌细胞的数量,数目,量或百分比减少至少25%,至少30%,至少40%,至少50%,至少65%,至少75%,至少85%,至少95%,或至少99。在一个方面,受试者是人。
本发明还提供了用于预防,治疗和/或管理与表达间皮素的细胞相关的疾病(例如间皮瘤)的方法,所述方法包括向需要的受试者施用与间皮素表达细胞结合的本发明的间皮瘤car表达细胞。在一个方面,受试者是人。
本发明提供了预防与间皮素表达细胞相关的癌症复发的方法,所述方法包括向有需要的受试者施用与间皮素表达细胞结合的本发明的间皮素car表达细胞。在一个方面,所述方法包括向有需要的受试者施用与有效量的另一种疗法组合的有效量的与间皮素表达细胞结合的本发明的间皮素car表达细胞。
联合疗法
本文所述表达car的细胞可以与其它已知的作用剂和疗法联合使用。正如本文中使用的那样,“联合”施用是指在受试者受病症折磨的过程期间,向受试者递送两种(或多种)不同的治疗,例如在已经诊断受试者患有病症之后和在病症已经治愈或消除或治疗由于其它原因停止之前递送两种或多种治疗。在某些实施方案中,当递送第二种治疗开始时,一种治疗的递送仍然存在,因此施用方面存在重叠。这有时在本文称为“同时”或“同时递送”。在其它实施方案中,一种治疗的递送在另一种治疗的递送开始之前结束。在任一情形的某些实施方案中,因为联合施用,治疗更有效。例如,与如果在不存在第一种治疗时施用第二种治疗所看到的,或采用第一种治疗看到类似的情形相比,第二种治疗更有效,例如,使用更少的第二种治疗可看到同等效果,或第二种治疗更大程度地减轻症状。在某些实施方案中,递送使得症状减轻,或与病症有关的其他参数大于在不存在另一种治疗时用一种治疗观察的参数。两种治疗的效果可部分相加,完全相加或大于相加。递送可以使得当递送第二种时递送第一种治疗的效果仍然可检测到。
本文所述的表达car的细胞和至少一种另外的治疗剂可以在相同的或不同的组合物中,同时施用或顺序施用。对于顺序施用,可以首先施用本文所述表达car的细胞,并接着施用另一种作用剂,或者可以颠倒施用顺序。
car的疗法和/或其它治疗剂,程序或形式可在活动病症的周期期间或疾病缓解或更少活动疾病期间给药。car疗法可以在其它治疗之前,与其他治疗同时、治疗后或在病症的缓解期间给药。
当联合给药时,car疗法和另外的作用剂(例如,第二或第三作用剂),或全部,的给药量或剂量高于、低于或等于各作用剂单独使用例如,作为单一疗法的量或剂量。在某些实施方案中,car疗法、另外的作用剂(例如,第二或第三剂)或全部所施用的量或剂量低于(如,至少20%,至少30%,至少40%,或至少50%)各作用剂单独使用例如,作为单一疗法的量或剂量。在其他实施方案中,car疗法、另外的作用剂(例如,第二或第三剂)或全部导致所希望的效果(例如,治疗癌症)的量或剂量低于(如,低至少20%,至少30%,至少40%,或至少50%)各作用剂单独使用例如,作为单一疗法实现相同的治疗效果所需的量或剂量。
在另外的方面,本文所述的car表达细胞可以与外科手术,细胞因子,放射或化疗例如环磷酰胺,氟达拉滨,组蛋白脱乙酰酶抑制剂,去甲基化剂或肽疫苗组合用于治疗方案,如在izumotoetal.2008jneurosurg108:963-971所述。
在某些情况下,将本发明的化合物与其它治疗剂如其它抗癌剂,抗过敏剂,抗恶心剂(或止吐药),止痛剂,细胞保护剂及其组合相组合。
在一个实施方案中,本文所述表达car的细胞可以与化疗剂联合使用。示例性的化疗剂包括蒽环类(例如,多柔比星(例如,脂质体多柔比星))、长春花生物碱(例如,长春碱、长春新碱、长春地辛、长春瑞滨)、烷化剂(例如,环磷酰胺、达可巴嗪、美法仑、异环磷酰胺、替莫唑胺)、免疫细胞抗体(例如,alemtuzamab、吉姆单抗、利妥昔单抗(rituximab)、ofatumumab、托西莫单抗(tositumomab)、brentuximab)、抗代谢药(包括,例如叶酸拮抗药、嘧啶类似物、嘌呤类似物和腺苷脱氨酶抑制剂(例如氟达拉滨))、mtor抑制剂、tnfr糖皮质激素诱导的tnfr相关蛋白(gitr)激动剂、蛋白酶体抑制剂(例如,阿克拉霉素a、胶霉毒素或硼替佐米)、免疫调节剂比如沙利度胺或沙利度胺衍生物(例如来那度胺(lenalidomide))。
考虑用于组合疗法的一般化疗剂包括阿那曲唑
与本发明化合物组合的特别有意义的抗癌剂包括:蒽环类;烷基化剂;抗代谢药物;抑制钙依赖性磷酸酶钙调磷酸酶或p70s6激酶fk506或抑制p70s6激酶的药物;mtor抑制剂;免疫调节剂;蒽环类;长春花生物碱;蛋白体抑制剂;gitr激动剂;蛋白酪氨酸磷酸酶抑制剂;cdk4激酶抑制剂;;btk抑制剂;mkn激酶抑制剂;dgk激酶抑制剂;或溶瘤病毒的药物。
示例性的抗代谢物包括但不限于嘧啶类似物,嘌呤类似物和腺苷脱氨酶抑制剂:甲氨蝶呤
示例性的烷化剂包括,不限于:氮芥(nitrogenmustards)、乙烯亚胺衍生物、烷基磺酸盐、亚硝基脲和三氮烯)∶尿嘧啶氮芥(aminouracil
在实施方案中,本文所述的car表达细胞与氟达拉滨,环磷酰胺,和/或利妥昔单抗组合施用于受试者。在实施方案中,本文所述的car表达细胞与氟达拉滨,环磷酰胺,利妥昔单抗(fcr)组合施用于受试者。在实施方案中,受试者患有cll。例如,该受试者具有在第17号染色体的短臂中的缺失(del(17p),例如,在白血病细胞中)。在其它实例中,受试者不具有del(17p)。在实施方案中,所述受试者包括包含在免疫球蛋白重链可变区(igvh)基因中的突变的白血病细胞。在其他实施方案中,受试者不包括包含在免疫球蛋白重链可变区(igvh)基因中的突变的白血病细胞。在实施方案中,氟达拉滨以约10-50mg/m2(例如约10-15,15-20,20-25,25-30,30-35,35-40,40-45,或45-50mg/m2)的剂量例如,静脉内施用。在实施方案中,环磷酰胺以约200-300mg/m2例如,约200-225,225-250,250-275,或275-300mg/m2)的剂量例如,静脉内施用。在实施方案中,利妥昔单抗以约400-600mg/m2(例如,400-450,450-500,500-550,或550-600mg/m2)的剂量例如,静脉内施用。
在实施方案中,本文所述的car表达细胞与苯达莫司汀和利妥昔单抗组合施用给受试者。在实施方案中,受试者患有cll。例如,该受试者具有在第17号染色体的短臂中的缺失(del(17p),例如,在白血病细胞中)。在其它实例中,受试者不具有del(17p)。在实施方案中,所述受试者包括包含在免疫球蛋白重链可变区(igvh)基因中的突变的白血病细胞。在其他实施方案中,受试者不包括包含在免疫球蛋白重链可变区(igvh)基因中的突变的白血病细胞。在实施方案中,苯达莫司汀以约70-110mg/m2(例如,70-80,80-90,90-100,或100-110mg/m2)的剂量例如,静脉内施用。在实施方案中,利妥昔单抗在约400-600mg/m2例如,400-450,450-500,500-550,或550-600mg/m2)的剂量例如,静脉内施用。
在实施方案中,本文所述的car表达细胞与利妥昔单抗,环磷酰胺,多柔比星,长春新碱和/或皮质类固醇(例如,泼尼松)组合施用于受试者。在实施方案中,本文所述的car表达细胞与利妥昔单抗,环磷酰胺,多柔比星,长春新碱和泼尼松(r-chop)组合施用于受试者。在实施方案中,受试者患有弥漫性大b细胞淋巴瘤(dlbcl)。在实施方案中,受试者具有非笨重限制阶段(nonbulkylimited-stage)dlbcl(例如,包含具有小于7cm的尺寸/直径的肿瘤)。在实施方案中,受试者用辐射与r-chop联合治疗。例如,向受试者施用r-chop(例如,1-6次循环,例如,1,2,3,4,5,或6个周期的r-chop),随后辐射。在某些情况下,给予受试者r-chop(例如,1-6次循环,例如,1,2,3,4,5,或6个周期的r-chop),接着辐射。
在实施方案中,本文所述的car表达细胞与依托泊苷,泼尼松,长春新碱,环磷酰胺,阿霉素,和/或利妥昔单抗组合施用于受试者。在实施方案中,本文所述的car表达细胞与依托泊苷,泼尼松,长春新碱,环磷酰胺,阿霉素,和利妥昔单抗(epoch-r)的组合施用于受试者。在实施方案中,本文所述的car表达细胞与剂量调整的epoch-r(da-epoch-r)组合施用于受试者。在实施方案中,受试者具有b细胞淋巴瘤,例如,myc重排的侵袭性b细胞淋巴瘤。
在实施方案中,本文所述的car表达细胞与利妥昔单抗和/或来那度胺组合施用于受试者。来那度胺((rs)-3-(4-氨基-1-氧代-1,3-二氢-2h-异吲哚-2-基)哌啶-2,6-二酮)是一种免疫调节剂。在实施方案中,本文所述的car表达细胞与利妥昔单抗和来那度胺组合施用于受试者。在实施方案中,受试者具有滤泡性淋巴瘤(fl)或套细胞淋巴瘤(mcl)。在实施方案中,受试者具有fl并且先前未用癌症疗法治疗。在实施方案中,来那度胺以约10-20毫克(例如,10-15或15-20毫克)的剂量每天给药。在实施方案中,利妥昔单抗以约350-550mg/m2(e.g.,350-375,375-400,400-425,425-450,450-475,或475-500mg/m2)的剂量例如,静脉内给药。
示例性的mtor抑制剂包括,坦罗莫司;雷达罗莫司(ridaforolimus)(正式称为deferolimus、(1r,2r,4s)-4-[(2r)-2[(1r,9s,12s,15r,16e,18r,19r,21r,23s,24e,26e,28z,30s,32s,35r)-1,18-二羟基-19,30-二甲氧基-15,17,21,23,29,35-六甲基-2,3,10,14,20-五氧代-11,36-二氧杂-4-氮杂三环[30.3.1.04,9]六(三十烷)-16,24,26,28-四烯-12-基]丙基]-2-甲氧基环己基二甲基亚膦酸酯,也称为ap23573和mk8669,且描述在pct公开号wo03/064383中);依维莫司(
示例性的免疫调节剂包括例如阿夫妥珠单抗(afutuzumab)(得自
示例性的蒽环类包括例如多柔比星(
示例性的长春花生物碱包括例如长春瑞滨酒石酸盐
示例性的蛋白体抑制剂包括硼替佐米(bortezomib)
在实施方案中,本文所述的car表达细胞与brentuximab组合施用于受试者。brentuximab是抗-cd30抗体和单甲基auristatine的抗体-药物缀合物。在实施方案中,受试者具有霍奇金淋巴瘤(hl),例如,复发性或难治性hl。在实施方案中,所述受试者包含cd30+hl。在实施方案中,受试者已经经历了自体干细胞移植(asct)。在实施方案中,受试者没有经历asct。在实施方案中,brentuximab以约1-3mg/kg(例如约1-1.5,1.5-2,2-2.5,或2.5-3mg/kg)的剂量给药,例如,静脉内,例如,每3周。
在实施方案中,本文所述的car表达细胞与brentuximab和达卡巴嗪或与brentuximab和苯达莫司汀组合施用于受试者。达卡巴嗪是一种烷化剂,化学名称是5-(3,3-二甲基-1-三氮烯基)咪唑-4-甲酰胺。苯达莫司汀是一种烷基化剂,化学名称是4-[5-[双(2-氯乙基)氨基]-1-甲基苯并咪唑-2-基]丁酸。在实施方案中,受试者具有霍奇金淋巴瘤(hl)。在实施方案中,受试者先前未用癌症疗法治疗。在实施方案中,受试者是至少60岁,例如,60,65,70,75,80,85岁或更老。在实施方案中,达卡巴嗪以约300-450mg/m2(例如约300-325,325-350,350-375,375-400,400-425,或425-450mg/m2)的剂量例如,静脉内给药。在实施方案中,苯达莫司汀以约75-125mg/m2(例如,75-100或100-125mg/m2,例如,约90mg/m2)的剂量例如,静脉内给药。在实施方案中,brentuximab以约1-3mg/kg(例如,约1-1.5,1.5-2,2-2.5,或者2.5-3mg/kg)的剂量给药,例如,静脉内,例如,每3周。
在一些实施方案中,本文所述的car表达细胞与cd20抑制剂,例如,抗cd20抗体(例如,抗cd20单-或双特异性抗体)或其片段组合施用于受试者。示例性抗cd20抗体包括但不限于利妥昔单抗,ofatumumab,奥瑞珠单抗,veltuzumab,obinutuzumab,tru-015(trubionpharmaceuticals),ocaratuzumab和pro131921(genentech)。见,例如,limetal.haematologica.95.1(2010):135-43。
在一些实施方案中,所述抗cd20抗体包含利妥昔单抗。利妥昔单抗是嵌合小鼠/人单克隆抗体igg1κ,其结合cd20并且使cd20表达细胞溶解,如在www.accessdata.fda.gov/drugsatfda_docs/label/2010/103705s5311lbl.pdf所述。在实施方案中,本文所述的car表达细胞与利妥昔单抗组合施用于受试者。在实施方案中,受试者具有cll或sll。
在一些实施方案中,利妥昔单抗静脉内给药,例如,作为静脉输注。例如,每次输注提供约500-2000mg(例如,约500-550,550-600,600-650,650-700,700-750,750-800,800-850,850-900,900-950,950-1000,1000-1100,1100-1200,1200-1300,1300-1400,1400-1500,1500-1600,1600-1700,1700-1800,1800-1900,或1900-2000mg)利妥昔单抗。在一些实施方案中,利妥昔单抗以150mg/m2到750mg/m2,例如,约150-175mg/m2,175-200mg/m2,200-225mg/m2,225-250mg/m2,250-300mg/m2,300-325mg/m2,325-350mg/m2,350-375mg/m2,375-400mg/m2,400-425mg/m2,425-450mg/m2,450-475mg/m2,475-500mg/m2,500-525mg/m2,525-550mg/m2,550-575mg/m2,575-600mg/m2,600-625mg/m2,625-650mg/m2,650-675mg/m2,或675-700mg/m2的剂量施用,其中m2表示受试者的体表面积。在一些实施方案中,利妥昔单抗以至少4天,例如,4,7,14,21,28,35天,或更长的给药间隔给药。例如,利妥昔单抗以至少0.5周,例如,0.5,1,2,3,4,5,6,7,8或更长的给药间隔施用。在一些实施方案中,利妥昔单抗以本文中所描述的剂量和给药间隔施用,例如,至少2周,例如,至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20周,或更长。例如,利妥昔单抗以本文中所描述的剂量和给药间隔施用,每治疗周期共至少4次剂量(例如,每个治疗周期至少4,5,6,7,8,9,10,11,12,13,14,15,16,或更多剂量)。
在一些实施方案中,所述抗cd20抗体包含ofatumumab。ofatumumab是具有约149kda的分子量的抗cd20igg1κ人单克隆抗体。例如,使用转基因小鼠和杂交瘤技术产生ofatumumab并从重组鼠细胞系(ns0)表达并纯化。见,例如,www.accessdata.fda.gov/drugsatfda_docs/label/2009/125326lbl.pdf;和临床试验标识符编号nct01363128,nct01515176,nct01626352,和nct01397591。在实施方案中,本文所述的car表达细胞与ofatumumab组合施用于受试者。在实施方案中,受试者具有cll或sll。
在一些实施方案中,ofatumumab作为静脉内输注施用。例如,每次输注提供约150-3000mg(例如,约150-200,200-250,250-300,300-350,350-400,400-450,450-500,500-550,550-600,600-650,650-700,700-750,750-800,800-850,850-900,900-950,950-1000,1000-1200,1200-1400,1400-1600,1600-1800,1800-2000,2000-2200,2200-2400,2400-2600,2600-2800,或2800-3000mg)ofatumumab。在实施方案中,ofatumumab以约300毫克的起始剂量施用,随后2000毫克,例如,约11次剂量,例如,24周。在一些实施方案中,ofatumumab以至少4天,例如,4,7,14,21,28,35天,或更长的给药间隔给药。例如,ofatumumab以至少1周,例如,1,2,3,4,5,6,7,8,9,10,11,12,24,26,28,20,22,24,26,28,30周,或更长的给药间隔施用。在一些实施方案中,ofatumumab以本文所述的剂量和给药间隔施用一段时间,例如,至少1周,例如,1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,22,24,26,28,30,40,50,60周或更长,或1,2,3,4,5,6,7,8,9,10,11,12个月或以上,或1,2,3,4,5年或以上。例如,ofatumumab以本文所述的剂量和给药间隔施用,每个治疗周期共至少2个剂量(例如,每个治疗周期至少2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,18,20或更多个剂量)。
在一些情况下,所述抗cd20抗体包含ocrelizumab。ocrelizumab是人源化抗cd20单克隆抗体,例如,如在临床试验标识符号nct00077870,nct01412333,nct00779220,nct00673920,nct01194570,和kapposetal.lancet.19.378(2011):1779-87所述。
在一些情况下,所述抗cd20抗体包含veltuzumab。veltuzumab是针对cd20的人源化单克隆抗体。见,例如,临床试验标识号nct00547066,nct00546793,nct01101581,和goldenbergetal.leuklymphoma.51(5)(2010):747-55。
在一些情况下,所述抗cd20抗体包含ga101。ga101(也称为obinutuzumab或ro5072759)是人源化和糖工程化抗cd20单克隆抗体。见,例如,robak.curr.opin.investig.drugs.10.6(2009):588-96;临床试验标识号:nct01995669,nct01889797,nct02229422,和nct01414205;和www.accessdata.fda.gov/drugsatfda_docs/label/2013/125486s000lbl.pdf。
在一些情况下,所述抗cd20抗体包含ame-133v。ame-133v(也称为ly2469298或ocaratuzumab)是针对cd20的人源化igg1单克隆抗体,与利妥昔单抗相比,对fcγriiia受体具有增加的亲和力和增强的抗体依赖性细胞毒性(adcc)活性。见,例如,robaketal.biodrugs25.1(2011):13-25;和forero-torresetal.clincancerres.18.5(2012):1395-403。
在一些情况下,所述抗cd20抗体包含pro131921。pro131921是工程化成具有与利妥昔单抗相比对fcγriiia的更好的结合和增强的adcc的人源化抗cd20单克隆抗体。见,例如,robaketal.biodrugs25.1(2011):13-25;andcasuloetal.clinimmunol.154.1(2014):37-46;和临床试验标识号nct00452127。
在一些情况下,所述抗cd20抗体包含tru-015。tru-015是从针对cd20的抗体的结构域衍生的抗cd20融合蛋白。tru-015比单克隆抗体更小,但保留fc介导的效应子功能。见,例如,robaketal.biodrugs25.1(2011):13-25。tru-015包含连接到人igg1铰链,ch2和ch3结构域但缺失ch1和cl结构域的抗cd20单链可变片段(scfv)。
在一些实施方案中,本文所述的抗cd20抗体缀合到或以其他方式结合到治疗剂,例如,本文中所描述的化疗剂(例如,环磷酰胺,氟达拉滨,组蛋白脱乙酰酶抑制剂,去甲基化剂,肽疫苗,抗肿瘤抗生素,酪氨酸激酶抑制剂,烷基化剂,抗微管或抗有丝分裂剂),抗过敏剂,抗恶心剂(或抗呕吐),止痛药,或细胞保护剂。
在实施方案中,本文所述的car表达细胞与b细胞淋巴瘤2(bcl-2)抑制剂(例如,venetoclax,也称为abt-199或gdc-0199)和/或利妥昔单抗组合施用于受试者。在实施方案中,本文所述的car表达细胞与venetoclax和利妥昔单抗组合施用于受试者。venetoclax是一种抑制抗细胞凋亡蛋白bcl-2的小分子。venetoclax(4-(4-{[2-(4-氯苯基)-4,4-二甲基环己-1-烯-1-基]甲基}哌嗪-1-基)-n-({3-硝基-4-[(四氢-2h-吡喃-4-基甲基)氨基]苯基}磺酰基)-2-(1h-吡咯并[2,3-b]吡啶-5-基氧基)苯甲酰胺)的结构如下所示。
在实施方案中,受试者患有cll。在实施方案中,受试者患有复发的cll,例如,受试者先前已经施用了癌症疗法。在实施方案中,venetoclax以约15-600mg(例如,15-20,20-50,50-75,75-100,100-200,200-300,300-400,400-500,或500-600mg)的剂量例如,每天施用。在实施方案中,利妥昔单抗以约350-550mg/m2(例如,350-375,375-400,400-425,425-450,450-475,或475-500mg/m2)的剂量给药,例如,静脉注射,例如,每月。
在一些实施方案中,本文所述的car表达细胞与溶瘤病毒组合施用。在实施方案中,溶瘤病毒能够选择性地复制并触发癌细胞的死亡或减缓癌细胞的生长。在某些情况下,溶瘤病毒对非癌细胞没有影响或影响最小。溶瘤病毒包括但不限于溶瘤性腺病毒,溶瘤性单纯疱疹病毒,溶瘤性逆转录病毒,溶瘤性细小病毒,溶瘤性痘苗病毒,溶瘤性辛比斯病毒,溶瘤性流感病毒或溶瘤性rna病毒(例如,溶瘤性呼肠孤病毒,溶瘤性新城疫病毒(ndv),溶瘤性麻疹病毒或溶瘤性水泡性口炎病毒(vsv))。
在一些实施方案中,溶瘤病毒是us2010/0178684a1(其全部内容通过引用并入本文)中描述的病毒,例如重组溶瘤病毒。在一些实施方案中,重组溶瘤病毒包含编码免疫或炎症反应抑制剂的核酸序列(例如,异源核酸序列),例如us2010/0178684a1中所述,其全部内容通过引用并入本文。在实施方案中,重组溶瘤病毒,例如溶瘤性ndv,包含促凋亡蛋白(例如,凋亡蛋白),细胞因子(例如gm-csf,干扰素-γ,白细胞介素-2(il-2),肿瘤坏死因子α),免疫球蛋白(例如,针对ed-b纤连蛋白的抗体),肿瘤相关抗原,双特异性衔接蛋白(例如,针对ndvhn蛋白的双特异性抗体或抗体片段和t细胞共刺激受体,例如cd3或cd28;或人il-2与针对ndvhn蛋白的单链抗体之间的融合蛋白)。参见,例如,zamarinetal.futuremicrobiol.7.3(2012):347-67,其全部内容通过引用并入本文。在一些实施方案中,溶瘤病毒是us8591881b2,us2012/0122185a1,或us2014/0271677a1(其各自的全部内容通过引用并入本文)中描述的嵌合溶瘤性ndv。
在一些实施方案中,溶瘤病毒包含条件复制型腺病毒(crad),其设计为仅在癌细胞中复制。参见例如alemanyetal.naturebiotechnol.18(2000):723-27。在一些实施方案中,溶瘤腺病毒包括alemany等人(其全部内容通过引用并入本文)的第725页的表1中所述的一种。
示例性溶瘤病毒包括但不限于以下:
b组溶瘤腺病毒(coload1)(psioxustherapeuticsltd.)(参见例如clinicaltrialidentifier:nct02053220);
oncos-102(以前称为cgtg-102),其是包含粒细胞-巨噬细胞集落刺激因子(gm-csf)(oncostherapeutics)的腺病毒(参见例如clinicaltrialidentifier:nct01598129);
vcn-01,其是编码人ph20透明质酸酶(vcnbiosciences,s.l.)的经遗传修饰的溶瘤性人腺病毒(参见例如clinicaltrialidentifiers:nct02045602和nct02045589);
条件复制型腺病毒icovir-5,其是来源于野生型人腺病毒血清型5(had5)的病毒,已被修饰以在具有失调的视网膜母细胞瘤/e2f途径的癌细胞中选择性复制(institutcatalàd’oncologia)(见,例如,临床试验标识:nct01864759);
celyvir,其包含用一种溶瘤腺病毒icovir5感染的骨髓衍生的自体间充质干细胞(msc)(hospitalinfantiluniversitario
cg0070,其是一种条件复制型溶瘤血清型5腺病毒(ad5),其中人e2f-1启动子驱动必需e1a病毒基因的表达,从而限制病毒复制和对rb途径缺陷型肿瘤细胞的细胞毒性(coldgenesys,inc.)(参见例如临床试验标识:nct02143804);或
dnx-2401(以前称为delta-24-rgd),其是已被工程化成在视网膜母细胞瘤(rb)途径缺陷细胞中选择性复制并且更有效地感染表达某些rgd结合整联蛋白的细胞的腺病毒(clinicauniversidaddenavarra,universidaddenavarra/dnatrix,inc.)(参见例如临床试验标识:nct01956734)。
在一些实施方案中,本文所述的溶瘤病毒通过注射,例如皮下,动脉内,静脉内,肌内,鞘内或腹膜内注射施用。在实施方案中,本文所述的溶瘤病毒是经肿瘤内,经皮,经粘膜,口服,鼻内或通过肺部给药施用的。
在一个实施方案中,本文所述的表达car的细胞与减少treg细胞群的分子组合施用于受试者。减少treg细胞的数量(例如,耗尽)的方法在本领域中是已知的,并且包括,例如,cd25耗尽,环磷酰胺给药,调节gitr功能。不希望受理论的束缚,但相信在单采血液成分术前或施用所述的car表达细胞前,降低受试者中treg细胞的数目减少了肿瘤微环境中不希望的免疫细胞(例如,treg细胞)的数目并降低了受试者复发的风险。
在一个实施方案中,本文所述的表达car的细胞与靶向gitr和/或调节gitr功能,诸如gitr激动剂和/或耗尽调节性t细胞(tregs)的gitr抗体的分子组合施用于受试者。在实施方案中,表达本文所述的car细胞与环磷酰胺组合施用于受试者。在一个实施方案中,gitr结合分子和/或调节gitr功能的分子(例如,gitr激动剂和/或treg耗尽gitr抗体)在施用car表达细胞之前施用。例如,在一个实施方案中,gitr激动剂可以在细胞的单采血液成分术之前施用。在实施方案中,在施用(例如,输注或重新输注)car表达细胞之前或细胞的单采血液成分术之前,将环磷酰胺施用于受试者。在实施方案中,在施用(例如,输注或重新输注)car表达细胞之前或细胞的单采血液成分术之前,将环磷酰胺和抗gitr抗体施用给受试者。在一个实施方案中,受试者患有癌症(例如,实体癌或血液癌症如all或cll)。在一个实施方案中,受试者患有cll。在实施方案中,受试者患有all。在实施方案中,受试者患有实体癌,例如,本文所述的实体癌。示例性的gitr激动剂包括例如gitr融合蛋白和抗-gitr抗体(例如,二价抗gitr抗体),比如例如美国专利号∶6,111,090、欧洲专利号:090505b1、美国专利号:8,586,023、pct公开号∶wo2010/003118和2011/090754中描述的gitr融合蛋白,或例如在美国专利号∶7,025,962、欧洲专利号∶1947183b1、美国专利号:7,812,135、美国专利号:8,388,967、美国专利号:8,591,886、欧洲专利号:ep1866339、pct公开号:wo2011/028683、pct公开号:wo2013/039954、pct公开号:wo2005/007190、pct公开号:wo2007/133822、pct公开号:wo2005/055808、pct公开号:wo99/40196、pct公开号:wo2001/03720、pct公开号:wo99/20758、pct公开号:wo2006/083289、pct公开号:wo2005/115451、美国专利号∶7,618,632和pct公开号:wo2011/051726中所述的抗gitr抗体。
在一个实施方案中,将本文所述表达car的细胞与gitr激动剂(例如,本文所述gitr激动剂)联合施用给受试者。在一个实施方案中,在表达car的细胞之前,施用gitr激动剂。例如,在一个实施方案中,可以在细胞的单采血液成分术之前,施用gitr激动剂。
在一个实施方案中,将本文所述的car表达细胞与mtor抑制剂(例如本文所述的mtor抑制剂,例如rapalog,如依维莫司)组合施用于受试者。在一个实施方案中,在car表达细胞之前施用mtor抑制剂。例如,在一个实施方案中,mtor抑制剂可以在细胞的单采血液成分术之前施用。
在一个实施方案中,本文所述的car表达细胞与蛋白质酪氨酸磷酸酶抑制剂例如本文所述的蛋白酪氨酸磷酸酶抑制剂组合施用于受试者。在一个实施方案中,蛋白质酪氨酸磷酸酶抑制剂是shp-1抑制剂,例如本文所述的shp-1抑制剂,例如葡萄糖酸锑钠。在一个实施方案中,蛋白酪氨酸磷酸酶抑制剂是shp-2抑制剂。
在一个实施方案中,本文所述的car表达细胞可与激酶抑制剂组合使用。在一个实施方案中,激酶抑制剂是cdk4抑制剂,例如本文所述的cdk4抑制剂,例如cd4/6抑制剂,例如6-乙酰基-8-环戊基-5-甲基-2-(5-哌嗪-1-基-吡啶-2-基氨基)-8h-吡啶并[2,3-d]嘧啶-7-酮盐酸盐(也称为palbociclib或pd0332991)。在一个实施方案中,激酶抑制剂是btk抑制剂,例如本文所述的btk抑制剂,例如ibrutinib。在一个实施方案中,激酶抑制剂是mtor抑制剂,例如本文所述的mtor抑制剂,例如雷帕霉素,雷帕霉素类似物osi-027。mtor抑制剂可以是例如mtorc1抑制剂和/或mtorc2抑制剂,例如本文所述的mtorc1抑制剂和/或mtorc2抑制剂。在一个实施方案中,激酶抑制剂是mnk抑制剂,例如本文所述的mnk抑制剂,例如4-氨基-5-(4-氟苯胺基)-吡唑并[3,4-d]嘧啶。mnk抑制剂可以是例如mnk1a,mnk1b,mnk2a和/或mnk2b抑制剂。在一个实施方案中,激酶抑制剂是dgk抑制剂,例如本文所述的dgk抑制剂,例如dgkinh1(d5919)或dgkinh2(d5794)。在一个实施方案中,激酶抑制剂为cdk4抑制剂,选自阿洛新a(aloisinea);夫拉平度(flavopiridol)或hmr-1275,2-(2-氯苯基)-5,7-二羟基-8-[(3s,4r)-3-羟基-1-甲基4-哌啶基]-4-色酮(chromenone);crizotinib(pf-02341066;2-(2-氯苯基)-5,7-二羟基-8-[(2r,3s)-2-(羟基甲基)-1-甲基-3-吡咯烷基]-4h-1-苯并吡喃-4-酮盐酸盐(p276-00);1-甲基-5-[[2-[5-(三氟甲基)-1h-咪唑-2-基]-4-吡啶基]氧基]-n-[4-(三氟甲基)苯基]-1h-苯并咪唑-2-胺(raf265);indisulam(e7070);roscovitine(cyc202);palbociclib(pd0332991);dinaciclib(sch727965);n-[5-[[(5-叔丁基
在一个实施方案中,激酶抑制剂为cdk4抑制剂,例如palbociclib(pd0332991),并且palbociclib以每日约50mg、60mg、70mg、75mg、80mg、90mg、100mg、105mg、110mg、115mg、120mg、125mg、130mg、135mg(例如,75mg、100mg或125mg)的剂量施用一段时间,例如28天周期的第14-21天每日施用,或21天周期的第7-12天每日施用。在一个实施方案中,施用1、2、3、4、5、6、7、8、9、10、11、12个或更多个周期的palbociclib。
在实施方案中,本文所述的car表达细胞与细胞周期蛋白依赖性激酶(cdk)4或6抑制剂,例如,本文所述的cdk4抑制剂或cdk6抑制剂组合施用于受试者。在实施方案中,本文所述的car表达细胞与cdk4/6抑制剂(例如,靶向cdk4和cdk6的抑制剂),例如,本文所述的cdk4/6抑制剂组合施用于受试者。在一个实施方案中,受试者具有mcl。mcl是一种侵入性癌症,其对目前可用的治疗弱应答,即,基本上不可治愈的。在mcl的许多情况下,在mcl细胞中表达细胞周期蛋白d1(cdk4/6的调节剂)(例如,由于涉及免疫球蛋白和细胞周期蛋白d1基因的染色体易位)。因此,不受理论的束缚,据认为,mcl细胞对cdk4/6抑制高度敏感,具有高特异性(即,对正常的免疫细胞的最小影响)。单独cdk4/6抑制剂在治疗mcl中已经有一定的效果,但只取得了部分缓解,复发率极高。示例性cdk4/6抑制剂是lee011(也称为ribociclib),其结构如下所示。
不受理论的约束,相信施用本文所述的car表达细胞与cdk4/6抑制剂(例如,本文所述的lee011或其他cdk4/6抑制剂)可以实现例如与单独的cdk4/6抑制剂相比更高的反应性,例如具有较高的缓解率和/或较低的复发率。
在一个实施方案中,激酶抑制剂为btk抑制剂,选自ibrutinib(pci-32765);gdc-0834;rn-486;cgi-560;cgi-1764;hm-71224;cc-292;ono-4059;cnx-774;和lfm-a13。在一个优选的实施方案中,btk抑制剂不会降低或抑制白介素-2诱导的激酶(itk))的激酶活性,并且选自gdc-0834;rn-486;cgi-560;cgi-1764;hm-71224;cc-292;ono-4059;cnx-774;和lfm-a13。
在一个实施方案中,激酶抑制剂为btk抑制剂,例如ibrutinib(pci-32765)。在实施方案中,本文所述的car表达细胞与btk抑制剂(例如,ibrutinib)组合施用于受试者。在实施方案中,本文所述的car表达细胞与ibrutinib(也称为pci-32765)组合施用于受试者。ibrutinib(1-[(3r)-3-[4-氨基-3-(4-苯氧基苯基)-1h-吡唑子基[3,4-d]嘧啶-1-基]哌啶-1-基]丙-2-烯-1-酮)的结构如下所示。
在实施方案中,受试者患有cll,套细胞淋巴瘤(mcl),或小淋巴细胞性淋巴瘤(sll)。例如,该受试者具有在第17号染色体的短臂中的缺失(del(17p),例如,在白血病细胞)。在其它实例中,受试者不具有del(17p)。在实施方案中,受试者已经复发cll或sll,例如,受试者先前已经施用了癌症治疗(例如,先前已经施用1、2、3或4次现有癌症疗法)。在实施方案中,受试者患有难治性cll或sll。在其他实施方案中,受试者患有滤泡性淋巴瘤,例如,复发或难治性滤泡性淋巴瘤。在一些实施方案中,ibrutinib以约300-600mg/天的剂量施用(例如,约300-350,350-400,400-450,450-500,500-550,或550-600mg/天,例如,约420mg/天或约560mg/天),例如,口服。在实施方案中,ibrutinib每日以约250mg、300mg、350mg、400mg、420mg、440mg、460mg、480mg、500mg、520mg、540mg、560mg、580mg、600mg(例如,250mg、420mg或560mg)的剂量施用一段时间,例如21天周期每日施用,或28天周期每日施用。在一个实施方案中,施用1、2、3、4、5、6、7、8、9、10、11、12个或更多个周期的ibrutinib。
在一些实施方案中,ibrutinib与利妥昔单抗组合施用。参见例如burgeretal.(2013)ibrutinibincombinationwithrituximab(ir)iswelltoleratedandinducesahighrateofdurableremissionsinpatientswithhigh-riskchroniclymphocyticleukemia(cll):new,updatedresultsofaphaseiitrialin40patients,abstract675presentedat55thashannualmeetingandexposition,neworleans,la7-10dec。不受理论的束缚,可以认为,加入ibrutinib增强了t细胞的增殖反应,并且可以从t辅助细胞2(th2)转移到t辅助细胞1(th1)表型。th1和th2是辅助性t细胞的表型,th1相比th2细胞定向不同的免疫应答途径。th1表型与炎症反应相关,例如用于杀死细胞,如细胞内病原体/病毒或癌性细胞,永久化自身免疫应答。th2表型与嗜酸性粒细胞的积累和抗炎应答有关。
在本文的方法,用途和组合物的一些实施方案中,btk抑制剂是国际申请wo/2015/079417中描述的btk抑制剂,其全部内容通过引用并入本文。例如,在一些实施方案中,btk抑制剂是式(i)的化合物或其药学上可接受的盐;
其中,
r1是氢,任选被羟基取代的c1-c6烷基;
r2是氢或卤素;
r3是氢或卤素;
r4是氢;
r5是氢或卤素;
或r4和r5彼此连接并代表键,-ch2-,-ch2-ch2-,-ch=ch-,-ch=ch-ch2-;-ch2-ch=ch-;或-ch2-ch2-ch2-;
r6和r7彼此独立地表示h,任选被羟基取代的c1-c6烷基,任选被卤素或羟基取代的c3-c6环烷基或卤素;
r8,r9,r,r’,r10和r11彼此独立地代表h或任选被c1-c6烷氧基取代的c1-c6烷基;或r8,r9,r,r’,r10和r11中的任何两个与它们所结合的碳原子一起可以形成3-6元饱和碳环;
r12是氢或任选被卤素或c1-c6烷氧基取代的c1-c6烷基;
或r12和r8,r9,r,r’,r10或r11中的任何一个与它们所结合的原子一起可以形成4,5,6或7元的氮杂环,该环可以任选地被卤素,氰基,羟基,c1-c6烷基或c1-c6烷氧基取代;
n为0或1;和
r13是任选被c1-c6烷基,c1-c6烷氧基或n,n-二-c1-c6烷基氨基取代的c2-c6烯基;任选被c1-c6烷基或c1-c6烷氧基取代的c2-c6炔基;或任选被c1-c6烷基取代的c2-c6环氧烷基(alkenyloxide)。
在一些实施方案中,式i的btk抑制剂选自:n-(3-(5-((1-丙烯酰基氮杂环丁烷-3-基)氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(e)-n-(3-(6-氨基-5-((1-(丁-2-烯酰基)氮杂环丁烷-3-基)氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-((1-丙炔酰氮杂环丁烷-3-基)氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-((1-(丁-2-炔酰基)氮杂环丁烷-3-基)氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(5-((1-丙烯酰基哌啶-4-基)氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(2-(n-甲基丙烯酰胺)乙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(e)-n-(3-(6-氨基-5-(2-(n-甲基丁-2-烯酰氨基)乙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(2-(n-甲基丙炔酰氨基)乙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(e)-n-(3-(6-氨基-5-(2-(4-甲氧基-n-甲基丁-2-烯酰氨基)乙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(2-(n-甲基丁-2-炔酰氨基)乙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(2-((4-氨基-6-(3-(4-环丙基-2-氟苯甲酰氨基)-5-氟-2-甲基苯基)嘧啶-5-基)氧基)乙基)-n-甲基环氧乙烷-2-甲酰胺;n-(2-((4-氨基-6-(3-(6-环丙基-8-氟-1-氧代异喹啉-2(1h)-基)苯基)嘧啶-5-基)氧基)乙基)-n-甲基丙烯酰胺;n-(3-(5-(2-丙烯酰胺乙氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(2-(n-乙基丙烯酰胺)乙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(2-(n-(2-氟乙基)丙烯酰胺)乙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(5-((1-丙烯酰胺环丙基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(5-(2-丙烯酰胺丙氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(6-氨基-5-(2-(丁-2-炔酰氨基)丙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(6-氨基-5-(2-(n-甲基丙烯酰胺)丙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(6-氨基-5-(2-(n-甲基丁-2-炔酰氨基)丙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(3-(n-甲基丙烯酰胺)丙氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(5-((1-丙烯酰基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(6-氨基-5-((1-(丁-2-炔酰基)吡咯烷-2-基)甲氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-2-(3-(5-((1-丙烯酰基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-(羟基甲基)苯基)-6-环丙基-3,4-二氢异喹啉-1(2h)-酮;n-(2-((4-氨基-6-(3-(6-环丙基-1-氧代-3,4-二氢异喹啉-2(1h)-基)-5-氟-2-(羟基甲基)苯基)嘧啶-5-基)氧基)乙基)-n-甲基丙烯酰胺;n-(3-(5-(((2s,4r)-1-丙烯酰-4-甲氧基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(((2s,4r)-1-(丁-2-炔酰基)-4-甲氧基吡咯烷-2-基)甲氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;2-(3-(5-(((2s,4r)-1-丙烯酰-4-甲氧基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-(羟基甲基)苯基)-6-环丙基-3,4-二氢异喹啉-1(2h)-酮;n-(3-(5-(((2s,4s)-1-丙烯酰-4-甲氧基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(((2s,4s)-1-(丁-2-炔酰基)-4-甲氧基吡咯烷-2-基)甲氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(5-(((2s,4r)-1-丙烯酰-4-氟吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(6-氨基-5-(((2s,4r)-1-(丁-2-炔酰基)-4-氟吡咯烷-2-基)甲氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(5-((1-丙烯酰基氮杂环丁烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-n-(3-(6-氨基-5-((1-丙炔酰氮杂环丁烷-2-基)甲氧基)嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(s)-2-(3-(5-((1-丙烯酰基氮杂环丁烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-(羟基甲基)苯基)-6-环丙基-3,4-二氢异喹啉-1(2h)-酮;(r)-n-(3-(5-((1-丙烯酰基氮杂环丁烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;(r)-n-(3-(5-((1-丙烯酰哌啶-3-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(5-(((2r,3s)-1-丙烯酰-3-甲氧基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;n-(3-(5-(((2s,4r)-1-丙烯酰-4-氰基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺;或n-(3-(5-(((2s,4s)-1-丙烯酰-4-氰基吡咯烷-2-基)甲氧基)-6-氨基嘧啶-4-基)-5-氟-2-甲基苯基)-4-环丙基-2-氟苯甲酰胺。
除非另有规定,否则上述用于描述式i的btk抑制剂的化学术语根据其在国际申请wo/2015/079417中所述的含义使用,其全部内容通过引用并入本文。
在一个实施方案中,激酶抑制剂为mtor抑制剂,选自坦罗莫司;雷达罗莫司(1r,2r,4s)-4-[(2r)-2[(1r,9s,12s,15r,16e,18r,19r,21r,23s,24e,26e,28z,30s,32s,35r)-1,18-二羟基-19,30-二甲氧基-15,17,21,23,29,35-六甲基-2,3,10,14,20-五氧代-11,36-二氧杂-4-氮杂三环[30.3.1.04,9]三十六碳-16,24,26,28-四烯-12-基]丙基]-2-甲氧基环己基二甲基亚膦酸酯,也称为ap23573和mk8669;依维莫司(rad001);雷帕霉素(ay22989);simapimod(5-{2,4-双[(3s)-3-甲基吗啉-4-基]吡啶并[2,3-d]嘧啶-7-基}-2-甲氧基苯基)甲醇(azd8055);2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基3-吡啶基)-4-甲基吡啶并[2,3-d]嘧啶-7(8h)-酮(pf04691502);和n2-[1,4-二氧代-4-[[4-(4-氧代-8-苯基-4h-1-苯并吡喃-2-基)吗啉鎓-4-基]甲氧基]丁基]-l-精氨酰基甘氨酰基-l-α-天冬氨酰基l-丝氨酸(seqidno:64),内盐(sf1126);和xl765。
在一个实施方案中,激酶抑制剂为mtor抑制剂,例如雷帕霉素,并且雷帕霉素每日以约3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg(例如6mg)的剂量施用一段时间,例如21天周期每日施用,或28天周期每日施用。在一个实施方案中,施用1、2、3、4、5、6、7、8、9、10、11、12个或更多个周期的雷帕霉素。在一个实施方案中,激酶抑制剂为mtor抑制剂,例如依维莫司,并且依维莫司以每日约2mg、2.5mg、3mg、4mg、5mg、6mg、7mg、8mg、9mg、10mg、11mg、12mg、13mg、14mg、15mg(例如,10mg)的剂量施用一段时间,例如28天周期每日施用。在一个实施方案中,施用1、2、3、4、5、6、7、8、9、10、11、12个或更多个周期的依维莫司。
在一个实施方案中,激酶抑制剂为mnk抑制剂,选自cgp052088;4-氨基-3-(对-氟苯基氨基)-吡唑并[3,4-d]嘧啶(cgp57380);cercosporamide;etc-1780445-2;和4-氨基-5-(4-氟苯氨基)-吡唑并[3,4-d]嘧啶。
在实施方案中,本文所述的car表达细胞与磷酸肌醇3-激酶(pi3k)抑制剂(例如,本文所述的pi3k抑制剂,例如,idelalisib或duvelisib)和/或利妥昔单抗组合施用于受试者。在实施方案中,本文所述的car表达细胞与idelalisib和利妥昔单抗组合施用于受试者。在实施方案中,本文所述的car表达细胞与duvelisib和利妥昔单抗组合施用于受试者。idelalisib(也被称为gs-1101或cal-101;gilead)是一种小分子,其阻断pi3k的δ同工型。idelalisib(5-氟-3-苯基-2-[(1s)-1-(7h-嘌呤-6-基氨基)丙基]-4(3h)-喹唑啉酮)的结构如下所示。
duvelisib(也称为ipi-145;infinitypharmaceuticalsandabbvie)是一种小分子,其阻断pi3k-δ,γ。duvelisib(8-氯-2-苯基-3-[(1s)-1-(9h-嘌呤-6-基氨基)乙基]-1-(2h)-异喹啉酮)的结构如下所示。
在实施方案中,受试者患有cll。在实施方案中,受试者具有复发的cll,例如,受试者先前已经施用了癌症治疗(例如,先前已施用抗cd20抗体或先前已经施用ibrutinib)。例如,该受试者具有在第17号染色体的短臂的缺失(del(17p),例如,在白血病细胞中)。在其它实例中,受试者不具有del(17p)。在实施方案中,所述受试者包括包含在免疫球蛋白重链可变区((igvh)基因中突变的白血病细胞。在其他实施方案中,受试者不包括包含在免疫球蛋白重链可变区(igvh)基因中突变的白血病细胞。在实施方案中,受试者具有在11号染色体长臂中的缺失((del(11q))。在其他实施方案中,受试者不具有(del(11q)。在实施方案中,idelalisib以约100-400mg(例如,100-125,125-150,150-175,175-200,200-225,225-250,250-275,275-300,325-350,350-375,或375-400mg)的剂量施用,例如,bid。在实施方案中,duvelisib以约15-100mg(例如,约15-25,25-50,50-75,或75-100mg)的剂量施用,例如每天两次。在实施方案中,利妥昔单抗以约350-550mg/m2(例如,350-375,375-400,400-425,425-450,450-475,或475-500mg/m2)的剂量,例如静脉内施用。
在一个实施方案中,激酶抑制剂为双重磷脂酰肌醇3-激酶(pi3k)和mtor抑制剂,其选自2-氨基-8-[反式-4-(2-羟基乙氧基)环己基]-6-(6-甲氧基3-吡啶基)-4-甲基吡啶并[2,3-d]嘧啶-7(8h)-酮(pf-04691502);n-[4-[[4-(二甲基氨基)-1-哌啶基]羰基]苯基]-n’-[4-(4,6-二-4-吗啉基-1,3,5-三嗪-2-基)苯基]脲(pf-05212384,pki-587);2-甲基-2-{4-[3-甲基-2-氧代-8-(喹啉-3-基)-2,3-二氢-1h-咪唑并[4,5-c]喹啉-1-基]苯基}丙烷腈(bez-235);apitolisib(gdc-0980,rg7422);2,4-二氟-n-{2-(甲氧基)-5-[4-(4-哒嗪基)-6-喹啉基]-3-吡啶基}苯磺酰胺(gsk2126458);8-(6-甲氧基吡啶-3-基)-3-甲基-1-(4-(哌嗪-1-基)-3-(三氟甲基)苯基)-1h-咪唑并[4,5-c]喹啉-2(3h)-酮马来酸(nvp-bgt226);3-[4-(4-吗啉基吡啶并[3’,2’:4,5]呋喃并[3,2-d]嘧啶-2-基]苯酚(pi-103);5-(9-异丙基-8-甲基-2-吗琳子基-9h-嘌呤-6-基)嘧啶-2-胺(vs-5584,sb2343);和n-[2-[(3,5-二甲氧基苯基)氨基]喹喔啉-3-基]-4-[(4-甲基-3-甲氧基苯基)羰基]氨基苯基磺酰胺(xl765)。
在实施方案中,本文所述的car表达细胞与间变性淋巴瘤激酶(alk)抑制剂组合施用于受试者。示例性的alk激酶包括但不限于crizotinib(pfizer),ceritinib(novartis),alectinib(chugai),brigatinib(也称为ap26113;ariad),entrectinib(ignyta),pf-06463922(pfizer),tsr-011(tesaro)(参见,例如,临床试验标识符号nct02048488),cep-37440(teva),和x-396(xcovery)。在一些实施方案中,受试者具有实体癌,例如,本文所述的实体癌,例如,肺癌。
crizotinib的化学名称是3-[(1r)-1-(2,6-二氯-3-氟苯基)乙氧基]-5-(1-哌啶-4-基吡唑-4-基)吡啶-2-胺。ceritinib的化学名称是5-氯-n2-[2-异丙氧基-5-甲基-4-(4-哌啶基)苯基]-n4-[2-(异丙基磺酰基)苯基]-2,4-嘧啶二胺。alectinib的化学名称是9-乙基-6,6-二甲基-8-(4-吗啉代哌啶-1-基)-11-氧代-6,11-二氢-5h-苯并[b]咔唑-3-腈。brigatinib的化学名称是5-氯-n2-{4-[4-(二甲基氨基)-1-哌啶基]-2-甲氧基苯基}-n4-[2-(二甲基磷酰基)苯基]-2,4-嘧啶二胺。entrectinib的化学名称是n-(5-(3,5-二氟苄基)-1h-吲唑-3-基)-4-(4-甲基哌嗪-1-基)-2-((四氢-2h-吡喃-4-基)氨基)苯甲酰胺。pf-06463922的化学名称是(10r)-7-氨基-12-氟-2,10,16-三甲基-15-氧代-10,15,16,17-四氢-2h-8,4-(metheno)吡唑子基[4,3-h][2,5,11]-苯并氧杂氮杂环十四烷-3-腈。cep-37440的化学结构是(s)-2-((5-氯-2-((6-(4-(2-羟基乙基)哌嗪-1-基)-1-甲氧基-6,7,8,9-四氢-5h-苯并[7]轮烯-2-基)氨基)嘧啶-4-基)氨基)-n-甲基苯甲酰胺。x-396的化学名称是(r)-6-氨基-5-(1-(2,6-二氯-3-氟苯基)乙氧基)-n-(4-(4-甲基哌嗪-1-羰基)苯基)哒嗪-3-甲酰胺。
也可以使用抑制钙依赖性磷酸酶钙调神经磷酸酶(环胞菌素和fk506)或抑制对于生长因子诱导的信号传导重要的p70s6激酶的药物(雷帕霉素)(liu等人,cell66:807-815,1991;henderson等人,immun.73:316-321,1991;bierer等人,curr.opin.immun.5:763-773,1993)。在一个进一步的方面,本发明的细胞组合物可以与下述一起(例如,在其之前、同时或在其之后)施用于患者:骨髓移植、使用化疗剂比如氟达拉滨的t细胞烧蚀疗法、外部-光束放射疗法(xrt)、环磷酰胺和/或抗体比如okt3或campath。在一个方面,本发明的细胞组合物是在b细胞烧蚀疗法比如与cd20反应的作用剂例如rituxan之后施用的。例如,在一个实施方案中,受试者可以进行用高剂量化疗,接着是周围血液干细胞移植的标准疗法。在某些实施方案中,在移植之后,受试者接受本发明的扩增免疫细胞的输注。在一个另外的实施方案中,在外科手术之前或之后施用扩增的细胞。
在实施方案中,本文所述的car表达细胞与吲哚胺2,3-双加氧酶(ido)抑制剂组合施用于受试者。ido是催化氨基酸l-色氨酸分解成对犬尿氨酸的酶。许多癌症过表达ido,例如,前列腺癌,结肠直肠癌,胰腺癌,子宫颈癌,胃癌,卵巢癌,头癌和肺癌。pdc细胞,巨噬细胞和树突细胞(dc)可以表达ido。不受理论的束缚,据认为,l-色氨酸的减少(例如,通过ido催化的)通过诱导t细胞无反应性和细胞凋亡导致免疫抑制环境。因此,不受理论的束缚,据认为,ido抑制剂可以提高本文所述的car表达细胞的功效,例如通过减少car表达免疫细胞的抑制或死亡。在实施方案中,受试者具有实体瘤,例如,本文所述的实体瘤,例如,前列腺癌,结肠直肠癌,胰腺癌,子宫颈癌,胃癌,卵巢癌,头癌,或肺癌。ido的示例性抑制剂包括但不限于:1-甲基-色氨酸,indoximod(newlinkgenetics)(见,例如,临床试验标识号nct01191216;nct01792050)和incb024360(incytecorp.)(见,例如,临床试用标识号nct01604889;nct01685255)。
在实施方案中,本文所述的car表达细胞与髓源抑制细胞(mdscs)的调节剂组合施用于受试者。mdscs积聚在许多实体瘤的外周和肿瘤部位。这些细胞抑制t细胞应答,从而阻碍car表达细胞疗法的功效。不受理论的束缚,可以认为,mdsc调节剂的施用增强了本文所述的car表达细胞的疗效。在一个实施方案中,受试者具有实体瘤,例如,本文所述的实体瘤,例如,成胶质细胞瘤。mdscs的示例性调节剂包括但不限于:mcs110和blz945。mcs110是抗巨噬细胞集落刺激因子(m-csf)的单克隆抗体(mab)。见,例如,临床试验标识号nct00757757。blz945是集落刺激因子1受体(csf1r)的小分子抑制剂。见,例如,pyontecketal.nat.med.19(2013):1264-72。blz945的结构如下所示。
在实施方案中,将本文所述的car表达细胞与抑制或降低免疫抑制性浆细胞活性的试剂组合施用于受试者。已经显示免疫抑制性浆细胞阻止t细胞依赖性免疫原性化疗,例如奥沙利铂(shalapour等人,nature2015,521:94-101)。在一个实施方案中,免疫抑制性浆细胞可以表达iga,白介素(il)-10和pd-l1中的一种或多种。在一个实施方案中,所述试剂是表达cd19car的细胞或表达bcmacar的细胞。
在一些实施方案中,本文所述的car表达细胞与白介素-15(il-15)多肽,白介素15受体α(il-15ra)多肽,或il-15多肽和il-15ra多肽的组合例如,hetil-15(admunetherapeutics,llc)组合施用于受试者。hetil-15是il-15和il-15ra的异二聚体非共价复合体。hetil-15被描述在,例如,u.s.8,124,084,u.s.2012/0177598,u.s.2009/0082299,u.s.2012/0141413,和u.s.2011/0081311,其通过引用并入本文。在实施方案中,het-il-15皮下给药。在实施方案中,受试者具有癌症,例如,实体癌,例如,黑素瘤或结肠癌。在实施方案中,受试者具有转移性癌症。
在实施方案中,对患有本文所述疾病例如血液病症例如aml或mds的受试者组合施用本文所述的car表达细胞与活性剂例如细胞毒性或化疗剂,生物治疗(例如,抗体,例如单克隆抗体或细胞治疗)或抑制剂(例如激酶抑制剂)。在实施方案中,将本文所述的car表达细胞与细胞毒性剂,例如cpx-351(celatorpharmaceuticals),阿糖胞苷,柔红霉素,vosaroxin(sunesispharmaceuticals)),sapacitabine(cyclacelpharmaceuticals),伊达比星或米托蒽醌组合施用于受试者。cpx-351是一种以5:1摩尔比含有阿糖胞苷和柔红霉素的脂质体制剂。在实施方案中,将本文所述的car表达细胞与低甲基化试剂(例如dna甲基转移酶抑制剂,例如氮杂胞苷或地西他滨)组合施用于受试者。在实施方案中,将本文所述的car表达细胞与生物疗法(例如抗体或细胞疗法,例如225ac-林妥珠单抗(actimab-a;actiniumpharmaceuticals),iph2102(innatepharma/bristolmyerssquibb),sgn-cd33a(seattlegenetics)或gemtuzumabozogamicin(mylotarg;pfizer)组合施用于受试者。sgn-cd33a是包含连接于抗cd33抗体的吡咯并苯并二氮杂
在另一个实施方案中,受试者在移植之前接受本发明的car表达细胞组合物的输注,例如细胞的同种异体干细胞移植。在优选的实施方案中,car表达细胞瞬时表达nkr-car,例如kir-car,例如通过电穿孔编码nkr-car,例如kir-car的mrna,由此肿瘤抗原的表达是输注供体干细胞之前终止以避免植入失败。
在给药期间或之后,一些患者可能对本发明化合物和/或其它抗癌药物发生过敏反应;因此,通常施用抗过敏剂以最小化过敏反应的风险。合适的抗过敏剂包括皮质类固醇,例如地塞米松(例如,
一些患者在施用本发明化合物和/或其它抗癌剂的过程中和之后可能会感到恶心;因此,止吐药可用于预防恶心(上胃)和呕吐。合适的止吐药包括:阿瑞吡坦
缓解治疗期间经历的疼痛的药物通常被处方为使患者更舒适。通常使用常用的非处方止痛剂,如
为了保护正常细胞免受治疗毒性和限制器官毒性,可以使用细胞保护剂(如神经保护剂,自由基清除剂,心脏保护剂,蒽环类外渗中和剂,营养物等)作为辅助疗法。合适的细胞保护剂包括氨磷汀
通过代号,通用名或商品名识别的活性化合物的结构可以从标准简编“themerckindex”的实际版本中获取,或者从数据库,例如,patentsinternational(例如imsworldpublications)获取。
可以与本发明化合物组合使用的上述化合物可以如本领域中,例如在上述文献中所述制备和施用。
在一个实施方案中,本发明提供药物组合物,其包含至少一种本发明的化合物(例如本发明的化合物)或其药学上可接受的盐以及适用于单独或与其他抗癌剂一起施用于人或动物受试者的药学上可接受的载体。
在一个实施方案中,本发明提供了治疗患有诸如癌症的细胞增殖性疾病的人或动物受试者的方法。本发明提供了治疗需要这种治疗的人或动物受试者的方法,包括向受试者施用单独或与其他抗癌剂组合的治疗有效量的本发明化合物(例如本发明化合物)或其药学上可接受的盐。
特别地,组合物将作为组合治疗一起配制或单独给药。
在组合疗法中,本发明的化合物和其它抗癌剂可以同时,并存或相继地施用,没有特定的时间限制,其中这种施用在患者体内提供治疗有效水平的两种化合物。
在优选的实施方案中,本发明化合物和其它抗癌剂通常通过输注或口服以任何顺序依次施用。给药方案可以根据疾病的阶段,患者的身体适应性,各种药物的安全性特征和各种药物的耐受性以及施用组合的主治医师和医学从业者所熟知的其他标准而变化。根据用于治疗的特定周期,本发明的化合物和其它抗癌剂可以在彼此分开的几分钟内,几小时,几天或甚至几周内施用。此外,该周期可以包括在治疗周期期间以及以每次施用药物的不同剂量施用一种药物多于另一种药物。
在本发明的另一方面,提供了包括一种或多种本发明化合物和本文公开的组合配偶体的药盒。代表性药盒包括(a)本发明的化合物或其药学上可接受的盐,(b)至少一种组合配偶体,例如如上所述,其中该药盒可以包含包装插页或包括给药指示的其他标签。
本发明的化合物也可以与已知的治疗过程例如,施用激素或特别是放射组合使用。本发明的化合物可特别用作放射增敏剂,特别是用于治疗对放射疗法敏感性差的肿瘤。
在一个实施方案中,可以向受试者施用减轻或改善与施用表达car的细胞有关的副作用的作用剂。与施用表达car的细胞有关的副作用包括,但不限于crs和噬血细胞性淋巴组织细胞增生症(hlh),也称为巨噬细胞活化综合征(mas)。crs的症状包括高烧、恶心、短暂性低血压、缺氧等。crs可以包括临床组成性体征和症状,比如发热、疲劳、厌食、肌痛、关节疼痛(arthalgias)、恶心、呕吐和头痛。crs可以包括临床皮肤性体征和症状,比如皮疹。crs可以包括临床胃肠道体征和症状,比如恶心、呕吐和腹泻。crs可以包括临床呼吸性体征和症状,比如呼吸急促和低氧血症。crs可以包括临床心血管体征和症状,比如心动过速、加宽的脉压、低血压、增加的心输出量(早期)和潜在减少的心输出量(晚期)。crs可以包括临床凝血性体征和症状,比如升高的d-二聚体、具有或不具有出血的低纤维蛋白原血症。crs可以包括临床肾脏性体征和症状,比如氮血症。crs可以包括临床肝脏性体征和症状,比如转氨酶升高(transaminitis)和高胆红素血症。crs可以包括临床神经性体征和症状,比如头痛、精神状态变化、意识错乱、谵忘、找字困难或frank失语症、幻觉、震颤、痴呆(dymetria)、步态改变和发作。
因此,本文所述方法可以包括向受试者施用本文所述表达car的细胞,并且进一步施用用于控制因采用表达car的细胞治疗而引起的可溶性因子水平升高的一种或多种作用剂。在一个实施方案中,受试者中升高的可溶性因子为ifn-γ、tnfα、il-2和il-6中的一种或多种。在一个实施方案中,受试者中升高的因子为il-1、gm-csf、il-10、il-8、il-5和fraktalkine中的一种或多种。因此,施用以治疗该副作用的作用剂可以是中和这些可溶性因子中一种或多种的作用剂。在一个实施方案中,中和一种或多种这些可溶性形式的作用剂是抗体或其抗原结合片段。这样的作用剂的实例包括,但不限于类固醇(例如,皮质类固醇)、tnfα的抑制剂和il-6的抑制剂。tnfα抑制剂的实例为抗-tnfα抗体分子,比如英夫利昔单抗(infliximab)、阿达木单抗(adalimumab)、赛妥珠单抗(certolizumabpegol)和戈利木单抗(golimumab)。tnfα抑制剂的另一个实例为融合蛋白,比如依他西普(entanercept)。tnfα的小分子抑制剂包括但不限于黄嘌呤衍生物(例如己酮可可碱)和安非他酮。il-6抑制剂的实例为抗-il-6抗体分子,比如tocilizumab(toc)、sarilumab、elsilimomab、cnto328、ald518/bms-945429,cnto136,cpsi-2364,cdp6038,vx30,argx-109,fe301和fm101。在一个实施方案中,抗il-6抗体分子为tocilizumab。基于il-1r的抑制剂的实例为阿那白滞素(anakinra)。
在一些实施方案中,对受试者施用皮质类固醇,例如甲泼尼龙,氢化可的松等。
在一些实施方案中,对受试者施用血管加压剂,例如去甲肾上腺素,多巴胺,去氧肾上腺素,肾上腺素,加压素或其组合。
在一个实施方案中,可以对受试者施用解热剂。在一个实施方案中,可以对受试者施用止痛剂。
在一个实施方案中,可以向受试者施用增强表达car的细胞的活性的作用剂。例如,在一个实施方案中,作用剂可以为抑制抑制性分子的作用剂,例如,作用剂是检查点抑制剂。在某些实施方案中,抑制性分子例如程序化死亡1(pd1)可以降低表达car的细胞建立免疫效应物应答的能力。抑制性分子的实例包括pd1、pd-l1、ctla4、tim3、lag3、vista、btla、tigit、lair1、cd160、2b4和tgfrβ。例如通过抑制dna、rna或蛋白水平来调控或调节(例如抑制)t细胞功能的分子抑制抑制性分子,可以优化表达car的细胞的功能。在实施方案中,抑制性核酸例如如本文所述的抑制性核酸,例如dsrna,例如sirna或shrna;簇状的规则间隔的短回文重复序列(crispr)、转录活化剂如效应物核酸酶(talen)、或锌指核酸内切酶(zfn),可用于抑制表达car的细胞中抑制性分子的表达。在一个实施方案中,抑制剂为shrna。在一个实施方案中,抑制性分子在表达car的细胞内被抑制。在这些实施方案中,抑制抑制性分子表达的dsrna分子连接至编码car的组分(例如所有组分)的核酸。
在一个实施方案中,编码抑制调节或调整例如抑制t细胞功能的分子表达的dsrna分子的核酸分子有效连接到启动子,例如h1-或u6衍生的启动子,使得抑制调节或调整例如抑制t细胞功能的分子表达的dsrna分子被表达,例如在表达car的细胞内表达。参见例如tiscorniag.,“developmentoflentiviralvectorsexpressingsirna,”chapter3,ingenetransfer:deliveryandexpressionofdnaandrna(eds.friedmannandrossi).coldspringharborlaboratorypress,coldspringharbor,ny,usa,2007;brummelkamptr,etal.(2002)science296:550–553;miyagishim,etal.(2002)nat.biotechnol.19:497–500。在一个实施方案中,编码抑制调节或调整,例如抑制t细胞功能的分子表达的dsrna分子的核酸分子存在于相同的载体上,例如包含编码car的组件,例如所有组件的核酸分子的慢病毒载体上。在这样的实施方案中,编码抑制调节或调整,例如抑制t细胞功能的分子表达的dsrna分子的核酸分子位于载体上,例如慢病毒载体上,编码car的组件,例如所有组件的核酸的5’-或3’。编码抑制调节或调整,例如抑制t细胞功能的分子表达的dsrna分子的核酸分子可以以与编码car的组件,例如所有组件的核酸相同或不同的方向转录。
在一个实施方案中,编码抑制调节或调整,例如抑制t细胞功能的分子表达的dsrna分子的核酸分子存在于除包含编码car的组件,例如所有组件的核酸分子的载体之外的载体上。在一个实施方案中,编码抑制调节或调整,例如抑制t细胞功能的分子表达的dsrna分子的核酸分子在表达car的细胞内瞬时表达。在一个实施方案中,编码抑制调节或调整,例如抑制t细胞功能的分子表达的dsrna分子的核酸分子稳定地整合到car表达细胞的基因组中。图44a-44e描绘了用于表达car的组件,例如所有组件的载体的实例,所述载体具有抑制调节或调整,例如抑制t细胞功能的分子表达的dsrna分子。
以下提供了可用于抑制调节或调整例如抑制t细胞功能的分子表达的dsrna分子的实例,其中调节或调整例如抑制t细胞功能的分子是pd-1。
下表7中提供了pdcd1(pd1)rnai试剂(来源于它们在小鼠pdcd1基因序列nm_008798.2中的位置)的名称,以及表示dna序列的seqidno:216-263。有义(s)和反义(as)序列呈现为19mer,21mer序列在该表中。还要注意,位置(pos,例如176)来源于小鼠pdcd1基因序列nm_008798.2中的位置编号。seqidno以对应于“sense19”seqidnos:65-76;“sense21”seqidnos:77-88;“asense21”seqidnos:89-100;“asense19”seqidnos:101-112的12组表示。
表7.小鼠pdcd1(pd1)shrna序列
下表8中提供了pdcd1(pd1)rnai试剂的名称(源于它们在人pdcd1基因序列中的位置,连同代表dna序列的seqidno:264-311)。有义(s)和反义(as)序列以19mer和21mer序列表示,seqidno以对应于“sense19”seqidnos:113-124;“sense21”seqidnos:125-136;“asense21”seqidnos:137-148;“asense19”seqidnos:149-160的12组指示。
表8.人pdcd1(pd1)shrna序列
在一个实施方案中,抑制性信号的抑制剂可以是例如结合抑制性分子的抗体或抗体片段。例如,作用剂可以为结合pd1、pd-l1、pd-l2或ctla4(例如ipilimumab(也称为mdx-010和mdx-101,且作为
pd-1为cd28受体家族的抑制性成员,该受体家族也包括cd28、ctla-4、icos和btla。pd-1在活化的b细胞、t细胞和骨髓细胞上表达(agata等人1996int.immunol8:765-75)。pd-1的两个配体pd-l1和pd-l2已经显示出当结合pd-1时下调t细胞活化(freemaneta.2000jexpmed192:1027-34;latchman等人2001natimmunol2:261-8;carter等人2002eurjimmunol32:634-43)。pd-l1在人类癌症中丰富地存在(dong等人2003jmolmed81:281-7;blank等人2005cancerimmunol.immunother54:307-314;konishi等人2004clincancerres10:5094)。免疫抑制可以通过抑制pd-1与pd-l1的局部相互作用来逆转。
抗体、抗体片段及pd-1、pd-l1和pd-l2的其它抑制剂是本领域可获得的,并且可以与本文所述本发明的car联合使用。例如,nivolumab(也称为bms-936558或mdx1106;bristol-myers)是一种完全人类igg4单克隆抗体,其特异性地阻断pd-1。nivolumab(克隆5c4)及特异性地结合pd-1的其他人类单克隆抗体公开在us8,008,449和wo2006/121168中。pidilizumab(ct-011;curetech)是一种结合pd-1的人源化的igg1k单克隆抗体。pidilizumab及其它人源化的抗-pd-1单克隆抗体公开在wo2009/101611中。pembrolizumab(之前称为lambrolizumab,也称为mk03475;merck)是一种结合pd-1的人源化的igg4单克隆抗体。pembrolizumab及其它人源化的抗-pd-1抗体公开在us8,354,509和wo2009/114335中。medi4736(medimmune)是一种人类单克隆抗体,其结合pdl1,并且抑制配体与pd1的相互作用。mdpl3280a(genentech/roche)是一种结合pd-l1的人类fc优化的igg1单克隆抗体。mdpl3280a及其它针对pd-1的人类单克隆抗体公开在美国专利号:7,943,743和美国公开号∶20120039906中。其它抗-pd-l1结合剂包括yw243.55.s70(重链和轻链可变区显示在wo2010/077634中的seqidnos20和21中)和mdx-1105(也称为bms-936559,及例如wo2007/005874中公开的抗-pd-l1结合剂)。amp-224(b7-dcig;amplimmune;例如wo2010/027827和wo2011/066342中公开的)是一种阻断pd-1和b7-h1之间的相互作用的pd-l2fc融合可溶性受体。其它抗pd-1抗体包括amp514(amplimmune),尤其例如us8,609,089、us2010028330和/或us20120114649中公开的抗-pd-1抗体。
在一个实施方案中,抗pd-1抗体或其片段是标题为“antibodymoleculestopd-1andusesthereof”的us2015/0210769(其全部内容通过引用并入本文)中所述的抗pd-1抗体分子。在一个实施方案中,抗pd-1抗体分子包含来自选自以下任何一种的抗体的重链和轻链可变区的至少一个,二个,三个,四个,五个或六个cdr(或统称为所有cdr):bap049-hum01,bap049-hum02,bap049-hum03,bap049-hum04,bap049-hum05,bap049-hum06,bap049-hum07,bap049-hum08,bap049-hum09,bap049-hum10,bap049-hum11,bap049-hum12,bap049-hum13,bap049-hum14,bap049-hum15,bap049-hum16,bap049-clone-a,bap049-clone-b,bap049-clone-c,bap049-clone-d,或bap049-clone-e;或如us2015/0210769的表1所述,或由表1中的核苷酸序列编码,或与前述序列任一个基本相同的序列(例如,至少80%,85%,90%,92%,95%,97%,98%,99%或更高的同一性);或密切相关的cdr,例如相同或具有至少一个氨基酸改变但不超过两个,三个或四个改变(例如,取代,缺失或插入,例如保守取代)的cdr。
在另一个实施方案中,抗pd-1抗体分子包含来自本文所述抗体,例如选自bap049-hum01,bap049-hum02,bap049-hum03,bap049-hum04,bap049-hum05,bap049-hum06,bap049-hum07,bap049-hum08,bap049-hum09,bap049-hum10,bap049-hum11,bap049-hum12,bap049-hum13,bap049-hum14,bap049-hum15,bap049-hum16,bap049-clone-a,bap049-clone-b,bap049-clone-c,bap049-clone-d,或bap049-clone-e任一个的抗体的至少一个,两个,三个或四个可变区;或如us2015/0210769的表1所述,或由表1中的核苷酸序列编码;或与上述任何序列基本相同(例如,至少80%,85%,90%,92%,95%,97%,98%,99%或更高同一性)的序列。
tim-3(t细胞免疫球蛋白-3)也负向调节t细胞功能,特别是在ifn-g-分泌cd4+t辅助因子1和cd8+t细胞毒素1细胞中,并且在t细胞耗尽中起关键作用。抑制tim3及其配体(例如半乳凝素-9(gal9)、磷脂酰基丝氨酸(ps)和hmgb1)之间的相互作用可以提高免疫应答。tim3及其配体的抗体、抗体片段及其它抑制剂是本领域可获得的,并且可以与本文所述cd19car联合使用。例如,靶向tim3的抗体、抗体片段、小分子或肽抑制剂结合tim3的igv结构域,以抑制与其配体的相互作用。抑制tim3的抗体和肽公开在wo2013/006490和us20100247521中。其它抗-tim3抗体包括rmt3-23的人源化形式(公开在ngiow等人,2011,cancerres,71:3540-3551中)和克隆8b.2c12(公开在monney等人,2002,nature,415:536-541)中。抑制tim3和pd-1的双特异性抗体公开在us20130156774中。
在一个实施方案中,抗tim3抗体或其片段是标题为“antibodymoleculestotim3andusesthereof”的us2015/0218274(其全部内容通过引用并入本文)中所述的抗tim3抗体分子。在一个实施方案中,抗tim3抗体分子包含来自选自以下任何一种的抗体的重链和轻链可变区的至少一个,二个,三个,四个,五个或六个cdr(或统称为所有cdr):abtim3,abtim3-hum01,abtim3-hum02,abtim3-hum03,abtim3-hum04,abtim3-hum05,abtim3-hum06,abtim3-hum07,abtim3-hum08,abtim3-hum09,abtim3-hum10,abtim3-hum11,abtim3-hum12,abtim3-hum13,abtim3-hum14,abtim3-hum15,abtim3-hum16,abtim3-hum17,abtim3-hum18,abtim3-hum19,abtim3-hum20,abtim3-hum21,abtim3-hum22,abtim3-hum23;或如us2015/0218274的表1-4所述,或由表1-4中的核苷酸序列编码,或与前述序列任一个基本相同的序列(例如,至少80%,85%,90%,92%,95%,97%,98%,99%或更高的同一性);或密切相关的cdr,例如相同或具有至少一个氨基酸改变但不超过两个,三个或四个改变(例如,取代,缺失或插入,例如保守取代)的cdr。
在另一个实施方案中,抗tim3抗体分子包含来自本文所述抗体,例如选自abtim3,abtim3-hum01,abtim3-hum02,abtim3-hum03,abtim3-hum04,abtim3-hum05,abtim3-hum06,abtim3-hum07,abtim3-hum08,abtim3-hum09,abtim3-hum10,abtim3-hum11,abtim3-hum12,abtim3-hum13,abtim3-hum14,abtim3-hum15,abtim3-hum16,abtim3-hum17,abtim3-hum18,abtim3-hum19,abtim3-hum20,abtim3-hum21,abtim3-hum22,abtim3-hum23任一个的抗体的至少一个,两个,三个或四个可变区;或如us2015/0218274的表1-4所述,或由表1-4中的核苷酸序列编码,或与前述序列任一个基本相同的序列(例如,至少80%,85%,90%,92%,95%,97%,98%,99%或更高的同一性)。
在其它实施方案中,提高表达car的细胞的活性的作用剂是ceacam抑制剂(例如,ceacam-1,ceacam-3和/或ceacam-5抑制剂)。在一个实施方案中,ceacam的抑制剂是抗-ceacam抗体分子。示例性的抗-ceacam抗体分子被描述在wo2010/125571、wo2013/082366、wo2014/059251和wo2014/022332中,例如单克隆抗体34b1、26h7和5f4;或其重组形式,如被描述在例如us2004/0047858、us7,132,255和wo99/052552中。在其它实施方案中,抗-ceacam抗体结合ceacam-5,如在例如zheng等人plosone.2010sep2;5(9).pii:e12529(doi:10:1371/journal.pone.0021146)中所述,或与ceacam-1和ceacam-5交叉反应,如在例如wo2013/054331和us2014/0271618中所述。
不希望受到理论的束缚,癌胚抗原细胞粘附分子(ceacam)比如ceacam-1和ceacam-5被认为至少部分地介导、抑制抗肿瘤免疫应答(参见,例如markel等人jimmunol.2002mar15;168(6):2803-10;markel等人jimmunol.2006nov1;177(9):6062-71;markel等人immunology.2009feb;126(2):186-200;markel等人cancerimmunolimmunother.2010feb;59(2):215-30;ortenberg等人molcancerther.2012jun;11(6):1300-10;stern等人jimmunol.2005jun1;174(11):6692-701;zheng等人plosone.2010sep2;5(9).pii:e12529)。例如,ceacam-1已经被描述为tim-3的异嗜性配体且在tim-3-介导的t细胞耐受性和耗尽中起作用(参见,例如wo2014/022332;huang,等人(2014)naturedoi:10.1038/nature13848)。在实施方案中,在异种移植物结肠直肠癌模型中,ceacam-1和tim-3的共同阻断已经显示出增强抗肿瘤免疫应答(参见,例如wo2014/022332;huang,等人(2014),同上)。在其它实施方案中,ceacam-1和pd-1的共同阻断减低了t细胞耐受性,如例如wo2014/059251中所述。因此,ceacam抑制剂可以与本文所述其它免疫调节剂(例如,抗-pd-1和/或抗-tim-3抑制剂)一起用于增强针对癌症,例如黑素瘤、肺癌(例如nsclc)、膀胱癌、结肠癌、卵巢癌及如本文所述的其它癌症的免疫应答。
lag-3(淋巴细胞活化基因-3或cd223)是在活化的t细胞和b细胞上表达的细胞表面分子,其已经显示在cd8+t细胞耗尽中起作用。lag-3及其配体的抗体、抗体片段及其它抑制剂是本领域可获得的,并且可以与本文所述cd19car联合使用。例如,bms-986016(bristol-myerssquib)是一种靶向lag-3的单克隆抗体。imp701(immutep)是一种拮抗剂lag3抗体,并且imp731(immutep和glaxosmithkline)是一种耗尽lag-3的抗体。其它lag-3抑制剂包括imp321(immutep),其为lag3和ig的可溶性部分的重组融合蛋白,其结合ii类mhc分子且活化抗原呈递细胞(apc)。其它抗体被公开在例如wo2010/019570中。
在某些实施方案中,提高表达car的细胞的活性的作用剂可以是例如包含第一结构域和第二结构域的融合蛋白,其中第一结构域是抑制性分子或其片段,且第二结构域是与正信号缔合的多肽,例如包含如本文所述的胞内信号传导结构域的多肽。在某些实施方案中,与正信号缔合的多肽可以包括cd28、cd27、icos的共刺激结构域,例如cd28、cd27和/或icos的胞内信号传导结构域,和/或初级信号结构域,例如如本文所述的cd3ζ。在一个实施方案中,融合蛋白由表达car的相同细胞表达。在另一个实施方案中,融合蛋白由不表达car的细胞(例如t细胞)表达。
在一个实施方案中,本文所述提高表达car的细胞的活性的作用剂为mir-17-92。
在一个实施方案中,增强本文描述的car活性的物质是细胞因子。细胞因子具有与t细胞扩增,分化,存活和内稳态相关的重要功能。可以施用给接受本文所述的car表达细胞的受试者的细胞因子包括:il-2,il-4,il-7,il-9,il-15,il-18,和il-21,或其组合。在优选的实施方案中,所施用的细胞因子是il-7,il-15,或il-21,或它们的组合。细胞因子可以每天一次给药或每天一次以上,例如,每天两次,每天三次,或每天四次。细胞因子可以施用一天以上,例如,施用细胞因子2天,3天,4天,5天,6天,1周,2周,3周,或4周。例如,所述细胞因子每天一次连续7天给药。
在实施方案中,所述细胞因子与car表达t细胞组合施用。细胞因子可以与car表达t细胞同时施用,例如,在同一天施用。细胞因子可以与car表达t细胞在相同的药物组合物制备,或可以在单独的药物组合物中制备。备选地,细胞因子可以在car表达t细胞施用后不久给药,例如,car表达t细胞给药后1天,2天,3天,4天,5天,6天,或7天。在细胞因子在出现超过一天的给药方案中施用的实施方案中,细胞因子给药方案的第一天可以是与car表达t细胞施用在同一天,或细胞因子给药方案的第一天可以是car表达t细胞给药后1天,2天,3天,4天,5天,6天,或7天。在一个实施方案中,在第一天,car表达t细胞施用给受试者,并在第二天,细胞因子是一天一次在接下来的7天给药。在一个优选的实施方案中,将与car表达t细胞组合施用的细胞因子是il-7,il-15,或il-21。
在其他实施方案中,细胞因子在car表达细胞的给药之后施用一段时间,例如,至少2周,3周,4周,6周,8周,10周,12周,4月,5月,6月,7月,8月,9月,10月,11月或1年或以上。在一个实施方案中,细胞因子在受试者对car表达细胞的应答的评估后施用。例如,根据本文所描述的剂量和方案对受试者施用car表达细胞。受试者对car表达细胞疗法的应答在car表达细胞的施用后2周,3周,4周,6周,8周,10周,12周,4月,5月,6月,7月,8月,9月,10月,11月或1年或以上时评估,所述评估使用任何本文所述的方法,包括肿瘤生长的抑制,循环肿瘤细胞的减少,或肿瘤消退。不呈现对car表达细胞疗法的充分反应的受试者可以被施用细胞因子。细胞因子向具有对car表达细胞疗法亚最佳应答的受试者的施用提高了car表达细胞效力或抗癌活性。在一个优选的实施方案中,car表达细胞的施用后施用的细胞因子是il-7。
与cd19抑制剂组合
本文公开的方法和组合物可以与cd19抑制剂组合使用。在一些实施方案中,本文所述的含car细胞,例如含nkr-car的细胞和cd19抑制剂(例如,表达结合cd19的car分子,例如结合本文所述的cd19的car分子的一种或多种细胞)同时或并行或顺序施用。
在一些实施方案中,本文所述的含car细胞和cd19抑制剂同时或并行地输注到受试者中,例如在相同的输注体积中混合。例如,含有car的细胞和含有cd19car的细胞的群体混合在一起。或者,施用共表达本文所述的car和cd19car的细胞群。在其它实施方案中,同时施用包括例如在预定时间间隔(例如彼此15,30或45分钟内)内单独施用含car细胞和cd19抑制剂。
在一些实施方案中,含car的细胞的起始和cd19抑制剂的起始彼此在1,2,3,4,6,12,18或24小时之内,或彼此在1,2,3,4,5,10,15,20,25,30,35,40,60,80,或100天内。在一些实施方案中,含car细胞递送的结束和cd19抑制剂递送的结束彼此在1,2,3,4,6,12,18或24小时之内,或者彼此在1,2,3,4,5,10,15,20,25,30,35,40,60,80,或100天内。在一些实施方案中,在含car的细胞递送(例如,输注)和cd19抑制剂递送(例如,输注)的结束之间施用方面的重叠是至少1,2,3,4,5,10,15,20,25,30分钟。在一个实施方案中,cd19抑制剂在含car细胞之前施用。在其它实施方案中,含有car的细胞在cd19抑制剂之前施用。
在一些实施方案中,在受试者中存在cd19抑制剂(例如,表达cd19car分子的一种或多种细胞)(例如,经历扩增的细胞)时施用含car细胞。在其它实施方案中,在受试者中存在含car细胞时(例如,经历扩增的细胞)施用cd19抑制剂(例如,表达cd19car分子的一种或多种细胞)。
cd19抑制剂包括但不限于表达cd19car的细胞,例如cd19cart细胞或抗cd19抗体(例如,抗-cd19单抗或双特异性抗体)或其片段或缀合物。
在一个实施方案中,将本文所述的car表达细胞与cd19car细胞(例如,cart细胞)(例如ctl019,如wo2012/079000中所述,通过引用将其并入本文)组合施用于受试者。
在其它实施方案中,本文所述的car表达细胞与如wo2014/153270(其通过引用并入本文)中所述(例如,wo2014/153270的表3)的包括人源化抗原结合结构域的cd19car细胞(例如,cart细胞)组合施用于受试者。
cd19抑制剂(例如,第一cd19car表达细胞)和第二car表达细胞可以由相同的细胞类型或不同类型表达。例如,在一些实施方案中,表达cd19car的细胞是cd4+t细胞,并且表达本文所述的car的细胞是cd8+t细胞,或表达cd19car的细胞是cd8+t细胞,并且表达本文描述的car的细胞是cd4+t细胞。在其他实施方案中,表达cd19car的细胞是t细胞,并且表达本文所述的car的细胞是nk细胞,或表达cd19car的细胞是nk细胞,并且表达本文所述的car的细胞是t细胞。在其它实施方案中,表达cd19car的细胞和表达本文所述的car的细胞都是nk细胞或都是t细胞,例如都是cd4+t细胞,或者都是cd8+t细胞。在其它实施方案中,单细胞表达cd19car和本文所述的car,并且该细胞是例如nk细胞或t细胞如cd4+t细胞或cd8+t细胞。
在实施方案中,受试者具有急性骨髓性白血病(aml),例如cd19阳性aml或cd19阴性aml。在实施方案中,受试者具有cd19+淋巴瘤,例如cd19+非霍奇金淋巴瘤(nhl),cd19+fl或cd19+dlbcl。在实施方案中,受试者具有复发性或难治性cd19+淋巴瘤。在实施方案中,在cd19cart细胞施用(例如,输注)之前,同时或之后向受试者施用淋巴滤除化疗。在一个实例中,在施用cd19cart细胞之前,向受试者施用淋巴滤除化疗。例如,在cd19cart细胞输注之前1-4天(例如,1,2,3或4天),淋巴滤除化疗结束。在实施方案中,施用多剂量的cd19cart细胞,例如如本文所述。例如,单次剂量包含约5x108个cd19cart细胞。在实施方案中,在本文所述的car表达细胞(例如非cd19car表达细胞)施用(例如,输注)之前,同时或之后向受试者施用淋巴滤除化疗。在实施方案中,在施用(例如,输注)非cd19car表达细胞,例如本文所述的非cd19car表达细胞之前,同时或之后向受试者施用cd19cart。
在一些实施方案中,本文所述的car表达细胞与cd19car表达细胞,例如如wo2012/079000(其通过引用并入本文)中所述的ctl019组合施用于受试者,用于治疗与本文所述的肿瘤抗原的表达相关的疾病,例如本文所述的癌症。不受理论的束缚,相信与car表达细胞组合施用cd19car表达细胞通过靶向早期谱系癌细胞(例如癌干细胞),调节免疫应答,消耗调节性b细胞和/或改善肿瘤微环境来改善本文所述的car表达细胞的功效。例如,cd19car表达细胞靶向表达早期谱系标志物的癌细胞,例如癌干细胞和表达cd19的细胞,而本文所述的car表达细胞靶向表达晚期谱系志物例如cd123的癌细胞。这种预处理方法可以改善本文所述的car表达细胞的功效。在这样的实施方案中,cd19car表达细胞在本文所述的car表达细胞施用(例如,输注)之前,同时或之后施用。
在实施方案中,本文所述的car表达细胞还表达靶向cd19的car,例如cd19car。在一个实施方案中,将表达本文所述的car和cd19car的细胞施用于受试者以治疗本文所述的癌症,例如aml。在一个实施方案中,一个或两个car分子的构型包含一级胞内信号传导结构域和共刺激信号传导结构域。在另一个实施方案中,一个或两个car分子的构型包含一级胞内信号传导结构域和两个或多个,例如2,3,4或5个或更多个共刺激信号传导结构域。在这样的实施方案中,本文所述的car分子和cd19car可以具有相同或不同的一级胞内信号传导结构域,相同或不同的共刺激信号传导结构域,或相同数目或不同数目的共刺激信号传导结构域。或者,本文描述的car和cd19car被配置为分裂car,其中car分子之一包含抗原结合结构域和共刺激结构域(例如4-1bb),而另一car分子包含抗原结合结构域和一级胞内信号传导结构域(例如cd3ζ)。
在一个实施方案中,本文描述的car和第二car(例如cd19car)在相同的载体上或在两个不同的载体上。在本文描述的car和第二car(例如cd19car)位于相同载体的实施方案中,编码本文所述的car和第二car(例如cd19car)的核酸序列在相同的框中,并且通过一个或多个肽切割位点,例如p2a分离。
在其它实施方案中,本文公开的car表达细胞与抗-cd19抗体抑制剂组合施用。在一个实施方案中,抗cd19抗体是wo2014/153270中描述的人源化抗原结合结构域(例如wo2014/153270的表3,其通过引用并入本文)或其缀合物。其他示例性抗cd19抗体或其片段或缀合物包括但不限于:blinatumomab,sar3419(sanofi),medi-551(medimmunellc),combotox,dt2219arl(masoniccancercenter),mor-208(也称为xmab-5574;morphosys),xmab-5871(xencor),mdx-1342(bristol-myerssquibb),sgn-cd19a(seattlegenetics),和afm11(affimedtherapeutics)。参见例如hammer.mabs.4.5(2012):571–77。blinatomomab是一种双特异性抗体,由两个scfv组成——一个结合cd19并且一个结合cd3。blinatomomab指导t细胞攻击癌细胞。参见例如hammeretal.;临床试验标识号nct00274742和nct01209286。medi-551是人源化的抗cd19抗体,其具有工程化的fc以具有增强的抗体依赖性细胞介导的细胞毒性(adcc)。参见例如hammer等人;和临床试验标识号nct01957579。combotox是结合cd19和cd22的免疫毒素的混合物。免疫毒素由与去糖基化的蓖麻毒素a链融合的scfv抗体片段组成。参见例如hammeretal.;和herreraetal.j.pediatr.hematol.oncol.31.12(2009):936-41;schindleretal.br.j.haematol.154.4(2011):471-6。dt2219arl是靶向cd19和cd22的双特异性免疫毒素,包含两种scfv和截短的白喉毒素。参见例如hammer等人;和临床试验标识号nct00889408。sgn-cd19a是由与合成的细胞毒性细胞杀伤剂单甲基auristatinf(mmaf)连接的抗cd19人源化单克隆抗体组成的抗体-药物缀合物(adc)。参见例如hammer等人;和临床试验标识号nct01786096和nct01786135。sar3419是抗cd19抗体-药物缀合物(adc),其包含通过可切割接头与美登素衍生物缀合的抗cd19人源化单克隆抗体。参见例如younesetal.j.clin.oncol.30.2(2012):2776-82;hammeretal.;临床试验标识号nct00549185;和blancetal.clincancerres.2011;17:6448-58。xmab-5871是一种fc工程化的人源化抗cd19抗体。参见,例如,hammer等人。mdx-1342是具有增强adcc的人fc工程化抗cd19抗体。参见,例如,hammer等人。在实施方案中,抗体分子是双特异性抗cd19和抗cd3分子。例如,afm11是靶向cd19和cd3的双特异性抗体。参见例如hammer等人;和临床试验标识号nct02106091。在一些实施方案中,本文所述的抗cd19抗体与治疗剂缀合或以其他方式结合到治疗剂,例如化学治疗剂,肽疫苗(例如在izumoto等人2008jneurosurg108:963-971中所述的那些),免疫抑制药物或免疫烧蚀剂,例如环孢菌素,硫唑嘌呤,甲氨蝶呤,霉酚酸酯,fk506,campath,抗cd3抗体,细胞毒素,氟达拉滨,雷帕霉素,霉酚酸,类固醇,fr901228或细胞因子。
与低剂量的mtor抑制剂组合
本文描述的方法使用低的免疫增强剂量的mtor抑制剂,例如变构mtor抑制剂,包括rapalogs如rad001。施用低的免疫增强剂量的mtor抑制剂(例如,不足以完全抑制免疫系统但足以改善免疫功能的剂量)可以优化受试者中免疫效应细胞(例如t细胞或car表达细胞)的性能。用于测量mtor抑制,剂量,治疗方案和合适的药物组合物的方法描述于美国专利申请号2005/01240036中,其通过引用并入本文。
在一个实施方案中,施用低的免疫增强剂量的mtor抑制剂可导致以下一种或多种:
i)pd-1阳性免疫效应细胞数量的减少;
ii)pd-1阴性免疫效应细胞数量的增加;
iii)pd-1阴性免疫效应细胞/pd-1阳性免疫效应细胞的比例增加;
iv)幼稚t细胞数量的增加;
v)例如在记忆性t细胞,例如记忆性t细胞前体上一种或多种以下标志物的表达的增加:cd62l高,cd127高,cd27+,和bcl2;
vi)例如在记忆性t细胞,例如记忆性t细胞前体上klrg1的表达的降低;或
vii)记忆t细胞前体,例如具有以下特征的任何一种或组合的细胞的数量增加:增加的cd62l高,增加的cd127高,增加的cd27+,减少的klrg1和增加的bcl2;
并且其中前述任何一种,例如,i),ii),iii),iv),v),vi)或vii)例如与未治疗的受试者相比例如至少短暂地发生。
在另一个实施方案中,例如与未处理的car表达细胞或未经治疗的受试者相比,施用低的免疫增强剂量的mtor抑制剂导致car表达细胞的增加或延长的增殖,例如在培养物或受试者中。在实施方案中,增加的增殖与car表达细胞数量的增加相关。用于测量增加或延长的增殖的方法在实施例9和10中描述。在另一个实施方案中,例如,与未处理的car表达细胞或未治疗的受试者相比,施用低的免疫增强剂量的mtor抑制剂导致car表达细胞增加对癌细胞的杀伤,例如在培养或在受试者中。在实施方案中,癌细胞的增加的杀伤与肿瘤体积的减少有关。用于测量增加的癌细胞杀伤的方法在实施例2中描述。
在一个实施方案中,表达car分子(例如本文所述的car分子)的细胞与低的免疫增强剂量的mtor抑制剂(例如变构mtor抑制剂,例如rad001或催化mtor抑制剂)组合施用。例如,可以在施用本文所述的car表达细胞之前开始施用低的免疫增强剂量的mtor抑制剂;在施用本文所述的car表达细胞之前完成;在施用本文所述的car表达细胞的同时启动;与本文所述的表达car的细胞的施用重叠;或在施用本文所述的car表达细胞后继续。
或者或另外,施用低的免疫增强剂量的mtor抑制剂可以优化待工程化以表达本文所述的car分子的免疫效应细胞。在这样的实施方案中,在从受试者收获待工程化以表达本文所述的car分子的免疫效应细胞例如t细胞或nk细胞之前开始或完成施用低的免疫增强剂量的mtor抑制剂,例如变构抑制剂,例如rad001或催化抑制剂。
在另一个实施方案中,待工程化以表达本文所述的car分子的免疫效应细胞,例如t细胞或nk细胞(例如在从受试者收获之后),或表达car的免疫效应细胞,例如t细胞或nk细胞,例如,在施用于受试者之前,可以在低的免疫增强剂量的mtor抑制剂的存在下培养。
在一个实施方案中,向所述受试者施用低的免疫增强剂量的mtor抑制剂包括例如每周施用一次,例如以即时释放剂型为0.1至20,0.5至10,2.5至7.5,3至6或约5mg的rad001或其生物等效剂量。在一个实施方案中,对受试者施用低的免疫增强剂量的mtor抑制剂包括例如每周一次,例如以持续释放剂型施用0.3至60,1.5至30,7.5至22.5,9至18或约15mg的rad001或其生物等效剂量。
在一个实施方案中,mtor抑制剂的剂量与至少5%但不超过90%,至少10%,但不超过90%,至少15%,但不超过90%,至少20%但不超过90%,至少30%但不超过90%,至少40%但不超过90%,至少50%但不超过90%,至少60%但不超过90%,至少70%但不超过90%,至少5%但不超过80%,至少10%但不超过80%,至少15%但不大于80%,至少20%但不超过80%,至少30%但不超过80%,至少40%但不超过80%,至少50%但不超过80%,至少60%但不超过80%,至少5%但不超过70%,至少10%但不超过70%,至少15%但不超过70%,至少20%但不超过70%,至少30%但不超过70%,至少40%但不超过70%,至少50%但不超过70%,至少5%但不超过60%,至少10%但不超过60%,至少15%但不至少60%,至少20%%但不超过60%,至少30%%但不超过60%,至少40%%但不超过60%,至少5%%但不超过50%,至少10%超过50%,至少15%但不超过50%,至少20%但不超过50%,至少30%但不超过50%,至少40%但不超过50%,至少5%但不超过40%,至少10%但不超过40%,至少15%但不超过40%,至少20%但不超过40%,至少30%但不超过40%,至少35%但不超过40%,至少5%但不超过30%,至少10%但不超过30%,至少15%但不超过30%,至少20%但不超过30%,或至少25%但不超过30%的mtor抑制剂相关或提供所述mtor抑制剂。
mtor抑制的程度可以传达或者对应于p70s6激酶抑制的程度,例如,mtor抑制的程度可以通过p70s6激酶活性的降低水平来确定,例如通过p70s6激酶底物磷酸化的降低水平来确定。可以通过各种方法评价mtor抑制水平,例如通过boulay测定法测量p70s6激酶活性,如美国专利申请号2005/01240036中所述,其通过引用并入本文,或如美国专利号7,727,950中所述,其通过引用并入本文;通过蛋白质印迹法测定磷酸化s6的水平;或评估pd1阴性免疫效应细胞与pd1阳性免疫效应细胞比例的变化。
正如本文中所使用的那样,术语“mtor抑制剂”是指在细胞中抑制所述的mtor激酶的化合物或配体或其药学上可接受的盐。在一个实施方案中,mtor抑制剂是别构抑制剂。别构的mtor抑制剂包括中性的三环化合物雷帕霉素(西罗莫司)、与雷帕霉素有关的化合物,即与雷帕霉素具有结构和功能相似性的化合物,包括例如,雷帕霉素衍生物、雷帕霉素类似物(也被称为雷帕系物)和抑制mtor活性的其它大环内酯化合物。在一个实施方案中,mtor抑制剂是催化抑制剂。
已知雷帕霉素是由吸水链霉菌生产的大环内酯抗生素,其具有式a中所示的结构。
参见,例如,mcalpine,j.b.等人,j.antibiotics(1991)44:688;schreiber,s.l.等人,j.am.chem.soc.(1991)113:7433;u.s.patentno.3,929,992。有许多种为雷帕霉素提出的编号方案。为了避免混乱,当本文中给具体的雷帕霉素类似物命名时,参考雷帕霉素,利用式a的编号方案给出名称。
可用于本发明中的雷帕霉素类似物例如是o-取代的类似物,其中雷帕霉素的环己基环上的羟基被or1替代,其中r1是羟基烷基、羟基烷氧基烷基、酰基氨基烷基或氨基烷基;例如rad001,也被称为依维莫司,如us5,665,772和wo94/09010中描述,将其内容并入作为参考。其它合适的雷帕霉素类似物包括在第26-或28-位取代的那些。所述的雷帕霉素类似物可以是前面提到的类似物的差向异构体,特别是在第40,28或26位取代的并且可以任选地进一步被氢化的类似物的差向异构体,例如如us6,015,815、wo95/14023和wo99/15530中描述的那样,将其内容并入作为参考,例如abt578也被称为zotarolimus或在us7,091,213、wo98/02441和wo01/14387中描述的雷帕霉素类似物,将其内容并入作为参考,例如ap23573,也被称为ridaforolimus。
适用于本发明中的来自us5,665,772的雷帕霉素类似物的例子包括但不限于:40-o-苄基-雷帕霉素,40-o-(4’-羟基甲基)苄基-雷帕霉素,40-o-[4’-(1,2-二羟基乙基)]苄基-雷帕霉素,40-o-烯丙基-雷帕霉素,40-o-[3’-(2,2-二甲基-1,3-二氧戊环-4(s)-基)-丙-2’-烯-1’-基]-雷帕霉素,(2’e,4’s)-40-o-(4’,5’-二羟基戊-2’-烯-1’-基)-雷帕霉素,40-o-(2-羟基)乙氧基羰基甲基-雷帕霉素,40-o-(2-羟基)乙基-雷帕霉素,40-o-(3-羟基)丙基-雷帕霉素,40-o-(6-羟基)己基-雷帕霉素,40-o-[2-(2-羟基)乙氧基]乙基-雷帕霉素,40-o-[(3s)-2,2-二甲基二氧戊环-3-基]甲基-雷帕霉素,40-o-[(2s)-2,3-二羟基丙-1-基]-雷帕霉素,40-o-(2-乙酰氧基)乙基-雷帕霉素,40-o-(2-烟酰氧基)乙基-雷帕霉素,40-o-[2-(n-吗啉代)乙酰氧基]乙基-雷帕霉素,40-o-(2-n-咪唑基乙酰氧基)乙基-雷帕霉素,40-o-[2-(n-甲基-n’-哌嗪基)乙酰氧基]乙基-雷帕霉素,39-o-去甲基-39,40-o,o-亚乙基-雷帕霉素,(26r)-26-二氢-40-o-(2-羟基)乙基-雷帕霉素,40-o-(2-氨基乙基)-雷帕霉素,40-o-(2-乙酰氨基乙基)-雷帕霉素,40-o-(2-烟酰胺基乙基)-雷帕霉素,40-o-(2-(n-甲基-咪唑并-2’-基乙氧甲酰氨基)乙基)-雷帕霉素,40-o-(2-乙氧基羰基氨基乙基)-雷帕霉素,40-o-(2-甲苯磺酰氨基乙基)-雷帕霉素和40-o-[2-(4’,5’-二乙氧羰基-1’,2’,3’-三唑-1’-基)-乙基]-雷帕霉素。
可用于本发明中的其它雷帕霉素类似物是其中雷帕霉素的环己基环上的羟基和/或在第28位的羟基被羟基酯基替代的类似物,例如,在usre44,768中发现的雷帕霉素类似物,例如坦罗莫司。
可用于本发明中的其它雷帕霉素类似物包括其中在第16位的甲氧基被另一个取代基替代的那些,优选地(任选地羟基取代的)炔基氧基,苄基,正甲氧基苄基或氯代苄基和/或其中在第39位的甲氧基与所述的第39位的碳一起被缺失,使得雷帕霉素的环己基环变成缺少所述的第39位的甲氧基的环戊基环的那些;例如如wo95/16691和wo96/41807中描述的那样,将其内容并入作为参考。可以进一步修饰所述的类似物,使得雷帕霉素第40位的羟基被烷基化和/或所述的第32位的羰基被还原。
来自wo95/16691的雷帕霉素类似物包括但不限于:16-去甲氧基-16-(戊-2-炔基)氧基-雷帕霉素,16-去甲氧基-16-(丁-2-炔基)氧基-雷帕霉素,16-去甲氧基-16-(炔丙基)氧基-雷帕霉素,16-去甲氧基-16-(4-羟基-丁-2-炔基)氧基-雷帕霉素,16-去甲氧基-16-苄基氧基-40-o-(2-羟基乙基)-雷帕霉素,16-去甲氧基-16-苄基氧基-雷帕霉素,16-去甲氧基-16-正-甲氧基苄基-雷帕霉素,16-去甲氧基-40-o-(2-甲氧基乙基)-16-戊-2-炔基)氧基-雷帕霉素,39-去甲氧基-40-脱氧-39-甲酰基-42-去甲-雷帕霉素,39-去甲氧基-40-脱氧-39-羟基甲基-42-去甲-雷帕霉素,39-去甲氧基-40-脱氧-39-羧基-42-去甲-雷帕霉素,39-去甲氧基-40-脱氧-39-(4-甲基-哌嗪-1-基)羰基-42-去甲-雷帕霉素,39-去甲氧基-40-脱氧-39-(吗啉-4-基)羰基-42-去甲-雷帕霉素,39-去甲氧基-40-脱氧-39-[n-甲基,n-(2-吡啶-2-基-乙基)]氨基甲酰基-42-去甲-雷帕霉素和39-去甲氧基-40-脱氧-39-(对-甲苯磺酰基亚肼基甲基)-42-去甲-雷帕霉素。
来自wo96/41807的雷帕霉素类似物包括但不限于:32-脱氧-雷帕霉素,16-o-戊-2-炔基-32-脱氧-雷帕霉素,16-o-戊-2-炔基-32-脱氧-40-o-(2-羟基-乙基)-雷帕霉素,16-o-戊-2-炔基-32-(s)-二氢-40-o-(2-羟基乙基)-雷帕霉素,32(s)-二氢-40-o-(2-甲氧基)乙基-雷帕霉素和32(s)-二氢-40-o-(2-羟基乙基)-雷帕霉素。
另一种合适的雷帕霉素类似物是如us2005/0101624中描述的umirolimus,将该文献并入本文作为参考。
rad001,另外被称为依维莫司
别构的mtor抑制剂的另外的例子包括西罗莫司(雷帕霉素,ay-22989),40-[3-羟基-2-(羟基甲基)-2-甲基丙酸酯]-雷帕霉素(也被称为坦罗莫司或cci-779)和ridaforolimus(ap-23573/mk-8669)。其它别构的mtor抑制剂的例子包括zotarolimus(abt578)和umirolimus。
备选地或此外,已经发现了催化性的、atp-竞争性的mtor抑制剂直接靶向所述的mtor激酶结构域并且靶向mtorc1和mtorc2两者。这些也是比诸如雷帕霉素的别构的mtor抑制剂更加有效的mtorc1的抑制剂,因为它们调控雷帕霉素抗性的mtorc1输出,例如4ebp1-t37/46磷酸化和帽依赖性翻译。
催化性抑制剂包括:bez235或2-甲基-2-[4-(3-甲基-2-氧代-8-喹啉-3-基-2,3-二氢-咪唑并[4,5-c]喹啉-1-基)-苯基]-丙腈,或单甲苯磺酸盐形式。bez235的合成被描述在wo2006/122806中;ccg168(另外被称为azd-8055,chresta,c.m.等人,cancerres,2010,70(1),288-298),它具有化学名称{5-[2,4-双-((s)-3-甲基-吗啉-4-基)-吡啶并[2,3d]嘧啶-7-基]-2-甲氧基-苯基}-甲醇;3-[2,4-双[(3s)-3-甲基吗啉-4-基]吡啶并[2,3-d]嘧啶-7-基]-n-甲基苯甲酰胺(wo09104019);3-(2-氨基苯并[d]噁唑-5-基)-1-异丙基-1h-吡唑并[3,4-d]嘧啶-4-胺(wo10051043和wo2013023184);n-(3-(n-(3-((3,5-二甲氧基苯基)氨基)喹喔啉-2-基)氨磺酰基)苯基)-3-甲氧基-4-甲基苯甲酰胺(wo07044729和wo12006552);pki-587(venkatesan,a.m.,j.med.chem.,2010,53,2636-2645),它具有化学名称1-[4-[4-(二甲基氨基)哌啶-1-羰基]苯基]-3-[4-(4,6-二吗啉代-1,3,5-三嗪-2-基)苯基]脲;gsk-2126458(acsmed.chem.lett.,2010,1,39-43),它具有化学名称2,4-二氟-n-{2-甲氧基-5-[4-(4-哒嗪基)-6-喹啉基]-3-吡啶基}苯磺酰胺;5-(9-异丙基-8-甲基-2-吗啉代-9h-嘌呤-6-基)嘧啶-2-胺(wo10114484);(e)-n-(8-(6-氨基-5-(三氟甲基)吡啶-3-基)-1-(6-(2-氰基丙烷-2-基)吡啶-3-基)-3-甲基-1h-咪唑并[4,5-c]喹啉-2(3h)-亚基)氰胺(wo12007926)。
催化性的mtor抑制剂的进一步例子包括8-(6-甲氧基-吡啶-3-基)-3-甲基-1-(4-哌嗪-1-基-3-三氟甲基-苯基)-1,3-二氢-咪唑并[4,5-c]喹啉-2-酮(wo2006/122806)和ku-0063794(garcia-martinezjm等人,biochemj.,2009,421(1),29-42。ku-0063794是哺乳动物雷帕霉素靶(mtor)的特异性的抑制剂)。wye-354是催化性的mtor抑制剂的另一个例子(yuk等人(2009).biochemical,cellular,andinvivoactivityofnovelatp-competitiveandselectiveinhibitorsofthemammaliantargetofrapamycin.cancerres.69(15):6232-6240)。
根据本发明,有用的mtor抑制剂还包括前述任何一种的前药、衍生物、药学上可接受的盐或其类似物。
可以基于本领域中成熟的方法,基于本文中描述的特定剂量,配制mtor抑制剂,例如rad001用于递送。特别地,美国专利6,004,973(并入本文作为参考)提供了可以与本文中描述的mtor抑制剂一起使用的制剂的例子。
药物组合物和治疗
本发明的药物组合物可以包含与一种或多种药学上可接受的或生理上可接受的载体、稀释剂或赋形剂组合的表达car的细胞,例如,许多表达car的细胞(正如本文中描述的那样)。这样的组合物可以包含缓冲液例如中性的缓冲盐水、磷酸缓冲盐水以及诸如此类;碳水化合物例如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸例如甘氨酸;抗氧化剂;螯合剂例如edta或谷胱甘肽;佐剂(例如氢氧化铝);和防腐剂。在一个方面中,把本发明的组合物配制成用于静脉内施用。
可以以合适的方式把本发明的药物组合物施用到将要被治疗(或预防)的疾病。施用的数量和频度将由这样的因素决定,如患者的状况以及患者的疾病类型和严重程度,然而合适的剂量可以由临床试验来确定。
在一个实施方案中,所述的药物组合物基本上不含有污染物,例如,没有可检测到的水平的污染物,例如,该污染物选自由下列组成的组:内毒素、支原体、有复制能力的慢病毒(rcl)、p24、vsv-g核酸、hivgag、残留的抗cd3/抗cd28包被的珠、小鼠抗体、汇合的人血清、牛血清白蛋白、牛血清、培养基组分、包装载体的细胞或质粒组件、细菌和真菌。在一个实施方案中,所述的细菌是选自由下列组成的组的至少一种:粪产碱菌(alcaligenesfaecalis),白念珠菌(candidaalbicans),大肠杆菌(escherichiacoli),流感嗜血杆菌(haemophilusinfluenza),脑膜炎奈瑟菌(neisseriameningitides),绿脓假单胞菌(pseudomonasaeruginosa),金黄色葡萄球菌(staphylococcusaureus),肺炎链球菌(streptococcuspneumonia),和酿脓链球菌a群(streptococcuspyogenesgroupa)。
当指示“免疫学上有效量”,“抗肿瘤有效量”,“抑制肿瘤有效量”或“治疗有效量”时,将要被施用的本发明的组合物的精确数量可以由医师在考虑个体在年龄、体重、肿瘤大小、感染或转移的程度以及患者(受试者)的状况的情况下确定。一般地可以声明:可以以104至109个细胞/kg体重(优选105至106个细胞/kg体重,包括这些范围内所有的整数值)的剂量,施用包含本文中描述的t细胞的药物组合物。也可以在这些剂量下多次施用t细胞组合物。可以通过使用免疫疗法中通常已知的输注技术来施用细胞(参见例如rosenbergetal.,neweng.j.ofmed.319:1676,1988)。特定患者的最佳剂量和治疗方案可以由医学领域的技术人员容易地通过监测患者的疾病病征并相应地调整治疗来确定。
在一些实施方案中,car细胞(例如,nkr-car细胞,例如kir-car细胞)的剂量包含约1x106,1.1x106,2x106,3.6x106,5x106,1x107,1.8x107,2x107,5x107,1x108,2x108,或5x108个细胞/kg。在一些实施方案中,car细胞(例如,nkr-car细胞,例如kir-car细胞)的剂量包含至少约1x106,1.1x106,2x106,3.6x106,5x106,1x107,1.8x107,2x107,5x107,1x108,2x108,或5x108个细胞/kg。在一些实施方案中,car细胞(例如,nkr-car细胞,例如kir-car细胞)的剂量包含至多约1x106,1.1x106,2x106,3.6x106,5x106,1x107,1.8x107,2x107,5x107,1x108,2x108,或5x108个细胞/kg。在一些实施方案中,car细胞(例如nkr-car细胞,例如kir-car细胞)的剂量包含约1.1x106–1.8x107细胞/kg。在一些实施方案中,car细胞(例如,nkr-car细胞,例如kir-car细胞)的剂量包含约1x107,2x107,5x107,1x108,2x108,5x108,1x109,2x109,或5x109个细胞。在一些实施方案中,car细胞(例如,nkr-car细胞,例如kir-car细胞)的剂量包含至少约1x107,2x107,5x107,1x108,2x108,5x108,1x109,2x109,或5x109个细胞。在一些实施方案中,car细胞(例如,nkr-car细胞,例如kir-car细胞)的剂量包含至多约1x107,2x107,5x107,1x108,2x108,5x108,1x109,2x109,或5x109个细胞。
可以通过使用免疫疗法中通常已知的输注技术来施用细胞(参见例如rosenbergetal.,neweng.j.ofmed.319:1676,1988)。
在某些实施方案中,可能需要向受试者施用活化的car表达细胞,然后随后重新抽血(或进行单采血液成分术),根据本发明活化其中的细胞,并且将这些活化和扩增的细胞再次输注患者。这个过程可以每几周进行多次。在某些实施方案中,可以从10cc至400cc的抽血活化t细胞。在某些实施方案中,t细胞从20cc,30cc,40cc,50cc,60cc,70cc,80cc,90cc或100cc的抽血活化。不受理论的束缚,使用这种多次抽血/多次再输注方案可用于选择某些t细胞群体。
主题组合物的施用可以以任何方便的方式进行,包括通过气溶胶吸入,注射,摄入,输液,植入或移植。本文所述的组合物可以皮下,皮内,肿瘤内,结节内,髓内,肌内,通过静脉内(i.v.)注射或腹膜内给药。在一个实施方案中,通过皮内或皮下注射将本发明的car表达细胞(例如,t细胞或nk细胞)组合物施用于患者。在另一个实施方案中,本发明的car表达细胞(例如,t细胞或nk细胞)组合物优选以静脉内注射给药。car表达细胞(例如t细胞或nk细胞)的组合物可以直接注射到肿瘤,淋巴结或感染部位。
在本发明的某些实施方案中,使用本文所述的方法或本领域已知的其它方法活化和扩增细胞,其中将t细胞扩增至治疗水平,与任何数量的相关治疗方式(例如,之前,同时或之后)结合施用于患者者,所述相关治疗方式包括但不限于用作用剂治疗,诸如抗病毒治疗,西多福韦和白细胞介素-2,阿糖胞苷(也称为ara-c)或用于ms患者的那他珠单抗治疗或用于牛皮癣患者的依伐珠单抗治疗或用于pml患者的其他治疗。在另外的实施方案中,本发明的t细胞可以与化学疗法,辐射,免疫抑制剂如环孢菌素,硫唑嘌呤,甲氨蝶呤,霉酚酸酯和fk506,抗体或其他免疫消蚀剂如campath,抗cd3抗体或其他抗体疗法,细胞毒素,氟达拉滨,环孢菌素,fk506,雷帕霉素,霉酚酸,类固醇,fr901228,细胞因子和照射组合使用。这些药物抑制钙依赖性磷酸酶钙调磷酸酶(环孢菌素和fk506)或抑制对生长因子诱导的信号传导重要的p70s6激酶(雷帕霉素)(liuetal.,cell66:807-815,1991;hendersonetal.,immun.73:316-321,1991;biereretal.,curr.opin.immun.5:763-773,1993)。在另一个实施方案中,本发明的细胞组合物与骨髓移植,t细胞消融疗法,使用化疗剂如氟达拉滨,外部束辐射治疗(xrt),环磷酰胺或抗体如okt3或campath联合(例如,在之前,同时或之后)施用于患者。在另一个实施方案中,本发明的细胞组合物在b细胞消融疗法(例如与cd20反应的药剂,例如rituxan)后施用。例如,在一个实施方案中,受试者可以通过高剂量化疗进行标准治疗接着进行外周血干细胞移植。在某些实施方案中,在移植后,受试者接受本发明的扩增的免疫细胞的输注。在另外的实施方案中,在手术之前或之后施用扩增的细胞。
在特定的示例性方面,受试者可以进行白细胞分离术,其中离体收集,富集或消耗白细胞以选择和/或分离目的细胞,例如免疫效应细胞(例如,t细胞或nk细胞)。这些免疫效应细胞(例如,t细胞或nk细胞)分离物可以通过本领域已知的方法扩增并进行处理,使得可以引入本发明的一种或多种car构建体,由此产生本发明的car表达细胞(例如cart细胞或表达car的nk细胞)。有需要的受试者随后可以用高剂量化疗进行标准治疗,随后进行外周血干细胞移植。在某些方面,在移植之后或同时,受试者接受本发明的扩增的car表达细胞(例如cart细胞或表达car的nk细胞)的输注。在另一方面,在手术之前或之后施用扩增的细胞。
要施用于患者的上述治疗的剂量将随待治疗的病症的确切性质和治疗的接受者而变化。可以根据本领域认可的做法进行人体施用剂量的缩放。已经讨论了用于cart细胞给药和时序安排的策略(ertletal,2011,cancerres,71:3175-81;junghans,2010,journaloftranslationalmedicine,8:55)。
在一个实施方案中,例如使用体外转录,将car引入免疫效应细胞(例如,t细胞或nk细胞),并且受试者(例如,人)接受初始施用本发明的car表达细胞(例如,cart细胞或表达car的nk细胞),以及以及一次或多次随后施用本发明的car表达细胞(例如cart细胞或表达car的nk细胞),其中所述一次或多次随后施用少于15天,例如在先前施用后的14,13,12,11,10,9,6,7,6,5,4,3或2天。在一个实施方案中,将本发明的car表达细胞(例如,cart细胞或表达car的nk细胞)的多于一次施用每周施用给受试者(例如,人),例如每周施用本发明的car表达细胞(例如,cart细胞或car表达nk细胞)2,3,或4次。在一个实施方案中,受试者(例如,人受试者)每周接受多于一次的car表达细胞(例如,cart细胞或表达car的nk细胞)的施用(例如每周2,3或4次施用)(在本文中也称为周期),随后是一周的无car表达细胞(例如,cart细胞或表达car的nk细胞)施用,然后一个或多个额外施用car表达细胞(例如,cart细胞或表达car的nk细胞)(例如,每周多于一次施用car表达细胞(例如cart细胞或表达car的nk细胞))于受试者。在另一个实施方案中,受试者(例如,人受试者)接受car表达细胞(例如cart细胞或表达car的nk细胞)多于一个周期,并且每个周期之间的时间小于10,9,8,7,6,5,4,或3天。在一个实施方案中,每隔一天施用car表达细胞(例如cart细胞或表达car的nk细胞),每周施用3次。在一个实施方案中,将本发明的car表达细胞(例如,cart细胞或表达car的nk细胞)施用至少两个,三个,四个,五个,六个,七个,八个或更多个周。
在一个方面,使用慢病毒病毒载体(例如慢病毒)产生表达cd123car的细胞(例如cart细胞或表达car的nk细胞)。以这种方式产生的car表达细胞(例如cart细胞或表达car的nk细胞)将具有稳定的car表达。
在一个方面,使用病毒载体如γ逆转录病毒载体,例如本文所述的γ逆转录病毒载体产生表达car的细胞,例如cart或表达car的nk细胞。使用这些载体产生的car表达细胞,例如cart或表达car的nk细胞可具有稳定的car表达。
一方面,car表达细胞(例如,cart细胞或表达car的nk细胞)在转导后瞬时表达car载体4,5,6,7,8,9,10,11,12,13,14,15天。car的瞬时表达可以通过rnacar载体递送来实现。一方面,通过电穿孔将carrna转导入细胞(例如t细胞或nk细胞)。
使用瞬时表达car的细胞(例如cart细胞或表达car的nk细胞)(特别是具有携带car的鼠scfv)治疗的患者中可能出现的潜在问题是多次治疗后的过敏反应。
不受这个理论的限制,相信这样的过敏反应可能是由正在发展体液抗car应答,即具有抗ige同种型的抗car抗体的患者引起的。认为当在暴露于抗原中有10到14天的间断时,患者的产生抗体的细胞发生从igg同种型(它不引起过敏反应)到ige同种型的类别转换。
如果患者在瞬时car治疗过程中(如通过rna转导产生的那些)处于发生抗car抗体反应的高风险,则car表达细胞(例如cart细胞或表达car的nk细胞)输注间隔应该不超过十到十四天。
实验实施例
通过参考下列实验实施例进一步详细描述本发明。提供这些实施例仅仅是为了举例说明的目的,并不意图是限定性的,除非另有说明。因此,无论如何不应把本发明解释为限定到下列实施例,而是应该把本发明解释成包括任何以及所有的变化,这些变化作为本文中所提供的教导的结果而变成显而易见的。
没有进一步描述,相信本领域普通技术人员可以使用前述描述和以下说明性实施例来制备和利用本发明的化合物并实施所要求保护的方法。因此,以下工作实施例具体指出了本发明的优选实施方案,并且不被解释为以任何方式限制本公开的其余部分。
实施例1:嵌合nk受体
本文给出的结果表明,与目前的car设计相比,可以更精细地调节构建t细胞car的备选方法。设计实验以开发包含至少两个或三个嵌合融合蛋白的新型调节的car系统。主要的t细胞激活信号和抑制信号是基于被称为杀伤细胞免疫球蛋白样受体(kir)的nk细胞的天然存在的激活和抑制性受体。
kir作为依赖于受体的胞内结构域的活化和抑制形式存在。活化的kir通过与含有基于免疫酪氨酸的活化基序(itam)的膜蛋白dap12的相互作用来传递信号,dap12由这些蛋白质的跨膜结构域内的残基募集。抑制性kir具有包含基于免疫酪氨酸的抑制基序(itim)的胞质结构域,其消除激活信号,导致抑制nk细胞溶解和细胞因子产生活性。与tcr类似,kir属于蛋白受体的免疫球蛋白家族,并且许多结合不变的mhc和mhc样配体。不希望受任何特定理论的束缚,相信这些相互作用被用于将恶性或病毒感染的细胞(通常具有低或缺失mhci类)和正常细胞(通常表达高密度mhci类)自然区分开来。
已经构建了kir-样的嵌合抗原受体(kir-car),其通过激活抑制性kir将scfv融合到感兴趣的目标抗原,如图1所示。通过活化kir-car(actkir-car)或具有scfv的标准tcr-ζcar对感兴趣的恶性细胞上的抗原的接合产生t细胞的条件激活。当t细胞遇到正常细胞时,携带针对存在于正常但不是恶性组织上的抗原的scfv的抑制性car(inhcar)将提供活化性car主要信号的衰减。作为抑制性car的有用靶标的抗原的实例包括肝配蛋白受体(pasquale,2010,natrevcancer10(3):165-80)和密蛋白(singhetal.,2010,joncol,2010:541957),其由来自正常组织的上皮细胞表达,但通常由癌症选择性丧失(例如epha7)。
实施例2:激活性kir-car构建和活性
基于先前掺入基于tcr-ζ胞质结构域的car的抗cd19或抗间皮素scfv(ss-1)的融合,设计实验来构建激活性kir-car,所述car目前正在进行临床试验。选择人kir2ds2激活kir受体作为actkir-car的初始碱基受体。为了传递激活信号,actkir-car需要共表达dap12,其在t细胞中不是正常表达的。因此,构建了慢病毒载体,其使用基于2a核糖体跳跃肽的“双顺反子”基因盒表达actkir-car与人dap12两者。慢病毒载体的图示于图2中。初步研究表明,actkir-cars在原代人t细胞中有效表达,ss1actkir-car与间皮素结合(图3)。与先前开发和公布的ss1scfvcd3ζ(ss1-ζ)car(carpenitoetal.,2009,procnatlacadsciusa106(9):3360-5)相似,表达ss1actkir-car的t细胞表现出对靶k562细胞的细胞毒性活性,所述靶k562细胞被工程化以表达间皮素配体(kt-meso),如图4所示。两个受体均未显示杀死缺乏间皮素靶标的野生型k562。
由于ss1kircar对间皮素阳性靶细胞的细胞毒活性低于具有可比car表面表达的靶向相同抗原的标准的基于tcrzeta的car,相信间皮素car可具有细胞外铰链(基于野生型kir2ds2),所述细胞外铰链由于其长度而与cd45分离不是最佳的。相信激活性基于itam的受体从cd45的动力学分离是tcr激活的关键机制,并且依赖于t细胞和靶细胞膜之间
实施例3:inhkir-car构建和活性
基于抗间皮素ss1scfv与抑制性kir2dl3受体碱基的融合构建了抑制性kir-car。初步研究表明,inhkir-cars在原代人t细胞中有效表达。单独或组合的cd19actkir-car,ss1actkir-car和ss1inhkir-car已经在nfat驱动的启动子的控制下引入带有dsgfp报告子的jurkatt细胞,以监测该关键t细胞信号传导途径的活化。虽然仅表达cd19actkir-car或ss1actkir-car的jurkatt细胞通过表达cd19和间皮素(kt-meso/cd19)的k562有效活化,但是共表达cd19actkir-car和ss1inhkir-car的jurkatt细胞显示被相同的kt-meso/cd19靶细胞的显著降低的活化(图7a);然而,使用独特型特异性试剂对cd19的表面表达和间皮素scfv结合的分析令人惊奇地证明,不同scfv靶特异性的表达是相互排斥的(图7b)。
实施例4:激活性kir-car设计对天然抑制受体系统的灵敏度
由于两个scfvcar的共表达是有限的,所以采用策略来评估基于kir的活化car对来自pd-1受体的抑制信号的灵敏度。pd-1是t细胞中的天然受体,其使用类似于抑制性kir的胞质结构域中的itim来募集负调节tcr信号传导的磷酸酶。示意图如图19所示。本文给出的结果表明,野生型pd-1可以用活化的基于kir的car和靶向间皮素的基于tcr-ζ的car来过度表达(图8a和8c)。结果还表明,这种组合导致pd-1配体1(pdl-1)依赖性抑制间皮素特异性活化kir-car细胞毒性(图9)。在t细胞(即没有pd-1转染的t细胞)的正常pd-1表达的情况下,与基于tcr-ζ的car相比,当遇到pd-l1过表达靶细胞时,kir-car显示较少的抑制。不希望受任何特定理论的约束,相信当遇到通常表达抑制性受体配体的肿瘤时,这可能是kir-car的优点。
实施例5:kircar的共刺激依赖性激活
设计实验以评估与klossetal.(klossetal.,2013,natbiotechnol31(1):71-5)所述的用标准car描述的作用相比,kir-car系统中嵌合共刺激受体(ccr)的作用。还设计了实验,以通过使用激动剂抗体克隆9.3将内源性cd28受体在t细胞中衔接来评价kirs的共刺激依赖性激活要求。如图14所示,在没有cd28共刺激的情况下,kirs2car显示出响应于间皮素阳性靶标的强烈增殖。这种增殖优于用tcr-ζcar观察到的,其中共刺激已被证明对增殖至关重要。这一数据表明对于抗原特异性增殖,基于kir的car可能与tcr-ζcar不具有相同的共刺激要求(miloneetal.,2009,molther17(8):1453-64;carpenitoetal.,2009,procnatlacadsciusa106(9):3360-5),并且这种共刺激独立性可能是基于kir的car对当前基于tcr-ζ的car的显著优点。已经设计了实验以评估人源化小鼠中的基于kir的car,以在体内临床前设置中测试基于kir的car对比具有和不具有共刺激结构域的car(实施例5中的数据和实验也在实施例6中给出)。
实施例6:基于杀伤细胞免疫球蛋白样受体(kir)的嵌合抗原受体(car)在实体瘤中触发稳健的细胞毒性活性
携带与cd3-ζ和共刺激受体的胞质结构域顺式连接的抗原结合结构域的嵌合抗原受体(car)为工程化对肿瘤的t细胞细胞毒性提供了有效的方法(gruppetal.,thenewenglandjournalofmedicine,368(16):1509-18,2013;brentjensetal.,sciencetranslationalmedicine,5(177):177ra38,2013;porteretal.,thenewenglandjournalofmedicine,365(8):725-33,2011)。本文描述了备选嵌合受体,其中靶向间皮素(ss1)的单链可变片段(scfv)与kir2ds2的跨膜和胞质结构域融合,kir2ds2是通常由自然杀伤(nk)细胞正常表达的刺激性杀伤免疫球蛋白样受体(kir)。这种基于ss1-kirs2kir的car在与衔接分子dap12组合引入人t细胞时,触发稳健的抗原特异性细胞毒活性和体外效应子功能,如细胞因子分泌和增殖。与用标准的基于cd3ζ的car转导的t细胞相比,修饰以表达kir-car和dap12的t细胞在抗性肿瘤异种移植模型中显示出显著增强的抗肿瘤活性,表明基于kir的car可以克服肿瘤内的抑制信号,所述抑制信号限制了第二代和第三代基于cd3ζ的car。本文提供的数据支持基于kir的car在包括实体瘤的癌症中未来的临床评估。
通过将含有基于免疫酪氨酸的激活基序(itam)的胞质结构域掺入到单个嵌合受体来设计“第一代”car,所述单个嵌合受体使用抗体的单链可变片段(scfv)进行特异性抗原靶向(sadelainetal.,cancerdiscovery,3(4):388-98,2013)。来自共刺激受体如cd28,icos,4-1bb和ox-40的许多不同的附加信号传导结构域随后串联并入这些受体中以增强t细胞的增殖,存活和功能(finneyhmetal.jimmunol.1998;161:2791–2797;maherj.etal.natbiotech2002;20:70-75;finneyhmetal.jimmunol.2004;18:676-684;miloneetal.,2009,molther17(8):1453-64;carpenitoetal.,2009,procnatlacadsciusa106(9):3360-5)。这些“第二代”(一个共刺激结构域)和“第三代”(2个共刺激结构域)car在癌症的临床前动物模型中表现出增强的功能,并且几个共刺激增强的car目前在早期阶段人类癌症临床试验中(在barrettdmetal.annrevmed2014;65:333-347中综述)。
尽管单链car引发强大的抗原特异性细胞毒活性,但是使用高度保守的itam结构域的天然受体通常被构建成由单独的配体结合和含有itam的信号链组成的多链复合体,例如t细胞受体(tcr)-cd3复合体,b细胞受体(bcr)-igα/β复合体和fc受体(fcr)复合体。多链免疫受体复合体的潜在益处是多种多样的,包括通过配体结合和信号分子之间的多重相互作用可获得的信号的更大多样性以及可与配体结合链的内化分离的持续itam信号传导(sigalovetal.,advancesinexperimentalmedicineandbiology,640:ix-xi,2008)。将通常在异源受体中发现的几种受体组分组合到car中的后果尚未完全阐明;然而,用一些设计已经观察到无效能和抗原依赖性信号传导(brocker,blood,96(5):1999-2001,2000;brockeretal.,thejournalofexperimentalmedicine.181(5):1653-9,1995;miloneetal.,moleculartherapy:thejournaloftheamericansocietyofgenetherapy,17(8):1453-64,2009)。
本文所要求的发明描述了在更“自然”的多链免疫受体设计上构建的car,由于在受体复合体内的亚单位和免疫细胞内的其他受体之间的自然选择的相互作用,所述car在活化t细胞中具有更大的效力。选择杀伤性免疫球蛋白样受体(kir)和dap12多链免疫受体复合体作为car的基础(thielensetal.,currentopinioninimmunology,24(2):239-45,2012)。虽然被自然杀伤细胞表达(其中它们对其天然细胞毒性有促进作用),但在cd4+和cd8+t细胞中也观察到kir表达(morettaetal.,immunologicalreviews,155:105-17,1997;falketal.,humanimmunology;61(12):1219-32,2000;remtoulaetal.,journalofimmunology,180(5):2767-71,2008)。活化性kirs,如kir2ds2,具有短的胞质结构域,没有已知的内源性信号传导活性。然而,kir与dap12的二聚体形成非共价复合体,dap12是能够结合nk细胞中的syk和zap70激酶的含itam的衔接分子(lanieretal.,nature,391(6668):703-7,1998)。除了刺激配体结合时的细胞毒性,kirs还显示在不存在dap12的情况下在t细胞内表现出共刺激作用,这表明这些分子可能能够在t细胞中提供主要触发活性和共刺激作用(snyderetal.,journalofimmunology,173(6):3725-31,2004)。
通过将间皮素特异性ss1scfv剪接到活化性kir的跨膜和短胞质结构域上构建基于kir的car,kir2ds2(ss1-kirs2),如图1所示(hassanetal.,clinicalcancerresearch:anofficialjournaloftheamericanassociationforcancerresearch,8(11):3520-6,2002)。含有itam的衔接分子dap12在自然杀伤(nk)细胞中组成型表达,但仅在人t细胞亚群中表达(moretta等人)。因此,产生编码由thoseaasigna病毒2a(t2a)序列分开的基于间皮素特异性kir的car(ss1-kirs2)和dap12分子的双顺反子慢病毒载体,以实现两种分子的共表达(图2)。在抗cd3和抗cd28活化后,用ss1-kirs2和dap12双顺反病毒慢病毒转染原代人t细胞证明ss1-kirs2的稳健的表面表达,其与基于cd3ζ的ss1ζcar相当(图6)。ss1-kirs2/dap12共转导的t细胞在用多克隆抗cd3/抗cd28刺激后扩增,具有与用模拟物转导的t细胞或用含有cd3ζ胞质结构域的间皮素特异性car转导的t细胞观察到的动力学相似的动力学(数据未显示)。比较基于kir的与基于cd3ζ(ss1-z)的cart细胞的细胞毒活性。ss1-kirs2/dap12转导的t细胞对表达人类间皮素(k-meso)的k562细胞显示出有效的细胞毒性活性,与ss1ζ构建体具有相似的幅度。没有一个工程化的t细胞对野生型k562(kwt)表现出裂解活性,支持同源间皮素靶抗原对ss1-kirs2受体的特异性激活(图6)。
由于在不存在可检测的dap12表达的情况下,在t细胞中已经描述了kir2ds2的表达,所以评估了具有或不具有dap12共同递送的ss1-kirs2受体的表达和功能。使用共表达dap12与红色荧光蛋白dsred(dap12-dsred)的慢病毒载体或dsred表达对照载体(dsred),用慢病毒dap12或对照载体转导t细胞,随后用体外转录的表达ss1-kirs2的rna转染。ss1-kirs2在不添加dap12的t细胞表面表达;然而,加入dap12后,ss1-kirs2的表面表达增加约1-log(图12a)。尽管ss1-kirs2表达,但没有dap12的t细胞不会裂解表达间皮素的靶细胞,表现出在ss1-kirs2触发的t细胞毒性活性中对dap12的需求(图12b)。这些数据不排除嵌合kir可能独立于其与dap12的结合而提供信号的可能性,如先前针对t细胞克隆中天然kir2ds2受体所报道的(snyder等人)。
天然kir2ds2和dap12的非共价结合依赖于kir跨膜(tm)结构域中天冬氨酸残基与dap12tm结构域中的赖氨酸残基之间的静电相互作用(fengetal.,plosbiology,4(5):e142,2006)。虽然tcr的tm结构域和cd3亚基中这些可离子化氨基酸残基的构型被认为与kirs和dap12不同,为相互作用提供了一些特异性,但研究了ss1-kirs2可能与cd3复合体的组分相互作用代替共同递送的dap12的可能性。由于cd3复合体和tcr链之间的结合对细胞表面上的tcr表达是必需的,所以预期cd3组分的kir的竞争会干扰正常的tcr表达,如以前用克隆的tcr的表达观察到的。已经显示将异位vβ链引入t细胞中由于复合体组装过程中的竞争而降低内源性tcrvβ的表面表达(varela-rohenaetal.,naturemedicine,14(12):1390-5,2008)。与模拟物转导的对照t细胞相比,kirs2转导的多克隆t细胞中tcrvβ13.1+的相似频率和强度支持ss1-kirs2与内源性cd3复合体成员之间不存在显著相互作用(图13)。
虽然细胞毒性活性是t细胞的体内抗肿瘤活性的重要效应子功能,但抗原-受体触发细胞因子分泌和t细胞增殖的能力也是通常与体内强大的抗肿瘤活性相关的重要特征。因此,比较了通过ss1-kirs2/dap12修饰的t细胞与携带基于cd3ζ的car并且没有共刺激结构域(ss1-ζ)或分别具有cd28或4-1bb共刺激结构域(ss1-28ζ和ss1-bbζ)的t细胞的抗原引发的干扰素γ(ifn-γ)和白细胞介素-2(il-2)分泌。ss1-ζ构建体刺激ifn-γ和il-2的最低分泌(图10,11)。表达ss1-kirs2/dap12或ss1-bbζ的t细胞中的干扰素γ产量增加且相当,而表达ss1-28ζcar的t细胞显示出显著更大的il-2和ifn-γ产生(图10)。分析更大的一组细胞因子和趋化因子表明ss1-kirs2/dap12刺激一种在基于cd3ζ的car间定性相似的表达模式,其抗原诱导的细胞因子和趋化因子分泌的量值与ss1-ζ和ss1–bbζcar相当(图11)。
ss1-kirs2/dap12受体也是响应于同源抗原的t细胞增殖的有效刺激物(图14)。与依赖于强大增殖的附加共刺激信号的标准ss1-ζcar不同,加入抗cd28激动剂抗体时,ss1-kirs2/dap12t细胞显示与ss1ζ相当的增殖。在没有dap12的情况下,由ss1-kir2提供的共刺激的机制可能与kir与其他衔接分子的相互作用有关(synder等人)。由t细胞天然表达的额外受体也可能能够利用共同递送的dap12,其进一步促进t细胞的活化和增殖。特别地,整联蛋白可以向t细胞提供共刺激信号(brunmarketal.(1996)pnasusa93(25):14736-41;zuckermanetal.(1998)j.immunol.160(7):3259-68)。dap12对巨噬细胞和嗜中性粒细胞中整联蛋白的外部向内信号传导似乎是关键的(jakusetal.(2007)trendsincellbiol.17(10):493-501;mocsaietal.(2006)natureimmunol.7(12):1326-33),并且可能对t细胞中的lfa-1和其他整联蛋白具有独特的信号传导活性,促进ss1-kirs2/dap12活性。
cd28和4-1bb已经掺入car中以增强体内的cart细胞活性(carpenitoetal.(2009)pnasusa106(9):3360-65);然而,共刺激并不总是能够克服免疫抑制性肿瘤微环境。最近报道,注射到具有em-meso细胞的异种移植物(来自恶性间皮瘤患者的胸腔积液的细胞系)的免疫缺陷型nod-scid-γc-/-(nsg)(nsg)小鼠中的ss1-bbζcart细胞)在体内扩增,但在与未能清除肿瘤相关的肿瘤微环境中变得功能低下(moonetal.(2014)clinicalcancerres.20:4262-4273)。在这种高度抗性的间皮瘤模型中评估了ss1-kirs2/dap12修饰的t细胞的活性。具有或不具有共刺激的ss1-kirs2/dap12和基于cd3ζ的car能够在体外裂解em-meso细胞,具有相当的功效。模拟物转导的和dap12-dsred转导的t细胞显示对em-meso细胞的最小裂解活性(图36)。单次静脉内注射模拟物,ss1ζ和ss1bbζ转导的t细胞对建立的em-meso异种移植物没有可观察到的抗肿瘤作用(图15a)。肿瘤生长被ss1-28ζcart细胞明显延迟;然而,只有ss1-kirs2/dap12修饰的t细胞在52天诱导肿瘤消退,em-meso肿瘤生长被显著抑制(p<0.001,使用post-hocscheffef检验的anova)。将表达ss1-kirs2/dap12的t细胞与单独的dap12或ss1-28ζ工程化t细胞进行比较的第二个实验显示出ss1-kirs2/dap12t细胞相似的增强的抗肿瘤活性(图38)。基于kir的car的稳健活性并不是间皮素特异性所独有的。还构建了基于cd19特异性kir的car,其具有与第二代cd3ζcar相当的体外活性(图16b)。在nalm-6白血病异种移植模型中的测试也显示优于第一代car的kir-car功效,与具有4-1bb共刺激结构域的第二代car相当。
进行t细胞移植和肿瘤浸润淋巴细胞(tils)的分析以探索em-meso异种移植模型中ss1-kirs2/dap12t细胞增强的抗肿瘤活性的机制。只有接受ss1-bbζcart细胞的小鼠在血液和脾脏中具有可检测的人cd45(hcd45)阳性细胞,与先前观察到的4-1bb共刺激结构域对体内car+t细胞持久性的影响一致(milone等人)。在模拟物或ss1ζ处理的小鼠中检测到少量hcd45+肿瘤浸润淋巴细胞(til)。相比之下,用ss1-kirs2/dap12,ss1-28ζ和ss1-41bbζcart细胞治疗的肿瘤具有hcd45+til,其占总活细胞的2-4%,每个组具有相当的频率(图15b)。免疫组织化学染色显示ss1-kirs2/dap12,ss1-28ζ和ss1-41bbζcart细胞处理的小鼠的肿瘤内的cd8+和cd4+tils(数据未显示),证实了流式细胞术分析。因此,ss1-kirs2/dap12t细胞的功效增加与肿瘤生长晚期肿瘤内的til频率无关。由于tils的比较受到晚期肿瘤体积的巨大差异的限制,因此评估t细胞注射后的较早时间点。在t细胞注射后10天,在ss1-28ζ和ss1-kirs2/dap12cart细胞治疗组中观察到hcd45+til相当的频率,但ss1-bbζcart细胞组中存在很少量cd45+til(图15b)。这些分离的til的有限分析显示只有ss1-kirs2/dap12cart细胞能够对em-meso细胞具有体外溶解活性(数据未显示)。这些结果表明,尽管ss1-bbζt细胞在肿瘤发育的晚期阶段具有高频率,但ss1-bbζt细胞向肿瘤的延迟积累以及肿瘤诱导的功能低下是这些细胞抗肿瘤活性差的基础。在t细胞注射后18天进行比较ss1-28ζ和ss1-kirs2/dap12cart细胞与til分离的重复实验,以获得更多数量的til用于表型和功能分析。与用于治疗的冷冻保存的t细胞相比,分离的ss1-28ζtil显示出显著降低的细胞毒性活性和抗原特异性ifn-γ产生。相比之下,来自ss1-kirs2/dap12cart细胞治疗肿瘤的til显示出与冷冻保存的细胞相当的体外细胞毒性和ifn-γ产生(图15e和图37)。来自tils和car蛋白的冷冻保存细胞的蛋白质裂解物的免疫印迹显示出car表达的丧失(数据未显示)。在til中不存在car可能是由于ss1-28ζcart细胞相对于肿瘤微环境内的非转导的t细胞的表达下调或弱存活。
总之,本文提供的数据表明基于kir的car和dap12的组合提供了高效的抗原特异性受体系统,其用于赋予t细胞人工抗原特异性。尽管相对相当的体外活性,但是已经表明在本文所用的模型肿瘤系统中,与具有一个或多个共刺激结构域的基于cd3ζ的car相比,基于kir的car还具有显著改善的抗肿瘤效力,这可能是由于对失活的抗性增加。将追求基于其他dap12相关配体结合受体以及另外的含有天然itam的受体系统如fcrγ的该增加的功效和嵌合受体设计的机制的进一步探索。
实施例7:基于kir的car可与天然抑制性kir共表达,允许通过在靶细胞上的hla表达进行调节
表达kir2dl3配体hla-cw的k562-meso细胞系的产生和表征
材料和方法:用编码hla-cw3等位基因的慢病毒载体转导野生型k562细胞或预先工程化以表达间皮素的k562系(k562-meso)。通过荧光激活细胞分选,分选细胞以使间皮素和hla-cw3均一地表达。用缀合到apc的w6/32抗hlaa,b,c抗体染色后,通过流式细胞术证实了hla-cw3表达。
结果:可以产生表达间皮素或hla-cw3单独或组合的k562细胞系(图20)。
ss1-kirs2和kir2dl3在原代人t细胞中的共表达
材料和方法:用抗cd3/28微珠刺激原代人t细胞,随后活化后的第1天,用表达dap12和ss1-kirs2的双顺反子慢病毒载体单独或与表达kir2dl3的慢病毒载体组合进行转导。使用生物素化的山羊抗小鼠f(ab)2多克隆抗体,然后用sa-apc通过流式细胞术评估ss1-kirs2car的表达。使用kir2d特异性单克隆抗体测定kir2dl3表达。
结果:单独使用dap12(kirs2),单独使用kir2dl3或两种受体的组合可以产生表达间皮素特异性的基于kir的car的原代人t细胞(图21)。
用kircar共表达的kir2dl3可以在靶细胞上存在hla-cw时抑制抗原特异性细胞毒性
材料和方法:用抗cd3/28微珠刺激原代人t细胞,随后用表达dap12和ss1-kirs2的双顺反子慢病毒载体转导。在离体扩增10天后,通过电穿孔将5μg体外转录的编码kir2dl3的mrna引入慢病毒转导的t细胞。将这些t细胞群与如所示的51cr标记的k562靶细胞(k562,k562-meso,k562-hlacw和k562-meso/hlacw)以效应t细胞与目标k562细胞的不同比例(e:t比)混合。通过在4小时测量释放到上清液中的51cr的分数来测定细胞毒性。
结果:表达ss1-kirs2/dap12的t细胞能够杀死表达间皮素的目标k562细胞,无论hla-cw3表达如何。相比之下,共表达ss1-kirs2/dap12受体复合体和抑制性kir——kir2dl3的t细胞未能对表达间皮素与hla-cw3的k562表现出强烈的细胞毒性;然而,这些细胞对仅表达间皮素的k562细胞显示出与ss1-kirs2/dap12修饰的t细胞相当的细胞毒性活性。这些结果表明抑制性kir受体调节激活性基于kir的cars的功能活性的能力(图22)。
实施例8:具有cd19特异性的基于kir的car可以在体外和体内触发抗原特异性靶细胞细胞毒性
具有cd19特异性的基于kir的car可以在体外引发抗原特异性靶细胞细胞毒性
材料和方法:在抗cd3/抗cd28珠激活后,用双顺反子慢病毒载体转导t细胞,所述载体表达dap12以及cd19特异性基于kir的car,其中fmc63衍生的scfv融合到全长kir2ds2(cd19-kir2s2)或基于kir的car,通过将fmc63scfv通过短接头[gly]4-ser接头融合到kir2ds2的跨膜和胞质结构域而产生所述基于kir的car(cd19-kirs2)。培养转导的t细胞直至对数生长期结束,并使用生物素化的山羊抗小鼠f(ab)2多克隆抗体接着通过sa-pe,通过流式细胞术评估cd19特异性基于kir的car的表达。将具有(k562-cd19)或不具有(k562-wt)cd19表达的51cr标记的k562靶细胞以t细胞与靶细胞的不同比例(e:t比)混合。通过在4小时测量释放到上清液中的51cr的分数来测定细胞毒性。用模拟物转导(ntd)的或用cd19(cd19-z)特异性的基于cd3ζ的car转导的对照t细胞也分别被包括作为阴性和阳性对照。
结果:流式细胞术分析证实cd19特异性scfv在用cd19-kir2ds2,cd19-kirs2和cd19-z转导的t细胞表面表达(图16a)。表达dap12与cd19-kir2ds2或cd19-kirs2的t细胞能够以抗原特异性方式杀死靶细胞(图16b)。基于kir的car-修饰的t细胞显示的细胞毒性与表达cd19特异性基于cd3ζ的car的t细胞相当或更高。
用cd19-kirs2/dap12转导的t细胞在人白血病异种移植物中诱导肿瘤消退
材料和方法:nod-scid-γc-/-(nsg)小鼠在第0天通过尾静脉静脉内移植100万nalm-6cbg肿瘤细胞——表达cd19的白血病细胞系。在实验中,用抗cd3/抗-cd28刺激珠刺激t细胞,随后在第1天用一系列具有或不具有共刺激结构域(cd19-z,cd19-bbz)的基于cd3的car或cd19特异性基于kir的car,具有dap12的cd19-kirs2进行慢病毒转导,如图所示。使用模拟物转导的t细胞(ntd)作为对照。将t细胞离体扩增至对数期生长结束,并在白血病细胞系注射后第5天静脉内注射,每只小鼠注射200万cart细胞。通过生物发光成像评估肿瘤负担。分析5只动物各t细胞状况(图17)。
结果:在给出的体内实验(图17)中,ntdt细胞对肿瘤生长没有影响,而cd19z,cd19bbz和cd19-kirs2转导的t细胞表现出多种抗肿瘤作用。输注cd19zt细胞的小鼠显示肿瘤负荷轻微降低,但保留可检测水平的发光。相比之下,输注cd19bbz或cd19kirs2t细胞的小鼠中的肿瘤细胞发光仅在t细胞注射后7天下降到检测下限(图17b,虚线),显示在t细胞无法接近的牙根中在白血病细胞的小的储存库外的完全清除。在第15天,模拟物t细胞组中的肿瘤负荷超过终点(2x1010光子/秒),并处死,而cd19bbz和cd19kirs2组的发光保持在检测下限。
实施例9:基于骆驼科单vhh结构域的car可以与没有明显的受体相互作用的基于scfv的car组合在t细胞表面上表达
材料和方法:在nfat依赖性启动子下表达gfp的jurkatt细胞(nf-gfp)用间皮素特异性激活car(ss1-car),cd19特异性激活(19-car)或使用egfr特异性的骆驼科vhh结构域产生的car(vhh-car)转导。在用激活car转导后,然后用识别cd19(19-pd1)的另外的抑制性car转导细胞以产生共表达活化和抑制性car(ss1+19pd1,19+19pd1或vhh+19pd1)的细胞。将转导的jurkatt细胞与不同的细胞系共培养24小时,所述不同的细胞系或者1)缺乏所有靶抗原(k562),2)仅表达间皮素(k-meso),cd19(k-19)或egfr(a431),3)表达egfr和间皮素(a431-间皮素)或cd19(a431-cd19)的组合,或4)表达cd19和间皮素(k-19/meso)的组合。还包括无刺激细胞(无stim)或具有1μg/mlokt3(okt3)的k562的附加条件,分别作为nfat激活的阴性和阳性对照。通过流式细胞术评估gfp表达,作为nfat激活的标记。
结果:骆驼和相关物种(如骆马)自然产生具有单个重链样可变结构域的抗体。这个称为骆驼科vhh结构域的结构域已经进化到不与轻链可变结构域配对而存在。图27a示意性地示出了当展示在细胞表面上时,两种异源scfv分子可以彼此解离并重新结合的可能性,如在受体共表达期间观察到scfv与同源配体结合的破坏所证明的(图25和图26)。图27b示出了展示在细胞表面上的scfvcar与基于vhh结构域的car组合之间预期减少的相互作用的示意图。图28表明,在jurkat表面上共表达两种基于scfv的car(ss1-z活化car和cd19-pd1抑制性car),导致活化car(ss1-z)不能识别靶细胞上的同源配体和触发t细胞活化,尽管不存在抑制性受体的配体。这与表面上观察到的减少的配体结合一致(图25)。相比之下,具有基于骆驼科vhh的活化car(vhh-z)的相同抑制性car(cd19-pd1)的共表达对基于vhh的活化car识别其同源egfr配体的能力没有影响。这些数据支持图27b所示的模型,即由于scfv和vhh结构域相互作用的能力降低,基于vhh的活化car可以与基于scfv的car表达,而在受体之间没有明显的相互作用。
实施例10:具有间皮素特异性的基于nkp46的ncrcar触发抗原特异性细胞毒性
材料与方法:在抗cd3/抗cd28珠激活后,用表达dap12和ss1-kirs2(对照)或fcεrγ和间皮素特异性基于nkp46的car(ss1-nkp46)或fcεrγ和间皮素特异性nkp46car(其中天然nkp46胞外结构域被截短)(ss1-tnkp46)的双顺反子慢病毒载体转导细胞。通过流式细胞术使用生物素化的山羊抗小鼠f(ab)2多克隆抗体,随后是sa-pe评估间皮素特异性car的表达(图18)。将t细胞与表达间皮素的51cr标记的k562靶细胞以效应t细胞与靶k562细胞的不同比例(e:t比)混合。通过测量与自发释放相比在4小时释放到上清液中的51cr的分数来测定细胞毒性。
结果:ss1-nkp46和ss1-nkp46受体均表现在t细胞上的表面表达。ss1-nkp46转导的t细胞表现出与基于kir的ss1-kirs2car相当的稳健的靶细胞细胞溶解。ss1-nkp46表现出较弱的细胞毒活性,其仅在高效应子与靶细胞比率下才是明显的(图18)。这些数据表明,使用类似于用于产生基于kir的car的设计,可以从天然细胞毒性受体(ncr)产生用于重定向t细胞溶细胞活性的抗原特异性嵌合免疫受体。
实施例11:scfv结构域的相互作用
材料和方法:在图24中,jurkatt细胞用编码间皮素特异性抑制性基于kir的car(ss1-kir2dl3)的慢病毒载体转导。然后将这些转导的细胞用不同稀释度的编码cd19特异性激活性基于kir的car(cd19-kir2ds2)的慢病毒载体转导。这些kir-cars在图23中示意性显示。在用两种car转导后,在用两种间皮素-fc融合蛋白,随后用pe标记的第二抗fc抗体和用apc标记的抗cd19特异性(克隆fmc63)抗独特型单克隆抗体染色后,通过流式细胞术评估细胞表面表达具有能够结合其靶配体的完整scfv的car的频率。在图25中,用不同的慢病毒载体转导抗cd3/28-活化的原代人t细胞,所述慢病毒载体编码具有与c末端的mcherry融合的间皮素特异性基于cd3z的car(ss1z-mch),具有cd3z和4-1bb胞质结构域的cd19特异性car(19bbz)或ss1z-mch和19bbz的组合。用间皮素-fc融合蛋白,随后用fitc标记的第二抗fc抗体染色后,用流式细胞术评估mcherry和功能性ss1scfv的表达。在图26中,使用编码间皮素特异性基于cd3z的car(ss1z),携带fmc63scfv的cd19特异性car(19bbz)或携带21d4scfv的cd19特异性car(21d4bbz)或携带bl22scfv的cd19特异性car(bl22bbz)的不同慢病毒载体转导抗cd3/28-活化的原代人t细胞,其中scfv由在scfv中轻链可变结构域(vl)5’的重链可变结构域(vh)(h2l)或位于vh5’处的vl(l2h)组成。用每个cd19特异性car转导后,t细胞用ss1z共转导。用间皮素-fc融合蛋白,随后用fitc或生物素化蛋白l标记的第二抗fc抗体,然后用链霉抗生物素蛋白–缀合的apc染色后,用流式细胞术评估ss1z与间皮素的结合以及抗cd19scfv的表面表达。
结果:图24显示,在细胞表面上共表达两种完整的配体结合的基于scfv的car(ss1-kir2dl3和cd19-kir2ds2)是相互排斥的。图26显示尽管在细胞中表达car,但是发生配体结合的丧失,如通过在用ss1z-mch和19bbz共转导的细胞中具有降低的间皮素结合的mcherry表达细胞的存在所阐明。图26表明导致scfv结合功能丧失的scfv之间的相互作用可以使用不同的基于scfv的car来观察,支持这种效应的普遍性质。这些观察结果与图27小图a中所示的模型一致,其中一个scfv的可变结构域可以与异源的基于scfv的嵌合受体发生分子间配对,导致单一car内的scfv的结合丧失。
实施例12:基于杀伤性免疫球蛋白样受体(kir)的嵌合抗原受体(car)触发实体瘤中的细胞毒性活性
基于单个嵌合分子的嵌合抗原受体(car)为针对肿瘤的工程化t细胞细胞毒性提供了有效的方法,所述car具有顺式连接到cd3ζ的胞质结构域和共刺激受体cd28或4-1bb的抗原结合结构域。使用基于通常由自然杀伤(nk)细胞和t细胞表达的杀伤性免疫球蛋白样受体(kir)的嵌合多链受体。通过将单链可变片段(scfv)融合到kir的跨膜和胞质结构域构建,显示靶向间皮素的基于kir的car(ss1-kir)触发抗原特异性细胞毒活性和细胞因子产生,其与具有独立于额外共刺激的抗原诱导的增殖的基于cd3ζ的car相当。使用抗t细胞免疫治疗的间皮瘤的异种移植模型,进一步证明,与具有共刺激性的带有间皮素特异性基于cd3ζ的car的t细胞相比,靶向间皮素的基于kir的car具有更强的抗肿瘤活性,尽管体内持续存在基于cd3ζ的car的t细胞。肿瘤浸润淋巴细胞的评估表明,与具有共刺激受体结构域的基于cd3ζ的car相比,基于kir的car+t细胞显示对肿瘤微环境内获得性机能减退的抵抗力。基于kir的car诱导肿瘤消退的能力(其中第二代基于cd3ζ的car显示有限的活性)支持了间皮瘤和其它肿瘤例如其它实体瘤中基于kir的car的未来的临床评估。
实施例13:间皮素特异性car的体内抗肿瘤活性
与实施例6中所述的异种移植实验类似,在间皮瘤模型中测试了一系列基于间皮素的car构建体以评估体内抗肿瘤活性。测试了三种间皮素特异性car构建体(如图39所示):含有ss1抗原结合结构域和含有cd28和cd3z胞内信号传导结构域的胞质结构域的第二代car构建体(ss1-28ζ,图39c),包含一个链上的ss1抗原结合结构域和kir2ds2胞质结构域和另一条链上的衔接分子dap12的多链kir-car(ss1-kirs2/dap12,图39a),和含有ss1抗原结合结构域和含有dap12的胞质结构域的单链kir-car(ss1-dap12,图39b)。使用的ss1-dap12构建体的跨膜结构域是cd8跨膜结构域。
对成年nsg小鼠皮下注射2x106个如前和实施例6中所述的em-meso细胞。用ss1-28ζ,ss1-kirs2/dap12,ss1-dap12转导原代人t细胞,实现90%的转导效率,或者用模拟物转导。在肿瘤植入后第20天静脉内注射4.3x106个car转导或模拟物转导的原代人t细胞。使用公式(π/6)×(长)×(宽)2在指定时间(n=5只小鼠每组)测量肿瘤体积。在第40天(肿瘤消退的最低点)和第52天(实验结束时)通过单因素方差分析(p<0.001)比较cart细胞治疗组间的肿瘤体积,通过posthocscheffef检验进行组间比较。*表示在两个时间点与模拟物对照是统计学差异的(p<0.001)。
如图40所示,与模拟物转导的和无t细胞对照相比,ss1-dap12显示出抗肿瘤活性,导致肿瘤体积减少。与实施例6中所述结果类似,ss1-kirs2/dap12显示出与ss1-28ζ构建体实现的相当的强烈抗肿瘤活性。
实施例14:含有结合间皮素的人抗原结合结构域的nkr-car的体外活性
产生含有与间皮素结合的人抗原结合结构域的nkr-car。如表4所提供,将结合间皮素,m-5,m-11,m-12,m-14,m-16,m-17,m-21和m-23的人scfv序列融合到来源于kir2ds2的跨膜结构域和胞质结构域,以下称为humeso-kirs2。如前述实施例中所述产生慢病毒构建体,例如进一步包含通过肽切割位点t2a与nkr-car连接的dap12的双顺反子慢病毒载体。进行多种体外测定以评估含有人抗间皮素scfv的间皮素特异性的nkr-cars的car活性。
表面表达
进行测定以确定humeso-kirs2构建体在原代人t细胞上的表面表达。用抗cd3/抗cd28t细胞活化珠(
细胞毒性
还测定了表达humeso-kirs2的car细胞的靶特异性细胞毒活性。将表达humeso-kirs2的原代人t细胞与51cr标记的间皮素表达靶细胞(工程化以表达间皮素的k562细胞,k562-meso)或不表达间皮素的对照靶细胞(k562细胞,k562)以效应t细胞与靶细胞的不同比例(0:1,10:1,20:1和30:1)混合。通过测量4小时后释放到上清液中的51cr的分数来测定细胞毒性。如在使用不表达间皮素(k562)的对照细胞的对照实验中预期的,没有car表达细胞表现出显著量的细胞毒性。在图42b中,未转导的(ntd)细胞未显示抗原特异性细胞毒性。含有m-23和m-12scfv的humeso-kirs2表现出很小的抗原特异性细胞毒性。然而,含有m-5,m-11,m-16,m-17和m-21的humeso-kirs2在与含ss1的对照相似的水平下表现出显著的抗原特异性细胞毒性。
细胞因子生产
还评估了表达humeso-kirs2的car细胞的细胞因子产生。刺激原代人t细胞,用humes-kirs2转导并如前所述扩增。扩增后,将转导的t细胞与k562(间皮素阴性细胞,空心条形)或进行工程化以表达间皮素的k562细胞(黑色条形)以2:1的比例混合。在刺激24小时后通过elisa为所指示的细胞因子测定在上清液中细胞因子浓度(ifnγ和il-2)。如图43a所示,含有m-5,m-11,m-14,m-16,m-17和m-23的表达humeso-kirs2的car细胞产生了ifnγ。如图43b所示,含有m-5,m-11,m16和m17的humes-kirs2表达细胞产生了il-2。
实施例15:低剂量rad001在细胞培养模型中刺激cart增殖
通过在不同浓度的rad001存在下将cart表达细胞与靶细胞共培养来评价低剂量rad001对体外cart细胞增殖的影响。
材料和方法
car转导的t细胞的产生
使用人源化的抗人cd19car(hucart19)慢病毒转移载体来产生包装成vsvg假型包装的慢病毒颗粒的基因组材料。人源化抗人cd19
car(hucart19)的氨基酸和核苷酸序列是在2014年3月15日提交的
pct公开wo2014/153270中描述的car1,id104875,并且在其中命名为seqidnos.85和31。
将慢病毒转移载体dna与三种包装组分vsvgenv,gag/pol和rev与lipofectamine试剂的组合混合以转染lenti-x293t细胞。在24h和30h后更换培养基,之后收集含病毒的培养基,过滤并在-80℃下保存。cart通过转导新鲜或冷冻的幼稚t细胞产生,所述t细胞通过对健康供体血液或leukopak的负磁选择而获得。通过与抗-cd3/抗-cd28珠温育24小时来活化t细胞,之后将病毒上清液或浓缩的病毒(分别为moi=2或10)加入到培养物中。使修饰的t细胞扩增约10天。通过在第7天和第9天之间的流式细胞术分析来测定转导的细胞的百分比(在细胞表面上表达car)和car表达水平(相对荧光强度,geomean)。减慢生长速率和t细胞大小接近~350fl的组合决定了待被冷冻保存用于以后分析的t细胞的状态。
评估cart的增殖
为了评价cart的功能,将t细胞解冻并计数,并通过cellometer评估存活力。使用非转导t细胞(utd)归一化每种培养物中的car阳性细胞的数量。在以50nm开始的rad001滴定中测试rad001对cart的影响。在所有共培养实验中使用的靶细胞系是nalm-6,其是表达cd19并转导以表达萤光素酶的人前b细胞急性淋巴细胞白血病(all)细胞系。
为了测量cart的增殖,用靶细胞以1:1的比例培养t细胞。测定进行4天,此时细胞对cd3,cd4,cd8和car表达进行染色。通过流式细胞术,使用计数珠作为参考评估t细胞的数量。
结果
在4天共培养测定中测试cart细胞的增殖能力。在用nalm-6培养car-转导和非转导的t细胞后,评估car-阳性cd3-阳性t细胞(深色条形)和总cd3-阳性t细胞(浅色条形)的数量(图39)。当在小于0.016nm的rad001存在下培养时,hucart19细胞扩增,在较高浓度的化合物下扩增程度较小。重要的是,在0.0032和0.016nmrad001下,增殖高于在不添加rad001的情况下观察到的增殖。非转导的t细胞(utd)没有显示可检测的扩增。
实施例16:低剂量rad001在体内刺激cart扩增
该实施例评价了hucar19细胞在体内用不同浓度的rad001增殖的能力。
材料和方法:
nalm6-luc细胞:从患有复发性all的患者的外周血开发nalm6人类急性淋巴细胞白血病(all)细胞系。然后用萤火虫萤光素酶标记细胞。这些悬浮细胞在补充有10%热灭活的胎牛血清的rpmi中生长。
小鼠:从jacksonlaboratory(货号005557)接收6周龄的nsg(nod.cg-prkdcscidil2rgtm1wjl/szj)小鼠。
肿瘤移植:使nalm6-luc细胞在补充有10%热灭活的胎牛血清的rpmi中在体外生长和扩增。然后将细胞转移到15ml锥形管中,并用冷的无菌pbs洗涤两次。然后计数nalm6-luc细胞,并以10x106个细胞/毫升pbs的浓度重悬。将细胞置于冰上并立即(在1小时内)植入小鼠中。通过尾静脉以100微升体积静脉内注射nalm6-luc细胞,每只小鼠总共1x106个细胞。
cart细胞给药:在肿瘤植入后7天给小鼠施用5x106cart细胞。将细胞在37℃水浴中部分解冻,然后通过向含有细胞的管中加入1ml冷的无菌pbs完全解冻。将解冻的细胞转移至15mlfalcon管中,并用pbs调整至最终体积为10ml。将细胞以1000rpm洗涤两次,每次10分钟,然后在血细胞计数器上计数。然后将t细胞以50x106cart细胞/ml冷pbs的浓度重悬,并保持在冰上直到对小鼠给药。通过尾静脉用100μlcart细胞静脉内注射小鼠,每只小鼠5x106cart细胞的剂量。每组8只小鼠用100μlpbs单独(pbs)或人源化cd19cart细胞处理。
rad001给药:配制50mg等于1mgrad001的浓缩微乳液,然后在给药时重悬于d5w(5%葡萄糖水溶液)中。每天口服给予小鼠(通过口服管饲)200微升所需剂量的rad001。
pk分析:在肿瘤植入后7天开始对小鼠每天给药rad001。给药组如下:0.3mg/kg,1mg/kg,3mg/kg和10mg/kg。在rad001的第一次和最后一次剂量后的第0天和第14天在以下的时间点对小鼠采血用于pk分析:15分钟,30分钟,1小时,2小时,4小时,8小时,12小时和24小时。
结果:
在具有nalm6-luc肿瘤的nsg小鼠中测试rad001的扩增和药代动力学。每天单独口服给予rad001对nalm6-luc肿瘤的生长没有影响(图40)。rad001的药代动力学分析显示其在荷瘤小鼠的血液中相当稳定(图41a和41b)。在第0天和第14天pk分析显示,在测试的最低剂量(0.3mg/kg)下,即使在给药后24小时,血液中的rad001浓度也高于10nm。
基于这些剂量,给予hucar19cart细胞rad001和不给予rad001以测定这些细胞的增殖能力。基于给药后24小时的血液中rad001的水平,使用的最高剂量为3mg/kg。由于在rad001的最终剂量后24小时rad001的浓度高于10nm,在使用cart细胞的体内研究中使用几种较低剂量的rad001。在开始每日口服rad001给药之前一天,静脉内给予cart细胞。通过facs监测小鼠的t细胞扩增。
最低剂量的rad001显示cart细胞的增强的增殖(图42)。与cd8+cart细胞相比,使用cd4+cart细胞,这种增强的增殖更加明显和延长。然而,对于cd8+cart细胞,在cart细胞剂量后的早期时间点可以看到增强的增殖。在实施方案中,rnacart细胞也可以与检查点抑制剂组合使用。
在此通过引用把在本文中引用的每一篇专利、专利申请和出版物全文并入本文中。虽然参考具体的实施方案公开了本发明,但是显然本领域其他技术人员在不偏离本发明真正的精神和保护范围的情况下,可以设计本发明的其它实施方案和变型。所附的权利要求书意在被理解为包括所有这样的实施方案和等同的变型。
- 还没有人留言评论。精彩留言会获得点赞!