通过融合到来自七鳃鳗的序列进行的重组蛋白多聚化的制作方法
本发明总体上涉及多聚体重组蛋白的产生。
发明背景
蛋白质负责大多数细胞功能,诸如分子识别(例如在免疫系统中)、信号传导途径(激素)、代谢物和营养物质的运输以及生化反应的催化(酶)。
蛋白质的功能由它们的三维结构引起,亦即多肽链的氨基酸如何在空间上相对于彼此安排。蛋白质通常仅处于蛋白质可以发挥其生物活性的折叠状态(天然状态)下。
虽然大多数蛋白质具有一级结构(氨基酸序列)、二级结构(α-螺旋和β-折叠)和三级结构(三维),但蛋白质低聚物具有被称为四级结构的另外的水平,该四级结构是三维结构的一部分。低聚物是若干多肽的复合物。它们可以包含被称为亚基的相同蛋白质的若干拷贝,并且被称为同源低聚物,或者它们可以由超过一种类型的蛋白质亚基组成,在这种情况下,它们被称为异源低聚物。血红蛋白是血液中的氧载体,它是包含相同亚基的蛋白质的实例。固氮酶是负责将氮气还原成氨的微生物酶,它是包含不相同的亚基的蛋白质的实例。
感兴趣的许多重组蛋白实质上是低聚物,例如抗体、许多跨膜蛋白诸如跨膜受体、孔蛋白、病毒表面抗原,热休克蛋白、病毒衣壳蛋白、铁蛋白、胰岛素、许多酶诸如谷胱甘肽过氧化物酶、过氧化氢酶或超氧化物歧化酶、胶原蛋白等等。
例如,流感病毒血球凝集素(ha)是病毒表面上的同源三聚体糖蛋白,其负责病毒与宿主细胞受体的相互作用。ha的三维结构在自然(nature),289,366-373(1981)中有详细描述。通过针对流感病毒的疫苗接种诱导的保护性免疫应答主要针对病毒ha蛋白质。重组ha蛋白质(rha)因此代表了用于开发流感疫苗的感兴趣抗原。
另一种感兴趣的低聚物抗原是发现在细菌的针尖处形成五聚体或在ipab存在下形成四聚体的志贺氏菌(shigella)侵袭质粒抗原d(ipad)蛋白质(张(cheung)等人,分子微生物学(molecularmicrobiology),95(1),31-50(2015))。
另外感兴趣的低聚物抗原是志贺氏菌的ipah(mxih)蛋白质的膜表达,已发现该蛋白质形成产生志贺氏菌针的亚基的螺旋组件(科德斯(cordes)等人,生物化学期刊(thejournalofbiologicalchemistry),278(19),17103-17107(2003))。
重组蛋白领域的挑战之一是重组蛋白并不总是具有与天然蛋白相同的三维构象。然而,蛋白质的功能通常由它们的三维结构引起。
类似地,相对于低聚物,如果重组蛋白不保留天然蛋白的四级结构,则重组蛋白的功能可能被改变或受到抑制。
例如,威廉·c.·威尔顿(williamc.weldon)等人在plosone,5(9),e12466(2010)中表明,重组流感血球凝集素的差的三聚作用可能在其低免疫原性中起作用。
因此,需要产生更好地保留低聚物结构和天然蛋白所希望的生物学功能的重组蛋白。
志仁·魏(chih-jenwei)等人,在病毒学期刊(journalofvirology),82(13),6200-6208(2008)中描述了使用t4噬菌体的折叠序列进行的流感rha的三聚化。
发明概述
本发明人令人惊讶地确定七鳃鳗可变淋巴细胞受体b(vlr-b)抗体的序列的片段可以用于使异源融合蛋白多聚化。
七鳃鳗是无颌脊椎动物,它具有由克隆上多样的淋巴细胞组成的适应性免疫系统,这些淋巴细胞表达由富含亮氨酸重复基因片段的组合组件产生的可变淋巴细胞受体(vlr)。vlr-b可以被分泌并且可以类似于颌类脊椎动物中的抗体起作用。
令人惊讶的是,发现编码感兴趣蛋白质的核酸序列和编码存在于七鳃鳗vlr-b抗体最后c-末端(即c-末端到茎部区域(stalk)(在wo2008/016,854的图11c中称为“c-term”的结构域))的肽的核酸序列的融合物编码能够以若干低聚程度进行低聚化的重组蛋白。
更令人惊讶的是,发现所获得的多聚体重组蛋白是稳定的。
以及甚至更令人惊讶的是,我们发现获得的稳定的多聚体重组蛋白具有若干低聚程度,同时保持它们天然形式的生物活性。
根据一个实施例,获得一种分子,该分子包含与seqidno:1具有至少80%一致性的第一氨基酸序列和与所述第一序列异源的第二氨基酸序列。
根据另一个实施例,获得一种重组蛋白,该重组蛋白包含与seqidno:1具有至少80%一致性的第一氨基酸序列和与所述第一序列异源的第二氨基酸序列。
根据另一个实施例,构建一种重组核酸,该重组核酸包含与seqidno:3具有至少80%一致性的第一核酸序列和与所述第一序列异源的第二核酸序列。
另一个方面涉及一种包含如上所述的重组核酸的表达盒,其中该重组核酸可操作地连接到启动子。
另一个方面涉及一种使用表达盒转化的宿主细胞。
本发明还涉及一种稳定的同源多聚体重组蛋白,该同源多聚体重组蛋白包含选自下组的蛋白质,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到含有与seqidno:1具有至少80%一致性的氨基酸序列的蛋白质。
另一个实施例涉及一种药物组合物,该药物组合物包含本发明的分子或重组蛋白和药学上可接受的载体或稀释剂。
在另一个方面,本发明提供一种免疫原性组合物,该免疫原性组合物包含本发明的分子或重组蛋白。
在另一个实施例中,本发明的分子或重组蛋白是用作药物。
在本发明的另一方面中,本发明的分子或重组蛋白是用于诱导对于受试者中的抗原的免疫应答。
本发明还涉及一种用于使重组蛋白多聚化的方法,该方法包括:
a)将与seqidno:3具有至少80%一致性的核酸序列融合到编码所述重组蛋白的核酸序列,其条件是所述重组蛋白不是七鳃鳗vlr-b抗体蛋白质,
b)在引起所述重组蛋白多聚化的条件下,表达由所述核酸序列编码的融合蛋白。
定义
在本发明的上下文中,蛋白质“低聚物”或“聚合物”或“多聚体”具有相同的含义,即,蛋白质具有四级结构,是至少两个多肽的复合物,所述多肽可以是相同或不同的。因此,在本发明的上下文中,“多聚化”、“低聚化”和“聚合”具有相同的含义,“多聚化的”、“低聚化的”和“聚合的”或“使...多聚化”、“使...低聚化”和“聚合...”也一样。
“重组蛋白”是由重组核酸编码的蛋白质。它们由宿主细胞中的重组核酸表达。在此使用“重组核酸”描述核酸分子,根据其来源或操作,该核酸分子不与其天然缔合的多核苷酸全部或部分缔合和/或连接到除了与其天然连接的多核苷酸之外的多核苷酸。本发明的重组蛋白包含来自七鳃鳗的vlr-b抗体的蛋白质片段和与来自七鳃鳗的vlr-b抗体的蛋白质片段异源的感兴趣蛋白质。如在此所述的,本发明的重组蛋白包含来自七鳃鳗的vlr-b抗体的最后c-末端的蛋白质片段。
在本发明的上下文中,“分子”是在来自七鳃鳗的vlr-b抗体的蛋白质片段和与来自七鳃鳗的vlr-b抗体的蛋白质片段异源的感兴趣蛋白质之间以任何方式的接合。例如,本发明的分子可以经由共价键通过接合vlr-b蛋白质和感兴趣的异源蛋白来产生。这样的共价键的实例包括肽键、酯键、酰胺键以及二硫键。如在此所述的,来自七鳃鳗的vlr-b抗体的蛋白质片段来自于七鳃鳗的vlr-b抗体的最后c-末端。
在本发明的分子或重组蛋白的说明中的“第一氨基酸序列”和“第二氨基酸序列”,并非意指考虑序列的特定顺序。这仅是为了使实施例清楚以更好地区分包含在本发明的分子或重组蛋白中的两个序列。
在本发明的重组核酸的说明中的“第一核酸序列”和“第二核酸序列”,并非意指考虑序列的特定顺序。这仅是为了使实施例清楚以更好地区分包含在本发明的重组核酸中的两个序列。
在本发明的上下文中,第一序列氨基酸序列或核酸序列分别命名源自于七鳃鳗的vlr-b抗体的c-末端的氨基酸序列或核酸序列。根据本发明,第一多肽序列的大小典型地是在24与43个氨基酸长度之间,具体地在30与43个氨基酸长度之间,包括边界。因此,第一多肽序列的大小可以优选地是约30、31、32、33、34、35、36、37、38、39、40、41、42或43个氨基酸长度。根据本发明,第一核酸序列的大小典型地是在72与129个碱基对长度之间,具体地在90与129个碱基对长度之间,包括边界。因此,第一核酸序列的大小可以优选地是约90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128或129个碱基对长度。
在本发明的上下文中,第二序列氨基酸序列或核酸序列分别命名感兴趣蛋白质或其片段的氨基酸序列或编码感兴趣蛋白质或其片段的核酸序列。在本发明的上下文中,如在此所提及的蛋白质的“片段”保持它所源自于的全长蛋白质的生物功能。因此,根据本发明的片段可以是至少20、至少50、至少75、至少100或至少150个氨基酸长度。
当包含在单个重组分子内的两个序列通常在自然界中彼此不缔合时,它们相对于彼此是“异源的”。在本发明的上下文中,与第一序列异源的第二序列氨基酸序列或核酸序列意指第二异源序列不是来自七鳃鳗的vlr-b抗体的序列或不包含来自七鳃鳗的vlr-b抗体的序列。在本发明的上下文中,异源序列不是聚组氨酸-标签(his-标签)的氨基酸序列或编码该聚组氨酸-标签的核酸序列。此外,优选的是,根据本发明的异源序列是至少5、至少10或至少15个氨基酸长度(或者是编码这样的氨基酸序列的核苷酸序列)。
“融合蛋白”是通过接合最初编码单独的蛋白质的两个或更多个基因而产生的蛋白质。这典型地涉及从编码第一蛋白质的dna序列中移除终止密码子,然后通过连接或重叠延伸pcr将第二蛋白质的dna序列附加在框内。如果融合超过两个基因,则以相同的方式在框内添加其他基因。然后可以将所得dna序列通过细胞表达为单个蛋白质。本发明的融合蛋白是通过将编码来自七鳃鳗vlr-b抗体的蛋白质片段的核酸融合到编码感兴趣蛋白质或其片段中的任一个或所有的核酸来获得的。在本发明的上下文中,蛋白质可以被工程化以包含感兴趣蛋白质的完整序列或感兴趣蛋白质的仅一部分。两个或更多个基因的接合能以任何顺序进行,即编码感兴趣蛋白质或其片段的序列是位于编码七鳃鳗vlr-b抗体的片段的序列的3’或5’。优选地,编码感兴趣蛋白质或其片段的序列是位于编码七鳃鳗vlr-b抗体的片段的序列的5’。如在此其他位置所述的,在本发明的上下文中,来自七鳃鳗的vlr-b抗体的蛋白质片段来自于七鳃鳗vlr-b抗体的最后c-末端。
如在此所用的,与第二序列具有至少x%一致性的第一序列意指x%表示相对于第二氨基酸序列的总长度,当经由总体比对来对两个序列来进行最佳地比对时,第一序列中的氨基酸与第二序列中它们匹配的氨基酸相同的数目。当x是最大值时,两个序列都是最佳对齐的。一致性百分比的比对和确定可以手动地或使用总体对比算法自动地进行,例如在尼德尔曼和文施(needlemanandwunsch),分子生物学期刊(j.molbiol.)48,443-453(1970)中描述的尼德尔曼和文施算法,其使用例如用于多肽序列比较的以下参数:比较矩阵:blosum62,来自亨尼考夫(henikoff)和亨尼考夫,美国科学院院刊(proc.natl.acad.sci.usa.),89,10915-10919(1992);空位罚分:8;以及空位长度罚分:2;以及用于多核苷酸比较的以下参数:比较矩阵:匹配=+10,错配=0;空位罚分:50;以及空位长度罚分:3。
可以与上述参数一起使用的程序作为威斯康辛州麦迪逊的遗传学计算机公司(geneticscomputergroup,madisonwi)的“空位”程序公开获得。上述参数是分别用于肽比较(同时末端间隙不存在罚分)和用于核酸比较的默认参数。
“抗原”是指可以在个体中引出免疫应答的任何药剂,优选地为大分子。该术语可以用于指示单个大分子或者抗原大分子的同种或异种群体。如在此所用的,“抗原”优选地用于指示一个或多个表位的蛋白质分子或其部分。表位是抗原被抗体或t细胞受体识别的一部分。一些表位倍称为不连续的构象表位。这意味着包含这些表位的氨基酸在蛋白质的三维结构中彼此接近,但当严格地查看一维线性氨基酸序列时看起来彼此远离。因此,清楚的是蛋白质的三维结构在免疫系统实际看到的方面是非常重要的。
“胞外域”是跨膜锚定蛋白延伸超过膜进入细胞外空间的部分。
“支架”是通过选择性随机诱变适当暴露的表面残基,之后选择具有所希望的结合活性的变体,通常由所选蛋白质支架的组合文库生成的特异性配体结合人工结构。卡斯帕·宾斯(kasparbinz)等人在自然生物科技(naturebiotechnology)86(10),1257-1268(2005)中评论了许多替代性蛋白质支架以及由它们设计组合文库的并选择相关变体的成熟技术,最主要是噬菌体展示和相关方法。
附图简述
参考以下对实施例和附图的详细描述,可以更充分地理解实施例的不同特征,在附图中:
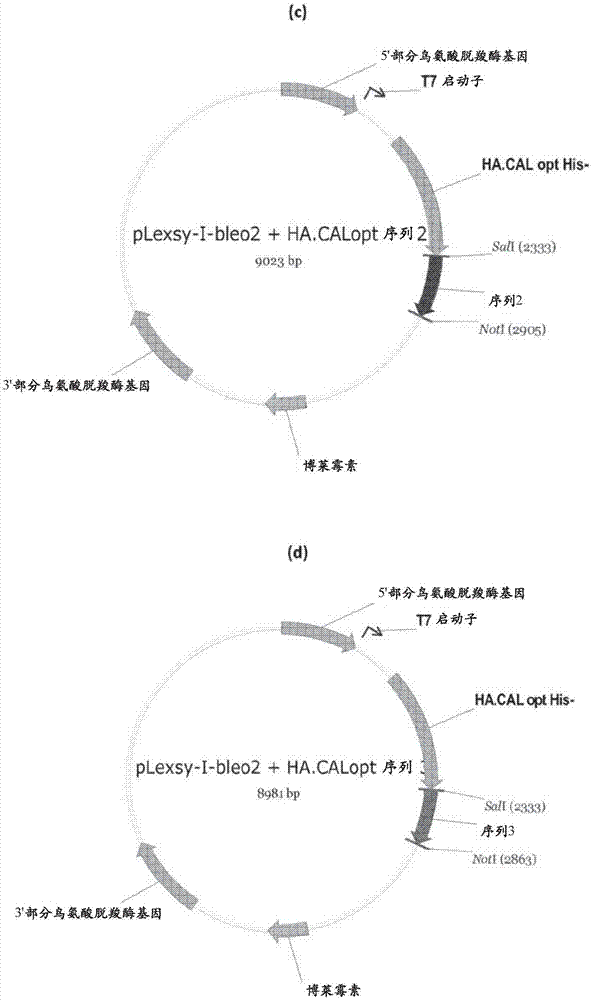
图1示出了用于产生重组流感ha胞外域蛋白质的表达盒。
(a)plexsy-i-bleo2表达盒。
(b)序列1对应于seqidno:7并且是编码第一测试序列的核酸序列,它融合到编码流感a/加利福尼亚(california)/07/2009(h1n1)的ha蛋白质的胞外域的核酸序列。
(c)序列2对应于seqidno:8并且是编码第二测试序列的核酸序列,它融合到编码流感a/加利福尼亚/07/2009(h1n1)的ha蛋白质的胞外域的核酸序列。
(d)序列3对应于seqidno:9并且是编码第三测试序列的核酸序列,它融合到编码流感a/加利福尼亚/07/2009(h1n1)的ha蛋白质的胞外域的核酸序列。
图2示出了不同的重组ha胞外域蛋白质的sdspage凝胶的蛋白质印迹。
·泳道1:分子量大小标记
·泳道2:阴性对照-未诱导启动子,使用热处理
·泳道3:阴性对照-未诱导启动子
·泳道4:阴性对照-无相关抗原(流感抗体),使用热处理
·泳道5:阳性对照-rha胞外域,无聚合序列,使用热处理
·泳道6:阳性对照-rha胞外域,无聚合序列
·泳道7:根据一个实施例,融合到聚合序列seqidno:1的rha胞外域,使用热处理
·泳道8:根据一个实施例,融合到聚合序列seqidno:1的rha胞外域
·泳道9:根据一个实施例,融合到聚合序列seqidno:2的rha胞外域,使用热处理
·泳道10:根据一个实施例,融合到聚合序列seqidno:2的rha胞外域
·泳道11:融合到聚合序列seqidno:5的rha胞外域,使用热处理
·泳道12:融合到聚合序列seqidno:5的rha胞外域
图3示出了根据实施例使用多聚体rha免疫的小鼠中的血凝集平均抗体滴度的抑制。
图4示出了用于在cho细胞中产生重组流感ha胞外域蛋白质的pee14.4表达盒。
图5示出了在cho细胞中表达的不同重组ha胞外域蛋白质的sdspage凝胶的蛋白质印迹。
图6示出了用于在大肠杆菌中产生重组弗氏志贺氏菌(shigellaflexneri)ipad蛋白质的pm1800表达盒。
图7示出了不同重组弗氏志贺氏菌ipad蛋白质的sdspage凝胶的蛋白质印迹。
图8示出了具有his-标签的不同重组弗氏志贺氏菌ipad蛋白质的sdspage凝胶的蛋白质印迹。
图9示出了不同的热处理的重组弗氏志贺氏菌ipad蛋白质的sdspage凝胶的蛋白质印迹。
图10示出了不同的重组弗氏志贺氏菌mxih蛋白质的sdspage凝胶的蛋白质印迹。“is”意指不可溶的(球粒样品),而“s”意指可溶的(上清液样品)。
图11示出了具有his-标签的不同的重组弗氏志贺氏菌mxih蛋白质的sdspage凝胶的蛋白质印迹。“is”意指不可溶的(球粒样品),而“s”意指可溶的(上清液样品)
实施例说明
根据一个实施例,获得一种分子,该分子包含与seqidno:1具有至少80%一致性的第一氨基酸序列和与所述第一序列异源的第二氨基酸序列。具体地,根据本发明的分子包含第一氨基酸序列,该第一氨基酸序列与seqidno:1具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
根据一个实施例,获得一种分子,该分子包含与seqidno:2具有至少80%一致性的第一氨基酸序列和与所述第一序列异源的第二氨基酸序列。具体地,根据本发明的分子包含第一氨基酸序列,该第一氨基酸序列与seqidno:2具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
在一个优选的实施例中,将对应于seqidno:1的位置2、7、13、19、21、24以及27的7个半胱氨酸保存在第一氨基酸序列中。本发明的分子不包含七鳃鳗vlr-b抗体蛋白质。
在一个优选的实施例中,将对应于seqidno:2的位置2、15、20、26、32、34、37以及40的8个半胱氨酸保存在第一氨基酸序列中。本发明的分子不包含七鳃鳗vlr-b抗体蛋白质。
根据一个实施例,获得一种重组蛋白,该重组蛋白包含与seqidno:1具有至少80%一致性的第一氨基酸序列和与所述第一序列异源的第二氨基酸序列。具体地,根据本发明的重组蛋白包含第一氨基酸序列,该第一氨基酸序列与seqidno:1具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
根据一个实施例,获得一种重组蛋白,该重组蛋白包含与seqidno:2具有至少80%一致性的第一氨基酸序列和与所述第一序列异源的第二氨基酸序列。具体地,根据本发明的分子包含第一氨基酸序列,该第一氨基酸序列与seqidno:2具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
在一个优选的实施例中,将对应于seqidno:1的位置2、7、13、19、21、24以及27的7个半胱氨酸保存在第一氨基酸序列中。本发明的重组蛋白不包含七鳃鳗vlr-b抗体蛋白质。
优选地,本发明的分子或重组蛋白不包含来自七鳃鳗vlr-b抗体的富含亮氨酸重复序列(lrr)模块。来自七鳃鳗vlr-b抗体的lrr模块的共有序列是lxxlxxlxlxxnxlxxxpxgxfdx,其中x可以是任何氨基酸(seqidno:29)。优选地,本发明的分子或重组蛋白不包含属于由seqidno:29限定的序列组的范围内的序列,即本发明的分子或重组蛋白不包含seqidno:29。lrr模块的具体实例(参见wo2008/016854的图11c)包括n-末端帽lrr(称为lrrnt)、lrr1、可变lrr模块(称为lrrv)、端部lrrv(称为lrrve)以及基c-末端帽lrr(称为lrrct)。优选地,本发明的分子或重组蛋白不包含来自七鳃鳗vlr-b抗体的lrrnt、lrr1、lrrv以及lrrct模块中的一个或多个。除lrr模块之外,七鳃鳗vlr-b抗体还包含连接肽(cp)和茎部区域。优选地,本发明的分子或重组蛋白不包含来自七鳃鳗vlr-b抗体的cp或茎部区域。优选地,本发明的分子或重组蛋白不包含来自七鳃鳗vlr-b抗体的lrr模块、cp或茎部区域。优选地,本发明的分子或重组蛋白中仅七鳃鳗来源的氨基酸序列源自于七鳃鳗vlr-b抗体的最后c-末端(即,蛋白质c-末端至茎部区域的区段,参见wo2008/016854的图11c)。优选地,本发明的分子或重组蛋白中仅七鳃鳗来源的氨基酸序列是与seqidno:1或seqidno:2具有至少80%一致性的序列,例如与seqidno:1或seqidno:2具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
另一个实施例涉及一种重组核酸,该重组核酸包含与seqidno:3具有至少80%一致性的第一核酸序列和与所述第一序列异源的第二核酸序列。具体地,根据本发明的重组核酸包含第一氨基酸序列,该第一核酸序列与seqidno:3具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
另一个实施例涉及一种重组核酸,该重组核酸包含与seqidno:4具有至少80%一致性的第一核酸序列和与所述第一序列异源的第二核酸序列。具体地,根据本发明的重组核酸包含第一氨基酸序列,该第一核酸序列与seqidno:4具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
在一个优选的实施例中,第一核酸序列编码氨基酸序列,该氨基酸序列包含对应于seqidno:1的位置2、7、13、19、21、24以及27的所述氨基酸序列内的位置处的半胱氨酸残基。本发明的重组核酸不编码七鳃鳗vlr-b抗体。在一个优选的实施例中,第一核酸序列编码氨基酸序列,该氨基酸序列包含对应于seqidno:2的位置2、15、20、26、32、34、37以及40的所述氨基酸序列内的位置处的半胱氨酸残基。
优选地,本发明的重组核酸不编码来自七鳃鳗vlr-b抗体的富含亮氨酸重复序列(lrr)模块。具体地,如在此所述的重组核酸不编码具有seqidno:29的序列的氨基酸序列。优选地,本发明的重组核酸不编码来自七鳃鳗vlr-b抗体的lrrnt模块、lrr1模块、lrrv模块、lrrct模块、cp和茎部区域中的一个或多个。优选地,由本发明的重组核酸编码的仅七鳃鳗来源的氨基酸序列源自于七鳃鳗vlr-b抗体的最后c-末端(即,蛋白质c-末端至茎部区域的区段,参见wo2008/016854的图11c)。优选地,本发明的重组核酸中仅七鳃鳗来源的核酸序列是与seqidno:3或seqidno:4具有至少80%一致性的序列,例如与seqidno:3或seqidno:4具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
接头可以插入在第一氨基酸序列与第二异源氨基酸序列之间。接头可以是蛋白质结构域之间的短肽序列或另一种合适的共价连接。优选地,接头是短肽序列。优选地,所述肽接头由柔性残基像甘氨酸(g)和丝氨酸(s)构成,这样使得相邻的蛋白质结构域相对于彼此自由移动。优选地,所述接头是至少3、4、5、6、7、8、9、10、11、12、13、14或至少15个氨基酸残基长度。本领域的技术人员已知的任何可能的接头可以用于本发明的目的。例如,接头可以是g6s9(这意指6个甘氨酸接着9个丝氨酸),如威廉·c.·威尔顿等人在plosone,5(9),e12466(2010)中所使用的;g8,如露德米拉·西索夫(ludmilla
编码如上所述的肽接头的间隔子核酸序列可以插入在第一核酸序列与第二异源核酸序列之间。
在一个优选的实施例中,感兴趣异源蛋白是抗原或其片段。在此实施例中,异源氨基酸序列是来自抗原氨基酸序列或者异源核酸序列是来自抗原核酸序列。出于本发明的目的,抗原可以获自或源自任何适当的来源。优选地,抗原的来源是选自下组,该组由以下各项组成:流感病毒、hiv、巨细胞病毒、登革病毒、黄热病病毒、蜱传脑炎病毒、肝炎病毒、日本脑炎病毒、人乳头状病毒、柯萨奇病毒、单纯疱疹病毒、风疹病毒、腮腺炎病毒、麻疹病毒、狂犬病病毒、脊髓灰质炎病毒、轮状病毒、呼吸道合胞体病毒、埃博拉病毒、基孔肯雅病毒(chikungunyavirus)、结核分枝杆菌(mycobacteriumtuberculosis)、金黄色葡萄球菌(staphylococcusaureus)、表皮葡萄球菌(staphylococcusepidermidis)、大肠杆菌(e.coli)、艰难梭菌(clostridiumdifficile)、百日咳杆菌(bordetellapertussis)、破伤风梭菌(clostridiumtetani)、b型流感嗜血杆菌(haemophilusinfluenzaetypeb)、肺炎衣原体(chlamydiapneumoniae)、沙眼衣原体(chlamydiatrachomatis)、牙龈卟啉单胞菌(porphyromonasgingivalis)、铜绿假单胞菌(pseudomonasaeruginosa)、白喉杆菌(mycobacteriumdiphtheriae)、志贺氏菌、脑膜炎奈瑟菌(neisseriameningitidis)、肺炎链球菌(streptococcuspneumoniae)以及恶性疟原虫(plasmodiumfalciparum)。优选地,抗原具有小于150kda、小于125kda或小于100kda的分子量。最优选地,抗原具有小于100kda的分子量。
优选地,抗原的来源是选自下组,该组由以下各项组成:流感病毒、巨细胞病毒、登革病毒、黄热病病毒、肝炎病毒、日本脑炎病毒、人乳头状病毒、单纯疱疹病毒、狂犬病病毒、脊髓灰质炎病毒、轮状病毒、呼吸道合胞体病毒、埃博拉病毒、基孔肯雅病毒、结核分枝杆菌、金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌、艰难梭菌、百日咳杆菌、破伤风梭菌、b型流感嗜血杆菌、白喉杆菌、志贺氏菌、脑膜炎奈瑟菌以及肺炎链球菌。优选地,抗原的来源是选自流感病毒和志贺氏菌。
在一些实施例中,本发明的分子或重组蛋白可以包含多于一种与如在此所述的七鳃鳗vlr-b序列异源的抗原。当分子或重组蛋白包含若干抗原时,这些抗原独立地是感兴趣的完整蛋白质或感兴趣的蛋白质片段,并且可以来自相同的生物体或不同的生物体。抗原可以是来自相同生物体的不同蛋白质或其片段的或来自不同生物体的融合抗原。
优选地,用于本发明的分子或重组蛋白中的抗原是来自流感病毒。流感病毒可以是季节性或大流行性流感病毒。流感病毒可以是a株、b株或c株的任何亚型。具体地,甲型流感病毒是选自下组,该组由以下各项组成:h1n1、h2n2、h3n1、h3n2、h3n8、h5n1、h7n1、h7n7、h1n2、h9n2、h7n2、h7n3以及h10n7病毒。
优选地,流感抗原是选自血球凝集素(ha)或其片段、基质2蛋白质(m2)(霍尔辛格(holsinger)等人,病毒学(virology),183,32-43(1991))或其片段以及ham2融合蛋白。在ham2融合蛋白中,ha和m2独立地是完整蛋白质或蛋白质片段。在一个更优选的实施例中,抗原是流感血球凝集素或其片段。
此外,出于本发明的目的,抗原包括具有对天然序列的修饰,诸如缺失、添加和取代的蛋白质,只要该蛋白质保持足够的免疫原性即可。这些修饰可以是有意的,例如通过定点诱变,或可能是偶然的,诸如在宿主细胞的抗原表达期间发生的突变。抗原也可以是由共有序列编码的蛋白质或其片段。
优选地,抗原是跨膜锚定蛋白的胞外域。胞外域对应于天然蛋白,其中跨膜结构域和胞质尾部(如果有的话)已被缺失,以便允许其在产生抗原的宿主中分泌并且使其容易进行下游纯化。
优选地,抗原是流感病毒ha的胞外域。
在另一个优选的实施例中,感兴趣蛋白质(即,用于本发明的抗原或重组蛋白中的抗原)是选自巨细胞病毒(cmv)糖蛋白b(gb)(施菲克奇克(scheffczick)等人,欧洲生化学会联合会快报(febsletters)506,113-116(2001))或其片段、巨细胞病毒ul130蛋白质(帕特罗(patrone)等人,病毒学期刊(j.virol.)79(13),8361-8373(2005))或其片段、或gb-ul130融合蛋白以及hiv糖蛋白41(gp41)(潘切拉(pancera)等人,自然(nature),514(7523),455-461(2014))或其片段。在gb-ul130融合蛋白中,gb和ul130独立地是完整蛋白质或其片段。
在一个更优选的实施例中,抗原是cmvgb蛋白质或hivgp41蛋白质的胞外域。在gb-ul130融合蛋白中,gb是完整蛋白质或gb蛋白质的胞外域。在另一个优选的实施例中,抗原是选自下组,该组由以下各项组成:hivgp41蛋白质和巨细胞病毒ul130蛋白质。
在另一个优选的实施例中,抗原是细菌蛋白质,例如来自志贺氏菌属某种的蛋白质。优选地抗原是来自索氏志贺氏菌(shigellasonnei)或弗氏志贺氏菌。优选地,抗原是来自索氏志贺氏菌或弗氏志贺氏菌的ipad或mxih。在某些实施例中,抗原优选地不是cmvgb蛋白质或cmvgb蛋白质的胞外域。
在另一个优选的实施例中,感兴趣蛋白质是抗体或支架。在此实施例中,异源氨基酸序列是来自抗体或支架氨基酸序列,或者异源核酸序列是来自抗体或支架核酸序列。
在一个优选的实施例中,抗体或支架是对抗原有特异性的,即特异性地结合到抗原。出于本发明的目的,抗体或支架对其有特异性的抗原可以获自或源自任何适当的来源。优选地,抗原的来源是选自下组,该组由以下各项组成:流感病毒、hiv、巨细胞病毒、登革病毒、黄热病病毒、蜱传脑炎病毒、肝炎病毒、日本脑炎病毒、人乳头状病毒、柯萨奇病毒、单纯疱疹病毒、风疹病毒、腮腺炎病毒、麻疹病毒、狂犬病病毒、脊髓灰质炎病毒、轮状病毒、呼吸道合胞体病毒、埃博拉病毒、基孔肯雅病毒、结核分枝杆菌、金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌、艰难梭菌、百日咳杆菌、破伤风梭菌、b型流感嗜血杆菌、肺炎衣原体、沙眼衣原体、牙龈卟啉单胞菌、铜绿假单胞菌、白喉杆菌、志贺氏菌、脑膜炎奈瑟菌、肺炎链球菌以及恶性疟原虫。
优选地,抗原的来源是选自下组,该组由以下各项组成:流感病毒、巨细胞病毒、登革病毒、黄热病病毒、肝炎病毒、日本脑炎病毒、人乳头状病毒、单纯疱疹病毒、狂犬病病毒、脊髓灰质炎病毒、轮状病毒、呼吸道合胞体病毒、埃博拉病毒、基孔肯雅病毒、结核分枝杆菌、金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌、艰难梭菌、百日咳杆菌、破伤风梭菌、b型流感嗜血杆菌、白喉杆菌、志贺氏菌、脑膜炎奈瑟菌以及肺炎链球菌。
在一个优选的实施例中,抗体是罗兰·康特曼(rolandkontermann)在当前分子治疗学观点(currentopinioninmoleculartherapeutics),12(2),176-183(2010)中描述的替代格式之一。具体地,抗体是选自下组,该组由以下各项组成:单克隆抗体、单域抗体(dab)、单链可变片段(scfv)、fab、f(ab’)2以及双特异性抗体(db)。在此实施例中,异源氨基酸序列或异源核酸序列分别来自单克隆抗体、dab、scfv、fab、f(ab’)2或db氨基酸序列,或来自单克隆抗体、dab、scfv、fab、f(ab’)2或db核酸序列。
罗兰·康特曼还在当前分子治疗学观点,12(2),176-183(2010)中描述了双特异性抗体格式。在一些实施例中,本发明的分子,例如重组蛋白是双特异性抗体或双特异性支架,即对两种不同的抗原有特异性的抗体或支架,或者是多特异性抗体或多特异性支架,即对多于两种不同的抗原有特异性的抗体或支架。在这些实施例中,异源氨基酸序列包含至少两种不同抗体、单克隆抗体、dab、scfv、fab、f(ab’)2、db或支架氨基酸序列,或者异源核酸序列包含至少两种不同抗体、单克隆抗体、dab、scfv、fab、f(ab’)2、db或支架核酸序列。两个或更多个基因的接合可以任何顺序进行,即编码两个或更多个感兴趣蛋白质或其片段的序列位于编码根据本发明的七鳃鳗vlr-b抗体的片段的序列的3’或5’处,或者编码感兴趣蛋白质或其片段的序列之一位于编码根据本发明的七鳃鳗vlr-b抗体的片段的序列的5’处,并且编码感兴趣蛋白质或其片段的另一个序列位于3’处。优选地,编码两个或更多个感兴趣蛋白质或其片段的序列位于编码根据本发明的七鳃鳗vlr-b抗体的片段的序列的5’。
本发明的分子或重组蛋白可以通过技术人员熟知的任何方法合成。此类方法包括由组成型氨基酸或其衍生物以固相常规化学合成(r.b.梅里菲尔德(merrifield),美国化学会志(j.am.chem.soc.),85(14),2149-2154(1963))或以液相酶合成(k.莫里拉(morihara),生物技术趋势(trendsinbiotechnology),5(6),164-170(1987))、不含细胞的蛋白质合成(卡岑(katzen)等人,生物技术趋势,23(3),150-156(2005))以及通过重组技术进行的生物产生方法。
技术人员已知的任何方法可以用于在第一氨基酸序列与第二氨基酸序列之间的化学偶联。此类方法包括经由肽键的常规化学偶联(例如,由重组核酸表达作为融合蛋白的第一氨基酸序列和第二氨基酸序列),任选地使用肽接头,或经由任何共价连接例如肽键、酯键、酰胺键或双硫键的偶联。优选地,第一氨基酸序列和第二氨基酸序列一起作为融合蛋白表达。
本发明的分子或重组蛋白的化学合成可以是特别有利的,因为它允许高纯度、不存在不希望的副产物并且易于生产。
然后可以使用技术人员已知的任何方法,任选地纯化通过这些方法获得的本发明的分子或蛋白质。
优选地,本发明的重组蛋白是使用生物生产过程利用重组宿主细胞获得的。在这个过程中,包含编码本发明的蛋白质或融合蛋白的核酸的表达盒被传输到宿主细胞中,该宿主细胞是在使相应蛋白质或融合蛋白能够表达的条件下培养的。然后可以回收和纯化由此产生的蛋白质或融合蛋白。
本发明还涉及一种包含本发明的重组核酸的表达盒,其中该重组核酸可操作地连接到启动子。在本领域中已描述了多个表达盒,每个表达盒典型地包含在宿主细胞内将dna或dna片段转录成mrna并且将后者翻译成蛋白质的所有元件。典型地,宿主细胞中核酸表达所需的元件包括启动子,该启动子在所选宿主细胞内有功能的并且可以是组成型或诱导型的;核糖体结合位点;起始密码子(atg);编码信号肽的区域,该信号肽为重组蛋白分泌所需的;终止密码子;以及3′末端区域(翻译和/或转录终止子)。其他转录控制元件,诸如增强子、操纵子以及抑制子抑制子,也可以与多核苷酸可操作地缔合以引导细胞中的转录和/或翻译。信号肽编码区域优选地邻近编码本发明的重组蛋白的核酸并且位于适合的阅读框中。信号肽-编码区域可以是与编码本发明的感兴趣蛋白质或融合蛋白的dna分子同源或异源的,并且可以是对用于表达的宿主的分泌装置有特异性的。
由本发明的重组核酸单独或与信号肽一起组成的开放阅读框是在启动子的控制下,这样使得转录和翻译在宿主细胞中发生。宿主细胞中核酸表达所需的启动子和其他元件是广泛已知的,并且对本领域的技术人员而言是可用的。
最后,本发明的核酸序列可以进行密码子优化,这样使得编码本发明的蛋白质和/或融合蛋白的dna的转录得以增强和/或编码蛋白质和/或融合蛋白的mrna的翻译得以延长。
“密码子优化的dna或mrna序列”意指一种核酸序列,该核酸序列已通过以下各项来适于在宿主细胞中更好地表达:在密码子-优化的dna序列的情况中,如us2004/0209241中所述的,将一个或多个密码子替换成在所述宿主细胞的基因中更频繁地使用的一种或多种密码子,或者在密码子优化的mrna序列的情况中,如us2011/0269950中所述的,最大化根据所使用的宿主细胞的mrna序列的g/c含量。适当地管理核酸序列的密码子优化,这样使得它不会改变在宿主细胞中表达的蛋白质和/或融合蛋白的氨基酸序列。
在另一个实施例中,宿主细胞使用本发明的表达盒转化。宿主细胞可以是表达盒可以被插入的任何细胞,即,任何真核细胞或原核细胞。根据本发明,优选的宿主细胞是真核细胞或原核细胞,包括但不限于动物细胞(例如,哺乳动物、鸟、昆虫以及鱼宿主细胞)、植物细胞(包括真核藻类细胞)、真菌细胞、酵母细胞、细菌细胞以及原生生物细胞。适用于本发明的优选的原核生物宿主细胞包括大肠杆菌(escherichiacoli)、芽孢杆菌属(bacillusgenus)细菌、乳酸乳球菌(lactococcuslactis)、荧光假单胞菌(pseudomonasfluorescens)、茎菌属(caulobactergenus)细菌、谷氨酸棒状杆菌(corynebacteriumglutamicum)以及富养罗尔斯通氏菌(ralstoniaeutropha)。用于本发明的特别优选的原核生物宿主细胞是大肠杆菌。适用于本发明的优选的真核生物宿主细胞包括蜥蜴利什曼原虫(leishmaniatarentolae)、嗜热四膜虫(tetrahymenathermophila)、willaertiamagna、vero细胞、cho细胞、293细胞、293t细胞、sf9细胞、s2细胞、eb66鸭细胞、巴斯德毕赤酵母(pichiapastoris)、酿酒酵母(s.cerevisiae)、多形汉逊酵母(hansenulapolymorpha)、本氏烟(nicotianabenthamiana)细胞、小立碗藓(physcomitrellapatens)细胞、亚洲栽培稻(oryzasativa)细胞、非洲栽培稻(oryzaglaberrima)细胞、蒺藜状苜蓿(medicagotruncatula)细胞、玉米(zeamays)细胞、裂殖壶菌属物种(schizochytriumsp.)、三角褐指藻(phaeodactylumtricornutum)以及嗜热毁丝霉(myceliophthorathermophila)。用于本发明的特别优选的真核生物宿主细胞是蜥蜴利什曼原虫或cho。
因为真核生物细胞中的糖基化不同于原核生物细胞中的糖基化并且比其更复杂,所以在真核生物细胞中自然地表达的感兴趣蛋白质优选地在真核生物宿主细胞中表达为具有根据本发明的七鳃鳗vlr-b抗体的片段的融合蛋白。类似地,在原核生物细胞中自然地表达的感兴趣蛋白质优选地在原核生物宿主细胞中表达为具有根据本发明的七鳃鳗vlr-b抗体的片段的融合蛋白。
存在用于将表达盒插入到宿主细胞中的多种手段和方案,包括但不限于转化、转染、细胞融合或原生质体融合、化学处理的使用(例如,原生质体的聚乙二醇处理、钙处理、转染剂诸如可得自英杰(invitrogen)(卡尔斯巴德,加利福尼亚州(carlsbad,calif.))的lipofectintm和lipofectaminetm转染试剂、不同类型的脂质体的使用、机械装置的使用(例如,核酸涂覆微珠)、电荷的使用(例如,电穿孔)及其组合。确定用于将在此所述的特定载体分子插入到所希望的宿主细胞中的特定方案和/或手段是在本领域技术人员的技能范围内。
重组宿主细胞可以在根据细胞要求确定的各种指定条件下生长。例如,宿主细胞可以具有某些营养要求或对物理(例如温度)和/或化学(例如抗生素)条件的特定抗性或敏感性。此外,可能需要特定的培养条件来调节所希望的基因的表达(例如使用诱导型启动子)。这些不同的条件和满足这些条件的要求被本领域技术人员所理解和体会。
用于纯化蛋白质的方法是技术人员熟知的。所获得的重组蛋白或融合蛋白可以通过单独或组合使用的方法从溶解物和细胞提取物、从培养基上清液纯化,这些方法诸如使用特异性单克隆抗体或多克隆抗体的分馏、色谱法、免疫亲和法等。优选地,所获得的重组蛋白或融合蛋白是从培养基上清液纯化的。
另一个实施例涉及本发明的能够形成稳定多聚体的分子或重组蛋白。在一个优选的实施例中,本发明的稳定多聚体是稳定的同源-多聚体重组蛋白,该同源-多聚体重组蛋白包含选自下组的蛋白质,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到含有与seqidno:1具有至少80%一致性的氨基酸序列的蛋白质。具体地,稳定的同源-多聚体重组蛋白包含选自下组的蛋白质,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到含有与seqidno:1具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性的氨基酸序列的蛋白质。优选地,该蛋白质是流感ha蛋白质。
根据另一个优选的实施例,本发明的稳定多聚体是稳定的同源-多聚体重组蛋白,该同源-多聚体重组蛋白包含选自下组的蛋白质,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到含有与seqidno:2具有至少80%一致性的氨基酸序列的蛋白质。具体地,稳定的同源-多聚体重组蛋白包含选自下组的蛋白质,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到含有与seqidno:2具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性的氨基酸序列的蛋白质。优选地,该蛋白质是流感ha蛋白质。
在本发明的这些实施例的一个优选方面(即,稳定的多聚体)中,对应于seqidno:1的位置2、7、13、19、21、24以及27的7个半胱氨酸(或对应于seqidno:2的位置2、15、20、26、32、34、37以及40的8个半胱氨酸)在蛋白质的氨基酸序列中是保守的,该蛋白质来源于七鳃鳗vlr-b的c-末端并且融合到选自下组的蛋白质,该组由以下各项组成:流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域。在一些实施例中,接头可以插入在选自下组的蛋白质的氨基酸序列与融合的氨基酸序列之间,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成。
优选地,本发明的稳定的多聚体不包含来自七鳃鳗vlr-b抗体的富含亮氨酸重复序列(lrr)模块。具体地,在此所述的稳定的多聚体不包含具有seqidno:29的序列的氨基酸序列。优选地,本发明的稳定的多聚体不包含来自七鳃鳗vlr-b抗体的lrrnt模块、lrr1模块、lrrv模块、lrrct模块、cp和茎部区域中的一个或多个。优选地,存在于本发明的稳定多聚体内的仅七鳃鳗来源的氨基酸序列源自于七鳃鳗vlr-b抗体的最后c-末端(即,蛋白质c-末端至茎部区域的区段,参见wo2008/016854的图11c)。优选地,存在于本发明的稳定多聚体内的仅七鳃鳗来源的氨基酸序列是与seqidno:1或seqidno:2具有至少80%一致性的序列,例如与seqidno:1或seqidno:2具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性。
本发明还提供一种稳定的同源多聚体重组蛋白,该同源多聚体重组蛋白通过表达系统由包含编码选自下组的蛋白质的核酸序列的核酸分子产生,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到与seqidno:3具有至少80%一致性的核酸序列。具体地,稳定的同源-多聚体重组蛋白通过表达系统由包含编码选自下组的蛋白质的核酸序列的核酸分子产生,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到与seqidno:3具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性的核酸序列。优选地,核酸序列编码流感ha蛋白质。
在一些实施例中,稳定的同源-多聚体重组蛋白通过表达系统由包含编码选自下组的蛋白质的核酸序列的核酸分子产生,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到与seqidno:4具有至少80%一致性的核酸序列。具体地,稳定的同源-多聚体重组蛋白通过表达系统由包含编码选自下组的蛋白质的核酸序列的核酸分子产生,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成,该蛋白质融合到与seqidno:4具有至少85%一致性、至少90%一致性、至少95%一致性、至少97%一致性、至少98%一致性、至少99%一致性或甚至100%一致性的核酸序列。优选地,核酸序列编码流感ha蛋白质。
在本发明的这些实施例的一个优选方面中,编码源自于七鳃鳗vlr-b抗体的c-末端的氨基酸序列(并且融合到编码选自下组的蛋白质的核酸序列,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成)的核酸序列编码氨基酸序列,该氨基酸序列包含对应于seqidno:1的位置2、7、13、19、21、24以及27的所述氨基酸序列内的位置的半胱氨酸残基(或者包含对应于seqidno:2的位置2、15、20、26、32、34、37以及40的所述氨基酸序列内的位置的半胱氨酸残基)。在一些实施例中,编码肽接头的间隔子核酸序列可以插入在编码选自下组的蛋白质的核酸序列与融合的核酸序列之间,该组由流感ha蛋白质、志贺氏菌ipad蛋白质和志贺氏菌mxih蛋白质的胞外域组成。
本发明还提供了一种药物组合物,该药物组合物包含本发明的分子或重组蛋白和药学上可接受的载体或稀释剂。在一个优选的实施例中,免疫原性组合物包含本发明的分子或重组蛋白。本发明的分子或重组蛋白还可以用作药物。在一个优选的实施例中,本发明的分子或重组蛋白是用于诱导对于受试者中的抗原的免疫应答。在另一个优选的实施例中,根据本发明的包含流感抗原的分子或重组蛋白是用于诱导针对流感病毒的免疫应答。在一个更优选的实施例中,根据本发明的重组流感ha蛋白质是用于诱导针对流感病毒的免疫应答。在另一个优选的实施例中,本发明的免疫原性组合物是疫苗组合物。
本发明的药物组合物和免疫原性组合物可以被配制成常规药物或疫苗制剂。这可以使用本领域技术人员可获得的标准药物或疫苗配制化学和方法来进行。可以使用常用于药物和疫苗配制中的任何溶剂、分散介质、电荷、佐剂等,以增强特别在人类中不产生任何二次反应(例如过敏反应)的活性剂的稳定性、无菌性、效力或递送性。赋形剂是基于所选择的药物或疫苗形式、给予方法和途径来选择的。适当的赋形剂和与药物配制相关的要求在雷明登氏药学全书(第19版,热纳罗编,麦克出版公司,伊斯顿,宾夕法尼亚州(1995))(“remington′spharmaceuticalsciences”(19thedition,a.r.gennaro,ed.,mackpublishingco.,easton,pa(1995))中有所描述,该文献代表本领域的参考作品。药学上可接受的赋形剂的实例是水、磷酸盐缓冲盐水溶液和0.3%甘氨酸溶液。
药物组合物和免疫原性组合物可以通过常规灭菌技术进行灭菌,或者可以无菌过滤。所得水溶液可以包装并且以液体形式储存或冻干,在给予之前,使用无菌水性载体重构冻干的制剂。在一个优选的实施例中,药物组合物和免疫原性组合物经由如wo2009109550中所述的造粒工艺包装并且储存为微球。制剂的ph典型地将是在3与11之间,例如,在5与9之间、6与8之间或7与8之间,诸如7至7.5。
一旦配制或重构,可以使用多种已知的途径和技术将药物组合物和免疫原性组合物体内递送到受试者。例如,液体制剂可以作为可注射溶液、悬浮液或乳液提供,并且使用常规针头和注射器或使用液体喷射注射系统,经由肠胃外、皮下、皮内、肌内、静脉内注射进行给予。液体制剂也可以局部给予到皮肤或粘膜组织,或作为适于呼吸或肺部给予的细分喷雾提供。其他给予方式包括口服给予、栓剂和主动或被动经皮递送技术。
对于口服给予,药物组合物和免疫原性组合物可以被配制成例如胶囊、片剂、混悬液或液体。
药物组合物和免疫原性组合物还可以制备成固体形式(包括颗粒、微球、粉剂或栓剂)。
另一个实施例涉及用于治疗患者的方法,所述方法包括向所述患者给予本发明的药物组合物。一个优选的实施例考虑到一种用于诱导针对患者中的抗原的免疫应答的方法,所述方法包括向所述患者给予本发明的免疫原性组合物或疫苗组合物。
另一个实施例涉及一种用于使重组蛋白多聚化的方法,该方法包括:
a)将与seqidno:3具有至少80%一致性的核酸序列融合到编码所述重组蛋白的核酸序列,其条件是所述重组蛋白不是七鳃鳗vlr-b抗体蛋白质,
b)在引起所述重组蛋白多聚化的条件下,表达由所述核酸序列编码的融合蛋白。
这些条件是本领域技术人员已知的,并且基本上由避免极端条件组成,例如高溶质浓度、ph极端条件、机械力以及化学变性剂的存在。
另一个实施例涉及一种用于使重组蛋白多聚化的方法,该方法包括:
a)将与seqidno:4具有至少80%一致性的核酸序列融合到编码所述重组蛋白的核酸序列,其条件是所述重组蛋白不是七鳃鳗vlr-b抗体蛋白质,
b)在引起所述重组蛋白多聚化的条件下,表达由所述核酸序列编码的融合蛋白。
在一个优选的实施例中,该方法是用于使抗原、抗体或支架多聚化。在一个最优选的实施例中,该方法是用于使重组流感ha或ha胞外域蛋白质多聚化。
实例1:重组流感ha胞外域蛋白质的聚合
通过融合到ha蛋白质的c-末端来评估源自于七鳃鳗的vlr-b抗体的c-末端的两个序列。第一测试序列是seqidno:1,并且第二测试序列是seqidno:2。seqidno:1是seqidno:2的缩短版本。seqidno:1对应于七鳃鳗的vlr-b抗体的最后c-末端处的30个氨基酸,并且seqidno:2对应于七鳃鳗的vlr-b抗体的最后c-末端处的43个氨基酸(参见wo2008/016,854的图11c)。关于最后c-末端,意指vlr-bc-末端至茎部区域的部分。
所测试的第三序列是t4噬菌体的折叠序列(seqidno:5)。
编码来自流感株a/加利福尼亚/07/09(h1n1)的ha胞外域的核酸序列(包含它自身的信号序列,但不包含ha的跨膜和胞质尾区的序列)是由吉纳特(geneart)(雷根斯堡,德国(regensburg,germany))针对蜥蜴利什曼原虫中的密码子使用进行优化的。此序列在此被称为seqidno:10。
通过吉纳特(雷根斯堡,德国),将编码三个所测试的多聚化序列(即,源自于vlr-b抗体的c-末端的两个序列和t4噬菌体折叠序列)的核酸序列单独融合到核酸序列seqidno:10(编码来自流感株a/加利福尼亚/07/2009的ha蛋白质的胞外域)。因此,seqidno:7是融合到核酸序列seqidno:10的核酸序列seqidno:3(它是编码氨基酸序列seqidno:1(即根据本发明的七鳃鳗vlr-b抗体的缩短片段)的核酸序列)。seqidno:8是融合到核酸序列seqidno:10的核酸序列seqidno:4(它是编码氨基酸序列seqidno:2(即根据本发明的七鳃鳗vlr-b抗体的“长”(未缩短)片段)的核酸序列),并且seqidno:9是融合到核酸序列seqidno:10的核酸序列seqidno:6(它是编码氨基酸序列seqidno:5(即,t4噬菌体的折叠序列)的核酸序列)。
将seqidno:7、seqidno:8和seqidno:9各自单独地插入到plexsy-l-bleo2表达盒的sall/notl限制性酶切位点,如图1所示。将seqidno:10插入到plexsy-i-bleo2表达盒的ncol/notl限制性酶切位点。此表达盒允许感兴趣基因整合到蜥蜴利什曼原虫t7-tr受体株的染色体鸟氨酸脱羧酶(odc)位点(库圣尼尔(kushnir)等人,蛋白质表达和纯化(proteinexpr.purif.),42(1),37-46(2005)),该基因在宿主rna聚合酶i的控制下组成地表达细菌噬菌体t7rna聚合酶和tet抑制子。经由通过四环素添加可诱导的t7启动子对感兴趣蛋白质的表达进行诱导(使用者指南ege-1400(user’sguideege-1400),耶拿生物科学,耶拿,德国(jenabioscience,jena,germany))。
然后通过swai消化包含具有或不具有聚合序列之一的ha序列的表达盒,并且在单独的实验中,使用nucleofectorii装置(阿玛克萨生物系统,科隆,德国(amaxabiosystems,cologne,germany))并且根据basicparasitenucleofectortm试剂盒1(龙沙,贝尔,瑞士(lonza,bale,switzerland))的说明书,经由核穿孔(nucleoporation),将1μg的各自纯化的线性swai片段转染到蜥蜴利什曼原虫t7-tr宿主株中。将转染的细胞转移到10ml的bhi(脑心浸液)培养物(耶拿生物科学)并且在黑暗中在26℃下温育过夜,该培养基包含5μg/ml的血晶素、50单位/ml青霉素、50μg/ml链霉素(pen/strep,以避免细菌污染)、100μg/ml诺尔丝菌素(ntc)以及100μg/ml潮霉素(ntc/hygro:用于分别将t7聚合酶和tet抑制子基因保持在t7-tr宿主中)。转染后二十四小时,将2ml悬浮液等分试样在2000g下离心5min,将球粒重新悬浮在50-100μl的bhi培养物中,并且将细胞轻轻地铺板在包含抗生素和100μg/ml的博莱霉素的新鲜bhi-琼脂平板上(选择性生长培养基)以用于选择重组寄生虫。在铺板大约7-9天后,小集落是可见的并且转移至0.2ml的选择性生长培养基中。将寄生虫的每个重组克隆在26℃的摇瓶中扩展到10ml的选择性培养基中。
通过遵循耶拿生物科学建议的诊断性pcr,确认包含ha序列的表达盒整合到基因组中。
将确认的重组寄生虫在26℃下在如上所述地补充有血晶素和抗生素的100mlbhi培养基中培养,并在黑暗中以100rpm搅拌。为了诱导rha蛋白的产生,在接种寄生虫时,通过将10μg/ml的四环素添加到补充培养基中来诱导t7驱动的转录。
对于发酵,使用1升biostatqplus12发酵罐(赛多利斯公司,欧巴涅,法国(sartoriusag,aubagne,france))。简言之,用1/10指数生长的重组寄生虫起子培养物(0.4od600)接种700ml补充的bhi培养基,并在黑暗中在26℃、100rpm、40%po2、ph7.4±0.1下培养。使用mfcs/win软件(赛多利斯公司)记录培养参数。使用10μg/ml四环素的诱导与重组寄生虫的接种(如对摇瓶培养物进行的)同时进行。在诱导后43h开始使用hcl1n/naoh1n调节ph,并以1.5ml/h输注100g/l的葡萄糖溶液,同时添加p1860抗蛋白酶混合物(1/800,西格玛,圣昆廷法拉维耶,法国(sigma,saintquentinfallavier,france))。
每天采集培养物样品,以便通过显微镜检查法测定培养物的光密度(od600)(一个od600相当于约1.5×107个寄生虫/ml)、各种代谢物(gln、glu、gluc、lac、nh4+)的浓度和细胞迁移率。
在48h后,收集转化的蜥蜴利什曼原虫培养物的上清液,并在0.2μm过滤器上过滤。通过595nm处的光密度测量来量化样品中的蛋白质,并将样品归一化。
加载20μl的每个样品并在sds-page凝胶上(
为了测试使用不同表达质粒获得的不同重组ha蛋白质的热稳定性,将三个测试样品和阴性对照样品分成两份,其中在sds-page凝胶上迁移之前,使用加热块将一半样品加热到99℃,持续15分钟,并且在sds-page凝胶上迁移之前不加热另一半。凝胶上的另一个对照样品包含使用表达另一种蛋白质(即针对流感的抗体)的质粒转化的蜥蜴利什曼原虫的加热的培养物上清液(在99℃的温度下15分钟)。
使用硝酸纤维素膜(伯乐实验室,赫拉克勒斯,美国(bioradlaboratories,hercules,usa))进行sds-page凝胶的蛋白质印迹,然后使用pbs、吐温200,1%和乳5%(difco-bd,斯巴克,美国(sparks,usa))处理,以便阻断非特异性固定位点。
使用针对流感a/加利福尼亚/07/09ha的兔多克隆抗体探测印迹,其中滴度为8000(血凝集抑制)并且滴度为32000(血清中和),随后使用抗兔irddye800cw抗体(li-cor生物科学,林肯,美国(li-corbiosciences,lincoln,usa)和opti-4cntm(伯乐实验室)底物进行探测。使用odyssey(li-cor生物科学)成像系统分析蛋白质印迹。
蛋白质印迹的结果在图2中示出。结果非常显著。首先,虽然融合到t4折叠序列(seqidno:5,泳道11-12)的ha蛋白质仅是三聚体形式,但融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:1(泳道7-8)的ha蛋白质或融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:2(泳道9-10)的ha蛋白质不仅作为三聚体产生,而且还作为四聚体、五聚体和其他更高聚合形式产生。此外,融合到vlr-b抗体c-末端序列的ha蛋白质大部分分泌到培养物的上清液中,因为在细胞内检测到非常少或没有检测到ha并且没有观察到裂解(结果未示出)。与保留在宿主细胞内的重组蛋白的纯化相比,将重组蛋白分泌到培养物上清液中对于下游纯化而言是高度有利的。此外,可以看出,由融合到测试的七鳃鳗vlr-b抗体c末端结构域中的任一个的ha蛋白质获得的聚合物在热处理后是稳定的(泳道7和9),而融合到t4折叠序列的ha蛋白质在热处理后失去其三聚体形式(泳道11)。由融合到所测试的七鳃鳗vlr-b抗体c-末端结构域之一的ha蛋白质获得的聚合物的热稳定性是非常有意义的,因为增加的稳定性应当增加包含这种抗原的免疫原性组合物的保质期。此外,当将热稳定的重组蛋白抗原注射到患者时,也可以预期该热稳定的重组蛋白抗原具有更长的体内稳定性。
实例2:通过融合到七鳃鳗vlr-b抗体c-末端结构域来聚合的重组流感ha蛋白质的免疫原性研究
如实例1中所述地产生通过融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:2(rha聚)来聚合的重组ha胞外域蛋白质。
在蜥蜴利什曼原虫培养基中用四环素诱导72h后,进行摇瓶收获,并在5,000g下离心30min。在赛多利斯sartoconslice200盒上浓缩和渗滤后,将上清液置于1ml的cona琼脂糖凝胶(sepharose)4b柱上。使用0.5mα-d-甲基甘露糖苷的pbs-mm缓冲液洗脱重组ha。用pbs/吐温透析洗脱物,在ultracell10k上浓缩并且使用0.22μm过滤器过滤。通过微布拉德福德(microbradford)技术滴定重组ha。将每个样品重新悬浮在pbs+吐温0.005%中。
将两组共10只8周龄的雌性balb/cbyj小鼠经由肌内(im)途径接受两次免疫,一次在第0天,并且一次在第28天,该免疫是10μg的通过融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:2(rha聚)来聚合的流感a/加利福尼亚/07/2009rha胞外域蛋白质(如实例1中所述地产生)或10μg的使用仅表达rha胞外域的质粒转化的蜥蜴利什曼原虫中产生的流感a/加利福尼亚/07/2009rha胞外域单体蛋白质(rha单)(即不融合到聚合序列(seqidno:11))。将10μgrha蛋白质重新悬浮在缓冲液(pbs+吐温0.005%)中并且注射体积是2×50μl(总计100μl)。
最终,5只8周龄的雌性balb/cbyj小鼠接受100μl的缓冲液(2×50μl)。
加强注射后三周,在第49天在麻醉下从所有动物采集血液样品。麻醉经由腹膜内途径以200μl体积给予
使用鸡红细胞(crbc)评估针对流感a/加利福尼亚/07/09(h1n1)株的血凝集抑制性抗体的存在。对个别受体破坏酶(rde)处理的血清样品进行测定,并且滴度表示为显示没有血凝集的最高稀释的倒数,如肯德尔(kendal)等人,用于基于实验室的流感监测的概念和程序中的血凝集抑制,(haemagglutinationinhibition,inconceptsandproceduresforlaboratory-basedinfluenzasurveillance),美国卫生与人类服务部和泛美卫生组织(usdepartmentofhealthandhumanservicesandpan-americanhealthorganization),亚特兰大,佐治亚州(atlanta,ga)),1982,第b17-b35.9页中所述。
血凝集抑制测定的结果在图3中示出。通过使用聚合体rha胞外域免疫小鼠获得的血凝集抑制(hai)滴度显著高于使用单体rha胞外域免疫小鼠获得的血凝集抑制滴度。表i示出通过将流感a/加利福尼亚/07/2009rha胞外域蛋白质融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:2来获得的聚合体rha胞外域比流感a/加利福尼亚/07/2009单体rha胞外域的免疫原性高4倍。
表i:hai滴度
实例3:cho细胞中表达的重组流感ha胞外域蛋白质的聚合
还在另一种宿主细胞中测试经由与七鳃鳗序列融合进行的重组流感ha胞外域蛋白质的聚合。
编码来自流感株a/加利福尼亚/04/09(h1n1)(基因库登录号fj966082)的ha胞外域的核酸序列包含它自身的信号序列,但不包含ha的跨膜和胞质尾区域,该核酸序列是由吉纳特(雷根斯堡,德国)针对cho中的密码子使用进行优化的。这种序列在此被称为seqidno:12。
将针对cho中的密码子使用优化的编码三个测试的多聚化序列(即,源自于vlr-b抗体的c末端的两个序列和t4噬菌体折叠序列)的核酸序列单独地融合到核酸序列seqidno:12。因此,seqidno:13是融合到核酸序列seqidno:12的核酸序列seqidno:3。seqidno:14是融合到核酸序列seqidno:12的核酸序列seqidno:4,并且seqidno:15是融合到核酸序列seqidno:12的核酸序列seqidno:6。seqidno:26是seqidno:13编码的蛋白质序列。seqidno:27是seqidno:14编码的蛋白质序列。seqidno:28是seqidno:15编码的蛋白质序列。
将seqidno:12、seqidno:13、seqidno:14以及seqidno:15各自单独地插入到图4所示的pee14.4表达盒的hindiii/ecori限制性酶切位点。使用这种表达盒不需要诱导,因为重组蛋白是组成性地表达的。
将包含具有或不具有聚合序列之一的ha序列的表达盒转染到cho宿主细胞(chok169atcc编号cb-ccl-61punk)中。经由核穿孔使用nucleofectorii装置(阿玛克萨生物系统,科隆,德国),将10μg的每种质粒单独地引入到10×106个cho细胞中。然后将cho细胞铺板在37℃的2ml含有4mml-谷氨酰胺的
核穿孔后72h,通过以10,000rpm离心10秒来收集转化的cho培养物的上清液。
加载与5μl
在tris-乙酸盐缓冲液中在150v下进行样品分离,持续40分钟(生命科技)。
使用硝酸纤维素膜(伯乐实验室,赫拉克勒斯,美国)进行sds-page凝胶的蛋白质印迹,然后使用pbs和乳5%(difco-bd,斯巴克,美国)过夜处理,以阻断非特异性固定位点。
使用针对在pbs中以1/1000稀释的流感a/加利福尼亚ha的兔多克隆抗体探测该印迹,在室温下持续1h。然后将印迹用pbs和吐温200.05%洗涤三次,之后使用在pbs中以1/5000稀释的抗兔irddye800绵羊抗体(洛克兰,利默里克,美国(rockland,limerick,usa))温育。使用odyssey(li-cor生物科学)成像系统分析蛋白质印迹。
蛋白质印迹的结果在图5中示出。结果再次是显著的。首先,虽然融合到t4折叠序列的ha蛋白质仅是二聚体或三聚体形式,但融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:1(短七鳃鳗序列)的ha蛋白质或融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:2(长七鳃鳗序列)的ha蛋白质不仅作为二聚体或三聚体产生,而且还作为四聚体、五聚体和其他更高聚合形式产生。此外,ha蛋白质分泌到培养物的上清液中,因为印迹是对培养物的上清液进行的。与保留在宿主细胞内的重组蛋白的纯化相比,将重组蛋白分泌到培养物上清液中对于下游纯化而言是高度有利的。
实例4:大肠杆菌中表达的重组弗氏志贺氏菌ipad蛋白质的聚合
编码来自弗氏志贺氏菌血清型2a株301的ipad蛋白质的核酸序列(q.金(jin)等人,核酸研究(nucleicacidsresearch),30(20),4432-4441(2002),基因库登录号af386526)是由吉纳特(雷根斯堡,德国)针对大肠杆菌中的密码子使用进行优化的。这种序列在此被称为seqidno:16。
将seqidno:16融合到核酸序列seqidno:4以生成seqidno:17,该核酸序列seqidno:4也是由吉纳特(雷根斯堡,德国)针对大肠杆菌进行密码子优化的。相应的蛋白质序列是seqidno:18。seqidno:16和seqidno:17经由ggsle接头也融合到编码聚组氨酸-标签(6×his)的序列,从而生成seqidno:19(ipad-his,ggsle接头是在ipad序列与his-标签之间)和seqidno:20(ipad-七鳃鳗-his,ggsle接头是在ipad-七鳃鳗序列与his-标签之间)。
将seqidno:16、seqidno:17、seqidno:19以及seqidno:20各自单独地插入到如图6所示的pm1800表达盒的ncol/xhoi限制性酶切位点。感兴趣蛋白质的表达的诱导经由添加iptg来进行。
将5μg的包含具有或不具有聚合序列并且具有或不具有接头和his-标签序列的ipad序列的质粒重悬在10μl的水中。将0.5μl的对应于具有或不具有聚合序列并且不具有接头和his-标签序列的ipad序列的悬浮液添加到大肠杆菌bl21de3c6000-03(生命科技)或大肠杆菌shuffle(b)refc3029h(新英格兰生物实验室(newenglandbiolabs),即工程化来促进蛋白质内双硫键的形成的大肠杆菌)的培养物中。将0.5μl的对应于具有或不具有聚合序列但具有接头和his-标签序列的ipad序列的悬浮液添加到大肠杆菌shuffle(b)中。在混合后,将样品放置在冰上15分钟。然后将样品在42℃下热震30秒。然后将样品置于冰上2分钟,之后用500μl的室温s.o.c培养基(赛默飞世尔(thermofisher))稀释。然后将样品在37℃下温育60分钟,之后剧烈摇动(250rpm)。
稀释100μl的每个样品并且铺展到包含卡那霉素(25μg/ml)板的lb培养基上,并在37℃温育过夜。使用无菌接种环挑取来自每个转化板的菌落,并且将其添加到2mllb肉汤/卡那霉素25μg/ml中。然后将培养物在25ml的lb+卡那霉素(25μg/ml)培养基中稀释以获得od600=0.05的接种光密度。
在37℃下在搅拌(200rpm)下生长2小时后,当培养物达到0.4-0.8的od600时,通过iptg1mm(即添加25μl的iptg1m)诱导重组蛋白的产生。
将细菌在37℃下在搅拌下保持约4h。从每个erlen烧瓶中取出一个od600单位并离心。在去除上清液后,将球粒储存在-20℃下。
将球粒重新悬浮在75μl的trisedta(10mmtris,1mmedta,ph8.0,novagen)+1μl的以1/50稀释的迅速溶解(readylyse)35ku/μl(epicentre)+1μl的全能核酸酶(benzonase)25u/μl(novagen)。然后将样品在37℃下搅拌20分钟,之后添加25μl的
将不含ipad序列且插入在由iptg诱导的大肠杆菌中的pm1800充当阴性对照。在tris-乙酸盐缓冲液中在150v下进行样品分离,持续1小时(生命科技)。
使用硝酸纤维素膜(伯乐实验室,赫拉克勒斯,美国)进行sds-page凝胶的蛋白质印迹,然后使用pbs和乳5%(difco-bd,斯巴克,美国)处理1h。
使用针对ipad的小鼠单克隆抗体探测印迹,随后使用在pbs中以1/5000稀释的alexafluor山羊抗小鼠抗体(英杰)或抗小鼠irdye800抗体(洛克兰)进行探测。使用odyssey(li-cor生物科学)成像系统分析蛋白质印迹。
蛋白质印迹的结果在图7和图8中示出。它们与上述实例1和实例3中使用rha观察到的结果相似。实际上,图7显示,虽然没有七鳃鳗序列的ipad蛋白质被表达为二聚体(ipad单体具有预期36.6kda的分子量),但是融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:2的ipad蛋白质不仅作为二聚体产生,而且还作为三聚体、四聚体、五聚体以及其他较高聚合形式(融合物ipad-七鳃鳗单体具有预期41.2kda的分子量)。在shuffle大肠杆菌株中以最高量产生聚合的ipad蛋白质。
图8的结果显示,适用于对重组蛋白进行下游纯化的his-标签的添加对于七鳃鳗vlr-b抗体c-末端结构域seqidno:2与ipad蛋白质的聚合没有不利影响。
为了测试所获得的不同重组ipad蛋白质的热稳定性,如上所述地进行另外的sds-page和蛋白质印迹,除了在sds-page凝胶上迁移之前使用加热块将测试样品和阴性对照样品加热至95℃持续10分钟之外。
此蛋白质印迹的结果在图9中示出。可以看出,从融合到七鳃鳗vlr-b抗体c末端结构域seqidno:2的ipad蛋白质获得的聚合物在热处理后是稳定的。从融合到七鳃鳗vlr-b抗体c末端结构域seqidno:2的ipad蛋白质获得的聚合物的热稳定性是非常有意义的,因为增加的稳定性应当增加包含这种抗原的免疫原性组合物的保质期。此外,当将热稳定的重组蛋白抗原注射到患者时,也可以预期该热稳定的重组蛋白抗原具有更长的体内稳定性。
实例5:大肠杆菌中表达的重组弗氏志贺氏菌mxih蛋白质的聚合
编码来自弗氏志贺氏菌血清型2a株301的mxih蛋白质的核酸序列是由吉纳特针对大肠杆菌中密码子使用进行优化的。这种序列在此被称为seqidno:21。
将seqidno:21融合到核酸序列seqidno:4以生成seqidno:22,该核酸序列seqidno:4也是由吉纳特针对大肠杆菌进行密码子优化的。相应的蛋白质序列是seqidno:23。seqidno:21和seqidno:22经由ggsle接头也融合到编码聚组氨酸-标签(6×his)的序列,从而生成seqidno:24(mxih-his,ggsle接头是在mxih序列与his-标签之间)和seqidno:25(mxih-七鳃鳗-his,ggsle接头是在mxih-七鳃鳗序列与his-标签之间)。
将seqidno:21、seqidno:22、seqidno:24以及seqidno:25各自单独地插入到pm1800表达盒的ncol/xhoi限制性酶切位点。感兴趣蛋白质的表达的诱导经由添加iptg来进行
将5μg的包含具有或不具有聚合序列并且具有或不具有接头和his-标签序列的mxih序列的质粒重新悬浮在10μl的水中。将0.5μl的每个悬浮液添加到大肠杆菌bl21de3c6000-03或大肠杆菌shuffle(b)refc3029h中,并且热震细菌,如实例4中所述的。
然后将样品在lb培养基上培养,使用iptg诱导,离心,并且将细胞球粒储存在-20℃下,如实例4所述的。
将球粒重新悬浮在63μl的trisedta(10mmtris,1mmedta,ph8.0,novagen)+1μl的以1/20稀释的迅速溶解(readylyse)20ku/μl(epicentre)+1μl的全能核酸酶25u/μl(novagen)。然后将样品在37℃下搅拌10分钟,之后以13,000rpm离心10分钟。
将60μl的上清液与20μl的
加载15μl的每个样品并在sds-page凝胶上(
将不含mxih序列并插入在由iptg诱导的大肠杆菌中的pm1800充当阴性对照。在mes缓冲液中在200v下进行样品分离,持续30分钟(生命科技)。
如实例4中所述的,进行sds-page凝胶的蛋白质印迹。
使用针对mxih并在pbs中以1/1000稀释的小鼠多克隆抗体探测印迹,然后使用在pbs中以1/5000稀释的兔抗小鼠irdye800抗体(洛克兰)进行探测。使用针对his(西格玛)并在pbs中以1/1000稀释的小鼠单克隆抗体探测另一个蛋白质印迹,然后使用以在pbs中1/5000稀释的兔抗小鼠irdye800抗体(洛克兰)进行探测。使用odyssey(li-cor生物科学)成像系统分析印迹。
蛋白质印迹的结果在图10和图11中示出。图10中的结果显示使用针对mxih的小鼠多克隆抗体探测的印迹,这些结果与以上实例1和实例3中使用rha观察到的结果和在实例4中使用ipad观察到的结果相似。实际上,图10显示,融合到七鳃鳗vlr-b抗体c-末端结构域seqidno:2的mxih蛋白质作为二聚体、三聚体、四聚体、五聚体以及其他更高聚合形式(融合物mxih-七鳃鳗单体具有预期13.86kda的分子量)在bl21和shuffle大肠杆菌株中产生(在shuffle中表达最强)。在球粒中发现mxih(不溶性级分:图10和图11上的is)。图11中的结果显示使用针对his的小鼠单克隆抗体探测的印迹,这些结果表明添加his-标签对于七鳃鳗vlr-b抗体c-末端结构域seqidno:2与mxih蛋白质的聚合没有不利影响。在图10和图11中,mxih是不可见的。本发明人考虑到,没有七鳃鳗序列的mxih的产生量太小以致不能被印迹上的抗体显示出来。
- 还没有人留言评论。精彩留言会获得点赞!