一株通过敲除CAR1过表达DUR1,2低产氨基甲酸乙酯酿酒酵母菌株及其构建方法与流程
本发明属于生物工程技术领域,涉及工业微生物的育种,具体是涉及一株低产氨基甲酸乙酯的酿酒酵母菌株及其构建方法。
背景技术:
:
氨基甲酸乙酯(Ethyl Carbamate,EC)是一种潜在致癌物,可导致肺癌、淋巴癌、肝癌和皮肤癌等疾病,2007年国际癌症研究机构把EC重新分类,由2B组(或可能令人类患癌的物质)改为2A组(可能令人类患癌的物质)。EC广泛存在于发酵食品(如面包、酸牛奶、乳酪和酱油等)和酒精饮料(如中国黄酒、日本清酒和葡萄酒)中。葡萄酒是世界上最古老的饮料之一,具有独特的风味和营养保健功能。经检测,在葡萄酒中,EC含量较高。欧美发达国家已对市场销售的葡萄酒制定了EC限量标准。因此,降低葡萄酒中的EC含量,对促进葡萄酒行业健康发展和保障人类身体健康具有深远的意义。
如何降低葡萄酒中EC的含量,一直都是国际葡萄酒企业和相关科研单位研究的重要课题。葡萄酒中的EC主要由尿素和乙醇自发反应而形成,EC的主要前体物质是尿素。因此,在降低EC含量的策略中,主要是通过降低EC的前体物质——尿素来达到目的。目前降低葡萄酒中EC含量的主要方法有如下两种:一是通过在葡萄酒发酵液中添加酸性脲酶降解尿素,从而减少EC的生成。但由于酸性脲酶的生产过程繁琐,成本高,酸性脲酶的使用会大大增加企业生产成本,且外加酶的添加可能会有二次污染的风险。二、是从酿酒工艺方面考虑,适当改变一些工艺条件进而减少EC的生成。但该方式可能导致葡萄酒中风味物质的改变,葡萄酒质量的下降。因此,要从根本上降低酿酒酵母的产尿素能力还是需要利用分子生物学育种技术构建低产尿素的酿酒酵母工业菌株。
研究表明,葡萄酒中的尿素主要由精氨酸在CAR1基因编码的精氨酸酶的作用下分解而产生。当酵母需要氮源时,尿素被DUR1,2基因编码的脲基酰胺酶分解为NH3和CO2,从而合成各种含氮化合物供自身需求。当胞内尿素含量过高时,可被由DUR4基因编码的尿素转运蛋白Dur4p转运出细胞。当酵母再次需要氮源时,发酵液中的尿素也可被细胞膜上DUR3基因编码的尿素转运蛋白Dur3p携带转入胞内,被酵母细胞重吸收利用。因此,敲除精氨酸酶基因CAR1阻断尿素的来源,过表达分解尿素为NH3和CO2的脲基酰胺酶基因DUR1,2促进尿素的分解是降低葡萄酒中尿素含量的有效措施。因此,本发明通过敲除一个拷贝的精氨酸酶基因CAR1,同时过表达脲基酰胺酶基因DUR1,2,选育低产EC酿酒酵母工业菌株,满足酿酒酵母应用相关领域对酵母的较高要求,对促进葡萄酒行业健康发展和保障人类身体健康具有深远的意义。
技术实现要素:
:
本发明解决的技术问题之一是提供一株低产氨基甲酸乙酯酿酒酵母。
所述低产氨基甲酸乙酯酿酒酵母是在出发酵母菌株中敲除一个拷贝的精氨酸酶基因CAR1,同时过表达脲基酰胺酶基因DUR1,2所得。
所述CAR1基因其Gene ID为:855993,核苷酸序列如表中SEQ NO:1所示;所述DUR1,2基因其Gene ID为:852507,核苷酸序列如表中SEQ NO:2所示;所述启动子PGK1其Gene ID为:850370,核苷酸序列如表中SEQ ID NO:3所示。
所述出发酵母菌株为酿酒酵母(Saccharomyces cerevisiae)CGMCC No.3373,保存于中国微生物菌种保藏管理委员会普通微生物中心,公众可购买获得。
本发明解决的另一个技术问题是提供一种低产氨基甲酸乙酯酿酒酵母菌株的构建方法,包括如下步骤:
(1)重组质粒Yep-APD1,2KB的构建
①以质粒pPGK1为模板,PCR扩增强启动子PGK1基因,用限制性内切酶BamHI和SalI对载体质粒YEP352和PGK1基因片段进行酶切,再用Solution I连接酶将两者连接构建质粒Yep-P;
②以出发酵母菌株基因组为模板,PCR扩增DUR1,2基因,用限制性内切酶XhoI对质粒Yep-P进行酶切,再用Infusion连接酶将DUR1,2基因片段和酶切后的质粒Yep-P连接构建质粒Yep-PD1,2;
③以质粒pUG6为模板,PCR扩增KanMX基因,用限制性内切酶BamHI对质粒Yep-PD1,2进行酶切,再用Infusion连接酶将KanMX基因片段和酶切后的质粒Yep-PD1,2连接构建质粒Yep-PD1,2K;
④以出发酵母菌株基因组为模板,PCR扩增DUR1,2基因的上游同源臂CUA,用限制性内切酶SmaI对质粒Yep-PD1,2K进行酶切,再用Infusion连接酶将DUR1,2基因的上游同源臂CUA基因片段和酶切后的质粒Yep-PD1,2K连接构建质粒Yep-APD1,2K;
⑤以出发酵母菌株基因组为模板,PCR扩增DUR1,2基因的下游同源臂CUB,用限制性内切酶SphI对质粒Yep-APD1,2K进行酶切,再用Infusion连接酶将DUR1,2基因的下游同源臂CUB基因片段和酶切后的质粒Yep-APD1,2K连接构建质粒Yep-APD1,2KB。
(2)CAR1基因的敲除同时DUR1,2基因的过表达
①以质粒Yep-APD1,2KB为模板,PCR扩增“CUA-KanMX-PGK1p-DUR1,2-PGK1t-CUB”重组片段;
②用醋酸锂转化法将步骤(2)-①得到的PCR重组片段导入出发酵母菌株中,获得敲除一个拷贝的CAR1基因,同时过表达DUR1,2基因的重组菌株1;
③用pGAP质粒去除步骤(2)-②获得菌株中的KanMX基因,获得不含抗性基因,敲除一个拷贝的CAR1基因,同时过表达DUR1,2基因的重组菌株2,传代得到不含pGAP质粒的重组菌株2。
所述重组菌株可通过上述方法构建,所涉及具体操作方法已有很多文献报道,如Joseph Sambrook等,《分子克隆实验指南》第二版,科学出版社,1995。
本发明所述的酿酒酵母重组菌株2,在其它发酵性能不受影响的情况下,葡萄酒发酵试验中,尿素的含量降低了40.38%,EC的含量降低了34.45%。
有益效果:
1、本发明提供了一种低产氨基甲酸乙酯酿酒酵母菌株,降低了葡萄酒中EC的含量,克服了普通酿酒酵母由于产EC含量高而导致的对人体致癌风险大的影响。
2、本发明提供的低产EC酿酒酵母在保持良好发酵性能的前提下,敲除了一个拷贝的精氨酸酶基因CAR1,同时脲基酰胺酶基因DUR1,2的表达量显著提高,达到了低产EC的目的,为酿造出更有利于人体健康的葡萄酒奠定了理论基础,具有广阔的市场前景,同时为研究相关基因对葡萄酒中尿素和EC含量的影响奠定了基础。
3、本发明选育得到的酵母菌株通过Cre/LoxP系统完全剔除了KanMX抗性基因,不含外源抗性基因,可以安全的用于工业生产,有广泛的应用前景。
附图说明:
图1为Yep-APD1,2KB质粒构建过程;
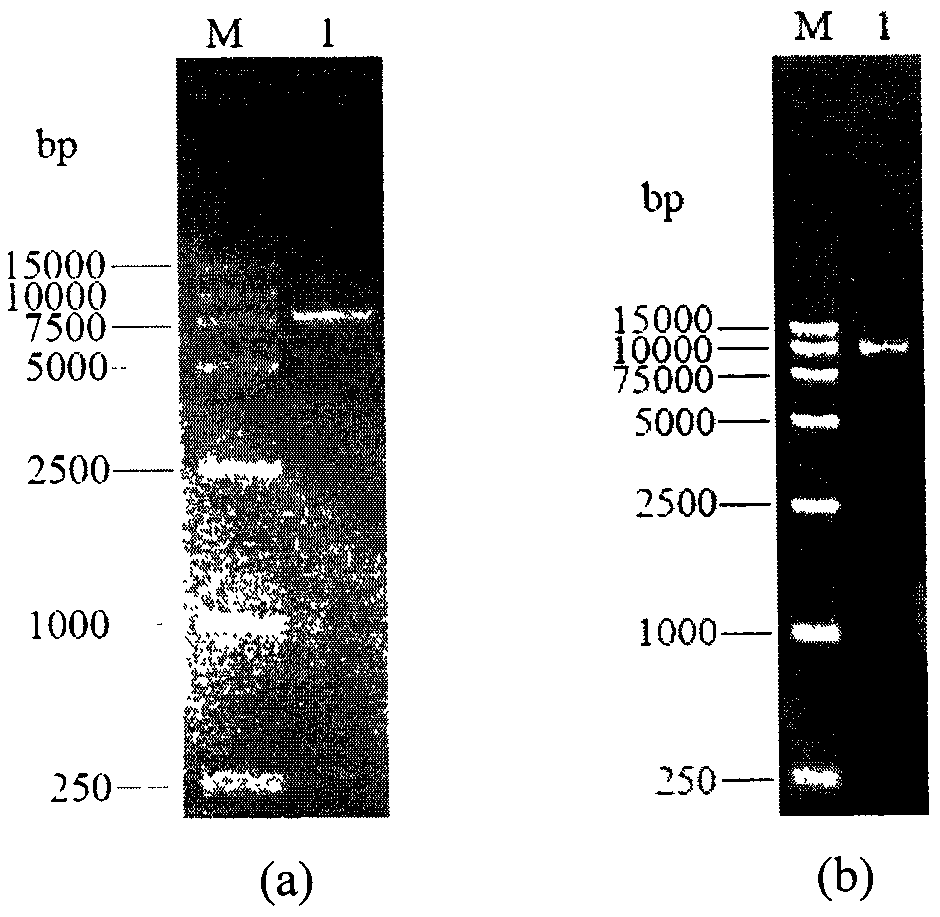
图2为质粒Yep-APD1,2KB的PCR验证:
其中:(a)中M为marker;1为以Yep-APD1,2KB为模板,PGK1-U/PGK1-D为引物PCR扩增PGK1p-DUR1,2-PGK1t片段;
(b)中M为marker;1为以Yep-APD1,2KB为模板,CU-U/CU-D为引物PCR扩增CUA-KanMX-PGK1p-DUR1,2-PGK1t-CUB片段;
图3为CAR1基因的敲除同时DUR1,2基因的过表达重组菌株的验证:
(a)中M为marker;1为以重组菌株1的基因组为模板,U-S/KU-S为引物,PCR扩增验证片段;2为以出发菌株的基因组为模板,U-S/KU-S为引物,PCR扩增验证片段;3为以重组菌株1的基因组为模板,PU-X/U-X为引物,PCR扩增验证片段;4为以出发菌株的基因组为模板,PU-X/U-X为引物,PCR扩增验证片段;
(b)中M为marker;1为以重组菌株2的基因组为模板,2为以重组菌株1的基因组为模板,以Kan-U/Kan-D为引物,PCR扩增验证片段;
(c)中M为marker;1为以传代后的重组菌株2的基因组为模板,2为以传代前的重组菌株2的基因组为模板,以Zeocin-U/Zeocin-D为引物,PCR扩增验证片段;
图4为9-羟基吨与尿素在酸性条件下衍生反应示意图。
具体实施方式:
下面通过具体的实施方案叙述本发明的一种低产EC酿酒酵母及其选育方法。下述实施例中所用的技术手段,如无特别说明,均为本领域常规方法。
实施例1:低产氨基甲酸乙酯酿酒酵母的构建
本实例所用的出发菌株CGMCC No.3373。所述大肠杆菌DH5a购自Takara公司。所述YEPD培养基为通用的完全培养基,固体培养基含2%进口琼脂粉。
根据Genebank中的酵母基因组数据和整合质粒序列,设计了下述引物。
表1本实施例中所用到的引物
注:下划线部分为酶切位点。
表2(a)本实施例中所用的Taq DNA聚合酶PCR扩增体系
表2(b)本实施例中所用的PrimeSTARGXLDNA聚合酶PCR扩增体系
表3(a)Solution I连接酶连接方法
注:反应条件为16C水浴,过夜连接
表3(b)Infusion连接酶连接方法
注:反应条件为50C水浴,连接30min
(1)重组质粒Yep-APD1,2KB的构建
重组质粒Yep-APD1,2KB的构建流程如图1所示;
以质粒pPGK1为模板,PGK1-U和PGK1-D为引物,Taq DNA聚合酶,PCR扩增强启动子PGK1基因,PCR反应条件:95℃5min;94℃1min,54℃1min,72℃105s,30个循环;72℃10min。用限制性内切酶BamHI和SalI对载体质粒YEP352和PGK1基因片段进行酶切,再用Solution I连接酶将两者连接构建质粒Yep-P。
以出发酵母菌株基因组为模板,DUR1,2-U和DUR1,2-D为引物,PrimeSTAR GXL DNA聚合酶,PCR扩增DUR1,2基因,PCR反应条件:95℃5min;98℃10s,55℃5s,72℃335s,30个循环;72℃10min。用限制性内切酶XhoI对质粒Yep-P进行酶切,再用Infusion连接酶将DUR1,2基因片段和酶切后的质粒Yep-P连接构建质粒Yep-PD1,2。
以质粒pUG6为模板,Kan-U和Kan-D为引物,Taq DNA聚合酶,PCR扩增KanMX基因,PCR反应条件:95℃5min;94℃1min,56℃1min,72℃100s,30个循环;72℃10min。用限制性内切酶BamHI对质粒Yep-PD1,2进行酶切,再用Infusion连接酶将KanMX基因片段和酶切后的质粒Yep-PD1,2连接构建质粒Yep-PD1,2K。
以出发酵母菌株基因组为模板,UA-U和UA-D为引物,Taq DNA聚合酶,PCR扩增DUR1,2基因的上游同源臂CUA,PCR反应条件:95℃5min;94℃1min,53℃1min,72℃60s,30个循环;72℃10min。用限制性内切酶SmaI对质粒Yep-PD1,2K进行酶切,再用Infusion连接酶将DUR1,2基因的上游同源臂CUA基因片段和酶切后的质粒Yep-PD1,2K连接构建质粒Yep-APD1,2K。
以出发酵母菌株基因组为模板,UB-U和UB-D为引物,PCR扩增DUR1,2基因的下游同源臂CUB,PCR反应条件:95℃5min;94℃1min,53℃1min,72℃60s,30个循环;72℃10min。用限制性内切酶SphI对质粒Yep-APD1,2K进行酶切,再用Infusion连接酶将DUR1,2基因的下游同源臂CUB基因片段和酶切后的质粒Yep-APD1,2K连接构建质粒Yep-APD1,2KB。
PCR验证结果如图2所示,其中:(a)中M为marker;1为以Yep-APD1,2KB为模板,PGK1-U/PGK1-D为引物PCR扩增PGK1p-DUR1,2-PGK1t片段;
(b)中M为marker;1为以Yep-APD1,2KB为模板,CU-U/CU-D为引物PCR扩增CUA-KanMX-PGK1p-DUR1,2-PGK1t-CUB片段。
(2)CAR1基因的敲除同时DUR1,2基因的过表达
以质粒Yep-APD1,2KB为模板,CU-U和CU-D为引物,PrimeSTAR GXL DNA聚合酶,PCR扩增“CUA-KanMX-PGK1p-DUR1,2-PGK1t-CUB”重组片段,PCR反应条件:95℃5min;98℃10s,55℃5s,72℃660s,30个循环;72℃10min。
通过醋酸锂转化的方法将PCR产物导入酿酒酵母出发菌株得到重组菌株1,通过G418抗性筛选重组子进行PCR验证,在DUR1,2基因的上游同源臂CUA外部设计引物U-S,KanMX序列内部设计引物KU-S;在PGK1序列内部设计引物PU-X,DUR1,2基因的下游同源臂CUB外部设计引物U-X,用于验证CAR1基因敲除同时DUR1,2基因过表达。以U-S和KU-S为引物,可扩增出大小为1208bp的片段;以PD-X和D-X为引物,可扩增出大小为1336bp的片段,且PCR扩增出的片段与预期的目的产物大小一致,而出发菌株则不能扩增得到该片段,PCR验证结果如图3(a)所示。
通过醋酸锂转化的方法将带有Cre重组酶的pGAPza质粒化转于重组菌株1中获得重组菌株2;挑取转化子在半乳糖培养基中诱导4-5h,稀释涂布,挑出单菌落于YEPD平板上,再影印到G418抗性平板上;挑出在YEPD平板上生长而在G418抗性平板上不生长的菌株,提取基因组进行PCR验证,即以重组菌株2的基因组为模板扩增KanMX片段,无法得到1600bp左右的条带,而重组菌株1则能扩增得到该片段,PCR验证结果如图3(b)所示。将验证正确的酵母单菌落接到YEPD液体培养基中进行传代培养,每12h转接一次,传数代之后pGAPza质粒即可丢失,提取酵母质粒进行PCR验证如图3(c)所示。
结果表明,在酵母细胞中实现了敲除一个拷贝的CAR1基因同时强启动子PGK1过表达DUR1,2基因全序列。
实施例2:低产EC酿酒酵母菌株发酵实验
(1)重组菌株与出发菌株的葡萄酒发酵实验
将重组菌株和出发菌株分别同时进行葡萄酒发酵实验,发酵工艺路线图:
葡萄原料→清洗、晾干、除梗→破碎→调糖、调酸→加亚硫酸、灭菌→接菌→前发酵→皮渣分离→后发酵→测定指标
工艺条件:
糖度:20.45Brix;酸度:pH 3.51;SO2添加量:80mg/L;接菌量:3%;前发酵温度和时间:25℃,4.5d;后发酵温度和时间:20℃,9d。
挑取一环酵母细胞,接入装有5mL YEPD培养基的试管中,30℃,180rpm培养12h,再按10%接种量接种到装有45mLYEPD培养基的150mL三角瓶中,30℃,180rpm培养12h后,按3%接种量接种到葡萄汁发酵培养基,25℃静置发酵。每隔12h称重1次,当两次失重小于0.3g,前发酵结束。用纱布过滤使皮渣分离,20℃静置进行后发酵,后发酵时间为前发酵的两倍。发酵结束后对发酵醪液进行过滤,得葡萄酒酒样。测定CO2累积排放量、酒精度、残余还原糖、总酸和pH等发酵性能指标,结果如表4。
表4亲本菌株和重组菌株的发酵性能测定
注:所示数据为三个平行试验结果的平均值。
(2)液相色谱法测葡萄酒中尿素含量
①原理
9-羟基吨与尿素在酸性条件下生成可以产生具有荧光特性的衍生物(N-9H-xanthen-9-yl-X),反应原理如图4所示,再经高效液相色谱柱C18的分离,荧光检测器的检测,用外标法定量。
②样品衍生处理
取500μL酒样用无水乙醇稀释至1000μL,再取稀释的酒样500μL,加9-羟基吨溶液500μL和盐酸溶液100μL,混匀,室温避光衍生30min,经有机微孔滤膜过滤后,待进样分析。
③液相色谱检测条件
色谱柱:Agilent-C18色谱柱:250mm×4.6mm,粒径5μm,柱温35℃;流动相A:乙腈;流动相B:0.02mol/L乙酸钠溶液,用1%(V/V)乙酸调pH为7.2;流动相流速:1mL/min;荧光检测器激发波长λex=240nm,发射波长λem=308nm,增益10;进样量20uL;梯度洗脱,详见表5:
表5洗脱程序
结果如表6。结果显示,重组菌株2发酵所生产葡萄酒中尿素含量为0.93mg/L,较出发菌株降低了40.38%。
(3)气相色谱质谱联用法测葡萄酒中EC含量
①原理
样品加氨基甲酸丙酯内标后,经过碱性硅藻土固相萃取柱净化除杂、洗脱、浓缩后,用气相色谱-质谱仪进行检测,内标法定量。
②样品的预处理
用固相萃取法对样品进行预处理。准确吸取2mL的酒样或配好的EC标品,加入20uL,10.0mg/L内标PC使用溶液,0.3g氯化钠,超声溶解、混匀后,上样至碱性硅藻土固相萃取柱,在真空条件下,使样品溶液慢慢渗入萃取柱,静置约10min。经10mL正己烷淋洗除杂后,用15mL、5%乙酸乙酯-乙醚溶液约以1mL/min流速进行洗脱,洗脱液先经装有2g无水硫酸钠的玻璃漏斗脱水,再收集于10mL具塞刻度试管中,室温下用氮气缓缓吹至0.5mL左右,用甲醇定容至1.0mL,制成待测液,供GC/MS分析。
③GC/MS的检测条件
色谱条件:CP-WAX毛细管50m*0.25mm*0.25μm,柱温50℃保持1min,再以3℃/min的速度增至180℃,保持1min,最后以20℃/min的速度增至220℃,保持10min。载气:He,载气流量:1mL/min,注射模式:不分流。
质谱条件:离子源温度250℃,电子能量70ev,接口温度230℃,电子倍增器电压1568V,EC检测离子m/z 62、74、89,定量离子m/z 62。PC检测离子m/z 59、62、74,定量离子m/z 62。
结果如表6。结果显示,重组菌株2发酵所生产葡萄酒中EC含量为12.50μg/L,较出发菌株降低了34.45%。
表6亲本菌株和重组菌株的尿素和EC产量
注:所不数据为三个平行试验结果的平均值。
(4)液相色谱法测葡萄酒中氨基酸含量
①原理
将样品进行DNFB柱前衍生,使氨基算衍生化成有利于分离,在紫外360nm处有吸收的化合物,经高效液相色谱柱C18的分离,紫外检测器的检测,用外标法定量。
②样品衍生处理
取样品20μL,加衍生缓冲液200μL和衍生剂200μL,混匀,65℃水浴避光衍生1h后取出,待溶液冷却至室温后,加定溶缓冲液至1200μL并混匀,放置15min后经有机微孔滤膜过滤后,待进样分析。
③液相色谱检测条件
色谱柱:Agilent-C18色谱柱:250mm×4.6mm,粒径5μm,柱温33℃;流动相A:50%乙腈;流动相B:0.05mol/L乙酸钠溶液;流动相流速:1mL/min;紫外检测器波长360nm,增益10;进样量20μL;梯度洗脱,详见表7:
表7洗脱程序
结果如表8。结果显示,重组菌株2发酵所生产葡萄酒中常见氨基酸含量较出发菌株无明显差异。
表8亲本菌株和重组菌株的常见氨基酸产量(单位mg/L)
注:所示数据为三个平行试验结果的平均值。
(5)气相色谱法测定酒中挥发性酸、酯和醇的含量
①酒样预处理
准确量取内标液(乙酸正丁酯)0.15mL于10mL容量瓶中,用待测酒样定容并混匀,用400μm孔径滤膜过滤后,进行高效气相色谱测定。
②气相色谱条件
气相色谱仪:Agilent 7890C;色谱柱:AT.LZP-930,230℃,50m×320μm×1μm;检测器:FID检测器,检测器温度:200℃;载气:高纯氮,流速5mL/min;检测条件:程序升温,50℃保持8min,5℃/min升到120℃,保持8min;进样口温度:200℃;进样量:1.0μL;分流方式:分流,分流比为10:1。
结果如表9。结果显示,重组菌株2发酵所生产葡萄酒中常见挥发性酸、酯和醇含量较出发菌株无明显差异。
表9亲本菌株和重组菌株的挥发性酸、酯和醇产量(单位mg/L)
注:所示数据为三个平行试验结果的平均值。
- 还没有人留言评论。精彩留言会获得点赞!
- 用CRISPR/Cas9技术易于筛选获得目的基因敲除细胞系的方法及产品与制造工艺
- 一种Candida amazonensis的FLP/FRT基因敲除方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 利用CRISPR/Cas9敲除人PD‑1基因构建靶向CD19CAR‑T细胞的方法与制造工艺
- 一种构建基因替代小鼠研究野生型和突变体非肌性肌球蛋白重链II功能的方法与制造工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 猪ApoE基因敲除打靶载体及其构建方法和应用与制造工艺
- 一种血小板减少症的斑马鱼模型的制造方法与工艺
- 基于CRISPR技术敲除FUT8基因的方法与制造工艺