Csad蛋白及其编码基因在抗流感病毒中的应用的制作方法
本发明总地涉及生物技术领域,具体来说,涉及一种csad蛋白及其编码基因在抗流感病毒中的应用。
背景技术:
流感病毒对人类的健康造成极大危害,在已经过去的20世纪,人类发生过4次大规模的流感流行,包括1918年的“西班牙流感”大流行、1957年的“亚洲流感”大流行、1968年的“香港流感”大流行和1977年的“俄罗斯流感”大流行。这些流感的大流行使得人类生命财产及经济发展遭受了巨大的打击。
流感病毒属于正粘病毒科,是一类分节段、有包膜的单链负链rna病毒,传染性强且易发生变异,包括a、b、c三型,可感染不同宿主。其中a型流感病毒可以感染人类、禽类及哺乳动物,是引起季节性流行性感冒的主要病原体;b型、c型流感病毒则主要感染人类。a型流感病毒又可依据其表面抗原血凝素(hemagglutinin,ha)、神经氨酸酶(neuraminidase,na)种类分为不同亚型,截止到目前为止已经发现了17种亚型的ha和10种亚型的na。a型流感病毒近年来在我国呈现季节性流行趋势。
流感病毒颗粒在电镜下呈球形,直径为80~120nm,外被囊膜,主要由蛋白质和rna组成。病毒颗粒的表面是来自于宿主细胞的脂质双层结构,其中的两种主要表面抗原ha和na以及一种离子通道蛋白m2。脂质双层内部为来自病毒的基质蛋白(matrixprotein,m1)。病毒粒子核心为8条核糖核蛋白复合体(ribonucleoproteincomplex,rnp),包括病毒基因组片段、rna聚合酶复合物(rnapolymerasecomplex)以及病毒核蛋白(nucleoprotein,np)。其中pb2(polymerasebasic2)、pb1(polymerasebasic1)、pa(polymeraseacid)三个蛋白组成了rna聚合酶复合物的主要成份。另外,核外转运蛋白(nuclearexportprotein/nonstructuralprotein2,ns2/nep)也存在于纯化的病毒粒子中。
流感病毒基质蛋白m1是包围在病毒核心外的一层膜结构,介于核蛋白与脂质双层膜之间,与组成脂质双层膜的类脂紧密结合,在维持病毒形状与完整性上起重要作用。m1蛋白参与病毒复制过程多个环节,具有调控病毒的转录和被感染细胞的细胞核、细胞浆之间的物质运输作用,以及参与病毒的出芽过程,是流感病毒的主要成分之一。
半胱亚磺酸脱羧酶(cysteinesulfinatedecarboxylase,csad)是氨基酸脱羧酶之一。是催化l-半胱亚磺酸脱羧产生氨乙基亚磺酸和二氧化碳的酶,亚磺酸(hypotaurine)经过脱氢而生成牛磺酸。该酶可在动物的肝脏、脾脏、肾脏、小肠壁等中见到,以磷酸吡哆醛为辅酶。
牛磺酸(taurine)又称β-氨基乙磺酸。纯品为无色或白色斜状晶体,无臭,牛磺酸化学性质稳定,不溶于乙醚等有机溶剂,是一种含硫的非蛋白氨基酸,在体内以游离状态存在,不参与体内蛋白的生物合成。牛磺酸虽然不参与蛋白质合成,但它却与胱氨酸、半胱氨酸的代谢密切相关。人体合成牛磺酸的半胱氨酸亚硫酸羧酶(csad)活性较低,主要依靠摄取食物中的牛磺酸来满足机体需要。
牛磺酸是一种特殊的氨基酸,是人体必不可少的一种营养元素。经过研究证实,人体心脏中牛磺酸含量最高。牛磺酸是通过保护心肌而增强心脏功能的。当心肌细胞中钙离子流入量过高时,就会引发冠心病。牛磺酸可以调整心肌细胞中钙离子的量,维持其平衡,实现强心。此外,牛磺酸对肺、肝脏、胃肠等都有保护作用。在日常生活方面,牛磺酸最显著的作用就在于增强免疫力和抗疲劳。牛磺酸可以结合白细胞中的次氯酸并生成无毒性物质,降低次氯酸对白细胞自身的破坏,从而提高人体免疫力。同时,牛磺酸能维持心脏功能,使血液循环正常化,从而消除疲劳生成物,使肌体能有效地产生能量。体内保持恒定的牛磺酸,便能有效地消除疲劳,这是维持人体健康的重要因素。
技术实现要素:
本发明提供了一种csad蛋白及其编码基因在抗流感病毒中的应用。
本发明的一个方面,提供蛋白质或其编码基因在制备抗流感病毒的药物或免疫增强剂中的应用;
所述蛋白质为如下(a)或(b):
(a)由seqidno:1所示的氨基酸序列组成的蛋白质;
(b)将seqidno:1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有抗流感病毒活性的衍生的蛋白质。
本发明的另一个方面,提供蛋白质及其编码基因在如下(a1)和/或(a2)和/或(a3)中的应用:
(a1)制备能够抑制流感病毒复制的药物;
(a2)制备能够抑制流感病毒复制的免疫增强剂;
(a3)制备能够结合并抑制流感病毒m1蛋白的药物;
(a4)制备能够抑制流感病毒感染引起的肺组织病理损伤的药物。
为了便于蛋白(csad)的纯化,可在由seqidno:1的氨基酸残基序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。
表1:标签的序列
上述(b)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(b)中的蛋白质的编码基因可通过将seqidno:2所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变。
在上述应用中,所述蛋白质的编码基因(csad编码基因)是如下(1)至(3)中任一所述的dna分子:
(1)seqidno:2所示的dna分子;
(2)在严格条件下与(1)所限定的dna分子杂交且编码所述蛋白质的dna分子;
(3)与(1)或(2)中任一所述的dna分子具有90%以上同源性且编码所述蛋白质的dna分子。
在上述应用中,所述流感病毒可为a型或b型流感病毒。
在本发明的一个实施例中,所述流感病毒具体为h1n1型流感病毒a/pr8/1934株
所述csad蛋白或其编码基因的抗流感病毒功能具体体现在如下:所述csad蛋白能够结合流感病毒m1蛋白,从而抑制流感病毒的复制。
本发明的再一个目的是提供含有seqidno:2所示的dna分子的抗流感病毒的药物或免疫增强剂。
本发明的另一个目的,提供含有seqidno:2所示的dna分子且用于制备抗流感病毒的药物或免疫增强剂的重组载体、表达盒、转基因细胞系或重组菌。
本发明的又一个方面,提供含有seqidno:1所示的蛋白质的抗流感病毒的药物或免疫增强剂。
本发明通过研究129小鼠宿主与流感病毒基质蛋白m1相互作用机制,运用酵母双杂交技术寻找到了129小鼠肺部蛋白中与a型流感病毒pr8基质蛋白m1相互作用的靶蛋白csad,并通过实验验证了csad蛋白与流感病毒基质蛋白m1的相互作用,并且发现csad蛋白可以在流感病毒感染前期(12-24h)抑制流感病毒复制水平;csad对129小鼠的灌胃实验表明,csad能够显著提高小鼠感染流感病毒后的存活率,并抑制肺部的炎症反应。本发明的研究结果为开发基于宿主细胞基因靶点的抗病毒药物提供了新的途径。
附图说明
图1为本发明实施例2中免疫共沉淀产物与pcdna-flag-csad与pci-gfp-m1转染细胞后提取的总蛋白进行westernblot结果图;
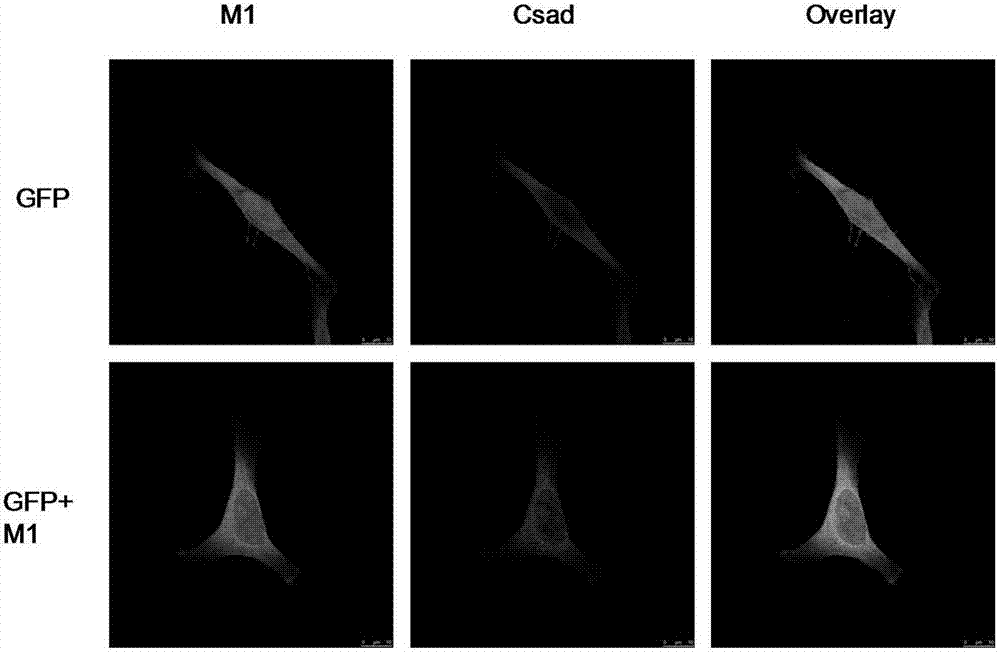
图2为本发明实施例2中csad蛋白与流感病毒基质蛋白m1在a549 细胞核内共定位结果图;
图3为本发明实施例3中过表达细胞系(a549-csad)与对照细胞系(a549-nc)感染流感病毒pr8病毒后病毒滴度对比图;
图4a为本发明实施例3中csad对129小鼠灌胃及流感病毒感染实验中小鼠存活率对比图;
图4b为本发明实施例3中csad对129小鼠灌胃及流感病毒感染实验中小鼠感染流感病毒后第四天肺部病理切片对比图。
具体实施方式
以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1通过酵母双杂交技术筛选特异性抗病毒蛋白
(1)使用酵母双杂交技术,筛选129小鼠肺部组织中与流感病毒基质蛋白m1相互作用的蛋白,寻找129小鼠宿主特异性抗病毒蛋白。
(2)处理8-12周龄雌性129小鼠(购自北京维通利华实验动物技术有限公司)各三只,取肺部组织液氮研磨,使用trizol法提取总rna。
(3)使用clontech公司makeyourown“mate&platetm”librarysystem试剂盒将总rna(1-2μg)反转录为cdna,具体步骤如下:
1)将如下试剂加到0.25ml离心管中,混合均匀,简短离心;
试剂:1-2μl步骤(2)中获得的rna;1.0μl的cdsⅲ/6引物(5’-attctagaggccgaggcggccgacatg-nnnnnn-3’);1-2μl;用去离子水补足体积至4.0μl。
2)72℃温育2min;再放在冰上冷却2min;简短离心。
3)离心管放置在室温下,加入下列试剂后,轻敲混匀,简短离心。
试剂:2.0μl5xfirst-strandbuffer;1.0μldtt(20mm);1.0μldntpmix(10mm);1.0μlmmlv逆转录酶;用去离子水补足体积至9.0μl。
4)在25–30℃的室温下,温育10min;再在42℃温育10min。
5)加入1.0μlbdsmartiii寡核苷酸。
6)在空气培养箱或者热盖pcr仪上,42℃温育一个小时。
7)放置反应试管75℃、10min,终止首链合成。
8)室温下冷却,在加1.0μl(3个单位)rnaseh;在37℃温育20min。
9)从首链合成物取2μl液体并加入到一个干净的、预冷的、0.5ml试管中,放置在冰上备用。
(4)通过ld-pcr扩增首链合成获得的dscdna。
(5)将(4)中获得的dscdna与pgadt7质粒(购自clontech公司)共转化y187酵母(购自clontech公司)感受态细胞,建立129小鼠肺部组织酵母cdna文库。
1)用dscdna和pgadt7-rec(购自clontech公司)转化ah109酵母菌株(购自clontech公司)准备酵母的感受态细胞;在无菌预冷的15ml离心管加入下列试剂:20μldscdna;6μlpgadt7-rec;20μlherringtestescarrierdna。
转移46μlherringdna到一个离心管中并在100℃加热5min。立即把试管放在冰浴中冷却dna。加dna到15ml反应试管前再进行一次加热及冷却步骤。加600μlah109酵母感受态细胞到herringdna中,轻轻涡旋震荡混合,加入2.5mlpeg/liac溶液,轻轻涡旋震荡混合;30℃温育45min,每隔15min混合一次细胞;加入160μldmso,混合,再放置试管到42℃水浴,20min。隔10min混合一次细胞;700×g离心5min,弃掉上清,用3mlypdplus液体培养基重新悬浮。30℃温育,摇动90min。700×g离心5min,弃掉上清,用30mlnacl(0.9%)溶液重新悬浮。
2)在sd/–leu平板上选择转化子
将1)获得的ah109酵母菌株悬浮液铺平板,每个150mm平板上铺展150μl悬浮液。(注:检测转化效率,铺100μl1:10,1:100,1:1,000,and1:10,000稀释液在100-mmsd/–leu平板上。)
上面向下30℃温育平板直到克隆出现(3-6天)。
计算转化效率。期望结果:≥1×106transformants/3μgpgadt7-rec。
3)收集转化子
4℃冷却平板3-4小时,每个平板加入5ml冷冻培养基;使用无菌的玻璃棒轻轻的搅动使细胞进入液体;汇集所有的液体到烧瓶中,混合均匀。使用记数计计算细胞的密度。每1ml等份保存在–80℃下。
(6)将h1n1a型流感病毒pr8株的m1cdna连接到pgbkt7载体(购自clontech公司)ecori与sali酶切位点间作为诱饵质粒(使用promega公司的t4dnaligase试剂盒,根据试剂盒的说明书具体操作),利用matchmakertwo-hybridsystem筛选与流感病毒m1蛋白相互作用的小鼠宿主蛋白,具体步骤如下:
1)融合文库宿主菌和诱饵菌株:
a)在室温水浴中融化1ml等份(≥2×107cells)步骤(5)中获得的ah109转化子(流感病毒pr8株的m1cdna文库)。
b)混合5mly187(129小鼠肺部组织酵母cdna文库)和1ml均份的ah109转化子细胞在一个无菌2l烧瓶中。
c)加入45ml2xypda/kan(50μg/ml)。轻轻摇动。
d)用两个2xypda/kan(50μg/ml)均分液从文库瓶中洗脱细胞。
e)30–50rpm转速,30℃温育20–24小时。
f)20个小时融合后,在相差显微镜下检查一滴融合培养物,如果合子存在,可以再进行四个小时的融合。
g)把融合混合物转移到一个无菌100ml的离心管底部。1,000×g离心10min。用0.5xypda/kan(50μg/ml)冲洗融合烧瓶两次(每次用50ml冲洗)。汇集冲洗液并用它重新悬浮细胞。
h)1,000×g离心10min。在10ml0.5xypda/kan(50μg/ml)细胞块。测量细胞和培养基总体积。
2)选择表达相互作用蛋白的酵母二倍体:
测定融合效率,铺100μl的1:10,000,1:1,000,1:100,和1:10稀释的融合培养物于三个培养基(100mm平板):sd/–leu、sd/–trp和sd/–leu/–trp。铺展剩余的融合培养物于tdo或者qdo平板(200μlcells/150mm平板)。在tdo或qdo平板上生长的酵母单克隆即为可能与流感病毒m1蛋白相互作用的宿主蛋白,继续测序鉴定。
3)将2)中筛选出的表达相互作用蛋白的酵母菌株克隆进行质粒dna 提取,并转化大肠杆菌dh5α细胞,而后再进行测序。测序结果在http://blast.ncbi.nlm.nih.gov网站进行序列比对,结果发现提交的基因序列与“musmusculuscysteinesulfinicaciddecarboxylase(csad),mrna”同源性达到95%以上。
实施例2免疫印迹及细胞共定位
将a型流感病毒pr8株基质蛋白m1与csad蛋白(核苷酸序列见seqidno:1)全长cdna分别构建到真核表达质粒pcdna-flag、pci-gfp中(ogawa,k.,tanaka,y.,uruno,t.,duan,x.f.,harada,y.,sanematsu,f.,yamamura,k.,terasawa,m.,nishikimi,a.,cote,j.f.,etal.(2014).dock5functionsasakeysignalingadaptorthatlinksfcepsilonrisignalstomicrotubuledynamicsduringmastcelldegranulation.journalofexperimentalmedicine211,1401-1413.质粒pcdna-flag、pci-gfp公众自本申请的申请日起二十年可从中国科学院微生物研究所获得),具体步骤包括:
(1)设计a型流感病毒pr8株基质蛋白m1全长引物,左右两端添加酶切位点xhoi、sali酶切位点(m1-f:5’-gccgaattcatgagtcttctaaccgag-3’;m1-r:5’-caggtcgactcacttgaaccgttgcat-3’),连接到pci-gfp质粒中,获得pci-gfp-m1。
(2)设计csad蛋白全长引物,左右两端分别添加ecori、xhoi酶切位点(引物序列:csad-f:5’-gcggaattcaccatggctgactcaaaac-3’;csad-r:5’-gcgctcgagcaggtcctggcccaggagc-3’),连接到pcdna-flag质粒中,获得pcdna-flag-csad。
将构建好的分别含有m1和csad蛋白的cdna序列的两个质粒共同转染293t细胞:①48h后裂解细胞提取蛋白,使用
结果:如图1所示,当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来,如果用蛋白质flag(csad)的抗体免疫沉淀flag(csad),那么与csad在体内结合的蛋白质m1也能沉淀下来(见泳道lane4)。反之,阴性对照组没有转染csad,因此m1无法被沉淀下来(见泳道lane3)。
如图2所示,pcdna-flag-csad与pci-gfp-m1共同转染至hela细胞(liu,d.,sheng,c.j.,gao,s.j.,yao,c.,li,j.d.,jiang,w.,chen,h.m.,wu,j.x.,pan,c.c.,chen,s.,etal.(2015).socs3drivesproteasomaldegradationoftbk1andnegativelyregulatesantiviralinnateimmunity.molecularandcellularbiology35,2400-2413.公众自本申请的申请日起二十年可从中国科学院微生物研究所获得)后,使用带有红色荧光的flag抗体对细胞进行染色,可以观察到csad与m1在核内发生共定位,即显示黄色(overlay下)。
实施例3csad稳定表达细胞系的构建及感染实验
使用慢病毒表达载体pcdh-cmv(购自systembiosciences,inc公司)构建csad稳定表达细胞系,具体步骤如下:
(1)在csad两端设计xbai、ecori酶切位点,插入pcdh-cmv载体中,获得载体pcdh-csad;
(2)使用pei转染试剂将pcdh-cmv与pcdh-csad分别转染至a549细胞(liu,d.,sheng,c.j.,gao,s.j.,yao,c.,li,j.d.,jiang,w.,chen,h.m.,wu,j.x.,pan,c.c.,chen,s.,etal.(2015).socs3drivesproteasomaldegradationoftbk1andnegativelyregulatesantiviralinnateimmunity.molecularandcellularbiology35,2400-2413.公众自本申请的申请日起二十年可从中国科学院微生物研究所获得)中,具体操作如下:
a)准备40%-80%的a549细胞(6-well,5×105/well),阴性对照(pcdh-cmv)和目的基因(pcdh-csad)各一个孔;
b)在400ul无血清dmem培养液中加入2μg质粒,混合均匀;
c)在b)的混合液中加入4μl的pei转染试剂(1mg/ml),混合均匀;室温静置10分钟;
d)向c)的混合液中加入1.1ml的2%fbs/dmem液体培养基,混 合均匀;
e)吸干细胞培养液,将混合液全部加入;
f)在37℃培养3小时,而后换成正常培养基(10%fbs/dmem);在24-48小时后检测基因表达。
(3)出现绿色荧光后,使用puromycin(5μg/ml)筛选阳性细胞,大约2周。而后使用流式细胞仪分选gfp高表达细胞,即为a549-csad(过表达)及a549-cmv(对照)细胞系。
分别将csad表达细胞系a549-csad与对照细胞系a549-cmv感染pr8病毒(moi=0.01)后,在感染后不同时间点(0-72h)通过空斑分析法(plaqueassay)测定病毒滴度。感染12h和24h后分别测定dmem培养液滴度。
结果:如图3所示,显示csad可以在感染前期(12-24h)抑制流感病毒复制水平。
使用1×106pfupr8病毒感染129小鼠,对照组与实验组各三只129小鼠,感染后每天给小鼠对照蛋白(nc)或csad蛋白各10μg,灌胃施用。记录小鼠每天体重变化与死亡率,并在感染后第4天处死小鼠制作肺部病理he切片。
结果:如图4所示,对照组小鼠在感染流感病毒后肺泡和细支气管壁上皮细胞严重破坏和增厚,肺泡间孔径显著缩小;而实验组小鼠肺泡和支气管上皮细胞破坏和增厚情况均要明显好于对照组小鼠。因此,csad可以有效抑制流感病毒感染引起的肺组织病理损伤(图4b)并显著提高小鼠的生存率(图4a)。
最后应说明的是:显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺
- 植物抗病毒相关蛋白GmSN1及其编码基因和应用的制造方法与工艺