肝癌标志物OXCT1及其在肝癌诊断、治疗以及预后中的应用的制作方法
本发明属于生物医药领域,具体涉及一种潜在的肝癌标记物oxct1,oxct1基因在导致肝癌过程中发挥作用,并且涉及oxct1在肝癌诊断、治疗以及预后中的应用。
背景技术:
恶性肿瘤严重危害人类的健康,并已超过心血管疾病成为致死的首要因素。根据2012年全球癌症统计报告:全世界肝癌当年死亡69.5万人,在所有癌症中死亡率中列居第三位。更为严重的是,中国是全球肝癌发病率最高以及致死数最多的国家,我国的肝癌患者约占全球肝癌患者的52.7%。并且我国的肝癌患者每年都在快速增长,预计2015年,中国男性肝癌发病人数为326,698,女性肝癌发病人数为111,017,两者相加437,715人。因此,探索肝癌发生的相关分子机制以及寻找新型有效治疗方法对肝癌病人的健康具有重要意义。
由于肝癌具有如此惊人地增长速度和致死率,使得早期诊断和预后判断对于提高肝癌患者的生存率具有十分重要的意义。目前的肝癌诊断手段包括血清检查、甲胎蛋白测定、超声检查、ct检查等,但是这些检测手段存在灵敏度和特异性有限的缺点,常常出现假阳性的情况。因此,发现新的高效的肝癌特异表达靶标对于肝癌的早期诊断和及时治疗具有重要作用。
肝癌的治疗主要是早期手术切除和晚期化疗的方法,具体治疗策略决定于肝癌的发生阶段以及肝癌病人不同的分子分型,往往由于诊断时肝癌已处于晚期,肿瘤已发生转移而失去了手术机会,并且针对性的化疗方案也很难提高病人的生存率。在肿瘤的治疗研究中,随着基因工程的广泛应用和实践,针对肿瘤特异表达基因的基因治疗方法也开始登上肿瘤治疗的舞台。通过导入特定的与靶分子mrna互补的dna或rna,来阻断异 常表达的基因转录或翻译过程,抑制异常表达基因,最终实现针对特定表达基因而治疗肿瘤。因此,寻找出肝癌中特异且恶性表达的基因并阐明其相关的分子机制,对癌症的有效治疗十分重要。
肝脏是合成酮体最主要的器官,肝细胞应对饥饿,合成酮体并快速对其他组织提供应急能源。由于肝脏中缺乏利用酮体的关键限速酶oxct1(蛋白名为scot),导致肝脏本身不能利用酮体。目前,oxct1在人类肝癌细胞中的表达情况和作用机制还不明了。
技术实现要素:
本发明人在肝癌临床病人的肝癌组织和对应的癌旁组织中比较oxct1的表达,发现oxct1基因和蛋白在肝癌组织中显著上调。此外,本发明人发现血清饥饿可以显著诱导oxct1基因和蛋白在肝癌细胞系中的表达,进而通过体内、体外功能实验发现:在肝癌细胞中oxct1蛋白的过表达与肿瘤细胞的增殖,自噬密切相关。而通过抑制oxct1蛋白在癌细胞中的表达水平,可以有效抑制肝癌细胞的增殖和血清饥饿诱导细胞自噬的敏感性。
因此,本发明第一方面提供一种肝癌生物标志物,所述标志物是oxct1基因/蛋白。
本发明的第二方面提供oxct1基因/蛋白在制备检测肝癌的试剂盒中的用途。
本发明的第三个方面提供一种用于肝癌检测或肝癌预后的试剂盒,所述试剂盒使用oxct1基因/蛋白作为检测靶标。
在优选的实施方案中,所述试剂盒包含可以用于特异扩增oxct1基因的引物对,或特异识别/结合oxct1蛋白的试剂。
在优选的实施方案中,所述试剂是抗体。
本领域技术人员通过本领域中已知的引物设计方法即可设计出适用于扩增oxct1基因的引物对。
在优选的实施方案中,所述抗体是单克隆抗体或多克隆抗体,优选多克隆抗体。另外,本领域技术人员知晓如何获得特异识别/结合oxct1蛋白的抗体。
在优选的实施方案中,所述引物对包括seqidno:1和seqidno:2所示的序列。
在优选的实施方案中,可以通过基因手段,如多种pcr手段,例如荧光实时定量pcr,使用所述引物进行检测,也可以通过免疫手段,如蛋白质印迹、免疫组化、免疫荧光等检测oxct1蛋白。
本发明的第四个方面提供治疗肝癌/增加肝癌细胞自噬的药物,所述药物可以抑制oxct1基因/蛋白的功能。
在优选的实施方案中,所述药物是抑制oxct1基因/蛋白表达的sirna和/或中和性抗体和/或其他抑制和/或中和性抗体的化合物。
在优选的实施方案中,所述肝癌为人肝癌。
综上所述,目前用于肝癌临床辅助诊断的标记物或技术尚不完善,而oxct1基因和蛋白在体内肝癌肿瘤中的表达较正常肝组织中明显上调,使得oxct1可以成为肿瘤辅助诊断标记物。并且根据本发明人的研究,抑制内源性oxct1可显著降低细胞增殖,使得oxct1可以成为肿瘤治疗有效靶点。本发明人同时发现oxct1蛋白表达越高的肝癌患者其生存率越低,即oxct1蛋白过表达明确指示较差的生存预后,即oxct1基因/蛋白可以成为肝癌患者生存预后指标。
因此,本发明为肝癌治疗提供新的理论依据和全新靶标,本发明还为肝癌提供了新的辅助诊断和预后诊断的方法。
附图说明
图1为oxct1蛋白在正常哺乳动物不同组织的表达情况;显示为oxct1蛋白在脑,心脏,肾脏,胃组织中过表达,在肺组织中表达水平一般,在肝脏中缺失表达;
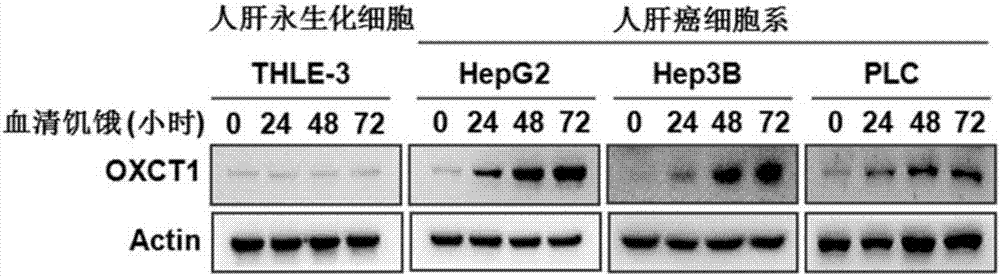
图2为oxct1蛋白在多种肝癌细胞系中血清饥饿条件下的表达情况;显示为oxct1蛋白在永生化的正常肝细胞中表达量低且不受血清饥饿上调,而在不同的肝癌细胞系中血清饥饿显著上调其表达;
图3显示在临床肝癌病人组织样品中oxct1的mrna水平过表达(a);并且在临床肝癌病人组织样品中oxct1的蛋白水平也过表达(b);
图4显示在肝癌病人临床分期中,肝癌恶性程度越高oxct1的蛋白表达 量越高(a),在79例肝癌临床肿瘤样本中oxct1蛋白过表达与患者10年总生存率(os)显著负相关(b);
图5为体外实验中的各组细胞生长实验,在hepg2(a)和hep3b(b)两种肝癌细胞系中显示抑制oxct1(shrna)能阻止肝癌细胞在血清饥饿时的生长,而外源过表达oxct1基因/蛋白有利于肝癌细胞在血清饥饿时的生长;
图6为裸鼠皮下成瘤实验,结果显示敲低oxct1基因/蛋白显著抑制了肝癌细胞的体内成瘤能力,而外源过表达oxct1基因/蛋白则显著增强了肝癌细胞的体内成瘤能力;其中a为肿瘤注射入小鼠皮下后各组小鼠体内的成瘤情况,b为注射肿瘤30天取出后的鼠的体重和皮下肿瘤的净重;
图7为通过免疫印迹实验和显微荧光照片统计检测显示敲低oxct1基因/蛋白能够进一步增强血清饥饿诱导肝癌细胞发生自噬的能力;而外源过表达oxct1基因/蛋白能够显著减少血清饥饿所导致的肝癌细胞的自噬,其中a为体外肝癌细胞系中的检测结果;b为小鼠体内皮下移植肝癌肿瘤样本的检测结果;c为体外培养的细胞在不同条件下的自噬情况检测结果。
具体实施方式
下面结合具体实施例,进一步阐述本发明内容。下列实施例中未注明具体条件的实验方法,通常按照常规条件,如《分子克隆实验指南》(第三版)中所述的条件,或按照制造厂商所建议的条件。
实施例1:oxct1基因/蛋白在肝癌中受到血清饥饿刺激后表达上调,且在肝癌临床样品中表达上调
1.免疫印迹实验(westernblot)检测小鼠不同组织中基因oxct1的蛋白表达情况
方法:通过解剖裸鼠获得其脑、心脏、肝脏、肾脏、肺及胃组织样品,用组织破碎仪将各组织破碎为组织匀浆,进而通过细胞裂解液(50mmtris-cl,ph8.0,150mmnacl,5mmedta,0.1%sds,1%np-40,proteasecocktails)使各组分细胞破碎,细胞内容物(包括蛋白质)融入细胞裂解液中,在相同条件下进行细胞溶解液蛋白质定量,最终将同等量的各组分样品通过westernbolt检测分析,具体步骤为:应用sds-page电 泳分离蛋白后,将蛋白转到硝酸纤维素膜上,脱脂牛奶封闭蛋白;用分别与oxct1,bdh1,acat1和actin这四种蛋白特异性结合的单克隆抗体(购自proteintech,#12175-1-ap,#15417-1-ap,#16215-1-ap和#60008-1-ig)与其充分结合后,再用与一抗特异性结合的二抗(购自bio-rad,抗兔和抗小鼠)与其结合后,进行荧光显影,定影;将图片扫描后进行分析。
结果:如图1所示,oxct1蛋白在脑,心脏,肾脏,胃组织中过表达,在肺组织中表达水平较低,而在肝脏中缺失表达。
结果分析:肝脏是机体产生酮体的最主要器官,为了防止酮体在肝脏中被循环利用而浪费能量,正常肝脏组织中利用酮体代谢的关键限速酶oxct1蛋白表达被抑制,也就是oxct1蛋白被阻止表达是正常肝组织中的显著特点,可以用其来区分正常肝脏组织和肝癌肿瘤组织。
2.免疫印迹实验(westernblot)检测血清饥饿条件下肝癌细胞中oxct1蛋白表达情况
方法:将不同肝癌肿瘤细胞系和永生化的正常肝细胞进行血清饥饿处理,即相对于正常10%胎牛血清(gibcobrl)培养基的基础上将培养细胞的胎牛血清降低为0%。以此方式血清饥饿处理细胞24,48和72小时后收获细胞,通过细胞裂解液使各组分细胞破碎,使细胞内容物(包括蛋白质)融入细胞裂解液中,在相同条件下进行细胞溶解液蛋白质定量调整,最终将统一蛋白含量的各组分样品通过westernbolt检测分析,具体步骤为:应用sds-page电泳分离蛋白后,将蛋白转到硝酸纤维素膜上,脱脂牛奶封闭蛋白;用分别与oxct1和actin这两个蛋白特异性结合的单克隆抗体(购自proteintech,#12175-1-ap和#60008-1-ig)与其充分结合后,再用与一抗特异性结合的二抗(购自bio-rad,抗兔和抗小鼠)与其结合后,进行荧光显影,定影;将图片扫描后进行分析。
结果:如图2所示,oxct1蛋白在多种肝癌细胞系(hepg2,hep3b,plc)中在血清饥饿条件下表达显著升高;然而在永生化的正常肝细胞(thle-3)中表达量低且不受血清饥饿影响。
结果分析:血清饥饿是肿瘤细胞在体内生长时经常遭遇的营养压力之一,血清饥饿能诱导肿瘤细胞中oxct1蛋白的过表达,但并不影响正常 肝脏细胞中oxct1蛋白的表达,说明肝癌细胞中被激活的oxct1蛋白是特异的,是可以和正常肝脏细胞进行区分的。
3.荧光实时定量pcr(real-timepcr)检测oxct1基因在临床肝癌样品中的表达水平
方法:通过real-timepcr检测10例肝癌组织和对应10例癌旁组织中的oxct1mrna表达水平。oxct1的引物序列,包括oxct1的正向引物序列:gttggtggttttgggctatgt(seqidno:1);以及反向引物序列:agaccatgcgttttatctgctt(seqidno:2)。不同组间比较用独立t检验(常变量),两组间均数的比较用t检验,分类变量的比较用χ2检验,多组间比较用单因素方差分析。数值用均数±sd表示。
结果:如图3-a所示,real-timepcr分析显示10例肝癌病人临床组织样品中oxct1的mrna表达水平显著高于其对应的癌旁组织样品。
结果分析:oxct1在临床肝癌样品中过表达。因此,用含有特异性结合oxct1的引物(上游引物5'-gttggtggttttgggctatgt-3'(seqidno:1);下游引物5'-agaccatgcgttttatctgctt-3'(seqidno:2)的辅助诊断试剂盒检测临床样本中oxct1的扩增表达情况,为肝癌的临床诊断提供证据。临床样本的分析进一步提示oxct1可作为辅助诊断的靶点。
4.免疫印迹实验(westernblot)检测基因oxct1在临床肝癌样品中的表达水平
将各组分临床肝癌肿瘤组织及相对应的正常肝组织,用组织破碎仪破碎为组织匀浆,进而通过细胞裂解液使各组分细胞破碎,细胞内容物(包括蛋白质)融入细胞裂解液中,在相同条件下进行细胞溶解液蛋白质定量调整,最终将统一蛋白含量的各组分样品通过westernbolt检测分析,具体步骤为:应用sds-page电泳分离蛋白后,将蛋白转到硝酸纤维素膜上,脱脂牛奶封闭蛋白;用分别与oxct1和actin这两种蛋白特异性结合的单克隆抗体(购自proteintech,#12175-1-ap和#60008-1-ig)与其充分结合后,再用与一抗特异性结合的二抗(购自bio-rad,抗兔和抗小鼠)与其结合后,进行荧光显影,定影;将图片扫描后进行分析。
结果:如图3-b所示,westernblot分析显示8例肝癌病人临床组织样 品中oxct1的蛋白表达水平显著高于其对应的癌旁组织样品。
结果分析:oxct1蛋白在临床肝癌样品中过表达。因此,用含有特异性识别oxct1蛋白的ihc抗体的辅助诊断试剂盒检测到临床切片样本中oxct1蛋白的异常过表达,更能确诊为该组织样本为肿瘤样本。临床样本的分析进一步提示oxct1蛋白可作为辅助诊断的靶点。
5.oxct1蛋白过表达的临床意义
方法:所有统计学分析用spss17.0统计软件进行处理。采用kaplan-meier方法绘制生存分析曲线,并采用log-rank检验方法检测其统计学意义。检验系数p<0.05认为在统计学上有显著性差异。运用spss统计软件分析oxct1蛋白的表达与肝癌患者10年总生存率(overallsurvival,os)的关系。
结果:如图4所示,在79例肝癌病人的肿瘤组织中,oxct1蛋白过表达的肝癌病人比oxct1蛋白低表达的肝癌病人的10年总生存率(os)明显降低。其中oxct1蛋白的过表达和低表达按照oxct1蛋白表达水平的中位数来划定。
结果分析:spss统计分析结果显示oxct1蛋白过表达与肝癌病人10年总生存率呈负相关(p<0.05),oxct1蛋白过表达明确指示较差的生存预后。因此,oxct1蛋白可作为患者生存预后的潜在指标。
实施例2:构建稳定敲低oxct1的细胞系和稳定过表达oxct1的细胞系。
1.构建稳定敲低oxct1mrna和蛋白的细胞株
(1)构建shoxct1的表达质粒
制备敲低oxct1基因表达的发夹结构(hairpinstructure)shoxct1,发夹结构(hairpinstructure)整合到细胞基因组后能表达sirna,sirna与risc通过抑制mrna翻译或切割mrna,从而降低目的基因在细胞内的表达水平。上述shoxct1可由相关生物公司进行合成,本发明所用到的shoxct1包括广谱性敲低oxct1基因表达的shrna以及敲低内源oxct1基因表达的shrna。广谱性敲低oxct1的shrna购买于sigma公司shrna库,共两个shrna质粒,包括oxct1-敲低1(trc_id:trcn0000036035)和oxct1-敲低2(trc_id:trcn0000036037)。购买 的广谱性敲低oxct1质粒为plko-lenti-puro表达载体,阴性对照ntccontrol的序列为随机序列。敲低内源oxct1基因表达的shrna是根据oxct1mrna的3‘-utr序列设计的,因此使用的shrna只针对内源oxct1基因的表达有抑制作用,而对外源无3‘-utr区域的oxct1表达无影响。shoxct1的senseseq:5’-agggctgtgggataatttacc-3’(seqidno:3),而阴性对照ntccontrol的序列为随机序列。将纯化的oxct1的发卡结构正向+反向序列或者对照control的随机序列构建到plko-lenti-puro表达载体(购自addgene)中,获得shoxct1表达质粒plko-lenti-puro-shoxct1。
(2)病毒感染人肝癌细胞
分别利用lipofectamine2000(invitrogen,#11668),将获得的plko-lenti-puro-shoxct1和作为对照的plko-lenti-puro-随机序列(ntc)转入hek293细胞。并于6小时后更换dmem培养基(dmem;gibcobrl)辅以10%的胎牛血清(gibcobrl)。48小时及72小时后收集慢病毒上清,并感染肝癌细胞hepg2或hep3b细胞。用puromycin(0.5μg/ml;sigma-aldrich)筛选10天左右可得到稳定敲低oxct1蛋白的细胞株hepg2/hep3b-shoxct1,对照细胞株为转入空载体的稳定细胞株hepg2/hep3b-ntccontrol。
(3)培养稳定的敲低oxct1的肝癌细胞株
使用dmem培养基(dmem;gibcobrl)辅以10%的胎牛血清(gibcobrl)和半抑制浓度puromycin的培养基培养肝癌细胞hepg2或hep3b,并在37℃的含5%浓度二氧化碳的无菌细胞培养箱中进行培养。
2.构建稳定的oxct1mrna和蛋白过表达的细胞株
(1)构建oxct1的表达质粒
用pcr扩增oxct1cds区域的cdna序列(seqidno:4),将纯化的oxct1的cds序列构建到psin-lenti-puro表达载体(购自addgene),获得oxct1过表达质粒psin-lenti-puro-oxct1。
(2)转染人肝癌细胞
分别利用lipofectamine2000(invitrogen,#11668),将获得的psin-lenti-puro-oxct1和作为对照的psin-lenti-puro-随机序列转入 hek293细胞。并于6小时后更换dmem培养基(dmem;gibcobrl)辅以10%的胎牛血清(gibcobrl)。48小时及72小时后收集慢病毒上清,并感染人肝癌细胞hepg2或hep3b细胞。用puromycin(0.5μg/ml;sigma-aldrich)筛选10天左右可得到稳定的oxct1mrna和蛋白过表达的细胞株hepg2/hep3b-oxct1,对照细胞株为转入psin-lenti-puro空载体后构建的稳定细胞株hepg2/hep3b-evcontrol。
(3)培养稳定的过表达oxct1mrna和蛋白的细胞株
使用dmem培养基(dmem;gibcobrl)辅以10%的胎牛血清(gibcobrl)和半抑制浓度puromycin的培养基培养肝癌细胞hepg2或hep3b,并在37℃的含5%浓度二氧化碳的无菌细胞培养箱中进行培养。
实施例3:oxct1蛋白在肝癌细胞中的功能研究
1.检测肿瘤细胞增殖
(1)体外实验:细胞生长实验
通过溴酚蓝染色的方法对不同组的细胞进行细胞数目统计,检测敲低oxct1基因/蛋白和外源过表达oxct1基因/蛋白的肝癌细胞生长速率的变化。简述如下:将实验组细胞(hepg2/hep3b-shoxct1和hepg2/hep3b-oxct1)或对照组细胞(hepg2/hep3b-ntccontrol和hepg2-evcontrol)按5×104个/孔接种于24孔培养板中,24小时后将dmem培养基(dmem;gibcobrl)中的10%胎牛血清(gibcobrl)替换为0%或1%,每隔24小时将对应孔中的细胞消化吹散成单个细胞,用溴酚蓝稀释至一定倍数后将细胞稀释悬液滴加入血球计数板中,在显微镜下对细胞数目进行统计,最后与稀释倍数相乘得到每孔细胞数,本实验平行重复3次。
结果:如图5-a和5-b所示较对照组细胞hepg2/hep3b-ntccontrol和hepg2/hep3b-evcontrol(图中ntc和ev曲线),敲低oxct1蛋白的肝癌细胞在血清饥饿后增殖明显减慢(图中oxct1敲低1/2曲线),而在敲低内源oxct1后过表达外源oxct1基因/蛋白的肝癌细胞增殖明显加快(图中oxct1过表达曲线)。
结果分析:细胞计数实验结果显示敲低oxct1蛋白能抑制肝癌细胞hepg2或hep3b在血清饥饿条件下的生长,而过表达oxct1蛋白能促进肝癌细胞hepg2或hep3b在血清饥饿条件下的生长。
(2)体内实验:皮下成瘤实验
方法:将5×106个实验组细胞(hepg2-shoxct1和hepg2-oxct1)或对照组细胞(hepg2-ntccontrol和hepg2-evcontrol)分别注射到6只4周龄左右裸鼠的右测背部皮下部位。追踪注射后1个月内肿瘤的形成情况和肿瘤的大小。
结果:如图6-a和6-b所示,在小鼠体重没有明显差异的情况下,敲低oxct1的肝癌细胞(hepg2-shoxct1)形成的肿瘤体积和重量明显小于对照组(hepg2-ntccontrol),而过表达oxct1基因/蛋白的细胞(hepg2-oxct1)形成的肿瘤体积和重量明显大于对照组(hepg2-evcontrol)。
结果分析:实验结果显示敲低oxct1基因/蛋白的表达减弱了肝癌细胞的体内成瘤能力,而过表达oxct1基因/蛋白增强了肝癌细胞的体内成瘤能力。
2.检测细胞自噬
(1)通过免疫印迹实验(westernblot)的方式检测oxct1基因/蛋白对于体外肝癌细胞自噬的影响
lc3蛋白是细胞内自噬标志物,当细胞发生自噬时,胞浆型lc3(即lc3-i)会酶解掉一段多肽,转变为(自噬体)膜型lc3(即lc3-ii),通过检测lc3-ii/i比值的大小可以得到细胞自噬水平的高低情况。
方法:将肝癌细胞(hepg2-shoxct1和hepg2-oxct1)或对照组细胞(hepg2-ntccontrol和hepg2-evcontrol)分别进行血清饥饿处理48小时,进而通过细胞裂解液使各组分细胞破碎,细胞内容物(包括蛋白质)融入细胞裂解液中,在相同条件下进行细胞溶解液蛋白质定量调整,最终将统一蛋白含量的各组分样品通过westernbolt检测分析,具体步骤为:应用sds-page电泳分离蛋白后,将蛋白转到硝酸纤维素膜上,脱脂牛奶封闭蛋白;用分别与lc3,oxct1和actin这三种蛋白特异性结合的单克隆抗体(购自proteintech,#12135-1-ap,#12175-1-ap和#60008-1-ig)与其充分结合后,再用与一抗特异性结合的二抗(购自bio-rad,抗兔和抗小鼠)与其结合后,进行荧光显影,定影;将图片扫描后进行分析。
结果:如图7-a所示,在血清饥饿条件下敲低oxct1基因/蛋白的肝癌细胞(hepg2-shoxct1)中lc3-ii/i的比值明显大于对照组(hepg2-ntccontrol),而过表达oxct1蛋白的肝癌细胞(hepg2-oxct1)中lc3-ii/i的比值明显小于对照组(hepg2-evcontrol)。
结果分析:实验结果显示敲低oxct1基因/蛋白的表达增加了肝癌细胞在血清饥饿下的自噬水平,而过表达oxct1基因/蛋白减少了肝癌细胞在血清饥饿下的自噬水平。
(2)通过免疫印迹实验(westernblot)的方式检测oxct1对于体内肝癌组织细胞自噬的影响
方法:将动物实验中裸鼠皮下形成的肝癌组织(hepg2-shoxct1和hepg2-oxct1)或对照组组织(hepg2-ntccontrol和hepg2-evcontrol)分别进行匀浆超声破碎,进而通过细胞裂解液使各组分细胞破碎,细胞内容物(包括蛋白质)融入细胞裂解液中,在相同条件下进行细胞溶解液蛋白质定量调整,最终将统一蛋白含量的各组分样品通过westernbolt检测分析,具体步骤为:应用sds-page电泳分离蛋白后,将蛋白转到硝酸纤维素膜上,脱脂牛奶封闭蛋白;用分别与lc3,oxct1和actin这三种蛋白特异性结合的单克隆抗体(购自proteintech,#12135-1-ap,#12175-1-ap和#60008-1-ig)与其充分结合后,再用与一抗特异性结合的二抗(购自bio-rad,抗兔和抗小鼠)与其结合后,进行荧光显影,定影;将图片扫描后进行分析。
结果:如图7-b所示,敲低oxct1基因的小鼠体内肝癌组织(hepg2-shoxct1)中lc3-ii/i的比值明显大于对照组(hepg2-ntccontrol),而过表达oxct1的体内肝癌组织(hepg2-oxct1)中lc3-ii/i的比值明显小于对照组(hepg2-evcontrol)。
结果分析:实验结果显示敲低oxct1基因/蛋白的表达增加了体内肝癌组织细胞的自噬水平,而过表达oxct1减少了体内肝癌组织细胞的自噬水平。
(3)通过肝癌细胞内过表达gfp-lc3结合荧光共聚焦显微镜检测oxct1对肝癌细胞自噬的影响
方法:首先构建稳定表达lc3-gfp质粒的肝癌细胞株:用pcr扩增 lc3cds区域的cdna序列(seqidno:5),将纯化的lc3的cds序列构建到psin-gfp-lenti-puro表达载体(购自addgene),获得lc3过表达质粒psin-gfp-lenti-puro-lc3。利用lipofectamine2000(invitrogen,#11668),将获得的psin-gfp-lenti-puro-lc3体转入hek293细胞。并于6小时后更换dmem培养基(dmem;gibcobrl)辅以10%的胎牛血清(gibcobrl)。48小时及72小时后收集慢病毒上清,并感染肝癌细胞hepg2-shoxct1,hepg2-shoxct1,以及对照hepg2-ntccontrol,hepg2-evcontrol细胞。
然后对相应细胞进行血清饥饿处理,48小时后在共聚焦荧光显微镜下观察,最后统计散点状lc3-gfp和融合状lc3-gfp的比例。
结果:如图7-c所示,在血清饥饿的条件下,敲低oxct1的肝癌细胞(hepg2-shoxct1)中散点状lc3-gfp和融合状lc3-gfp的比例明显大于对照组(hepg2-ntccontrol),而过表达oxct1基因/蛋白的肝癌细胞(hepg2-oxct1)中散点状lc3-gfp和融合状lc3-gfp的比例明显小于对照组(hepg2-evcontrol)。
结果分析:在血清饥饿的条件下,敲低oxct1基因/蛋白的表达增加了肝癌细胞的自噬水平,而过表达oxct1基因/蛋白减少了肝癌细胞的自噬水平。
- 还没有人留言评论。精彩留言会获得点赞!