MSC‑TNFα‑AB干细胞及其制备方法和应用与流程
本发明涉及干细胞治疗技术领域,尤其涉及一种MSC-TNF α-AB干细胞及其制备方法和应用。
背景技术:
骨关节炎(osteoarthritis,OA)又名退行性骨关节炎,为关节软骨发生退行性变,并在关节边缘有骨刺形成,随着时间的延长,骨关节炎的发展越来越快。炎症可以促进软骨的退变,而软骨退变又能刺激炎症的发展。炎症主要是通过炎症因子破坏细胞基质和软骨细胞,主要的信号通路有MAPK,核转录因子信号通路、Wnt信号通路等。治疗骨关节炎的方法有药物治疗,非药物治疗如物理治疗,体育锻炼,控制体重,矫形术以及外科手术,当前主要目的是减少疼痛和维持关节功能。治疗骨关节炎的药物可分为多类:镇痛药,NSAIDS,COX-2抑制剂,类固醇,滑液补充剂等。然而,这些治疗方法的效率有限,特异性不明显,而且不能有效改善病情的进展。
在骨关节炎疾病中,TNF α是重要的促炎细胞因子,介导了一系列不同的炎症反应,当组织内高表达TNF α时促进了下游炎性细胞因子的产生,引起组织损伤。
间充质干细胞是具有自我更新能力和分化能力的组织细胞前体细胞,能够分化为一系列的间质细胞,包括成骨细胞、成软骨细胞、脂肪细胞、肌细胞和内皮细胞等。细胞治疗是再生医学发展的一个重要分支。越来越多的研究发现,间充质干细胞能够修复组织损伤,达到一定的治疗效果。因此,间充质干细胞具有负性免疫调节能力。在体外共培养的条件下,间充质干细胞能够抑制免疫细胞功能,包括抑制T细胞反应, 抑制树突状细胞的成熟和抗原提成,抑制B细胞的激活和增殖,降低自然杀伤(natuOAl killer,NK)细胞的增殖和毒性,促进调节性T细胞(regμLatory T Cell,Treg)生成等。研究报道,多能诱导干细胞分化成的间充质干细胞(induced pluripotent stem cell derived mesenchymal stem cell,IPS-MSC)在体外也能够抑制NK细胞的毒性,CD4+T细胞能够分化为一系列的细胞亚群保护机体免受病原体伤害,包括辅助性T细胞1(Thelp1)和辅助性T细胞2(Thelp2)。研究发现,间充质干细胞能够抑制Th1细胞的IFN-γ分泌,促进Th2细胞的白细胞介素4(interleokin 4,IL-4)释放。MSC分泌的bFGF,VEGF,SDF-1,angiopoietin-1,HGF,IGF,PDGF,SFRP,TGF,MMP9等有利于损伤的修复,是MSC发挥保护作用的关键因子。
MSC治疗OA有以下优势:1、基础研究证实MSC在体外可分化成骨、软骨、脂肪、腱、肌肉等细胞,可能参与受损组织的再生修复;关节病变可以促进MSC向病变滑膜聚集,从而修复损伤的关节组织。2、MSC能分泌多种细胞因子,具有营养作用,能促进干细胞的增殖和分化。3、MSC具有独特的免疫调节作用,自体或异体MSC能明显抑制T淋巴细胞的增殖活化,对免疫网络的调节起重要作用,有望从根本上调整患者病态免疫系统。4、MSC具有驱化作用,可以组织炎性介质的释放,减轻炎症反应,减轻组织损伤,有利于组织病情进展。
目前,国内外尚无将MSC和TNF α抗体结合的报道,而传统治疗骨关节炎的手段,病情复发率高,副作用大且治疗效果并不明显, 因此将MSC和TNF α抗体有效结合,使TNF α抗体在MSC中可以被炎症因子TNF α启动,有望成为基因治疗骨关节炎的关键点。
技术实现要素:
本发明所要解决的技术问题是提供一种MSC-TNF α-AB干细胞及其制备方法,该MSC-TNF α-AB干细胞在炎症环境中过表达TNF α抗体,并结合MSC本身的免疫调节和抗炎作用,有效缓解骨关节炎的炎症浸润。
本发明的另一目的是提供一种启动子,该启动子可以在炎症因子TNF α存在的情况下正向激活表达TNF α-AB。
为实现上述目的,本发明采用的技术方案如下。
一种MSC-TNF α-AB干细胞,所述MSC-TNF α-AB干细胞为重组间充质干细胞,MSC-TNF α-AB干细胞中整合有TNF α抗体基因;所述TNF α抗体基因的序列如SEQ ID NO:1所示。
一种可以使MSC-TNF α-AB干细胞在炎症因子TNF α存在的情况下正向激活表达TNF α-AB的启动子,所述IL-CAG启动子的序列如SEQ ID NO:2所示。
本发明还提供一种MSC-TNF α-AB干细胞的制备方法,包括以下步骤:
(1)设计合成TNF α抗体基因以及IL-CAG启动子,TNF α抗体基因与IL-CAG启动子可操作地连接;构建慢病毒表达质粒TNF α-GFP;
(2)将慢病毒表达质粒TNF α-GFP加入慢病毒包装质粒后共同转染包装细胞;
(3)收集包装细胞产生的病毒上清并感染间充质干细胞,培养,得到可在炎症因子TNF α刺激下中过表达TNF α-AB的MSC-TNF α-AB干细胞。
进一步地,所述步骤(1)中,IL-CAG启动子的设计合成步骤为:将IL-10启动子与CAG启动子相结合,合成并克隆进穿梭质粒pGFP,得到IL-CAG 启动子及包含IL-CAG 启动子的穿梭质粒TNF α-GFP。当组织环境中TNF α高表达,IL-CAG启动子可以正向激活表达TNF α-AB,可明显减缓骨关节炎的炎症浸润反应。
本发明设计相关启动子控制TNF α抗体的表达,当TNF α被激活时,相应的TNF α抗体也被激活同时高表达,其作用机理是:TNF α最重要的一个下游信号通路是NF-κB转录因子的激活;TNF α激活NF-κB通路有多种信号分子参与,包括TNFR相关因子、 RIP(receptorinteOActingprotein)、MAP3K(mitogen-activatedproteinkinaseki-nase3)、 IKK复合物等;本发明从众多下游因子中成功筛选出与TNF-α关系密切的白介素10(IL-10),当TNF α表达升高时,可激活IL-10的表达,据此设计的IL-CAG启动子可正向激活表达TNF α-AB。
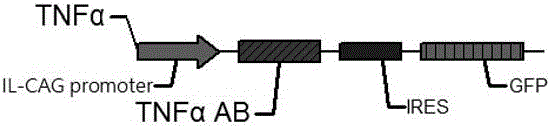
进一步地,所述步骤(1)中,慢病毒表达质粒TNF α-GFP为IRES介导的TNF α抗体基因表达模式,TNF α抗体基因受IL-CAG启动子调控。
进一步地,所述步骤(1)中,慢病毒表达质粒TNF α-GFP的构建包括以下步骤:
A、连接:取穿梭质粒TNF α-GFP,用Xho1和Xba1双酶切3h~过夜;将酶切后的PCR产物经凝胶电泳后,切胶收回预期大小的TNF α-AB基因片段;取经过酶切和纯化的穿梭质粒TNF α-GFP作为载体,加入3倍摩尔数的TNF α-AB基因片段进行连接,连接反应体系以20μL计包括如下组分:载体:50ng;10× Ligation Buffer:2μL;T4 DNA ligase:0.5μL;加双蒸水或MiLLiQ水至20μL;得到TNF α-AB质粒载体。
B、TNF α-AB质粒载体的转化:取步骤A中连接反应体系12μL加到50μL大肠杆菌DH5α感受态细胞,混匀,冰浴;再进行热休克,42℃金属浴后,迅速置于冰上冷却,加入500μL已温育至37℃的无抗性的LB培养基,于37℃温度下摇床培养,离心,去部分上清后涂布于含AMP的LB培养基,于37℃温度下倒置培养过夜;挑取单克隆菌落于无抗性的LB培养基中,按体积比1:300加入AMP,于37℃温度下200rpm摇床培养,得到培养液;
C、质粒抽提:取过夜的培养液,使用质粒小提试剂盒进行质粒抽提,得到慢病毒表达质粒TNF α-GFP。
本发明体外用慢病毒方法在间充质干细胞中过表达TNF αAB基因,将改造过的MSC进行移植,使经过改造的MSC对缓解骨关节炎的能力得到明显增强。
进一步地,所述MSC-TNF α-AB干细胞在治疗骨关节炎的应用。传统使用非甾体类抗炎药物和满作用抗风湿药的治疗手段,其病情复发率高,副作用明显,且不能改变病情的进展。本发明的MSC-TNF α-AB干细胞可加强MSC的抗炎与免疫调节能力,无明显的副作用,有效缓解骨关节炎的炎症反应,优化了骨关节炎的疗法。
本发明还提供一种组合物,包含有效量的MSC-TNF α-AB干细胞以及在药学上可接受的载体或赋形剂。
本发明MSC-TNF α-AB干细胞可以单独或以药物组合物的形式给药。本发明药物组合物可根据给药途径配成各种适宜的剂型。使用一种或多种生理学上可接受的载体,包含赋形剂和助剂,它们有利于将MSC-TNF α-AB干细胞加工成可以在药学上使用的制剂。适当的制剂形式取决于所选择的给药途径,可以按照本领域熟知的常识进行制造。所述MSC-TNF α-AB干细胞存在于细胞相容的介质中如生理盐水中等。
本发明的有益效果在于:
本发明利用关键靶点炎症因子TNF α高表达的特点,将TNF α抗体(TNF α-antibody,TNF α-AB)基因与MSC相结合,在MSC中过表达TNF α抗体,并结合MSC本身的免疫调节和抗炎作用,得到能够高效缓解骨关节炎的治疗方法;
本发明从TNF-α众多下游因子中成功筛选出与TNF-α关系密切的IL10,将IL-10启动子与CAG启动子相结合,合成并克隆进穿梭质粒pGFP得到IL-CAG启动子(IL-CAG promoter),可正向激活表达TNF α-AB;通过质粒调控系统可精确调控TNF α水平,从而避免过敏反应和其他不良反应,当TNF α升高时,启动IL-CAG启动子,启动子后的TNF α抗体会被启动表达,从而可用于治疗骨关节炎;
本发明构建的干细胞MSC TNF α-AB在炎症环境中会被TNF α炎症因子激活,更稳定地结合到炎症位点,从而加强MSC的抗炎与免疫调节能力,为临床优化MSC疗法开拓了新的思路。
附图说明
利用附图对发明作进一步说明,但附图中的实施例不构成对本发明的任何限制,对于本领域的普通技术人员,在不付出创造性劳动的前提下,还可以根据以下附图获得其它的附图。
图1为TNF α-AB激活所需的作用元件。
图2为IL-CAG promoter与TNF α-AB结合的示意图。
图3为第三代慢病毒包装质粒图谱,由addgene公司提供。
图4为穿梭质粒pGFP的图谱,由广州复能基因有限公司提供。
图5为穿梭质粒TNF α-GFP的图谱。
图6为慢病毒感染小鼠MSC后的效率鉴定图。
图7为RT-PCR检测MSC在慢病毒感染后,TNF α-AB的表达情况。
图8为western blotting检测细胞中TNF α-AB的表达情况。
图9为HE染色检测经治疗后组织炎症浸润情况是否改善。
图10为ELISA技术经治疗后炎症小鼠脾脏细胞的增殖检测。
图11为ELISA技术检测经治疗后炎症小鼠炎症因子的表达。
图12为Real-time PCR技术检测经治疗后炎症小鼠mRNA水平上炎症因子的表达。
具体实施方式
下面结合实施例及附图1-12对本发明作进一步的说明。
本发明构建含有TNF α-AB基因的慢病毒表达质粒,加入包装质粒后共同转染包装细胞,收集病毒上清并感染MSC,使MSC成功过表达TNF α-AB,从而有效缓解骨关节炎的炎症浸润。
本发明的技术路线主要包括以下步骤:
一、构建骨关节炎小鼠模型;
二、利用慢病毒包装系统在MSC中过表达TNF α-AB;
三、检测MSC-TNF α-AB与野生型MSC中的表达差异;
四、验证MSC-TNF α-AB在两种细胞中的差异表达是否对骨关节炎炎症的缓解作用增强。
五、检测MSC-TNF α-AB在实际情况中的各类炎症因子的变化。
实施例一、制备骨关节炎炎症浸润小鼠模型
将纯化的天然胶原溶于11M的醋酸制成浓度为1mg/mL的溶液,与等量的福氏佐剂或不完全佐剂混合成稳定的乳剂;用1mL乳剂分4~6个部位注射小鼠背部皮内,注射部位会出现小溃疡(在7~10天后自愈);21天后,将15mg胶原溶于15mL1M的醋酸中,注入小鼠腹腔再次免疫。
初次注射后14~60天后,出现关节红肿,通常发生于关节远端,后足踝关节是最常累积的部位。急性期病理改变可分为两期,免疫10天后,关节内只有一些纤维沉积物而滑膜细胞无改变;12天后,肉眼可见踝关节红肿,膝关节出现红肿,光镜下滑膜细胞增多,层数增至3~7层,并向软骨骨面爬行,滑膜及滑膜下组织有纤维沉积。电镜下则见滑膜细胞变圆,细胞间接触减少,丝状伪足增多,细胞内溶酶体和内质网增大、增多;19天后进入第二期,增生的滑膜由6~10 μm增厚至200~250μm,形成血管翳,其中有大量单核细胞、多形核巨细胞、巨噬细胞,在微血管周围形成微脓肿,可见到单核细胞侵入软骨连接处的软组织;6~7周后,炎症进入慢性期,水肿仍存在,浸润的细胞以CD+4的T细胞为主,关节内出现瘢痕,颗粒状增生组织,软骨及软骨下骨被 破坏,最后导致骨关节炎形成。
实施例二、TNF α-AB抗体片段的设计合成,慢病毒制备,MSC感染
本实验所需的包装质粒购于addgene公司,质粒图谱见图3,图3包括图3A、图3B及图3C;穿梭质粒pGFP购于广州复能基因有限公司,质粒图谱见图4;上述质粒的信息见表1;慢病毒包装细胞293FT购于Invitrogen公司(目录号R700-07);MSC从C57/BL6小鼠骨髓提取;C57/BL6小鼠购于香港大学实验动物中心。
本实验所需的目的片段序列TNF α-AB如SEQ ID NO:1所示。
本实验所需试剂见表1。
表1 慢病毒包装质粒及穿梭质粒信息
本实验中293FT及小鼠骨髓MSC培养基成分见表2。
表2 慢病毒制备及MSC感染所需的试剂信息
本实验中293FT 及小鼠骨髓MSC 培养基成分见表3。
表3 293FT 细胞及小鼠骨髓MSC 培养基配方
实验过程:
2.1表达TNF α-AB抗体质粒的作用元件构建及IL-CAG promoter合成
提供TNF α-AB(TNF α抗体,TNF α-antibody)序列(SEQ ID NO:1)。本发明设计了专门的启动子IL-CAG promoter序列(SEQ ID NO:2)及作用元件(见图1),在香港大学分子中心合成。
IL-CAG启动子的设计合成步骤为:将IL-10启动子与CAG启动子相结合,合成并克隆进穿梭质粒pGFP,得到IL-CAG 启动子(见图2)及包含IL-CAG 启动子的穿梭质粒TNF α-GFP(见图5)。具体地,选取小鼠IL-10的60-420bp片段(SEQ ID NO:7)与CAG 启动子的部分序列(catcaagtgtatcatatgccaagtacgccccctattgacgtcaatg )(SEQ ID NO:8)相融合。启动子的合成步骤为本领域技术人员的常规手段,这里不再赘述。该启动子后表达TNF α抗体蛋白。本发明的质粒调控系统可精确调控TNF α水平,从而避免过敏反应和其他不良反应。当TNF α升高时,会启动IL-CAG promoter,IL-CAG promoter启动子被启动后,启动子后的TNF α抗体会被启动表达,从而达到实验目的。
慢病毒表达质粒TNF α-GFP的构建包括以下步骤:
A、连接:取1-2μg穿梭质粒TNF α-GFP,用Xho1和Xba1双酶切过夜,或酶切3h以上,尽量确保酶切充分,否则后续会导致产生很多自连的克隆;将酶切后的PCR产物经凝胶电泳后,切胶收回预期大小的TNF α-AB基因片段;取1-2μg经过酶切和纯化的穿梭质粒TNF α-GFP作为载体,加入3倍摩尔数的TNF α-AB基因片段进行连接,连接反应体系以20μL计包括如下组分:载体:50ng;10× Ligation Buffer:2μL;T4 DNA ligase:0.5μL;加双蒸水或MiLLiQ水至20μL;得到TNF α-AB质粒载体。
B、TNF α-AB质粒载体的转化:取混合物12μL加到50μL感受态细胞,感受态细胞为大肠杆菌DH5α,轻轻混匀,冰浴30 min; 再进行热休克,42℃金属浴50s,迅速置于冰上1~2 min,加入500μL已温育至37℃无抗性的LB培养基;37℃,200rpm摇床培养1h,8000rpm离心,去部分上清后涂布于含AMP的LB平板上,37℃倒置培养过夜;挑取单克隆菌落于无抗性的LB培养基中,按体积比1:300加入AMP,于37℃温度下200rpm摇床培养12 h,得到培养液;
C、质粒抽提:使用质粒小提试剂盒Lot# L0802进行质粒抽提:
1)柱平衡,吸附柱加入500μL平衡液,12000rpm离心1min;
2) 取过夜的培养液3mL,分两次加入1.5mL EP管中,12000 rpm离心1min,尽量吸出上清液,收集菌体细胞;
3)向沉淀中加250μL溶液P1,用枪彻底悬浮沉淀;
4)加入250μL 溶液P2,温和上下翻转6~8次,使菌体充分溶解;
5)加入350μL溶液P3,立即温和上下翻转6~8次直至出现絮状沉淀,12000rpm离心10min;
6)将上清加入吸附柱中,12000rpm离心30s,重复该步操作一次;
7)加入600μL的漂洗液,12000rpm离心30s,重复该步操作一次;
8)12000rpm离心2min,去除漂洗液,室温开盖晾干;
9)加入40μLddH2O洗脱,静置2min中,12000rpm离心2min,得到慢病毒表达质粒TNF α-GFP。
2.2慢病毒制备
细胞转染前 24h, 消化 293FT 细胞并计数, 以 5×106 接种于10cm培养皿中, 使其转染时细胞融合率达 80%~90%。 按照Lipofectamine 2000 说明书的步骤, 将慢病毒表达质粒TNF α-GFP及穿梭质粒pGFP分别加入慢病毒包装质粒后,转染包装细胞293FT。质粒用量分别为(10μg pGFP+6.52μg pMDL+2.52μg pRSV-REV+3.52μg pMD2.G)及(36μg TNF α-GFP+12μg pMDL+6μg pRSV-REV+18µg pMD2.G)。转染 48h后,收获包装细胞293FT产生的病毒上清,置于4℃温度下暂存。加入新鲜293FT培养基,再培养24h,第二次收集病毒上清,与第一次收集的病毒上清混合,经 0.45μm 滤膜过滤并按照Peg-it说明书将病毒浓缩。分装浓缩后的病毒液,置于-80℃温度下保存。
2.3慢病毒感染 MSC及感染效率的检测
2.3.1小鼠骨髓MSC提取
小鼠MSC细胞通过骨髓冲洗法获取。通过贴壁培养法去杂细胞,大约传代4次后,镜下可见MSC为较规则的长梭形,排列有方向性,呈现漩涡状、辐射状生长趋势。
2.3.2慢病毒感染MSC及感染效率检测消化MSC细胞并计数,以 1×106每孔的密度接种于 6 孔板中,将病毒上清及 Polybrene(终浓度为 8µg/mL)加入6孔板中。感染 48h后在荧光倒置显微镜下观察 MSC中绿色荧光蛋白(GFP)的表达情况。
在488nm 波长激发光下,可见绝大多数细胞发出绿色荧光,证实靶细胞MSC可被成功感染。表达对照载体(对照载体为pGFP,不表达TNF α-AB)的MSC记为MSCe,表达载体TNF α-AB的MSC记为MSC-TNF α-AB。未进行慢病毒感染的MSC作为对照组,无GFP表达(图6)。
2.3.3慢病毒感染MSC后TNF α-AB基因的表达鉴定
分别收集1×106 的MSC,MSCe及MSC-TNF α-AB,按照QIAGEN公司的RNeasy Mini Kit(目录号74104)提取细胞总RNA, 根据TakaOA公司的PrimeScript First StOAnd cDNA Synthesis Kit(目录号6110A)逆转录试剂盒说明书, 将总RNA 逆转录为 cDNA,用 TaKaOA Taq™(目录号R001A)并以 60℃为退火温度进行PCR。
PCR所用引物序列如下:
小鼠MSC-TNF α-AB基因产物长度(257bp):
F:5’- GCTAGAGTGGCTCTCGCA- 3’(SEQ ID NO:3)
R:5’- CGAAGGGGCGGAACTTAA - 3’(SEQ ID NO:4)
小鼠β-actin 基因(Genbank 登录号:NM_007393.3) (产物长度448bp):
F:5’-AGAGGGAAATCGTGCGTGAC - 3’(SEQ ID NO:5)
R:5’-TGCTGGAAGGTGGACAGTGAG - 3’(SEQ ID NO:6)
结果显示,相比阴性对照组MSC以及空载体MSCe对照组, 重组载体MSC-TNF α-AB病毒感染后的MSC-TNF α-AB细胞中TNF α-AB表达水平显著提高 (图7),证明重组载体MSC-TNF α-AB病毒感染 MSC效果良好,可使其稳定过表达TNF α-AB。
实施例三、检测构建的新型干细胞系MSC-TNF α-AB可被炎症因子TNF α特异调节启动
本实施例为检测体外MSC细胞培养中在加入炎症因子TNF α后TNF α-AB的表达情况。
3.1 MSC-TNF α-AB细胞培养:
MSC-TNF α-AB细胞培养基为:在DMEF/F12培养基中含有10%胎牛血清(FBS),100U/mL青链霉素,1%非必须氨基酸,0.1%β-巯基乙醇,5ng/mL的EGF,5ng/mL的FGF。
1)在进行无菌培养前,将实验室所需材料高压灭菌;紫外灯照射30min;穿戴细胞间专用实验服和手套,用75%酒精擦拭双手;显微镜下,观察细胞状态,细胞密度汇合至70%以上则需传代,关闭紫外灯,打开风机,同时用酒精棉球擦拭超净台,点燃酒精灯。
2) 在打开培养皿盖,去除细胞培养上清, PBS洗涤后,去除PBS。
3) 将胰酶加入培养皿内,在培养箱放置13min。显微镜下随时观察,见到细胞的突起消失,变圆时,立即加入等体积完全培养基终止消化。注意不要消化时间过长,否则细胞会被胰酶消化掉。
4) 终止后移液器轻轻吹打,使其从瓶壁上脱落分散到培养基中,吸取细胞悬液并转移至EP管中,400xg离心3min。重悬细胞,并根据实验目的和细胞习性按不同比例分皿继续培养。
5) 传代后观察,传代或换液24~48h,注意细胞是否被污染,污染的细胞培养液变浑浊,镜下可见有大量菌丝或其他悬浊物。如果细胞生长缓慢,生长特性改变,胞质内颗粒性物质增多,尽管培养液不变浑浊,考虑可能有支原体污染。
3.2 Western Blot检测MSC-TNF α-AB被炎症因子TNF α激活情况
选取50μmoL/L浓度的TNF α炎症因子处理对数期的MSC-TNF α-AB细胞,置于光镜下观察,细胞体外生长良好,细胞呈梭形,轮廓清楚。为了确定TNF α-AB的表达情况,选取了MSC组(对照组),TNF α-组(未加炎症因子TNF α刺激)和TNF α+组(已加炎症因子TNF α刺激)同时进行了总蛋白提取。所述蛋白提取使用RIPA(Sigma,目录号R0278)试剂,按照说明书进行。
调整细胞密度为70%-80%,PBS洗细胞两遍,加入8mL无酚红DMEM(GIBCO,目录号21063-029)。将细胞裂解后收集蛋白,所得细胞蛋白经(BOAdford (BIO-OAD), 目录号5000202)方法进行定量后,用于常规western blotting实验。检测靶蛋白为TNF α-AB,内参照为β-actin(Santa Cruz,目录号SC-47778),Western Blot结果显示TNF α+组TNF α-AB表达明显(图8)。
TNF α是重要的炎症因子之一,加入TNF α炎症因子处理MSC-TNF α-AB细胞符合炎症浸润的实际情况。实验表明,经过本发明改造过的新型细胞系,在无TNF α炎症因子刺激时,不会表达TNF α-AB。 而在TNF α炎症因子的刺激下,发挥其正反馈调节上调TNF α-AB的表达非常明显,这说明本发明的细胞系MSC-TNF α-AB达到预期的实验目的。
实施例四、 HE染色鉴定炎症组织
小鼠骨关节炎是经典的移植模型,本实施例应用该移植模型,分别将2×106 MSC-TNF α-AB,MSC,以及等体积的PBS(Control组)移植到患处。一周以后将小鼠麻醉,颈椎脱臼处死,采集小鼠组织,4%多聚甲醛固定后进行常规石蜡包埋和HE染色,观察移植部位细胞的保存情况和免疫细胞的浸润情况。HE染色分析显示,Control组炎症细胞浸润明显。MSC-TNF α-AB组明显降低了炎症细胞的浸润,MSCs组炎症缓解情况介于两组之间,随机选取每只受体小鼠的三张切片并在高倍视野下计数(400倍),统计受体小鼠的炎症细胞数。
结果显示,PBS组浸润的平均炎症细胞数为235±70.4,MSC-TNF α-AB组浸润的平均炎症细胞数为103.4±29.6,MSCs组浸润的平均炎症细胞数为112.8±15.2。该数据表明,MSC-TNF α-AB移植组更明显的降低炎症反应,缓解炎症症状,已经达到本发明的预期治疗效果(图9)。
实验例五、炎症因子变化检测
本发明采集了受体小鼠脾脏,分离小鼠脾脏细胞进行了脾细胞增殖检测,CD4+T细胞,CD3+T细胞,TH1以及TH2细胞亚群分析检测,以及炎症因子mRNA水平和血清中常规炎症因子蛋白水平的检测。
将小鼠脾细胞体外培养72h,在到达12h前,加入1×BrdU。并进行BrdU和MTT检测。结果显示:在细胞增殖方面,Control组炎症细胞增殖明显,MSC-TNF α-AB组具有较低的增殖水平,MSC组处于两者之间。这表明MSCs-TNF AB能够有效的抑制炎症细胞的增殖情况(图10)。
本发明分析检测脾细胞种T细胞的亚群变化。检测发现,MSC-TNF α-AB组治疗的受体小鼠脾细胞种Th细胞和Th2以及整体CD4+T细胞亚群比例明显降低,结果表示,MSC-TNF α-AB治疗明显抑制了小鼠体内T细胞数目,降低了Th1细胞和Th2细胞亚群比例.
为了进一步确定炎症细胞的表达情况,本发明检测是否整体T细胞的比例有所降低,CD3是T细胞的表面标记物,本发明检测了被治疗小鼠脾细胞CD3+的T细胞比例以及FOXp3的调节性T细胞(Treg)。结果显示,MSC-TNF α-AB 组CD3T细胞比例明显降低,由23.1%下降至17.4%,Treg比例明显上升,由2.9%上升至4.32%。以上结果表明,MSC-TNF α-AB能够有效抑制T细胞比例,促进调节性T细胞增加。此外本发明通过Real-timePCR和ELISA技术分别检测了脾脏和血清中常规炎症因子IL-2,IL-4,IL-10,IFN-γ,TGF-β和Foxp3的表达。ELISA实验使用试剂盒(USCN, 目录号E91866Mu),按照说明书进行。其中IL-2,IFN-γ为TH1细胞炎症因子,TGF-β能够有效促进T细胞向Treg分化并诱导Treg表达Foxp3和IL-10。检测发现,MSC-TNF α-AB抑制了血清中IL-2,IL-4的表达,促进了IL-10,IFN-γhe和TGF-β1的表达(图11)。
在mRNA水平上,MSC-TNF α-AB组抑制了IL-2,IL-4的表达,促进了IL-10,Foxp3和TGF-β1的表达(图12)。以上结果表明,MSC-TNF α-AB治疗抑制了促炎症因子的表达和释放,促进抑炎症因子的表达和释放。
作为一种新型干细胞治疗方法,本发明构建的新型细胞系MSC-TNF α-AB可明显减缓炎症反应及抑制多种炎症因子,为骨关节炎的炎症浸润反应起到了有效的缓解作用。
本发明还提供一种组合物,包含有效量的MSC-TNF α-AB干细胞以及在药学上可接受的载体或赋形剂。本发明的MSC-TNF α-AB干细胞可以单独或以药物组合物的形式给药。其制剂形式取决于所选择的给药途径,可以按照本领域熟知的常识进行制造,所述MSC-TNF α-AB干细胞存在于细胞相容的介质中如0.9%生理盐水中或制成缓控制剂等。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
<110>连祺周
<120> MSC-TNF α-AB干细胞及其制备方法和应用
<160>8
<210>1
<211>465
<212>DNA
<213>人工序列
<400>1
atgctacgct cttcgtccca gaactcatcg gataagcctg tcgcgcacgt ggtagccaat 60
caccaagtgg aagagcagct agagtggctc tcgcaacgcg ccaatgcgct actggctaac 120
ggtatggacc tgaaggacaa tcaactggta gttccggcag acggtctata cctggtatac 180
tccaggtgct tttcaaggga caaggttgcc ctgactatgt gctgctaacg cacactgttt 240
cacggttcgc tatttcgtac caggaaaagg ttaacctgct atccgcggtt aaatccccgt 300
gcccaaagga cactcccgaa ggggcggaac ttaagccttg gtacgaacct atttacctgg 360
gtggagtttt ccaacttgaa aaaggcgacc agctttcagc cgaagtaaat cttcccaagt 420
acctggactt tgcggaatct gggcaagttt actttggggt catag 465
<210>2
<211>707
<212>DNA
<213>人工序列
<220>
<223>IL-CAG 启动子
<400>2
tgggatctga gcttcttcgt gaaacacggg gcagaggagg caccagaact ctcctctgac 60
caactgcccc acagcacaca tatcctcaaa ggatagtctt gaatacgtga tggaagaatt 120
aaagagagtg aggtctgaag aaaatcagcc ctctcggggt ttcctttggg taactgagtg 180
ctaaggtgac ttccgagtca gcaagaaata tcggacgttc aacccaggtt gagtggagga 240
aacaattatt tctcaatcct aatatgttct ggaatagccc atttatccac gtcattatga 300
cctgggagtg cgtgaatgga atccacagat gagggcctct gtacatagaa cagctgtctg 360
cctcaggaaa tacaactttt agtattgaga agctaaaaag aaaaaaaaat taaaagagag 420
gtagcccata ctaaaaatag ctgtaatgca gaagttcatt ccgaccagtt ctttagcgct 480
tacaatgcaa aaaaaaggga aaggaaaaaa aaaaagaaag aaattaaact caaaaattgc 540
atggtttaga agagggagga ggagcctgaa taacaaaaac ctttgccagg aaggccccac 600
tgagccttca gtataaaagg gggaccaaga acaggaggtc tacatttaga gacttgctct 660
tgcactacca aagccacaag gcagccttgc agaaaagaga gctccat 707
<210>3
<211>18
<212> DNA
<213>人工序列
<400>3
gctagagtgg ctctcgca 18
<210>4
<211>18
<212> DNA
<213>人工序列
<400>4
cgaaggggcg gaacttaa 18
<210>5
<211>20
<212> DNA
<213>人工序列
<400>5
agagggaaat cgtgcgtgac 20
<210>6
<211>20
<212> DNA
<213>人工序列
<400>6
tgctggaagg tggacagtga g 20
<210>7
<211>420
<212> DNA
<213>人工序列
<400>7
atgctacgct cttcgtccca gaactcatcg gataagcctg tcgcgcacgt ggtagccaat 60
caccaagtgg aagagcagct agagtggctc tcgcaacgcg ccaatgcgct actggctaac 120
ggtatggacc tgaaggacaa tcaactggta gttccggcag acggtctata cctggtatac 180
tccaggtgct tttcaaggga caaggttgcc ctgactatgt gctgctaacg cacactgttt 240
cacggttcgc tatttcgtac caggaaaagg ttaacctgct atccgcggtt aaatccccgt 300
gcccaaagga cactcccgaa ggggcggaac ttaagccttg gtacgaacct atttacctgg 360
gtggagtttt ccaacttgaa aaaggcgacc agctttcagc cgaagtaaat cttcccaagt 420
<210>8
<211>46
<212> DNA
<213>人工序列
<400>8
catcaagtgt atcatatgcc aagtacgccc cctattgacg tcaatg 46
- 还没有人留言评论。精彩留言会获得点赞!