一种自然杀伤细胞(NK细胞)培养基及其制备方法与流程
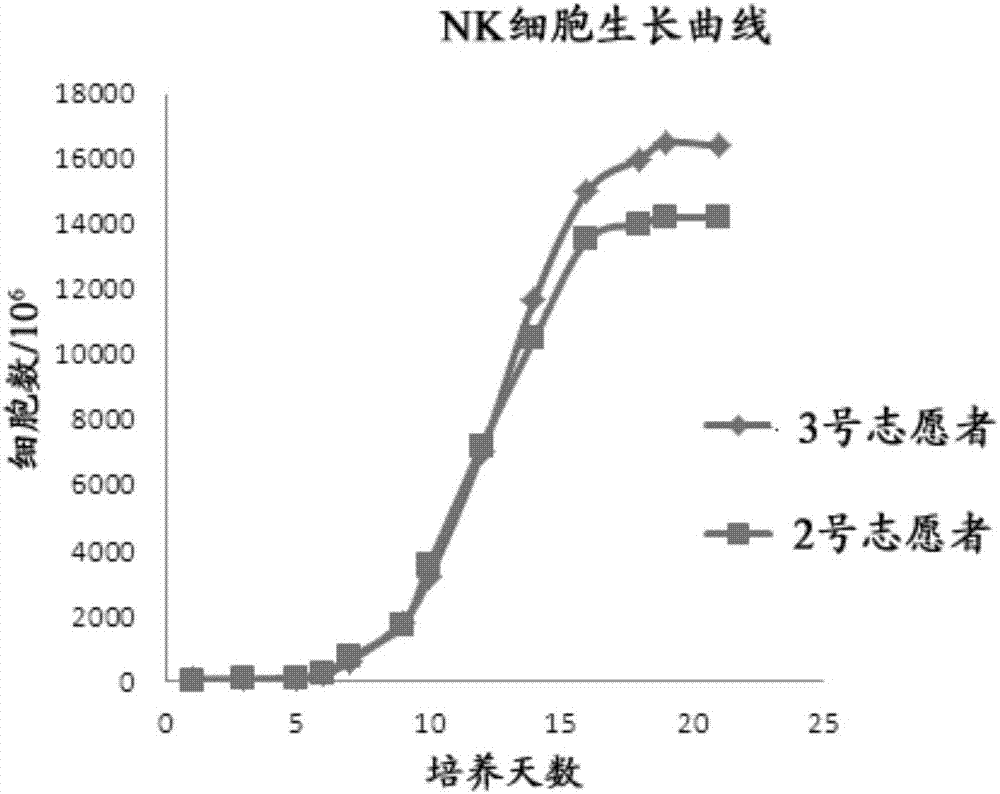
本申请大体涉及生物医学领域,具体而言,本申请涉及用于培养自然杀伤细胞(nk细胞)的培养基,使用其培养nk细胞的方法,使用该方法获得的nk细胞以及所获得nk细胞的用途。发明背景自然杀伤细胞(nk细胞)被认为是机体抗感染、抗肿瘤的第一道天然防线,是机体重要的免疫细胞,与抗肿瘤、抗病毒感染和免疫调节密切相关。nk细胞起源于骨髓来源的cd34+造血祖细胞,约占外周血淋巴细胞的5%-15%,其免疫表型特点为cd3-cd16+cd56+,主要分布于外周血、淋巴结、脾和骨髓,也可以在不同化学趋化因子作用下迁移到炎症部位。nk细胞最初被发现时被命名为大颗粒淋巴细胞,并发现其可以在无需预先致敏的情况下发挥细胞毒作用。nk细胞可直接或间接对肿瘤细胞起到杀伤作用,抑制肿瘤细胞的增殖和远处转移,起到免疫监视的作用,而且nk细胞的抗肿瘤作用具有广谱性,其不显示肿瘤杀伤的特异性和mhc限制性。有临床研究显示nk细胞功能低下的人罹患肿瘤的风险显著增加。目前nk细胞常用的扩增技术有:利用添加有多种细胞因子的组合的培养基进行培养,利用饲养层细胞激活与促进nk细胞的扩增以及利用磁珠分选等。但是这些技术普遍存在成本高、扩增倍数低、细胞纯度低、培养周期长等问题。因此,本领域目前亟需其他可用于培养nk细胞的工具和方法。发明概述第一方面,本申请提供了用于培养自然杀伤细胞(nk细胞)的培养基,其包含白介素-2(il-2)和抗肿瘤药物。在一些实施方案中,抗肿瘤药物为a群链球菌制剂。在一些实施方案中,a群链球菌制剂为沙培林或康赛宁在一些实施方案中,培养基还包含抗cd16抗体。在一些实施方案中,培养基包含用于淋巴细胞培养的基础培养基。第二方面,本申请提供了用于培养nk细胞的培养基,其包含il-2和香菇多糖。在一些实施方案中,培养基还包含自体血浆。在一些实施方案中,培养基包含用于淋巴细胞培养的基础培养基。第三方面,本申请提供了用于培养nk细胞的培养基套装,其包括第一方面所述的培养基以及第二方面所述的培养基。第四方面,本申请提供了培养nk细胞的方法,所述方法包括:(1)提供用抗cd16抗体包被的培养器;(2)将单核细胞接种于添加第一方面中不包含抗cd16抗体的培养基的步骤(1)的培养器中进行培养;以及(3)收集步骤(2)中获得的细胞,并将获得的细胞接种于第二方面所述的培养基中进行培养。在一些实施方案中,单核细胞获自个体的外周血。第五方面,本申请提供了培养nk细胞的方法,所述方法包括:(1)将单核细胞接种于第一方面中包含抗cd16抗体的培养基中进行培养;以及(2)收集步骤(1)中获得的细胞,并将获得的细胞接种于第二方面所述的培养基中进行培养。在一些实施方案中,单核细胞获自个体的外周血。第六方面,本申请提供了通过第四或第五方面所述的方法获得的nk细胞。第七方面,本申请提供了第六方面所述的nk细胞在制备用于治疗肿瘤、感染或免疫系统疾病的药物中的用途。附图简要描述图1显示了本申请的实施例中的流式细胞仪分析结果,其中显示了 在培养预定天数下,nk细胞样品的cd56/cd3(a、b、c)以及cd16/cd3(d)的表达情况。图2中显示了用本申请的示例性方法对获自2名志愿者的样品进行nk细胞扩增培养的生长曲线。发明详细描述本申请的发明人经过对nk细胞培养的大量探索和研究,开发出了新的培养基以及培养方法。本申请的培养基、培养方法以及培养得到的nk细胞具有下述一种或多种优势:1.培养操作简单、所需试剂来源广泛易得、对培养条件和设备要求低;2.培养成本低;3.培养周期短;4.培养得到的nk细胞具有理想的特性,例如,数量大、纯度高和/或诱导细胞毒性(adcc)的能力强等。因此,在第一方面,本申请提供了用于培养自然杀伤细胞(nk细胞)的培养基,其包含il-2和抗肿瘤药物。本领域技术人员能够理解,本申请的培养基应当包含培养细胞用的基础培养基,以用于向细胞提供基本的养分等。适用于本申请的培养基可以是淋巴细胞培养基。各种淋巴细胞的基础培养基是本领域技术人员公知的,可以容易地商购得到,例如,x-vivo15、aim-v、gtt561、cellgronk培养基等常用淋巴细胞培养基。il-2是一种白介素,是免疫系统中的一类生长因子,具有广泛的生物活性,是调控免疫应答的重要因子,也参与抗体反应、造血和肿瘤监视等。在本发明的一些实施方案中,培养基中il-2的使用浓度为100-10000iu/ml,优选1000iu/ml。在一些实施方案中,抗肿瘤药物为a群链球菌制剂,例如经青霉素处理的a群链球菌制剂。在一些实施方案中,抗肿瘤药物为沙培林。沙培林的主要成份为经 青霉素处理的a群溶血性链球菌的冻干品。临床试验证明,腔内施用沙培林对恶性胸腔积液疗效明显,瘤内及全身施用沙培林对实体瘤有一定疗效,可配合手术、放疗或化疗,用于恶性肿瘤的辅助治疗。在一些实施方案中,培养基中沙培林的使用浓度为0.001-0.1ke/ml,优选0.01ke/ml。在一些实施方案中,抗肿瘤药物为康赛宁。康赛宁是一种肿瘤生物反应调节剂,主要成分为经青霉素处理的a群溶血性链球菌弱毒株制成的冷冻干燥制剂。实验证明其可以直接杀死肿瘤细胞,激活宿主细胞的免疫功能。临床上,可将康赛宁与化疗合用用于治疗肺癌、头颈癌、乳腺癌等实体瘤。在一些实施方案中,培养基中康赛宁的使用浓度为0.001-0.1mg/ml,优选0.01mg/ml。在一些实施方案中,培养基还包含抗cd16抗体。cd16是nk细胞的标志物之一。在本发明的一些实施方案中,培养基中抗cd16抗体的使用浓度为0.05-15μg/ml,优选0.5-1.5μg/ml,例如0.5μg/ml、0.6μg/ml、0.7μg/ml、0.8μg/ml、0.9μg/ml、1.0μg/ml、1.1μg/ml、1.2μg/ml、1.3μg/ml、1.4μg/ml或1.5μg/ml。第二方面,本申请提供了用于培养nk细胞的培养基,其包含il-2和香菇多糖。同样地,第二方面的培养基也应当包含培养细胞用的基础培养基,以用于向细胞提供基本的养分等。示例性的培养基可以是淋巴细胞培养基。第一方面和第二方面使用的基础培养基可以相同,也可以不同。在一些实施方案中,培养基中il-2的使用浓度为100-10000iu/ml,优选1000iu/ml。香菇多糖是从优质香菇子实体中提取的有效活性成分,是一种良好的免疫增强剂,能够显著提高机体的特异性和非特异性免疫。多种香菇多糖制剂都是能够商购得到的,例如,注射用香菇多糖(江苏康缘药业股份有限公司)、注射用香菇多糖(山西振东泰盛制药有限公司)。在一些实施方案中,培养基中香菇多糖的使用浓度为5-500ng/ml,例如5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、150、200、250、300、350、400、450或500ng/ml,优选50ng/ml。在一些实施方案中,培养基还包含自体血浆。自体血浆的主要作用是为初始细胞的生长和扩增提供营养物质,保证细胞在初始阶段能够顺利生长。在一些实施方案中,培养基中自体血浆的含量为1-20%,优选5%。应当理解,第一或第二方面所述的培养基可以是用于复原的粉末培养基,也可以是配制好的液体培养基。第三方面,本申请提供了用于培养nk细胞的培养基套装,其包括第一方面所述的培养基以及第二方面所述的培养基。第四方面,本申请提供了培养nk细胞的方法,所述方法包括:(1)提供用抗cd16抗体包被的培养器;(2)将单核细胞接种于添加第一方面中不包含抗cd16抗体的培养基的步骤(1)的培养器中进行培养;以及(3)收集步骤(2)中获得的细胞,并将获得的细胞接种于第二方面所述的培养基中进行培养。在本申请的培养方法中,抗cd16抗体可以事先包被于培养容器的表面,也可以掺入培养基中。作为步骤(1)的非限制性实例,可以在培养细胞前,预先在培养瓶中加入含抗cd16抗体的包被液,并且4℃下包被过夜。在一些实施方案中,包被液中抗cd16抗体的浓度为0.05-15μg/ml,优选0.5-1.5μg/ml,例如0.5μg/ml、0.6μg/ml、0.7μg/ml、0.8μg/ml、0.9μg/ml、1.0μg/ml、1.1μg/ml、1.2μg/ml、1.3μg/ml、1.4μg/ml以及1.5μg/ml。在一些实施方案中,单核细胞获自个体的外周血。从个体的外周血中分离单核细胞的技术是本领域技术人员公知的。例如,常用的密度梯度离心法,根据单核细胞的密度设计了淋巴细胞分离液的密度稍大于单核细胞,将血液平铺到淋巴细胞分离液上,离心后可以获得不同细胞的分层,密度最大的红细胞被离心到离心管底部,密度稍小于淋巴细胞分离液的单核细胞离心后分布在淋巴细胞分离液上面,最上面是血浆、粒细胞等密度较小的细胞。在一些实施方案中,单核细胞的接种浓度为1.0×105-1.0×107个/ml,优选1.0×106个/ml。在一些实施方案中,步骤(2)的培养时间为48-96小时,例如72小时。在一些实施方案中,步骤(3)中的收集包括离心、洗涤、重悬等操作。在步骤(3)的一些实施方案中,定时观察细胞生长情况,并视情况补加培养基或更换培养基,例如每隔2-3天。在一些实施方案中,步骤(3)的培养时间12-18天。第五方面,本申请提供了培养nk细胞的方法,所述方法包括(1)将单核细胞接种于第一方面中包含抗cd16抗体的培养基中进行培养;以及(2)收集步骤(1)中获得的细胞,并将获得的细胞接种于第二方面所述的培养基中进行培养。除了抗cd16抗体的提供方式不同之外,第五方面的方法的细节特征可以与第四方面相同。第六方面,本申请提供了通过第四或第五方面所述的方法获得的nk细胞。第七方面,本申请提供了第六方面所述的nk细胞在制备用于治疗肿瘤、感染或免疫系统疾病的药物中的用途。在一些实施方案中,所述肿瘤包括但不限于:血液系统淋巴瘤、b细胞淋巴瘤、t细胞淋巴瘤、非小细胞肺癌、乳腺癌、肾癌、黑色素瘤、卵巢癌以及结肠癌。在一些实施方案中,nk细胞可选择性地杀伤病毒感染的靶细胞,所述细胞包括但不限于下述病毒感染的靶细胞:疱疹病毒、牛痘病毒、麻疹病毒、腮腺炎病毒、巨细胞病毒和/或流感病毒。由辅助细胞或nk细胞所产生的ifn可协同nk的抗病毒作用,从而对正常细胞产生保护。同时病毒感染细胞表面的病毒抗原和其它表面分子使得其对nk杀伤细胞作用变得更加敏感。在一些实施方案中,本申请提供的nk细胞还可用于提高人体免疫力。在一些实施方案中,本申请提供的nk细胞可用于美容抗衰老。应当理解,以上详细描述仅为了使本领域技术人员更清楚地了解本申请的内容,而并非意图在任何方面加以限制。本领域技术人员能够对所述实施方案进行各种改动和变化。实施例提供以下实施例仅仅是对本申请的一些实施方案进行举例说明,没有任何限制的目的或性质。以下实施例中使用的外周血由发明人及其同事作为志愿者提供,所有志愿者均已签署知情同意书。志愿者的纳入标准为:1.年龄大于18周岁;2.无hiv、hbv感染;3.血常规检测正常;4.非孕妇或哺乳期妇女。实施例1:外周血单核细胞(pbmc)的分离和nk细胞的培养预先在细胞培养瓶中加入含有抗cd16抗体(biolegend,克隆号3g8)的包被液,4℃包被过夜,包被液抗体浓度为1.0μg/ml。利用采血袋从志愿者采集外周血。将采集的血样转至50ml离心管;3000rpm下离心分离8min,吸取上层血浆,放入56℃水浴中灭活30min,培养时备用;用0.9%生理盐水将血样还原至原体积,混匀;将稀释血样缓慢加在15mlficoll上,800g下离心15min;吸取淋巴细胞分离液界面白膜单核细胞层;1600rpm离心8min,洗涤2次并计数;用gtt551淋巴细胞基础培养基将外周血单核细胞重悬混匀,并调整细胞浓度为1.0×106个/ml。将细胞转入预先用抗cd16抗体包被的细胞培养瓶中,同时加入含1000iu/ml的il-2(购自双鹭药业)、0.01ke/ml的沙培林(购自鲁抗医药)的淋巴细胞基础培养基,放置于37℃5%co2培养箱中培养72h。培养三天后,将细胞收集于离心管中,1600rpm离心8分钟,然后用生理盐水洗涤一遍。用淋巴细胞基础培养基重悬细胞,并加入1000iu/ml的il-2、50ng/ml的香菇多糖(购自康缘药业股份有限公司)和5%的自体血浆。自体血浆的制备方法为:采集外周血后将抗凝血液加至50ml离心管中,3000rpm离心8分钟,离心完毕吸取上层黄色透明血浆,将血浆移入50ml离心管中无菌密封后放入56℃的水浴中灭活30分钟;灭活完毕,将血浆冷却至室温后3000rpm离心15分钟,离心完毕取上清保存备用。随后,每隔2-3天观察细胞生长状态,并根据需要补充或更换培养基。培养12-18天后收获nk细胞。以下实施例中描述的检测和分析包括在实施例1的培养过程中以及培养完成后所实施的测试。实施例2:培养的nk细胞的免疫表型检测分别取培养第0、8、14以及21天的细胞,加至1.5mlep管中,每管约含1.0×106个细胞。2500rpm离心5分钟后弃去上清,用pbs洗涤一遍。将细胞重悬于100μlpbs中,加入荧光标记抗体各5μl(biolegend,cd3-fitc、cd56-pc5.5、cd16-apc、cd314-pe),其中各荧光抗体均为小鼠抗人抗体,4℃避光孵育30分钟;用pbs洗涤2遍,弃去上清;将细胞用0.2mlpbs重悬,并用cytoflex流式细胞仪进行检测分析。结果显示于图1中:在培养第8天,nk(cd3-cd56+)的流式表型为81.53%;在第14天,为94.3%;在第21天为91.04%。上述结果说明nk细胞的表型在第13天可以达到培养的峰值,并且在第13-21天nk(cd3-cd56+)的流式表型一直处于峰值水平,之后继续培养会有一定的回落。同时流式细胞仪的检测结果表明,nk细胞的cd16表达量很高,有利于nk发挥adcc作用。这是本申请的优势之一。实施例3:nk细胞ifn-γ的测定将细胞分为实验组和对照组,按照不同的培养方案进行培养。实验组培养方案:同实施例1。对照组培养方案:利用采血袋静脉采集志愿者外周血,将采集的血样转至50ml离心管;3000rpm下离心分离8min,吸取上层血浆,放入56℃水浴中灭活30min,培养时备用;用0.9%生理盐水将血样还原至原体积,混匀;将稀释血样缓慢加在15mlficoll上,800g下离心15min;吸取淋巴细胞分离液界面白膜单核细胞层;1600rpm离心8min,洗涤2次并计数;用gtt551淋巴细胞基础培养基将外周血单核细胞重悬混匀,并调整细胞浓度1.0×106个/ml。培养三天后,将细胞收集于离心管中,1600rpm离心8分钟,然后用 生理盐水洗涤一遍。用淋巴细胞基础培养基重悬细胞,并加入1000iu/ml的il-2和5%的自体血浆。随后,每隔2-3天观察细胞生长状态,并根据需要补充或更换基础培养基和1000iu/ml的il-2。在细胞培养的14-17天,按下述方法分别取实验组和对照组细胞培养液的上清液进行ifn-γ的测定。首先确定所需样品孔数。按照ebioscience试剂盒说明书配制洗涤缓冲液,并用400μl洗涤缓冲液洗涤各孔。然后将ifn-γ标准品稀释10倍至20ng/ml;再稀释100倍至200pg/ml;向各孔中添加100μl稀释缓冲液,然后向第一孔中加入100μl200pg/ml的标准品溶液,再从第一孔中吸取100μl溶液加至第二孔中,以此类推。向待测样品孔加入待测样品及待测样品的稀释液。向各孔中添加50μl生物素偶联物(biotin-conjugate)。之后室温放置于摇床上,400rpm摇动2小时。用400μl洗涤缓冲液洗涤各孔。向各孔中添加100μl链霉亲和素-hrp,室温放置于摇床上,400rpm摇动1小时。用400μl洗涤缓冲液洗涤各孔。向各孔中添加100μltmb,作用10分钟。加入终止液,并测定450nm处的吸光度。获得的实验数据如表1所示。表1nk细胞培养液中ifn-γ的测定根据表1中的数据绘制标准品浓度与吸光度的标准曲线。并得到下述浓度计算公式:y=0.015×x+0.107,其中r2=0.9962。之前对不同浓度待测样品稀释液的测定显示待测样品需要稀释2000倍以上才能获得合理的数据。故而将待测样品稀释5000倍后,测定其浓度。根据公式可得:实验组:y=0.4490=0.015×x+0.107,x=22.8pg/ml,实际浓度为114.0 ng/ml对照组:y=0.4021=0.015×x+0.107,x=19.67pg/ml,实际浓度为98.36ng/ml比较可得,实验组细胞培养液中的ifn-γ含量显著高于对照组中的ifn-γ含量。实施例4:nk细胞的细胞杀伤活性检测nk细胞对k562细胞杀伤作用的比较取处于对数生长期的k562细胞(中国医学科学院细胞典藏中心)作为靶细胞,对培养的nk细胞的细胞杀伤作用进行检测。将k562细胞的浓度调整为1×106/ml,然后用如实施例2中所述的实验组培养方案和对照组培养方案,将培养至14天的实验组和对照组nk细胞作为效应细胞,以1:5、1:10和1:20的效靶比混合效应细胞与靶细胞。同时设效应细胞孔、靶细胞孔、靶细胞ldh释放孔,每组设3个平行孔,各孔的终体积为200μl。将细胞在37℃5%的co2培养箱中孵育3h,然后向靶细胞ldh释放孔中添加ldh释放试剂(购自碧云天),继续孵育1h。之后向每孔中添加ldh检测工作液(购自碧云天),用酶标仪检测490nm处的od值。并按以下公式计算杀伤率:杀伤率(%)=(实验孔-靶细胞对照孔)/(靶细胞ldh释放孔-靶细胞对照孔)。计算的细胞杀伤率结果如表2所示。表2不同培养方式获得的nk细胞对k562细胞的杀伤作用的比较效靶比1:51:101:20对照组43.5%71.5%100%实验组45.7%98.9%100%结果显示,用实施例2中所述的实验组培养方案和对照组培养方案培养获得的nk细胞,当以1:5和1:20的效靶比混合时,其对靶细胞k562细胞的杀伤率相差不大,而当以1:10的效靶比将nk细胞与靶细胞k562细胞混合时,用实验组对照方案获得的nk细胞对于k562细胞的杀伤率显著高于用对照组培养方案获得的nk细胞,其中杀伤率分别为98.9%和71.5%。上述结果说明,用本申请中提供的培养基和培养方法获得的nk细胞对k562细胞的杀伤率优于用对照组实验方案获得的nk细胞。实施例4:nk细胞对skbr3细胞杀伤作用的比较分别用下述三种方法培养nk细胞:实验组的培养方法如实施例2中的实验组培养方案所述,然后将培养获得的nk细胞用5μg/ml的pd-1单抗封闭;技术1组的培养方案与实验组大致相同,除了用0.1μg/ml的cd3单抗(500μg/支,克隆号okt3,购自达科为生物技术有限公司)与20μg/ml的cd52单抗(购自上海优宁维生物科技股份有限公司)替代cd16单抗包被培养瓶;技术2组的培养方案与实施例2中的对照组培养方案相同。取处于对数生长期的skbr3细胞(中国医学科学院细胞典藏中心)作为靶细胞,对用上述三种方法培养获得的nk细胞的细胞杀伤作用进行检测。将skbr细胞的浓度调整为1×106/ml,然后将用所述三种方法培养14天的nk细胞作为效应细胞,以1:5、1:10和1:20的效靶比混合效应细胞与靶细胞。同时设效应细胞孔、靶细胞孔、靶细胞ldh释放孔,每组设3个平行孔,各孔的终体积为200μl。将细胞在37℃5%的co2培养箱中孵育3h,然后向靶细胞ldh释放孔中添加ldh释放试剂,继续孵育1h。之后向每孔中添加ldh检测工作液,用酶标仪检测490nm处的od值。并按以下公式计算杀伤率:杀伤率(%)=(实验孔-靶细胞对照孔)/(靶细胞ldh释放孔-靶细胞对照孔)。计算的细胞杀伤率结果如表3所示。表3乳酸脱氢酶法比较不同培养方式获得的nk细胞对skbr3细胞的杀伤作用效靶比1:51:101:20技术1组nk17.75%26.79%44.14%技术2组nk17.75%26.32%46.22%实验组nk31.26%59.04%74.1%结果显示,技术1组和2组nk细胞对skbr3细胞的杀伤率无显著差异。而用本申请提供的培养基和培养方法获得的nk细胞对skbr3细胞的杀伤率明显优于两组技术组nk细胞,且不管以何种效靶比进行混合。实施例5:本申请的方法与对照组方法获得的细胞扩增倍数的比较分别用实施例1的方法和下述对照组方法培养细胞:将cd3mab(10μg/ml)(500μg/支,克隆号okt3,购自达科为生物技术有限公司)用无菌pbs稀释,取10ml加入至75cm2细胞培养瓶内,使液体铺满瓶底,于4℃冰箱内过夜保存待用。移除75cm2细胞培养瓶内的包被液,将由50ml外周血得到的pbmc细胞重悬到30ml加有组合细胞因子il-2(终浓度为1750iu/ml)、il-15(终浓度为10ng/ml)、il-12(终浓度为10ng/ml)的培养基中,并加入3ml自体血浆(10%),在温度37℃、co2含量5%的细胞培养箱内培养;培养4天,在倒置显微镜下观察细胞生长状态;当细胞铺满培养瓶底后,将75cm2细胞培养瓶中的细胞轻轻震荡让其悬浮后,吹打混匀,进行细胞计数,直接倒入175cm2细胞培养瓶中,然后再加入150ml加有组合细胞因子il-2(终浓度为1750iu/ml)、il-15(终浓度为10ng/ml)、il-12(终浓度为10ng/ml)的培养基中,并加入10%自体血浆,混合均匀后平分到175cm2的细胞培养瓶中,在温度37℃、co2含量5%的细胞培养箱内培养;从第6天开始培养基中只加入il-2和自体血浆,培养至14天。图2中显示了用实施例1的方法对获自2名志愿者的样品进行nk细胞扩增培养的生长曲线。对用实施例1的方法和上述对照组方法培养至第14天的nk细胞进行计数,利用流式细胞仪测定nk细胞的含量;并计算nk细胞的扩增倍数,计算公式如下:扩增倍数=(14天nk细胞总数量×nk细胞含量)/(第0天pbmc×nk细胞含量)计算结果下述表4所示。表4采用本申请的方法对7例志愿者的nk细胞培养情况表5本申请的方法与对照组方法对比通过计算,上述七例志愿者的nk细胞14天平均扩增倍数为1236倍;21天的平均扩增倍数在2000倍左右。与对照组方法的扩增350倍相比扩增倍数高出许多,细胞总数量多,细胞纯度高;并且细胞培养成本更低。本申请提供的培养方法简便可靠,普通技术人员在通常实验条件下无需专门培训就可以掌握培养nk细胞的技术;培养过程无特需设备;短周期内(例如,14天)培养出来的细胞数量大(例如,50-80ml外周血可以获得60-80亿细胞),细胞纯度高(例如,cd3-cd56+细胞平均纯度在85%),诱导细胞毒性(adcc)的能力强。同时节省nk细胞的制备成本,简化制备过程,更适合技术人员掌握与应用。在不偏离本申请公开的实质和范围的情况下,可对本申请公开的各实施方案进行多种改变和用等同替换。除非上下文中另有说明,否则本公开的实施方案的任何特征、步骤或实施方案都可以与任何其他特征、步骤或实施方案组合使用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1