一种与金属离子具有更强结合力的蛋白纯化标签及其应用的制作方法
本发明涉及基因工程、蛋白质工程以及生物化学与分子生物学技术领域,特别涉及一种高结合力金属离子亲和色谱蛋白纯化标签。
背景技术:
金属螯合亲和层析,又称固定化金属离子亲合层析(Immobilized metal ion affinity chromatography,IMAC)。该方法利用蛋白质表面的一些氨基酸,如组氨酸、色氨酸、半胱氨酸等能和金属离子发生特殊相互作用的原理,从而对蛋白质加以分离。这些作用包括配价键结合、静电吸附、共价键结合,其中以配价键结合为主。其中,由6个连续组氨酸组成的组氨酸标签(6×His-Tag)在蛋白亲和纯化以及免疫检测等领域应用最为广泛。通过在重组蛋白末端融合多个组氨酸组成的肽段(常用6-10个组氨酸),使重组蛋白可以与二价金属离子(镍、铜、锌和钴等)具有较强的金属螯合作用,从而便于用金属螯合亲和层析纯化重组蛋白质。
利用金属螯合亲和层析高效分离纯化含有6×His-Tag的重组蛋白质,为蛋白质的分离纯化提供了一个有力的工具。由于6×His-Tag相较于其他蛋白表达标签,比如GST,MBP和Thioredoxin等,具有分子量小,没有明显二级结构,因此对重组蛋白的折叠和功能影响较小。同时,金属螯合亲合层析还具有配体简单、吸附量大、分离条件温和、通用性、样品与树脂的结合条件可选择范围广强等优点,在高盐、一定浓度的变性剂以及去垢剂存在的条件下,带6×His纯化标签的蛋白质都可以和亲合填料特异性结合,因此逐渐成为蛋白质分离纯化、蛋白免疫检测以及蛋白质相互作用检测等领域中最有效的技术之一。
然而,在6×His-Tag蛋白标签应用过程中,人们也发现,在高浓度变性剂,表明活性剂或还原剂等存在的条件下,6×His-Tag蛋白标签与金属螯合树脂的亲和能力明显减弱。同时,天然蛋白质中往往也存在多个His连续存在或者空间上相距较近的情况,因此6×His-Tag的结合特异性和结合力尚需进一步优化和提高。为了加强His tag的结合力及特异性,通常采用增加His tag中组氨酸的个数来实现,比如8×His-Tag,10×His-Tag,甚至12×His-Tag等,这虽然一定程度上增强了重组蛋白与金属螯合树脂的结合效率,但由于His-tag的增大,往往对目标蛋白的折叠和功能会产生较明显的空间位阻效应;并且由于组氨酸为碱性氨基酸,在蛋白纯化通常采用的中性缓冲液中,带有正电荷,因此His-tag中组氨酸个数的增加,还会改变整个蛋白的带电性质,对其结构与功能产生较大的影响。因此,急需开发与金属离子具有更高结合能力,且带电性质更接近中性的蛋白标签。
技术实现要素:
本发明所要解决的技术问题在于:提供了一种与金属离子具有更高结合力的亲和色谱蛋白纯化标签m-HDn-Tag。
本发明首先提供一种能与金属离子具有更强结合力的蛋白亲和纯化标签,其特征在于:在多聚组氨酸(H)蛋白纯化标签的基础上,将标签内部某一位点的组氨酸H突变为天冬氨酸(D);
进一步地,其中所述标签内部某一位点组氨酸到天冬氨酸突变为单突变,且不确定突变位点;
进一步地,所述蛋白亲和纯化标签的结构为m-HDn-Tag,其中m表示氨基酸总数,m可以为3-12,n表示为自N末端起,第n个氨基酸突变为D,且1≤n≤m;
具体地,在m-HDn-Tag标签中,包含的氨基酸总数m可以为3-12,比如3-HD2(表示HDH),4-HD2(表示HDHH),5-HD2(表示HDHHH),6-HD2(表示HDHHHH),以此类推,12-HD2(表示HDHHHHHHHHHH)等;n表示为自N末端起,第n个氨基酸突变为D(1≤n≤m),且具有多种组合方式:6-HD2(表示HDHHHH)6-HD3(表示HHDHHH),6-HD4(表示HHHDHH),6-HD5(表示HHHHDH),6-HD6(表示HHHHHD)等。
进一步地,其中所述m的数值为6,n的数值为5,结构为6-HD5-Tag;
进一步地,其中所述m的数值为6,n的数值为3,结构为6-HD3-Tag。
本发明还提供该蛋白亲和纯化标签在基因工程、细胞工程以及蛋白质工程领域的应用,该标签可以用于蛋白质纯化标签、分子间相互作用检测标签、药物设计等。
附图说明
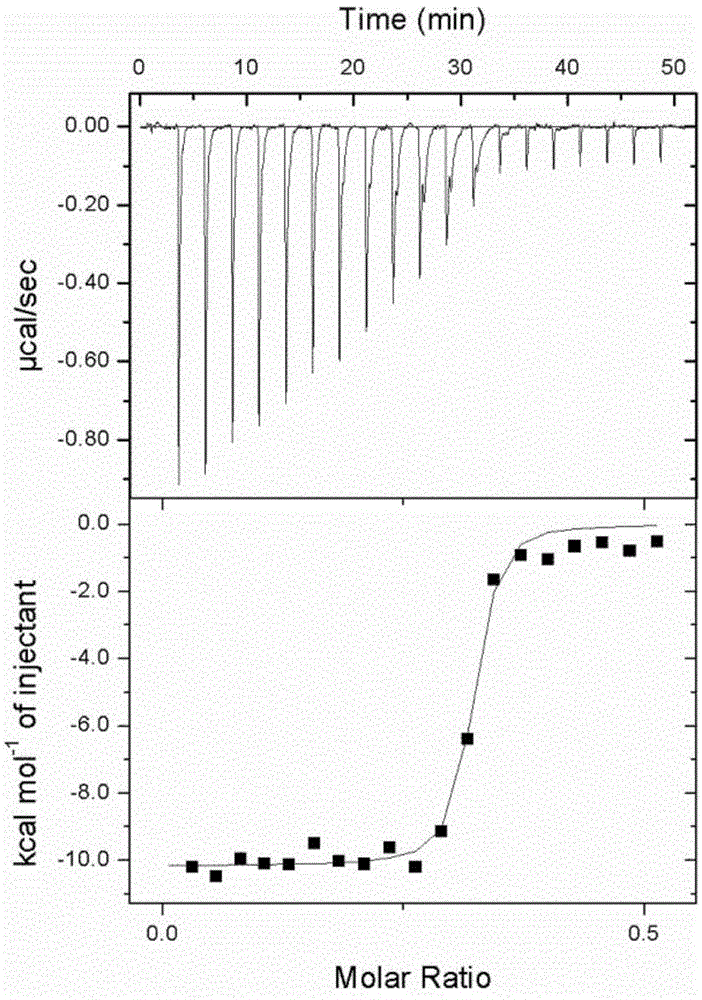
图1:现有技术通常采用的蛋白纯化标签6×His-Tag与Cu2+滴定数据;
图2:6-HD3-Tag与Cu2+滴定数据;
图3:6-HD5-Tag与Cu2+滴定数据;
图4:6×His-tag蛋白纯化结合效率;
图5:6-HD5-tag蛋白纯化结合效率。
具体实施方式
下面结合附图及实施例进一步描述本发明,但并不限制本发明的保护范围。
实施例1:m-HDn-tag的设计
本发明所采用的m-HDn-Tag蛋白纯化标签为将含有m个氨基酸数的His-Tag纯化标签中某个位点(n)的氨基酸突变成天冬氨酸(D)后得到的一种蛋白纯化标签。包含的氨基酸总数m可以为3-12,比如3-HDH,4-HDH2,5-HDH3,6-HDH4,7-HDH5,8-HDH6,9-HDH7,10-HDH8,11-HDH9,12-HDH10等;且D的位置也可以更换,具有多种组合方式:4-HDH2,6-H2DH3,6-H3DH2,6-H4DH,8-H5DH2,8-H6DH等。所述蛋白纯化标签可以委托多肽合成公司直接合成也可以通过与其他蛋白质融合构建从而在基因工程重组细胞中进行重组合成。
实施例2:6-HD3-Tag和传统6×His-Tag蛋白纯化标签与金属离子的螯合能力差异对比
为对比m-HDn-Tag蛋白纯化标签和相同氨基酸个数His-Tag蛋白纯化标签与金属离子的螯合能力差异,我们合成HHDHHH(6-HD3)和HHHHHH(6×His)短肽序列标签。采用等温滴定量(ITC)的方法,将蛋白纯化标签与金属离子直接进行滴定,以求得蛋白纯化标签与金属离子的结合常数。所述ITC是一种可以通过高灵敏度、高自动化的微量量热仪连续、准确地监测和记录一个变化过程的量热曲线,原位、在线和无损伤地同时提供热力学和动力学信息(包括结合常数)的一种方法。
实验过程中,滴定所使用多肽浓度为0.2mM。所述金属离子采用Cu2+,使用浓度分别为0.5和1.5mM。所述滴定实验使用缓冲液为50mM的HEPES(pH7.5),氯化钠浓度为100mM。为防止上述Cu2+在该缓冲体系下出现沉淀,我们使用10mM甘氨酸(Gly)作保护。
所述ITC滴定结果如表1所示:
表1:6-HD3-Tag与His-Tag(6×His)与Cu2+螯合作用的ITC滴定结果比较
从表1中可以看出,6-HD3-tag(HHDHHH)与铜离子的结合能力比传统六个组氨酸标签(HHHHHH)的结合能力要强三个数量级。
实施例3:6-HD5-Tag和传统6×His-Tag蛋白纯化标签与金属离子的螯合能力差异对比
所述6-HD5-Tag(HHHHDH)蛋白纯化标签和6×His-Tag蛋白纯化标签(HHHHHH)与金属离子的螯合能力差异的对比方法、实验条件同实施例2。
所述金属离子采用Cu2+,使用浓度分别为2.0和1.5mM。
所述对比结果如表2所示:
表2:6-HD5-Tag与His-Tag(6×His)ITC滴定结果比较
从表2中可以看出,6-HD5-tag(HHHHDH)与铜离子的结合能力比传统六个组氨酸标签的结合能力要强三个数量级,因此可以利用金属螯合层析对含有m-HDn-tag的目标蛋白质进行更高效的纯化分离。同时m-HDn-tag分子量更小,并且带电性更弱,因此对目标蛋白质的结构与功能影响将更小,因此通常情况下即使不去除标签也可以很方便研究蛋白质的结构与功能,大大简化了纯化程序,降低了纯化成本。
实施例4:采用6-HD5-Tag和传统6×His-Tag蛋白纯化效果的比较
为对比6-HD5-tag和传统6×His-tag蛋白纯化的效果,我们选择了一种蛋白质,通过定点突变技术,将其原有的6×His-tag突变成6-HD5-tag,在大肠杆菌中重组表达之后,利用镍柱对两种标签蛋白分别进行梯度洗脱,根据蛋白洗脱所需要的咪唑浓度,来比较不同蛋白纯化标签的纯化效果。
实验所用蛋白质为YibK,所用大肠杆菌为BL21菌株。所述纯化缓冲液有两种,分别为裂解缓冲液buffer A(25mM Tris-HCl,300mM NaCl,5mM咪唑,pH 7.5),洗脱缓冲液buffer B(25mM Tris-HCl,300mM NaCl,500mM咪唑,pH 7.5)。
所述6-HD5-tag和传统6×His-tag镍柱纯化结果分别如图4、图5所示。
从图4、图5中可知,6-HD5-tag(HHHHDH)蛋白洗脱时所需的咪唑浓度比6×His-tag(HHHHHH)高13%,因此6-HD5-tag相比于传统6×His-tag蛋白纯化效果更好。
本发明与现有技术相比,具有以下优点:
m-HDn-Tag与传统相同氨基酸个数的His-tag相比,具有更强的金属离子螯合能力,使目的蛋白能更好地与亲和填料相结合,因此,可以显著提高目标蛋白的纯化效率、纯度以及得率。
由于D为酸性氨基酸,在通常蛋白纯化采用的中性缓冲液中带负电荷,而组氨酸为碱性氨基酸,在中性溶液中带正电荷,因此,m-HDn-Tag的整体带电性和分子量均较传统相同氨基酸个数的His-Tag有所减少,这使得该标签对目标蛋白质本身的结构与功能影响将更小。
m-HDn-tag基于金属螯合原理,可以与目前市场上通用的金属螯合层析树脂兼容,无需购买新型树脂,不会增加纯化成本,同时具有更强的结合力,因此将会在基因工程、蛋白质工程等领域具有更广泛的应用。
所有上述的首要实施这一知识产权,并没有设定限制其他形式的实施这种新产品和/或新方法。本领域技术人员将利用这一重要信息,上述内容修改,以实现类似的执行情况。但是,所有修改或改造基于本发明新产品属于保留的权利。
- 还没有人留言评论。精彩留言会获得点赞!