一种适用于谷氨酸棒杆菌的表达载体及其应用的制作方法
本发明涉及基因工程和代谢工程技术领域,具体涉及一种适用于谷氨酸棒杆菌的表达载体及其应用。
背景技术:
谷氨酸棒杆菌是一种非致病性的革兰氏阳性菌,广泛用于工业生产氨基酸、有机酸、高级醇等工业产品;同时,谷氨酸棒杆菌无内毒素并且胞外无水解酶活性,其能够分泌正确折叠的有生物活性功能蛋白质,所以谷氨酸棒杆菌也是一种表达外源蛋白的极为有利的宿主。
启动子是一段控制基因起始转录的重要DNA序列,位于转录起始位点上游。而基因的mRNA转录水平是最终蛋白表达水平的主要影响因素之一,有研究通过大量的分析证明在控制蛋白表达水平的序列各种区域中,启动子区域的影响力超过45%,是最重要的序列区域。因此,一个强效的启动子通过使携带基因序列的mRNA高转录,从而实现高水平蛋白表达。
对于谷氨酸棒杆菌而言,人们目前依旧局限于应用以cspB、trc或tac为启动子的表达载体,其中应用tac启动子的表达载体的外源蛋白表达水平较高,但仍然无法满足人们对外源蛋白日益增长的需求。
技术实现要素:
针对上述问题,本发明提供了一种适用于谷氨酸棒杆菌的表达载体,其能解决谷氨酸棒杆菌外源蛋白表达水平低的技术问题,本发明还提供了该表达载体的应用。
一种适用于谷氨酸棒杆菌的表达载体,其包含启动子,其特征在于:所述启动子的核酸序列如SEQ ID NO:1所示,或与其互补的核苷酸序列。
一种外源蛋白表达系统,其包括谷氨酸棒杆菌和所述表达载体。
上述表达载体或外源蛋白表达系统在外源蛋白表达中的应用。
本发明的上述表达载体,包含SEQ ID NO:1所示的枯草芽孢杆菌的tufA启动子,经实验证实,该载体的表达效果超过tac启动子与保守SD序列在pXMJ19中的经典组合,能够有效提高外源蛋白的表达水平。
附图说明
图1为载体p10-A0的质粒图谱
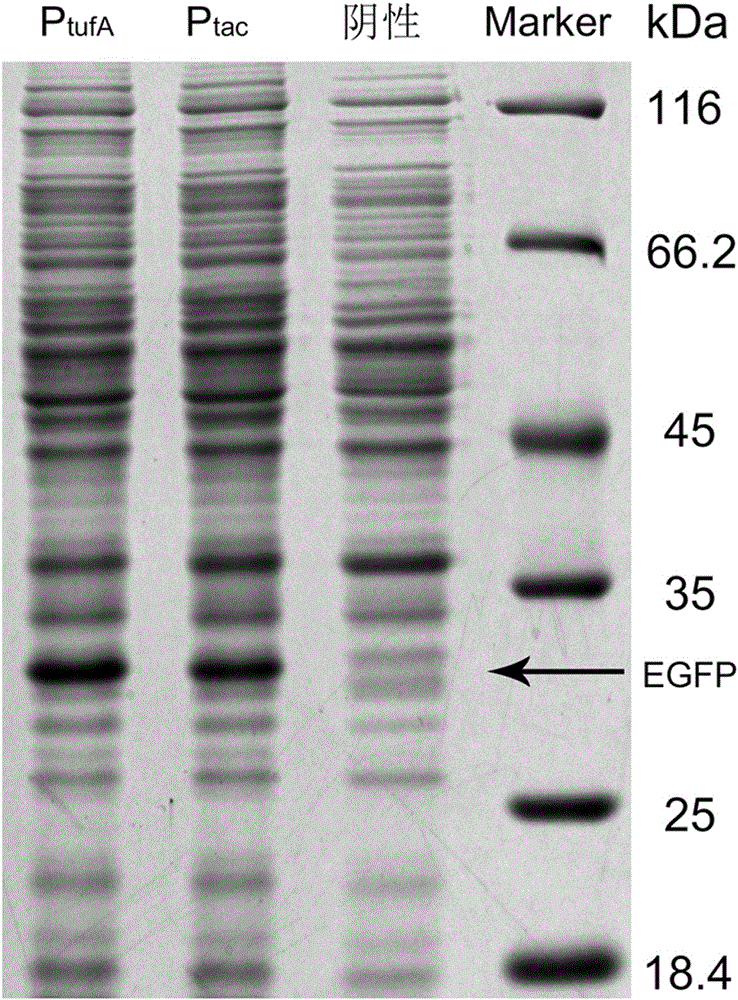
图2为本发明启动子和tac启动子构建的不同表达载体蛋白表达的SDS-PAGE分析图。
具体实施方式
本发明中所用到的菌株:枯草芽孢杆菌168、谷氨酸棒杆菌ATCC 13032和大肠杆菌DH5α均购自中国高校微生物资源数据平台。
限制性内切酶Hind III、BamH I、EcoR V,T4 DNA连接酶等购自Thermo公司;Bsa I二型内切酶、Q5超保真聚合酶购自NEB公司;质粒提取试剂盒、PCR产物纯化试剂盒、胶回收试剂盒购自Axygen公司;基因组提取试剂盒购自天根公司;Infusion重组试剂盒购自Clontech公司;氯霉素、卡那霉素等抗生素购自上海生物工程有限公司;其余试剂均为国产或者进口分析纯。高速冷冻离心机和PCR热循环仪,美国ThermoFisher公司;Synergy H4酶标仪,美国BioTek公司;恒温金属浴,北京天根公司;Dark Reader,北京达科为生物公司;核酸和蛋白电泳仪,美国Bio-Rad公司。
本发明所用载体p19-A0的核酸序列如SEQ ID NO:3所示,其质粒图谱如图1所示,其构建方法参见:刘秀霞, 赵子豪, 孙杨, 等. 谷氨酸棒杆菌内源表达元件的筛选[J]. 微生物学通报, 2016-05-24 16:42,载体p19-A0含有egfp报告基因。
1、启动子的克隆。
包括以下步骤:
a、枯草芽孢杆菌基因组DNA的获取:通过基因组提取试剂盒提取枯草芽孢杆菌168的基因组DNA。
b、PCR扩增:
PCR扩增条件为:98 °C 、3 min;98 °C 、15 s,72 °C、 3.25 min,30 个循环;72 °C 、2 min。反应体系为:10×Buffer 5 μl、dNTPs 4 μl (各2.5 mmol/L)、上下游引物各1 μl (0.2 μmol/L)、Q5 DNA聚合酶0.5 μl (2 U/μl)、模板1 μl,加水至50 μl;
本发明的tufA启动子(以下简称为PtufA)的引物:
tufA-F:5‘- TTTTGAAGCTTCTGGTTACGAAGAAGTGCCGAAGAG -3’
tufA-R:5‘-CGCCCTTGCTCACCATTCTAAAATCCTCCTTAAGAGCTTT -3’;
上述引物5’端分别引入同源臂序列“TTTTGAAGCTTCTGGT”和“CGCCCTTGCTCACCA”,使得扩增后的两条序列与Bsa I酶切线性化后的载体p19-A0两端序列一致,在体外同源重组酶的帮助下,能够发生同源重组,从而使启动子与报告基因egfp无缝连接,构建出含有启动子得EGFP表达质粒。
2、表达载体的构建。
含有PtufA的质粒的构建,包括以下步骤:
a、通过II型内切酶Bsa I切割载体p19-A0获得线性质粒;
b、通过Infusion重组试剂盒将启动子与线性质粒在反应液中发生同源重组;
c、将同源重组后获得的反应液转化大肠杆菌DH5α,即可构建出含有NtufA的表达质粒,简称为ptufA。
传统方法使用的酶切位点如EcoR I、BamH I等会干扰启动子的正确测定,而本发明所使用的载体p19-A0避免了这些额外序列的存在和对结果的干扰。
含有tac启动子(简称为Ptac)的阳性对照质粒的构建,包括以下步骤:
a、克隆如SEQ ID NO:2所示的谷氨酸棒杆菌保守SD序列和egfp基因片段,所需的引物为:
SD-EGFP-F: 5‘- CCCAAGCTTAAAGGAGGACAACTAATGGTGAGCAAGGGCG -3’
SD-EGFP-R: 5‘-CCCGGATCCTTACTTGTACAGCTCGTCCATG-3’
PCR扩增条件与“1、启动子的克隆”中PCR扩增条件相同;
两条引物的“AAGCTT”“GGATCC”分代表构建这一阳性对照质粒所需引入的酶切位点,分别为Hind III和BamH I。
b、Hind III和BamH I双酶切,
c、T4连接。
酶切与连接均按照商品酶试剂的说明书指导进行。
谷氨酸棒杆菌保守SD序列和egfp基因片段与质粒pXMJ19上的Ptac组合,构建组成型表达的阳性对照质粒(简称为pTAC),这一经典的阳性对照代表了的谷氨酸棒杆菌高效表达重组蛋白的水平。
3、转化。
包括以下步骤:
a、通过质粒提取试剂盒分别提取ptufA、pTAC;
b、转化谷氨酸棒杆菌ATCC 13032。
具体方法为:
(1)谷氨酸棒杆菌感受态细胞的制备
将在培养基平板上火化后的谷氨酸棒杆菌挑取接种至BHI培养基中,于30°C、230 rpm条件下过夜培养,将菌液转接至含有3%甘氨酸、0.1%Tween 80和0.5%葡萄糖的LB液体培养基的250 ml三角瓶中,控制其初始OD600为0.3,于30°C、230 rpm条件下培养4-6 h,至OD600达到0.6-0.9。再将菌液转移至无菌离心管中,冰上放置15 min。以下操作均在低温,无菌条件下进行。
4°C、4000 rpm离心5min,去上清,收集菌体,用预冷的10%甘油重悬菌体,悬浮式用移液枪小心的吹打。重复上述离心,去上清步骤3次,用1.5 ml 10%甘油重悬细胞,分装至1.5ml 离心管中,每管装100 μl,保存于-80°C备用。
(2)谷氨酸棒杆菌感受态的电击转化
将感受态细胞从-80°C冰箱中去除,至于冰上融化,添加10μl重组质粒后轻轻混匀,转移至预冷的0.1 cm电击杯中,于1.8 kv,200 Ω,25 μF条件下电击细胞。电击后立即加入含1.85%脑心浸出液的9.2%山梨醇的LB液体培养基1 ml,混匀,转入1.5 ml离心管中,于46°C水浴6 min,30°C,150 rpm振荡培养2 h。然后将菌液浓缩后涂布于含有1.85%脑心浸出液的9.2%山梨醇的LB固体培养基上,于30°C培养48h。
4、启动子的活性测定。
包括以下步骤:
a、培养,将“2、表达载体的构建”中构建的含有ptufA或pTAC的谷氨酸棒杆菌分别接种到2 ml 含有10 mg/L氯霉素的脑心浸出液(BHI)培养基中,30 °C、230 r/min培养过夜,然后按照1:100的比例稀释转接到新的2 ml BHI培养基中,使用高通量24孔深孔培养板,在相同的条件下培养24小时;
b、菌体收集,将培养好的菌液迅速置于冰上预冷,离心收集菌体,用PBS缓冲液清洗两次,重悬;
c、EGFP表达量测定:单位菌体的EGFP表达量定义为荧光测量值F与样品的OD600的比值,使用多功能酶标仪测量OD600和荧光强度,其结果如下表所示。
5、应用PtufA启动子在谷氨酸棒杆菌中表达淀粉酶。
a、淀粉酶表达载体的构建
按照相同方法将启动子PtufA插入淀粉酶探测载体p19-B0中,淀粉酶探测载体p19-B0与绿色荧光蛋白探测载体p19-A0的区别仅在于报告基因更换为淀粉酶基因。将构建好的质粒转化进谷氨酸棒杆菌中。
b、 酶活测定方法:取1%,pH6.0可溶性淀粉溶液50 μl,于60℃下水浴预热5 min后,加入粗酶液250 μl精确反应5 min后,加入450 μl 二硝基水杨酸(DNS),沸水浴反应5分钟,加水稀释20倍后用分光光度计在540 nm处测定吸光值,计算产生的还原糖量。标准曲线的绘制参见:史永昶、姜涌明. 五种α-淀粉酶测活方法的比较研究[J]. 微生物学通报, 1996-06-14 6:23酶活定义:一个淀粉酶单位相当于在60℃、pH6.0条件下,每分钟催化产生1 μmol还原糖(以葡萄糖计)所需酶量。酶活计算公式为:(5.1159╳OD540 -0.0353)╳稀释倍数÷5
经过淀粉酶活力的检测,带有启动子PtufA序列的淀粉酶基因表达载体在谷氨酸棒杆菌中的活力是33.6U/ml,而不带有启动子序列的对照载体没有检测到淀粉酶活力活力。
上述实验结果证明:
PtufA与蛋白编码序列直接相连后即可启动蛋白表达,并且可以在不添加任何化学诱导剂或者物理诱导条件的情况下组成型表达重组蛋白;
在绿色荧光蛋白报告基因的评测下,本发明的含有PtufA的载体的蛋白表达水平明显超过Ptac与保守SD序列在pXMJ19中的经典组合的蛋白表达水平。
通过SDS-PAGE分析,含有不同载体的谷氨酸棒杆菌的EGFP蛋白表达测试结果如图2所示。其中,含有ptufA的谷氨酸棒杆菌所对应的EGFP蛋白条带颜色深于含有pTAC的谷氨酸棒杆菌所对应的EGFP蛋白条带颜色,亦印证了PtufA的蛋白表达水平高于Ptac的蛋白表达水平。
此外,经淀粉酶基因的表达验证,证明PtufA也适用于其他基因在谷氨酸棒杆菌中的表达。
- 还没有人留言评论。精彩留言会获得点赞!