一种重组表达果聚糖蔗糖酶的基因工程菌株及其应用的制作方法
本发明涉及一种重组表达果聚糖蔗糖酶的基因工程菌株及其应用,属于基因工程和酶工程领域。
背景技术:
果聚糖蔗糖酶是糖基转移酶家族中的一员,它除了具有转糖基活性,还有水解活性,可以将蔗糖水解为葡萄糖和果糖。大部分果聚糖蔗糖酶具有广泛的受体活性,在转糖基过程中是以蔗糖作为其优先选择的底物供体,以木糖、蔗糖、乳糖等为受体,催化转移果糖残基到受体的碳链上,促进碳链延伸,从而形成低聚果糖、果聚糖以及低聚乳果糖等产物。由于低聚果糖、低聚乳果糖等低聚糖对人体健康有益,因此,果糖基转移酶的生产越来越受到人们的关注。目前已经发现多种细菌可以产果聚糖蔗糖酶,如多黏芽孢杆菌(Bacillus polymyxa)、枯草芽孢杆菌(Bacillus subtilis)、运动发酵单胞菌(Zymomonasmobilis)、金山乳杆菌(Lactobacillus sanfranciscensis)、淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)、粘性放线菌(Actinomycesviscosus)、肠膜明串珠菌(Leuconostocmesenteroides)、丁香假单胞杆菌(Pseudomonassyringae)、地衣芽孢杆菌(Bacillus licheniformis)等。这些菌株生产果聚糖蔗糖酶的能力差别较大,所产果聚糖蔗糖酶对受体的专一性及酶转化获得的产物性质也有较大区别。
低聚乳果糖(lactosucrose,LS)是一种三糖,它由β-D-半乳糖苷、α-D-葡萄糖苷和β-D-呋喃果糖苷残基组成,所以它可以被看作是一分子乳糖与一分子果糖的缩合物,或者是一分子半乳糖与一分子蔗糖的缩合物,其化学名称应为β-D-半乳糖基蔗糖,但习惯上,人们将其称为低聚乳果糖。低聚乳果糖是一种功能性低聚糖,它易溶于水,甜度约为蔗糖的70%,几乎不被生物体消化和吸收,是双歧杆菌的有效增殖因子,其增值效果比其他功能性低聚糖如低聚果糖、低聚半乳糖等更好。低聚乳果糖同时具有低热量、低龋齿、降低血液中的胆固醇、改善血脂、促进钙吸收等特殊的生理功能,可作为一种功能保健食品。国内对低聚乳果糖做了初步研究,还没有工业化生产的报道,而在日本低聚乳果糖已经进入市场多年。由于其具有广阔的应用前景,近年来低聚乳果糖的研究开发受到了极大地重视。
技术实现要素:
本发明第一个目的是提供一种产果聚糖蔗糖酶的重组短小芽孢杆菌(Brevibacillus brevis),是将来源于弯曲芽孢杆菌的编码果聚糖蔗糖酶的基因导入短小芽孢杆菌得到的基因工程菌。
所述编码果聚糖蔗糖酶基因核苷酸序列如SEQ ID NO.1所示。
本发明第二个目的是提供一种构建分泌表达果聚糖蔗糖酶的重组短小芽孢杆菌的方法,包括以下步骤:
1)扩增SEQ ID NO.1所示的目的基因,连接到载体pNCMO2上,转化E.coli JM109,涂布具有抗性的LB平板培养基,获取重组质粒pNCMO2-Lsc;
2)将重组质粒pNCMO2-Lsc通过电转化进入短小芽孢杆菌中,涂布具有抗性的TM平板培养基,获得短小芽孢杆菌基因工程菌。
本发明的第三个目的是提供一种利用所述的短小芽孢杆菌基因工程菌生产果聚糖蔗糖酶的方法,是将活化后的短小芽孢杆菌基因工程菌接种到发酵培养基中,于30℃、200r/min培养48小时,将获得的发酵液离心除菌体,获得的发酵上清液即为粗酶液。
所述发酵培养基的配方为:工业酵母粉1.7%、葡萄糖或蔗糖1%。
本发明的第四个目的是提供一种利用重组果聚糖蔗糖酶转化淀粉制备低聚乳果糖的方法,包括(1)利用所述的短小芽孢杆菌基因工程菌生产果聚糖蔗糖酶,(2)以蔗糖和乳糖为底物转化生产低聚乳果糖,底物蔗糖和乳糖浓度均为200g/L,加酶量为0.5-5U/g底物,起始pH6.0~7.0,反应温度35℃,150r/min的搅拌速度。
在本发明的一种实施方式中,所述加酶量为2U/g底物。
利用本发明构建得到的重组得到的短小芽孢杆菌发酵产重组果聚糖蔗糖酶,发酵上清液酶活在43U/mL。进一步利用该重组果聚糖蔗糖酶催化蔗糖和乳糖生成低聚乳果糖,转化率可达39.01%。本发明以食品安全的短小芽孢杆菌为表达宿主,重组生产果聚糖蔗糖酶,该重组菌株产酶水平高、发酵原料来源广泛,生产成本较低。
附图说明
图1重组菌摇瓶发酵产酶曲线
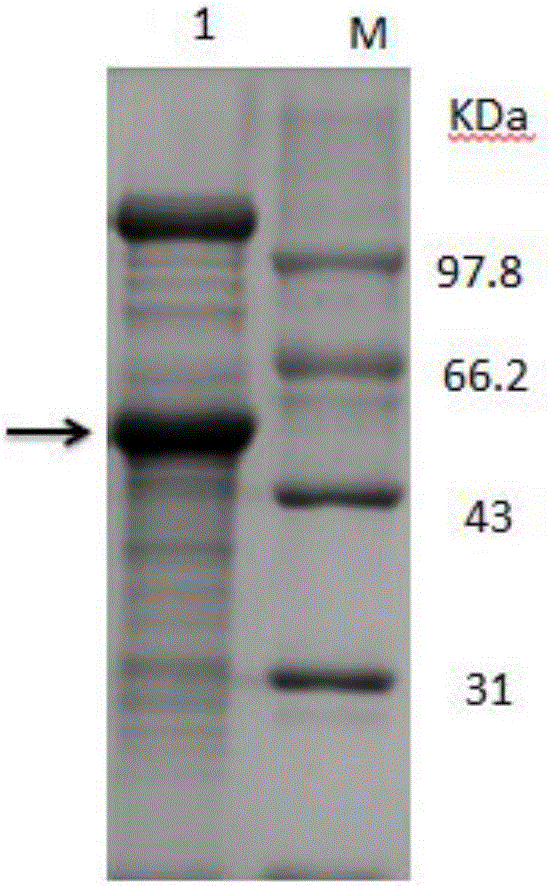
图2重组菌摇瓶发酵胞外上清SDS-PAGE电泳图;M:Marker,1:重组菌发酵上清
图3不同氮源对B.brevis摇瓶发酵生物量和产酶的影响
图4不同碳源对B.brevis摇瓶发酵生物量和产酶的影响
图5加酶量和反应时间对低聚乳果糖转化率的影响
图6温度对低聚乳果糖转化率的影响
图7 pH对低聚乳果糖转化率的影响
具体实施方式
实施例1弯曲芽孢杆菌果聚糖蔗糖酶编码基因的克隆及表达载体的构建
弯曲芽孢杆菌在LB液体培养基中培养2天,10000rpm离心收集菌体,无菌水洗涤,收集沉淀悬浮于500μL Tris-EDTA缓冲液,加入15uL溶菌酶,37℃下保温30min,再加入5μL RNA酶,37℃下保温30min,加入30μL 10%十二烷基硫酸钠和15μL蛋白酶K,37℃下保温60min,加入5M的NaCl 100μL和十六烷基三甲基溴化铵80μL,65℃下保温20min,用700μL的酚:氯仿:异戊醇体积比为25:24:1的混合溶剂抽提,10000rpm离心,上清液用700μL的氯仿:异戊醇体积比为24:1的混合溶剂抽提,10000rpm离心,上清液用1400μL体积的冰异戊醇混合,-20℃沉淀30min,10000rpm离心,沉淀加200μL70%浓度的乙醇清洗,10000rpm离心,沉淀用Tris-EDTA缓冲液溶解,即为弯曲芽孢杆菌总DNA;
根据数据库中的聚糖蔗糖酶基因设计引物P1、P2:
P1:5’-CGGGATCCAAAGGTAAAG GTGTAGATGAAG-3’
P2:5’-GGAATTCTTATTTTTTCTTTTCATCATACGTG-3’
以原始菌基因组为模板,克隆含编码信号肽序列的目的基因,PCR体系为:10μM引物P1和P2各1μL,2mM dNTPS 5μL,10×KOD-Plus-NeoBuffer 5μL,1U/μL的PrimeStar聚合酶1uL,模板0.5μL,加双蒸水补齐50μL。PCR条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min 30s,30个循环。得到序列如SEQ ID NO.1所示的编码果聚糖蔗糖酶的基因Lsc。将PCR产物和载体pNCMO2分别进行双酶切,并胶回收,于16℃连接过夜,转化E.coli JM109,涂布含有氨苄(100μg/mL)抗性的LB平板,37℃培养10-12h,挑取3个转化子,提取重组质粒并进行PCR和双酶切验证,然后对验证正确的重组质粒测定DNA序列,阳性克隆子即pNCMO2-Lsc。
实施例2短小芽孢杆菌的转化
1)新鲜TM平板(TM培养基:多聚蛋白胨1%,牛肉浸膏0.5%,酵母粉0.2%,葡萄糖1%)挑短小芽孢杆菌为Brevibacillus brevis(CCTCC 94025)单菌落接种于10ml TM培养基中,过夜培养。
2)测量摇瓶内OD,控制好接种量,使接种完毕后培养基的OD600在0.19-0.2之间。培养基为50mL GM培养基(蛋白胨0.5%,大豆蛋白胨0.5%,牛肉浸膏0.5%,酵母提取物0.25%,葡萄糖0.5%,α-甘油磷酸钠1.9%,维生素C 0.05%,MgSO40.012%)。37℃,200rpm培养至OD600=1.0(大约3-4小时)左右。
3)取全部菌液冰水浴10min,然后5000rpm,8min,4℃离心收集菌体。
4)用40ml预冷的电转缓冲液ETM(山梨醇9%,甘露醇9%,丙三醇10%)洗涤菌体,5000rpm,8min,4℃离心去上清,如此漂洗3次。
5)将洗涤后的菌体重悬于等500μL的ETM中,每管分装60μL。
6)将60μl感受态细胞中加入1-6μL质粒,冰浴孵育5min,加入预冷的电转杯(1mm)中,电击一次。电转仪设置:2.0kv,25uF 200Ω,1mm,电击1次.(持续时间4.5ms-5ms之间)。
7)电击完毕立即加入1mL复苏培养基TM,37℃,200rpm,复苏3h后,涂板。37℃,过夜培养,挑取菌落至TM新霉素培养基中,进行验证,正确后进行下一步产酶。
实施例3摇瓶发酵产酶
1)发酵培养
将实施例2中筛选得到的产果聚糖蔗糖酶菌株接种于TM培养基中,在30℃下培养12h后以5%接种量转接至TM发酵培养基中,30℃恒温培养44~48h产酶。发酵结束后,离心收集上清液即为粗酶液。
TM培养基(g/L):多聚蛋白胨10,牛肉粉5,酵母粉2,葡萄糖10,pH7.0。
2)酶活测定
酶活力测定方法将0.5mL 20%(w/v)的蔗糖溶液与0.5mL粗酶液在pH 7.0、20mmol/L的磷酸盐缓冲体系下混合均匀,在30℃水浴下反应20min,最后沸水浴煮沸10min终止反应,用高效液相法测定果糖、葡萄糖的生成量,确定酶活。色谱条件为:色谱柱:Shodex氨基柱;柱温:30℃;流动相:75%乙腈(经0.45μm膜过滤);流速:0.8mL/min;上样体积:10μL。该条件下每分钟转移1μmol葡萄糖所需的酶量定义为一个果聚糖蔗糖酶活力单位(U)。
由图1可以看出酶活随时间延长而逐渐增大,并且在48小时左右达到稳定,最大酶活力约为17U/ml,蛋白电泳结果显示在55kDa处有一条与理论分子量一致的条带(图2)。
实施例4TM培养基中摇瓶发酵产酶实验
1)一级种的制备:将短小芽孢杆菌单菌落挑在TM液体培养基中30℃、220rpm过夜培养,所得菌种为一级种。
3)摇瓶发酵:将二级种接种于50ml摇瓶中,TM培养基,30℃,培养约48小时。发酵液经过10000g离心除菌,上清即为果聚糖蔗糖酶原液,最终酶活为17U/mL。
实施例5不同氮源培养基中摇瓶发酵产酶实验
1)一级种的制备:将短小芽孢杆菌单菌落挑在TM液体培养基中30℃、220rpm过夜培养,所得菌种为一级种。
3)摇瓶发酵:以17g·L-1的工业酵母粉、工业蛋白胨、鱼粉蛋白胨、大豆蛋白胨、牛肉浸膏、酪蛋白、棉籽粉、多聚蛋白胨、玉米浆粉等为单一氮源,取代TM培养基中的氮源。分别配制发酵培养基,将一级种接种于其中培养约48小时。发酵液经过10000g离心除菌,上清即为果聚糖蔗糖酶原液,其中工业酵母粉作为氮源酶活最高,如图3,最终酶活为31.5U/mL。
实施例6不同碳源培养基中摇瓶发酵产酶实验
1)一级种的制备:将短小芽孢杆菌单菌落挑在TM液体培养基中30℃、220rpm过夜培养,所得菌种为一级种。
2)摇瓶发酵:以10g·L-1的淀粉、糊精、果糖、蔗糖、甘油和葡萄糖作为唯一的碳源配制发酵培养基,取代TM培养基中的碳源,将一级种接种于其中进行发酵产酶培养约48小时。发酵液经过10000g离心除菌,上清即为果聚糖蔗糖酶原液,最终酶活为37U/mL。从图4可以看出,在所用碳源中,以蔗糖和葡萄糖为碳源时菌体的生物量最大,且对产酶的促进最明显。
实施例7加酶量和反应时间对低聚乳果糖生产的影响
在初始反应温度30℃,起始pH 7.0,蔗糖和乳糖浓度均为200g/L的情况下,加酶量分别控制为0.5、1、2、3、4、5U/g底物,设置水浴摇床温度为30℃、转速150r/min,从第2h开始每隔2h取样煮沸终止反应,直至反应达到平衡。产物用HPLC进行检测。
HPLC检测条件为:低聚乳果糖产物中的低聚乳果糖、蔗糖、乳糖以及单糖的量采用HPLC来确定。色谱条件为:安捷伦1260HPLC色谱仪,安捷伦自动进样器,色谱柱ShodexAsahipak NH2-504E(4.6mm×250mm),示差检测器为安捷伦G1362A;流动相采用75%(v/v)乙腈和水的混合溶液,流速为0.8mL/min,柱温设定为35℃。采用外标法,根据保留时间和峰面积确定相应低聚乳果糖的浓度。
结果如图5所示,加酶量为0.5U/g底物时,前期反应速率较低,反应进行10h达到平衡,低聚乳果糖转化率为31.89%。而加酶量为1、2、3、4、5U/g底物时,在2-6h时,他们的转化率比较接近,在24.41%-29.98%之间。在6h之后,加酶量为3、4、5U/g底物的样品中,低聚乳果糖的转化率缓慢增加,并接近平衡点,而加酶量为1、2U/g底物的样品在6h之后低聚乳果糖的转化率仍然继续增加,在反应进行到8h时可达到平衡。其中加酶量为2U/g底物的样品中低聚乳果糖的转化率可达到37%。
实施例8:温度对低聚乳果糖生产的影响
在起始pH 7.0,蔗糖和乳糖浓度均为200g/L的情况下,加酶量为2U/g底物,转速150r/min,使反应温度分别为25、30、35、40、45、50℃,在反应进行到8h时取样煮沸终止反应,直至反应达到平衡。产物用HPLC进行检测。
结果如图6所示,在不同温度下低聚乳果糖的转化率差别较大。在35℃时,低聚乳果糖的转化率最高,可达到38.32%。在低于35℃时,转化率随着温度的升高而升高,温度过低时,酶活会受到抑制。而温度高于35℃之后,转化率随着温度升高开始下降,可能是由于温度升高,有部分果聚糖蔗糖酶失活。故选择最适反应温度为35℃(酶的最适反应温度为30℃)。
实施例9:pH对低聚乳果糖生产的影响
在起始温度为35℃时,蔗糖和乳糖浓度均为200g/L的情况下,加酶量为2U/g底物,转速150r/min,使反应pH分别为5、5.5、6、6.5、7、7.5、8,在反应进行到8h时取样煮沸终止反应,直至反应达到平衡。产物用HPLC进行检测。
对环境酸碱度敏感是酶分子的特征之一。每一种酶只在一定的pH体系下才会表现反应的最大速度,高于或低于此值,反应速度均会下降。结果如图7所示,在pH 6.0时低聚乳果糖的转化率为39.01%,为不同pH情况下的最高值。此外,在pH 6.0-7.0这个范围内时,转化率都维持在较高值。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!