利用CRISPR/Cas9技术敲除人PD‑1基因构建可靶向MSLN新型CAR‑T细胞的方法及其应用与流程
本发明涉及基因工程、免疫学和肿瘤学领域,尤其是涉及一种利用CRISPR/Cas9技术敲除人PD-1基因构建可靶向MSLN(Mesothelin,间皮素)新型CAR-T细胞的方法及其应用。
背景技术:
随着工业化进程不断深入,大气污染、环境问题、食品安全以及人们生活方式的改变,促使癌症成为本世纪威胁人类健康的头号杀手和社会发展的主要障碍。癌症的免疫细胞生物治疗技术是一种新兴的、具有显著疗效的肿瘤治疗模式,它是运用基因工程技术对从病人体内采集的免疫细胞进行体外修饰、培养和扩增,再回输到病人体内,来激发和增强机体自身免疫功能,从而达到抑制肿瘤生长和治疗肿瘤的目的。细胞免疫治疗是继手术、放疗和化疗之后的第四大肿瘤治疗技术。在诸多癌症免疫细胞治疗方法中,近两年脱颖而出的是嵌合抗原受体(Chimeric antigen receptor,CAR)T细胞肿瘤靶向治疗(即CAR-T细胞治疗)。
目前,CAR-T细胞免疫疗法在欧美及亚洲各国都正积极开展临床试验,其中美国开展临床试验项目最多,宾夕法尼亚大学医院、费城儿童医院、美国癌症研究院(NCI)、Fred Hutchinson癌症研究中心、纪念斯隆凯特琳癌症中心和西雅图儿童医院等是最早开展CAR-T细胞疗法的研究机构。传统国际制药巨头如诺华、葛兰素史克、辉瑞、强生等,以及新兴国际生物制药公司如Juno、Kite、Celgene、Cellectis、Bluebird都投入了大量资金和人力到CAR-T疗法的研发中,推动这一极具前景的疗法尽早进入到临床,从而造福癌症患者(A service of the U.S.National Institute of Health.http://clinicaltrials.gov)。
CAR-T细胞疗法在晚期难治性白血病和淋巴瘤患者中进行的早期临床试验已经显示出非常振奋人心的结果。宾夕法尼亚大学研究人员在世界顶尖医学杂志《新英格兰医学杂志》上发表的一项临床试验结果显示,在接受了CTL019输注(靶向CD19抗原的CAR-T疗法)的30名复发性或难治性ALL受试者中,治疗后1个月有27名患者获得完全缓解,其中甚至包括15位已经接受过骨髓干细胞移植的患者。6个月时无反复生存率为67%(20人),总体生存率为78%(23人)。另外还有1名患者2年随访时仍然持续完全缓解(Grupp SA et al,N Engl J Med 2013,368(16):1509-18)。
NCI开展的一项临床试验也展现了良好的结果,该试验入组了20名ALL患儿,在接受CAR-T细胞疗法后,14名达到了完全缓解;12名患儿的骨髓中已检测不到未成熟的白血病细胞,其中10名又接受了干细胞移植,至今无癌生存。研究结果还表明,CAR-T细胞疗法可帮助化疗无应答的患者顺利地过度到骨髓移植治疗。纪念斯隆凯特林癌症中心与NCI在成人患者中开展的1期临床试验也取得了类似的结果(Mazzarella L.2013 American Society of Haematology meeting[J]2014,8:390)。
除白血病之外,CAR-T疗法对淋巴瘤也显示了喜人的疗效,NCI领导的CAR-T细胞临床试验招募了15名成人受试者,其中的绝大多数(9名)都患有晚期弥漫性大B细胞淋巴瘤(DLBCL)。据Kochenderfer博士及NCI的同事报道,该临床试验的大多数患者都达到了缓解,在7例可评估的DLBCL受试者中4例获得完全缓解,持续时间从9个月到22个月(Kochenderfer JN et al,Blood 2012,119(12):2709-20)。
虽然针对白血病和淋巴瘤的CAR-T细胞临床试验的疗效可以用革命性来形容,这也是投资者对这个技术充满希望的原因,但90%的癌症是实体瘤,所以实体瘤疗效是这个技术的一个关键门槛。最近,制药巨头诺华公司和美国宾州大学的初步研究表明,CAR-T疗法的安全性和有效性在实体瘤方面似乎同样出众。这一结果也将市场更广阔的实体瘤治疗领域展现在CAR-T疗法面前。在诺华-宾大此次进行的临床一期研究中,研究人员使分离获得的T细胞识别一种名为间皮素(mesothelin,MSLN)的蛋白,这种蛋白在多种实体瘤中都为高表达。研究人员在五名患者身上测试了这种名为CART-meso的新疗法,其中两人患有卵巢癌、两人患有上皮间质瘤(一种肺癌)、另有一人患有胰腺癌。这五名患者此前接受过多种疗法,均告无效。在此次临床一期研究中,尽管五位受试患者在接受治疗时出现了败血症、气短以及白细胞水平升高等副作用,但研究人员并未观察到重大的副作用事件发生。而直到患者接受T细胞回输后的第28天,患者体内仍然可以检测到这种修饰后T细胞的存在,同时还有迹象显示这些T细胞已经开始向肿瘤部位富集。负责这一研究的宾大教授Dr.Janos Tanyi表示这些结果表明,对于实体瘤来说CAR-T疗法的安全性是有保证的。另一方面,影像学手段显示其中一名患者体内的实体瘤体积出现萎缩的迹象,而另外一名肺癌患者肺部的恶性细胞出现减少的迹象。这与之前CAR-T疗法在白血病等非实体瘤癌症方面的治疗效果有段距离。这一早期研究暗示,CAR-T疗法在实体瘤治疗方面或许还有更长的路要走(2015Workshop of Cancer and Immunotherapeutics)。更多种类的实体瘤以及更多的肿瘤表面特异性靶点抗原有待进一步确认。
此外,癌细胞在长期的进化过程中也发展出了一套自身的逃逸机制,可以躲过T细胞的摧毁,进而肆无忌惮地扩张。研究人员发现T细胞表面有一个重要的“接头”分子,他们把它称为“程序性死亡受体-1”或PD1(Programmed Death 1),正常状态下,它都能明辨“敌我”,但当癌细胞表面出现“PD-L1”(Programmed Death Like 1)的时候,情况就变了。PD-L1蛋白正是PD1的配体,它们俩一旦结合便会向T细胞传递一种负向调控信号,诱导T细胞进入静息状态,让其无法识别癌细胞,并且使T细胞自身增殖减少或凋亡,有效解除机体的免疫反应,因此癌细胞可以毫不费力就“登堂入室”。值得一提的是,许多癌细胞表面都存在这种PD-L1蛋白,包括乳腺癌、肺癌、胃癌、肠癌、食管癌、卵巢癌、宫颈癌、肾癌、膀胱癌、胰腺癌、神经胶质瘤、黑色素瘤等。于是,科学家们开始思索如何能阻止PD1与PD-L1的结合,帮助T细胞恢复活性,正常识别癌细胞的威胁,进而全力攻击癌细胞。因此各大国际制药巨头纷纷致力于PD-1抑制剂和抗体药物的临床研究和开发。基于PD-1分子在肿瘤免疫逃逸过程中的重要作用,我们利用最新的基因组编辑技术CRISPR/Cas9,在表达靶向MSLN CAR分子的T细胞中将PD-1基因敲除,阻断癌细胞对T细胞的逃逸和抑制作用,使得CAR-T细胞能更加高效地识别和攻击癌细胞。
技术实现要素:
本发明的第一个目的在于提供一种利用CRISPR/Cas9技术敲除人PD-1基因构建可靶向MSLN新型CAR-T细胞的方法。
本发明的第二个目的在于提供两种新型CAR-T细胞。
本发明的第三个目的在于提供上述新型CAR-T细胞的应用。
为实现上述第一个目的,本发明采用以下内容:
一种利用CRISPR/Cas9技术敲除人PD-1基因构建可靶向MSLN新型CAR-T细胞的方法,该方法利用CRISPR/Cas9技术通过使用携带人PD-1基因sgRNA和Cas9-HF核酸酶的病毒液同步感染CAR-T细胞来敲除人PD-1基因,得到可靶向MSLN新型CAR-T细胞;其中,人PD-1基因的mRNA序列由SEQ ID No.46至SEQ ID No.50所示的人PD-1基因外显子组成,靶向sgRNA序列由SEQ ID No.51至SEQ ID No.56所示的人PD-1基因靶向sgRNA序列PD-1-Tn组成;Cas9-HF核酸酶由序列表SEQ ID No.57至SEQ ID No.60所示的Cas9-HF-NLS-FLAG核酸酶序列组成。
进一步地,所述方法包括以下步骤:
1)构建携带人PD-1基因sgRNA寡聚核苷酸病毒载体
所述sgRNA在PD-1基因上的靶序列符合5’-N(20)NGG的序列排列规则,且所述sgRNA在PD-1基因上的靶序列位于基因的外显子;所述sgRNA在PD-1基因上的靶序列是唯一的,并且所述sgRNA在PD-1上的靶位点序列由SEQ ID No.51至SEQ ID No.56所示的人PD-1基因靶向sgRNA序列PD-1-Tn组成;合成sgRNA寡聚核苷酸双链,并退火,之后与线性化的慢病毒载体连接,获得携带PD-1基因sgRNA寡聚核苷酸病毒载体;
2)构建携带Cas9-HF核酸酶病毒载体
在Cas9核酸酶氨基酸序列上依次进行1-4个位点的突变,包括N497A、R661A、Q695A和Q926A,得到高保真Cas9-HF核酸酶,之后将高保真Cas9-HF克隆进慢病毒载体,获得Cas9-HF核酸酶病毒载体;
3)转导T细胞
按照MOI=1-10的值将携带PD-1基因sgRNA和Cas9-HF核酸酶的病毒液同步感染CAR-T细胞,完成敲除人PD-1基因,获得敲除PD-1基因以及表达靶向MSLN CAR分子的T细胞,即新型CAR-T细胞。
为实现上述第二个目的,本发明采用以下内容:
一种新型CAR-T细胞,该T细胞中PD-1基因被敲除并且表达靶向MSLN的CAR分子,该CAR分子由序列表SEQ ID No.1至SEQ ID No.22所示的序列组成;
其中,SEQ ID No.1至SEQ ID No.2为引导序列;
SEQ ID No.3至SEQ ID No.12为scFv序列;
SEQ ID No.13至SEQ ID No.14为CD8铰链区;
SEQ ID No.15至SEQ ID No.16为CD8跨膜区;
SEQ ID No.17至SEQ ID No.18为4-1BB胞内结构域;
SEQ ID No.19至SEQ ID No.22为CD3ζ结构域。
将所述CAR分子克隆进慢病毒载体,构建单一编码框的全长CAR序列表达框,利用EF1alpha启动子(序列表SEQ ID No.45)进行表达。
一种新型CAR-T细胞,该T细胞中PD-1基因被敲除并且表达靶向MSLN的CAR分子,该CAR分子由序列表SEQ ID No.23至SEQ ID No.44所示的序列组成;
其中,SEQ ID No.23至SEQ ID No.24为引导序列;
SEQ ID No.25至SEQ ID No.34为scFv序列;
SEQ ID No.35至SEQ ID No.36为CD8铰链区;
SEQ ID No.37至SEQ ID No.38为CD8跨膜区;
SEQ ID No.39至SEQ ID No.40为4-1BB胞内结构域;
SEQ ID No.41至SEQ ID No.44为CD3ζ结构域。
将所述CAR分子克隆进慢病毒载体,构建单一编码框的全长CAR序列表达框,利用EF1alpha启动子(序列表SEQ ID No.45)进行表达。
为实现上述第三个目的,本发明还公开了上述可靶向MSLN新型CAR-T细胞在制备用于治疗实体肿瘤的制剂中的应用,所述肿瘤为MSLN阳性肿瘤细胞。
上述制备方法可以用来制备靶向ALK、CD171、CDK4/6、CEA、CLAN18(Claudin18)、CTLA-4、EGFR/EGFRvⅢ、GD2、GPC-3(Glypican-3)、FAP、GPC3、MET、MUC16、MUC1、HER2、IL-13、PD-1/PD-L1、PSMA、RANKL或VEGF/VEGFR/VEGFR2的新型CAR-T细胞。
本发明具有以下优点:
本发明应用CRISPR/Cas9技术将CAR-T细胞中的人PD-1基因敲除,阻断肿瘤细胞对T细胞的逃逸和抑制作用,得到可靶向MSLN新型CAR-T细胞,该新型CAR-T细胞能更有效地靶向攻击肿瘤细胞,可用来制备用于治疗实体肿瘤的制剂,尤其是表达MSLN阳性肿瘤细胞的制剂。本发明的制备方法步骤简单、获得的CAR-T细胞对肿瘤细胞的杀伤率高。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
图1是KD-020 CAR分子的表达。
图2是KD-021 CAR分子的表达。
图3是Cas9-HF核酸酶及PD-1蛋白的表达。
图4是KD-020 CAR-T细胞对Ovcar3细胞的杀伤率。
图5是KD-021 CAR-T细胞对BxPC-3细胞的杀伤率。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例对本发明做进一步的说明。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
实施例
一种利用CRISPR/Cas9特异性敲除人PD-1基因构建靶向MSLN的新型CAR-T细胞的方法,包括以下步骤:
1)携带PD-1基因sgRNA寡聚核苷酸病毒载体的构建
sgRNA在PD-1基因上的靶序列符合5’-N(20)NGG的序列排列规则,且sgRNA在PD-1基因上的靶序列位于基因的外显子;sgRNA在PD-1基因上的靶序列是唯一的,并且sgRNA在PD-1上的靶位点序列由SEQ ID No.51至SEQ ID No.56所示的人PD-1基因靶向sgRNA序列PD-1-Tn组成;
人PD-1基因的mRNA序列由SEQ ID No.46至SEQ ID No.50所示的人PD-1基因外显子组成;
合成sgRNA寡聚核苷酸双链(生工生物工程(上海)股份有限公司合成),混合后于95℃退火5分钟,之后与线性化的慢病毒载体lentiGuide-Puro连接,获得携带PD-1基因sgRNA寡聚核苷酸病毒载体;
2)携带Cas9-HF核酸酶病毒载体的构建
在Cas9核酸酶氨基酸序列上依次进行1-4个位点的突变,包括N497A、R661A、Q695A和Q926A,得到高保真Cas9-HF核酸酶,由序列表SEQ ID No.57至SEQ ID No.60所示的Cas9-HF-NLS-FLAG核酸酶序列组成,之后将高保真Cas9-HF克隆进慢病毒载体lentiCas9-Blast,获得Cas9-HF核酸酶病毒载体;
3)转导T细胞
按照MOI=1-10的值将携带PD-1基因sgRNA和Cas9-HF核酸酶的病毒液同步感染靶向MSLN的CAR-T细胞(记为KD-020 CAR-T细胞和KD-021 CAR-T细胞),完成敲除人PD-1基因,获得敲除PD-1基因以及表达靶向MSLN的CAR分子T细胞,即得到敲除基因后的新型CAR-T细胞。
两种特异CAR分子,分别记为KD-020 CAR分子和KD-021 CAR分子。其中,KD-020CAR分子由序列表SEQ ID No.1至SEQ ID No.22所示的序列组成;其中,SEQ ID No.1至SEQ ID No.2为引导序列;SEQ ID No.3至SEQ ID No.12为scFv序列;SEQ ID No.13至SEQ ID No.14为CD8铰链区;SEQ ID No.15至SEQ ID No.16为CD8跨膜区;SEQ ID No.17至SEQ ID No.18为4-1BB胞内结构域;SEQ ID No.19至SEQ ID No.22为CD3ζ结构域。KD-021CAR分子由序列表SEQ ID No.23至SEQ ID No.44所示的序列组成;其中,SEQ ID No.23至SEQ ID No.24为引导序列;SEQ ID No.25至SEQ ID No.34为scFv序列;SEQ ID No.35至SEQ ID No.36为CD8铰链区;SEQ ID No.37至SEQ ID No.38为CD8跨膜区;SEQ ID No.39至SEQ ID No.40为4-1BB胞内结构域;SEQ ID No.41至SEQ ID No.44为CD3ζ结构域。将CAR分子克隆进慢病毒载体,构建单一编码框的全长CAR序列表达框,利用EF1 alpha启动子(序列表SEQ ID No.45)进行表达。
对获得的KD-020 CAR-T细胞和KD-021 CAR-T细胞进行体外活性分析
1)T细胞分离培养
通过密度梯度离心分离新鲜的外周血单核细胞(PBMC,peripheral blood mononuclear cell);利用偶联anti-CD3和anti-CD28抗体的paramagnetic beads(Dynabeads ClinExVivo CD3/CD28,Invitrogen,Camarillo,CA,USA)富集CD3+细胞,磁珠与细胞比例为3:1;细胞稀释到TNC(total nucleated cell)浓度为(10-30)×106/mL,在培养皿中与磁珠在室温共孵育2-3小时;利用Magnetic particles concentrator(MPC)(Invitrogen)富集CD3+细胞;含有CD3+的细胞在培养皿中重悬于培养液(OpTmizerTM CTSTMT-Cell Expansion SFM,Life Technologies)中,终浓度为1×106cells/mL。在37℃、5%CO2培养箱中培养2天。
2)病毒液的制备
将KD-020 CAR分子或KD-021 CAR分子、人PD-1基因sgRNA以及高保真Cas9-HF核酸酶DNA片段分别克隆进慢病毒穿梭载体;包装载体按照Lenti-X Packaging Single Shots(Takara)说明书进行制备。所有载体进行高纯度无内毒素抽提,共转染Lenti-X 293T细胞,转染后6h更换为完全培养基,培养48h和72h后,分别收集富含慢病毒颗粒的细胞上清液,病毒上清液通过超离心浓缩病毒。
3)敲除人PD-1基因的KD-020 CAR-T细胞或KD-021 CAR-T细胞的制备
培养T细胞至浓度为(1-2)×106/ml;将状态良好的细胞接种到24孔板,使细胞浓度为1×105/ml细胞,接种细胞数量因细胞的生长速度而略有不同,一般是保证第二天进行病毒感染的时候细胞汇合率介于50-70%之间;第二天将适量的携带KD-020 CAR分子或KD-021CAR分子以及人PD-1基因sgRNA的病毒液和携带高保真Cas9-HF核酸酶的病毒液一同加入细胞培养瓶后,封好口,放入平角离心机后,低速(500g-1000g/min)离心1h,然后放入培养箱中37℃培养。感染后48小时后可以进行下一步的功能实验。
4)利用流式细胞术分析检测CAR分子的表达
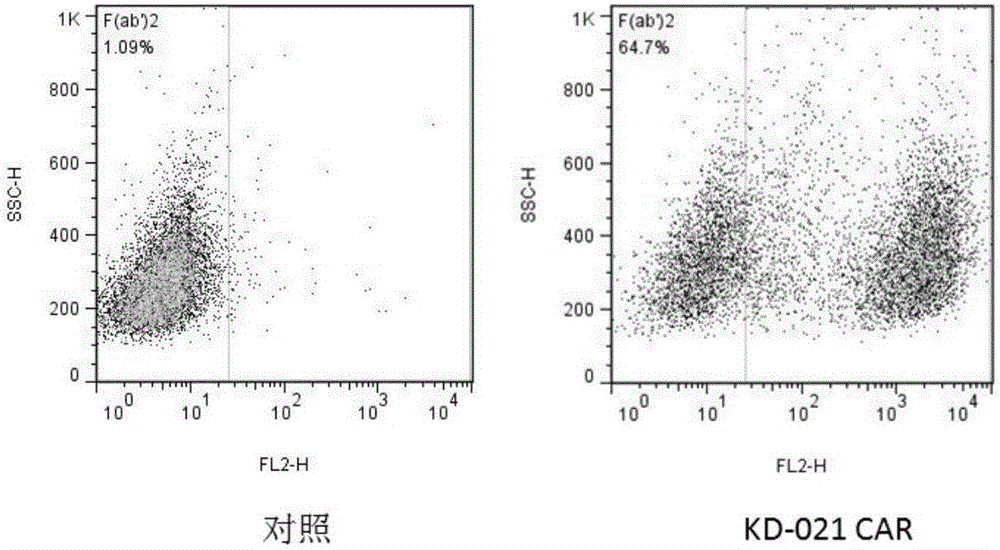
离心细胞,用PBS清洗两次后重悬于FACS液中(含0.1%叠氮化钠和0.4%BSA的PBS);将Biotin-labeled polyclonal goat anti-mouse-F(ab)2抗体(anti-Fab,Jackson Immunoresearch)加入细胞悬液中,4℃孵育30分钟;清洗细胞两次后,加入phycoerythrin(PE)-labeled streptavidin(BD Pharmingen),室温30分钟;BD FacsCanto II用于获取染色细胞,FlowJo用于分析结果。如图1所示,对照组为感染空载体病毒液的T细胞,几乎检测不到CAR分子的表达;而在感染KD-020 CAR分子病毒液的T细胞中,CAR分子的表达率达到47.7%。如图2所示,对照组为感染空载体病毒液的T细胞,几乎检测不到CAR分子的表达;而在感染KD-021 CAR分子病毒液的T细胞中,CAR分子的表达率达到64.7%。
5)Cas9-HF的表达及PD-1基因敲除的验证
首先利用western blotting检测了Cas9-HF核酸酶的表达。感染病毒后的细胞经过离心、清洗以后在含有蛋白酶抑制剂的RIPA裂解液中裂解1小时,高速离心后得到的裂解上清液与4x LDS上样缓冲液混合后在10%Bis-Tris预制胶(Life technologies)中进行分离,然后通过电转将蛋白转移到PVDF膜上。PVDF膜在含5%脱脂奶粉的TBST中封闭一小时,在1:1000的兔抗HA抗体中4℃孵育过夜。用TBST清洗膜3次,用1:5000偶联HRP的羊抗兔IgG二抗室温孵育1小时。用ECL Plus发光液孵育5分钟后,在Tanon 9500机器中曝光。如图3所示,相对于没有感染病毒液的对照T细胞而言,在感染Cas9-HF核酸酶病毒液的T细胞中有很强的Cas9-HF蛋白表达(图3中A)。
接下来利用western blotting检测PD-1蛋白在CAR-T细胞中的表达情况。感染病毒后的细胞经过离心、清洗以后在含有蛋白酶抑制剂的RIPA裂解液中裂解1小时,高速离心后得到的裂解上清液与4x LDS上样缓冲液混合后在10%Bis-Tris预制胶(Life technologies)中进行分离,然后通过电转将蛋白转移到PVDF膜上。PVDF膜在含5%脱脂奶粉的TBST中封闭一小时,在1:1000的兔抗人PD-1抗体中4℃孵育过夜。用TBST清洗膜3次,用1:5000偶联HRP的羊抗兔IgG二抗室温孵育1小时。用ECL Plus发光液孵育5分钟后,在Tanon 9500机器中曝光。如图3所示,相对对照组,PD-1的蛋白表达量在敲除组有明显的下降(图3中B和C)。
6)KD-020 CAR-T细胞杀伤测试
利用7-AAD/CFSE细胞毒性测试试剂盒评估KD-020 CAR-T细胞对肿瘤细胞OVCAR-3的杀伤力。CSFE标记肿瘤细胞后,以每孔2×104的细胞铺于培养板中,分别以10:1、5:1和1:1的比例将KD-020 CAR-T细胞加入肿瘤细胞中,培养20小时后离心去上清,细胞沉淀清洗之后用7AAD染色,BD FacsCanto II用于获取染色细胞,FlowJo用于分析结果。如图4所示,相对于不感染病毒和感染空载体病毒液的对照组,KD-020 CAR-T细胞对靶细胞OVCAR-3有明显的杀伤作用,并且在KD-020 CAR-T细胞中敲除人PD-1基因能显著提高该杀伤率。
7)KD-021 CAR-T细胞杀伤测试
利用7-AAD/CFSE细胞毒性测试试剂盒评估KD-021 CAR-T细胞对肿瘤细胞BxPC-3的杀伤力。CSFE标记肿瘤细胞后,以每孔2×104的细胞铺于培养板中,分别以10:1、5:1和1:1的比例将KD-021 CAR-T细胞加入肿瘤细胞中,培养20小时后离心去上清,细胞沉淀清洗之后用7AAD染色,BD FacsCanto II用于获取染色细胞,FlowJo用于分析结果。如图5所示,相对于不感染病毒和感染空载体病毒液的对照组,KD-021 CAR-T细胞对靶细胞BxPC-3有明显的杀伤作用,并且在KD-021 CAR-T细胞中敲除人PD-1基因能显著提高该杀伤率。
本发明的CAR分子能特异性靶向识别MSLN阳性的肿瘤细胞。本发明的Cas9-HF核酸酶能有效降低CRISPR/Cas9基因组编辑过程中的脱靶现象。利用本发明方法敲除PD-1基因后得到的靶向MSLN新型CAR-T细胞可用于评估对实体瘤癌细胞的靶向杀伤力,对正常细胞的副作用,以及用于卵巢癌、胰腺癌及肺癌、乳腺癌等其他各类实体瘤病症。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!
- 用CRISPR/Cas9技术易于筛选获得目的基因敲除细胞系的方法及产品与制造工艺
- 一种Candida amazonensis的FLP/FRT基因敲除方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 利用CRISPR/Cas9敲除人PD‑1基因构建靶向CD19CAR‑T细胞的方法与制造工艺
- 一种构建基因替代小鼠研究野生型和突变体非肌性肌球蛋白重链II功能的方法与制造工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 猪ApoE基因敲除打靶载体及其构建方法和应用与制造工艺
- 一种血小板减少症的斑马鱼模型的制造方法与工艺
- 基于CRISPR技术敲除FUT8基因的方法与制造工艺