一种食用菌液体菌种细菌污染检测方法与流程
本发明涉及一种液体菌种质量检测的方法,尤其涉及一种食用菌工厂化栽培过程中液体菌种的质量检测方法,属于微生物领域。
背景技术:
我国食用菌工厂化产业经历了20多年的发展历程,栽培设施硬件和技术水平均有了巨大的进步与创新。菌种制备作为食用菌工厂化栽培过程的重要环节,逐渐由传统的基于固体培养基料的二级、三级种生产工艺发展为具有纯度高、活力强、周期短、成本低等优点的液体菌种生产工艺。液体菌种的应用大大缩短食用菌栽培周期,为食用菌工厂化高效标准化生产奠定了重要基础,但液体菌种生产过程极易产生细菌污染,并且传统固体菌种质量检查方法很难用来对液体菌种进行质控。
目前文献报道的有关食用菌液体菌种细菌污染的检测方法,主要包括感观判断、显微镜观察、酸碱度测定以及培养检测等。通过颜色、气味以及形态等指标的感观判断,虽然对于菌种发酵早期污染有较高准确度,但对始于发酵后期的污染易造成失误,同时并非所有细菌污染均会形成明显的感官特征,并且主观性的感官判断缺乏统一标准;显微镜观察以及基于酸碱度变化的测定对液体菌种中的少量细菌污染检测精度不够,因此这些方法均可能形成误判,从而可能造成生产上的严重损失。与上述检测方法相比,培养方法可较为准确地判断液体菌种污染状况,但由于培养时间一般需要24小时至48小时,检测时效性较差,可能延误液体菌种最佳接种时间,降低液体菌种发酵设备的利用效率。因此建立快速、精确的细菌污染检测技术,是液体菌种技术安全、高效应用的关键。
有关食用菌液体菌种质量检测的专利技术申请只有1件(CN 105087750A,“食用菌液体菌种检测器”),是一种用于液体菌种浓度检测的装置。针对液体菌种细菌污染检测的专利申请信息几乎未见。
技术实现要素:
本发明的目的在于提供一种快速、精确测定食用菌液体菌种污染细菌数量的检测方法。其基本理念是:运用BAClight染色法对经过了特异性分离的食用菌液体菌种中的污染细菌进行荧光染色,通过建立细菌浓度与荧光定量指标的数学关系模型,快速、精确测定食用菌液体菌种污染细菌数量。
为了实现以上目的,本发明的技术方案如下:
本发明提供了一种食用菌液体菌种细菌污染检测方法,包括如下步骤:
1)标准曲线制备:
分别对获得的各稀释度的代表污染细菌稀释菌悬液进行NB平板培养计数和荧光染色测定,所述的代表污染细菌为食用菌液体菌种常见污染细菌污染细菌G-和G+类污染细菌中分别至少一种,如:假单胞菌(G-)和枯草芽孢杆菌(G+);随后根据各稀释度菌悬液平板计数结果(Bq)及相应荧光染色测定结果(Fg)建立标准曲线,以明确每种代表污染细菌数量与荧光值之间线性关系范围。
进一步地,所述的代表污染细菌可以是两种或者多种代表污染细菌株;优选地,所述的标准曲线可以是所使用的代表污染细菌株标准曲线的拟合标准曲线。
2)根据食用菌菌丝与细菌细胞个体大小及形态的差异性,采用孔径适宜的滤膜,即:适合过滤食用菌菌丝的滤膜,如:孔径5μm尼龙网,对液体菌种进行过滤,将食用菌丝球从液体菌种培养液滤除,避免其对污染细菌定量检测产生干扰,优选地,重复过滤3次;随后,对滤液进行离心,弃去培养液,并利用无菌生理盐水对菌体沉淀物进行洗涤,再沉淀,取无菌水对沉淀细菌细胞进行再悬浮处理,并进行梯度稀释形成系列梯度菌悬液。
3)对步骤2)中获得的污染细菌系列梯度菌悬液进行染色并测定荧光值,方法同步骤1)中的标准曲线制备,并依据标准曲线计算食用菌液体菌种中污染细菌浓度。
4)校正系数和校正公式的计算:通过待测菌种定量加入典型污染菌,形成模拟细菌污染液体菌种,并采用步骤2)及3)检测计算其污染细菌浓度(测量值),并与液体菌种中实际掺入污染细菌浓度比对,获得校正系数;其校正公式为:实际值=测量值×校正系数。其中,校正系数是考虑抽滤过程污染细菌菌体有一部分仍粘附于食用菌菌丝球中,从而使得通过上述方法获得的污染细菌浓度低于实际浓度,因此建立了一个校正公式。
通过上述技术方案,本发明达到了如下的有益效果:
本发明提供的液体菌种细菌污染检测方法可以把检测时间控制在90分钟内,测定结果与基于培养的检测结果误差小;相对于现有技术中的感官判断及镜检检测方法具有明显的准确度优势,并且相对于传统培养检测法具有便捷快速优势,因此是一种快捷、准确的食用菌液体菌种细菌污染检测方法;本发明方法针对液体菌种中污染细菌活细胞进行精确的定量测定,从而为食用菌液体菌种工厂化应用提供了快速、准确、便捷的检测手段,具有较广泛的应用推广价值。
附图说明
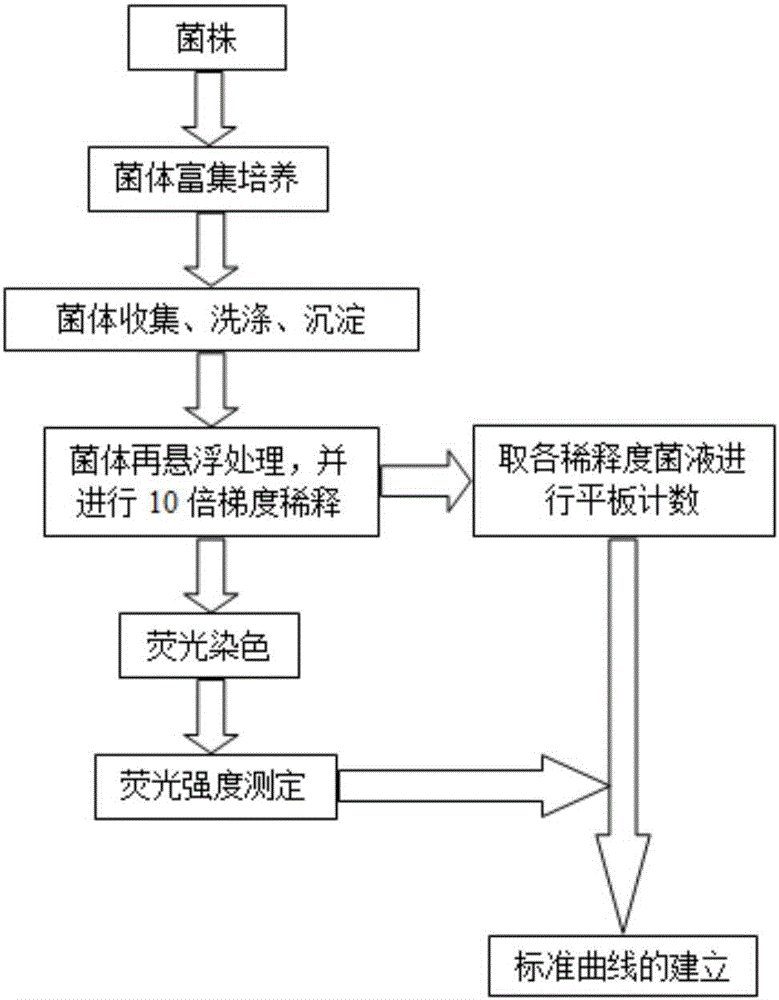
图1是本发明食用菌液体菌种污染细菌数量荧光染色定量测定标准曲线建立流程图。
图2是本发明一种食用菌液体菌种中污染细菌分离与检测流程图。
图3是本发明模拟细菌污染的食用菌液体菌种中细菌数量测定及校正系数确定流程图。
图4是本发明中两种典型污染细菌的荧光染色强度与平板计数结果的关系曲线(标准曲线)。图中分别列出了荧光假单胞菌和枯草芽孢杆菌活菌浓度与BAClight染色绿荧光强度之间的数学关系以及两者拟合后的活菌数量与绿荧光强度之间的数学关系。
图5是抽滤装置示意图。其中,无菌环境指超净工作台环境,确保空气中杂菌对抽滤过程产生污染。图中,1.滤杯,2.夹子,3.滤头,4.锥形瓶,5.真空泵。
具体实施方式
为了阐明本发明的技术方案及技术目的,下面结合附图及具体实施方式对本发明做进一步的介绍。
实施例1:
实施例1是本发明所提供的食用菌液体菌种细菌污染检测方法的一种具体实施方式,包括以下步骤:
1.标准曲线制备
图1是本发明食用菌液体菌种污染细菌数量荧光染色定量测定标准曲线建立流程,分别采用平板计数与荧光染色两种方法获得细菌浓度数值,并构建两者数学关系,形成标准曲线。本发明是以两种典型污染细菌假单胞菌及枯草芽孢杆菌纯菌株作为样本的,本流程同样适用于具体食用菌液体菌种生产过程中其它常见污染细菌荧光定量测定标准曲线的构建。
其具体操作步骤如下:
1.1以常见食用菌液体菌种污染细菌假单胞菌(G-)及枯草芽孢杆菌(G+)作为污染细菌代表菌株,分别接种于灭菌NB液体培养基中摇瓶培养,培养条件:28℃恒温,摇床转速:180r/min,培养24小时后培养液细菌浓度(OD600)范围约为1.8-2.0;
1.2分别取假单胞菌、芽孢杆菌培养液10ml至50ml无菌离心管中,10000r/min离心5min,弃上清;
1.3用灭菌生理盐水30ml充分洗涤菌体沉淀3次,每次均10000r/min离心5min,弃上清;
1.4取10ml无菌水对沉淀细菌细胞进行再悬浮处理,利用涡旋仪使细菌沉淀在液体中分散均匀,并进行10倍梯度稀释形成系列梯度菌悬液;分别取200μl各梯度稀释菌液涂布于灭菌NB平板培养基,28℃恒温培养24小时后计数,计算各梯度稀释液中活菌浓度(Bq);
1.5分别对上述制备的假单胞菌、枯草芽孢杆菌梯度稀释菌悬液(稀释倍数为100~10-10)进行荧光染色,染色剂分别用2.5mL灭菌去离子水溶解,实验时等比例混合,具体方法:于1ml系列稀释菌悬液分别加入25μl SYTO 9+PI(1:1混合),均匀混合,室温避光染色15min;
1.6利用上海棱光F97Xp荧光分光光度计测定上述各稀释度细菌染液荧光强度,仪器测定条件:激发波长470nm,发射波长510nm,激发、发射光谱带宽均为5nm,测定绿光吸收波长(510nm)峰值计为Fg;
1.7依据各稀释度菌悬液平板计数结果(Bq)及相应荧光染色测定结果(Fg)建立标准曲线,假单胞菌标准曲线为:Fg1=250.7lg(Bq1)+249.2,R2=0.997,检测范围5.2×100~5.2×107cfu/ml;芽孢杆菌标准曲线:Fg2=248.5lg(Bq2)+216.7,R2=0.995,检测范围8.5×100~8.5×107cfu/ml;拟合标准曲线:Fg=249.6lg(Bq)+232.9,R2=0.996。如图4所示。考虑到食用菌液体菌种发酵过程细菌污染种类的复杂性可能,本发明以拟合标准曲线数学公式作为以下污染细菌数量的计算公式。
2.食用菌液体菌种中污染细菌的分离与检测:
食用菌液体菌种中污染细菌分离与检测流程可见图2。
具体包括如下步骤:
2.1利用津腾GM-0.33II隔膜真空泵对250ml食用菌液体菌种进行抽滤,收集菌种中污染细菌体。滤膜采用孔径5μm尼龙网,压强1500Pa,抽滤过程均在超净工作台进行;
2.2取无菌生理盐水30ml充分洗涤滤膜上的菌丝,并抽滤入细菌收集瓶(见图5),重复3次,以洗出吸附在菌丝及滤膜表面的细菌细胞;
2.3将上述细菌收集瓶中滤液(约330ml)分批装入2只50ml无菌离心管(离心管1、离心管2)中,10000r/min离心5min,最终获得上述滤液菌体沉淀;
2.4取灭菌生理盐水30ml充分洗涤菌体沉淀2次,每次均10000r/min离心5min,弃上清;取灭菌生理盐水10ml加入离心管1中,悬浮处理后将悬浮液合并入离心管2,并再取灭菌生理盐水10ml洗涤离心管1后并入离心管2,重复洗涤1次并将洗涤液并入离心管2。对离心管2离心处理,方法同上,最终获得食用菌液体菌种中污染细菌细胞沉淀。
2.5取10ml无菌水对沉淀细菌细胞进行再悬浮处理,利用涡旋仪使菌体均匀悬浮,并进行10倍梯度稀释形成系列稀释度菌悬液;
2.6取稀释度为10-1、10-3、10-5、10-7菌悬液1ml,分别加入25μl SYTO 9+PI(1:1混合),均匀混合,室温避光染色15min;
2.7利用上海棱光F97Xp荧光分光光度计测定染液荧光强度(方法同实施例1中步骤1.6),选择荧光强度值位于标准曲线线性范围的样本,依据拟合的标准曲线(见实施例1中步骤1.7)进行活菌数(Bq)计算,并计算样本活菌数平均测定值。
实施例2:
本实施例2中,使用实施例1中的方法对模拟细菌污染的金针菇菌液体菌种进行了细菌数量的测定,其流程图见图3。
具体包括如下步骤:
1)培养基的制备:平板培养基:PDA培养基;液体培养基:玉米粉5%,麦麸3%,酵母膏1%,蔗糖4%,KH2PO4 0.1%,MgSO4 0.15%,VB1 10mg/L,pH=5.5。
2)金针菇平板菌种制备:将配制好的PDA培养基于高压蒸汽灭菌锅中灭菌(121℃,30min)处理后分装于灭菌培养皿中,冷却凝固后倒置于恒温培养箱28℃培养过夜,剔除污染平板;将金针菇菌种接于PDA平板培养基上,于28℃恒温恒湿培养7d;
3)金针菇液体菌种制备:将200ml液体培养基装于500ml的锥形瓶,并通过高压蒸汽灭菌锅灭菌(121℃,30min),冷却后每瓶接入3块1cm2金针菇菌种,28℃恒温,180r/min摇培8d;摇床中放置无菌湿毛巾,以保证菌种摇培处于恒湿环境。
4)模拟细菌污染金针菇液体菌种制备:分别吸取假单胞菌菌悬液(稀释平板计数浓度为2.9×107cfu/ml)、芽孢杆菌菌悬液(稀释平板计数浓度为8.7×107cfu/ml)各10ml分别加入上述培养8d的金针菇液体菌种中并摇匀;
5)金针菇液体菌种污染细菌分离:利用津腾GM-0.33II隔膜真空泵分别对上述混合液进行抽滤(见图5),滤膜选用孔径5μm尼龙网,利用灭菌生理盐水充分洗涤滤膜上的菌丝3次并分别抽滤,对收集的菌体离心沉淀,再悬浮,并进行梯度稀释获得一系列稀释度的菌悬液(具体操作同实施例1中步骤2.1—2.4);
6)分别取系列稀释度菌悬液中稀释度为10-1、10-3、10-5、10-7菌悬液1ml,分别加入25μl SYTO 9+PI(1:1混合),并混合均匀,室温避光染色15min;
7)利用上海棱光F97Xp荧光分光光度计测定染液荧光强度,激发波长470nm,发射波长510nm,激发、发射光谱带宽均为5nm,测定绿光吸收波长(510nm)的峰值Fg;并根据拟合计算公式计算活菌浓度,假单胞菌计算值分别为1.37×106cfu/ml、1.48×106cfu/ml、1.54×106cfu/ml、1.33×106cfu/ml,与理论值相比,误差范围为-8.28%~+6.21%;芽孢杆菌数量分别为4.01×106cfu/ml、4.78×106cfu/ml、3.86×106cfu/ml、4.41×106cfu/ml,与理论值相比,误差范围为-11.26%~+9.89%。
实施例3:
本实施例3中,使用实施例1中的方法对模拟细菌污染的杏孢菇菌液体菌种进行了细菌数量的测定,其流程图见图3。
1)培养基的制备:平板培养基:PDA培养基;液体培养基:葡萄糖3%,蛋白胨0.2%,酵母膏0.5%,KH2PO4 0.05%,MgSO4 0.05%,VB1 10mg/L,pH=7.5。
2)杏鲍菇平板菌种制备:将PDA培养基于高压蒸汽灭菌锅中灭菌(121℃,30min),灭菌后,将培养基分装入灭菌平板中,冷却凝固后倒置于恒温培养箱28℃培养过夜,剔除污染平板;将杏鲍菇菌种接于PDA培养基上,于28℃恒温恒湿培养7d;
3)杏鲍菇液体菌种制备:将液体培养基分装于500ml的锥形瓶中,每瓶200ml,并置于高压蒸汽灭菌锅中进行灭菌,冷却后,每瓶培养基接入3块1cm2杏鲍菇菌种,28℃恒温,180r/min摇培8d;摇床中放置无菌湿毛巾,以保证菌种摇培处于恒湿环境。
4)模拟细菌污染杏鲍菇液体菌种制备分别吸取假单胞菌菌悬液(稀释平板计数浓度为2.9×107cfu/ml)、芽孢杆菌菌悬液(稀释平板计数浓度为8.7×107cfu/ml)各10ml分别加入上述培养8d的杏鲍菇液体菌种中,混合均匀;
5)杏鲍菇液体菌种污染细菌分离:利用津腾GM-0.33II隔膜真空泵分别对上述混合液进行抽滤(见图5),并利用灭菌生理盐水充分洗涤滤膜上的菌丝3次并分别抽滤;滤膜选用5μm尼龙网,压强1500Pa;利用灭菌生理盐水充分洗涤滤膜上的菌丝3次并分别抽滤,对收集的菌体离心沉淀,再悬浮,并进行梯度稀释获得一系列稀释度的菌悬液(具体操作同实施例1中步骤2.1—2.4);
6)分别取系列梯度菌悬液中稀释度为10-1、10-3、10-5、10-7菌悬液1ml,分别加入25μl SYTO 9+PI(1:1混合),并混合均匀,室温避光染色15min;
7)利用上海棱光F97Xp荧光分光光度计测定染液荧光强度,激发波长470nm,发射波长510nm,激发、发射光谱带宽均为5nm,测定绿光吸收波长(510nm)的峰值Fg;并根据拟合计算公式计算活菌浓度,假单胞菌数量分别为1.34×106cfu/ml、1.42×106cfu/ml、1.58×106cfu/ml、1.30×106cfu/ml,与理论值相比,误差范围为-10.34%~+8.97%;芽孢杆菌数量分别为3.93×106cfu/ml、4.16×106cfu/ml、4.56×106cfu/ml、4.81×106cfu/ml,与理论值相比,误差范围为-9.66%~+6.89%。
实施例4:
本实施例4中,对某食用菌工厂化生产企业金针菇不同批次液体菌种进行了细菌数量测定。具体包括如下步骤:
1)对某食用菌工厂金针菇液体菌种样本进行梯度稀释,分别取200μl各梯度(10-1、10-3、10-5、10-7)稀释菌液涂布于无菌NB平板28℃恒温培养24小时计数,每个梯度3个重复,平板菌落数在30-300之间的样本用于计算活菌数平均值。
2)取250ml金针菇液体菌种按前述(实施例1中步骤2.1—2.4)方法进行抽滤、离心并制作液体菌种中污染细菌梯度稀释菌悬液。
3)分别取1mL梯度菌悬液(10-1、10-3、10-5、10-7),分别加入25μl SYTO 9+PI(1:1混合),并混合均匀,室温避光染色15min;利用上海棱光F97Xp荧光分光光度计测定染液荧光强度,激发波长470nm,发射波长510nm,激发、发射光谱带宽均为5nm,测定绿光吸收波长(510nm)的峰值Fg。
4)依据实施例2和3中模拟细菌污染金针菇及杏鲍菇液体菌种中细菌数量实际值与拟合公式计算值,计算出实际值与测量值间校正系数为1.869,即实际值=测量值×1.896;并根据拟合曲线以及校正系数计算活菌数。金针菇液体菌种不同批次样本污染细菌数量检测结果见表1。
表1金针菇液体菌种不同批次样本污染细菌数量检测结果
实施例5:
本实施例5中,对某食用菌工厂化生产企业杏鲍菇不同批次液体菌种中细菌数量测定。
具体包括如下步骤:
1)对某食用菌工厂杏鲍菇液体菌种样本进行梯度稀释,分别取200μl各梯度稀释菌液(10-1、10-3、10-5、10-7)接种于灭菌NB平板培养基28℃,恒温培养24小时后计数,每个稀释度设3重复,计算方法同5.3.1;
2)取250ml杏鲍菇液体菌种按上述(实施例1中步骤2.1—2.4)方法进行抽滤、离心、洗涤、沉淀后,制作液体菌种中污染细菌梯度稀释菌悬液;
3)分别取系列梯度菌悬液中稀释度为10-1、10-3、10-5、10-7的菌悬液1ml,分别加入25μl SYTO 9+PI(1:1混合),并混合均匀,室温避光染色15min;利用上海棱光F97Xp荧光分光光度计测定染液荧光强度,激发波长470nm,发射波长510nm,激发、发射光谱带宽均为5nm,测定绿光吸收波长(510nm)的峰值Fg;并根据拟合曲线及实施例4步骤4)中所述的校正系数计算活菌数。杏鲍菇液体菌种不同批次样本污染细菌数量检测结果见表2。
表2杏鲍菇液体菌种不同批次样本污染细菌数量检测结果
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,本发明要求保护范围由所附的权利要求书、说明书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!