利用单拷贝核基因检测食品和饲料中牛源性成分的实时荧光PCR检测方法与流程
本发明属于生物工程领域,具体地说,是关于一种利用单拷贝核基因检测食品和饲料中牛源性成分的实时荧光PCR检测方法。
背景技术:
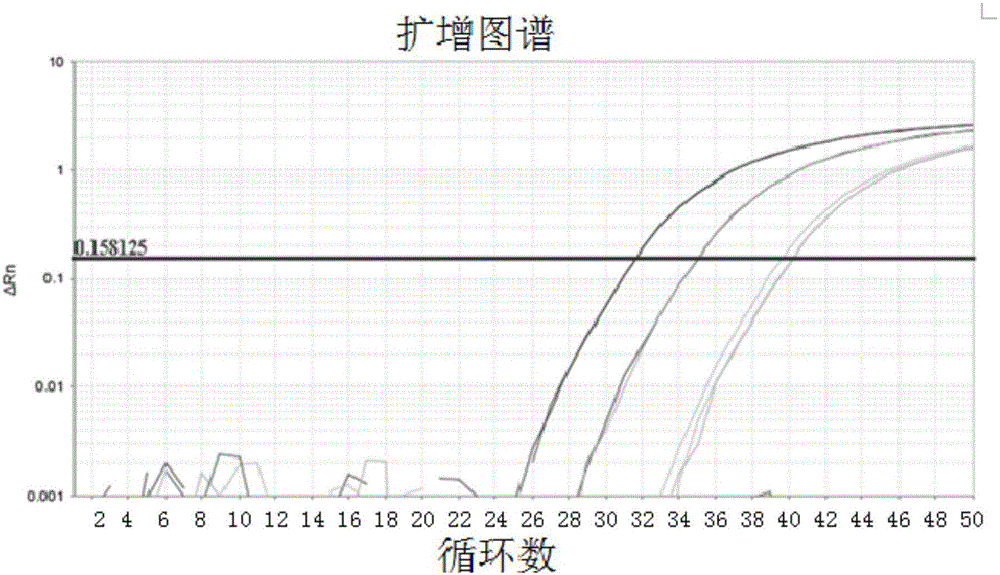
:自1987年英国首先发生疯牛病以来,世界各国和地区都先后颁布了法律法规以控制动物源性成分的使用。2004年,我国颁布《动物源性饲料产品安全卫生管理办法》,规定禁止在反刍动物饲料中使用乳及乳制品之外的动物源性饲料产品。2013年初,瑞典、英国等多个欧洲国家卷入“马肉风波”丑闻中,引起各国对肉及肉制品掺假问题的关注。在我国,“掺假”问题一直是消费者投诉的焦点和社会关注的热点。一些不法商贩和企业因利益驱使将猪、鸭等低成本原料掺入牛、羊等高价肉及肉制品中。这些行为不仅侵害消费者利益,还可能因某些宗教食品中含有非清真成分引起纠纷,如果未经检疫还有可能引起疫病的传播,不利于维护社会安定和人民身体健康,如果问题产品出口到国外更会损害我国食品企业的整体形象。为了阻止疯牛病等疾病的传播,打击肉类掺假的违法行为,维护消费者权益和生命安全,保障食品产业的健康发展,我们需要制定严格的法律法规来约束生产者和经营者的行为,同时我们需要制订准确、灵敏、简便的检测方法。常见的肉及肉制品真伪鉴别技术主要包括:(1)基于蛋白质分子结构的免疫分析技术等;基于蛋白大分子结构的免疫分析方法具有高灵敏度、高通量、操作简便的特点,可实现对大量样品的快速检测。例如,Macedo-Silva等通过制备抗牛、鸡、猪、马白蛋白的抗血清建立了ELISA方法用于鉴别汉堡中可能掺入的廉价肉类成分,灵敏度可达0.6%。但是,基于抗原-抗体特异性结合的免疫分析方法对于亲缘关系较近的物种易出现交叉反应。蛋白质三级结构在食物加工过程中可能受到破坏而影响抗体识别也是该方法的重要不足之处。(2)基于核酸的分子生物学技术,如PCR、实时荧光PCR和分子指纹技术等;基于DNA序列特异性的分子生物学技术以动物种属间遗传信息的差异作为肉种鉴别的检测靶点而被广泛使用。相比于蛋白质,DNA由于热稳定性高,在加工过程中虽然存在一定程度的降解,但仍能提取出小片段DNA用于PCR等分析。同时DNA具有特异性高、灵敏度高、不受组织类别限制等诸多优势,对于亲缘关系较近的物种具有较高的分辨能力。近年来,基于DNA检测技术的肉及肉制品真实性鉴别方法的研究越来越多。目前主要集中于以PCR为基础的各类分析方法,其中包括DNA测序、多重PCR、实时荧光定量PCR等。特别是实时荧光定量PCR技术在动物源性成分的检测领域,日渐成为主流检测技术。PCR技术通过一段特异的寡核苷酸与目标DNA序列结合而在体外合成数以百万计的DNA拷贝。通过物种特异性引物对DNA片段进行扩增,通过琼脂糖电泳分离并观察特异性条带是PCR技术鉴别物种成分的最基本方法。线粒体DNA在细胞中拷贝数量大、灵敏度高、进化速度快,具有较高的种间多样性和较低的种内变异,已被广泛应用于引物设计和靶序列的扩增。如常用的线粒体基因有细胞色素b基因、12S和16S核糖体RNA亚基、D-loop区。但是,由于线粒体DNA序列的拷贝数高且不恒定,只能应用于动物源性成分的定性检测,很难应用于定量检测。“SpeciesidentificationandquantificationinmeatandmeatproductsusingdropletdigitalPCR(ddPCR)AnalyticalMethods”,C.Floren,I.Wiedemann,B.Brenig,E.Schütz,J.Beck,FoodChemistry173(2015)1054–1058,该文章的结论明确了在定量的时候使用线粒体源的引物和探针会引起结果偏差。目前国内外检测动物成分的引物和探针一般都是针对线粒体基因设计的,线粒体基因在细胞中的拷贝数在5000-6000拷贝或更多。但在实际研究工作中发现:利用多拷贝的线粒体基因设计出一套引物和探针进行检测时,其Ct值可低达为13左右,如此低的Ct值,当样品中动物源性成分在0.00000001%时,Ct值仍然在37左右。在目标检测物如此低的检测浓度,出现这样的Ct值,使检测人员很难判断实际样品是真正含有目标成分,还是样品受到非常轻微的污染。所以利用线粒体基因设计引物和探针进行检测,容易出现假阳性结果或很难判断低目标含量下的检测结果。如果根据这么低的Ct值来出具阳性检测报告,会引出很大的贸易纠纷。因此,有必要建立一套特异性好、灵敏度高、可以避免出现假阳性结果等的食品和饲料中牛源性成分的时候死荧光定量PCR检测方法。技术实现要素:本发明通过研究发现:检测某一个动物纯肉样品中的动物源性成分,利用单拷贝的核基因设计的引物和探针进行检测,其Ct值为22-24时,当样品中动物源性成分在0.001%时,Ct值在37左右。为此本发明利用单拷贝的核基因进行物种鉴别检测,结果发现利用单拷贝基因检测可避免出现假阳性结果或很难判断结果的情况发生,并且利用单拷贝的核基因进行检测,还能进行定量检测,所以寻找单拷贝的核基因进行检测并据此建立标准方法显得非常必要。本发明首要目的在于提供一种食品和饲料中牛源性成分的实时荧光PCR检测方法,以克服现有技术所存在的难于定量检测、容易出现假阳性结果等的不足。本发明的第二个目的在于提供一种检测试剂盒以及检测试剂盒的应用。本发明的第三个目的在于提供一种食品和饲料中牛源性成分的实时荧光PCR检测方法的引物对和探针。为实现上述目的,本发明采用以下技术方案:作为本发明的第一个方面,一种利用单拷贝核基因检测食品和饲料中牛源性成分的实时荧光PCR检测方法,该方法包括以下步骤:第一步,以待测样品的DNA为模板,进行荧光定量PCR扩增,获得PCR扩增产物;第二步,检测扩增产物的荧光信号;第三步,以检测结果的Ct值判定样品中是否含有牛源性成分以及定量检测样品中的牛源性成分的含量;其中,用于PCR扩增的反应体系中含有扩增牛源性成分的特异性引物对和牛源性成分的特异性探针,所述扩增牛源性成分的特异性引物对的序列如SEQIDNO.1和SEQIDNO.2所示,所述牛源性成分的特异性探针的序列如SEQIDNO.3所示。根据本发明,所述PCR扩增的条件如下:反应体系为25μl:实时荧光PCR试剂(2×)12.5μl,引物各10μM,探针5μM,DNA模板5μl;PCR反应条件:95℃10min;95℃15s;60℃1min;共45个循环。作为本发明的第二个方面,一种牛源性成分的检测试剂盒,该检测试剂盒含有以下试剂:(a)扩增牛源性成分的特异性引物对;(b)牛源性成分的特异性探针;其中,所述扩增牛源性成分的特异性引物对的序列如SEQIDNO.1和SEQIDNO.2所示,所述牛源性成分的特异性探针的序列如SEQIDNO.3所示。进一步的,所述检测试剂盒还包括:(c)标准参照物,用于定量检测样品中的牛源性成分的含量。作为本发明的第三个方面,一种所述的检测试剂盒的应用,所述检测试剂盒用于定性或定量检测食品或饲料中的牛源性成分。作为本发明的第四个方面,一种牛源性成分的特异性引物对和探针,所述特异性引物对的序列如SEQIDNO.1和SEQIDNO.2所示,所述特异性探针的序列如SEQIDNO.3所示。本发明的有益效果是:1、提供了一种来源于核基因的可特异性鉴定牛源性成分的引物对和探针,其特异性良好,对于牛源性成分能够实现特异性扩增,而对于牛以外的其它成分则不能特异性扩增;而且,所述引物对和探针具有良好的再现性、结果稳定可靠。2、利用所述的引物对和探针可快速、大批量地检测食品或饲料中是否存在牛源性成分以及定量检测食品或饲料中的牛源性成分的含量,并且所需样品量少,操作简单,灵敏度高。3、本发明的牛源性成分的实时荧光PCR检测方法,其适用范围广,特别适用于各类食品或饲料中的牛源性成分的检测,因此可以推广应用,对保障产品的质量,保护消费者知情权和选择权,维护正常的经济秩序等提供了技术支持,为食品的市场监督部门和检验检疫部门提供了技术支持。附图说明图1为实时荧光PCR引物特异性试验的扩增曲线图。其中,扩增曲线从左到右分别是:牛肉DNA和家牛DNA标准品。图2为实时荧光PCR灵敏度试验扩增曲线图。其中,扩增曲线从左到右分别是(W/W):0.1%牛肉粉、0.01%牛肉粉和0.001%牛肉粉提取的DNA。图3为牛源性成分的定量标准曲线。具体实施方式以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,如《分子克隆:实验室手册》(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件或厂商提供的条件进行。本发明的实验材料如下:(1)家牛(Bostaurus)、驴(Equusasinus)、绵羊(Ovisaries)、山羊(Caprahircus)、马(Equuscaballus)、鸡(Gallusgallus)、鸭(Anasplatyrhynchos)、鹅(Anseranser)、火鸡(Meleagrisgallopavo)、猪(Susscrofa)、鹌鹑(Coturnixcoturnix)、骆驼(Camelusdromedarius)、家猫(Feliscatus)的DNA标准品购自于美国ZyagenLaboratories公司。(2)牛肉、鳊鱼肉、鲳鱼肉、黄鱼肉、大马哈鱼肉等动物成分为市售产品。(3)大鼠肉、小鼠肉购买于上海西普尔-必凯实验动物有限公司。(4)大米、玉米、黄豆、小米、绿豆、红薯、马铃薯、白云豆、苹果、梨、海藻(紫菜)、芹菜等植物成分为市售产品。(5)用于实际验证的鸡肉火腿腊肠(进口)、猪肉火腿腊肠(进口)、牛肉火腿腊肠(进口)、牛肉午餐肉、猪肉午餐肉、红烧牛肉罐头、牛肉干、猪肉脯、牛肉丸、咖喱牛肉酱、鸡精调味料、鸡肉味狗粮(进口)、牛肉味狗粮(进口)、吞拿鱼猫罐头(进口)为市售产品。(6)澳大利亚宠物级鸡肉骨粉由上海海关口岸提供。实施例1引物对和探针的设计(1)根据NCBI中已发表的牛(Bostaurus)β肌动蛋白的序列(登录号:EH170825.1),选取合适的序列片段进行引物探针设计。针对牛源性成分的目的片段长度为62bp。荧光PCR引物对和探针的序列如下:Bovine-62bp-F:5’-GGCCTCGGAGTGTGTATTCAG-3’(SEQIDNO:1)Bovine-62bp-R:5’-GCCCCAGAATGAGGTTCACTT-3’(SEQIDNO:2)Bovine-62bp-P:FAM-AGGTGCACAGTACGTTC-MGB(SEQIDNO:3)其中,FAM表示荧光报告基团,MGB表示淬灭基团。本发明采用荧光探针法,其检测原理是利用荧光标记特异性探针来识别模板。与现有技术中SYBR染料法相比,本发明荧光标记特异性探针的特异性更强,背景干扰更低。(2)实时荧光PCR的反应体系和反应程序实时荧光PCR反应体系见表1:其中,实时荧光PCR反应程序为:95℃10min;95℃15s,60℃1min;共45个循环。表1牛源性成分实时荧光PCR反应体系实施例2测试样品的准备动物肉类样品经撕碎、烘干后,使用冷冻研磨机(SPEX6850)磨成粉末状。植物样品和用于实际验证的样品直接使用冷冻研磨机(SPEX6850)磨成粉末状。以玉米粉为基质,加入牛肉粉配制成含量分别为0.1%(W/W)、0.01%(W/W)、0.001%(W/W)、0.0001%(W/W)和0.00001%(W/W)的牛肉粉混合样品,用于灵敏度检测。实施例3DNA的抽提使用动物基因组提取试剂盒(天根生化科技有限公司;目录号:DP323)提取动物样品DNA,植物基因组提取试剂盒(天根生化科技有限公司;目录号:DP305)提取植物样品DNA,动物源性植物饲料基因组提取试剂盒(天根生化科技有限公司;目录号:DP323)提取混合样品及实际验证样品DNA,提取方法详见试剂盒操作说明书。DNA溶液置于-20℃保存备用。实施例4牛源性成分的引物对和探针的特异性检测本实施例使用实施例1的牛源性成分的引物对和探针对实施例3供试的32种动植物材料DNA样品进行检测,检测扩增产物的荧光信号。检测结果的总结见表2和图1。表2牛源性成分的特异性检测结果从图1和表2可以看出,引物对和探针仅对家牛DNA和牛肉样品扩增阳性,有明显S型扩增曲线,而对其它多个物种DNA样品均扩增阴性,无明显S型扩增曲线。结论:本发明的检测方法具有良好的物种特异性。实施例5牛源性成分的引物对和探针的灵敏度检测以牛含量为0.1%(W/W)、0.01%(W/W)、0.001%(W/W)、0.0001%(W/W)和0.00001%(W/W)的混合样品DNA为模板,进行实时荧光PCR检测,试验重复6次。在6次检测中,0.1%、0.01%、0.001%的牛样品DNA中均出现扩增曲线,而0.0001%和0.00001%牛样品DNA未出现扩增曲线,如图2。结论:在模板使用量为0.001%(W/W)时,有明显S型扩增曲线,检出灵敏度达到0.001%(W/W)。实施例6牛源性成分的引物对和探针的实际验证采用实施例4的检测方法,对市场上、进出口贸易途径收集的15份肉质食品和动物饲料等样品进行检测。结果见表3。表315份待测样品的牛源性成分的检测结果序号样品名称试验结果1牛肉火腿腊肠+2牛肉午餐肉+3红烧牛肉罐头+4牛肉干+5咖喱牛肉酱+6牛肉味狗粮+7鸡肉火腿腊肠—8猪肉火腿腊肠—9猪肉午餐肉—10猪肉脯—11牛肉丸—12鸡精调味料—13鸡肉味狗粮—14吞拿鱼猫罐头—15澳大利亚宠物级鸡肉骨粉—从表3可以看出,在5份肉质食品(牛肉火腿腊肠、牛肉午餐肉、红烧牛肉罐头、牛肉干、咖喱牛肉酱)和1份牛肉味狗粮中检出牛源性成分;在6份肉质食品(鸡肉火腿腊肠、猪肉火腿腊肠、猪肉午餐肉、猪肉脯、牛肉丸、鸡精调味料)和3份饲料(鸡肉味狗粮、吞拿鱼猫罐头、澳大利亚宠物级鸡肉骨粉)中未检出牛源性成分。结论:除肉质加工食品(牛肉丸)外,其他抽取样品的肉质来源与检测结果相符。说明肉质加工食品(牛肉丸)存在掺假可能。同时也说明采用实施例4的检测方法可以大批量地检测食品或饲料中是否存在牛源性成分。实施例7定量标准曲线的建立(1)牛源性成分引物对和探针的定量检测将实施例3抽提获得的家牛DNA稀释成100ng/well、10ng/well、1ng/well、0.1ng/well、0.01ng/well,共五个浓度梯度,使用实施例1的引物对和探针进行检测,每个浓度6个重复,获得Ct值。阴性对照为水。如表3所示,其中Ct值为6个重复试验的平均值。表3实时荧光PCR定量检测试验的Ct值模板用量(ng/well)Ct值10026.391030.00133.640.137.270.0140.90阴性对照-结论:可以看出随着牛源性成分的浓度降低,扩增Ct值呈梯度增大,并呈一定的线性关系(R2=0.997)。(2)数据的处理和计算结果如图3所示,以DNA浓度的对数值为横坐标,以样品的6次重复试验的Ct值的平均值为纵坐标,取点进行曲线拟合,得定量标准直线,线性方程为y=3.6273x+22.76,且R2=0.997。对于需定量的样品,每次测得待测样品的各自的Ct值,利用标准曲线公式求得相应的x值。即能得出待测样品的牛源性成份的含量。(3)定量标准曲线的验证按实施例3的方法抽提DNA,分别稀释定量6个独立的样本,浓度分别为50ng/well和0.5ng/well的,检测各自的Ct值,并通过定量标准曲线计算其中的牛源性成份的含量,用以验证该方法的重复性。结果显示,50ng样品测得值的平均值为53.7ng,0.5ng样品测得值的平均值为0.4ng。结论:说明采用本实施例的方法在一定动态范围内具有精确定量的能力。从而证明本发明的方法实际测得值与理论值相符,重复性好。本发明建立了利用单拷贝核基因检测食品和饲料中牛源性成分的实时荧光PCR方法,针对牛物种的核基因设计引物对和探针,仅需结合实时荧光扩增曲线图,不超过两个小时就能准确检测到样品中是否存在牛源性成份,其灵敏度为0.001%(W/W)。综上所述,本发明设计的牛源性成份实时荧光PCR扩增的特异性引物对和探针不仅特异性好,而且灵敏度高,为快速准确地区分是否含有牛源性成分提供了一种很好的检测方法,在食品安全领域的检测把关上,具有良好的应用前景。而且,所述特异性引物对和探针可采用本领域中已知的方法,进一步制成检测试剂盒,所述检测试剂盒除了所述特异性引物对和探针外,还可以包括标准参照物,这对于本领域的技术人员来说是显而易见的。以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。SEQUENCELISTING<110>上海出入境检验检疫局动植物与食品检验检疫技术中心<120>利用单拷贝核基因检测食品和饲料中牛源性成分的实时荧光PCR方法<130>161053<160>3<170>PatentInversion3.3<210>1<211>21<212>DNA<213>人工序列1<400>1ggcctcggagtgtgtattcag21<210>2<211>21<212>DNA<213>人工序列<400>2gccccagaatgaggttcactt21<210>3<211>17<212>DNA<213>人工序列<400>3aggtgcacagtacgttc17当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1