一种纳米磁球定向比例可控固定多酶的方法与流程
本发明属于酶固定化技术领域,具体地涉及一种多酶的固定化方法,尤其涉及一种用于酶级联反应中需要两种不同比例的酶催化反应的多酶固定化方法。
背景技术:
酶是一种能够降低反应的活化能并提高反应速率的生物催化剂。固定化酶具有显著的催化性能和可重复利用性,因而,其在绿色应用和可持续应用中具有巨大的潜力,特别是在工业应用中表现尤为明显。
现在已经有很多关于努力开发有效的固定酶的策略的报道,其中大多数主要集中在单一酶的固定化。然而,在许多情况下,单个酶不能完全催化反应,而是需要多个酶在级联反应中协同作用,因此越来越多的人开始对通过多酶共固定来催化生物转化感兴趣。将多酶在载体表面进行共固定,充分地利用不同酶种的催化特性,提高中间产物的运转浓度,既能扩展酶催化的应用范围,又可以提升多酶体系的整体反应效率,在很大程度上克服了单酶反应体系单一催化的局限性。
虽然已经开始有人探索用于共固定多酶的不同策略,但其中大多数方法仍是基于单一酶固定化开发的技术。通常,这些方法的主要缺点是难以在共固定期间将一种酶与另一种酶区分开,因为很多酶具有共同的结构特征。因此,共定位的酶分子的顺序和化学计量比通常不能很好地控制,从而导致级联反应总催化效率的降低。与体外反应系统相比,活细胞中或活细胞表面的许多级联反应由多酶复合物催化,多酶复合物即由不同的酶自组装成高度有序的结构。这种多酶复合物的优点包括产生底物通道的物理邻近效应,保持中间体的高局部浓度,减少底物抑制作用,从而提高目标途径的总体催化效率。
而对于固定酶的载体,大部分磁性高分子微球是把磁性金属或氧化物与有机高分子复合的有机.无机杂化材料,是把具有磁性的金属或金属氧化物这些无机物材料与有机高分子杂化、复合而产生的。磁性复合高分子微球的高分子部分还可以很方便的通过共聚、与小分子通过共价键键合、吸附等方法引入功能基团从而为其他有机或无机纳米材料引入磁性高分子微球提供方便,以进一步实现新的功能。而纳米磁球是20世纪70年代后逐步产生、发展、壮大的一种应用前景广阔的新型磁性材料,由于其具有良好的磁响应性、粒径小、比表面积大、生物相容性好等优点而广泛地应用于固定化酶技术中。
技术实现要素:
本发明旨在提供一种纳米磁球定向比例可控固定多酶的方法,该方法操作简单,条件温和,能够实现在纳米磁球上定向和比例可控地固定多酶,大大提高了需要多酶的级联反应的催化效率;同时用磁性纳米微球作为载体,有利于酶和底物、产物的分离和重复性利用。
为了实现上述目的,本发明具体技术方案如下:
1.一种纳米磁球定向比例可控固定多酶的方法,其特征在于:利用纳米磁球表面螯合的Ni2+和支架蛋白的His标签之间的亲和吸附作用,把支架蛋白固定在纳米磁球上;依据支架蛋白上黏连蛋白和锚定域的特异性吸附作用,将融合了锚定域的酶固定在支架蛋白上;通过控制支架蛋白上黏连蛋白的种类、数量和排序,实现酶的定向、比例可控吸附。
2.所述的纳米磁球定向比例可控固定多酶的方法,用于需要不同数量比的多酶的级联反应中。
3.进一步,所述的纳米磁球定向比例可控固定多酶的方法,其特征在于:包括以下步骤:
(1)构建重组支架蛋白;
(2)构建融合锚定域的荧光蛋白;
(3)将支架蛋白和螯合Ni2+的磁球混合培养,使支架蛋白固定在磁球上;
(4)将支架蛋白处理过的纳米磁球用磁铁分离,之后和融合了锚定域的荧光蛋白混合吸附,加入CaCl2,使其终浓度为5mM~10mM,使荧光蛋白复合物和支架蛋白结合起来,从而固定在纳米磁球上。
4.进一步,步骤(1)中所述的支架蛋白包含His标签。
5.进一步,步骤(1)中所述的支架蛋白为包含多个、多种黏连蛋白的不同组合。
6.进一步,步骤(2)中所述的每种荧光蛋白分别与一种锚定域结合,这些锚定域分别和步骤(1)中所述的支架蛋白的黏连蛋白特异性结合。
7.进一步,步骤(3)中所述的支架蛋白是单一的一种支架蛋白,或者是多种支架蛋白按照不同的摩尔比例混合吸附。
8.进一步,步骤(4)中所述的荧光蛋白复合物是粗提液或者纯的蛋白溶液。
一种纳米磁球定向比例可控固定多酶的方法,其特征在于:以螯合了Ni2+的磁性纳米微球为载体,融合了锚定域的荧光蛋白为模型蛋白代替酶研究固定化效果,以包含His标签和黏连蛋白的支架蛋白为中间体通过Ni2+和His标签的亲和吸附作用以及黏连域-锚定域的特异性吸附作用,将融合了锚定域的荧光蛋白固定在纳米磁球上。
一种纳米磁球定向比例可控固定多酶的方法,其特征在于:包括以下步骤:
(1)通过基因重组构建的方法,构建支架蛋白ACA和CAC。将A和C克隆到质粒pYD1中,再将融合的ACA和CAC克隆到质粒pETDuet-1中,从而得到N端带His标签的支架蛋白pETDuet1-A-C-A和pETDuet1-C-A-C。其中,黏连蛋白A来自C.cellulovorans中的CbpA,黏连蛋白C来自Clostridium cellulolyticum中CipC的第一个黏连蛋白。
(2)通过基因重组构建的方法,构建融合了锚定域的荧光蛋白GFP-docA和DsRed-docC。将GFP和docA插入质粒pYD1中,得到中间带有GS linker的GFP-docA(GA),再将其克隆到质粒pET22b中,用同样的方法可得到DsRed-docC(RC)。其中,锚定域docA来自C.cellulovorans中的EngY,锚定域docC来自C.cellulolyticum中的celCCA。
(3)将支架蛋白于37℃摇床中培养约2h,至OD600=0.6~0.8,在37℃用1mM的IPTG诱导3h~6h,优化为3h;将荧光蛋白复合物于37℃摇床中培养约2h,至OD600=0.6~0.8,在20℃用0.4mM的IPTG诱导12h。将得到的蛋白溶液在8000r离心5min,并水洗一遍。将得到的菌体重悬在1×PBS缓冲液中(pH≈7.4),使OD600=40。用超声破碎仪破胞,12000r离心10min得上清,即目标蛋白粗提液。
(4)进行SDS-PAGE定性表征,用考马斯亮蓝法测蛋白含量,用BandScan软件测定目标蛋白占蛋白粗提液的百分数,从而计算出目标蛋白的浓度。
(5)将螯合了Ni2+的磁性纳米微球(MNPs)分散为10mg/ml的溶液,取200ul MNPs重悬在4ml支架蛋白溶液中,15℃摇床培养3~5h。
(6)将支架蛋白处理过的纳米磁球用磁铁分离并用水冲洗一遍后和1.2ml融合了锚定域的荧光蛋白在4℃静置12h,并且加入CaCl2,使其浓度为10mM。
(7)根据荧光蛋白的浓度和相应的荧光强度作标准曲线,根据支架蛋白处理过的磁球吸附荧光蛋白前后,荧光蛋白上清溶液的荧光强度差值,计算单位磁球吸附荧光蛋白的量。
步骤(5)中,所述支架蛋白可以为单一的一种支架蛋白,也可以为两种支架蛋白以不同的比例混合。
与现有技术相比,本发明的有益效果:
在本发明中,采用了两种重组支架蛋白,两者都有三个黏合域和一个N端His标签。GFP和DsRed基因在C端和锚定域融合,确保他们可以通过黏合域-锚定域的特异性吸附作用和支架蛋白结合。据报道,这种蛋白质-蛋白质相互作用是物种特异性的,因此我们能够控制GFP和DsRed特异性结合在支架蛋白上的数量和位置。支架蛋白的His标签通过其与镍离子的亲和吸附作用将荧光蛋白复合物固定在磁性纳米微球表面。通过调整两个支架蛋白的摩尔固定比率,可以进一步调节负载GA和RC的比例。
附图说明
图1为荧光扫描图:(A)用BSA或支架蛋白处理后的纳米磁球吸附荧光蛋白复合物(GFP-docA)后的蛋白上清荧光强度;(B)用BSA或支架蛋白处理后的纳米磁球吸附荧光蛋白复合物(DsRed-docC)后的蛋白上清荧光强度。
图2为纳米磁球吸附的荧光蛋白复合物的量。
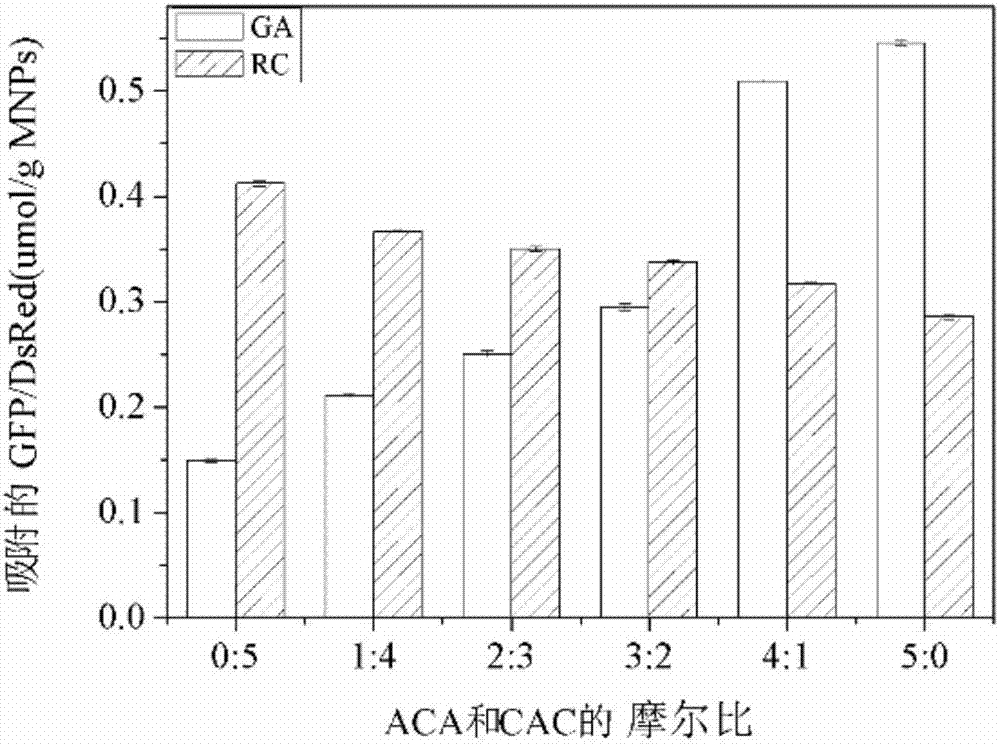
图3为两种支架蛋白的摩尔比例分别为0:5,1:4,2:3,3:2,4:1和5:0时,纳米磁球吸附的两种荧光蛋白复合物的比例。
图4是本发明方法流程示意图。
具体实施方式
以下结合实施实例对本发明做进一步说明,需要指出的是,本实施例仅用于解释本发明,而非对本发明范围的限制。
实施例1:荧光蛋白复合物(GA,RC)固定在纳米磁球上的定性表征
(1)将螯合了Ni2+的磁性纳米微球(MNPs)分散为10mg/ml的溶液,取200ul MNPs分散在4ml 0.02umol/ml的支架蛋白(ACA,CAC)和相同浓度的对照BSA溶液中,15℃摇床培养5h。用磁铁分离磁球,水洗几遍。
(2)将支架蛋白或BSA处理过的磁球分散在1.2mL荧光蛋白复合物GA中(加入CaCl2,使其终浓度为10mM),在4℃静置12h,期间偶尔摇晃,使其处于混悬的状态。
(3)用磁铁分离磁球,水洗几遍。将其分散在1.2mL荧光蛋白复合物RC中(加入CaCl2,使其终浓度为10mM),在4℃静置12h,期间偶尔摇晃,使其处于混悬的状态。
(4)将分离磁球后的上清溶液用荧光分光光度计扫描,得荧光图谱(图1)。和对照BSA处理过的磁球相比,用支架蛋白处理过的磁球去吸附时,分离出的荧光蛋白复合物的荧光强度急剧下降,说明支架蛋白处理过的磁球能够很好的吸附荧光蛋白复合物。
实施例2:荧光蛋白复合物(GA,RC)固定在纳米磁球上的吸附量
(1)根据荧光蛋白的浓度和相应的荧光强度作标准曲线。
(2)按照实施例1相同的方法,用ACA:CAC(摩尔比)分别为0:5,1:4,2:3,3:2,4:1和5:0的支架蛋白处理磁球后,依次吸附GA和RC,用荧光分光光度计测定吸附前后荧光蛋白复合物的荧光强度(GA激发波长:475cm-1,发射波长:499cm-1;RC激发波长:558cm-1,发射波长:583cm-1;)
(3)依据步骤(1)中的标准曲线,根据支架蛋白处理过的磁球吸附荧光蛋白复合物前后,荧光蛋白上清溶液的荧光强度差值,计算单位磁球吸附荧光蛋白复合物的量(图2)。随着支架蛋白ACA:CAC的增加,GA增加,这取决于黏连蛋白-锚定域的特异性吸附作用。磁球最大吸附量可达~0.831μmol/g磁球。
实施例3:荧光蛋白复合物(GA,RC)固定在纳米磁球上的摩尔比
(1)按照实施例2相同的方法,进行吸附和测定,最后计算吸附的两种荧光蛋白复合物(GA,RC)的吸附比(图3)。吸附GA和RC的比例大都小于理论值,这是由于吸附时空间位阻的原因。吸附两种荧光蛋白的比例在约1:3到2:1的范围内可控。
- 还没有人留言评论。精彩留言会获得点赞!
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺