一种海洋源钙螯合肽及其制备方法与流程
本发明涉及一种钙螯合肽,更具体地涉及了一种海洋源钙螯合肽及其制备方法,属于生物技术领域。
背景技术:
目前,钙缺失是全球性的营养问题,缺钙造成机体的各种疾病,使人处于亚健康状态。近几年来,随着补钙试剂迅猛发展,使得国民补钙意识也在不断增加。虽然这些补钙剂能在一定程度上缓解钙缺失的压力,但却也没有从根本上改善国民缺钙的状况,其主要原因是在于钙的生物利用度较低。我国的膳食组成是植物性食物,而植物中的草酸、磷酸和植酸等成分容易在肠道中钙离子结合形成难溶性的草酸盐、磷酸盐和植酸盐,降低了机体内钙的生物利用度。因此,除了开发补钙产品外,提高钙的生物利用度也是解决钙缺失的关键方法之一。随着科学研究的深入,发现多肽-钙螯合物具有独特的螯合体制与转运机制,更易被人体吸收转运,肽钙螯合物结构稳定。机体对肽钙螯合物的吸收是通过肽的吸收通道,从而可以避免与其他被吸收的金属离子的拮抗竞争,提高钙离子的吸收率,提高其生物利用度。由此可见,多肽-金属螯合物的吸收率高,稳定性好,是理想的保健品添加物。
随着海洋源活性物质的研究与产品开发的兴起,微藻生物被联合国粮农组织确定为21世纪绿色健康食品,微藻不仅营养成分丰富,而且有优良的医疗保健作用。裂殖壶菌作为优质饵料的微藻源,本身就含有较高的蛋白质,且富含能与钙离子结合的氨基酸残基,因此,从裂殖壶菌粕中提取出蛋白做为原料开发钙螯合肽,能够为钙制剂提供一种有效的载体,既增加了裂殖壶菌蛋白产品的附加值,又能为补钙制品提供了新的思路;
因此,如何获得具有钙螯合活性的肽,就成为制备新型微量金属元素补充剂亟需的研究方向。
技术实现要素:
本发明的目的在于提供了一种利用碱性蛋白酶和复合风味蛋白酶分步酶解裂殖壶菌粕蛋白制备的金属螯合肽,使钙螯合活性得以高效地实现。
为实现上述目的,本发明采用如下技术方案:
一种金属螯合肽,所述肽的氨基酸序列为:SSV。
所述金属为Ca。
一种金属螯合肽的制备方法,以裂殖壶菌粕蛋白为原料,采用碱性蛋白酶和复合风味蛋白酶对其进行分步酶解,分离纯化、冷冻干燥得到金属螯合肽。
所述的第一步酶解条件为:最适酶为碱性蛋白酶,时间为8 h,pH为9,酶底比为10%,底物浓度为1%。所述的第二步酶解条件为:最适酶为复合风味蛋白酶,酶底比为10%,温度为40 ℃,pH为6,时间为3 h50 min。
所述分离纯化的具体步骤为:酶解产物首先利用Sephadex G-25凝胶过滤色谱进行分离,洗脱液为去离子水,流速为0.3 mL/min,洗脱峰在214 nm下进行测定;收集具有最高金属螯合活性的峰,利用RP-HPLC-C18反相高效液相色谱再进行进一步分离,反相HPLC的分离条件是用体积比为0-40%乙腈溶液作为洗脱液梯度洗脱,流速为2 mL/min,收集洗脱峰,得到所述的金属螯合肽。
本发明立足于多肽具备与金属离子螯合的作用位点,能够与其形成稳定的化合物,且多肽-金属螯合物具有独特的螯合体制和转运机制,易被吸收转运、又能补充氨基酸和金属的理论基础,以来自于海洋源的裂殖壶菌粕蛋白为原材料,经过碱性蛋白酶和复合风味蛋白酶分步酶解进行优化,以制备具有高钙螯合活性的肽,而使金属螯合活性得以高效地实现。本发明为裂殖壶菌粕蛋白的应用提供了一条崭新的思路。
附图说明
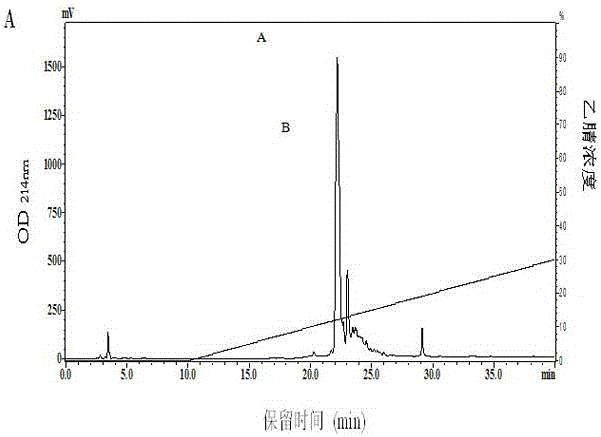
图1纯化裂殖壶菌粕蛋白源金属螯合肽的RP-HPLC-C18色谱图;其中SPH-2A为该特异性金属螯合肽的色谱峰。
具体实施方式
实施例1
采用的仪器、检测手段如下:
本技术所采用的裂殖壶菌粕,由福建省水产研究所提供,酶购自诺维信生物技术有限公司(中国·天津)。首先进行裂殖壶菌粕蛋白的提取,使用中药粉碎机处理裂殖壶菌粕,过60目筛,获得实验用原料。采用碱提酸沉的方法提取裂殖壶菌粕中的蛋白质。配制浓度为0.39mol/L的NaOH溶液,按料液比1:100(w/v)在90℃下提取30min。将所获得的样液在4℃下以10000r/min的转速离心20min,取上清弃沉淀。再用6mol/L HCl调节上清液中的pH值,调节pH值至3.0,对蛋白质进行酸沉。静置30min后,在4℃下以10000r/min的转速离心20min。最终取沉淀弃上清,冷冻干燥,然后再进一步对其酶解。
酶解工艺采用单因素实验,第一步酶解实验分别对五个酶解因素进行考察,分别为最适酶(中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胰蛋白酶),时间(0.0h、0.5h、1.0h、1.5h、2.0h、2.5h、3.0h、3.5h、4.0h、6.0h、8.0h、10.0h、12.0h),pH(7.0、8.0、9.0、10.0、11.0、12.0,酶底比(2%、4%、6%、8%、10%、12%,w/w),底物浓度(1%、3%、5%、7%、9%,w/v)。在第一步酶解的基础上,第二步酶解实验分别对五个酶解因素进行考察,最适酶(复合风味蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶),时间(0h、0.5h、1h、2h、3h、4h、6h、8h),酶底比(4%、6%、8%、10%、12%,w/w),pH(5.0、6.0、7.0、8.0、9.0),温度(40℃、50℃、60℃、70℃、80℃)。称取一定质量裂殖壶菌蛋白溶解于蒸馏水中,然后用2mol/L NaOH将其pH调节至最适pH。先将该溶液水浴加热到需要温度,接着再按不同的酶底比加入相应量的酶,按照预定的反应时间开始反应。接着再在沸水浴中灭酶10分钟,冷却后再10000rpm离心10分钟。上清液收集后,分别对金属钙螯合活性进行测定,以确定最佳酶解条件。得到第二步酶解中具有最大金属螯合活性的酶解液的酶解条件是:酶底比10%、温度40℃、pH6、时间3h50min。
本发明的制备金属螯合肽的钙螯合活性测定方法,采用邻-甲酚酞比色法,测定金属螯合肽对钙离子的螯合作用。将1 mL 5 mmol/L的CaCl2和2 mL 0.2 mol/L的磷酸盐缓冲液(pH 8.0)加入具塞试管中,再加入1 mL清蛋白肽溶液,置于恒温加热水浴摇床中37℃温育2h,取出后10000 r/min常温离心10 min。取1 mL上清液,加入邻-甲酚酞显色液5 mL,摇匀。放置10 min后于分光光度计570 nm处测定吸光值,将数值代入标准曲线中计算出可溶性钙结合量。
标准曲线的制作:分别取标准Ca工作液(10 ug/ mL)0,0.2,0.4,0.6,0.8, 1.0 mL于10 mL试管中,分别加去离子水1.0,0.8,0.6,0.4,0.2,0 mL,加入邻-甲酚酞显色液5 mL,摇匀,放置10 min后于分光光度计570 nm处测定吸光值。以可溶性钙含量(ug/mL)为横坐标,吸光值为纵坐标做图,得标准曲线公式为:y = 0.0992x - 0.0887,R² = 0.9988。
应用Sephadex G-25分子筛、RP-HPLC反相高效液相色谱等分离纯化手段,实现显著活性的裂殖壶菌粕蛋白金属螯合肽的高效分离纯化。
称取1.0克裂殖壶菌粕蛋白溶解于100ml 蒸馏水中→用2mol/L NaOH调节pH至9.0→加碱性蛋白酶→立即置于50℃的水浴摇床中反应8h→沸水浴灭酶10min→立即冷却→10000r/min离心10min,取上清→粗酶解液→用2mol/L NaOH调节pH至6.0→加复合风味蛋白酶→立即置于40℃的水浴摇床中反应3h50min→沸水浴灭酶10min→立即冷却→10000r/min离心10min,取上清备用。
将上清液用Sepadex G-25凝胶过滤色谱(长100 cm,外径2.0 cm)进行分离,获得最好的金属钙螯合活性的样品利用RP-HPLC-C18反相高效液相色谱再进行进一步的分离纯化。洗脱液自含100%去离子水(v/v)的混合液开始,至40%乙腈和60%水(v/v)的混合液结束,流速为2 ml/min进行梯度洗脱,收集洗脱峰,得到本发明的高纯度的特异性金属钙螯合肽,如图1所示。SPH-1A峰为该特异性金属螯合肽的色谱峰。
纯化得到的特异性金属螯合肽具有很高的金属钙螯合活性,由表1可以看出,与酶解液相比,SPH-2A的金属螯合力有了很大提高。
表1 纯化的特异性金属螯合肽的金属螯合力
对纯化的特异性金属螯合肽利用ESI质谱仪((WATERS MALDI SYNAPT Q-TOF MS, Waters Co., U.S.A)测定特异性金属螯合肽的氨基酸序列。所述金属螯合肽的氨基酸序列为:SSV。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
SEQUENCE LISTING
<110> 福州大学
<120> 一种海洋源钙螯合肽及其制备方法
<130> 1
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 3
<212> PRT
<213> 人工序列
<400> 1
Ser Ser Val
1
- 还没有人留言评论。精彩留言会获得点赞!