抗肿瘤活性的ONS三齿配体Pt(II)配合物及其制备方法和应用与流程
本发明属于生物医药技术领域,具体涉及具有抗肿瘤活性的化合物,尤其涉及具有ONS三齿配体的Pt (II)配合物及其制备方法和应用。
背景技术:
据2016年世界卫生组织(WHO)发布的《癌症控制:2015年全球速览》(Cancer Control: A Global Snapshot in 2015)的统计,肺癌、结直肠癌和乳腺癌属于高发癌症。其中,肺癌仍是癌症死亡的最主要原因,而在女性患者中,特别是欠发达地区,乳腺癌仍为女性癌症死亡的首要因素。事实上,癌症不仅是一个单纯的卫生问题,它对国家乃至世界经济、社会发展都有着至关重要的影响。正因如此,2000年国际抗肿瘤联盟(UICC)和WHO在巴黎召开世界肿瘤高峰会议并签署“巴黎抗肿瘤宪章”,将每年2月4日定为世界癌症日,并提出在全世界范围内同步开展肿瘤防治的宣传。
我国的抗肿瘤形势也不容乐观。据WHO统计,2015年中国有280多万人死于癌症,平均每天7500人,并且发病率和死亡率还在逐年上升。目前我国肿瘤治疗手段主要有手术、放疗、化疗及独具特色的中医疗法和近几十年兴起的生物免疫疗法。一般来说,手术切除是治疗肿瘤的首选方法,但手术中不能切除或切除后仍然有残留则容易造成复发。放疗则由于照射范围大,射线能量高,穿透力强,容易对肿瘤周围脏器和正常组织造成放射性损伤而引起并发症。中医疗法虽然在改善肿瘤患者全身情况、扶正培本方面有很好的效果,但对肿瘤局部的控制作用较差,不如放化疗的效果明显。除去治疗费用相对高昂,生物免疫疗法在多数临床应用时也显示对肿瘤细胞聚集形成的肿瘤占位性肿块的作用差一些。综合种种因素,多数情况下化疗仍是主要的癌症治疗手段。因而研制和开发价廉高效的抗肿瘤药物有重大需求。
抗肿瘤药物的种类非常多,在早期主要是一些有机化合物,自从1965年首次报道顺氯氨合铂对动物的肿瘤细胞有强烈的抑制活性后,铂类药物得到了空前的发展。目前已应用于临床的铂类药物有顺铂、卡铂、奥沙利铂、奈达铂、乐铂和依铂等。据统计现今大约有50%癌症治疗过程会用到此类药物,然而在临床应用中这些药物还存在一些问题,如:在某些类型的癌细胞中活性低、易受细胞内生物分子影响进而甚至失活、副作用、时间依赖性和癌细胞的耐药性等等均可能导致化疗失败,这也是铂类抗肿瘤药物应用于化疗时亟待解决的问题。
研发高效、低副作用的新型铂类抗肿瘤药物已经成为世界各国科研工作者的不懈追求。Lippard课题组最近报道了一系列新型的顺铂类衍生物,虽然相关测试结果表明这类化合物具有较高的抗肿瘤活性,但这类化合物是由顺铂制备而成,成本较高,不利于制备价廉的抗肿瘤药物。
本发明提供了有全新结构的具有ONS三齿配体的Pt(II)配合物及其制备合成方法,该合成方法简单、收率高,并且所需原料相对低廉、易得。一系列测试结果证明本发明物可以有效地抑制肿瘤细胞的生长。
技术实现要素:
本发明的目的是提供抗肿瘤活性化合物,尤其是具有ONS三齿配体的Pt(II)配合物。
发明的另一个目的是提供所述的具有ONS三齿配体的Pt(II)配合物的制备合成方法。
本发明的又一个目的是提供具有ONS三齿配体的Pt(II)配合物在制备抗非小细胞肺癌(NSCLC)、大肠癌(CRC)和乳腺癌的药物中的用途。
本发明提供的具有ONS三齿配体的Pt(II)配合物,具有平面四边形配位结构,Pt(II)与三齿(ONS)的水杨醛亚胺衍生物配体和一个4-甲基吡啶或卤素配体配位,其结构通式为:
其中:
R选自氢原子,卤素原子,C1-C6烃基或C1-C6烷氧基;X为卤素或吡啶衍生物配体。
具体来说,本发明包括具有ONS三齿配体的Pt(II)配合物或者其药学上可接受的无毒盐,其中,所述的化合物为:
化合物:C1a
;
化合物:C2a
;
化合物:C3a
;
化合物:C4a
;
化合物:C1b
;
化合物:C2b
;
化合物:C3b
;
化合物:C4b
。
本发明提供具有ONS三齿配体的Pt(II)配合物的制备合成方法,具体步骤如下:
(1)在二氯甲烷和甲醇混合体系中加入水杨醛衍生物和2-氨基茴香硫醚,然后将该反应体系在40-60℃下搅拌8-12小时,TLC监测反应完全;
(2)向该体系中加入适量的无水硫酸钠进行干燥,过滤和浓缩,得到粗产品;粗产品用乙醇在冰箱中冷冻重结晶,获得配体L1-L4;
(3)配体L1-L4溶解于二甲亚砜和甲醇混合溶剂,再加入醋酸钠和甲醇,并缓慢升温至回流状态。然后将事先制备好的K2PtCl4溶液分批加入上述配体L1-L4的溶液中,反应体系继续回流状态下搅拌一天到两天;
(4)将该体系浓缩,边搅拌边加水,有固体析出;过滤,固体用水洗涤,干燥,用二氯甲烷和正己烷重结晶得到纯净配合物C1a-C4a;
(5)在乙腈中加入配合物C1a-C4a和四氟硼酸银,50-70℃下搅拌2-3小时后用硅藻土过滤除去氯化银沉淀,浓缩滤液,再用二氯甲烷稀释,接着加入对甲基吡啶,室温下搅拌一天到两天,反应结束后浓缩得到粗产品;
(6)将粗产品在硅胶柱上用甲醇的二氯甲烷溶液洗脱,收集滤液并浓缩;再将该浓缩物用二氯甲烷和正己烷重结晶,得到纯净配合物C1b-C4b。
合成策略具体见如下反应式(Scheme 1)。
Scheme 1
实验表明,本发明具有ONS三齿配体的Pt(II)配合物有很高的抗肿瘤活性,与顺铂相比,本发明物对非小细胞肺癌细胞A549株、大肠癌细胞HT-29株和乳腺癌细胞MDA-MB-231株的生长表现出更强的抑制作用,且会较明显地影响癌细胞的形态。
因此,本发明具有ONS三齿配体的Pt(II)配合物具有抗肿瘤活性高,显示出重大的临床应用前景。
为了便于理解,以下将通过具体的附图和具体实施方式对本发明进行详细地描述。需要特别指出的是,这些描述仅仅是示例性的描述,并不构成对本发明范围的限制。依据本说明书的论述,本发明的许多变化、改变对所属领域技术人员来说都是显而易见了。
附图说明
图1显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C1a的MTS法测试结果。
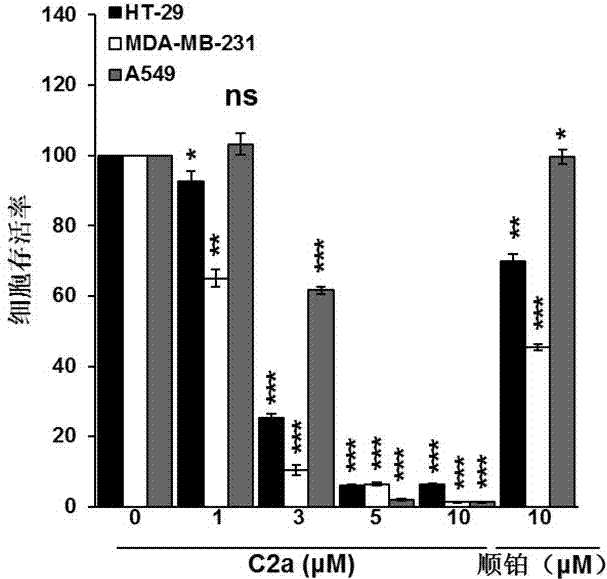
图2显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C2a的MTS法测试结果。
图3显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C3a的MTS法测试结果。
图4显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C4a的MTS法测试结果。
图5显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C1b的MTS法测试结果。
图6显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C2b的MTS法测试结果。
图7显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C3b的MTS法测试结果。
图8显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物C4b的MTS法测试结果。
图9显示了抗肿瘤活性的ONS三齿配体的Pt(II)配合物克隆生成分析法测试结果。
具体实施方式
本发明中,核磁共振谱在bruker AVANCE III HD 400 MHz上测定,用TMS作为内标。
实施例1:制备配合物C1a
根据文献报道,在二氯甲烷(5 mL)和甲醇(5 mL)混合体系中加入水杨醛(122.1 mg, 1 mmol)2-氨基茴香硫醚(139.2 mg, 1 mmol),然后将该反应体系在50℃下搅拌10小时,TLC层析监测显示原料点消失。接着往该体系中加入适量的无水硫酸钠进行干燥,过滤和浓缩,得到粗产品。将粗产品用冷的乙醇在冰箱中冷冻重结晶,即获得所需要的配体L1,为黄色固体。1H NMR (400 MHz, CDCl3) δ 8.6 (s, 1H), 7.5–7.4 (m, 2H), 7.4–7.3 (m, 2H), 7.3–7.2 (m, 2H), 7.1 (d, J = 8.2 Hz, 1H), 7.0 (t, J = 7.4 Hz, 1H), 2.5 (s, 3H).。
在10 mL圆底烧瓶中加入K2PtCl4(20.8 mg, 0.05 mmol)、二甲亚砜(1 mL)和甲醇(5 mL),在室温下搅拌溶解。往50 mL圆底烧瓶中加入配体L1(12.2 mg, 0.05 mmol)、醋酸钠(4.1 mg, 0.05 mmol)和甲醇(15 mL),并缓慢升温至回流状态。然后将事先制备好的铂盐溶液分批加入上述配体L1溶液中,反应体系继续回流状态下搅拌24小时。将该体系浓缩,再在搅拌状态下往其中加入水(10 mL),有橙黄色固体生成,过滤,将滤渣用水洗涤,干燥。接着用二氯甲烷和正己烷混合体系重结晶可得到纯的目标产物C1a。目标产物C1a产量78 %,为黄色固体。1H NMR (400 MHz, DMSO-d6) δ 9.6 (s, JPt-H = 64 Hz, 1H), 8.4 (d, J= 8.6 Hz, 1H), 8.1 (d, J = 7.7 Hz, 1H), 7.9 (d, J = 6.9 Hz, 1H), 7.6 (t, J = 7.6 Hz, 2H), 7.48 (t, J = 7.5 Hz, 1H), 7.0 (d, J = 8.6 Hz, 1H), 6.8 (t, J = 7.4 Hz, 1H), 2.9 (s, 1H).。
实施例2:制备配合物C2a
将水杨醛(122.1 mg, 1 mmol)替换成5-甲基水杨醛(136.2 mg, 1 mmol),其余所需试剂及制备方法同实施例1得到配体L2。配体L2产量63%,为黄色固体。1H NMR (400 MHz, DMSO-d6) δ 12.7 (s, 1H), 8.9 (s, 1H), 7.4 (s, 1H), 7.4 (d, J = 7.7 Hz, 1H), 7.4–7.3 (m, 2H), 7.3–7.2 (m, 2H), 6.9 (d, J = 8.4 Hz, 1H), 2.4 (s, 3H), 2.3 (s, 3H).。
将配体L1(12.2 mg, 0.05 mmol) 替换成配体L2(12.9 mg, 0.05 mmol),其余所需试剂及制备方法同实施例1得到目标产物C2a。目标产物C2a产量81%,为黄色固体。1H NMR (400 MHz, DMSO-d6) δ 9.6 (s, JPt-H = 64 Hz, 1H), 8.4 (d, J = 8.5 Hz, 1H), 8.1 (d, J = 7.8 Hz, 1H), 7.6 (s, 1H), 7.6 (t, J = 7.3 Hz, 1H), 7.51–7.38 (m, 2H), 6.9 (d, J = 8.7 Hz, 1H), 2.9 (s, 3H), 2.3 (s, 3H).。
实施例3:制备配合物C3a
将水杨醛(122.1 mg, 1 mmol)替换成5-氟水杨醛(140.1 mg, 1 mmol),其余所需试剂及制备方法同实施例1得到配体L3。配体L3产量78 %,为橙黄色固体。1H NMR (400 MHz, DMSO-d6) δ 12.7 (s, 1H), 8.9 (s, 1H), 7.5 (dd, J = 8.9, 3.2 Hz, 1H), 7.4 (d, J = 7.8 Hz, 1H), 7.35–7.20 (m, 4H), 7.0 (dd, J = 9.0, 4.5 Hz, 1H), 2.5 (s, 3H). 19F NMR (376 MHz, DMSO-d6) δ -125.1 – -125.2 (m).。
将配体L1(12.2 mg, 0.05 mmol)替换成配体L3(13.1 mg, 0.05 mmol),其余所需试剂及制备方法同实施例1得到目标产物C3a。目标产物C3a产量83%,为橙色固体。1H NMR (400 MHz, DMSO-d6) δ 9.7 (s, JPt-H = 68 Hz, 1H), 8.4 (d, J = 8.5 Hz, 1H), 8.1 (d, J = 7.7 Hz, 1H), 7.7 (d, J = 9.6 Hz, 1H), 7.6 (t, J = 7.8 Hz, 1H), 7.6–7.5 (m, 2H), 7.0 (dd, J = 9.3, 4.6 Hz, 1H), 2.9 (s, 3H). 19F NMR (376 MHz, DMSO-d6) δ -129.0 – 129.2 (m).。
实施例4:制备配合物C4a
将水杨醛(122.1 mg, 1 mmol)替换成3-甲氧基水杨醛(152.1 mg, 1 mmol),其余所需试剂及制备方法同实施例1得到配体L3。配体L3产量78 %,为橙黄色固体。配体产量80%,为红色固体。1H NMR (400 MHz, DMSO-d6) δ 13.1 (s, 1H), 8.9 (s, 1H), 7.4 (d, J = 7.8 Hz, 1H), 7.4–7.3 (m, 2H), 7.3–7.2 (m, 2H), 7.1 (d, J = 7.9 Hz, 1H), 6.9 (t, J = 7.9 Hz, 1H), 3.8 (s, 3H), 2.4 (s, 3H).。
将配体L1(12.2 mg, 0.05 mmol)替换成配体L4(13.7 mg, 0.05 mmol),其余所需试剂及制备方法同实施例1得到目标产物C4a。目标产物C4a产量8
7%,为橙红色固体。1H NMR (400 MHz, DMSO-d6) δ 9.6 (s, JPt-H = 60 Hz, 1H), 8.4 (d, J = 8.6 Hz, 1H), 8.1 (d, J = 7.8 Hz, 1H), 7.6 (t, J = 7.7 Hz, 1H), 7.5–7.4 (m, 2H), 7.2 (d, J = 7.3 Hz, 1H), 6.7 (t, J = 7.9 Hz, 1H), 3.8 (s, 3H), 2.9 (s, 3H).。
实施例5:制备配合物C1b
在乙腈(10 mL)中加入C1a(23.6 mg, 0.05 mmol)和四氟硼酸银(9.7 mg, 0.05 mmol),60 ℃下搅拌2小时。反应体系用硅藻土过滤除去氯化银沉淀,浓缩滤液,再用二氯甲烷(10 mL)稀释,接着加入两滴4-甲基吡啶,将该体系于室温下搅拌24小时。反应结束后,将体系浓缩,得到粗产品。再将该粗产品用1 %甲醇的二氯甲烷溶液在硅胶柱上洗脱,收集滤液并浓缩。将该浓缩物用二氯甲烷和正己烷的混合体系重结晶,得到所需的纯目标产物C1b。目标产物C1b产量73 %,为橙色固体。1H NMR (400 MHz, DMSO-d6) δ 9.5 (s, 1H), 8.8 (d, J = 6.6 Hz, 2H), 8.5 (d, J = 8.5 Hz, 1H), 8.1 (d, J = 7.9 Hz, 1H), 8.0 (d, J = 8.1 Hz, 1H), 7.7–7.65 (m, 1H), 7.64–7.6 (m, 3H), 7.5 (t, J = 7.5 Hz, 1H), 7.0 (d, J = 8.5 Hz, 1H), 6.9 (t, J = 7.0 Hz, 1H), 2.8 (s, 3H), 2.5 (s, 3H). 19F NMR (376 MHz, DMSO-d6) δ -148.2, -148.3.。
实施例6:制备配合物C2b
将化合物C1a(23.6 mg, 0.05 mmol)替换成C2a(24.3 mg, 0.05 mmol),其余所需试剂及制备方法同实施例1得到目标产物C2b。目标产物C2b产量79%,为橙黄色固体。1H NMR (400 MHz, DMSO-d6) δ 9.4 (s, 1H), 8.8 (d, J = 6.5 Hz, 2H), 8.5 (d, J = 8.6 Hz, 1H), 8.1 (d, J = 7.8 Hz, 1H), 7.7 (s, 1H), 7.7 (t, J = 7.4 Hz, 1H), 7.6 (d, J = 6.3 Hz, 2H), 7.5 (t, J = 7.5 Hz, 1H), 7.5 (d, J = 8.8 Hz, 1H), 6.9 (d, J = 8.7 Hz, 1H), 2.8 (s, 3H), 2.5 (s, 3H), 2.3 (s, 3H). 19F NMR (376 MHz, DMSO-d6) δ -148.2, -148.3.。
实施例7:制备配合物C3b
将化合物C1a(23.6 mg, 0.05 mmol) 替换成C3a(24.5 mg, 0.05 mmol),其余所需试剂及制备方法同实施例1得到目标产物C3b。目标产物C3b产量68 %,为黄色固体。1H NMR (400 MHz, DMSO-d6) δ 9.5 (s, 1H), 8.8 (d, J = 6.5 Hz, 2H), 8.4 (d, J = 8.6 Hz, 1H), 8.2 (d, J = 7.9 Hz, 1H), 7.8 (dd, J = 9.5, 3.2 Hz, 1H), 7.7 (t, J = 7.9 Hz, 1H), 7.64–7.50 (m, 4H), 7.0 (dd, J = 9.4, 4.7 Hz, 1H), 2.8 (s, 3H), 2.5 (s, 3H). 19F NMR (376 MHz, DMSO-d6) δ -127.6 – -127.8 (m), -148.2, -148.3.。
实施例8:制备配合物C4b
将化合物C1a(23.6 mg, 0.05 mmol)替换成C4a(25.1 mg, 0.05 mmol),其余所需试剂及制备方法同实施例1得到目标产物C4b。目标产物C4b产量82 %,为橙色固体。1H NMR (400 MHz, DMSO-d6) δ 9.4 (s, 1H), 8.8 (d, J = 6.1 Hz, 2H), 8.4 (d, J = 8.6 Hz, 1H), 8.1 (d, J = 7.8 Hz, 1H), 7.6 (t, J = 7.7 Hz, 1H), 7.6 (d, J = 5.9 Hz, 2H), 7.5 (t, J = 7.5 Hz, 1H), 7.4 (d, J = 8.2 Hz, 1H), 7.2 (d, J = 7.3 Hz, 1H), 6.8 (t, J = 7.9 Hz, 1H), 3.8 (s, 3H), 2.8 (s, 3H), 2.5 (s, 3H). 19F NMR (376 MHz, DMSO-d6) δ -148.2, -148.3.。
下面结合具体实施例对本发明的具有ONS三齿配体的Pt(II)配合物的活性作进一步阐述。下述实施例中,所用的试验材料及其来源包括:
非小细胞肺癌细胞株(A549)、大肠癌细胞株(HT-29)和乳腺癌细胞株(MDA-MB-231)均购自美国菌种保藏中心American Type Culture Collection (ATCC, Manassas, VA);MTS法试剂:CellTiter 96® AQueous单溶液细胞增殖检测试剂盒,购自Promega公司(Promega, Madison, WI, USA);其他涉及的化学试剂均为分析纯,并从化学试剂公司购得。
实施例10 具有ONS三齿配体的Pt(II)配合物的抗肿瘤活性测定
1)肿瘤细胞的接种方法:非小细胞肺癌细胞A549株和乳腺癌细胞MDA-MB-231株这两类肿瘤细胞分别接种于DMEM培养基(含10%热灭活的牛胎儿血清,1%谷氨酰胺和100 unit/mL的青霉素/链霉素)中。大肠癌细胞HT-29株则接种于McCoy’s 5A培养基(含10%热灭活的牛胎儿血清和100 unit/mL的青霉素/链霉素)中。
2)MTS法和IC50值的测定:非小细胞肺癌细胞A549株、大肠癌细胞HT-29株和乳腺癌细胞MDA-MB-231株分别置于96孔细胞培养板中,通过TC20全自动细胞计数仪计数使每个空有2000个细胞。然后分别用不同浓度(0, 1, 3, 5和10 µM)的每种化合物(C1a, C1b, C2a, C2b, C3a, C3b, C4a和C4b)及10 µM的顺铂溶液来处理72小时。接着再使用MTS法试剂在Wallac Victor 1420 Multilabel counter(Perkin Elmer, Wellesley, MA)仪器上测定上述溶液在490 nm处的吸光度,同时也可计算出半数抑制浓度IC50。认为未经处理的细胞存活率是100%,标准曲线可由化合物浓度和细胞相对存活率关系制得。细胞相对存活率 =(实验测得的吸光度-背景吸光度)/(空白样品的吸光度-背景吸光度)×100%
本发明具有ONS三齿配体的Pt(II)配合物对体外非小细胞肺癌细胞A549株、大肠癌细胞HT-29株和乳腺癌细胞MDA-MB-231株的生长起到了明显的抑制作用,其IC50值为0.13 – 6.25 μM,而顺铂的IC50值均大于或等于10。
3)克隆生成分析法的测定:非小细胞肺癌细胞A549株、大肠癌细胞HT-29株分别接种在60 cm的培养碟上,且使得每个培养碟上细胞个数为3000。经过24小时的培养,在每个培养碟上分别加入不同浓度的每种化合物(C1b, C2b, C3b和C4b)及0.25 µM的顺铂溶液,继续培养24小时。然后用PBS洗涤细胞,接着使之培养15天。细胞随后用0.5%龙胆紫和含25%甲醇的PBS处理。这样就可以通过光学显微镜观察细胞增殖情况。
本发明具有ONS三齿配体的Pt(II)配合物与顺铂相比对体外非小细胞肺癌细胞A549株、大肠癌细胞HT-29株的增殖表现出更有效的抑制作用。
。
- 还没有人留言评论。精彩留言会获得点赞!