一种DNA酶包裹的DNA分子层层自组装微胶囊及其制备与应用的制作方法
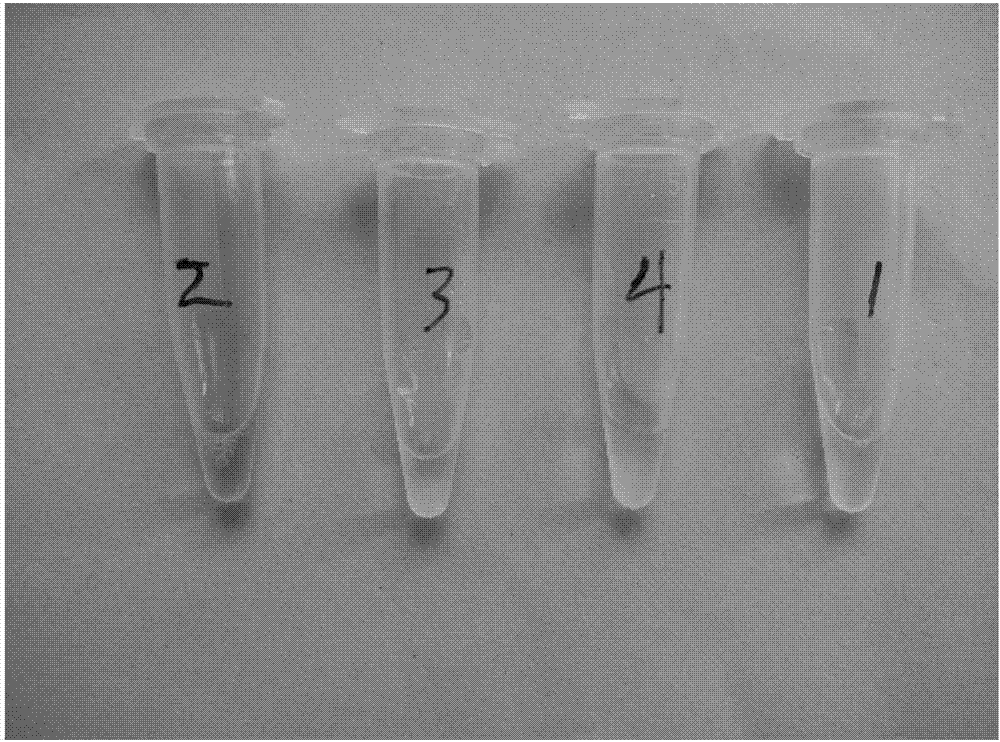
(一)技术领域
本发明涉及一种微胶囊,特别涉及一种dna酶包裹的dna分子层层自组装微胶囊及其制备与自身所具有的dna酶催化氧化示踪特性的应用。
(二)
背景技术:
微胶囊(microcapsule)是一种微型容器,它能够储存细小的物质并根据需要在合适的时间对该物质进行释放。因此,微胶囊已在制药、化妆品、食品和农业等领域得到应用;随着现代科技的发展,微胶囊将越来越多地被用于微反应器、药物载体、细胞和酶的包埋防护以及基因转染等方面。目前,利用层层自组装(lbl)技术制备微胶囊成为一大热点;方法是以可被去除的微纳颗粒作为模板核心,通过聚电解质沉积、聚合物阴阳离子静电作用等方法在模板颗粒上进行多层包裹,最后除去模板颗粒,即可制备出微胶囊。与其他方法相比,lbl技术制得的微胶囊具有可精确控制形态、尺寸、壁厚、囊壁通透性及强度的优点,不仅拓宽了自组装技术的研究与应用范围,而且制备出的微胶囊显示出独特的结构与多变的性能,在基础研究和实际应用方面都具有重要的价值,同时lbl技术能够对微胶囊进行内部及外表的修饰,使其具有多重功能性。
但值得注意的是,上述经典的lbl技术制备微胶囊,其囊壁采用高聚物阴阳离子静电作用层层组装而成,其自身通常不具有标记基团,无法示踪。因此,在进行微胶囊分析测定时,需要进行额外的标记工作,如荧光基团的标记。
核酸适配体是一类能与目标物质高特异性结合的dna寡核苷酸单链序列,因其高特异性的配体结合能力以及优良的化学性质,是目前生物传感器理想的识别器件,被形象地称为“化学抗体”;且表现出许多优于传统蛋白质抗体的特点,如适配体能在体外直接通过化学合成生产并纯化,合成速度快、成本低;而常规免疫分析中的蛋白质抗体需要依赖动物或细胞生物法获得,制备周期长,成本高。适配体还可通过化学合成对其dna分子进行修饰,如一端连接巯基、氨基、生物素等,固定修饰荧光基团、电活性物质用于信号传导。
(三)
技术实现要素:
本发明目的是提供一种“g-四链体-血红素”dna酶包裹的dna分子层层自组装微胶囊及其合成条件,进而利用dna酶-abts显色反应,表征该微胶囊具有dna酶的催化显色活性,进而实现微胶囊的自身示踪,利于微胶囊的分析检测。
本发明采用的技术方案是:
本发明提供一种dna酶包裹的dna分子层层自组装微胶囊,所述微胶囊以碳酸盐微粒为模板核心,依次在其外包裹聚丙烯胺盐酸盐层和寡核苷酸链a层,然后交替包裹若干层寡核苷酸链b层和寡核苷酸链c层,再用edta去除模板核心制成dna分子层层自组装微胶囊;最后将dna分子层层自组装微胶囊与寡核苷酸链d和血红素共同孵育成dna酶包裹的dna分子层层自组装微胶囊;所述寡核苷酸链b与寡核苷酸链a部分互补,所述寡核苷酸链c与寡核苷酸链b部分互补,所述寡核苷酸链d是与寡核苷酸链c部分互补的g四链体。所述寡核苷酸链a、寡核苷酸链b、寡核苷酸链c和寡核苷酸链d均指寡核苷酸链,字母本身没有含义。
进一步,所述寡核苷酸链a为寡核苷酸链t30,所述寡核苷酸链t30核苷酸序列为tttttttttttttttttttttttttttttt。
进一步,所述寡核苷酸链b为寡核苷酸链a15-g15,寡核苷酸链c为寡核苷酸链t15-c15,寡核苷酸链d为寡核苷酸链a15-pw17;所述寡核苷酸链a15-g15核苷酸序列为aaaaaaaaaaaaaaaggggggggggggggg,所述寡核苷酸链t15-c15核苷酸序列为tttttttttttttttccccccccccccccc,所述寡核苷酸链a15-pw17核苷酸序列为aaaaaaaaaaaaaaagggttgggcgggatggg。
更进一步,本发明所述dna酶包裹的dna分子层层自组装微胶囊以碳酸盐(如mnco3)微粒为模板核心,依次在其外包裹聚丙烯胺盐酸盐层和寡核苷酸链t30层,然后交替包裹若干层寡核苷酸链a15-g15层和寡核苷酸链t15-c15层,再用edta去除碳酸盐(如mnco3)模板核心,制成dna分子层层自组装微胶囊;最后将dna分子层层自组装微胶囊与寡核苷酸链a15-pw17和血红素共同孵育形成dna酶包裹的dna分子层层自组装微胶囊。
进一步,所述碳酸盐微粒为mnco3微粒或caco3微粒,微粒粒径为5-10μm,mnco3微粒制备方法参考:邓长春,王凯,窦艳丽,张万喜.以mnco3为模板的聚电解质胶囊的制备.功能材料,2007,38卷,增刊,1947-1949.。
进一步,所述寡核苷酸链b(优选a15-g15)层和寡核苷酸链c(优选t15-c15)层各自交替包裹2-10层,优选各自5层。
进一步,所述聚丙烯胺盐酸盐层是以2μm聚丙烯胺盐酸盐(pah,分子量约50kda)水溶液的形式振荡形成;所述寡核苷酸链t30层是以10μm寡核苷酸链t30水溶液的形式振荡形成;所述寡核苷酸链a15-g15层以10μm寡核苷酸链a15-g15水溶液形式振荡形成,寡核苷酸链t15-c15层以10μm寡核苷酸链t15-c15水溶液形式振荡形成。
进一步,所述寡核苷酸链d包裹方法为:取寡核苷酸链d(优选a15-pw17)溶液(优选10μm),置于pcr管中,于热循环仪升温95℃,保持10-20分钟,然后在1.5-2小时内使热循环仪温度缓慢匀速降至37℃,再加入血红素(hemin)溶液(优选2μm)孵育1个小时,获得dna酶;所述寡核苷酸链d(优选a15-pw17)溶液与血红素溶液体积比为10:4;所述寡核苷酸链d(优选a15-pw17)溶液是将寡核苷酸链d(优选a15-pw17)用超纯水配置成(优选100μm)储备液,再取(优选10μl)储备液用含5mmkcl的ph=7.4、50mmtris-hcl缓冲液稀释而成;所述血红素溶液是将hemin用二甲亚砜(dmso)配制成(优选1mm)储备液,再用含5mmkcl的ph=7.4、50mmtris-hcl缓冲液稀释而成。
本发明还提供一种所述dna酶包裹的dna分子层层自组装微胶囊的制备方法,所述方法为:(1)向pcr管移取碳酸盐微粒的水悬浮液,离心,弃去上清液,用nacl水溶液洗涤;
(2)向步骤(1)pcr管中加入聚丙烯胺盐酸盐水溶液,在振荡器上反应10-20分钟后,离心,用nacl水溶液洗涤;
(3)向步骤(2)pcr管中加入寡核苷酸链a水溶液,在振荡器上反应10-20分钟,离心,用nacl水溶液洗涤;
(4)向步骤(3)pcr管中加入寡核苷酸链b水溶液,在振荡器上反应10-20分钟,离心,用nacl水溶液洗涤,再加入寡核苷酸链c水溶液,同样在振荡器上反应10-20分钟,离心,用nacl溶液洗涤;
(5)重复步骤(4),逐层交替包裹若干寡核苷酸链b层和寡核苷酸链c层,形成自组装微粒悬浮液;
(6)取步骤(5)自组装微粒悬浮液加入edta水溶液,振荡反应10-20分钟以去除碳酸盐模板核心,离心,弃上清,获得dna分子层层自组装微胶囊悬浊液;
(7)取寡核苷酸链d溶液置于pcr管中,于热循环仪升温95℃,保持10-20分钟,然后在1.5-2小时内使热循环仪温度缓慢匀速降至37℃,再加入血红素溶液孵育1-2个小时,获得dna酶液;所述血红素溶液是将血红素用二甲亚砜配制成(优选1mm)储备液,再用含5mmkcl的ph7.4、50mmtris-hcl缓冲液稀释而成;所述寡核苷酸链d溶液是将寡核苷酸链d用超纯水配置成(优选100μm)储备液,再取储备液用含5mmkcl的ph=7.4、50mmtris-hcl缓冲液稀释而成;
(8)将步骤(7)dna酶液加入到步骤(6)dna分子层层自组装微胶囊悬浊液中,振荡反应10-20分钟后,离心,取沉淀,即为dna酶包裹的dna分子层层自组装微胶囊。
进一步,优选所述dna酶包裹的dna分子层层自组装微胶囊的制备方法为:(1)向pcr管移取1-5μm(更优选3μm)碳酸盐微粒的水悬浮液,8000rpm离心5分钟,弃去上清液,用0.5-5μm(更优选2m)nacl水溶液洗涤3次,优选每次nacl水溶液用量与碳酸盐微粒的水悬浮液体积比为1:1;
(2)向步骤(1)pcr管中加入0.5-5μm(更优选2μm)聚丙烯胺盐酸盐水溶液,在振荡器上反应15分钟后,8000rpm离心10分钟,用0.5-5μm(更优选2m)nacl水溶液洗涤3次,优选每次nacl水溶液用量与碳酸盐微粒的水悬浮液体积比为1:1;所述0.5-5μm(更优选2μm)聚丙烯胺盐酸盐水溶液用量与步骤(1)中碳酸盐微粒的水悬浮液体积比为1:1;
(3)向步骤(2)pcr管中加入10μm寡核苷酸链a(优选t30)水溶液,在振荡器上反应15分钟,8000rpm离心10分钟,用0.5-5μm(更优选2m)nacl水溶液洗涤3次,优选每次nacl水溶液用量与碳酸盐微粒的水悬浮液体积比为1:1;所述寡核苷酸链a(优选t30)水溶液用量与步骤(1)中碳酸盐微粒的水悬浮液体积比为1:1;
(4)向步骤(3)pcr管中加入5-20μm(更优选10μm)寡核苷酸链b(优选a15-g15)水溶液,在振荡器上反应15分钟,8000rpm离心10分钟,用0.5-5μm(更优选2m)nacl水溶液洗涤3次,再加入5-20μm(更优选10μm)寡核苷酸链b(优选t15-c15)水溶液,同样在振荡器上反应15分钟,8000rpm离心10分钟,用0.5-5μm(更优选2m)nacl溶液洗涤3次;优选每次nacl水溶液用量与碳酸盐微粒的水悬浮液体积比为1:1;所述寡核苷酸链a(优选a15-g15)水溶液和寡核苷酸链b(优选t15-c15)水溶液用量与步骤(1)中碳酸盐微粒的水悬浮液体积比均为1:1;
(5)重复步骤(4),逐层交替包裹若干寡核苷酸链a(优选a15-g15)层和寡核苷酸链b(优选t15-c15)层,形成自组装微粒悬浮液;
(6)取步骤(5)自组装微粒悬浮液加入0.1-0.5m(更优选0.2m)的edta水溶液,振荡反应15分钟以去除碳酸盐模板核心,离心并弃去上清液,取去核后的悬浊液得到dna分子层层自组装微胶囊悬浊液;所述自组装微粒悬浮液与edta水溶液体积比为1:1;
(7)取5-20μm(更优选10μm)寡核苷酸链d(优选a15-pw17)溶液置于pcr管中,于热循环仪升温95℃,保持10分钟,然后在1.5小时内使热循环仪温度缓慢匀速降至37℃,再加入1-5μm(更优选2μm)血红素溶液孵育1-5个小时,获得dna酶液;所述寡核苷酸链d(优选a15-pw17)溶液与血红素溶液体积比为10:4;所述1-5μm(更优选2μm)血红素溶液是将血红素用二甲亚砜(dmso)配制成1mm储备液,再用含5mmkcl的ph7.4、50mmtris-hcl缓冲液稀释至1-5μm;所述2-20μm寡核苷酸链a15-pw17溶液是将寡核苷酸链d(优选a15-pw17)用超纯水配置成5-200μm的储备液,再取10μl储备液用含5mmkcl的ph=7.4、50mmtris-hcl缓冲液稀释至5-20μm;
(8)取步骤(6)dna分子层层自组装微胶囊悬浊液加入步骤(7)dna酶液,振荡反应15分钟后,8000rpm离心8~10分钟,分离上清液和微胶囊沉淀悬浮液;取微胶囊沉淀悬浮液,即为dna酶包裹的dna分子层层自组装微胶囊;所述dna酶液与dna分子层层自组装微胶囊悬浊液体积比为1∶7。
本发明还提供一种所述dna酶包裹的dna分子层层自组装微胶囊在微胶囊自身示踪测定中的应用,具体所述微胶囊自身示踪测定的应用为:将dna酶包裹的dna分子层层自组装微胶囊悬浮于超纯水中制成0.3mm的悬浮液,再将悬浮液与0.5mm2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(abts)溶液和1.2mmh2o2水溶液混合,振摇,放置约10~20分钟,观察溶液颜色是否变绿或测定420nm处的吸光度值进行示踪(吸光度值随微胶囊所偶联的dna酶量以及酶活性而变,在实验中确定),所述abts溶液、h2o2水溶液与悬浮液体积比是1∶1∶2;所述0.5mmabts溶液是将abts用超纯水配成5mmabts储备液,再用含5mmkcl的ph7.4、50mmtris-hcl缓冲液稀释至0.5mm。
此外,本发明还提供一种所述dna酶包裹的dna分子层层自组装微胶囊在dna酶氧化显色反应中的应用,所述的应用方法为:将dna酶包裹的dna分子层层自组装微胶囊悬浮于超纯水中制成0.3mm的悬浮液作为催化剂,再将悬浮液与0.5mmabts溶液和1.2mmh2o2水溶液混合,振摇,放置约10~20分钟,通过显色或测定420nm处的吸光度值可判断该氧化显色反应的反应程度,进而表明dna酶的活性。所述abts溶液、h2o2水溶液与悬浮液体积比是1∶1∶2;所述0.5mmabts溶液是将abts用超净水配成5mmabts储备液,再用含5mmkcl的ph7.4、50mm的tris-hcl缓冲液稀释至0.5mm。
富含鸟嘌呤(g)的特定dna寡核苷酸序列可形成不同于经典watson-crick双螺旋结构的特殊核酸二级结构,称之为g四链体。g四链体由多个g四分体平面通过π-π相互作用堆积而成,而g四分体平面又由4个鸟嘌呤g通过hoogsteen碱基配对(g-g)形成。特定的g四链体在体内广泛分布于基因组的许多重要区域,如启动子区和端粒区,具有影响dna的复制、转录、翻译等重要生理机能;在体外可用于构建具有辣根过氧化物酶活性的“g-四链体-血红素”dna酶,该酶可催化过氧化氢氧化2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(abts),而使后者变绿(最大吸收波长λmax=420nm)。abts在双氧水的作用下,会被缓慢氧化为阳离子自由基,但此时氧化反应速率较低,阳离子自由基的歧化作用却较快,因此难以观测到显色变化;一旦反应体系中存在“g-四链体-血红素”dna酶,氧化反应速率显著加快,可观测到溶液从无色变为绿色(λmax=420nm),并快速达到光谱吸收最大值。因此,该反应所显示的颜色变化可被用于标记dna酶存在以及表征dna酶活性的示踪反应。
本发明通过层层自组装制备dna分子微胶囊,并使其最外层结合一定比例富含鸟嘌呤的特定核苷酸序列,形成“g四链体-血红素”dna酶包裹的dna分子微胶囊,通过dna酶催化氧化双氧水-abts的反应,对上述dna酶包裹的dna分子层层自组装微胶囊的显色示踪功能进行表征。
本发明所述寡核苷酸链a不仅可与聚丙烯胺盐酸盐交联,其部分碱基(优选15个碱基)还可与寡核苷酸链b互补成键;寡核苷酸链b中的部分碱基(优选15个碱基)可与寡核苷酸链a互补成键,同时另有部分碱基(优选15个碱基)可与寡核苷酸链c互补成键;寡核苷酸链c中的部分碱基(优选15个碱基)可与寡核苷酸链b互补成键,同时另有部分碱基(优选15个碱基)可与寡核苷酸链d互补成键;寡核苷酸链d不仅部分碱基(优选15个碱基)可与寡核苷酸链c互补成键,还可形成“g-四链体-血红素”dna酶。
与现有的采用高分子合成材料作囊壁的微胶囊技术相比,本发明有益效果主要体现在:本发明微胶囊的外层是层层自组装dna链,因为特定的dna链具有分子识别和dna酶催化功能,因此该微胶囊具有潜在靶向效应和自身示踪能力,在靶向识别和检测方面有明确的应用前景。
(四)附图说明
图1为dna酶催化氧化abts反应原理图。
图2为荧光倒置显微镜拍摄图,(a)mnco3微粒悬浮液;(b)edta去核的碳酸锰微粒悬浮液;(c)dna层层膜(未去核、未染色);(d)已去核的dna多层膜微胶囊(未染色);(e)已去核的dna多层膜微胶囊(荧光染料genefinder染色)。
图3为abts显色,pcr管从左到右依次是组2、组3、组4、组1。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1
一、实验材料和试剂配制
mnco3微粒,φ=5-10μm,制备方法参考:邓长春,王凯,窦艳丽,张万喜.以mnco3为模板的聚电解质胶囊的制备.功能材料,2007,38卷,增刊,1947-1949页中所述的mnco3微粒制备的最优条件)水悬浮液,pah溶液(聚丙烯胺盐酸盐,分子量50kda),hemin(血红素)溶液,abts(2,2’-连氮基(3-乙基苯并二氢噻唑啉)-6-磺酸)溶液,含5mmkcl的50mmtris-hcl缓冲液(ph=7.4),nacl,edta,h2o2(过氧化氢),荧光染料genefinder溶液(购自厦门致善生物科技有限公司);系列dna寡核苷酸(t30、a15-g15、t15-c15、a15-pw17,见表1)溶液均为超纯水配置,所述超纯水是指去离子水为原料的重蒸馏水。
表1系列dna寡核苷酸序列
各试剂按如下方法配制:
10μm系列dna寡核苷酸溶液:各取市售t30、a15-g15、t15-c15、a15-pw17等dna寡核苷酸固体适量,加适量超纯水配制成100μm的储备液,分装在0.2ml的pcr管中于-20℃的环境中储存;再各取10μl到pcr管中,使用前用含5mmkcl的50mmtris-hcl缓冲液(ph=7.4)稀释至10μm。
2μmhemin(血红素)溶液:取适量血红素用dmso(二甲亚砜)配制成1mm储备液,于-20℃的环境下储存,使用前用含5mmkcl的50mmtris-hcl缓冲液(ph=7.4)稀释至2μm。
0.5mmabts溶液:取适量abts,用少量超纯水溶解定容成5mmabts储备液;使用前用含5mmkcl的ph=7.4tris-hcl缓冲液稀释至0.5mm。
1.2mmh2o2溶液:使用前用超纯水逐级稀释得到。
2mnacl溶液和0.2medta溶液:使用前用超纯水溶解定容得到。
二、dna酶包裹的层层自组装微胶囊的制备
(1)向pcr管移取100μl含3μmmnco3微粒的水悬浮液,离心5分钟,弃去上清液,用2mnacl溶液洗涤3次,每次用量均为100μl。在荧光倒置显微镜下观察,结果见图2中a所示。取10μlmnco3微粒水悬浮液,加入10μl0.2m的edta溶液,振荡反应15分钟以去除mnco3核,荧光倒置显微镜下图见图2中b所示。
(2)向上述pcr管中加入100μl2μmpah溶液,在振荡器上反应15分钟后,置于离心机中离心10分钟,用2mnacl溶液洗涤3次,每次用量100μl。
(3)向上述pcr管中加入100μl10μmt30溶液,在振荡器上反应15分钟,离心10分钟,用2mnacl溶液洗涤3次,每次用量100μl。
(4)向上述pcr管中加入100μl10μma15g15溶液,在振荡器上反应15分钟,离心10分钟,用2mnacl溶液洗涤3次,每次用量100μl;再加入100μl10μmt15c15溶液,同样在振荡器上反应15分钟,离心10分钟,用2mnacl溶液洗涤3次,每次用量100μl。
(5)重复步骤(4),逐层包裹a15g15和t15c15的dna寡核苷酸链各自5层,获得3μm自组装微粒悬浮液100μl。
(6)在完成所需要包裹的层数(各自5层)后,取10μl步骤(5)自组装微粒悬浮液(荧光倒置显微镜下图见图1中c所示),加入10μl0.2m的edta溶液,振荡反应15分钟以去除mnco3核,离心,弃上清,获得20μl、0.3μm层层自组装微胶囊悬浊液,荧光倒置显微镜图见图2中d所示。
(7)取1μlgenefinder荧光染料加到10μl的上述步骤(6)层层自组装微胶囊悬浊液中,在荧光倒置显微镜下观察,结果见图2中e所示。
在显微镜明场模式下,观察(a)mnco3微粒悬浮液、(b)mnco3微粒悬浮液加edta去核溶液、(c)具mnco3核心的dna层层自组装微胶囊悬浮液、(d)加edta去核溶液的dna层层自组装微胶囊悬浮液;通过图2中avs.b和cvs.d的对比,可见edta通过与阳离子(如mn2+)的络合,溶解溶液中的碳酸盐(如mnco3)微粒的结果。而用dna双链嵌入荧光染料(genefinder)对去核dna层层自组装微胶囊进行标记,在荧光显微镜暗场模式下进行观察,可见微胶囊外层的双链dna分子,如图2中e。
(8)取100μl10μma15-pw17溶液,置于pcr管中,于热循环仪升温95℃,保持10分钟,然后在1.5小时内使热循环仪温度缓慢匀速降至37℃,再加入40μl2μmhemin溶液孵育1个小时,促进pw17寡核苷酸片段形成g四链体,获得g-四链体/hemin复合体,即dna酶。
将上述g-四链体/hemin体系140μl加入到20μl步骤(6)层层自组装微胶囊悬浊液中,振荡反应15分钟后,离心8~10分钟,分离沉淀悬浮液和上清液,取沉淀悬浮液部分即得到“g-四链体/hemin”dna酶与层层自组装微胶囊交联物,即为dna酶包裹的dna分子层层自组装微胶囊,用超纯水悬浮稀释至100μl,即为0.3μmdna酶包裹的dna分子层层自组装微胶囊悬浮液。
三、dna酶包裹的dna分子层层自组装微胶囊的dna酶活性表征
利用“双氧水-abts”反应体系,对dna酶包裹的dna分子层层自组装微胶囊的酶活性进行表征:
向装有100μl、0.3μm的dna酶包裹的dna分子层层自组装微胶囊悬浮液(组4)的pcr管中,分别加入50μl、0.5mm的abts溶液和50μl、1.2mm的h2o2溶液,振摇,放置约10~20分钟待abts显色,观察溶液的颜色深浅,结果见图3所示,或测定420nm处的吸光度值。
同样条件下,将组4的dna酶包裹的dna分子层层自组装微胶囊悬浮液分别替换为2μmhemin溶液(组1),10μma15-pw17与2μmhemin体积比10:4混合溶液(组2);步骤8离心后的上清液(组3),其它操作相同,观察溶液的颜色,结果见图3所示。
实验结果如图3所示,4个实验组中,组2溶液明显显绿色,但组3溶液显色不显著,仅略微变绿,说明g-四链体大部分与dna酶包裹的层层自组装微胶囊结合而进入沉淀中,上清液中残留很少,证明g-四链体/微胶囊复合物功能材料的成功制备,验证了具有dna酶活性,从而表征dna酶可包裹在上述层层自组装dna微胶囊外。
sequencelisting
<110>浙江大学
<120>一种dna酶包裹的dna分子层层自组装微胶囊及其制备与应用
<130>
<160>4
<170>patentinversion3.5
<210>1
<211>30
<212>dna
<213>unknown
<220>
<223>人工序列
<400>1
tttttttttttttttttttttttttttttt30
<210>2
<211>30
<212>dna
<213>unknown
<220>
<223>人工序列
<400>2
aaaaaaaaaaaaaaaggggggggggggggg30
<210>3
<211>30
<212>dna
<213>unknown
<220>
<223>人工序列
<400>3
tttttttttttttttccccccccccccccc30
<210>4
<211>32
<212>dna
<213>unknown
<220>
<223>人工序列
<400>4
aaaaaaaaaaaaaaagggttgggcgggatggg32
- 还没有人留言评论。精彩留言会获得点赞!