一种维药恰麻古多糖及其提取方法和应用与流程
本发明主要涉及植物有效组份提取领域,具体地说,本发明涉及一种恰麻古多糖提取
技术领域:
。
背景技术:
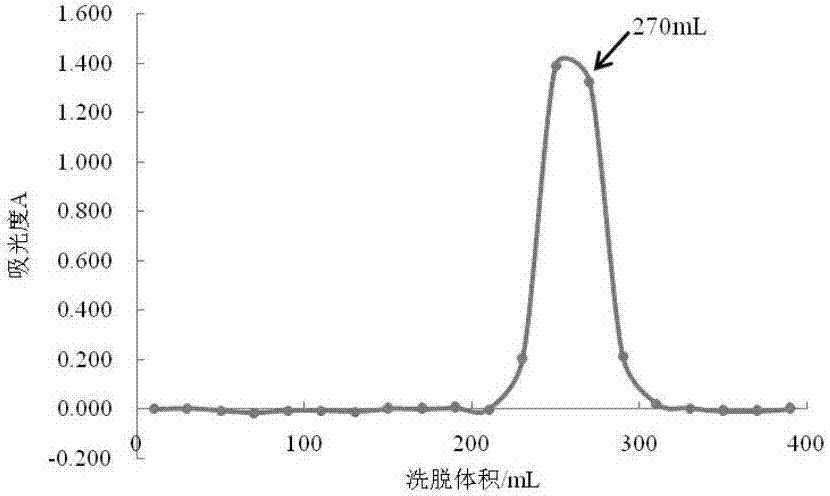
:恰麻古又名诸葛菜、蔓菁、圆菜头。为十字花科芸薹属芜菁亚种植物,是新疆维吾尔族居民喜爱的药食同源物品。药典记载,其性温归胃经、归肝经、通三焦、益中气、利五脏、解邪毒。能润肺止咳、清肝明目、填精壮肾、软肠通便、利尿消肿、治霍乱、瘰疬、乳疬、消渴,具有生精、补气、消渴、提神、开胸顺气、健胃消食、解毒等作用。现代药理研究证实,恰麻古中富含维生素、蛋白质、粗纤维、粗脂肪、多糖、皂苷、亚油酸、类黄酮、芸苔素、多种氨基酸、无机盐、钙、铁等,具有抗病毒、抗凝血、降血脂、抗肿瘤、免疫调节、延缓衰老等多种生物活性。安熙强,马媛,张涛,等.维药恰玛古蜜膏和恰玛古粉药效学对比研究[j].中华中医药杂志,2011(1):141-143;新疆师范大学运动人体科学实验室,新疆师范大学体育学院蔡啸镝,刘跃峰等.超声辅助提取恰麻古多糖工艺研究[j].食品工业,2015年第36卷第6期:140-142;和新疆师范大学运动人体科学实验室,新疆师范大学体育学院蔡啸镝,刘跃峰等研究发表的恰玛古多糖的纯化及对运动小鼠抗疲劳活性研究[j].食品工业,2015年第36卷第8期:59-62都研究显示恰麻古恰麻古多糖有对抗疲劳、提高免疫力有一定疗效,但是都不能指出是那种成分具有活性。专利cn201510011425.7公开了一种热水浸提制备具有免疫调节活性的新疆芜菁多糖的方法,cn201410266707.7公开了一种恰麻古多糖提取物及制备方法,都显示恰麻古多糖具有良好的提高免疫力和抗疲劳活性,但是都没能分离出具体的活性成分,没能明确具体活性成分的结构,使得恰麻古应用受到限制,尤其在西方国家对活性成品不明确的药材认可度不高。技术实现要素:针对现有技术现状,特别是目前恰麻古活性成分不明确的技术问题问题,本发明提供了一种恰麻古多糖及其制备方法,使得恰麻古多糖中具体活性成分结构明确,药理清楚,制备方法简单,为以后人工合成有效活性和增强恰麻古药物活性提供了依据和方法,在食品药品领域具有广泛的适用性。为了实现上述目的,本发明提供的技术方案如下:本发明提供一种维药恰麻古多糖,所述恰麻古多糖brnp-1和brnp-2结构式分别如下:本发明中,恰麻古多糖提取包括下列步骤:(1)取恰麻古干燥药材,加入3倍量体积的石油醚,60℃连续回流脱脂2h,药渣过滤后,晾干备用,滤液回收。(2)取脱脂后的恰麻古药材,加入30倍质量的水,90℃-100℃连续回流提取3次,每次2h,合并三次提取液,过滤后,滤液浓缩至总量的20%,加入无水乙醇至浓缩滤液的体积分数为80%,放至4℃过夜。(3)抽滤步骤(2)过夜溶液后收集沉淀,加入10-30倍质量的蒸馏水重新溶解,室温下充分搅拌,使其溶解完全,将样品溶液装入7000da-8000da分子量的透析袋,用蒸馏水透析后,收集袋内溶液,浓缩冻干后,得到恰麻古粗多糖。(4)按质量份数计,取恰麻古粗多糖质量份数3份,用0.01份-0.1份蒸馏水充分溶解后,4000r·min-1,15min离心除去不溶于水的杂质,沉淀收集保存。(5)另将上清液,上样至已装填平衡完全的阴离子交换柱,分别用h2o、0.5mol/lnacl、1.0mol/lnacl、2.0mol/lnacl和0.2mol/lnaoh洗脱,硫酸苯酚法检测,分段收集含糖部分的洗脱液,得到brn、bra1、bra2、bra3、bra45个组分。(6)分别将5个组分浓缩,冷冻干燥,按质量份数计,取brn300份-500份,加入0.01倍-0.1倍纯水,室温下充分溶解,4500r·min-1,20min离心2次,取上清液,上样至已装填平衡完全的凝胶色谱柱,用0.1mol/lnacl洗脱,按每管15ml收集洗脱液,硫酸苯酚法检测,收集至无糖检出。(7)按照洗脱曲线合并、浓缩、透析、冷冻干燥得到brn-1和brn-2。(8)按质量份数计,分别取brn-1和brn-2150份,加入0.05倍-0.1倍纯水,4500r·min-1,20min离心2次,取上清液,上样至已装填平衡完全的凝胶色谱柱,用0.1mol/lnacl洗脱,按每管10ml收集洗脱液,硫酸苯酚法检测,收集至无糖检出,brn-1得到两个部分,分别为brn-1a和brn-1b;brn-2得到两个组分,分别为brn-2a和brn-2b,取brn-1a和brn-2b浓缩后,冷冻干燥,分别标号为brnp-1和brnp-2,称重,分别置于干燥器中保存,备用。更加优选的,本发明中,步骤(2)用90℃水连续回流提取3次。更加优选的,本发明中,步骤(3)用7000da分子量的透析袋。更加优选的,本发明中,步骤(4)用0.016份蒸馏水充分溶解后,4000r·min-1,15min离心除去不溶于水的杂质,沉淀收集保存。更加优选的,本发明中,步骤(6)取brn500份,加入0.03倍纯水,室温下充分溶解,4500r·min-1,20min离心2次,取上清液。更加优选的,本发明中,步骤(8)加入0.075倍纯水,4500r·min-1,20min离心2次,取上清液,上样至已装填平衡完全的凝胶色谱柱(sephacryls-300凝胶色谱柱)。本发明提取方法提取的多糖brnp-1和brnp-2的总糖含量为100%。本发明中,多糖brnp-1和brnp-2为中性糖。本发明所述的一种维药恰麻古多糖在制备提高免疫力药物中的应用。本发明所述的提高免疫力,brnp-1体外给药浓度为400μg·ml-1。本发明所述的提高免疫力,brnp-1体外给药浓度为400μg·ml-1。通过实施本发明的技术方案可获得如下有益效果:(1)本发明提供的一种维药恰麻古多糖及其制备方法和应用,使得恰麻古多糖有效成分更为明确,制备方法简单,药理更为清楚,使得恰麻多糖在医药领域用量更为准确,药效更易控制,也为人工合成恰麻古多糖提供了依据,在食品和药品领域具有广泛的适用性。(2)本发明结果显示中性糖brnp-1样品浓度大于80μg·ml-1时,细胞毒性减小,巨噬细胞raw264.7细胞增值率高于100%,且在400μg·ml-1时,巨噬细胞增殖率最高。brnp-2对raw264.7细胞增殖具有促进作用,且在1.6-2000μg·ml-1范围内无细胞毒性。brnp-1对no释放呈剂量依赖型,而brnp-2在400μg·ml-1时,no释放量最多,与空白对照组和lps阳性对照组差异均有统计学意义(p<0.05)。brnp-1和brnp-2对tnf-α的释放有一定的促进作用,brnp-1在400μg·ml-1时,tnf-α的释放量最高;brnp-2对tnf-α的释放量均高于空白对照组,在400μg·ml-1时,与lps阳性对照组无差异(p<0.05)。brnp-1和brnp-2在400μg·ml-1时,il-6的释放量最高,与空白对照组和lps阳性对照组相比,差异均有统计学意义(p<0.05)。brnp-1、brnp-2可以刺激raw264.7细胞产生no、il-6、tnf-α,具有免疫激活作用。附图说明图1显示为本发明brn在sepharose6b柱的洗脱曲线。图2显示为本发明brn-1在sephacryls-300柱的洗脱曲线。图3显示为本发明brn-2在sephacryls-300柱的洗脱曲线。图4显示为本发明中性糖brnp-1和brnp-2的hpgpc图。图5显示为本发明brnp-1和brnp-2在400-4000cm-1的ft-ir谱图。图6显示为本发明中性糖brnp-1(b)和brnp-2(c)的单糖组成分析,(a)为标准品;rha-鼠李糖;fuc-岩藻糖;ara-阿拉伯糖;xyl-木糖;man-甘露糖;glc-葡萄糖;gal-半乳糖。。图7显示为本发明brnp-1的gc-ms结果。(a)tic图;(b)ms碎片图;(c)推断结构.峰:1、1,5-二乙酰氧基-(1-氘)-2,3,4,6-四甲氧基葡萄糖醇;2、1,4,5-三乙酰氧基-(1-氘)-2,3,6-三甲氧基葡萄糖醇;3、1,4,5,6-四乙酰氧基-(1-氘)-2,3-甲氧基葡萄糖醇。图8显示为本发明brnp-2的gc-ms结果。(a)tic图;(b)ms碎片图;(c)推断结构.峰:1、1,5-二乙酰氧基-(1-氘)-2,3,4,6-四甲氧基葡萄糖醇;2、1,4,5-三乙酰氧基-(1-氘)-2,3,6-三甲氧基葡萄糖醇;3、1,4,5,6-四乙酰氧基-(1-氘)-2,3-甲氧基葡萄糖醇。图9显示为本发明brnp-1的13c-nmr谱图。图10显示为本发明brnp-1的1h-nmr谱图。图11显示为本发明brnp-1的hsqc(a)谱图。图12显示为本发明brnp-1的hmbc(b)谱图。图13显示为本发明brnp-2的13c-nmr谱图。图14显示为本发明brnp-21h-nmr谱图。图15显示为本发明brnp-2的hmbc谱图。图16显示为本发明中性糖brnp-1和brnp-2对巨噬细胞raw264.7增殖活性的影响。图17显示为本发明中性糖brnp-1和brnp-2对细胞因子tnf-α释放的影响。图18显示为本发明中性糖brnp-1和brnp-2对细胞因子il-6释放的影响。图19显示为本发明中性糖brnp-1和brnp-2对no释放的影响。具体实施方式下面对本发明的具体实施方式作进一步详细描述,但本发明的方法不限于下述实施例。本发明中,所用到试剂石油醚、恰麻古干燥药材、无水乙醇、nacl、naoh、t-系列右旋糖酐标准品、nano3、α-d-半乳糖、苯酚、浓硫酸、α-d-半乳糖醛酸、间羟基联苯、l-鼠李糖、l-岩藻糖、d-阿拉伯糖、d-甘露糖、d-葡萄糖、d-半乳糖、d-木糖、肌醇、氨水醋酸酐、1-甲基咪唑、无水硫酸钠、氯仿、碘甲烷、d2o、小鼠腹腔巨噬细胞raw264.7、器具玛瑙研钵、透析袋、耐高温具塞玻璃反应管、co2培养箱、96孔板、培养板、酶标板、tnf-α试剂盒、no试剂盒、il-6试剂盒和检测仪器阴离子交换柱、凝胶色谱柱、高效凝胶色谱仪、红外光谱仪、旋转蒸发仪、gc-ms、核磁共振波谱仪等均采用市场公共渠道购买获得。实施例一:本发明恰麻古多糖的制备本发明中,恰麻古多糖提取包括下列步骤:(1)取恰麻古干燥药材,加入3倍量体积的石油醚,60℃连续回流脱脂2h,药渣过滤后,晾干备用,滤液回收。(2)取脱脂后的恰麻古药材,加入30倍质量的水,90℃-100℃连续回流提取3次,每次2h,合并三次提取液,过滤后,滤液浓缩至总量的20%,加入无水乙醇至浓缩滤液体积份数为80%,放至4℃过夜。(3)抽滤步骤(2)过夜溶液后收集沉淀,加入10-30倍蒸馏水重新溶解,室温下充分搅拌,使其溶解完全,将样品溶液装入7000da-8000da分子量的透析袋,用蒸馏水透析后,收集袋内溶液,浓缩冻干后,得到恰麻古粗多糖。(4)按质量份数计,取恰麻古粗多糖质量份数3份,用0.01-0.1份蒸馏水充分溶解后,4000r·min-1,15min离心除去不溶于水的杂质,沉淀收集保存。(5)另将上清液,上样至已装填平衡完全的阴离子交换柱(deae-650m,55mm×19cm),分别用h2o、0.5mol/lnacl、1.0mol/lnacl、2.0mol/lnacl和0.2mol/lnaoh洗脱,硫酸苯酚法检测,分段收集含糖部分的洗脱液,得到brn、bra1、bra2、bra3、bra45个组分。(6)分别将5个组分浓缩,冷冻干燥,按质量份数计,取brn300份-500份,加入0.01-0.1倍纯水,室温下充分溶解,4500r·min-1,20min离心2次,取上清液,上样至已装填平衡完全的凝胶色谱柱(sepharose6b,40mm×90cm),用0.1mol/lnacl洗脱,按每管15ml收集洗脱液,硫酸苯酚法检测,收集至无糖检出。(7)按照洗脱曲线合并、浓缩、透析、冷冻干燥得到brn-1和brn-2,如附图1所示。(8)按质量份数计,分别取brn-1和brn-2150份,加入0.05-0.1倍纯水,4500r·min-1,20min离心2次,取上清液,上样至已装填平衡完全的凝胶色谱柱(sephacryls-300,22mm×90cm),用0.1mol/lnacl洗脱,按每管10ml收集洗脱液,硫酸苯酚法检测,收集至无糖检出,brn-1得到两个部分,分别为brn-1a和brn-1b;brn-2得到两个组分,分别为brn-2a和brn-2b,取brn-1a和brn-2b浓缩后,冷冻干燥,分别标号为brnp-1和brnp-2,称重,分别置于干燥器中保存,备用,如附图2、3所示。实施例二:本发明恰麻古多糖的制备本发明中,恰麻古多糖提取中,步骤(2)用90℃水连续回流提取3次;步骤(3)用7000da分子量的透析袋;所述步骤(6)取brn500份,加入0.03倍纯水,室温下充分溶解;其余方法和实施例一相同,制备的brnp-1给药浓度为400μg·ml-1;brnp-2给药浓度为400μg·ml-1。实施例三:本发明提取的恰麻古多糖均一性和表观分子量测定取t-系列右旋糖酐标准品(分子量分别为2000、670、410、270、150、80、50、12、5和1kd)5mg,用1ml超纯水充分溶解后,分别配置成5mg·ml-1右旋糖酐系列标准溶液,过0.22μm滤膜,备用。分别取10μl标准溶液,进样至高效凝胶色谱仪(hpgpc),用0.1mnano3洗脱,流速为0.6ml·min-1,柱温35℃。以峰面积为纵坐标,分子量为横坐标绘制标准曲线。取本发明提取方法提取的恰麻古多糖单一组分样品5mg,用1ml超纯水充分溶解后,配置成5mg·ml-1样品溶液,过0.22μm滤膜,进样至高效凝胶色谱仪(hpgpc),用0.1mol/lnano3洗脱,流速为0.6ml·min-1,柱温35℃。得出本发明提取方法提取的恰麻古多糖峰面积。中性糖的两个组分brnp-1和brnp-2为淡黄色粉末,水溶性较好。如附图4所示,两个样品都呈均一、对称的尖峰,说明brnp-1和brnp-2的均一性较好。将峰面积分别带入t-系列右旋糖酐标准曲线,得到brnp-1和brnp-2的表观分子量分别为6873da和4751da。实施例四:本发明提取的恰麻古多糖化学组成分析总糖含量利用苯酚硫酸法进行测定。以α-d-半乳糖做标准品,配制1mg·ml-1半乳糖标准品溶液,依次稀释成100μg·ml-1、80μg·ml-1、60μg·ml-1、40μg·ml-1、20μg·ml-1、10μg·ml-1系列浓度溶液,分别取0.2ml半乳糖标准品系列浓度,加入0.2ml质量分数5%苯酚溶液,快速加入1.0ml浓硫酸,充分震荡后,静置20min,在490nm处测定吸光度,以浓度c为横坐标,吸光度a为纵坐标,绘制标准曲线a=0.008c+0.005,r2=0.999。取干燥的样品,配制成1mg·ml-1样品溶液,稀释至25μg·ml-1,按照上述方法显色后测定吸光度,带入标准曲线,计算样品总糖含量。糖醛酸含量利用间羟基联苯法进行测定。以α-d-半乳糖醛酸做标准品,配制1mg·ml-1半乳糖醛酸标准品溶液,依次稀释成100μg·ml-1、20μg·ml-1、10μg·ml-1、5μg·ml-1、2.5μg·ml-1、1.25μg·ml-1系列浓度溶液,分别吸取200μl半乳糖醛酸标准品系列浓度,加入1.2ml0.0125m硫酸-四硼酸钠溶液,冰浴至冷却,100℃水浴加热5min,冰浴冷却后,加入20μl体积分数为0.15%间羟基联苯溶液,空白组加入20μl质量浓度0.5%的naoh溶液充分震荡后,静置5min,在520nm出测定吸光度,以浓度c为横坐标,吸光度a为纵坐标,绘制标准曲线a=0.008c+0.023,r2=0.998。取干燥的样品,配制成1mg·ml-1样品溶液,稀释至50μg·ml-1,按照上述方法显色后测定吸光度,带入标准曲线,计算样品糖醛酸含量。蛋白质含量利用bio-rad蛋白质试剂盒进行测定。本发明提取方法提取的多糖样品化学组成分析见表1。表1恰麻古多糖样品的化学组成分析化学组成brnp-1(%)brnp-2(%)总糖含量100%100%糖醛酸含量-a-蛋白含量tr.btr.注:a:没有检测到;tr.:痕量中性糖两个组分brnp-1和brnp-2的总糖含量均接近100%,蛋白质含量几乎为零。而糖醛酸未在样品中检出,说明brnp-1和brnp-2结构中不含羧基,为中性多糖。实施例五:本发明提取的恰麻古多糖ft-ir分析取干燥的多糖样品约2mg,加入约200mgkbr在玛瑙研钵中研磨混合后压片,用红外光谱仪在4000-400cm-1区域内进行红外扫描。brnp-1(下)和brnp-2(上)的ft-ir如附图5所示,3409.3cm-1处的较大的吸收峰为糖残基的o-h的伸缩振动。2929.4cm-1处的吸收峰为糖环上的c-h伸缩振动。1649.1cm-1处的吸收峰是酯羰基的c-o伸缩振动。在1100-1000cm-1处的三个较强的吸收峰说明葡萄糖为吡喃型。在这一组吸收峰中,1154.1cm-1和1025.7cm-1处的吸收峰分别代表了c-o-c和c-o-h键,进一步表明单糖中存在吡喃环。928.4cm-1处的吸收峰表示了不对称吡喃环的c-o-c键。842.2cm-1处的吸收峰表示存在α型的糖单元。实施例六:本发明提取的恰麻古多糖样品单糖组成分析分别称取l-鼠李糖、l-岩藻糖、d-阿拉伯糖、d-甘露糖、d-葡萄糖、d-半乳糖和d-木糖标准品1mg,配制成2mg·ml-1单一单糖标准品溶液,取肌醇5mg,配置成5mg·ml-1肌醇溶液,备用。取本发明提取方法提取的多糖样品1mg,加入450μl纯水溶解,备用。取三支耐高温具塞玻璃反应管,第一管中加入7种单糖标准溶液各50μl,肌醇50μl和纯水100μl,配置成0.2μg·μl-1的混合单糖标准溶液。第二管中加入7中单糖标准溶液各25μl,肌醇50μl和纯水225μl,配置成0.1μg·μl-1的混合单糖标准溶液。第三管中加入样品溶液450μl,肌醇50μl,配制成2μg·μl-1的样品溶液。每管中加入500μl4mol/ltfa溶液,120℃水解2h。静置至室温后,用n2吹干溶剂,用甲醇洗涤3遍。加入0.5ml1mol/l氨水溶液后,分别加入3mg硼氢化钠粉末,拧紧反应管,室温放置过夜。加入10%体积分数的醋酸-甲醇溶液,用旋转蒸发仪旋干溶剂,重复操作3次。再加入无水甲醇复溶,旋干溶剂,重复操作4次。加入1ml醋酸酐和0.1ml1-甲基咪唑,室温下进行30min乙酰化反应。将溶液转移至反应管,加入1ml纯水终止反应,冰浴。加入1ml氯仿萃取2次,收集氯仿层,合并后转移至干净的反应管,再加入2ml纯水洗涤5次,水层弃去。加入适量的无水硫酸钠去除溶液中的水,静置30min后,将溶液过自制无水硫酸钠小柱后,收集,n2吹干至1ml,备用。gc-ms进样条件:载气为he2,分流比100:1,检测器:280℃,柱温由160℃,每分钟2℃升高至190℃,再由每分钟5℃升高至280℃,保持5min。根据对应标准品的保留时间,确定样品中的单糖组成;另取标准品浓度为横坐标,峰面积为纵坐标,绘制标准曲线,计算样品中每种单糖的含量。乙酰化后的混合单糖标准品和中性糖样品的gc-ms结果如附图6所示,(a)是混合单糖标准品的色谱图,从左至右依次是:鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖。根据brnp-1(b)和brnp-2(c)的色谱图,可知brnp-1和brnp-2均只含有α-d-葡萄糖,其分子结构是由单一α-d-葡萄糖组成的,如附图7、8所示。实施例七:本发明提取的恰麻古多糖甲基化——糖链连接方式分析取干燥的多糖样品2mg于2ml反应瓶中,置于干燥器中过夜。加入1mldmso,搅拌至样品完全溶解。将50mgnaoh用研钵中研成细粉,加入反应瓶中,搅拌2h。每隔15min加入150μl碘甲烷,一共加入3次,室温下搅拌45min,至溶液澄清透明。加入1ml纯水终止反应,冰浴,转移至玻璃反应管,n2吹干碘甲烷后,用等量氯仿萃取2次,合并氯仿层,再用纯水洗涤5次,水层弃去。氯仿层用n2吹干溶剂,加入0.5ml2mol/ltfa,120℃水解2h。静置至室温后,用n2吹干溶剂,用甲醇洗涤3遍。加入0.5ml1mol/l氨水溶液后,分别加入3mg硼氘化钠粉末,拧紧反应管,室温放置过夜。加入10%体积分数的醋酸-甲醇溶液,用旋转蒸发仪旋干溶剂,重复操作3次。再加入无水甲醇复溶,旋干溶剂,重复操作4次。加入1ml醋酸酐和0.1ml1-甲基咪唑,室温下进行30min乙酰化反应。将溶液转移至反应管,加入1ml纯水终止反应,冰浴。加入1ml氯仿萃取2次,收集氯仿层,合并后转移至干净的反应管,再加入2ml纯水洗涤5次,水层弃去。加入适量的无水硫酸钠去除溶液中的水,静置30min后,将溶液过自制无水硫酸钠小柱后,收集,n2吹至1ml,备用。gc-ms进样条件:载气为he2,分流比100:1,检测器:280℃,柱温由120℃,每分钟4℃升高至280℃,保持5min。根据样品保留时间,确定样品的碎片分子质谱图;另取峰面积比值,计算样品碎片分子占总分子量的含量比值。通过ms归属各样品的总离子流图(tic)中信号峰。以brnp-1为例,gc-ms结果如附图7所示,tic图中,1号峰的质谱数据如附图7中(a-b)所示,由单糖组成分析可知,brnp-1仅含有葡萄糖,为六碳醛糖。由几乎相近量的m/z161和162可知,c-3、c-4处应有2个相邻-ome相连的c-c键(具有相同r基团),且m/z162的次要裂解为m/z102,即裂解一个-ch3cooh,再由m/z118和205可知,c-2、c-3处也有相邻-ome相连的c-c键裂解,则可判断m/z162的次要裂解是β-c连接的-oac裂解。m/z161的次要裂解为m/z101和129,可判断c-5为-oac取代,c-6为-ome取代。综上所述,1号峰为1,5-二乙酰氧基-(1-氘)-2,3,4,6-四甲氧基葡萄糖醇,是端基葡萄糖的信号峰,即t-葡萄糖。2号峰的质谱数据如附图7中(a-b)所示,由含量较高的m/z118和233可知,c-2、c-3处有2个相邻-ome相连的c-c键,m/z233的次要裂解为m/z173、113,则可知c-5为-oac取代,c-4或c-6也为-oac取代,但由于没有m/z161的出现,则c-4为-oac取代,而c-6为-ome取代,综上所述,2号峰为1,4,5-三乙酰氧基-(1-氘)-2,3,6-三甲氧基葡萄糖醇,是1,4位连接的葡萄糖,即(1→4)-葡萄糖。3号峰的质谱数据如附图7中(a-b)所示,由含量最高的m/z118和261可知,c-2、c-3处有2个相邻-ome相连的c-c键,其余碎片的含量较低,可推断c-4、c-5和c-6都为-oac取代。综上所述,3号峰为1,4,5,6-四乙酰氧基-(1-氘)-2,3-甲氧基葡萄糖醇,是1,4,6位连接的葡萄糖,即(1,4→6)-葡萄糖。brnp-2的gc-ms结果如附图8所示,与brnp-1一致,推断过程与上述过程一致。表2甲基化后brnp-1和brnp-2的糖链分析和gc-ms分析brnp-1和brnp-2的糖链分析总结如表2所示,由糖残基的摩尔比可算出多糖样品的分支度,按照公式:分支度(db)=(nt+nb)/(nt+nb+nl),其中nt为端基糖残基数目,nb为分支糖残基数目,nl为线性糖残基数目。brnp-1的nt/nb/nl为10.99:55.94:6.88,brnp-2的nt/nb/nl为11.27:56.24:6.32,代入公式计算,db(brnp-1)为0.24,db(brnp-2)为0.24。实施例八:本发明提取的恰麻古多糖nmr分析取20mg本发明提取方法提取的多糖样品,加入1ml99.99%d2o充分溶解,室温,在varianinova600核磁共振波谱仪上进行1h-nmr、13c-nmr、hsqc、hmbc光谱分析。以brnp-1为例,brnp-1的13cnmr谱图如附图9所示,在化学位移δ90-110处有3个信号,分别对应3个端基碳信号。brnp-1的1hnmr谱图如附图10所示,在化学位移δ4.5-5.5处有3个较强的信号,表明在端基氢部分有3个不同的活跃的氢原子。结合brnp-1的hsqc谱图如附图11所示,化学位移为99.99、99.62和98.49ppm的信号分别代表了d-吡喃葡萄糖残基(a),(1→4)-d-吡喃葡萄糖残基(b)和(1→4,6)-d-吡喃葡萄糖残基(c)。化学位移为5.30、5.27和5.24ppm的信号分别对应残基a、b、c的端基氢信号,其余c、h的信号见表3。表3brnp-1的nmr化学位移残基a在化学位移73.25和72.73ppm分别为c-3和c-5的信号,说明残基a为吡喃型葡萄糖,此结果与ir数据相吻合。相同地,残基b和c的c-3和c-5的信号也可以说明为α-d-吡喃型葡萄糖残基。brnp-1的hmbc谱图如附图12所示,可以推测出残基的连接方式。从hmbc谱图的交叉峰3.56/99.68ppm处,可以推测为残基a(δ99.68)的c-1与残基b的h-4(δ3.56)连接。除此之外,交叉峰5.32/69.36ppm处显示残基c的c-6与残基b的o-1相连。这些推断与hsqc图和gc-ms数据一致。相同地,brnp-2的一维nmr谱图和hmbc图,如附图13、14、15所示,与brnp-1的一致,可推断brnp-2与brnp-1有类似的结构。中性糖brnp-1和brnp-2均为只含有α-d-葡萄糖的多糖分子,表观分子量分别为6873da、4751da,糖链由α-d-(1→4)-葡萄糖骨架组成,包含o-6链接的分支,分支度均为0.24,确定结构式为:实施例八:本发明方法提取的恰麻古多糖单一组分的免疫活性评价1.1小鼠腹腔巨噬细胞raw264.7增殖活性测定取小鼠腹腔巨噬细胞raw264.7,培养于含10%pbs的dmem完全培养液中,培养液中另加入100ug/ml的链霉素和100ug/ml青霉素。以1×104个/ml的细胞密度接种于96孔板中,置于37℃,5%co2培养箱培养。24h后,吸弃上清,加入用完全培养液配制的多糖样品,浓度分别为0,1.6ug/ml,3.2ug/ml,8.0ug/ml,16.0ug/ml,40.0ug/ml,80.0ug/ml,200.0ug/ml,400.0ug/ml,1000.0ug/ml各浓度设6复孔,置于37℃,5%co2培养箱培养。培养24h后,每孔加入20μlcck-8试剂,并置于37℃,5%co2培养箱培养孵育1h,用酶标仪在450nm处测各孔od值,根据其od值计算细胞增殖率%=((od实-od空)/od对)×100%,用spaa17.0分析数据是否具有统计学意义。1.2多糖样品对小鼠腹腔巨噬细胞raw264.7细胞因子分泌的影响将小鼠腹腔巨噬细胞raw264.7,以2×104个/ml接种于96孔板中,置于37℃,5%co2培养箱培养过夜,弃去上清,分别加含有不同质量浓度的多糖样品的完全培养液,200ul/孔加入培养板中,设正常对照组、lps阳性对照组和空白组,每个浓度设6复孔,24h后收集细胞上清,1000xg离心15min,收集上清,在-20℃冻存备用。根据tnf-α试剂盒说明,精确配置2000pg/ml的标准品,分别以标准溶液配置500pg/ml,250pg/ml,125pg/ml,62.5pg/ml,31.25pg/ml,15.6pg/ml,0的标准品系列浓度,每孔100ul加至酶标板,每组设3复孔。将收集离心好的细胞上清,加至酶标板已设好的样品孔中,每组3复孔,每孔100ul。轻轻晃动混匀,盖上板贴,37℃温育2h。弃去液体,甩干。每孔加生物素标记抗体工作液100μl,盖上新的板贴,37℃温育1h。弃去孔内液体,甩干,洗板3次。每次浸泡2min,每孔200μl,甩干。每孔加入辣根过氧化物酶标记亲和素工作液100μl,盖上新的板贴,37℃温育1h。弃去孔内液体,甩干,洗板5次。每次浸泡2min,每孔200μl,甩干。依次每孔加底物溶液90μl,37℃避光显色15min。依次每孔加终止溶液50μl,终止反应。在反应终止后5min内用酶标仪在450nm下依次测量各孔的吸光度(od值)。以od值对应标准品系列浓度,得到线性回归方程,制的标准曲线。将样品孔od值带入标准曲线,计算各浓度样品释放tnf-α水平。计算结果用spaa17.0分析数据是否具有统计学意义。根据il-6试剂盒说明,精确配置100pg/ml的标准品,分别以标准溶液配置50pg/ml,25pg/ml,12.5pg/ml,6.25pg/ml,3.12pg/ml,1.56pg/ml,0的标准品系列浓度,每孔100ul加至酶标板,每组设3复孔。将收集离心好的细胞上清,加至酶标板已设好的样品孔中,每组3复孔,每孔100ul。盖上板贴,室温下温育2.5h。丢弃孔内液体,用1倍洗液清洗4次,每孔100μl。最后一次洗涤时,将洗液完全清除,甩干。每孔加入100μl1倍的生物素化il-6检测抗体,轻微摇晃,室温下温育1h。弃去孔内液体,用1倍洗液清洗4次,甩干。每孔加入100μl1倍的hrp-链霉亲合素,轻微摇晃,室温下温育45min。弃去孔内液体,用1倍洗液清洗4次,甩干。每孔加入100μltmb一步基质试剂,轻微摇晃,室温下温育30min。每孔加入50μl终止溶液,立即在波长为450nm处测定od值,根据od值与标准品浓度制作标准曲线,并将对应样品孔的od值带入后计算出细胞释放il-6水平,计算结果用spaa17.0分析数据是否具有统计学意义。1.3多糖样品对小鼠腹腔巨噬细胞raw264.7分泌no的影响将小鼠腹腔巨噬细胞raw264.7,以1×105个/ml接种于96孔板中,置于37℃,5%co2培养箱培养过夜,弃去上清,分别加含有不同质量浓度的中性多糖完全培养液,200ul/孔加入培养板中,设正常对照组、lps阳性对照组和空白组,每个浓度设6复孔,24h后收集细胞上清,1000xg离心20min,收集上清,在-20℃冻存备用。根据no试剂盒说明,精确配置100umol/l的标准品,分别以标准溶液配置50umol/l、25umol/l、12.5umol/l、6.25umol/l、3.13umol/l、1.56umol/l的标准品系列浓度,每孔50ul加至酶标板,每组设3复孔。将收集离心好的细胞上清,加至酶标板已设好的样品孔中,每组3复孔,每孔50ul。各标准品孔与样品孔,加入50ula试剂(sulfanilamidesolution),室温避光反应5-10min。反应后加入50ulb试剂(n-1-napthylethylenediaminedihydrochloride),并在室温避光反应5-10min。反应后,在波长为520nm处的吸光度od值。以od值对应标准品系列浓度,得到线性回归方程,制的标准曲线。将样品孔od值带入标准曲线,计算各浓度样品释放no水平。2试验结果2.1小鼠腹腔巨噬细胞raw264.7增殖活性测定中性糖brnp-1和brnp-2对小鼠腹腔巨噬细胞raw264.7增殖活性的结果如附图16所示,在浓度为1.6μg/ml-1000μg/ml的范围内,brnp-1和brnp-2对巨噬细胞增殖的影响随多糖样品浓度的增加而增加,近似剂量依赖型。brnp-1的巨噬细胞增殖率基本高于100%,说明brnp-1对巨噬细胞无细胞毒性,且在400μg/ml时,巨噬细胞增殖率最高,因此,在之后的试验中,选择80μg/ml、400μg/ml、2000μg/ml的浓度。brnp-2的巨噬细胞增值率均高于100%,说明brnp-2对巨噬细胞无细胞毒性,且样品浓度越高,巨噬细胞增殖率越高,故在之后的试验中,选择80μg/ml、400μg/ml、2000μg/ml的浓度。2.2多糖样品对小鼠腹腔巨噬细胞raw264.7细胞因子分泌的影响中性糖brnp-1和brnp-2对小鼠腹腔巨噬细胞raw264.7细胞因子分泌的试验结果,如附图17所示。在细胞因子tnf-α分泌试验中如附图18所示,与空白对照组相比,lps阳性对照组tnf-α显著升高,差异有统计学意义(p<0.05);brnp-1低剂量组含量降低,差异有统计学意义(p<0.05),中剂量和高剂量组均升高,差异有统计学意义(p<0.05);brnp-2各剂量组含量均升高,差异有统计学意义(p<0.05)。与lps阳性对照组相比,brnp-1各剂量组tnf-α含量均降低,差异有统计学意义(p<0.05);brnp-2各剂量组含量均降低,除中剂量组外,其余各组差异有统计学意义(p<0.05)。在细胞因子il-6分泌试验中,如附图18所示,与空白组相比,lps阳性对照组il-6含量升高,差异具有统计学意义(p<0.05);brnp-1高剂量组含量降低,差异具有统计学意义(p<0.05),中剂量和高剂量组均升高,差异具有统计学意义(p<0.05);brnp-2各剂量组il-6含量均升高,差异有统计学意义(p<0.05)。与lps阳性对照组相比,brnp-1高剂量组含量降低,差异有统计学意义(p<0.05),其余各组含量升高,差异有统计学意义(p<0.05);brnp-2各剂量组含量均升高,除高剂量组外,其余各组差异有统计学意义(p<0.05)。2.3多糖样品对小鼠腹腔巨噬细胞raw264.7分泌no的影响中性糖brnp-1和brnp-2对小鼠腹腔巨噬细胞raw264.7的no分泌的试验结果,如附图19所示。与空白对照组相比,lps阳性对照组no含量升高,差异有统计学意义(p<0.05);brnp-1各剂量组均升高,差异有统计学意义(p<0.05),呈剂量依赖型;brnp-2各剂量组含量均升高,差异有统计学意义(p<0.05)。与lps阳性对照组相比,brnp-1低剂量组含量降低,差异有统计学意义(p<0.05),其余剂量组含量升高,差异有统计学意义(p<0.05);brnp-2各剂量组含量均低于lps阳性对照组,除中剂量组外,其余各组差异有统计学意义(p<0.05)。2.4结论中性糖brnp-1和brnp-2对小鼠腹腔巨噬细胞raw264.7增殖具有促进作用,且在1.6μg/ml-1000μg/ml范围内无细胞毒性。巨噬细胞激活是治疗一些疾病的常规免疫治疗方案之一。因此,本发明验证试验测定了中性糖brnp-1和brnp-2是否可以刺激巨噬细胞激活。no是生命有机体中一氧化氮合成酶(nos)合成的一种重要的分子,它常常作为一种针对微生物传染的毒剂或者是肿瘤细胞凋亡的诱导剂。在本发明验证试验中,brnp-1对no释放呈剂量依赖型,而brnp-2在400μg/ml时,no释放量最多,与空白对照组和lps阳性对照组差异均有统计学意义(p<0.05)。细胞因子是一种控制机体体内平衡,调节细胞分化、增殖和凋亡以及防御免疫反应和炎症反应等的信号分子。在所有促炎性细胞因子中,il-6是最重要的促使发热及急相反应的介质。tnf-α在免疫和炎症反应中也是重要的细胞因子,它可以在体内或体外直接作为细胞抑制剂从而杀死细胞,与il-6类似,也是主要的免疫和炎症介质,它最突出的活性是能够造成肿瘤相关内皮细胞凋亡,从而使得肿瘤坏死。另外,tnf-α在宿主防御中起着举足轻重的作用,也可以作用于单核细胞和巨噬细胞自分泌的方式加强各种功能反应,诱导其他一些免疫调节和炎症介质的表达。本发明验证试验中,brnp-1和brnp-2对tnf-α的释放有一定的促进作用,brnp-1在400μg/ml时,tnf-α的释放量最高;brnp-2对tnf-α的释放量均高于空白对照组,在400μg/ml时,与lps阳性对照组无差异(p<0.05)。brnp-1和brnp-2在400μg/ml时,il-6的释放量最高,与空白对照组和lps阳性对照组相比,差异均有统计学意义(p<0.05)。如上所述,即可较好地实现本发明,上述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明确定的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1