抗癌融合蛋白及其药物组合物和应用的制作方法
本发明属于治疗性融合蛋白、特别是重组融合蛋白的领域。具体涉及肝细胞生长因子的功能片段和肿瘤血管生成抑制剂的序列的融合蛋白,包含它们的药物组合物,它们在治疗、特别是抗癌试剂中的用途。
背景技术:
肿瘤干细胞理论认为,肿瘤由高度异质性细胞组成,其中有少量细胞成瘤能力强,并且具有自我更新和多向分化潜能,是肿瘤复发、转移和放化疗耐受的“元凶”。因此,抑制肿瘤干细胞是当前肿瘤药物发展的热点。
肿瘤血管生成是实体瘤发生、发展的核心事件。早期研究发现,在肿瘤体积达到2毫米左右,肿瘤组织即可见肿瘤血管生成,它们为肿瘤的生长提供必需的营养、氧气,并带走肿瘤细胞的代谢产物,从而促进肿瘤的生长和侵袭。因此,抑制肿瘤血管生成可以抑制实体瘤的生长。一些抗血管生成试剂,包括小分子酪氨酸酶抑制剂、单克隆抗体等已经在临床肿瘤治疗中应用。然而,临床疗效不如预期。甚至,一些接受抗血管生成治疗的肿瘤,变得更为侵袭,患者预后更差。近年研究发现,其主要原因是:存在肿瘤干细胞。肿瘤干细胞是增殖静息细胞,对缺氧、营养饥饿耐受,抗血管生成治疗导致肿瘤组织缺氧,肿瘤干细胞可活化细胞缺氧诱导因子(hif),分泌表达一系列促进细胞增殖、侵袭相关的细胞因子,从而赋予存留的肿瘤细胞更强的增殖能力和侵袭转移能力。
蛋白质是一类重要的生物大分子,是生物体实现复杂生命活动的基础物质。蛋白药物是生物治疗药物发展的重要方向。与常规小分子化学药物相比,它具有靶向明确、副作用小、功能更强大的优点,迄今为止,也有超过130重蛋白药物已被美国食品药品管理局批准上市。融合蛋白,是将具有不同功能的蛋白片段,通过基因重组技术,链接、融合表达,实现多种功能需求目的的蛋白,是人们设计、创造新功能蛋白的重要途径。
然而,在治疗性融合蛋白实践中,一方面,如何选用功能片段,以起到优异的抑癌作用,本非易事,已研制出的相关融合蛋白,针对上述细胞表面标记物的抑制治疗,并未收到理想疗效。另一方面,确定了针对性的功能片段,又如何进一步选择连接肽,以使得相应的,能够保证功能片段保持良好的功能活性,也是一个亟待解决的问题。最后,现有技术中对相关癌细胞表面标记物的针对性抑制,并未有良好的癌细胞增殖抑制效果,亟待提出一种新的抑癌策略和思路,并提供予以实现策略和思路的融合蛋白。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述和/或现有治疗性融合蛋白、特别是重组融合蛋白领域中存在的问题,提出了本发明。
因此,本发明其中的一个目的是解决现有技术中的不足,提供一种抗癌融合蛋白。
为解决上述技术问题,本发明提供了如下技术方案:包括,结构域a,其为肝细胞生长因子蛋白功能片段,抑制肿瘤干细胞;结构域b,其为肿瘤血管生成抑制剂,通过直接识别血管内皮细胞表面的vegfr2,竞争性拮抗vegf,抑制血管生成;结构域c,其为柔性连接肽或刚性连接肽;其中,所述结构域a,其中所述功能片段是肝细胞生长因子α链氮端第一个环状结构域,起始于肝细胞生长因子第127位氨基酸,终于第214位氨基酸,具体氨基酸序列为:seq.no.1;其中,所述结构域b,为多效性抗血管生成多肽内皮抑素的功能片段,选自seq.no.2和/或seq.no.3;其中,所述结构域c,选自seq.no.4和/或seq.no.5。
作为本发明所述抗癌融合蛋白的一种优选方案,其中:其中,结构域a的氮端连接于结构域c的碳端,结构域b的碳端连接于结构域c的氮端。
作为本发明所述抗癌融合蛋白的一种优选方案,其中:其中,结构域a的碳端连接于结构域c的氮端,结构域b的氮端连接于结构域c的碳端。
作为本发明所述抗癌融合蛋白的一种优选方案,其中:所述结构域a,其碱基序列选自seq.no.6。
作为本发明所述抗癌融合蛋白的一种优选方案,其中:所述结构域b,其碱基序列选自seq.no.7和/或seq.no.8。
作为本发明所述抗癌融合蛋白的一种优选方案,其中:所述结构域c,其碱基序列选自seq.no.9和/或seq.no.10。
本发明另外一个目的是提供一种具有抗癌作用的药物组合物。
为解决上述技术问题,根据本发明的另外一个方面,本发明提供了如下技术方案:一种药物组合物,其为以融合蛋白作为活性成分,与药学上可接受的载体组合。
作为本发明所述药物组合物的一种优选方案,其中:所述药学上可接受的载体选自:溶剂、稀释剂、悬浮剂、乳化剂、抗氧化剂、药学防腐剂、着色剂、香味剂、介质、油性基底、赋形剂中的一种或几种。
本发明还有一个目的是提供药物组合物用于制备治疗哺乳动物中的癌症疾病的试剂的用途。
本发明还有一个目的是融合蛋白用于任何的靶向载体、生物试剂的用途。本发明的有益效果:
本发明所提供的融合蛋白,对于肿瘤细胞具有抑制增殖、诱导凋亡和促进衰老的作用,并且与所采用的肝细胞生长因子蛋白和肿瘤血管生成抑制蛋白相比,具有更强的血管抑制作用。
本发明所提供的融合蛋白连接肽,对于所采用蛋白功能片段,具有很好的选择性,能在融合为新蛋白后,体现出很好的功能活性,并增强了其对肿瘤血管生成的抑制能力。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
图1为ptxb1载体质粒。
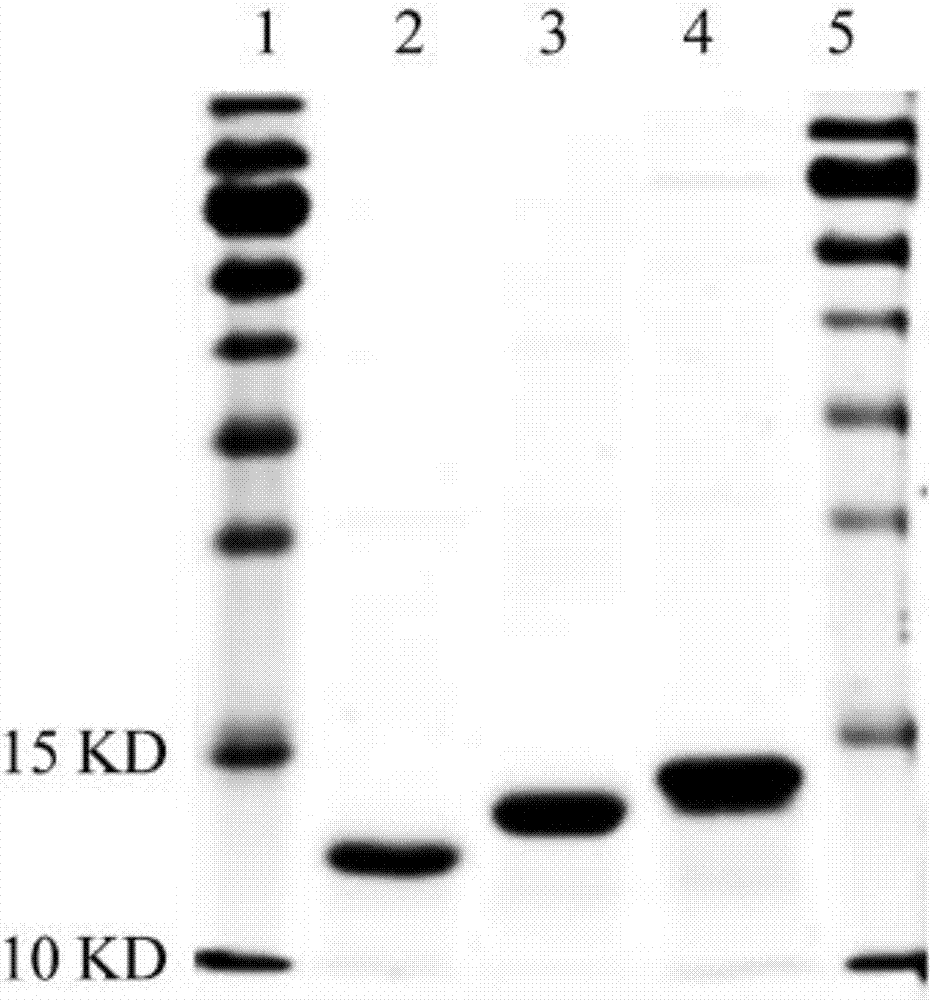
图2为sds-page蛋白电泳图,纯化后的rhgfk1,rel1hk1,rel2hk1三种蛋白,经sds-page蛋白电泳后,行考马斯亮蓝染色。泳道1和5为蛋白marker;泳道2-4分别为纯化后的rhgfk1、rel1hk1和rel2hk1。3种蛋白纯度达90%以上。
图3为rhgfk1、rel1hk1和rel2hk1处理抑制huvec细胞成管能力对比试验图,其说明与rhgfk1相比,融合蛋白rel1hk1和rel2hk1增加了对肿瘤血管生成的抑制能力。
图4cck-8法测定融合蛋白对细胞增殖的抑制作用,其中图4a为融合蛋白对u87细胞增殖的影响;图4b为融合蛋白对u251细胞增殖的影响,表明融合蛋白对于两种细胞均有明显的细胞增殖抑制作用。
图5为ptxb1-e25-linker1-1-hgfk1原核表达效果,泳道1为蛋白marker;泳道2为未诱导菌液;泳道3为诱导菌液。
图6为ptxb1-e25-linker1-2-hgfk1原核表达效果,泳道1为蛋白marker;泳道2为未诱导菌液;泳道3为诱导菌液;泳道4为未诱导菌液;泳道5为诱导菌液。
图7为ptxb1-e25-linker1-3,4-hgfk1原核表达效果,泳道1为蛋白marker;泳道2、4为ptxb1-e25-linker1-3-hgfk1未诱导菌液;泳道3、5为ptxb1-e25-linker1-3-hgfk1诱导菌液;泳道6、8为ptxb1-e25-linker1-4-hgfk1未诱导菌液;泳道7、9为ptxb1-e25-linker1-4-hgfk1诱导菌液。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
实施例1:
seq.no.1的功能片段
肝细胞生长因子(hepatocytegrowthfactor),简称hgf。
seq.no.1的蛋白是起始于肝细胞生长因子第127位氨基酸,含端点,终于肝细胞生长因子第214位氨基酸的功能片段,其简称为hgfk1(thekringle1domainofhumanhgfα-chain)。
hgfk1包含一个由5个氨基酸残基组成的met受体胞外ilr3、4区高亲和结合片段,是一种met受体条件性拮抗剂,具有抗肿瘤干细胞的功能。
seq.no.1氨基酸序列来自于ncbi:aaa35980.1,其氨基酸序列和包含针对在大肠杆菌中表达而优化的密码子的dna编码序列seq.no.6,如下所示:
氨基酸序列:seq.no.1
dna序列:seq.no.6
实施例2:
seq.no.2和seq.no.3的功能片段
内皮抑素(endostatin)是一个公认的多效性抗血管生成多肽,它可直接识别血管内皮细胞表面的vegfr2,竞争性拮抗vegf的功能,从而抑制肿瘤血管生成。
seq.no.2是endostatin的n端25个氨基酸组成的zn绑定片段(e25),其具体的氨基酸序列来自于ncbi:acf74768.1,其氨基酸序列和包含针对在大肠杆菌中表达而优化的密码子的dna编码序列seq.no.7,如下所示:
氨基酸序列:seq.no.2
hshrdfqpvlhlvalnsplsggmrg25
dna序列:seq.no.7
seq.no.3是endostatin的全长,其具体的氨基酸序列来自于ncbi:acf74768.1,其氨基酸序列和包含针对在大肠杆菌中表达而优化的密码子的dna编码序列seq.no.8,如下所示:
氨基酸序列:seq.no.3
dna序列:seq.no.8
实施例3:
seq.no.4和seq.no.5的连接肽
seq.no.4是柔性连接肽,其氨基酸序列和包含针对在大肠杆菌中表达而优化的密码子的dna编码序列seq.no.9,如下所示:
氨基酸序列:seq.no.4
egkssgsgseskst14
dna序列:seq.no.9
gaaggtaaatctagcggctctggttccgaatccaaatctacc42
seq.no.5是刚性连接肽,其氨基酸序列和包含针对在大肠杆菌中表达而优化的密码子的dna编码序列seq.no.9,如下所示:
氨基酸序列:seq.no.5
aeaaakeaaaka12
dna序列:seq.no.10
gccgaagccgccgccaaagaagccgccgccaaagcc36
实施例4:
(1)重组载体ptxb1-hgfk1的构建:
将实验室原有含hgfk1基因的质粒pet-30a(+)-hgfk1送测序,结果回示其中包含hgfk1基因(genbank:m73239.1)。如图1所示,根据ptxb1质粒的酶切位点,设计hgfk1的上下游引物。
hgfk1上游引物序列为:
5’tcgtcggcatatgaactgcatcattggtaaag3’;
下游引物序列为:
5’atagctcttccgcagcaggtcatgcattc3’;
其上下游引物分别引入了限制性内切酶ndeⅰ和sapⅰ的酶切位点。
以pet-30a(+)-hgfk1为模板,pcr扩增hgfk1基因,其反应体系为:100ng含有hgfk1的质粒dna模板,200pmol每种引物,1ulpfu酶(promega公司),10ul10×buffer,200umdntp,相应体积的无核酶水,共100ul体系;扩增程序为:95℃预变性2分钟,95℃变性30秒,58℃引物退火30秒,72℃延伸1分钟,25个循环后,72℃延伸5分钟结束反应,扩增得到了260bp的hgfk1基因片段。用胶回收试剂盒切胶回收后用限制性内切酶ndeⅰ和sapⅰ双酶切hgfk1基因序列,然后用pcr产物纯化试剂盒进行回收;同时,载体ptxb1用限制性内切酶ndeⅰ和sapⅰ双酶切,离心后加入2ul去磷酸化酶,37℃水浴3小时,切胶回收载体。然后把hgfk1基因片段与经ndeⅰ和sapⅰ酶切后的ptxb1载体用t4连接酶进行连接(基因片段与载体的摩尔质量比为7:1,16℃过夜连接14小时),得重组载体。
将获得的重组载体转化至大肠杆菌dh5α感受态细胞,具体方法为:将10ul的连接产物与50ul的大肠杆菌dh5α感受态细胞混匀,冰浴30分钟,42℃热激90秒,冰浴3分钟,然后加入500ullb培养基中,于37℃摇床中孵育45分钟,涂于含100ug/ml氨苄青霉素的lb抗性培养平板进行筛选,37℃培养12-16小时。
挑选菌落并以此为模板,用t7载体上游引物、hgfk1下游引物进行菌落pcr鉴定,pcr反应体系为:单克隆菌落,100pmol每种引物,2×mastermix(promega),相应体积的无核酶水,共20ul体系;扩增程序为:95℃预变性2分钟,95℃变性30秒,50℃引物退火30秒,72℃延伸30秒,25个循环后,72℃延伸5分钟结束反应。将筛选得到的阳性克隆转至10ml含100ug/ml氨苄青霉素的lb液体培养基中,37℃、220rpm振摇12-16小时,提取质粒交由金唯智生物科技公司进行测序,将含有hgfk1基因的ptxb1重组载体命名为ptxb1-hgfk1。
测序结果如下:
(2)重组载体ptxb1-linker-hgfk1的构建(包含柔性连接肽linker1和刚性linker2两种连接肽):
两种连接肽相应氨基酸序列为:
柔性为seq.no.4;
刚性为seq.no.5;
根据ndeⅰ和sapⅰ的酶切位点设计两种连接肽上下游引物,序列如下:
刚性连接肽上游引物序列为:
5’atacatatggccgaagccgccgccaaagaagccgccgccaaagccaactgcatcattggt3’;
柔性连接肽上游引物序列为:
5’gctcatatggaaggtaaatctagcggctctggttccgaatccaaatctaccaactgcatcattgg3’;
下游引物序列均为:
5’atagctcttccgcagcaggtcatgcatt3’;
以测序正确的ptxb1-hgfk1为模板,pcr扩增linker1-hgfk1和linker2-hgfk1基因,pcr反应体系同(1),退火温度改为60℃,其余反应条件同(1),得到300bp的linker1-hgfk1及linker2-hgfk1基因片段。用胶回收试剂盒切胶回收后用限制性内切酶ndeⅰ和sapⅰ双酶切,然后用pcr产物纯化试剂盒进行回收;然后把linker1-hgfk1和linker2-hgfk1基因片段与经ndeⅰ和sapⅰ酶切后的ptxb1载体用t4连接酶进行连接(本次基因片段与载体的摩尔质量比为6:1,16℃过夜连接18小时),得重组载体。
将获得的重组载体转化至大肠杆菌dh5α感受态细胞,涂于含100ug/ml氨苄青霉素的lb抗性培养平板进行筛选,37℃培养12-16小时。挑选菌落并以此为模板,用t7载体上游引物、hgfk1下游引物进行菌落pcr鉴定,pcr反应体系及反应条件同(1)。将筛选得到的阳性克隆转至10ml含100ug/ml氨苄青霉素的lb液体培养基中,37℃、220rpm振摇12-16小时,提取质粒交由金唯智生物科技公司进行测序,将含有linker1-hgfk1和linker2-hgfk1基因的ptxb1重组载体命名为ptxb1-linker1-hgfk1和ptxb1-linker2-hgfk1。
测序结果如下:
ptxb1-linker1-hgfk1
ptxb1-linker2-hgfk1
(3)重组载体ptxb1-e25-linker-hgfk1的构建(包含柔性linker1和刚性linker2):
选取endostatin(genbank:di212352.1)的n端25个氨基酸hshrdfqpvlhlvalnsplsggmrg,为合成包含刚性连接肽的e25-linker2-hgfk1,根据酶切位点设计上游引物:
上游引物序列为:
5’tatcatatgcacagccaccgcgacttccagccggtgctccacctggttgcgctcaacagccccctgtcaggcggcatgcggggcgccgaagccgccg3’;
下游引物序列为:
5’cgcgctcttccgcagcaggtcatgcattcaac3’;
以测序正确的ptxb1-linker2-hgfk1为模板,pcr扩增e25-linker2-hgfk1基因,pcr反应体系为:200ng的质粒模板,100pmol每种引物,相应体积的2×taqmix,共100ul体系;反应条件为:94℃预变性5分钟,94℃变性1分钟,78℃引物退火30秒,72℃延伸1分钟,30个循环后,72℃延伸5分钟结束反应,扩增得到400bp的e25-linker2-hgfk1基因片段。用胶回收试剂盒切胶回收后用限制性内切酶ndeⅰ和sapⅰ双酶切,然后用pcr产物纯化试剂盒进行回收。为合成包含柔性连接肽的e25-linker1-hgfk1,请金唯智生物科技公司合成e25-linker1-hgfk1片段退货双链,直接使用限制性内切酶ndeⅰ和sapⅰ进行双酶切,然后用pcr产物纯化试剂盒进行回收。然后把回收好的e25-linker1-hgfk1和e25-linker2-hgfk1基因片段与经ndeⅰ和sapⅰ酶切后的ptxb1载体用t4连接酶进行连接(本次基因片段与载体的摩尔质量比为7:1,16℃过夜连接15小时),得重组载体。
将获得的重组载体转化至大肠杆菌dh5α感受态细胞,涂于含100ug/ml氨苄青霉素的lb抗性培养平板进行筛选,37℃培养12-16小时。挑选菌落并以此为模板,用t7载体上游引物、hgfk1下游引物进行菌落pcr鉴定,pcr反应体系及反应条件同(1)。将筛选得到的阳性克隆转至10ml含100ug/ml氨苄青霉素的lb液体培养基中,37℃、220rpm振摇12-16小时,提取质粒交由金唯智生物科技公司进行测序,将含有正确基因序列的ptxb1重组载体命名为ptxb1-e25-linker1-hgfk1和ptxb1-e25-linker2-hgfk1。
测序结果如下:
ptxb1-e25-linker1-hgfk1
ptxb1-e25-linker2-hgfk1
(4)重组e25-hgfk1融合蛋白的原核表达和纯化:
提取步骤(3)中含有ptxb1-e25-linker1,2-hgfk1的大肠杆菌dh5α中的质粒,按照常规方法转化到大肠杆菌er2566中。将空载体对照和含有重组载体的菌液在含氨苄青霉素抗性的lb培养基中37℃培养至od600达0.6-1.0之间,加入终浓度为0.4mmiptg25℃诱导表达蛋白12-16小时。5000g,15分钟离心收集细菌,并用超声缓冲液(20mmtris-hcl,0.5mnacl,0.1%tritonx-100,ph8.5)重悬,将重悬液超声破碎(输出功率为300w,每次超声10秒和间歇10秒,处理时间为25分钟),12000g,30分钟离心,超声破碎后离心所得的上清液即为含有re25-linker1,2-hgfk1蛋白的粗产物(以下简称为rel1hk1和rel2hk1)。转移上清液至新管中,用于进一步分析。
将细菌超声破碎后的上清与几丁质珠4℃结合2小时。然后使用平衡缓冲液(20mmtris-hcl,0.5mnacl,ph8.5)重悬结合融合蛋白的beads,用平衡缓冲液洗10倍柱体积,清洗非特异性蛋白。向柱中加入三倍柱体积的切割缓冲液(20mmtris-hcl,0.5mnacl,50mmdtt,ph8.5),置换出平衡缓冲液,于4℃切割24-40小时。最后用平衡缓冲液洗脱收集目的蛋白。图2为rhgfk1、rel1hk1和rel2hk1的纯化产物,可见得到了目标大小11kd作用的rhgfk1和13kd左右的融合蛋白,且纯度在90%以上。
(5)重组e25-linker1,2-hgfk1融合蛋白的浓缩:
将洗脱下的、纯化的融合蛋白液装入透析袋,放入透析液(0.02w/v碳酸铵,0.01w/v蔗糖,ph9.2)中4℃透析,每2h换液,换4次,以去除纯化蛋白中含有的dtt。然后进行冷冻干燥,得到蛋白干粉,于-40℃保存,使用前用无菌水重悬过滤除菌,以bsa作为标准蛋白,行sds-page胶测量融合蛋白浓度。
实施例5:
实验前一天将基质胶、48孔板及200ul枪头放入4℃冰箱,使胶过夜缓慢融化。开始实验前,将基质胶始终保持放于冰盒内。取预冷好的48孔板及枪头,每孔加入100ul基质胶,使其均匀覆盖皿底,置于37℃培养箱30分钟使其凝固。
将进入对数生长期的huvec细胞用pbs洗1次,以0.25%胰蛋白酶37℃消化2分钟,加入含血清的1640培养液吹打混匀,离心后用空egm培养基重悬,进行细胞计数,取5个1.5ml的ep管,每管加入3×104个细胞,340g离心5分钟,吸去上清,分别加入200ul的空egm或者使用空egm配制的endostatin(n端25个氨基酸)、rhgfk1、rel1hk1、rel2hk1(其中endostatin为125ng/ul,其余与其保持摩尔数相同)。将细胞混匀后加入包被好基质胶的孔中,3-8小时之间观察成管情况,并进行拍照、统计。结果如图3,可见与对照组相比,加蛋白组均有明显的血管形成抑制作用,其中融合蛋白组相较endostatin(n端25个氨基酸)组之间有更强的抑制效果,而endostatin(n端25个氨基酸)与hgfk1之间差异无统计学意义。
实施例6:
融合蛋白对细胞增殖活性的影响
将进入对数生长期的u87、u251细胞用pbs洗1次,以0.25%胰蛋白酶37℃消化1分钟,加入含血清的dmem培养液吹打混匀,进行细胞计数,将细胞接种于96孔平底型培养板中,细胞密度为5×103个/孔,每孔体积为200ul,血清浓度为0.5%。置于37℃培养箱中孵育24小时使其贴壁。吸去各孔培养基,按分组加入rel1hk1和rel2hk1,每组做5个平行对照孔,置于37℃培养箱中继续培养,于24小时重复加药一次,48小时后终止反应,每孔加入cck-810ul,置于37℃培养箱中孵育1-3小时,酶标仪上450nm波长下测定各孔吸光度值。结果如图4所示,融合蛋白对于两种细胞均有明显的细胞增殖抑制作用。
实施例7:
1.选取如下4种柔性连接肽,记为linker1-1,1-2,1-3,1-4,分别连接形成ptxb1-e25-linker1-hgfk1。
(1)linker1-1:
氨基酸序列:ggggsggggs
对应碱基序列:ggcggtggcggtagcggcggtggcggtagc
(2)linker1-2:
氨基酸序列:sggggsggggsggggs
对应碱基序列:tcaggtggcggcggttcaggtggcggcggttcaggtggcggtggctca
(3)linker1-3:
氨基酸序列:gsagsaagsgef
对应碱基序列:ggctctgcggggtccgcggcggggtccggtgaattc
(4)linker1-4:
氨基酸序列:egkssgsgseskst
对应碱基序列:gaaggtaaatctagcggctctggttccgaatccaaatctacc
2.测序确认连接正确。
3.原核表达:将测序结果正确的质粒,包括ptxb1-e25-linker1(1-1,2,3,4)-hgfk1,通过转化方法转入er2566感受态细胞中。在氨苄抗性lb平板上于37℃温箱培育12-16h后,挑取单克隆菌,接种于lb液体培养基(含氨苄抗性),在37℃、220rpm摇床培养至菌液od600达到0.6-1.0之间时,分为两份,一份加入终浓度为0.4mm的iptg,另一份不加iptg,在25℃,220rpm条件下表达蛋白12-16小时,分别留取样品,分别记为诱导菌液和未诱导菌液。对留取的样品通过12%sds-page电泳分析蛋白质的表达情况,见图5~7。
实施例8:
药物组合物
本公开内容的融合蛋白可以配制成例如给予受治疗者以治疗癌症的药物组合物。融合蛋白可以单独给予,或者可在同一组合物中或作为单独的组合物,与其它疼痛疗法联合给予。
药物组合物通常包括药学上可接受的载体。本文所用的“药学上可接受的载体”包括任何及所有生理上相容的溶剂、分散介质、包衣材料、抗细菌剂和抗真菌剂、等渗剂和吸收延缓剂等。组合物可包括药学上可接受的盐,例如酸加成盐或碱加成盐。
药物制剂技术是普遍接受的技术,更多详情参见例如gennaro,thescienceandpracticeofpharmacy,第20版,lippincott,williams&wilkins(2000)(isbn:0683306472);ansel等,pharmaceuticaldosageformsanddrugdeliverysystems,第7版,lippincottwilliams&wilkinspublishers(1999)(isbn:0683305727);以及kibbe,handbookofpharmaceuticalexcipientsamericanpharmaceuticalassociation,第3版(2000)(isbn:091733096x)。
在一个实施方案中,所述肽与赋形剂材料(例如盐水、氯化钠、磷酸氢二钠七水合物、磷酸二氢钠)和稳定剂一起配制。还可在例如缓冲溶液中按合适的浓度提供。
药物组合物可呈各种形式。这些包括例如液体、半固体和固体剂型,例如液体溶液剂(例如注射和输注溶液剂)、分散剂或混悬剂、片剂、丸剂、散剂、脂质体和栓剂。优选的形式可取决于既定的给药方式和治疗应用。
可通过胃肠外方式(例如静脉内、皮下、腹膜内或肌内注射)给予组合物。本文所用术语“胃肠外给药”和“经胃肠外给予”是指肠内和局部给药以外的给药方式,通常经注射给药,包括而不限于静脉内、肌内、动脉内、鞘内、囊内、眶内、心脏内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内、硬膜外及胸骨内注射和输注。
可经肠内途径给予组合物,例如通过消化道,例如经口服给药。例如,可以片剂、胶囊剂、囊片剂、丸剂、散剂、滴剂、混悬剂、溶液剂、糊剂、凝胶剂或其它口服剂型给予组合物。
肠内途径包括经胃饲管、十二指肠饲管或胃造口或直肠给予,例如以栓剂或灌肠剂形式的组合物。
组合物可局部给药,例如在肿瘤所在部位。局部给药包括例如表皮、鼻内、吸入和阴道给药。可将组合物给予皮肤(例如烧伤、疱或破口)、唇、牙龈、牙、口腔、眼、耳、甲床或咽喉等,例如肿瘤所在部位。局部给药的组合物可为乳膏剂、凝胶剂、洗剂或软膏剂等。
药物组合物可包括“治疗有效量”的本文所述的肽。该有效量可根据所给药物(例如肽)的效果确定,或者如果使用一种以上药物时,则根据联用效果确定。治疗有效量的药物还可根据以下因素而变化:例如受治疗者的疼痛类型、疾病状况、年龄、性别和体重以及药物在受治疗者体内引起所需反应(例如改善疼痛)的能力。治疗有效量也是其中组合物的治疗有益作用超过任何毒性或有害作用的量。
由上述实施例可见,本发明所提供的抗癌融合蛋白,对于抑制肿瘤血管生成,相较于各功能片段单独抑制,具有增效效果。由上述实施例可见,本发明所优选的连接肽,能够使得功能片段活性最佳。
这是因为,细胞膜met受体信号通路,调控正常细胞的增殖、运动与形态形成,其在多种肿瘤中均被发现异常活化,功能涉及肿瘤的增殖、侵袭和转移,是肿瘤治疗的靶点。多种met受体拮抗剂和酪氨酸激酶抑制剂,已经进行临床测试。然而,单独的met抑制治疗,临床疗效并不理想。
vegfr2是血管生成因子vegf的主要受体,它调节内皮细胞的增殖,是肿瘤血管生成抑制的重要靶点。
met受体是肝细胞生长因子hgf的唯一配体,hgfk1(thekringle1domainofhumanhgfα-chain)是hgfα链的氮端kringle1片段,它包含一个由5个氨基酸残基组成的met受体胞外ilr3、4区高亲和结合片段,是一种met受体条件性拮抗剂,具有抗肿瘤干细胞的功能。
内皮抑素(endostatin)是一个公认的多效性抗血管生成多肽,它可直接识别血管内皮细胞表面的vegfr2,竞争性拮抗vegf的功能,从而抑制肿瘤血管生成。进一步研究显示,endostatin氮端由25个氨基酸组成的zn绑定片段(e25),是endostatin的核心功能区域,单独使用,可完全替代母体蛋白的功能。
经发明人研究发现,met与vegfr2连接成复合物表达于肿瘤细胞表面,当met受体抑制时,细胞可活化vegf/vegfr2的通路,再次激活肿瘤的生长;而单独的vegfr2抑制,细胞可刺激met受体的活化,而刺激肿瘤的生长。
本发明具体使用的柔性及刚性连接肽,不仅保证功能片段体现所需活性,并且在融合后,刚性连接肽更增强了对血管生成的抑制效果,从而整体上体现出更优异的抑癌效果。
这是因为,刚性连接子结构更为稳定,e25与hgfk1可以保持一段间距,有利于其功能的独立发挥;而且,刚性连接子也可能在受体嵌合后,限制了受体的移动,而抑制其同源或者异源二聚,而发挥双受体抑制功能。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
序列表
<110>姚宏
<120>抗癌融合蛋白及其药物组合物和应用
<160>10
<170>patentinversion3.5
<210>1
<211>88
<212>prt
<213>homosapiens
<400>1
asncysileileglylysglyargsertyrlysglythrvalserile
151015
thrlysserglyilelyscysglnprotrpsersermetileprohis
202530
gluhisserpheleuprosersertyrargglylysaspleuglnglu
354045
asntyrcysargasnproargglyglugluglyglyprotrpcysphe
505560
thrserasnprogluvalargtyrgluvalcysaspileproglncys
65707580
sergluvalglucysmetthrcys
85
<210>2
<211>25
<212>prt
<213>homosapiens
<400>2
hisserhisargasppheglnprovalleuhisleuvalalaleuasn
151015
serproleuserglyglymetarggly
2025
<210>3
<211>183
<212>prt
<213>homosapiens
<400>3
hisserhisargasppheglnprovalleuhisleuvalalaleuasn
151015
serproleuserglyglymetargglyileargglyalaaspphegln
202530
cyspheglnglnalaargalavalglyleualaglythrpheargala
354045
pheleuserserargleuglnaspleutyrserilevalargargala
505560
aspargalaalavalproilevalasnleulysaspgluleuleuphe
65707580
prosertrpglualaleupheserglysergluglyproleulyspro
859095
glyalaargilepheserpheaspglylysaspvalleuarghispro
100105110
thrtrpproglnlysservaltrphisglyseraspproasnglyarg
115120125
argleuthrglusertyrcysgluthrtrpargthrglualaproser
130135140
alathrglyglnalaserserleuleuglyglyargleuleuglygln
145150155160
seralaalasercyshishisalatyrilevalleucysilegluasn
165170175
serphemetthralaserlys
180
<210>4
<211>14
<212>prt
<213>人工合成
<400>4
gluglylysserserglyserglysergluserlysserthr
1510
<210>5
<211>12
<212>prt
<213>人工合成
<400>5
alaglualaalaalalysglualaalaalalysala
1510
<210>6
<211>264
<212>dna
<213>homosapiens
<400>6
aactgcatcattggtaaaggacgcagctacaagggaacagtatctatcactaagagtggc60
atcaaatgtcagccctggagttccatgataccacacgaacacagctttttgccttcgagc120
tatcggggtaaagacctacaggaaaactactgtcgaaatcctcgaggggaagaaggggga180
ccctggtgtttcacaagcaatccagaggtacgctacgaagtctgtgacattcctcagtgt240
tcagaagttgaatgcatgacctgc264
<210>7
<211>75
<212>dna
<213>homosapiens
<400>7
cacagccaccgcgacttccagccggtgctccacctggttgcgctcaacagccccctgtca60
ggcggcatgcggggc75
<210>8
<211>549
<212>dna
<213>homosapiens
<400>8
cacagccaccgcgacttccagccggtgctccacctggttgcgctcaacagccccctgtca60
ggcggcatgcggggcatccgcggggccgacttccagtgcttccagcaggcgcgggccgtg120
gggctggcgggcaccttccgcgccttcctgtcctcgcgcctgcaggacctgtacagcatc180
gtgcgccgtgccgaccgcgcagccgtgcccatcgtcaacctcaaggacgagctgctgttt240
cccagctgggaggctctgttctcaggctctgagggtccgctgaagcccggggcacgcatc300
ttctcctttaacggcaaggacgtcctgacccaccccacctggccccagaagagcgtgtgg360
catggctcggaccccaacgggcgcaggctgaccgagagctactgtgagacgtggcggacg420
gaggctccctcggccacgggccaggcctactcgctgctggggggcaggctcctggggcag480
agtgccgcgagctgccatcacgcctacatcgtgctatgcattgagaacagcttcatgact540
gcctccaag549
<210>9
<211>42
<212>dna
<213>人工合成
<400>9
gaaggtaaatctagcggctctggttccgaatccaaatctacc42
<210>10
<211>36
<212>dna
<213>人工合成
<400>10
gccgaagccgccgccaaagaagccgccgccaaagcc36
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗CD24人源化抗体融合蛋白的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 一种融合蛋白表达纯化方法与制造工艺
- 抗USP2a蛋白单克隆抗体杂交瘤细胞及其产生的抗USP2a单克隆抗体和应用的制造方法与工艺
- 与癌症相关的基因融合体和基因变异体的制造方法与工艺
- 包含邻近氨基酸端的志贺毒素A亚基效应子区和细胞靶向性免疫球蛋白型结合区的蛋白的制造方法与工艺
- 杀虫融合蛋白改进的制造方法与工艺
- vin‑cdtb在大肠杆菌中的表达和制备的制造方法与工艺
- 一种抗肿瘤侵袭转移的多靶点融合蛋白的制备及用途的制造方法与工艺
- 重组人成纤维细胞生长因子21融合蛋白及其在制备治疗代谢疾病药物中的应用的制造方法与工艺