一株产紫杉醇的黄曲霉BP6T2及其应用的制作方法
本发明属于微生物
技术领域:
,具体涉及一种从巴山榧树中分离出的黄曲霉bp6t2,该菌株具有高产紫杉醇的特性,还涉及黄曲霉bp6t2在治疗肿瘤细胞中的应用。
背景技术:
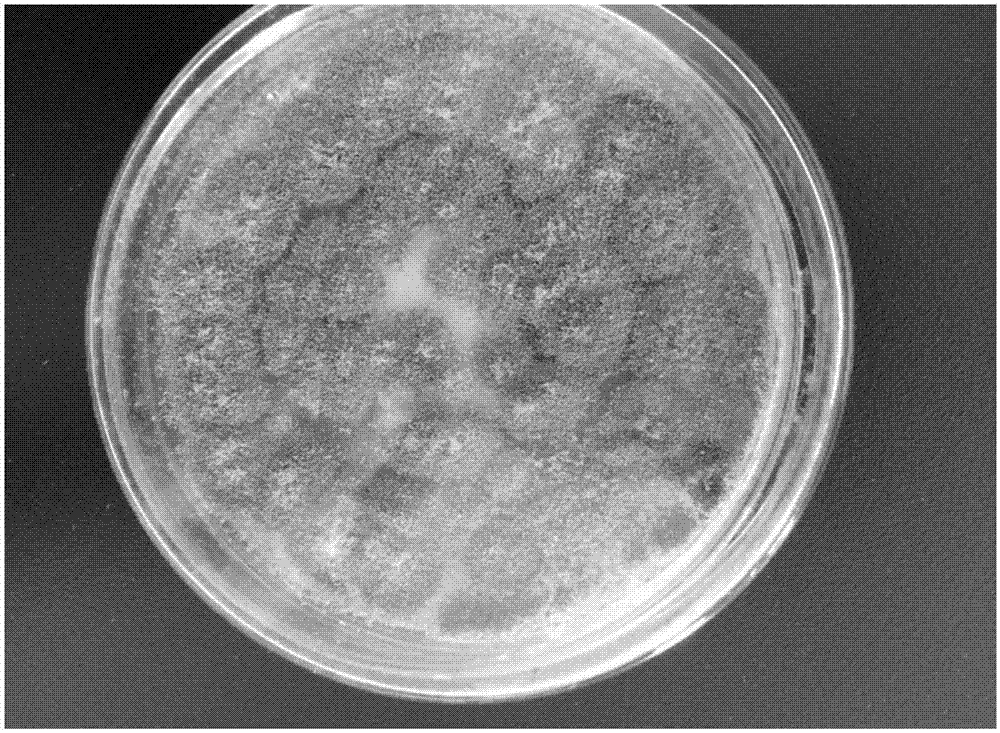
:紫杉醇(paclitaxel)别名泰素、紫素、特素,分子量853.92,分子式c47h51no14(图1),是细胞有丝分裂抑制剂,被用于癌症治疗(wanimc,taylorhl,wallme,etal.plantantitumoragents.vi.theisolationandstructureoftaxol,anovelantileukemicandantitumoragentfromtaxusbrevifolia[j].jamchemsoc,1971,93:2325~2327.)。紫杉醇及其类似物被认为是高效、广谱、低毒性的抗癌药物,尤其是目前治疗卵巢癌、子宫癌和乳腺癌最好的药物,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也都有一定疗效。它是一种高效细胞毒素,与已上市的其它化学合成抗肿瘤剂或植物抗癌药相比,具有独特的抗癌机理。它特异性结合于分裂中的细胞如癌细胞的维管束蛋白,尤其是β-微管蛋白上,促进微管蛋白聚合,抑制解聚,保持微管蛋白稳定,使肿瘤细胞停止在g2期和m期,抑制细胞有丝分裂,从而阻止癌细胞的增殖,因而使肿瘤体积逐渐缩小,而不是直接杀死癌细胞。在肿瘤细胞中,紫杉醇可诱导促凋亡基因,如bax,p53和p21,c-mos,tnf-α等的表达而诱发凋亡。还发现紫杉醇可增强酪氨酸激酶的磷酸化,激活细胞凋亡的信号转导途径,促进细胞凋亡。紫杉醇还可调节机体的免疫功能,促进il-1,ifn-α和ifn-β、inf-α等的分泌和释放,对肿瘤细胞起杀灭或抑制的作用。紫杉醇最早于1967年在美国国家癌症研究所被发现,上世纪五十年代末,美国国家癌症研究所制定了一项从全美植物中筛选抗癌活性物质的庞大计划。受该计划资助,monroee.wall和mansukhc.wani于1963年从太平洋红豆杉(taxusbrevifolia)树皮中提取出紫杉醇粗提物。1966年,紫杉醇得到纯化,并确定了它的结构。随后证明其具有较高的抗b16黑色瘤活性。1979年,schiff和horwitz阐明了紫杉醇特异性结合于分裂中的细胞如癌细胞。至1992年12月29日,美国食品药品管理局(fda)才批准bristol-myers-squibb(bms)公司将紫杉醇上市,商品名为taxol,主要用于治疗卵巢癌和乳腺癌。但是红豆杉属等植物中紫杉醇含量极低,仅有0.003%-0.069%。即治疗1个癌症病人所需要的紫杉醇的量为需要砍掉3株生长60年的红豆杉树,或1株千年红豆杉的树皮方可获取。每提取1kg紫杉醇,要砍伐大约2000棵百年大树。并且它的自然资源红豆杉和东非罗汉松均生长十分缓慢,数量有限,很难满足人类的需要,因此其价格非常昂贵。即便采伐全部的天然资源,也只能满足短期需要,且造成对森林和人类生存环境以及生物多样性不可弥补的损失。因此,紫杉醇原料的保障就成为该药能否成功走向市场的关键因素。为了解决某些药用植物生长缓慢、资源紧张等因素带来的药源紧张和生态破坏问题,人们也一直在尝试利用其它的方法生产紫杉醇,诸如化学合成法,半化学合成法,细胞组织培养等,其主要特点如下:(1)化学全合成紫杉醇方法获得了成功,但整个过程非常昂贵,而且产量不高,并非一个理想途径。(2)半合成虽然有效,但从植物组织中分离纯化半合成前体亦较为困难。(3)植物组织培养需要的步骤较为简单,但紫杉醇产量较低,产量不稳定。产紫杉醇或类似物内生真菌的分离是近年来发展起来的一种有效解决紫杉醇资源问题的新途径。通过微生物发酵的方法大量生产紫杉醇,有望改善目前紫杉醇价格昂贵、供不应求的现状。即使其产量与植物中紫杉醇含量相当或略低,但由于真菌发酵周期短(10~15天),发酵规模可以人为控制,其生产能力一定大大优于植物材料的生产能力。因此,寻找可以产生紫杉醇的植物内生真菌,通过微生物发酵的方法大量生产紫杉醇,有望改善目前紫杉醇价格昂贵、供不应求的现状。植物内生菌广泛存在于几乎各种植物中,在长期的进化过程中,它们与植物宿主之间形成了和谐的生态关系。宿主为它们提供相对稳定的环境,而内生菌则赋予宿主抗菌、抗病毒、抗干旱及抗虫等特性。通过长期的共同进化,可能在某些药用植物的内生菌中也能够产生与宿主相同或相似的药用活性物质。因此许多药用植物的内生真菌研究受到了广泛的关注,包括产紫杉醇或类似物的植物内生真菌的分离研究也同样受到了广泛的关注。1993年,stierle等首次从短叶紫杉(taxusbrevifolia)的韧皮部中分离出一种新的内共生真菌——安德鲁紫杉菌(taxomycesandreanae),可在半合成培养液中产生紫杉醇和紫杉烷类化合物,表明有的内生真菌具有合成和宿主植物相同或相似的活性成分的能力。此后,各国学者纷纷开展产紫杉醇内生真菌的分离工作。li等从秃柏(taxodiumdistichum)的树皮下韧皮部和木质部中都分离到产紫杉醇的内生真菌(pestalotiopsismicrospora)。strobel等从西藏红豆杉(t.wallachiana)中分离到一株产生紫杉醇的内生真菌小孢拟盘多毛孢(pestalotiopsismicrospora),这种真菌的培养液可以产生紫杉醇的量达到50μg/l;此后又分离到尼泊尔盘端鹿角菌(seimatoantleriumnepalense),其真菌培养液产生紫杉醇的量为62~80ng/l。这说明产紫杉醇的内生真菌不仅存在于红豆杉属植物中,在一些非红豆杉属植物中也存在,进一步扩大了产紫杉醇内生真菌的筛选范围。我国学者在分离产紫杉醇内生真菌的研究中也取得了一定的成果。1994年,邱德有等从云南红豆杉(t.yunnanensis)树皮中分离出一种内生真菌yfi,形态类似于stierle发现的安德鲁紫杉菌,经过tlc分析测定,表明亦可产生紫杉醇,但是生物合成量很低。周东坡等从东北红豆杉(t.cuspidase)中发现一种内生真菌——树状多节孢(nodulisporiumsp.),可以产生紫杉醇,是我国的新记录属,产量为51.06~125.7μg/l。王伟等从南方红豆杉(t.chinensisvarmairei)的主干和侧枝树皮及皮下部分分离得到9株内生菌,其中6株能分泌紫杉烷类化合物,经鉴定分别属于头孢霉属(cephalosporiumsp.)、轮柄梳霉属(martensiomycessp.)和无孢菌(myceliasterlia)。代文亮等也从中国南方红豆杉中分离到一株产紫杉醇内生真菌,经鉴定为镰刀菌属(fusariummairei),产量约20μg/l。由于野生型真菌产紫杉醇或类似物的含量普遍偏低,为了提高其产量,目前的研究主要集中在以下几个方面:如利用常规诱变改良菌种(周东坡,平文祥,孙剑秋等.紫杉醇产生菌分离的研究[j].微生物学杂志,2001,21(1):18~21.);利用原生质体诱变改良菌种(赵凯,平文祥,马玺等,紫杉醇高产菌株的原生质体诱变选育及其遗传变异初探,微生物学报,2005,45(3),355-358.);利用基因工程技术构建工程菌株改良菌种;优化培养基及发酵条件等;要将这些产紫杉醇或类似物真菌应用到生产中,其关键问题在于其产量如何。但是目前发现的产生菌的产量均未达到工业化生产的要求。迄今为止,产紫杉醇内生真菌菌株主要从濒危物种红豆杉属的植物中分离,却忽略了红豆杉科中其它属植物。有研究表明,红豆杉科榧属植物中也发现有紫杉烷类化合物,但含量极低,紫杉醇含量低于0.003%,认为药用开发价值不大(易官美,邱迎春.榧树的研究现状与发展[j].资源与环境,2013,29(8):844-848)。刘艳等从海南粗榧(cephalotaxushainanensisli)中分离到的产次生代谢产物的菌种,主要产生的可能抗肿瘤的物质三尖杉酯碱类化合物(刘艳等.海南粗榧内生真菌ch1307鉴定及其抗肿瘤活性研究[d].海南大学,2012.蒋春洁.海南粗榧内生真菌抗肿瘤活性菌株筛选[d].海南大学,2014.)本发明从神农架国家地质森林公园巴山榧树(红豆杉科,榧属;torreyafargesii)组织中分离内生真菌,通过抑菌试验,筛选出具有抗菌活性植物的内生真菌;再通过高效液相色谱分析和抗肿瘤活性分析,筛选出产生紫杉醇或类似物次生代谢产物的菌种;并通过用液质联用仪定性检测,推测该菌株产生的紫杉烷类化合物为紫杉醇。通过微生物发酵的方法大量生产紫杉醇,有望改善目前紫杉醇价格昂贵、供不应求的现状。即使其产量与植物中紫杉醇含量相当或略低,但由于真菌发酵周期短(10~15天),发酵规模可以人为控制,其生产能力一定大大优于植物材料的生产能力。技术实现要素:本发明的目的是在于提供了一种从巴山榧树中分离出的内生菌黄曲霉(aspergillusflavus)bp6t2,该菌株具有抗金黄色葡萄球菌(g+)和大肠杆菌(g-)活性,同时还具有高产紫杉醇的特性。本发明另一个目的是在于提供了黄曲霉(aspergillusflavus)bp6t2在制备治疗肿瘤细胞药物中的应用,经试验证明,黄曲霉bp6t2发酵液提取物对hela肿瘤细胞具有明显的抑制作用。为了达到上述的目的,本发明采用下述技术方案:黄曲霉(aspergillusflavus)bp6t2的分离筛选,其步骤是:1、将巴山榧树的根、茎、叶、树皮分别用无菌水冲洗后,吸干,依次用75%(v/v)的酒精消毒5min和2%(v/v)次氯酸消毒8min,然后用无菌水冲洗,用无菌刀将采集到的根、茎和树皮切成小段,取各部位的材料置于pda固体培养基平皿,放置于28℃恒温箱中培养,待上述平皿中接种物切面边缘长出细小菌丝,挑取菌丝转接入新的pda固体平板上纯化,直至为纯培养物;2、将纯化的真菌接种至pda平板上,28℃培养,记录菌落大小、颜色、菌丝致密程度、菌落边缘是否整齐、菌落生长速度以及产色素等菌落形态;3、用琼脂块法测定内生真菌的抑菌活性:将试验细菌(金黄色葡萄球菌、大肠杆菌)用lb培养基活化后,分别涂布于lb固体培养基表面,每个平皿中接种带有琼脂培养基的内生菌,37℃培养1-2天,观察琼脂块周围的抑菌圈,获得一株具有同时具有抗金黄色葡萄球菌(g+)和大肠杆菌(g-)活性的菌株,记为bp6t2;4、经过平皿培养特性观察,该菌株菌落颜色呈草绿色,菌落质地为丝绒状,显微镜下观察其分生孢子头呈疏松放射状,顶囊近球形,单层和双层小梗同时存在,鉴定为黄曲霉(aspergillusflavus)bp6t2;5、将菌株bp6t2在pda液体培养基中,180rpm、28℃活化3天,作为种子液,将种子液以5%(v/v)的接种量,接入pda液体培养基中,180rpm,28℃培养7-10天收获发酵液;6、发酵结束后,收集滤液,滤液中加入1/3体积的乙酸乙酯,逆流萃取3次,收集上层有机相,于旋转蒸发仪中除去有机溶剂,获得脂溶性提取物,其含量平均约为93mg/l;7、高效液相色谱(hplc)发现抽提物中含有与紫杉醇标准品保留时间基本一致的成分,测得保留时间为13.208min,与标准品保留时间相近,表明其含有紫杉醇或类似物;8、液质联用仪(hplc-ms)测定代谢抽提物中紫杉醇类似物的结构,表明其母离子da为876.300,子离子da分别为307.900、591.200和531.200,源电压均为150,碰撞能分别为36、36和40,与紫杉烷类化合物紫杉醇标准品完全一致,故判断黄曲霉(aspergillusflavus)bp6t2产生的代谢抽提物为紫杉醇。所述的巴山榧树组织中分离出来的植物内生菌黄曲霉(aspergillusflavus)bp6t2,保藏于中国典型培养物保藏中心(cctcc),保藏地址:中国.武汉.武汉大学,保藏日期:2016年6月8日,保藏编号:cctccno.m2016318,其特征是具有抗金黄色葡萄球菌和大肠杆菌的活性,发酵液中紫杉醇的含量达到7.81mg/l。黄曲霉bp6t2在制备治疗肿瘤细胞药物中的应用:通过cck-8法测定黄曲霉bp6t2的发酵液提取物对hela细胞的抑制作用,结果表明随着提取物的浓度的升高,对细胞增殖的抑制作用增强,其中以3.104μg/ml浓度处理的抑制作用最强,抑制率为66.20%,故推测黄曲霉bp6t2产生的抗hela细胞物质为紫杉醇。与现有技术相比,本发明具有以下优点和有益效果:1、迄今为止,产紫杉醇内生真菌菌株主要从濒危物种红豆杉属的植物和罗汉松植物中分离,已有研究从秃柏中也分离出产生紫杉醇的内生菌。本发明也从从红豆杉属以外的植物中如巴山榧树(红豆杉科,榧属)组织中分离出产紫杉醇的内生真菌,进一步扩大了获取产生紫杉醇或类似物菌种的资源范围,有利于更广泛地利用微生物资源。2、本研究是首次获得产生紫杉醇类化合物的黄曲霉,该植物内生菌黄曲霉bp6t2可以非常稳定地产生紫杉醇类似物,发酵液提取物最高可达到93mg/l,紫杉醇相对百分含量为10.5%,紫杉醇的产量为7.81mg/l,高于现有技术已公开的产量(邱德有等.一种云南红豆杉内生真菌的分离,《菌物学报》,1994(4):314-316;lij,etal.ambuicacid,ahighlyfunctionalizedcyclohexenonewithantifungalactivitypestalotiopsisspp.andmonochaetiaspphytochemistry,2001,56(5):463-468;周东坡,平文祥,孙剑秋等.紫杉醇产生菌分离的研究[j].微生物学杂志,2001,2l(1):18—20;赵凯,平文祥,马玺等,紫杉醇高产菌株的原生质体诱变选育及其遗传变异初探,微生物学报,2005,45(3):355-358.)。3、采用cck-8试剂法检验黄曲霉bp6t2发酵液中代谢抽提物对hela肿瘤细胞的抑制作用,试验表明随着提取物浓度的升高,对hela肿瘤细胞增殖的抑制作用增强,当其浓度为0.0310μg/ml时抑制率为39.90%,当用3.104μg/ml浓度处理hela细胞的抑制作用最强,抑制率为66.20%。4、利用本发明的植物内生菌发酵生产紫杉醇,可以不受资源、环境、条件、设备等的各种限制,短时间、大规模进行生产。附图说明图1为紫杉醇的化学结构式。图2为黄曲霉bp6t2的菌苔照片,菌落颜色呈草绿色,菌落质地为丝绒。图3为黄曲霉bp6t2的显微照片,分生孢子头呈疏松放射状,顶囊近球形,小梗单层双层同时存在。图4为紫杉醇标准品的高效液相色谱图,箭头所示峰为紫杉醇。图5为黄曲霉bp6t2代谢抽提物的高效液相色谱图,箭头所示峰为紫杉醇类似物。具体实施方式实施例1:巴山榧树植物内生菌的分离纯化1、巴山榧树材料的预处理于湖北省神农架国家地质森林公园采集巴山榧树的根、茎、叶、树皮,用无菌水冲洗后,吸水纸吸干;分别经75%(v/v)的酒精消毒5min和2%(v/v)次氯酸消毒8min,然后用无菌水冲洗再用无菌刀将采集到的根、茎和树皮切成约2-3cm小段,叶片从中间切出剖面。2、巴山榧树植物内生菌的分离取预处理的各部位的材料置于pda固体培养基平皿,在28℃培养;pda培养基:马铃薯200g,葡萄糖20g,kh2po41.0g,mgso4·7h2o0.5g,水1000ml,加琼脂(15g/l)为pda固体培养基。3、巴山榧树植物内生菌的纯化当平皿中接种物切面边缘长出细小菌丝时,用接种针挑取菌丝植入新配制pda固体平板上,在pda培养基上反复纯化,直至得到纯培养物。实施例2:内生真菌抑菌活性检测1、将供试细菌(金黄色葡萄球菌、大肠杆菌)用lb液体培养基活化后,分别涂布于lb固体培养基表面;2、切下实施例1获得的纯化植物内生菌琼脂培养基块,分别放置接种于金黄色葡萄球菌和大肠杆菌平皿中,37℃培养1-2天,观察琼脂块周围的抑菌圈。通过上述方法,筛选获得一株同时具有抗金黄色葡萄球菌(g+)和大肠杆菌(g-)活性的菌株,记为bp6t2。实施例3:内生真菌bp6t2的鉴定经过平皿培养特性观察,该菌株菌落颜色呈草绿色,菌落质地为丝绒(图2);显微镜下观察分生孢子头呈疏松放射状,顶囊近球形,小梗单层双层同时存在(图3),根据《中国真菌志第五卷曲霉属及其相关有性型》(齐祖同主编,中国真菌志(第五卷)曲霉属及其相关有性型[m].北京:科学出版社,1997,5~10.)可初步鉴定为黄曲霉(aspergillusflavus)bp6t2。实施例4:黄曲霉bp6t2发酵液中脂溶性物质的提取1、将实施例2获得的黄曲霉bp6t2于pda液体培养基中活化(活化条件:28℃,180rpm,培养5-7天)作为种子液;2、按照5%(v/v)的接种量接入pda液体培养基中,28℃,180rpm,培养7-10天;3、过滤收集滤液,滤液中加入1/3体积的乙酸乙酯,逆流萃取3次,收集上层有机相;4、有机相于旋转蒸发仪上35℃除去有机溶剂,用甲醇溶解粘在壁上的物质并挥发干燥,通过重量法测定发酵液脂溶性提取物含量;测定黄曲霉bp6t2发酵液中脂溶性提取物含量平均约为93mg/l。实施例5:高效液相色谱(hplc)定量检测黄曲霉bp6t2提取物紫杉醇类似物1、实施例4中获得的脂溶性提取物及流动相处理:将实施例4中获得的浓缩产物13200r/min离心2min,吸取上清液,经0.22μm孔径滤膜过滤除去杂质,然后同配好的流动相(甲醇/水=65/35,v/v)一起超声波排气,时间分别为3min、10~15min;2、色谱条件为:色谱柱,ods(c18)柱4.6×250mm,5nm;柱温,常温;样品及流动相,甲醇/水=65/35(v/v);流速,1.0ml/min;样品进样量,20μl;紫外检测波长,227nm;3、测得紫杉醇标准品(sigam)的rt(保留时间)为13~14min(图4);4、在实施例4制得的提取物样品中发现与紫杉醇标准品保留时间基本一致的成分,出峰时间为13.208min(图5),可初步鉴定为紫杉醇类似物;5、定量分析:使用hplc伍丰液相色谱工作站软件根据色谱图测算出黄曲霉bp6t2代谢抽提物中紫杉醇类似物的相对峰面积为2491.2(图5),相对百分含量平均约为8.4%。实施例6:液质联用仪(hplc-ms)确定黄曲霉bp6t2发酵液含有紫杉醇1、液相色谱仪器型号:岛津lc-30auplc(1)样品及流动相处理:将实施例4制备的脂溶性提取物,13200r/min离心2min,吸取上清液,经0.22μm孔径滤膜过滤除去杂质,然后同配好的流动相(乙腈/水=65/35,v/v)一起超声波排气,时间分别为3min、10~15min;(2)色谱条件为:色谱柱,ods(c18)柱4.6x250mm,5nm;柱温,常温;样品及流动相,甲醇/水=65/35(v/v);流速,1.0ml/min;样品进样量,20μl;紫外检测波长,227nm;2、质谱仪器型号为absciex4500qqq(三重四级杆液质联用仪)经过液质联用仪测定代谢抽提物中紫杉醇类似物的结构(表1),表明其母离子da为876.300,子离子da分别为307.900、591.200和531.200,源电压均为150,碰撞能分别为36、36和40,与紫杉烷类化合物紫杉醇标准品完全一致,可将黄曲霉bp6t2发酵液中紫杉醇类似物定性为紫杉醇。表1紫杉醇标准品与黄曲霉bp6t2发酵液中紫杉醇类似物的质谱分析参数q1mass(da)q3mass(da)dpcedwell(msec)876.300307.9001503650876.300591.2001503650876.300531.2001504050实施例7:黄曲霉bp6t2发酵液提取物对hela肿瘤细胞的抑制作用1、取对数生长期的hela细胞(华联科生物技术有限公司)铺板,将细胞按100μl/孔(1~5×103个细胞/孔)接种于96孔板中,置于37℃,5%co2培养箱中培养24h;2、将实施例4中含紫杉醇的黄曲霉bp6t2发酵液提取物配置不同浓度(表2),取10μl分别加入样品孔中,37℃,5%co2培养箱中培养24h;3、取出培养板,吸去上清,每孔加入90μl新鲜培养液(含有10%胎牛血清的dmem培养液)和cck-810μl,同样的条件下继续培养4h;4、用酶标仪在450nm处读取a450值,计算细胞生长抑制率,细胞生长抑制率计算:hela细胞抑制率(ir)=(对照孔a值—样品孔a值)/对照孔a值×100%。通过上述实验,证明黄曲霉bp6t2发酵液提取物对肿瘤细胞有明显的抑制作用(表2),且随着提取物的浓度的升高,对细胞增殖的抑制作用增强,其中以3.104μg/ml浓度处理的抑制作用最强,抑制率为66.20%。最低的浓度为0.0310μg/ml时,抑制率为39.90%,故推测黄曲霉bp6t2产生的抗hela细胞物质为紫杉醇。表2黄曲霉bp6t2发酵液提取物对hela细胞的抑制作用样品浓度(μg/ml)a450值抑制率(%)空白对照1.153----0.03100.69339.9%0.31040.61546.7%3.1040.3966.2%当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1