用于紫杉醇的药代动力学引导给药的监测血浆中的紫杉醇浓度的方法、装置和试剂与流程
本申请要求2014年4月4日提交的美国专利申请No.61/975,386和2014年9月17日提交的美国专利申请No.62/051,757的权益,每个申请明确地通过引用整体并入本文。
关于序列表的声明
与本申请相关联的序列表以文本格式代替纸质拷贝提供,并在此通过引用并入说明书中。包含序列表的文本文件的名称为53634_SEQ.txt。文本文件为11KB;创建于2015年4月6日;并通过EFS-Web与本说明书的提交一起提交。
发明背景
最初从太平洋紫杉树的树皮中分离的紫杉醇已被建立为用于一系列癌症类型(包括肺癌、卵巢癌和乳腺癌)的最有效的化疗药物之一。紫杉醇的主要限制是其低溶解度和需要配制在有毒有机溶剂(通常为聚氧乙烯化蓖麻油和脱水乙醇混合物(称为))中。为了防止溶剂毒性,已将紫杉醇与多种赋形剂一起配制以及使用可提高疏水性药物诸如紫杉醇的溶解度的纳米颗粒递送系统。
(紫杉醇白蛋白结合的纳米颗粒制剂)在2005年被FDA批准并且是目前用于化疗的紫杉醇的最佳制剂之一。其它系统已被研究用于递送紫杉醇或正在开发中,例如使用聚合物纳米颗粒、基于脂质的纳米颗粒制剂、聚合物缀合物、无机纳米颗粒、碳纳米管、纳米晶体或环糊精纳米颗粒(参见例如Ping Ma等,2013,J Nanomed.Nanotechnology:4:2)。
尽管是广泛使用的化疗剂并且实际适用于所有癌症类型,但是对的反应可低至20%。在一些患者中发现的对紫杉醇的相对不敏感性可能是低反应率的促成因素。然而,这种不敏感性可能不是低反应率的主要原因。当以各种批准的剂量(260mg/m2用于转移性乳腺癌,125mg/m2用于胰腺癌,和100mg/m2用于肺癌)给药时,在临床患者样品中监测的紫杉醇的血液浓度存在高达10倍的变化(Nyman DW等,2005,J Clin.Oncol.23,7785-93)。这种变化表明绝大多数患者可能被以太大浓度的紫杉醇施用而不正确地给药并必须取消治疗,或者施用的剂量太低从而不能从治疗提供益处。即使患者对紫杉醇敏感,药物水平不足也会使其无反应从而治疗无效。低剂量组是最脆弱的患者群体,因为难以确定他们是对紫杉醇不敏感还是没有施用足够的紫杉醇。完全药代动力学(PK)分析是在这种情况下的唯一方法来基于个体药代动力学变化提供适当药物剂量的指导。
目前没有可用的方法来进行紫杉醇的完全PK定量而无需让患者参加全面的临床测试(这需要住院)。这种PK测试的典型持续时间可以是48小时的时间过程并且包括重复抽血。目前,需要使用复杂的实验室设备来分析紫杉醇的血液浓度,包括液相色谱/质谱(LC/MS)方法。这些方法非常昂贵,目前超过120美元/样本,设备成本在每台仪器超过150K美元至200K美元的范围内。还已经证明,需要在48至72小时的时间段内收集最少四个数据点以充分表征每个特定患者的PK参数。让患者住院进行PK测试可以很容易地将每个患者的成本提高至大约10,000美元。用于证明PK引导给药的临床疗效的充分有力的III期临床试验将需要500名患者(250名患者用于BSA给药,250名患者用于PK引导给药)。单独的生物分析成本将为150万美元(500个点×6个周期的化疗×4个用于PK分析的血液采样×120美元/样品分析)。试验的其它组成部分对每名患者的费用大约为10万美元,总额为5000万美元。这代表了获得指导剂量调整以实现最佳的肿瘤反应和装置的监管批准所必需的有意义的临床数据的重要障碍。因此,分析和仪器的高成本对于针对具有相对窄的治疗范围的许多药物建立治疗药物监测(TDM)具有令人望而止步的后果。
因此,仍然需要一种简单、有效和廉价的方法来监测患者中紫杉醇的药代动力学,从而通过为给药策略的任何调整提供信息来适当地个性化对个体患者的治疗。本发明寻求满足这种需要并提供另外的相关优势。
发明概述
本发明提供了用于测定治疗剂的方法、装置和组合物。在一个方面,提供了用于测定紫杉醇的方法、装置和组合物。
在一个方面,本发明提供了用于测定液体样品中的紫杉醇的方法。在一个实施方案中,所述方法包括:
(a)将包含紫杉醇的液体样品施加到侧流测定装置,所述装置包含
(i)用于接收液体样品的样品接收区;
(ii)检测试剂区,其与所述样品接收区液体连通并且按流动方向位于所述样品接收区的下游,
其中所述检测试剂区包含沉积在其上的检测试剂,
其中所述检测试剂是用可检测的报告基团标记的结合紫杉醇的紫杉醇抗体或其片段或衍生物,并且
其中所述紫杉醇抗体或其片段或衍生物具有约104至约107的Kon和约10-3至约10-7的Koff;和
(iii)捕获区,其与所述检测试剂区液体连通,并按流动方向位于所述检测试剂区的下游,
其中所述捕获区包含固定在其上的第一和第二捕获试剂,
其中所述第一捕获试剂是能够结合所述检测试剂的紫杉醇材料(测试线),
其中所述第二捕获试剂是能够结合所述检测试剂的抗体(对照线),
其中所述第一捕获试剂按流动方向定位在所述捕获区的上游端的下游的第一距离处,
其中所述第二捕获试剂按流动方向定位在所述捕获区的上游端的下游的第二距离处,
其中所述第二距离大于所述第一距离,以及
其中当Kon大于约2.0×105且Koff小于约1.0×10-3时,第一距离与第二距离的比率为约0.0至约0.4,以及
其中当Kon大于约2.0×104且Koff小于约2.0×10-4时,第一距离与第二距离的比率为约0.2至约1.0;以及
(b)使样品从样品接收区流动通过检测试剂区以提供具有紫杉醇的检测试剂;
(c)使具有紫杉醇的检测试剂流过捕获区,
由此第一捕获试剂(测试线)与分析物(紫杉醇)竞争结合检测试剂,和
由此第二捕获试剂(对照线)结合过量的检测试剂;以及
(d)观察结合至第一捕获试剂(测试线)相对于第二捕获试剂(对照线)的检测试剂的量。
在某些实施方案中,所述方法还包括通过定量结合至第一捕获试剂的检测试剂的量来测定样品中紫杉醇的量。定量结合至第一捕获试剂的检测试剂的量可以包括光密度测量。
在一个实施方案中,紫杉醇抗体是3C6。在另一个实施方案中,紫杉醇抗体是8A10。在某些实施方案中,使用结合紫杉醇的两种紫杉醇抗体或其片段或衍生物(例如3C6和8A10)。
在该方法中,紫杉醇材料是与紫杉醇竞争结合检测试剂的紫杉醇抗原。在一个实施方案中,紫杉醇材料是紫杉醇蛋白质缀合物。
在本发明的方法中,样品接收区与第一捕获试剂之间的距离可改变,以优化紫杉醇检测灵敏度。在某些实施方案中,使样品接收区与第一捕获试剂之间的距离最小化,以优化紫杉醇检测灵敏度。
在某些实施方案中,所述方法还包括观察结合至第二捕获试剂(对照线)的过量检测试剂的量。在这些实施方案中,所述方法还可包括通过定量结合至第二捕获试剂的检测试剂的量来测定样品中紫杉醇的量。
为了增加灵敏度和动态范围,该方法可进一步包括在第一与第二捕获区之间的第三捕获区,其中第三捕获区包含能够结合检测试剂的紫杉醇材料。在这些实施方案中,可以通过定量结合至第三捕获试剂的检测试剂的量来测定紫杉醇的量。定量结合至第三捕获试剂的检测试剂的量可以包括光密度测量。
应当理解,本发明的方法适用于其它固相测定,包括例如表面等离子体共振(SPR)测定。
如上所述,在该方法中可以使用不止一种抗体、其片段或衍生物。在这些实施方案中,第一抗体可以具有相对高的Kon(例如大于1×104),并且第二抗体可以具有相对低的Koff(例如,小于1×10-3)。
此外,在某些实施方案中,捕获区可包括多个捕获位置(例如,两条或三条线,T1、T2、T3),以在相同样品上提供多个读数,从而允许增加的重现性和扩展的动态范围。
在另一个方面,本发明提供了用于治疗药物监测(TDM)引导的紫杉醇疗法的方法。在一个实施方案中,本发明提供了用于监测紫杉醇疗法在经诊断患有癌症的患者中的功效的方法,包括:
(a)在第一时间点用紫杉醇治疗癌症患者;
(b)在第一时间点测定患者中紫杉醇的第一浓度,其中测定浓度包括上述用于测定紫杉醇的方法;
(c)在第二时间点用紫杉醇治疗所述患者;
(d)在第二时间点测定患者中紫杉醇药物的第二浓度,其中测定浓度包括上述用于测定紫杉醇的方法;和
(e)比较患者中紫杉醇的第一和第二浓度以测定癌症治疗的功效。
在相关实施方案中,本发明提供了用于在经诊断患有癌症的患者中进行紫杉醇疗法的PK引导给药的方法,包括:
(a)在第一时间点用紫杉醇治疗癌症患者;
在第一时间点测定所述患者中紫杉醇的一个或多个药代动力学参数,其中测定所述一个或多个药代动力学参数包括上述用于测定紫杉醇的方法;
(b)使用来自第一次给药的PK信息在第二时间点用紫杉醇治疗所述患者;
(c)在第二时间点测定患者中紫杉醇的一个或多个药代动力学参数,其中测定所述一个或多个药代动力学参数包括上述用于测定紫杉醇的方法;和
(d)将所述受试者中的紫杉醇在第一时间点的一个或多个药代动力学参数与在第二时间点的水平进行比较,以确认实现了适当的给药。
在某些实施方案中,药代动力学参数选自达到最大浓度的时间(Tmax)、浓度最大值(Cmax)、曲线下面积(AUC)、清除率(CL)、分布体积(Vd)、在末期期间的表观分布体积(Vz)、在稳态期间的表观分布体积(Vss)及其组合。
在其它方面,本发明提供了类似于上文中针对紫杉醇所述的那些但可用于测定其它治疗剂的装置和方法。
在一个实施方案中,本发明提供了侧流装置,其包含:
(a)用于接收液体样品的样品接收区;
(b)检测试剂区,其与所述样品接收区液体连通并且按流动方向位于所述样品接收区的下游,
其中所述检测试剂区包含沉积在其上的一种或多种检测试剂;
(c)捕获区,其与所述检测试剂区液体连通,并且按流动方向位于所述检测试剂区的下游,
其中所述捕获区包含固定在其上的一种或多种捕获试剂;和
(d)吸收区,其与捕获区液体连通并按流动方向位于所述捕获试剂区的下游。
如上所述,在该方法中可以使用不止一种抗体、其片段或衍生物。在这些实施方案中,第一抗体可以具有相对高的Kon(例如,大于1×104),并且第二抗体可以具有相对低的Koff(例如,小于1×10-3)。在一个实施方案中,检测试剂包含对治疗药物具有第一亲和力的第一抗体和对治疗药物具有第二亲和力的第二抗体,其中第一亲和力大于第二亲和力。此外,在某些实施方案中,捕获区可包括多个捕获位置(例如,两条或三条线,T1、T2、T3),以在相同样品上提供多个读数,从而允许增加的重现性和扩展的动态范围。
在该方法中,检测试剂是用可检测报告基团标记的抗体,并且捕获试剂是与治疗药物竞争结合检测试剂的抗原,或捕获试剂是能够结合检测试剂的抗体。在某些实施方案中,捕获试剂包含第一捕获试剂和第二捕获试剂,所述第一捕获试剂是与治疗药物竞争结合检测试剂的抗原,所述第二捕获试剂是能够结合检测试剂的抗体。第一捕获试剂被固定在按流动方向第二捕获试剂的上游。可改变样品接收区与第一捕获试剂之间的距离,以优化治疗药物的检测。
在某些实施方案中,该装置还包括固定在第一与第二捕获试剂之间的第三捕获试剂。在该实施方案中,第三捕获试剂是与治疗药物竞争结合检测试剂的抗原。
在某些实施方案中,治疗剂是紫杉醇,并且检测试剂包含选自8A10和3C6的单克隆抗体或其片段或衍生物,其中抗体或片段或衍生物结合紫杉醇。
在另一个实施方案中,本发明提供了用于测定样品中的治疗药物的方法,其包括:
(a)将样品施加到上述装置的样品接收区;和
(b)观察结合至一种或多种固定的捕获试剂的检测试剂的量。
该方法还可包括通过定量结合至一种或多种固定的捕获试剂的检测试剂(例如,检测试剂结合至第一捕获位置中的捕获试剂,检测试剂结合至第二捕获位置中的捕获试剂,检测试剂结合至第一和第二捕获位置中的捕获试剂,检测试剂结合至第一、第二和第三捕获位置中的捕获试剂)的量来测定样品中的治疗药物的量。
在另外的实施方案中,提供了TDM引导的治疗方法。
在一个实施方案中,本发明提供了用于监测经诊断患有疾病或病症的患者中治疗性治疗的功效的方法,其包括:
(a)在第一时间点用治疗剂治疗患者;
(b)在第一时间点测定所述患者中治疗剂的第一浓度,其中测定浓度包括本文所述的方法;
(c)在第二时间点用所述治疗剂治疗所述患者;
(d)在第二时间点测定患者中治疗剂的第二浓度,其中测定浓度包括本文所述的方法;和
(e)比较患者中的第一与第二浓度以测定治疗性治疗的功效。
在另一个实施方案中,本发明提供了用于在经诊断患有疾病或病症的患者中进行治疗性治疗的PK-引导给药的方法,其包括:
(a)使用来自第一给药的PK信息在第一时间点用治疗剂治疗所述患者;
(b)在第一时间点测定所述患者中所述治疗剂的一个或多个药代动力学参数,其中测定一个或多个药代动力学参数包括根据本文所述的方法测定所述治疗剂;
(c)在第二时间点用所述治疗剂治疗所述患者;
(d)在第二时间点测定所述患者中所述治疗剂的一个或多个药代动力学参数,其中测定一个或多个药代动力学参数包括根据本文所述的方法测定所述治疗剂;和
(e)将受试者中所述治疗剂在第一时间点的一个或多个药代动力学参数与在第二时间点的水平进行比较,以确认实现了适当的给药。
在某些实施方案中,药代动力学参数是达到最大浓度的时间(Tmax)、浓度最大值(Cmax)、曲线下面积(AUC)、清除率(CL)、分布体积(Vd)、在末期期间的表观分布体积(Vz)、在稳态期间的表观分布体积(Vss)及其组合中的一个或多个。
上述方法适用于受益于治疗药物监测的疾病或病症治疗。代表性疾病或病症包括癌症、炎症、高血压、心血管病和疼痛。代表性治疗剂包括紫杉醇、多西他赛、7-表紫杉醇、t-乙酰基紫杉醇、10-去乙酰基紫杉醇、10-去乙酰基-7-表紫杉醇、7-木糖基紫杉醇、10-去乙酰基-7-戊二酰基紫杉醇、7-N,N-二甲基甘氨酰紫杉醇和7-L-丙氨酰紫杉醇。
在其它方面,本发明提供了紫杉醇抗体。在一个实施方案中,本发明提供了选自8A10和3C6的单克隆抗体或其片段或衍生物,其中所述抗体、抗体片段或抗体衍生物结合紫杉醇。在某些实施方案中,单克隆抗体、抗体片段或抗体衍生物包含一个或多个与SEQ ID NO:2、4、6或8中包含的CDR具有至少95%同源性的互补决定区(CDR)。
附图概述
当结合附图考虑时,本发明的前述方面和许多附带的优势将变得更容易理解,提供参考下文的详细描述也同样变得更好理解。
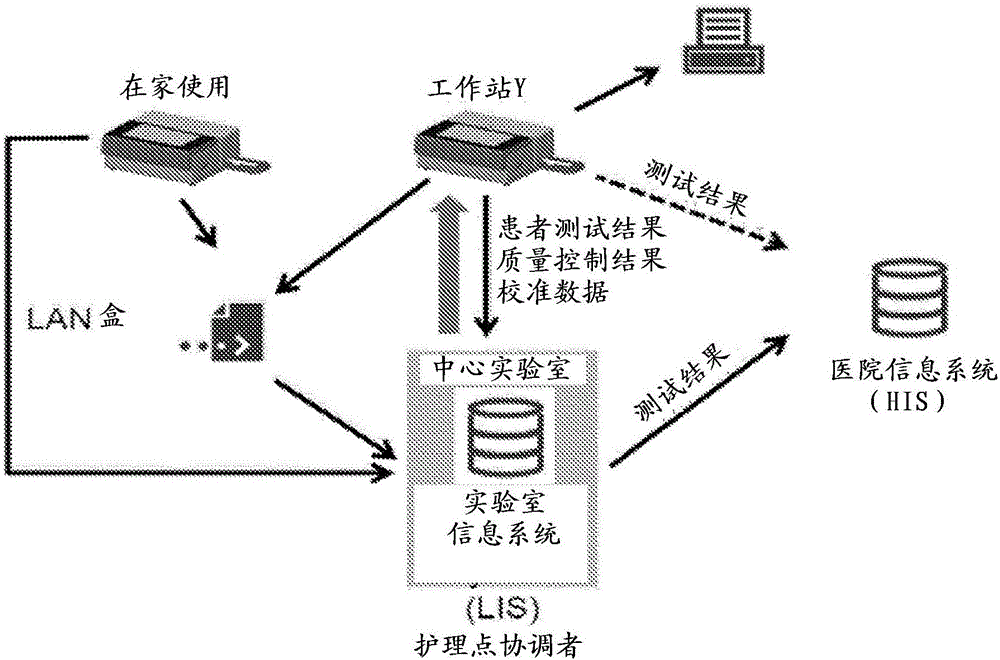
图1是使用本发明的代表性系统和方法的药代动力学引导给药概念和过程的示意图。
图2A是根据本发明的治疗药物监测装置的代表性工作流程的图示。
图2B是用于根据本发明的侧流免疫测定的代表性测试条的图示。
图2C是根据本发明的用于紫杉醇侧流免疫测定的代表性测试条的图示。
图3是经历根据本发明的测定条件的代表性测试条的图像,其中代表性分析物(紫杉醇)的量是变化的。在该测定配置中,测试条包括三个捕获区:测试线1和测试线2显示使用固定的抗原(呈固定的BSA-紫杉醇形式的紫杉醇)作为第一捕获材料的捕获;对照线显示使用固定的抗体(山羊抗小鼠抗体,GAM)作为第二捕获材料的捕获。在该测定中,检测试剂是用胶体金标记的抗紫杉醇抗体(8A10)。
图4是说明在ELISA上本发明的完整IgG(8A10和3C6)与BSA-紫杉醇抗原的直接结合的图。
图5A和5B显示了在使用如图2C中示意性说明和如实施例3中描述的装置进行的本发明的代表性侧流测定中在T1和T2线处结合的8A10的曲线。图5A显示了标准曲线,即测试线与对照线(T/C)的比率相对紫杉醇浓度。对于较低浓度,8A10在T1处的比率相对T2的大差异表明当被放置得更靠近样品端口时(其中分析物的浓度可能更高),该类抗体的灵敏度要高得多。图5B显示了如读取器装置提供的扫描的测试条的输出强度相对于位置读出。
图6A和6B显示了在使用如图2C中示意性说明和如实施例3中描述的装置进行的本发明的代表性侧流测定中在T1和T2线处结合的3C6的曲线。图6A示出了标准曲线,即测试线与对照线(T/C)的比率相对紫杉醇浓度。对于较低浓度,3C6在T1处的比率相对T2的相对小的差异表明对于将抗体放置得更靠近样品端口(其中分析物的浓度可能更高),会获得该类抗体的相对低的灵敏度改善。这类抗体的特征在于来自样品端口的与位置无关的信号。图6B显示了由读取器装置提供的扫描的测试条的输出强度相对于位置读出。
图7A和7B显示了在使用如图2C中示意性说明和如实施例3中描述的装置进行的本发明的代表性侧流测定中在T1和T2线处结合的组合的8A10和3C6的曲线。图7A显示了标准曲线,即测试线与对照线(T/C)的比率相对紫杉醇浓度。通过组合结合垫中的两类抗体(8A10和3C6)获得T1和T2的高灵敏度。这改善了测定的动态范围。图7B显示了由读取器装置提供的扫描的测试条的输出强度相对于位置读出。
发明详述
当今有许多治疗剂处于临床使用或开发中。困难不在于寻找治疗药物,而是在定制治疗以适合患者。不考虑药代动力学(PK)可变性的个体化医疗将导致一些患者的错误分类,这是由于太多的药物暴露在假设的敏感群体中的可从较低量的施用药物或过少的药物暴露受益的患者中导致毒性。具有治疗药物监测(TDM)的个性化医疗消除了PK可变性,并允许根据患者的生物标志物对他们进行正确分类。
本发明提供了用于治疗药物的药物动力学(PK)-引导给药的护理点(point-of-care,POC)治疗药物监测(TDM)方法、装置和相关组合物。
图1显示了具有医院信息系统和/或实验室信息系统并使得能够将数据传送给医生,最终支持药物剂量决定的装置的系统特性、优势和潜在连接性。本发明的方法和装置通过在24至48小时的时间内采集手指刺血样品收集患者的治疗药物(例如,紫杉醇)PK数据,并且PK数据由医生访问,所述医生可以分析数据并确定是否应该修改治疗药物剂量。
在一个方面,本发明提供了用于一般性的免疫测定的方法和装置,以及特别地用于紫杉醇的免疫测定的方法和装置。一些时候,生物样品中低水平的紫杉醇表明需要向受试者增加紫杉醇的剂量,并且生物样品中高水平的紫杉醇表明需要降低给予受试者的紫杉醇的剂量。本发明的方法和装置提供了可用于调整受试者的治疗方案的信息。
在用于检测和监测紫杉醇的组合物、方法和装置的上下文中描述了本文提供的测定方法和装置。然而,应当理解,所述组合物、方法和装置的形式不限于此,并且容易更广泛地应用于监测所选择的任何分析物。
代表性测定方法和装置
本发明提供了用于检测或定量样品中的分析物(例如,紫杉醇)的测定方法和装置。
所述方法和装置可用于测定生物样品,诸如从已接受治疗剂(例如,紫杉醇)以治疗病症的受试者(患者)获得的样品。在测定中使用的样品最终是液体样品(例如,血液、血浆、尿)。
本发明的方法是固相测定,因此适合于适应其它固相测定配置。为了举例说明本发明,使用侧流测定配置描述所述方法和装置。应当理解,本领域已知的其它固相测定可以根据本发明的方法和装置进行配置。
可根据本发明使用侧流测定方法和装置。取决于侧流测定方法和装置的形式,可将测定试剂布置在某些配置中。在这样的实施方案中,一种试剂将充当“检测试剂”,另一种试剂将充当“捕获试剂”。在该形式中,检测试剂通常在样品端口与沉积捕获试剂的位置之间的位置处沉积在结合垫上。检测试剂通常包含可检测标记,而捕获试剂被固定在其在垫上的位置。因此,在操作期间,引入样品端口中的液体样品可沿着垫流动。样品将首先与检测试剂接触,然后随后流过捕获试剂。
在图2A中显示了用于根据本发明进行侧流测定的代表性装置。参考图2A,装置100是盒,其包括具有样品端口120、读取窗口130和测试条200(参见图2B)的壳体110。在操作中,待分析的液体样品通过端口120被引入至测试条,并且如由流动方向所指示的沿着测试条流动(从样品垫210至吸收垫240)。测试结果可通过经由读取窗口130观察测试条来查看。
测试条包括用于进行测定的几个区域和试剂。参考图2A和2B,代表性测试条200包括样品垫210、结合垫220、膜230和吸收垫240。样品垫210、缀合物垫220、膜230和吸收垫240处于液体连通,以使得被引入至样品垫的液体样品流过或穿过结合垫和膜到达吸收垫。可以改变测试条组件的尺寸和构造以适合待执行的特定测定。例如,组件垫和膜中的一个或多个可以重叠以促进从一个组件至下一个组件的最佳流动(样品垫210可与结合垫220重叠,结合垫220可与膜230重叠,膜230可与吸收垫240重叠,如图2A所示)。测试带区域的性质不是特别关键的,并且这些组件的材料是本领域已知的。
代表性装置的操作描述如下。样品垫210接收待测试的液体样品。样品从样品垫流至结合垫220。
结合垫220包括一种或多种检测试剂(例如,对待测定的样品中的分析物具有亲和力并且被标记以便于在测定中检测抗体的抗体)。
在某些实施方案中,将单一检测试剂沉积在结合垫上。在其它实施方案中,将两种或更多种检测试剂(例如,两种不同的抗体,诸如对待测定的分析物具有不同亲和力、不同Kon速率和/或不同Koff速率的第一和第二抗体)沉积在结合垫上。第一和第二亲和力不相同。在一个实施方案中,第一Kon大于第二Kon。在另一个实施方案中,第二Koff大于第一Koff。在下文中在紫杉醇测定的上下文中描述的抗体亲和力、Kon和Koff速率的描述和说明可适用于一般性的治疗剂测定。沉积的第一和第二抗体的量可以变化并且不必相同。
沉积在结合垫220上的检测试剂通过液体样品移动并与样品一起流至膜230。当分析物存在于样品中时,一旦样品接触检测试剂,分析物与检测试剂之间的结合开始发生。检测试剂的捕获发生在膜230上,其中一些检测试剂可包括结合的分析物,并且其中一些检测试剂可不包括结合的分析物。
膜230包括至少两个捕获区:用于捕获不包括结合的分析物的检测试剂的第一捕获区(测试线)(参见图2A、2B和2C中的232)和用于捕获包括结合的分析物的过量检测试剂的第二捕获区(对照线)(参见图2A、2B和2C中的238)。第一捕获区包括有效捕获不包括结合的分析物的检测试剂(即,游离检测试剂)的第一捕获材料(例如,固定的抗原)。第二捕获区包括有效捕获具有或不具有结合的分析物的检测试剂的第二捕获材料(例如,固定的抗体)。分别由第一和第二捕获材料捕获的检测试剂的量将取决于样品中存在的分析物的量。上述测定是竞争性测定,其中分析物和第一捕获材料竞争与检测试剂的亲和力结合。样品中存在的分析物的量越大,由第一捕获材料捕获的检测试剂的量越小。由于捕获材料的耗尽,样品中存在的分析物的量越少,由第一捕获材料捕获的检测试剂越多,因此可由第二捕获材料捕获的可检测试剂越少。第一和第二捕获线的强度比给出了用于分析物定量的最佳值。
在某些实施方案中,捕获区包括用于捕获不包括结合的分析物的检测试剂的两个或更多个第一捕获区(例如,图2B和2C中的232和234)。在某些实施方案中,捕获区包括用于捕获检测试剂的两个或更多个第二捕获区(例如,图2B中的236和238)。
侧流盒的所示方法可利用任何兼容的读取器,其具有用于检测来自流动盒的信号的适当灵敏度以及校准和量化这样的信号的能力。任何读取器的有益特征可包括易于使用的特征,包括触摸屏、集成RFID或集成条形码读取器,以及容易将结果输出至诸如存储卡或USB棒的能力。读取器优选具有便于语言选择中的接口的预装软件。读取器优选具有高存储容量以便于存储多个(诸如>1000个)结果并且可储存>100个不同的测试方法方案。读取器可包含连接性以便于将其集成至更大的系统中,诸如通过LAN或WLAN连接性至LIS或基于云的数据存储和管理系统。最后,多个USB端口对于额外的连接能力(诸如以便于连接至外部打印机等)是期望的。
代表性读取器是Qiagen's Reader ESEQuantLFR(可从Qiagen,Germany商购获得),其已被证明是用于包含本文所述的侧流盒的相容的有效读取器。该读取器是一种小型便携式装置,内置可充电电池,从而可允许其在现场操作,满足护理点(POC)装置的要求。使用嵌入读取器中的共焦照相机系统扫描侧流盒。板载图像分析系统与侧流盒的条形码读取器是完全功能性的,以使得可轻松地将分析方法上传至装置。
检测试剂。在某些实施方案中,检测试剂是如本文所述的至少一种抗体、抗体片段或抗体衍生物。检测试剂能够结合样品中的分析物(例如,紫杉醇),并且当检测试剂不结合样品中的紫杉醇时,检测试剂结合至捕获试剂。
检测试剂包括可提供能够可靠定量的可检测信号的部分或标记。合适的部分包括在免疫测定领域中已知的提供比色、荧光、化学发光、酶或放射性信号的那些部分。代表性部分包括提供为可视的,并且可以不需要仪器来读取(例如,产生有色部分或酶促的有色部分或酶)的可检测信号的那些部分。通常通过对可检测信号的仪器分析来实现定量。在一个实施方案中,检测试剂是用胶体金标记的抗体,其可以用肉眼观察。
金胶体从具有单分散性质的氯化金的还原产生,其具有受控且均匀的直径,例如40nm单分散胶体。抗体通过被动吸收与胶体金结合。
如上所述,在优选的实施方案中,使用多种(即,不止一种类型)抗体、抗体片段或抗体衍生物。在一些实施方案中,将多种(不同)抗体、抗体片段或抗体衍生物组合并沉积在测试条(即,结合垫)上的相同位置。
本文描述了两种不同的抗紫杉醇抗体3C6和8A10。3C6抗体对紫杉醇具有高度特异性,而8A10抗体对紫杉醇的特异性较低并且通常对紫杉烷类具有更广泛的亲和力。虽然两种抗体在常规竞争性ELISA中表现相似,但令人惊讶地发现,在固相侧流测定中,由8A10提供的信号通过将第一捕获试剂(例如,T1位置)移动更靠近样品端口而得到改善,相比之下,3C6独立于位置(T1或T2)。靠近样品施加的T1暴露于较高浓度的分析物,而距离样品施加更远的T2暴露于较低浓度的分析物。这是令人惊讶的发现,即捕获线的最佳放置与该方法中使用的抗体的Kon和Koff值相关。3C6的可用性允许构建多线装置,其中将高Kon抗体(例如8A10)尽可能地接近样品起点沉积,并沿着垫沉积低Koff抗体(例如3C6)以提供第二/第三/第四等读出。
因此,可对侧流盒装置进行各种修改以促进或赋予各种检测特性。例如,为了扩展装置的动态范围,使用多种亲和抗体的多测试线(T1、T2等),可扩展测定的动态范围和/或重现性。在下文中于代表性紫杉醇测定的上下文中描述的测试条上定位捕获试剂(T/C)的描述和说明通常适用于在本发明的测定中的捕获试剂的定位。
在实施例1中描述了可用于本发明的测定中的代表性检测试剂(例如,紫杉醇抗体-胶体金缀合物)的制备。
捕获试剂。捕获试剂用于捕获检测试剂,从而允许在测定中观察和定量可检测的信号。如上所述,测定方法和装置包括分别固定在第一和第二捕获区的第一和第二捕获材料。
在一个实施方案中,捕获试剂是固定的分析物(例如,紫杉醇复合物),其在检测试剂是抗体时为捕获不包括结合的分析物的检测试剂的固定的抗原。固定的分析物可被直接固定至测试条。或者,固定的分析物可通过接头或载体材料固定(例如,与载体蛋白,诸如白蛋白结合的分析物)。在这样的实施方案中,捕获试剂是如上所述的第一捕获材料。
在一个实施方案中,捕获试剂是捕获具有或不具有结合的分析物的检测试剂的固定的抗体。在其中检测试剂是小鼠单克隆抗体的实施方案中,捕获试剂是抗小鼠抗体(例如,山羊抗小鼠抗体,GAM抗体)。在这样的实施方案中,捕获试剂是如上所述的第二捕获材料。
可用于本发明测定中的代表性捕获试剂(例如,BSA-紫杉醇)的制备描述于实施例1中。
替代测定配置。本文所述的本发明的侧流测定法是固相免疫测定法。应当理解,可使测定和装置的形式从上述形式倒转过来,以使得检测试剂是标记的抗原(例如,具有可检测标记的BSA-紫杉醇),并且捕获试剂是一种或多种抗体、抗体片段或抗体衍生物(即固定在捕获区中)。在这种形式的操作中,样品流动通过/穿过沉积的标记抗原,并随后接触固定的抗体、抗体片段或抗体衍生物。此时,样品中最初存在的游离分析物(例如,紫杉醇)与标记的抗原竞争结合固定的抗体、抗体片段或抗体衍生物。如上所述,装置可以包括固定在相同或不同位置的多种不同的抗体、抗体片段或抗体衍生物。捕获试剂可以在相同或不同的位置。在其中测试条具有其中固定捕获试剂的多个位置的所有实施方案中,使用可检测那些位置中的信号的适当读取器。
应当注意,本发明的装置、系统、组合物和方法一般根据侧流测定描述。然而,如本文所述,用于监测选择的抗原的一般策略不必限于侧流测定形式,而是可应用于其它测定形式,诸如其它固相免疫测定(表面等离子体共振测定),其在本领域中通常是公知的。因此,尽管描述介绍侧流格式,但本公开内容还包括结合任何已知测定形式的装置、系统、组合物和方法。在一些实施方案中,测定形式包括在基底上固定捕获试剂,诸如抗原缀合物(例如,紫杉醇缀合物)或抗原结合试剂(例如,抗紫杉醇抗体、片段、衍生物)。基底可以是用于测定形式的任何已知的合适基底,诸如硝化纤维素或玻璃。在一些实施方案中,基底是纳米结构。在一些实施方案中,基底可包含可将捕获试剂固定至其的碳纳米结构(诸如碳纳米管)或由其组成。
代表性紫杉醇测定。图2C是用于根据本发明的紫杉醇侧流免疫测定的代表性测试条的图示。参考图2C,代表性测试条200包括样品垫210、结合垫220、具有第一捕获区232和234(T1和T2)以及第二捕获区238(C)的膜230,和吸收垫240。如上关于图2A和2B所述,样品垫210、结合垫220、膜230和吸收垫240处于液体连通,以使得引入至样品垫的液体样品流过或穿过结合垫和膜到达吸收垫;可改变测试条组件的尺寸和构造以适合待进行的紫杉醇测定(例如,组件垫和膜中的一个或多个可以重叠以促进从一个组件至下一个组件的最佳流动,如图2A所示)。
在一个实施方案中,本发明提供了用于测定液体样品中的紫杉醇的方法,其包括:
(a)将包含紫杉醇的液体样品施加至侧流测定装置,所述装置具有
(i)用于接收液体样品的样品接收区;
(ii)检测试剂区,其与所述样品接收区液体连通并且按流动方向位于所述样品接收区的下游,
其中所述检测试剂区包含沉积在其上的检测试剂,
其中所述检测试剂是用可检测的报道基团标记的结合紫杉醇的紫杉醇抗体或其片段或衍生物;和
(iii)捕获区,其与所述检测试剂区液体连通,并且按流动方向位于所述检测试剂区的下游,
其中所述捕获区包含固定在其上的第一和第二捕获试剂,所述第一捕获试剂按流动方向位于所述第二捕获试剂的上游,
其中所述第一捕获试剂是能够结合所述检测试剂的紫杉醇材料,并且
其中所述第二捕获试剂是能够结合所述检测试剂的抗体;
(b)使样品从样品接收区流过检测试剂区以提供具有紫杉醇的检测试剂(例如,检测剂与结合的紫杉醇、任选游离的检测试剂和任选游离的紫杉醇的组合);
(c)使具有紫杉醇的检测试剂流过捕获区,
由此所述第一捕获试剂结合游离检测试剂以提供结合至所述第一捕获试剂的检测试剂,以及
由此所述第二捕获试剂结合具有或不具有结合的紫杉醇的检测试剂;以及
(d)观察结合至第一捕获试剂相对于第二捕获试剂的检测试剂的量。
在某些实施方案中,所述方法还包括通过定量结合至第一捕获试剂的检测试剂的量来测定样品中紫杉醇的量。定量结合至第一捕获试剂的检测试剂的量包括光密度测量等。
合适的可检测报告基团如上所述。在一个实施方案中,可检测的报告基团是胶体金。
可用于本发明方法的紫杉醇抗体或其片段或衍生物具有大于约1X104的Kon。代表性Kon值为大于约2X104、4X104、8X104、1X105、1X106和1X107。优选范围为约1X104至约1X107。
可用于本发明方法的紫杉醇抗体或其片段或衍生物具有小于约1X10-3的Koff。代表性Koff值为小于约1X10-3、1X10-4、1X10-5和1X10-7。优选的Koff值为约1X10-3至1X10-7。
在某些实施方案中,紫杉醇抗体或其片段或衍生物具有约1X104至约1X106的Kon和约1X10-3至约1X10-4的Koff。
用于测定Kon值和Koff值的方法在实施例4中进行了描述。
在一个实施方案中,抗体具有高的Kon和低的Koff(例如,最小Kon为2.0X105,最大Koff为1.0X10-3)。在该实施方案中,捕获线位于0.0至0.4T/C。对于此类别,单克隆抗体工程化将集中于保持Koff恒定,同时尽可能多地增加Kon。Kon越大,抗体检测越好。
在另一个实施方案中,抗体具有低Kon和高Koff(例如,最小Kon为2.0X104且最大Koff为2.0X10-4)。在该实施方案中,捕获线位于0.2-1.0T/C。对于此类别,单克隆抗体工程化将集中于保持Kon恒定,同时尽可能多地降低Koff。解离速率越低,检测抗体越好。
在某些实施方案中,紫杉醇抗体是3C6。在其它实施方案中,紫杉醇抗体是8A10。在另外的实施方案中,可使用紫杉醇抗体的组合(例如,3C6和8A10)。这些抗体在下面进行了详细描述。
在测定中,第一捕获区包括固定的紫杉醇材料,其用作与紫杉醇竞争结合检测试剂的紫杉醇抗原。第一捕获区捕获不包括结合的紫杉醇的检测试剂(即,游离检测试剂)。在某些实施方案中,紫杉醇材料是紫杉醇蛋白质缀合物。合适的蛋白质缀合物包括血清白蛋白缀合物,诸如BSA-紫杉醇。
在测定中,第二捕获区包括能够结合检测试剂的固定的抗体。在某些实施方案中,抗体是山羊抗小鼠抗体。
如上所述,可以通过改变在将样品引入侧流装置(例如,样品接收区)的点与第一捕获试剂之间的距离来优化测定中的紫杉醇检测灵敏度。在某些实施方案中,将样品接收区与第一捕获试剂之间的距离最小化,以优化紫杉醇检测灵敏度。在某些实施例中,距离小于20mm,小于10mm,小于5mm,小于3mm,小于2mm或小于1mm。在某些实施方案中,距离为20至1mm,10至1mm,5至1mm,3至1mm或2至1mm。
优化可以被描述为T(测试线)和C(对照线)的相对定位:T/C,其被定义为从起始点到T的距离/从起始点到C的距离的比,其中起始点被定义为捕获区的上游边缘(图2A-2C中膜230的上游边缘)。T/C可以大于约0.0(即,第一捕获试剂位于捕获区的上游边缘),或约0.01、约0.02、约0.04、约0.08、约0.10、约0.20、约0.40、约0.80,或小于约1.0(即,第一捕获试剂位于捕获区的下游边缘,第二捕获试剂位于第一捕获试剂与捕获区的下游边缘之间)。优选地,T/C为约0.2至约0.7。
在某些实施方案中,第一距离与第二距离的比率为约0.0至约0.40。在其它实施方案中,第一距离与第二距离的比率为约0.20至约1.0。
在某些实施方案中,观察并测量与第二捕获试剂结合的过量检测试剂的量。在某些实施方案中,通过使最终捕获试剂(测试线)与第二捕获试剂(对照线)相关来测定样品中的紫杉醇的量。
如上所述,本发明的代表性测定法包括在不止一个第一捕获区中的不止一种第一捕获试剂。在这些实施方案的某些实施方案中,该方法还包括在第一(T1,图2C中的232)与第二(C,图2C中的238)捕获区之间的第三捕获区(参见T2,图2C中的234),其中所述第三捕获区包含能够结合检测试剂的紫杉醇材料。第一和第三区中的紫杉醇材料可以相同或不同。在这些实施方案的某些实施方案中,样品中紫杉醇的量通过定量结合至第一和第二捕获试剂的检测试剂的量来测定。定量结合至第一和第二捕获试剂的检测试剂的量可以包括光密度测量。
在该方法的某些实施方案中,侧流装置还包含与捕获试剂区液体连通并且按流动方向位于捕获试剂区下游的吸收区。
图3是经历其中代表性分析物(紫杉醇)的量是变化的测定条件的代表性测试条的图像。在这些测定配置中,膜230包括三个捕获区:测试线1和测试线2显示使用固定的抗原(呈固定的BSA-紫杉醇形式的紫杉醇)作为第一捕获材料的捕获;对照线显示使用固定的抗体(山羊抗小鼠抗体)作为第二捕获材料的捕获。在该测定中,检测试剂是用胶体金标记的抗紫杉醇抗体(8A10)。
应注意,本发明的方法和装置可用于检测生物样品中紫杉醇的水平,包括紫杉醇前药或紫杉醇的任何制剂。紫杉醇的制剂包括任何已知的促进紫杉醇递送的试剂,诸如聚合物纳米颗粒、基于脂质的纳米颗粒制剂、聚合物缀合物、无机纳米颗粒、碳纳米管、纳米晶体和环糊精纳米颗粒。
根据本发明的方法和装置的代表性侧流免疫测定的描述在实施例3中进行了描述。
紫杉醇抗体
在另一个方面,本发明提供了结合紫杉醇的抗体(例如,单克隆抗体或mAb)。使用MabSelect(GE Healthcare,Pittsburgh,PA)从富含抗体的收获培养基中纯化被称为8A10和3C6的mAb。基于它们与BSA-紫杉醇的结合来选择mAb,所述BSA-紫杉醇是如J-G Leu等,Cancer Res.(1993)53:1388-1391中所述制备的。
在一个方面,本发明提供了选自8A10、3C6的单克隆抗体及其片段或衍生物,其中所述抗体、抗体片段或抗体衍生物结合紫杉醇。
如本文所用,术语“抗体”包括来源于任何产生抗体的哺乳动物(例如,小鼠、大鼠、兔、骆驼和灵长类动物,包括人)或者合成或重组产生的抗体及其抗体片段,其特异性结合目标靶标(例如,紫杉醇)或其部分。示例性抗体包括多克隆、单克隆和重组抗体;多特异性抗体(例如,双特异性抗体);人源化抗体;鼠抗体;嵌合的小鼠-人、小鼠-灵长类动物、灵长类动物-人单克隆抗体;和抗独特型抗体,并且可以是任何完整分子或其片段,诸如抗原结合片段。如本文所述,单克隆抗体是优选的,因为它们提供了选择的抗原(诸如治疗药物(例如,紫杉醇))的结合的增加的特异性。
如本文所用,术语“抗原结合片段”是指来自全长抗体或与全长抗体相关的抗原结合或可变区。抗体片段的举例说明性实例包括Fab、Fab'、F(ab)2、F(ab')2和Fv片段、scFv片段、双抗体、纳米抗体、线性抗体、单链抗体分子和由抗体片段形成的多特异性抗体。
如本文所用,“单链Fv”或“scFv”抗体片段包含抗体的VH和VL结构域,其中这些结构域存在于单条多肽链中。通常,Fv多肽还包含在VH与VL结构域之间的多肽接头,其使scFv能够形成抗原结合所需的结构。
如本文所用,“嵌合抗体”是重组蛋白,其含有来源于非人物种(例如,啮齿类动物)抗体的可变结构域和互补决定区,而抗体分子的其余部分来源于人抗体。
如本文所用,“人源化抗体”是包含符合来源于被移植至人抗体框架中的非人免疫球蛋白的特异性互补决定区的最小序列的嵌合抗体。人源化抗体通常是重组蛋白,其中只有抗体互补决定区是非人来源的。
如本文所用,术语“衍生物”表示已从参照抗体产生的抗体或抗体片段。例如,有时需要修饰或增强参照抗体的结合特性。因此,可对抗体进行各种修饰,包括对编码DNA进行突变,以改变结合性质。所得的具有改变的性质的抗体然后被称为参照抗体的“衍生物”。例如,抗体衍生物可以是包含由施加于参照抗体(或编码参照抗体的核酸)的亲和力成熟过程产生的突变的抗体。此类突变可导致具有改变的(例如,改善的)结合亲和力、选择性等的抗体。
在一些实施方案中,抗体、抗体片段或抗体衍生物包含一个或多个与SEQ ID NO:2、4、6或8中包含的CDR具有至少95%同源性的互补决定区(CDR)。下面更详细地描述的SEQ ID NO:2和4分别是8A10轻链和重链的可变区的氨基酸序列。也在下文更详细描述的SEQ ID NO:6和8分别是3C6轻链和重链的可变区的氨基酸序列。每个可变区含有三个互补决定区(CDR),如下所示。在一些实施方案中,抗体、抗体片段或抗体衍生物包含与SEQ ID NO:2、4、6或8的任一个包含的1个、2个或所有3个CDR具有至少95%同源性的1个、2或所有3个互补决定区(CDR)。在一些实施方案中,抗体、抗体片段或抗体衍生物具有重链和轻链,其包含1个、2个、3个、4个、5个或所有6个由8A10可变轻链和重链区提供的CDR区(SEQ ID NO:2和4中的)。在一些实施方案中,抗体、抗体片段或抗体衍生物具有重链和轻链,其包含1个、2个、3个、4个、5个或所有6个由3C6可变轻链和重链区提供的CDR区(SEQ ID NO:6和8中的)。
在一些实施方案中,所述一个或多个CDR与SEQ ID NO:2、4、6或8的任一个中的一个或多个CDR具有至少95%、96%、97%、98%、99%或100%序列同一性。如本文所用,术语“百分比同源性”或“百分比同源的”,当与本发明实践中使用的多肽结合使用时,被定义为在对齐序列以获得最大百分比同源性后多肽序列中与指定的多肽的氨基酸序列同源的氨基酸残基的百分比。当进行比较时,没有缺口被引入生物标志物序列以实现最佳比对。氨基酸序列同源性可以例如以下列方式来测定。多肽的氨基酸序列被用于使用BLASTP程序来搜索蛋白质序列数据库,诸如GenBank数据库。在无缺口模式下使用程序。默认滤过用于去除由于低复杂度的区域而导致的序列同源性。使用BLASTP的默认参数。
可用于本发明的测定方法的代表性紫杉醇抗体(3C6和8A10)的生产、加工、纯化、表征和优化描述于实施例2中。本发明的抗体通过用缀合于KLH的浆果赤霉素或免疫小鼠来产生。抗体概括为:3C6抗-IgG2a,k、3H5抗浆果赤霉素III IgG1、8A10抗紫杉烷IgG2a。3C6、3H5和8A10抗体的交叉反应性特征通过其针对表1中各种紫杉烷的IC50值来显示。
表1.紫杉醇抗体的交叉反应性
为了有效地利用抗体在诊断应用中实现动态检测范围,需要被成功优化的两个关键因素是抗体对靶向抗原的特异性和亲和力。3C6和8A10单克隆抗体对紫杉醇具有高特异性和亲和力,这表明这些抗体以高度均一的方式特异性结合靶向紫杉醇抗原的单个表位。这种特异性还有助于消除检测测定中的交叉反应性问题。结合特异性,单克隆抗体还可具有针对抗原的优化的和改善的亲和力,以便在诊断测试中实现动态检测范围,这可通过亲和力成熟的过程实现。另外,可针对快速Kon选择mAb以与快速流动测定相容。
如图4所示,3C6和8A10单克隆抗体都具有约10nM的表观Kd值,灵敏度极限为约100-200ng/mL。
以下实施例被提供来用于说明目的而不是限制本发明。
实施例1
测定试剂
在本实施例中,描述了在本发明的测定方法和装置中有用的代表性检测试剂和捕获试剂的制备。
检测试剂:抗体-胶体金缀合物。简言之,将抗体(参见实施例2)在0.5X PBS中稀释至1mg/mL,并采取以下步骤:(1)摇动或涡旋金以重悬任何沉淀的金,然后将0.5mL裸金溶胶置入10个清洁的个体试管;(2)每个管用来自提供的pH图的pH值(或1至10)标记;(3)将pH图用于向每个试管中添加不同量的缓冲液(以微升表示),并摇动混合;(4)将每个试管置于低速涡旋混合器上并添加抗体溶液,随后充分混合(约2至3秒),对于20nm金,14μL的2mg/mL抗体或蛋白质溶液是最佳的;(5)一些管上的深紫色和/或黑色沉淀表明抗体或蛋白质低于其等电点,导致个体金溶液的交联(不能用于免疫测定的交联的溶液被丢弃;深紫色溶液大部分也是无活性的;只有具有浅紫色或无颜色变化的管可用于免疫测定);(6)使反应持续总共30分钟;和(7)通过加入50μL封闭液停止反应。
捕获试剂:紫杉醇-白蛋白缀合物。通常按照J-G Leu等,Cancer Res.(1993)53:1388-1391中所述,制备紫杉醇-白蛋白缀合物(例如,BSA-紫杉醇)。对于2'-半琥珀酰基紫杉醇的合成,晶体是用于将紫杉醇与载体蛋白缀合的起始材料。在室温下将紫杉醇(20mg)和琥珀酸酐(36mg)在真空下于P2O5上干燥4小时,并溶于480μL无水吡啶中。在室温下静置过夜后,在真空下除去吡啶,残余物用2mL蒸馏水洗涤一次。加入丙酮(1mL),并将蒸馏水滴加至丙酮溶液中,直至出现少量晶体(2'-半琥珀酰基紫杉醇)。将混合物在4℃下保持3小时,通过过滤回收晶体并在真空下干燥。产物收率为70%。
透析步骤除去任何未缀合的紫杉醇。将2'-半琥珀酰基紫杉醇(10mg)溶解在1mL DMSO和300μL乙腈中,然后添加50μL(35mg;0.19mmol)正-三丁胺。将混合物在冰浴中冷却至4℃,向混合物中添加25μL(25mg;0.18mmol)氯甲酸异丁酯,将其在冰上保持30分钟。将溶液滴加至BSA溶液[25mg,(3.73x10-4mmol)于3mL蒸馏水中,pH 9.5,在4℃下]中。用1N HCl将pH立即调节至7.5,并将混合物在4℃保持过夜,在4℃下用PBS透析过夜。
在一个示例性实施方案中,评估侧流系统。将0.5mg/mL BSA-紫杉醇(测试线)和0.5mg/mL山羊抗小鼠抗体(对照线)条纹式印制至系统的膜上。使紫杉醇抗体-胶体金缀合物流过系统。抗体-胶体金缀合物结合至固定在膜上的BSA-紫杉醇并产生强信号。该信号是紫杉醇特异性的,因为当将紫杉醇添加至样品中加标时观察到信号减小。
实施例2
紫杉醇抗体
在本实施例中,描述了在本发明的方法和装置中有用的代表性紫杉醇抗体的生产、加工、纯化、表征和优化。
抗体生产和加工。将细胞在含有5-10%FBS和1X Pen/Strep的CCM1(Hyclone)中生长。一旦细胞达到>1×106个细胞/mL的密度,就将细胞分开(1:4)。然后将细胞冷冻并储存在2个单独的液氮冷冻槽中作为备份。将细胞在滚瓶中培养直至达到1×106个细胞/mL的密度。在该时刻,不再喂养培养物,每天监测细胞活力。一旦细胞活力降低至<50%,则除去细胞并收获富含抗体的培养基。
抗体的亲和纯化。使用PBS,pH 7.4进行透滤,并使用50Kd截留膜将收获的抗体浓缩10倍。MabSelect(GE Healthcare,Pittsburgh,PA)用于亲和纯化。针对容量和通量以及rProtein A配体的定向偶联优化的亲水性高流量琼脂糖珠递送了高纯度和高产率的产物库。
纯化运行程序。
柱:XK 16/40(16mm i.d.,20cm床高)。
样品:澄清的杂交瘤消耗的培养基。
上样缓冲液A:20mM NaH2PO4,0.15M NaCl,pH7.2。
洗脱缓冲液B:0.1M柠檬酸三钠,pH 3.6。
抗体亲和力。完整IgG(8A10和3C6)与BSA-紫杉醇抗原的直接结合的结果的图显示于图4中。将50μL在1x PBS中浓度为3.5μg/mL的BSA-紫杉醇抗原结合至板并在4℃下孵育过夜。用PBS/0.05%Tween 20洗涤板四次。用PBS/0.05%Tween 20中的1%BSA在室温封闭板2小时。用PBS/0.05%Tween 20洗涤板四次。结合50μL抗体样品(8A10和3C6)(始于300nM且滴度下降3s)。将板用PBS/0.05%Tween 20洗涤4次。结合50μL山羊抗mIgG辣根过氧化物酶(1:5000稀释),然后添加50μL底物溶液TMB,并使颜色显色。用50μL 1M HCl终止反应,并在450nm处读取光密度。完整IgG(8A10和3C6)与BSA-紫杉醇抗原的直接结合的结果显示在图4中。
抗体优化。进行包括亲和力成熟的抗体优化。该方法包括:(1)通过对从杂交瘤细胞系产生的抗体进行测序来表征抗体,(2)构建集中于CDR区的抗体文库;(3)筛选有益突变,和(4)组合有益突变。
步骤1:克隆和表达抗紫杉醇mAb为Fab
A.从杂交瘤细胞产生的抗体(8A10和3C6)的可变区的测序。
i.总RNA提取和mRNA变性
使用QIAGEN RNeasy Mini试剂盒从两个杂交瘤细胞(8A10和3C6)提取总RNA。将mRNA混合物(如下所述)在72℃温育3分钟,然后冷却至42℃,持续2分钟。冷却后,将管以14,000×g短暂旋转10秒以收集底部的内容物。
mRNA混合物
RNA模板(0.2–0.4ug) 1-2.75uL
5'-RAGE引物A 1uL
不含RNA酶的水 至3.75uL
ii.cDNA合成和5'RAGE反应
如下所示进行cDNA合成和5'RAGE反应。
iii.通过琼脂糖凝胶电泳分析PCR反应
将PCR扩增产物在琼脂糖凝胶上电泳以确认对应于8A10和3C6mAb的轻链和重链可变区的扩增子的存在。
iv.克隆、测序和CDR分析
将PCR阳性条带克隆入载体中并进行测序。抗体序列分析鉴定了8A10和3C6的一条轻链和一条重链。最初对于3C6,仅鉴定了一条轻链并且未鉴定重链(异常序列)。因此,将根据从N-末端测序结果获得的序列设计的特异性引物用于对重链再进行PCR。最后,完成了3C6的重链的鉴定。
8A10杂交瘤
8A10杂交瘤测序结果如下所示。
8A10可变轻链核酸序列是SEQ ID NO:1:
GAC ATT GTG ATG ACC CAG TCT CAA AAA TTC ATG TCC ATA ACACTA GGA GAG AGG GTC AGC ATC ACC TGC AAG CCC AGT CAG AAT GTGGGT TCT GCT GTA ACC TGG TGG CAA CAG AAA CCA GGA CAA TCT CCTAAA CTA CTG ATT TAC TCA GCT TCC AAT CGG TAT ACT GGA GTC CCTGAT CGC TTC ACA GGC AGT GGA TCT GGG ACA GAT TTC ACT CTC ACCATT AGT AAT GTG CAG TCT GAA GAC CTG GCA GAT TAT TTC TGT CAACAA TAT AGC AGC TAT CCG TAC ACG TTC GGA GGG GGG ACC AAG CTGGAA ATA AAA CG(SEQ ID NO:1).
编码CDR区的序列加以下划线。
相应的8A10可变轻链氨基酸序列是SEQ ID NO:2:
DIVMTQSQKFMSITLGERVSITCKPSQNVGSAVTWWQQKPGQSPKLLIYSASNRYTGVPDRFTGSGSGTDFTLTISNVQSEDLADYFCQQYSSYPYTFGGTKLEIKR(SEQ ID NO:2)。
三个CDR区加以下划线(即,CDRL1是KPSQNVGSAVT,CDRL2是SASNRYT,CDRL3是QQYSSYPYT)。
8A10可变重链核酸序列是SEQ ID NO:3:
GAG GTC CAG CTG CAA CAA TCT GGA CCT GAA CTG GTG AAG CCTGGG GCT TCA GTG AAG ATT TCC TGT AAG GCT TCT GGA TAC ACG TTCACT GAC TCC ACC ATG AAC TGG GTG AAG CAG AGC CAT GGA AAG AGCCTT GAG TGG ATT GGA GAG ATT GAT CCT AAC AAT GGT GGT ACT AACTAC AAT CAG AAG TTC AAG GGC AAG GCC ACA TTG ACT GTA GAC AAGTCC TCC AGC ACA GCC TAT ATG GAG CTC CGC AGC CTG ACA TCT GAGGAC TCT GCA GTC TAT TAC TGT GCA AGA GGG GTC TGG GGC CAA GGCACC ACT CTC ACA GTC TCC TCA(SEQ ID NO:3).
编码CDR区的序列加下划线。
相应的8A10可变重链氨基酸序列是SEQ ID NO:4:
EVQLQQSGPELVKPGASVKISCKASGYTFTDSTMNWVKQSHGKSLEWIGEIDPNNGGTNYNQKFKGKATLTVDKSSSTAYMELRSLTSEDSAVYYCARGVWGQGTTLTVSS(SEQ ID NO:4)。
三个CDR区加以下划线(即,CDRH1是GYTFTDSTMN,CDRH2是EIDPNNGGTNYNQKFKG,CDRH3是GV)。
3C6杂交瘤
3C6杂交瘤测序结果如下所示。
3C6可变轻链核酸序列是SEQ ID NO:5:
GAT GTT GTG ATG ACC CAA ACT CCA CTC TCC CTG CCT GTC AGTCTG GGA GAT CAA GCC TCC ATC TCT TGC AGA TCT CGT CAG AGC CTTGTA CAC AGT AAT GGA AAC ACC TAT TTA CAT TGG TAC CTG CAG AAGCCA GGC CAG TCT CCA AAG CTC CTG ATC TAC AAA GTT TCC AAC CGATTT TCT GGG GTC CCA GAC AGG TTC AGT GGT AGT GGA TCA GGG ACAGAA TTC ACA CTC GAG ATC AGC AGA GTG GAG GCT GAG GAT CTG GGAGTT TAT TTC TGC TCT CAA AGT ACA CAT GTT CCT CCG ACG TTC GGT GGAGGC ACC AAG CTG GAA ATC AAA C(SEQ ID NO:5).
编码CDR区的序列加以下划线。
相应的3C6可变轻链氨基酸序列是SEQ ID NO:6:
DVVMTQTPLSLPVSLGDQASISCRSRQSLVHSNGNTYLHWYLQKPGQSPKLLIYKVSNRFSGVPDRFSGSGSGTEFTLEISRVEAEDLGVYFCSQSTHVPPTFGGGTKLEIK(SEQ ID NO:6)。
三个CDR区带有下划线(即,CDRL1是RSRQSLVHSNGNTYLH,CDRL2是KVSNRFS,CDRL3是SQSTHVPPT)。
3C6可变重链核酸序列是SEQ ID NO:7:
GAG GTG CAG CTT CAG GAG TCG GGA CCT AGT CTC GTG AAA CCTTCT CAG ACT CTG TCC CTC ACC TGT TCT GTC ACT GGC GAC TCC ATC ACCAGT GGT TAC TGG AAC TGG ATC CGG AAA TTC CCA GGG AAT AGA CTTGAG TAC ATG GGG TAC ATA AGC TAC AGT GGT AGC ACT TAC TAC AATCCG TCT CTC AAA AGT CGA ATC TCC ATC ACT CGA GAC ACA TCC AAGAAC CAG TAC TAC CTA CAT TTG ACT TCT GTG ACT ACT GAG GAC ACAGCC ACA TAT TAC TGT GCC CAA GGG GAT GGC GCC TAC TGG GGC CAAGGC ACC ACT CTC ACA GTC TCC TCA(SEQ ID NO:7).
编码CDR区的序列加以下划线。
相应的3C6可变重链氨基酸序列是SEQ ID NO:8:
EVQLQESGPSLVKPSQTLSLTCSVTGDSITSGYWNWIRKPGNRLEYMGYISYSGSTYYNPSLKSRISITRDTSKNQYYLHLTSVTTEDTATYYCAQGDGAYWGQGTTLTVSS(SEQ ID NO:8)。
三个CDR区加以下划线(即,CDRH1是GDSITSGYWN,CDRH2是YISYSGSTYYNPSLKS,CDRH3是GDGAY)。
表2. 8A10和3C6 mAb的N-末端测序结果与杂交瘤测序结果的比较。
B.将mAb的可变区克隆入M13工程载体中。
使用PCR,利用序列特异性引物扩增编码mAb(即,8A10和3C6)的VL、Cκ和VH区的DNA。将所得PCR产物进行凝胶纯化,并针对在lacZ启动子控制下的基于M13的噬菌体载体内的特定位点进行限制性消化。将编码8A10和3C6 mAb的VL、Cκ和VH区的双链DNA连接至含有人IgG1的CH1区的恒定区的基因的基于噬菌体的载体中。将所述DNA转化至大肠杆菌(E.coli)中,并详细检查含有噬菌体的所得噬菌斑。随机挑取噬菌斑,分离其DNA,并测定序列。克隆8A10_1经测定具有与mAb 8A10相同的VL、Cκ和VH区的序列(未显示)。3C6的克隆过程可根据相同的方案进行。
C.从M13工程载体产生的Fab的紫杉醇结合活性的证明。
在用IPTG诱导的同时生长XL1-Blue大肠杆菌(革兰阴性)的克隆8A10_1噬菌体感染的培养物,通过离心收获所述培养物,并通过渗透压休克(periprep)释放周质内容物。从培养物中分离释放的Fab产物。Fab浓度通过ELISA来定量,使用紫杉醇ELISA与完整的IgG一起来进行Fab的抗原特异性结合(未显示)。两种完整IgG的Kd值(对于两种抗体均为约10nM)与先前报道的Kd值相当(参见图3)。Fab 8A10的Kd值经测定也为10nM,其与完整IgG 8A10的Kd值相同。这些结果表明,亲本抗体8A10的正确可变区序列存在于本发明的Fab 8A10中,并且以Fab形式从M13工程载体正确折叠和表达。
Fab在周质制剂中表达得足够好以证明与BSA-紫杉醇缀合物包被的孔的浓度依赖性结合。
实施例3
代表性固相竞争测定
在本实施例中,描述了证明固相竞争性测定的功效的代表性测定。该测定证明了在此类检测形式中使用本文所述的抗紫杉醇抗体来为样品中紫杉醇的存在提供信息性信号的有用性。结果表明,抗体的变化的放置可增强测定性能。
紫杉醇侧流系统。将1.2mg/mL BSA-Pac(试验线,T)和0.2mg/ml山羊抗小鼠抗体(对照线,C)条纹式印制至膜卡片(High-Flow Plus HF180膜卡片,Millipore)上。将抗紫杉醇抗体-胶体金缀合物吸收和干燥至结合垫(玻璃纤维垫,Millipore)。在测定中流入加标有紫杉醇(10uL)的胎牛血清(FBS)(由80μL PBS Tween追踪)。
串联抗体测定。使用蒸馏水重建抗体-金缀合物,然后将其添加至彼此中以制备适当的浓度。施加该串联抗体溶液,然后干燥至测定结合垫上。
读取器输出:强度相对位置。扫描测试条的结果的读出。使用Qiagen读取器(Qiagen,Germany)读取条。
紫杉醇标准曲线。产生测试线与对照线的比率相对紫杉醇浓度的标准曲线。
图5A和5B显示了在T1和T2线处结合的8A10的曲线。图5A显示了标准曲线,即测试线与对照线(T/C)的比率相对紫杉醇浓度。对于较低浓度,8A10在T1处的比率相对T2的大差异表明当被放置得更靠近样品端口时(其中分析物的浓度可能更高),抗体的灵敏度要高得多。图5B显示了如读取器装置提供的扫描的测试条的输出强度相对于位置读出。
图6A和6B显示了在T1和T2线处结合的3C6的曲线。图6A示出了标准曲线,即测试线与对照线(T/C)的比率相对紫杉醇浓度。对于较低浓度,3C6在T1处的比率相对T2的相对小的差异表明对于将抗体放置得更靠近样品端口(其中分析物的浓度可能更高),会获得相对低的灵敏度改善。然而,观察到相对于T2处的信号强度的改善。图6B显示了由读取器装置提供的扫描的测试条的输出强度相对于位置读出。
图7A和7B显示了在T1和T2线处结合的组合的8A10和3C6的曲线。图7A显示了标准曲线,即测试线与对照线(T/C)的比率相对紫杉醇浓度。通过将靠近样品端口的8A10的高灵敏度和与位置无关的在T2处的3C6的较高灵敏度组合,使得测定更加强健。图7B显示了由读取器装置提供的扫描的测试条的输出强度相对于位置读出。
在上述分析中(和在图5-7中),图5B、6B和7B中的T1、T2和C的位置的测量(Pos[mm])是按流动方向从测试条的下游端(例如,在55mm点处引入样品,T2在约45mm处,T1在约40mm处,C在约35mm处)进行的。
实施例4
用于测定抗体结合特性的方法
在本实施例中,描述了用于测定抗体性质的方法。该方法由Precision Antibody,Inc.(Columbia,MD)使用Biacore测定进行。本实施例还显示了本发明的LFA测定可如何适用于其它固相测定,诸如表面等离子体共振(SPR)测定。
在25℃下在Biacore 3000仪器(GE,Pittsburgh,PA)上进行结合实验。通过胺偶联(EDC/NHS)将约13,000RU的抗BSA ab(Life Technologies,A11133,lot 1637270)直接固定在CM5芯片的流动池2上。捕获110-120RU的BSA-紫杉醇(BSA-Ag)。流动池1以相同的方式处理,但不使用配体,并用作空白表面以用于参照扣除。用1M乙醇胺封闭未被占据的位点。将分析物Ab1(8A10)和Ab2(3C6)以不同的浓度在芯片上流动。实时监测抗原与抗体的结合以获得缔合(ka)和解离(kd)速率。从观察到的ka和kd计算平衡常数(KD)。
使用如利用2倍连续稀释所示的分析物浓度进行全动力学分析。起始浓度为200nM,随后为100nM、50nM、25nM、12.5nM和0nM。以一式二份运行100nM浓度以确认测定的可重现性。全动力学分析结果概述于表3中。
测定缓冲液是10mM HEPES缓冲液(pH 7.4),150mM NaCl,3mM EDTA,0.05%P20(聚氧乙烯山梨聚糖)。再生缓冲液为10mM甘氨酸缓冲液(pH2.0)。缀合缓冲液是10mM乙酸钠缓冲液(pH5.0)。用于捕获配体的流速为1μL/min。动力学分析的流速为50μL/min。
在实际传感图与从BIAnalysis软件产生的传感图之间进行卡方(χ2)分析,以测定分析的准确性。1-2内的χ2值被认为是显著的(准确的),而低于1的值是高度显著的(高度准确的)。
三个独立的SPR运行的概述在表4中给出。
表3.完全动力学分析
表4.SPR概述
虽然已显示和描述了说明性实施方案,但是应当理解,在不脱离本发明的精神和范围的情况下,可以进行各种改变。
序列表
<110> Trieu, Vuong
Park, Chulho
Lee, Cynthia
<120> 用于紫杉醇的药代动力学引导给药的监测血浆中的紫杉醇浓度的方法、装置和试剂<130> ATLC-1-53634
<150> US 62/051757
<151> 2014-07-17
<150> US 61/975386
<151> 2014-04-04
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 323
<212> DNA
<213> 人工序列
<220>
<223> 合成的
<400> 1
gacattgtga tgacccagtc tcaaaaattc atgtccataa cactaggaga gagggtcagc 60
atcacctgca agcccagtca gaatgtgggt tctgctgtaa cctggtggca acagaaacca 120
ggacaatctc ctaaactact gatttactca gcttccaatc ggtatactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat ttcactctca ccattagtaa tgtgcagtct 240
gaagacctgg cagattattt ctgtcaacaa tatagcagct atccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 2
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成的
<400> 2
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Ile Thr Leu Gly
1 5 10 15
Glu Arg Val Ser Ile Thr Cys Lys Pro Ser Gln Asn Val Gly Ser Ala
20 25 30
Val Thr Trp Trp Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 3
<211> 333
<212> DNA
<213> 人工序列
<220>
<223> 合成的
<220>
<221> CDS
<222> (1)..(333)
<400> 3
gag gtc cag ctg caa caa tct gga cct gaa ctg gtg aag cct ggg gct 48
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
tca gtg aag att tcc tgt aag gct tct gga tac acg ttc act gac tcc 96
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
acc atg aac tgg gtg aag cag agc cat gga aag agc ctt gag tgg att 144
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
gga gag att gat cct aac aat ggt ggt act aac tac aat cag aag ttc 192
Gly Glu Ile Asp Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
aag ggc aag gcc aca ttg act gta gac aag tcc tcc agc aca gcc tat 240
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
atg gag ctc cgc agc ctg aca tct gag gac tct gca gtc tat tac tgt 288
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
gca aga ggg gtc tgg ggc caa ggc acc act ctc aca gtc tcc tca 333
Ala Arg Gly Val Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
100 105 110
<210> 4
<211> 111
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 4
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Val Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
100 105 110
<210> 5
<211> 337
<212> DNA
<213> 人工序列
<220>
<223> 合成的
<220>
<221> CDS
<222> (1)..(336)
<400> 5
gat gtt gtg atg acc caa act cca ctc tcc ctg cct gtc agt ctg gga 48
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
gat caa gcc tcc atc tct tgc aga tct cgt cag agc ctt gta cac agt 96
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Leu Val His Ser
20 25 30
aat gga aac acc tat tta cat tgg tac ctg cag aag cca ggc cag tct 144
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
cca aag ctc ctg atc tac aaa gtt tcc aac cga ttt tct ggg gtc cca 192
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
gac agg ttc agt ggt agt gga tca ggg aca gaa ttc aca ctc gag atc 240
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Glu Ile
65 70 75 80
agc aga gtg gag gct gag gat ctg gga gtt tat ttc tgc tct caa agt 288
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
aca cat gtt cct ccg acg ttc ggt gga ggc acc aag ctg gaa atc aaa c 337
Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 6
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 6
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Arg Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Glu Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 7
<211> 339
<212> DNA
<213> 人工序列
<220>
<223> 合成的
<220>
<221> CDS
<222> (1)..(339)
<400> 7
gag gtg cag ctt cag gag tcg gga cct agt ctc gtg aaa cct tct cag 48
Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
act ctg tcc ctc acc tgt tct gtc act ggc gac tcc atc acc agt ggt 96
Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
tac tgg aac tgg atc cgg aaa ttc cca ggg aat aga ctt gag tac atg 144
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Arg Leu Glu Tyr Met
35 40 45
ggg tac ata agc tac agt ggt agc act tac tac aat ccg tct ctc aaa 192
Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys
50 55 60
agt cga atc tcc atc act cga gac aca tcc aag aac cag tac tac cta 240
Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
cat ttg act tct gtg act act gag gac aca gcc aca tat tac tgt gcc 288
His Leu Thr Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
caa ggg gat ggc gcc tac tgg ggc caa ggc acc act ctc aca gtc tcc 336
Gln Gly Asp Gly Ala Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
tca 339
Ser
<210> 8
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 合成的构建体
<400> 8
Glu Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Val Thr Gly Asp Ser Ile Thr Ser Gly
20 25 30
Tyr Trp Asn Trp Ile Arg Lys Phe Pro Gly Asn Arg Leu Glu Tyr Met
35 40 45
Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Tyr Tyr Leu
65 70 75 80
His Leu Thr Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Gln Gly Asp Gly Ala Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val Ser
100 105 110
Ser
- 还没有人留言评论。精彩留言会获得点赞!