一株新青霉菌及其代谢产物安他拟酸A的制作方法
本发明涉及一株来源于土壤并能产生新天然产物安他拟酸的青霉菌z08及其在医药、林业及农业上的应用。
背景技术:
土壤微生物在土壤中度过它们全部或者部分的生命历程,并在土壤内部各种过程中发挥着重要作用,这些作用在许多方面影响人类的社会和经济发展。很多土壤微生物可以分泌次生代谢产物,如根瘤菌分泌根瘤菌结瘤因子——脂壳寡糖,在根瘤菌与植物的共生结瘤过程中起重要作用。真菌天然产物还是天然药物的重要来源之一1,2,如麦角生物碱,二酮哌嗪,喹啉,喹唑啉,地西泮,和聚酮化合物等。大规模真菌基因组序列测序的完成表明真菌具有产生丰富的次级代谢产物的潜能,这类次生代谢产物已经成为了研究的热点和开发的方向3,4,5。人们在20世纪初开始注意到微生物与土壤肥力之间的关系,并发现一些难溶性的复合物施入土壤中,可以被作为磷源而应用,人们从土壤中筛选出50多株细菌,其中几株青霉菌在平板上形成了肉眼可见的溶磷圈6。随着工业污染和环境破坏的日益严重,恶性肿瘤发病率正在逐年提高,而常规抗癌药物又具有很大的副作用,所以抗肿瘤药物的研发是药物化学研究领域研究的重要课题。真菌天然产物表现出十分广泛的生物学活性,包括抗肿瘤、抗菌、抗病毒、免疫抑制等。
据报道7草酸青霉菌p8,具有溶解土壤中多种难溶磷的作用,适合南方的红壤、北方的黑土、褐土、潮土等多种土壤类型,具有提高作物产量,活化土壤难溶磷、防止磷肥的土壤化学固定,提高磷肥利用效率的多种作用功能。马忠岩等8在公开的发明专利中指出,对番茄苗根部周围撒播淡紫拟青霉菌菌剂处理,能够显著促进番茄的生长,且效果稳定,具有很好的推广应用前景。利用淡紫拟青霉菌株fjat-9041制备辛硫磷的降解菌剂,能有效地降解农药辛硫磷9。田间试验表明,接种溶磷菌-青霉菌可以增加玉米产量10。草酸青霉菌njdl-03可修复土壤铅污染及提高石灰性土壤磷素利用率,在促进作物生长方面效果显著11。细脚拟青霉菌株培养产物具有调节免疫、抗肿瘤、抗病毒、护肝、改善营养、抗衰老、提高耐缺氧能力、镇静、镇痛等功能12。
由此可见,青霉菌在农业与医药等方面均具有广阔的应用前景。因此,有必要进一步对青霉菌及其代谢产物进行研究。
技术实现要素:
本发明的目的在于提供一种来源于土壤的新的青霉菌(penicililliumflavonim)z08,该青霉菌于2016年6月29日在中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc)注册保藏,保藏地点为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏号为cgmccno.12761。
本发明从种植玉米的土壤中分离得到一株真菌,该菌使用its引物扩增得到its序列,经blast鉴定,结果显示该序列和penicililliumsp.1jjk-2011(genebankid:hm469397)相似度最高,达到98.9%,故鉴定该株菌属于青霉属(penicililliumflavonim)的青霉菌z08。
该菌的微生物学特征为:在pda平板上28℃培养4天后,菌落呈现白色,多为营养菌丝。其营养体为无色或淡黄色的菌丝体,菌丝各细胞之间有横隔膜。7天后可见气生菌丝上产生简单的长而直立的分生孢子梗,顶端以特殊的对称的扫帚状的分支,同时菌落呈现淡绿色,显微镜检可见成团菌丝体。
本发明的另一目的是提供从该真菌中分离得到的一个新化合物安他拟尼酸a(antanicacida),其化学名称为:(e)-2-(2-(3-(2-氨基苯甲酰胺);分子式为:c15h17n3o6,分子量为:335.1117;化学结构如下:
该化合物为淡黄色无定形粉末,易溶于水,二甲基亚砜等。
本发明的优点和积极效果:
(1)本发明在土壤中分离得到的新青霉菌z08,其具有很好的解磷功效,能够溶解土壤中多种难溶磷,在种植农作物的土壤中使用,能够活化土壤难溶磷、防止磷肥的土壤化学固定,提高作物产量。
(2)本发明在新青霉菌z08发酵产物中提取得到一新的化合物安他拟酸a,该化合物能够抑制nih3t3细胞繁殖,安他拟酸a浓度越大,对nih3t3细胞增殖的抑制作用就越明显;同时,安他拟酸a对nih3t3细胞tgf-β1基因表达也有较强的抑制作用,该化合物有望在治疗糖尿病的药物中得以应用,为糖尿病患者的治疗提供新产品。
(3)本发明提取的安他拟酸a能够抑制脂多糖诱导的巨噬细胞分泌炎症因子,还有望在治疗抗炎的药物中得以应用。
附图说明
图1为安他拟酸a化合物1h核磁共振图谱。
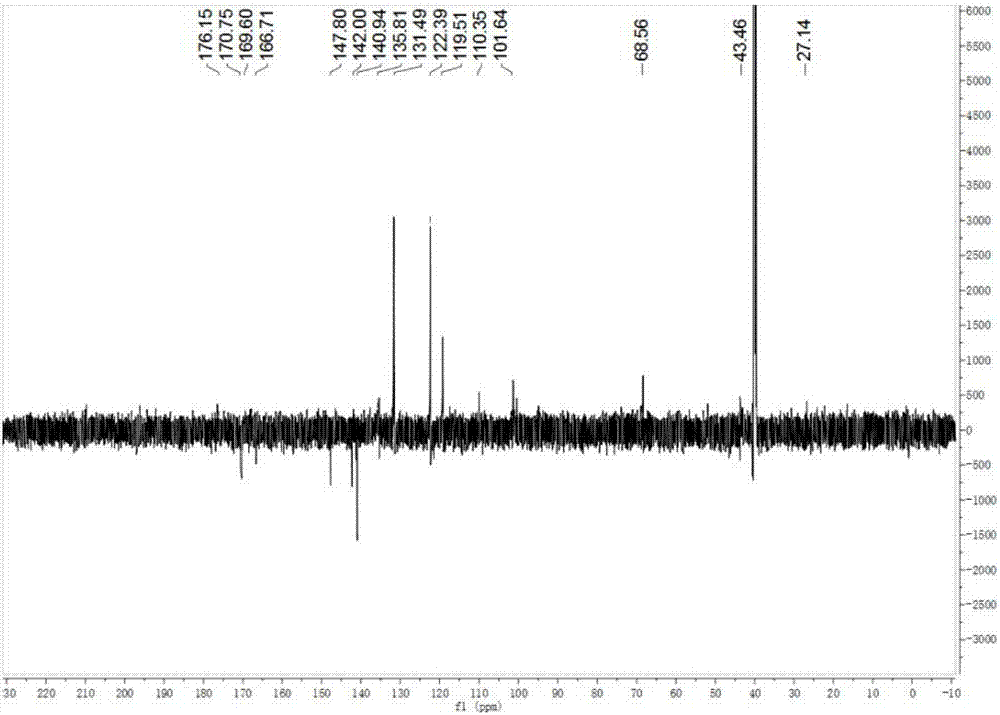
图2为安他拟酸a化合物13c图谱。
图3为安他拟酸a化合物1h-13chmqc图谱。
图4为安他拟酸a化合物1h-13chmbc图谱。
图5为安他拟酸a化合物1h-1hcosy图谱。
图6为安他拟酸a化合物高分辨质谱。
图7为青霉菌z08对土壤磷的溶解动态分析图。
图8为nih3t3细胞中提取的总rna质量检测分析图。
图9为安他拟酸a三个浓度对raw264.7细胞活性的影响图。
图10为安他拟酸a三个剂量对lps诱导小鼠细胞no的生成情况图。
具体实施方式
下面结合实施例对本发明作进一步的描述,以便是本领域技术人员更加清楚明白,但并不构成对本发明的任何限制。
实施例1
一、青霉菌z08菌株的分离与鉴定
从吉林省九台市张家农场土壤中应用pda+青霉素和链霉素平板分离得到了21株真菌,其中一株真菌即青霉菌z08,青霉菌z08在pda琼脂糖平板上可产生淡黄色化合物。该菌株经分类学研究和分子生物学研究鉴定为青霉菌(penicililliumflavonim)。
该菌的微生物学特征为:在pda平板上28℃培养4天后,菌落呈现白色,多为营养菌丝。其营养体为无色或淡黄色的菌丝体,菌丝各细胞之间有横隔膜。7天后可见气生菌丝上产生简单的长而直立的分生孢子梗,顶端以特殊的对称的扫帚状的分支,同时菌落呈现淡绿色,显微镜检可见成团菌丝体。
1、青霉菌z08菌株的制备
青霉菌纯化采用如下培养基:在1000毫升水中加入土豆培养基40克,加入葡萄糖20克,琼脂20克,在121℃,压力为1kg/cm2条件下灭菌20分钟,冷却后加入无菌的青霉素和链霉素各30微克/毫升。无菌状态下称取土壤样本约l克,加入无菌水10毫升,震荡混匀,再分别稀释10倍、100倍、100倍共制成4个浓度梯度的样品,各取0.25毫升涂布于固体培养基上,每个梯度涂布20个平板,当分离菌株在培养基上进入生长旺盛期时,挑取菌株的孢子,在真菌纯化培养基上划线纯化,28℃、相对湿度90%、恒温恒湿条件下倒置培养,按此方法连续划线直至单个平板上为形态单一的菌落时,挑取平板上的单菌落进行纯培养,待菌落长成后保存纯种。
2、青霉菌z08的基因组dna提取
首先将菌株在28℃摇床(150r/min)培养7天,然后取冷冻干燥后的菌丝100mg,加适量的液氮于研钵中充分研磨,并加入2ml缓冲液(50mmtris-hclph7.2,50mmedta,2.5%sds,1%β-巯基乙醇),混匀,转移至10ml试管中,加入2ml苯酚:氯仿(1:1)抽提液,提取,提取液离心,然后取上清液加入50微升rnase,55℃条件下,放置1小时并加入蛋白酶。然后用70%冷乙醇洗两次,室温干燥30分钟,加入500微升水溶解,-80℃保存备用。
3、青霉菌z08菌株鉴定
通过引物its58a1f:5’-gcatcgatgaagaacgc-3’和
itsnlb3:5’-ggattctcaccctctatga-3’对青霉菌z08基因组dna进行扩增,将扩增片段用t载克隆转化到dh5a并对阳性克隆进行测序,获得青霉菌z08的its序列如下:
对青霉菌z08的its序列进行blast分析,结果显示该序列和penicililliumsp.1jjk-2011(genebankid:hm469397)相似度最高,达到98.9%。故鉴定该株菌属于青霉属(penicililliumflavonim)青霉菌z08。该菌于2016年6月29日在中国微生物菌种保藏管理委员会普通微生物中心注册保藏,保藏地点为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏号为cgmccno.12761。
二、青霉菌z08发酵产物中安他拟酸a的分离鉴定
1、青霉菌z08发酵产物的制备及分离方法
①发酵物的制备
取青霉菌z08的孢子划线列于8升pda的琼脂平板(克/升)上:取酵母提取物(购自sigma公司)0.5克,葡萄糖10.0克,磷酸钙5.0克,硫酸铵0.5克,氯化钾0.2克,硫酸镁0.1克,硫酸锰0.0001克,硫酸亚铁0.0001克,琼脂15.0克,板在室温下(20-22℃)下,温育14天。当观察到琼脂板变成黄颜色,同时孢子变成绿色时,用水将孢子从琼脂板上除去,然后将琼脂再用水提取。所得琼脂浆液加10升水中搅拌5小时,并通过金属(100目)过滤,得到青霉菌z08发酵产物。
②反相液相色谱分离纯化
将上述发酵产物溶液减压蒸发至2l的体积,然后用乙酸乙酯等量萃取3次,萃取液减压蒸干,干燥萃取物溶于水,依次用环己烷与甲醇萃取,取甲醇部分进行hplc制备。
仪器:hplc-esi-ms(agilent1100hplc系统,esi模式布鲁克的amazon点离子阱质谱仪,配备160-600nm可变uv检测仪,phenomenexluna5μmc18(250毫米×15毫米,4.6微米),流速(10ml/min);
色谱条件:a(乙腈含0.1%甲酸)和b(含0.1%甲酸的水)溶剂梯度,0-5分钟,5%a;5-15.5分钟,线性梯度至60%a;15.5-16分钟,线性梯度至100%a;16-17.5分钟,100%a等度;17.5-18分钟,线性到5%a,18-21分钟,5%a。
③结果
青霉菌z08发酵物(约200克)经乙酸乙酯(2升)等量萃取3次,得1.5克浸膏,溶于水,依次用环己烷与甲醇萃取,取甲醇部分进行hplc制备,共采集30个部分,收集13.5分钟样品峰,得到一亮黄色粉末,5毫克。供thermoscientificltq,orbitrapxl高分辨质谱以及bruker,avance600mhz核磁共振光谱仪进行检测。
2、青霉菌z08发酵产物中安他拟酸a的鉴定
取上述所得亮黄色粉末1毫克,用thermoscientificltq,orbitrap分析得高分辨质谱,分子量为:335.1117(见图6);取上述所得亮黄色粉末3毫克溶解在dmso-d6中,用bruker,avance600mhz核磁共振光谱仪进行检测(见表1和图2)。
1hnmr(600mhz,dmso-d6)δ:7.34(d,1h,j=8.5,h-2),8.51(t,1h,j=8.5,1.5,h-3),7.01(t,1h,j=8.5,h-4),8.01(d,1h,j=8.5,h-5),7.35(d,1h,j=8.5,h-8),5.21(d,j=10.2,h-9),3.06(m,1h,h-11),2.13(m,1h,h-12a),1.98(m,1h,h-12b),2.51(m,1h,h-13)。
13cnmr(150mhz,dmso-d6)δ:140.7(s,c-1),131.6(d,c-2),119.3(d,c-3),122.4(d,c-4),131.6(d,c-5),124.2(s,c-6),170.7(s,c-7),135.4(d,c-8),101.2(d,c-9),166.3(s,c-10),58.7(d,c-11),28.2(t,c-12),32.6(t,c-13),176.1(s,c-14),176.1(s,c-15)。
表1核磁共振光谱数据
根据hresims推导其分子式为c15h17n3o6:m/z=336.1191[m+h]+(计算336.1196),同时根据13cnmr及其它核磁光谱数据,推导其需要9个不饱和度。1h-1hcosy(图5)和hmqc(图3)谱分析表明存在以下自旋系统:h2-h3-h4-h5,h8-h9,h11-h12-h13。由hmbc光谱(图4和表1)中观察到的碳氢相关如下:从c-1到h-2,h-5;从c-6到h-4,h-2;从c-7到h-8,h-5;从c-10到h-8,h-7;从c-14至h-12;从c-15至h-12;从c-13到h-11。安他尼酸a的hmbc相关:
经过检索及以上所有这些数据最终确定,该化合物为新化合物,其化学名称为:(e)-2-(2-(3-(2-氨基苯甲酰胺),被命名为安他拟酸a;化学式为:
实施例2青霉菌z08的解磷功效试验
一、青霉菌z08解磷能力的定量测定及结果
按照前人(参考文献13)的研究方法制作磷标准曲线,得出回归方程,计算细菌的解磷量。将保存的内生菌过夜培养(28℃,120r/min)后,取100ul接种于50mlpko无机磷培养液中,3次重复,以接无菌水为对照,置28℃摇床(120r/min)培养12d后,取上清液按照参考文献[13]的方法测定解磷量。菌株解磷量计算公式为:
菌株解磷量(mg/ml)=比色液(mg/ml)×(100/5)×取用量倍数
表2青霉菌z08菌株解磷量定量测定
二、青霉菌z08对土壤磷溶解能力测定及结果
称取过筛后的土壤5g置于150ml三角瓶中,分灭菌和不灭菌2个处理,每处理分3组:
(1)三角瓶中加入1ml青霉菌z08菌株过夜培养液(28℃,120r/min)和9ml无菌水,以加入1ml经灭菌的青霉菌z08菌株过夜培养液和9ml无菌水为ck;
(2)加入5ml青霉菌z08菌株过夜培养液和5ml无菌水,以加入5ml经灭菌的青霉菌z08菌株菌株过夜培养液和5ml无菌水为ck;
(3)加入10ml青霉菌z08菌株过夜培养液,以加入10ml经灭菌的青霉菌z08过夜培养液为ck;置于28℃培养,分别在培养的第3,5,10,15,20,25和30天按参考文献[13]中土壤速效磷的测定方法测定其解磷量,3次重复,结果见图7。
从附图7可以看出,随着接种菌量的增加,解磷量增加,三个培养组在培养第5天时解菌量明显剧增,在第5-15天期间,解磷趋势有所减缓,在15-30天这个阶段,接种10ml青霉菌z08解磷量增加。结果表明,接菌量大,青霉菌z08菌体的基数大,解磷能力强,可溶磷积累多;青霉菌z08能与土壤中的土著微生物互惠协作,土著微生物能增强青霉菌z08的解磷能力。
实施例3安他拟酸a对nih3t3细胞及tgf-β1基因表达的影响
1.实验材料
1.1细胞
nih3t3细胞由吉林农业大学生物反应器与药物开发教育部工程研究中心赠予。
1.2实验药物
deme高糖培养基,hyclone公司;胎牛血清(fbs),hyclone公司;抗生素,gibco公司;二甲基噻唑(mtt),amresco公司;重组碱性成纤维细胞生长因子(rbfgf),oryzogen公司;高纯总rna快速提取试剂盒,北京百泰克生物技术有限公司;biotakesuperrtkit,北京百泰克生物技术有限公司;2×powertaqpcrmastermix,北京百泰克生物技术有限公司;2×sybpreal-timepcrpremixture,北京百泰克生物技术有限公司。
1.3实验仪器
tgl-20b高速台式离心机(上海安亭科学仪器厂),倒置显微镜(olympus公司),sw-cj-1f超净工作台(苏州净化设备厂),电泳仪(北京六一仪器厂),凝胶成像仪(美国biorad公司),rcr仪(美国sbp公司),applidebiosystems实时荧光定量rcr仪(美国abi公司)。
2.实验方法
2.1细胞前处理
细胞的复苏:将装有nih3t3细胞的离心管从液氮中拿出,37℃水浴复苏,1min内完成,之后在超净工作台里加入5ml培养基(deme),然后离心5min,弃去上清液,将细胞吸入到细胞培养瓶中,加入4ml培养基,培养基中加入10%血清(fbs)和1‰抗生素,轻轻摇匀,置于温度为37℃,浓度为5%的co2培养箱中培养,培养瓶盖不要拧太严,便于细胞呼吸。
细胞的传代:在显微镜下爱观察细胞培养瓶中的细胞,待其长到80~90%时,将其用pbs缓冲液冲洗2遍,弃去pbs,用移液枪加入5mldeme,同时将细胞吹打下来,进行传代。
2.2mtt法测定细胞存活率
将长至对数生长期的nih3t3细胞转移至离心管内,调整细胞浓度至1×105个/ml。然后点入96孔细板中,每孔100μl,96孔板周围的孔不点,防止发生边缘效应。之后将其置于37℃,5%的co2培养箱中培养24h小时使细胞贴壁。实验共设5组,分别为空白对照组(加入等量的培养液),rbfgf组(5ng/ml),安他拟酸a组(0.4,2,10,50,250μg/ml),每个浓度做3个平行,在37℃,5%的二氧化碳培养箱中培养12,24,48h后,用移液枪向每孔内加入20μlmtt,再放入培养箱中孵育4h,终止培养。向每孔内加入150μldmso,置于振荡器上振荡10min,使dmso充分溶解。在酶联免疫监测仪上570nm处测定各孔光吸收值。
2.3荧光实时定量pcr检测tgf-β1
将长至对数生长期的nih3t3细胞转移至离心管内,调整细胞浓度,至4×105个/ml,将nih3t3细胞接种于6孔板内,每孔加入2ml细胞悬浮液,在37℃,5%的二氧化碳培养箱中培养24h,吸除培养液。空白组加入dmem培养液,阳性对照组加入含5ng/mlrbfgf的deme,实验组加入含0.4,2,10,50,250μg/ml安他拟酸a的deme,37℃、5%co2培养24h,终止培养。弃去培养液,pbs清洗细胞2~3次,高纯总rna快速提取试剂盒提取细胞中的rna,用biotakesuperrtkit试剂盒反转录cdna。
表3引物序列
3.结果
3.1mtt法测定细胞存活率
用mtt比色法检测安他拟酸a和rbfgf作用于nih3t3细胞后,nih3t3细胞的吸光度,结果显示,未加任何药物干预的空白对照组细胞在培养了12、24、48h后od值逐渐升高,说明细胞在培养基中逐渐繁殖。nih3t3细胞在rbfgf的作用下繁殖明显增多(p<0.05)。如表4所示,随着安他拟酸a浓度的增大,对nih3t3细胞增殖的抑制作用越明显。与空白组比较,培养12h后250μg/ml组的od值具有显著性差异(p<0.05),24h时10μg/ml组具有显著性差异(p<0.05),50μg/ml组和250μg/ml组具有及显著性差异(p<0.01),培养48h后10、50、250μg/ml组均具有显著性差异(p<0.01),可以看出24h时的抑制作用最为明显。
表4mtt法检测安他拟酸a作用后nih3t3细胞的od值
注:与空白对照组比较,#p<0.05,##p<0.01
3.2af对nih3t3细胞tgf-β1基因表达的影响
将nih3t3细胞中提取的总rna用琼脂糖凝胶电泳对其提取质量进行检测,在紫外仪检测器上可以观察到18s和28s电泳条带清晰(图8中,a:空白对照组;b:rbfgf组;c:0.4μg/ml组;d:2μg/ml组;e:10μg/ml组;f:50μg/ml组;g:250μg/ml组)。如图8、表4、表5所示,提取得到的总rna具有较好的完整性,还可以看出随着浓度的升高,安他拟酸a对nih3t3细胞tgf-β1基因表达的抑制作用越显著。
表5nih3t3细胞中tgf-β1基因的相对表达量
注:与空白对照组比较,#p<0.05,##p<0.01
实施例4安他拟酸a对脂多糖诱导的巨噬细胞分泌炎症因子的影响
1.材料
1.1细胞株来源
小鼠的raw264.7单核巨噬细胞,购于中国科学院上海生命科学研究院细胞库。
1.2药品及试剂
安他拟酸a,实验室自制,纯度大于90%,临用时,用纯净水配置成高、中、低剂量所需浓度;一氧化氮(no)测定试剂盒订购于南京建成生物工程研究所;白细胞介素-1β(il-1β)酶联免疫分析试剂盒,白细胞介素-6(il-6)酶联免疫分析试剂盒,肿瘤坏死因子-α(tnf-α)酶联免疫分析试剂盒和前列腺e2(pge2)酶联免疫分析试剂盒,批号:201511,均购于美国r&d公司;小牛血清(fbs)购于hyclone公司;脂多糖(lps)购于sigma公司;二甲基噻唑(mtt)购于amresco公司;二甲基亚砜(dmso)购于sigma公司;地塞米松(dmx)购于sigma公司;青链双抗购于gibco公司;蒸馏水,实验室自制。
1.3主要仪器
tgl-20b高速台式离心机(上海安亭科学仪器厂);微量振荡器(江苏省金坛市宏华仪器厂);-70℃温冰箱(haier);co2培养箱(formascientific公司,美国);倒置显微镜(olympus公司,日本);电子天平(梅特勒-托利多仪器有限公司,上海);sw-cj-1f超净工作台(苏州净化设备厂);mk3酶标仪(thermoelectron公司,美国);电热恒温水浴锅(金坛市医疗仪器厂);移液枪(thermo);48孔细胞板(coster);lc-20atshimadzushplc(检测器spd-20a,日本岛津公司);fd-1d-50型真空冷冻干燥机(北京博医康实验仪器有限公司)。
2.方法
2.1细胞培养
使用rpmi1640培养液50ml培养小鼠巨噬细胞系raw264.7,在5%co2培养箱中37℃恒温培养。
2.2给药分组
空白对照组:不加药物干预也不加脂多糖刺激;lps模型组:不加药物干预只加10μg·l-1的lps处理,建立炎症模型;阳性对照组:加塞米松dmx0.5μg·l-1干预后2h加10μg·l-1的lps刺激;给药组:加入不同浓度(5mg·l-1、10mg·l-1、20mg·l-1)的安他拟酸a进行干预后2h加10μg·l-1的lps刺激。
2.3检测方法
2.3.1对raw264.7细胞存活率影响
取对数生长期的细胞,用0.25%胰蛋白酶消化,制成1×105个·ml-1单细胞悬液,以每孔100μl点在48孔板内,置于37℃,5%co2培养箱中培养24h后加入不同浓度(5mg·l-1、10mg·l-1、20mg·l-1)的安他拟酸a预处理2h后,加入10μg·l-1的lps刺激细胞继续培养24h,在终止细胞培养前4h,将上述各处理组的各孔细胞中加入20μl,5mg·l-1的mtt,37℃继续孵育。终止细胞培养后,每孔加入150μl的dmso,振荡,直至细胞内结晶完全溶解,530nm波长下用酶标仪测定各孔吸光度值(od值)。
2.3.2对lps诱导的raw264.7细胞no的检测
将调整好的1×105个·ml-1单细胞悬液,在48孔板中每孔均匀点100μl,根据4.2.2所述的过程进行分组处理后,37℃,5%co2培养箱中继续培养24h,吸取上清液,按照no测定试剂盒(griess法)说明书测定细胞培养液中no含量。
2.3.3对lps诱导的raw264.7细胞il-1β、il-6、tnf-α及pge2的检测
取对数生长期细胞,使细胞悬液浓度为1×105个·ml-1,每孔100μl均匀点于48孔板内,与操作相同,根据4.2.2所述的过程进行分组处理后,37℃,5%co2继续细胞培养24h后取上清液,按照elisa试剂盒说明书上的方法分别检测il-1β、il-6、tnf-α及pge2的分泌量。
2.4统计学分析
采用spss17.0软件进行统计学分析,各组的检测结果按照
3.结果
3.1对raw264.7细胞存活率影响
mtt结果如图9所示,安他拟酸a的三个浓度干预细胞24h后,安他拟酸a的三个剂量均与空白对照组相比差异均无统计学意义(p>0.05),说明安他拟酸a对细胞的活性没有显著影响。
3.2no检测
no生成的影响结果如图10所示,模型组与空白对照组相比no的生成量显著增加,差异具有统计学意义(p<0.01)。不同剂量的安他拟酸a处理组与模型组比较,no的生成量显著减少,差异均具有统计学意义(p<0.01),安他拟酸a低、中、高三个剂量与模型组相比较,no的含量逐渐降低,其低、中、高三个剂量的抑制率分别为22.2%、30.3%和50.6%。图10中与空白组相比##p<0.01;与模型组相比**p<0.01。
3.3il-1β、il-6的检测
模型组与空白对照组相比,il-1β和il-6都有显著地增加(p<0.01),而经安他拟酸a处理后的il-1β和il-6的分泌量与模型组相比较,都显著地降低(p<0.01),其中,经安他拟酸a的低剂量和中剂量处理后的il-1β分泌量,与阳性对照组相比差异无统计学意义(p>0.05);安他拟酸a的高剂量处理后的il-1β分泌量与阳性对照组相比差异具有统计学意义(p<0.01)。结果见表6。
表6安他拟酸a三个剂量对lps诱导小鼠细胞il-1β、il-6的生成情况
与空白组相比##p<0.01;与模型组相比**p<0.01;与阳性组相比δp<0.05,δδp<0.01
3.4tnf-α、pge2的检测
tnf-α和pge2的生成情况如表7所示,模型对照组与空白组比较,tnf-α和pge2的生成均显著增加(p<0.01),安他拟酸a给药组三个剂量与模型组比较,tnf-α和pge2的生成均显著性降低(p<0.01)。其中,在tnf-α的生成量中,安他拟酸a的低、中、高三个剂量呈逐渐降低趋势,安他拟酸a的20mg/l剂量最有效。经安他拟酸a的中剂量和高剂量处理后的pge2分泌量比安他拟酸a低剂量组分泌量低,与阳性对照组无明显差异(p>0.05)。
表7安他拟酸a三个剂量对lps诱导小鼠细胞tnf-α、pge2的生成情况
与空白组相比##p<0.01;与模型组相比**p<0.01;与阳性组相比δδp<0.01。
参考文献:
1)nishikoris,takemotok,kamisukis,nakajimas,kuramochik,tsukudas,iwamotom,katayamay,suzukit,kobayashis,watashik,sugawaraf.anti-hepatitiscvirusnaturalproductfromafungus,penicililliumherquei.journalofnaturalproduct,2016,79,442-446.
2)olesyai.zhuravleva,mariap.sobolevskaya,elenav.leshchenko,natalyan.kirichuk,vladimira.denisenko,pavels.dmitrenok,sergeya.dyshlovoy,alexanderm.zakharenko,natalyayu.kim,andshamilsh.afiyatullov.meroterpenoidsfromthealga-derivedfungipenicililliumthomiimaireandpenicililliumlividumwestling.journalofnaturalproduct,2014,77,1390–1395.
3)李春远,丁唯嘉,邵长伦,佘志刚,林永成。一株红树林青霉属真菌(no12556)活性代谢产物的研究。中药材,2008,31,960-962.
4)靳鹏飞,左文健,郭志凯,梅文莉,戴好富.角果木内生青霉菌fj-1化学成分研究[j].药学学报,2013,48(11):1688-1691.
5)原雪娜;陈刚;白皎;华会明;徐文峰;裴月湖。草酸青霉菌hsy-p-17次级代谢产物的分离与鉴定。沈阳药科大学学报2014,31;34-36.
6)stevena.wakelin,rosemarya.warren,paulr.harvey,maartenh.ryder.phosphatesolubilizationbypenicililliumspp.closelyassociatedwithwheatroots.biologyandfertilityofsoils.2004,40(1):36-43
7)龚明波,一种溶磷草酸青霉菌p8,中国专利,200810118076.9
8)马忠岩梁小文王根豪陈晓燕周立峰李肖宇曾繁富,一株淡紫拟青霉菌及其应用,中国专利,201310644028.4
9)刘波,黄素芳,史怀,李芳,朱育菁,唐建阳。一种降解辛硫磷的淡紫拟青霉菌株及其应用,中国专利,201210276405.9
10)m.leggett,n.k.newlands,d.greenshields,l.west,s.inman,andm.e.koivunen,maizeyieldresponsetoaphosphorus-solubilizingmicrobialinoculantinfieldtrials,jagricsci.2015;153(8):464–1478
11)王世梅李真戴乐天韦中徐阳春沈其荣,一种草酸青霉菌njdl-03菌株及其应用,中国专利,201510713680.6
12)陈祝安谭悠久李成魏宁孙长胜,一种细脚拟青霉菌株及其应用,中国专利,201210062125.8
13)南京农学院.土壤农化分析[m].北京:农业出版社,1980。
序列表
<110>郑毅男
<120>一株新青霉菌及其代谢产物安他拟酸a
<160>1
<210>1
<211>520bp
<212>dna
<213>penicilliumsp.
<400>1
gcatcgatgaagaacgcagcgaaatgcgataactaatgtgaattgcagaattcagtgaat60
catcgagtctttgaacgcacattgcgccccctggtattccggggggcatgcctgtccgag120
cgtcattgctgccctcaagcacggcttgtgtgttgggcctccgtccccccgccccggggg180
gacgggcccgaaaggcagcggcggcaccgtgtccggtcctcgagcgtatggggctttgtc240
acccgctctgtaggcccggccggcgcctgccgacccccaatcatccttttttttcaggtt300
gacctcggatcaggtagggatacccgctgaacttaagcatatcaataagcggaggaaaag360
aaaccaacagggattgccccagtaacggcgagtgaagcggcaagagctcaaatttgaaag420
ctggctccttcggggtccgcattgtaatttgcagaggatgcttcgggagcggtccccatc480
taagtgccctggaacgggctgtcatagagggtgagaatcc520
- 还没有人留言评论。精彩留言会获得点赞!