闭管可视化鳗源嗜水气单胞菌环介导等温扩增检测方法与流程
本发明涉及水生动物病原微生物检测,尤其是涉及一种基于环介导恒温扩增技术的快速闭管可视化式、检测鳗鲡致病性嗜水气单胞菌气单胞菌的方法。
背景技术:
鳗鲡(anguillaspp.)是世界名贵经济鱼类,鳗鲡养殖在我国已有近30年的历史,养殖产量约占全球的70%,是我国出口创汇的重要产业之一。然而,在集约化高密度养殖过程中,鳗鲡细菌性疾病的爆发,严重制约了中国鳗鲡养殖业的健康可持续性发展(熊静等.2017.7株鳗鲡致病性气单胞菌毒力基因胞外产物及其活性比较,华中农业大学学报,2017,36(1):76-85)。嗜水气单胞菌(aermonashydrophila)是一类条件致病菌,广泛存在于水和土壤中,是我国养鱼史上引发危害面积最大、损失最为严重的细菌性败血症的主要病原之一。该菌感染鳗鲡后导致鱼体表出血、水肿、腹部膨胀及肾脏变黑等临床症状,从而引发鱼类败血症,造成大量死亡。国内外学者普遍认为,综合预防是相对有效的方法,即尽早发现疾病并采取诸多措施阻止细菌传播。因此,建立灵敏、准确、快捷、方便的嗜水气单胞菌检测方法是减少嗜水气单胞菌的发生和危害的重要途径。传统嗜水气单胞菌检测主要是常规生化鉴定方法,由于气单胞菌属的种类繁多,而且它们的生化性状极为相似,需要采取一系列生化鉴定反应才能够鉴定到种,存在着操作繁琐、检测周期长、鉴定结果不准确等缺点,远不能满足日常快速检测工作的需要。以酶联免疫吸附试验(enzyme-linkedimmunosorbentassays,elisa)为代表的免疫学技术虽比传统鉴定方法简单、快速,但前提是必需先制备相关抗体,同时由于该方法操作步骤繁琐、影响因素较多,极易导致较高的假阳性率。以pcr技术为代表的分子生物学技术已成功应用于嗜水气单胞菌的实验室诊断,具有灵敏度高的优点,但需要依赖昂贵的热循环系统,难以在基层中普及。由日本学者notomi等提出的环介导等温扩增技术(loop-mediatedisothermalamplification,lamp)在保留原有分子生物学技术特异性强、灵敏度高等优点的基础上(notomietal.2000.loop-mediatedisothermalamplificationofdna.nucleicacidsresearch,28(12):e63),实现了恒定温度下对靶基因的高效扩增,脱离了对pcr仪等专业设备的依赖,更加适用于病原的临床检测。
这种新型核酸等温扩增技术(lamp)工作原理在于,在60~65℃时,双链dna处于变性和延伸性的动态平衡,此时,任何一个引物向双链dna的互补部位进行碱基配对延伸时,另一条链就会被解离,变成单链。基此,通过设计针对靶基因不同区域的4条特异性引物,在具有链置换活性dna聚合酶(如bst、gsp等)作用下,在恒温条件下(60~65℃)进行链置换反应,可实现1h内对靶核酸序列超过109倍的扩增效果。由于lamp是对同一段dna链上互补序列的周而复始扩增,故形成多种长短不一的茎环结构和花椰菜样结构的dna混合物,所以,扩增产物的琼脂糖电泳图呈阶梯条带状。同时,在lamp阳性反应过程中,随着核酸的大量形成,其副产物焦磷酸根可与反应液中的镁离子形成焦磷酸镁(白色沉淀),离心后,肉眼可观察到白色沉淀(morietal,2004.real-timeturbidimetryoflampreactionforquantifyingtemplatedna,journalofbiochemicalandbiophysicalmethods,59(2):145-157)。此外,由于lamp阳性反应产物为大量dna,故可通过添加与核酸结合的荧光染料,在紫外光下可观察到颜色变化(gotoetal,2009.colorimetricdetectionofloop-mediatedisothermalamplificationreactionbyusinghydroxynaphtholblue[j].biotechniques,46(3):167-172)。lamp技术在保持pcr技术优点的基础上,进一步增强了反应的特异性并缩短了检测时间;特别是它不需使用昂贵的热循环仪,在等温条件下就能完成反应,且扩增产物用肉眼能观察,可用于病原的现场快速检测。
目前,在嗜水气单胞菌检测中已有关于lamp技术的报道,例如匡燕云利用以嗜水气单胞菌的气溶素基因为靶序列,建立了扩增产物通过琼脂糖凝胶电泳进行判定的lamp方法(匡燕云,环介导等温扩增技术检测嗜水气单胞菌方法的建立,南昌大学,2007,硕士论文)。潘晓艺等和柯浩等人均以致病因子菌毛编码基因为靶序列,分别建立了扩增产物开管添加sybrgreen染料的可视化lamp方法检测嗜水气单胞菌(潘晓艺,沈锦玉,郝贵杰,姚嘉赟,徐洋,尹文林,致病性嗜水气单胞菌的lamp检测试剂盒及检测方法,专利号zl201010611571.0;柯浩,李嘉彬,马江耀,马艳平,刘振兴,郝乐,梁志凌,专利号zl201410081651.8)。王文琪等利用气溶素基因为靶序列,利用电泳方法检测扩增结果的非可视化lamp方法(王文琪,徐申波,任贻超,王鑫,张艳,一种对虾养殖中嗜水气单胞菌的lamp检测方法,专利号zl201710046232.4)。然而上述对lamp结果判定,主要通过扩增产物开盖添加染色剂、副产物白色沉淀或琼脂糖电泳实现开盖可视化或利用特殊浊度仪实现闭管,前者由于lamp扩增产物产量巨大,在开盖检测过程极易产生气溶胶等污染问题,从而可能导致假阳性结果的出现,而后者仪器价格昂贵,限制了该技术在现场检测中的应用。最近,有研究报道,在核酸等温扩增反应过程中,伴随着靶基因扩增产物的积累过程中,产生了大量的[h+],使反应体系ph下降(tanneretal,2015.visualdetectionofisothermalnucleicacidamplificationusingph-sensitivedyes.biotechniques,2015,58(2):59-68),因此,可以利用ph敏感的指示剂通过颜色变化以判断lamp反应是否发生,从而实现闭管可视化结果判定的目的。目前,尚未见ph指示剂应用于鳗源嗜水气单胞菌lamp检测的相关报道。
技术实现要素:
本发明的目的在于提供一种闭管可视化鳗源嗜水气单胞菌环介导等温扩增检测方法。
本发明包括以下步骤:
1)鳗鲡基因组提取;
在步骤1)中,所述鳗鲡基因组提取的具体方法可采用gb/t28630.2-2012提供的方法进行基因组提取或利用商品化试剂盒(天根生化科技有限公司,或generay公司)提取基因组dna;
所述采用gb/t28630.2-2012提供的方法进行基因组提取的具体方法可为:采集鳗鲡的肌肉、鳃、肝脏等病灶组织约100mg,加入300μlctab溶液研磨匀浆,后转移到1.5ml离心管中,再加入450μlctab溶液充分混匀,于25℃静置2h;再加入600μl酚-三氯甲烷-异戊醇到组织样品中,充分混匀,12000r/min,离心5min;吸取上清至新的1.5ml离心管中,加入700μl酚-三氯甲烷-异戊醇到组织样品中,充分混匀,12000r/min,离心5min;吸取上清于新的1.5ml离心管中,加入900μl预冷的无水乙醇(-20℃),混匀并静置,并于-20℃放置8h以上;12000r/min,离心30min,弃去上清,将离心管倒置在吸水纸上,37℃干燥20min;加入10μl超纯水,作为dna模板。
所述利用商品化试剂盒提取基因组dna,置于-20℃保存,所述商品化试剂盒可采用天根生化科技有限公司或generay公司产品。
2)提取致病菌基因组;
在步骤2)中,所述提取致病菌基因组的具体方法可为:将过夜培养的菌体利用商品化试剂盒提取基因组dna,置于-20℃保存,备用;或将过夜培养的菌体离心后加入到0.5mlte缓冲液或双蒸水中振荡混匀,95~100℃煮沸3~8min,10,000r/min离心取上清液,作为待检基因组dna溶液,置-20℃保存;所述商品化试剂盒可采用天根生化科技有限公司或generay公司产品。所述te缓冲液的ph可为8.0。
3)制备阳性对照;
在步骤3)中,所述制备阳性对照的具体方法可为:以阳性嗜水气单胞的基因组dna为模板,分别以gyrb和hlya靶基因的f3和b3为引物进行pcr扩增,pcr反应体系(20μl):2×gotaq@greenmastermix(promega)10μl,引物各0.5μl,模板各1.0μl,超纯水8μl;反应程序:94℃1min;94℃30s,58℃30s,72℃1min,共32个循环;72℃10min。产物经2%琼脂糖凝胶电泳后,经过胶回收后,连接进行pmd-19t载体,转化感受态细胞,测序验证,提取阳性质粒作为阳性对照,-20℃保存,备用。
4)阴性对照制备:超纯水;
5)样品检测及结果判定。
在步骤5)中,所述样品检测及结果判定的具体方法可为:取基因组dna1μl加入到lamp反应体系中,在63℃60min,95℃3min后,通过以下方式判定结果:肉眼观察;若gyrb-lamp和hlya-lamp两个反应体系的颜色与阳性对照相近,均变成亮黄色则为阳性反应,表明待检测样品中含有致病性嗜水气单胞菌;若仅有gyrb-lamp反应体系颜色变成亮黄色,则说明样品含有非溶血素基因嗜水气单胞菌;若gyrb-lamp和hlya-lamp两个反应体系颜色均与阴性对照相近,即保持反应体系原有的颜色(no.1指示剂为紫色,no.2指示剂粉红色)则为阴性反应,表明待检样品中没有嗜水气单胞菌;备选:琼脂糖凝胶电泳:2%琼脂糖凝胶中120v电压下,电泳40min,eb染色或sybrgreeni染色后,在紫外灯下观察到大小不一的条带状产物,即为阳性反应,反之,没有条带状产物,为阴性反应。
所述lamp反应体系为缓冲液体系,体积5~50μl,以25μl反应体系为例:10×buffer(80~120μm(nh4)2so4,300~700μmkcl,60~120μmmgso4,0.1%~1.5%tween-20或triton-100)2.5μl,外引物f3和b3各0.5μl,内引物fip和bip各4μl,4×dntps(20~100mm)1.4μl,模板2μl,超纯水8.1μl,bstdna合成酶1μl,染料1μl,1mkoh调整体系ph为(7.5~9.5),反应程序为60℃5min,63℃60min,95℃3min。
本发明提供2组检测鳗源致病性嗜水气单胞菌的环介导等温扩增引物组合,包括2个靶基因的外引物和内引物,所述外引物为f3和b3,所述内引物为fip和bip,鳗源致病性气单胞菌两套引物序列见表1;不同引物的最适用量比为外引物︰内引物为1︰(6~8);引物浓度范围为1~50μm,最适浓度为10μm;
表1
两种指示剂的配方及其用量范围见表2。
表2
本发明分别以嗜水气单胞菌管家基因gyrb和致病因子hlya保守序列,设计了lamp引物,建立lamp反应体系,并通过在lamp反应中添加不同的ph指示剂,以达到闭管可视化判定靶基因是否被有效扩增的效果。
本发明采用闭管可视化快速检测鳗源致病性嗜水气单胞菌的方法,因为反应产物无须通过电泳和/或开管添加入荧光染料等鉴定,因此降低了lamp产物的污染风险。
附图说明
图1为gryb-lamp和hlya-lamp反应后,不同指示剂的颜色变化情况。在图1中,图(a)为gyrb-lamp,图(b)为gyra-lamp,标记1、2和5、6为1号指示剂;3、4和7、8为2号指示剂;1,3,5,7为阳性反应结果;2,4,6,8为阴性反应结果。
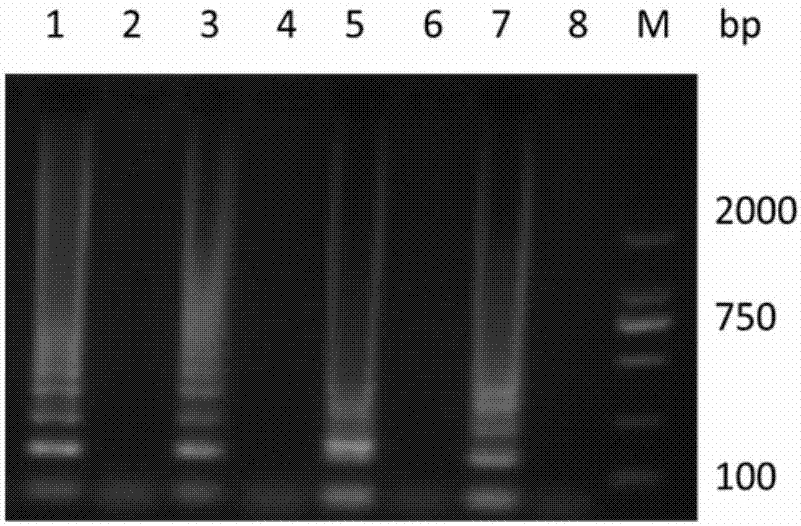
图2为gryb-lamp和hlya-lamp反应后的凝胶电泳结果。在图2中,加样同图1。
图3为gryb-lamp和hlya-lamp反应灵敏度检测结果。在图3中,标记1~6分别是10倍稀释的dna模板。a、c是1号指示剂,b、d是2号指示剂。结果显示:1号指示剂灵敏度比2号指示剂更灵敏;1号指示剂对gyrb和hlya的最低检测深度分别为20和10copies/μl。
图4为gryb-lamp和hlya-lamp反应特异性检测结果。在图4中,以2号指示剂为例;标记1~5:嗜水气单胞菌(1~4含有hlya基因),6~13:温和气单胞菌,维氏气单胞菌,豚鼠气单胞菌,2株金黄色葡萄球菌,副溶血弧菌,绿脓杆菌,肺炎克雷伯氏杆菌。结果显示:gryb-lamp和hlya-lamp反应特异性高,两个反应的配合可以有效检测鳗源致病性嗜水气单胞菌。
具体实施方式
以下实施例将结合附图对本发明作进一步的说明。
实施例1:新型环介导等温扩增技术对样品的检测
1)鳗鲡基因组提取:采用gb/t28630.2-2012提供的方法进行基因组提取。具体操作如下:采集鳗鲡的肌肉、鳃、肝脏等病灶组织约100mg,加入300μlctab溶液研磨匀浆,后转移到1.5ml离心管中,再加入450μlctab溶液充分混匀,于25℃静置2h。加入600μl酚-三氯甲烷-异戊醇到组织样品中,充分混匀,12000r/min,离心5min。吸取上清至新的1.5ml离心管中,加入700μl酚-三氯甲烷-异戊醇到组织样品中,充分混匀,12000r/min,离心5min。吸取上清于新的1.5ml离心管中,加入900μl预冷的无水乙醇(-20℃),混匀并静置,并于-20℃放置8h以上。12000r/min,离心30min,弃去上清,将离心管倒置在吸水纸上,37℃干燥20min。加入10μl超纯水,作为dna模板。
或利用其他商品化试剂盒(天根生化科技有限公司,或generay公司)提取基因组dna,置于-20℃保存,备用。
2)致病菌基因组提取:
将过夜培养的菌体利用商品化试剂盒(天根生化科技有限公司,或generay公司)提取基因组dna,置于-20℃保存,备用。或将过夜培养的菌体离心后加入到0.5mlte缓冲液(ph8.0)或双蒸水中振荡混匀,95~100℃煮沸3~8min,10,000r/min离心取上清液,作为待检基因组dna溶液,置-20℃保存。
3)阳性对照的制备:以阳性嗜水气单胞的基因组dna为模板,分别以gyrb和hlya靶基因的f3和b3为引物进行pcr扩增。pcr反应体系(20μl):2×gotaq@greenmastermix(promega)10μl,引物各0.5μl,模板各1.0μl,超纯水8μl。反应程序:94℃1min;94℃30s,58℃30s,72℃1min,共32个循环;72℃10min。产物经2%琼脂糖凝胶电泳后,经过胶回收后,连接进行pmd-19t载体,转化感受态细胞,测序验证,提取阳性质粒作为阳性对照,-20℃保存,备用。
4)阴性对照制备:超纯水。
5)样品检测及结果判定:取基因组dna1μl加入到lamp反应体系中,在63℃60min,95℃3min后,通过以下方式判定结果:肉眼观察。若gyrb-lamp和hlya-lamp两个反应体系的颜色与阳性对照相近,均变成亮黄色则为阳性反应,表明待检测样品中含有致病性嗜水气单胞菌;若仅有gyrb-lamp反应体系颜色变成亮黄色,则说明样品含有非溶血素基因嗜水气单胞菌;若gyrb-lamp和hlya-lamp两个反应体系颜色均与阴性对照相近,即保持反应体系原有的颜色(no.1指示剂为紫色,no.2指示剂粉红色)则为阴性反应,表明待检样品中没有嗜水气单胞菌(参见图1)。备选:琼脂糖凝胶电泳:2%琼脂糖凝胶中120v电压下,电泳40min,eb染色或sybrgreeni染色后,在紫外灯下观察到大小不一的条带状产物,即为阳性反应,反之,没有条带状产物,为阴性反应(参见图2)。
实施例2:鳗源嗜水气单胞菌的闭管可视化环介导等温扩增技术的灵敏度
分别以嗜水气单胞菌gyrb基因和hlya基因阳性质粒为模板,进行10倍比稀释,模板中靶基因gyrb拷贝数分别为2.0×106、2.0×104、2.0×103、2.0×102、2.0×101、2.0×100(copy/μl);靶基因hlya拷贝数分别是1.1×106、1.1×1041.1×103、1.1×102、1.1×101、1.1×100(copy/μl)的和阴性对照,同时采用优化的lamp反应体系及程序进行lamp反应,反应体系为25μl。通过实施例1中的肉眼观察变化和电泳检测以判断所检测样品的结果。结果显示,靶基因gyrb拷贝数大于或等于20copy/μl或靶基因hlya拷贝数大于或等于11copy/μl的模板,检测结果为阳性,gyrb拷贝数2偶尔出现阳性结果,阴性对照的结果均呈现为阴性反应,说明该方法针对嗜水气单胞菌管家基因gyrb扩增的灵敏度为20copy/μl,对溶血素基因hlya的扩增的灵敏度为11copy/μl(参见图3)。gryb-lamp和hlya-lamp反应特异性检测结果参见图4。
实施例3:鳗源嗜水气单胞菌闭管可视化的环介导等温扩增技术的特异性
以pcr检测为阳性的样本10份和阴性的样本10份,相应的鳗鲡组织dna为模板;或5株嗜水气单胞菌(aeromonashydrophila,其中4株含有hlya基因)、1株温和气单胞菌(a.sobria)、1株维氏气单胞菌(a.veronii)、1株豚鼠气单胞菌(a.caviae)、2株金黄色葡萄球菌(staphylococcusaureus)、1株副溶血弧菌(vibrioparahemolyticus)、1株绿脓杆菌(pseudomonasaeruginosa)和1株肺炎克雷伯氏杆菌(klebsiellapneumoniae)的基因组为模板,利用优化的lamp反应体系和反应程序,以实施例1所制备的阴性和阳性对照为参比。通过实施例1中的肉眼观察变化和电泳检测以判断所检测样品的结果。结果显示,仅20份嗜水气单胞菌阳性标本和4株纯培养物的检测结果呈现阳性,其余均为阴性结果,与预期结果相同,即表明该方法特异性强。
本发明的gyrb-lamp和hlya-lamp检测技术的优势:
1)分别利用管家基因gyrb和毒力基因hlya建立了鳗源致病性嗜水气单胞菌的检测,双重检测,结果互相印证,提高了检测的可靠性。
2)本发明反应从起始到结果判断定均在完全闭管状态,无需开管检测反应产物。
3)本发明提供2种优选指示剂,其阳性和阴性反应结果颜色差异大,难以发生结果误判。
4)本发明的检测方法特异性强:对温和气单胞菌、维氏气单胞、豚鼠气单胞菌、副溶血弧菌、绿脓杆菌、嗜肺巴斯德杆菌、肺炎克雷伯氏菌等多种病原菌,均无阳性扩增结果。
5)灵敏度高,两个靶基因dna最低检出率分别为20和11copy/μl。
6)该方法结合简易的基因组核酸提取技术,具有良好野外及资源有限的基层实验室检测应用的前景。
序列表
<110>集美大学
<120>闭管可视化鳗源嗜水气单胞菌环介导等温扩增检测方法
<130>2017
<160>8
<170>patentinversion3.3
<210>1
<211>18
<212>dna
<213>嗜水气单胞菌
<400>1
gcgatgcagtggaacgac18
<210>2
<211>17
<212>dna
<213>嗜水气单胞菌
<400>2
cactggcggcagacttg17
<210>3
<211>35
<212>dna
<213>嗜水气单胞菌
<400>3
taccaccatcgcgctgcggcctaccaggaaggggt35
<210>4
<211>39
<212>dna
<213>嗜水气单胞菌
<400>4
ccacctggtgggcttccgtgccttcttgctgtagtcctc39
<210>5
<211>20
<212>dna
<213>嗜水气单胞菌
<400>5
ttctacctcaacgtcaaccg20
<210>6
<211>16
<212>dna
<213>嗜水气单胞菌
<400>6
ccggccgactcttcgt16
<210>7
<211>43
<212>dna
<213>嗜水气单胞菌
<400>7
tcgcagaacagccggtcgcttttaagatcagcgatgccgagtg43
<210>8
<211>43
<212>dna
<213>嗜水气单胞菌
<400>8
ctccctgcaatttggcaacaccttttccagcgagatccgcact43
- 还没有人留言评论。精彩留言会获得点赞!