一种检测小麦抗赤霉病基因PFT的标记及使用方法与流程
本发明属于生物技术领域,具体涉及一种检测小麦抗赤霉病基因pft的标记及使用方法。
背景技术:
由禾谷镰刀菌等引起的小麦赤霉病(fusariumheadblight,fhb)是一种广泛流行的真菌病害,严重影响小麦产量和品质。我国长江中下游和东北麦区是其常发、重发区域。近年来,受全球气候变化、小麦–玉米轮作制度下秸秆还田的普及等影响,该病呈扩张、加重趋势,已成为黄淮麦区常发病害。当前我国小麦赤霉病年均发生面积超过533.3万hm2,其中2012、2015和2016年尤其严重。如江苏省2012~2015年均发生面积约120万hm2,超过该省小麦种植面积50%;河南省2012年发生最为严重,面积为339.7万hm2,2016年次之,为174.0万hm2。感病籽粒含真菌毒素,如脱氧雪腐镰刀菌烯醇(deoxynivalenol,don),危害人畜健康,严重影响食用和饲用。
培育抗病品种是降低赤霉病危害的经济有效手段。国内外对赤霉病抗性遗传进行了大量研究,已定位约100个抗赤霉病qtl,分布在小麦所有染色体。fhb1~fhb7等7个抗病基因被正式命名,其中来自苏麦3号位于3b染色体短臂的fhb1抗性最强且稳定。在不同遗传背景下,fhb1的作用略有差异,高病害压力下平均可降低赤霉病严重度20%左右。fhb1还可将don转化为低毒的脱氧雪腐镰刀菌烯醇-3-葡萄糖苷(don-3g),减轻毒素危害。
fhb1在赤霉病重发的北美春麦区得到较为广泛应用,如美国北达科他州立大学利用苏麦3号育成抗赤霉病硬红春小麦品种alsen,年推广面积95万hm2,占该州小麦种植面积的1/3左右,标记检测含fhb1。明尼苏达大学利用fhb1分子标记辅助育成了抗赤霉病品种sabin,且该校当前选育的多数品种(系)含此基因。日本品种nobeokabouzukomugi、nyubai和shinchunaga等也含fhb1,其中shinchunaga作为赤霉病抗源在日本得到广泛应用。
赤霉病抗性鉴定受环境影响大,分子标记辅助选择是培育抗病品种的首选技术。fhb1已被证明是抗性最强且稳定的抗赤霉病基因,当前利用标记辅助选择fhb1的限制因素是没有低成本的诊断性标记,虽其连锁标记xgwm493、xgwm533、umn10和xsnp3bs-8等在育种中有一定应用,但均受遗传背景影响较大。最近rawat等克隆了该基因,为pft(pore-formingtoxin-like)类型,全长3472bp,含两个外显子,一个内含子,编码嵌合凝集素蛋白,为开发其诊断性标记提供了重要信息。
技术实现要素:
本发明的第一个目的是提供一种检测或辅助检测小麦抗赤霉病基因pft的引物对。
本发明提供的检测或辅助检测小麦抗赤霉病基因pft的引物对由引物1和引物2组成;
所述引物1为序列1所示的单链dna分子;
所述引物2为序列2所示的单链dna分子。
上述引物对中,所述引物1和所述引物2的摩尔量比为1:1。
本发明的第二个目的是提供检测或辅助检测小麦抗赤霉病基因pft的pcr试剂。
本发明提供的检测或辅助检测小麦抗赤霉病基因pft的pcr试剂包括上述引物对。
上述pcr试剂中,所述引物1和所述引物2在所述pcr试剂中的终浓度均为0.25μmol/l。
本发明的第三个目的是提供一种检测或辅助检测小麦抗赤霉病基因pft的试剂盒。
本发明提供的检测或辅助检测小麦抗赤霉病基因pft的试剂盒包括上述引物对或上述pcr试剂。
本发明的第四个目的是提供上述引物对或上述pcr试剂或上述试剂盒的新用途。
本发明提供了上述引物对或上述pcr试剂或上述试剂盒在如下1)-4)中任一种中的应用:
1)检测或辅助检测待测小麦抗赤霉病基因pft;
2)辅助选育抗赤霉病小麦品种;
3)制备检测或辅助检测待测小麦赤霉病抗性基因pft的产品;
4)制备选育抗赤霉病小麦品种的产品。
本发明的第五个目的是提供一种检测或辅助检测待测小麦抗赤霉病基因pft的方法。
本发明提供的检测或辅助检测待测小麦抗赤霉病基因pft的方法包括如下步骤:
用上述引物对对待测小麦进行pcr扩增,得到扩增产物,用draⅰ酶切所述pcr扩增产物,得到酶切产物;根据所述pcr扩增产物和所述酶切产物判断待测小麦抗赤霉病基因pft等位基因:
若待测小麦有pcr扩增产物,且pcr扩增产物不能被draⅰ酶切,则待测小麦品种含有等位基因pft-ⅰ;
若待测小麦有pcr扩增产物,且pcr扩增产物能被draⅰ酶切为1567bp和709bp的两个片段,则待测小麦含有等位基因pft-ⅱ;
若待测小麦无pcr扩增产物,则待测小麦品种含有等位基因pft-ⅲ。
上述方法中,所述pcr扩增的模板为待测小麦的基因组dna。
本发明的第六个目的是提供一种选育抗赤霉病小麦品种的方法。
本发明提供的选育抗赤霉病小麦品种的方法是选择含有等位基因pft-ⅰ的小麦品种进行育种。在实际应用中,可用含等位基因pft-ⅰ的抗赤霉病亲本与不含等位基因等位基因的感赤霉病亲本杂交,在分离世代中利用上述引物对和方法选择含等位基因pft-ⅰ的单株,直至选育出含等位基因pft-ⅰ的纯合株系。如感病亲本为pft-ⅱ类型,分离世代pft-ⅰ纯合单株酶切产物仅显示一个大小为2277bp的条带,杂合单株显示三个条带,大小分别为2277bp、1567bp和709bp;如感病亲本为pft-ⅲ类型,则不需进行draⅰ酶切,仅需用上述引物对扩增分离世代各单株dna,pft-ⅰ纯合及杂合单株显示一个大小为2277bp的条带,不含pft-ⅰ单株无扩增产物。
上述应用或上述方法中,所述小麦抗赤霉病基因pft只存在于小麦3b染色体上,一个拷贝,共有如下三种等位基因:等位基因pft-ⅰ、等位基因pft-ⅱ和等位基因pft-ⅲ。所述等位基因pft-ⅰ的序列如序列3所示;所述等位基因pft-ⅱ的序列如序列4所示;所述等位基因pft-ⅲ为基因缺失。
本发明通过对204份不同品种pft基因进行pcr扩增和测序,发现该基因的3种等位基因中,pft-ⅰ和pft-ⅱ之间共有14个核苷酸差异,并根据pft基因的第1471位脱氧核糖核苷酸开发了pft基因的诊断性标记pft-caps。通过实验证明:本发明的分子标记pft-caps可用于小麦抗赤霉病基因pft的鉴定和小麦抗赤霉病分子标记辅助育种。
附图说明
图1为pft的3种等位基因。以起始密码子的第1个碱基作为+1。
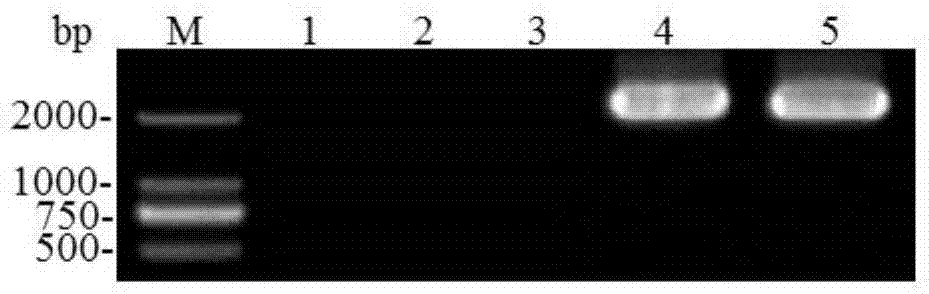
图2为用引物pft-1f和pft-2r对pft基因部分片段扩增结果。m:dl2000dnamarker;1~3为pft-ⅲ类型;4为pft-ⅰ类型;5为pft-ⅱ类型。
图3为pft-ⅱ类型中draⅰ内切酶识别序列及切割位点。以起始密码子的第1个碱基作为+1。
图4为含pft-ⅰ或pft-ⅱ的品种pft-caps标记检测。m:dl5000dnamarker;1~4为pft-ⅰ类型;5~8为pft-ⅱ类型。
图5为含有不同pft等位基因小麦品种的赤霉病病情指数。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
实施例1、分子标记pft-caps的获得及鉴定小麦抗赤霉病基因pft的方法
一、pft的3种等位基因及多态位点的获得
1、pft扩增特异性引物的设计
以苏麦3号fhb1区段(genbank登录号:kx907434)内的pft编码区序列作为探针,在ensemblplants数据库(http://plants.ensembl.org/index.html)进行序列比对,获取各基因同源序列,以获得的同源序列和苏麦3号对应的基因序列为参照,设计扩增该基因开放阅读框(orf)3b染色体的特异引物,引物序列如表1所示。引物结合位置如图1所示。
表1、用于扩增pft基因开放阅读框(orf)的特异引物
2、pcr扩增
以204个小麦品种(品种名称及来源如表2)幼苗叶片的基因组dna为模板,采用步骤1设计的引物进行pcr扩增,得到pcr扩增产物。pcr扩增使用高保真性pcr酶kodfx(toyobo)。
3、pcr扩增产物的检测与克隆
用1.5%琼脂糖凝胶电泳检测pcr产物,溴化乙锭(ethidiumbromide,eb)染色,紫外光下成像。凝胶回收dna,连接载体后转化大肠杆菌感受态细胞并培养,每个连接转化反应挑取12个单克隆,扩大培养后由华大基因测序,或将目标dna片段回收直接测序。序列分析采用geneious10.0.7(http://www.geneious.com)软件。
结果表明:在204个小麦品种中,pft基因共有3种等位基因,分别记作pft-ⅰ、pft-ⅱ和pft-ⅲ。其中,pft-ⅰ等位基因的核苷酸序列如序列3所示,并将具有pft-ⅰ等位基因的小麦命名为pft-ⅰ类型小麦(共25份);pft-ⅱ等位基因的核苷酸序列如序列4所示,并将具有pft-ⅱ等位基因的小麦命名为pft-ⅱ类型小麦(共35份);pft-ⅲ等位基因为pft基因缺失,并将具有pft-ⅲ等位基因的小麦命名为pft-ⅲ类型小麦(共144份)。经过比对发现:pft-ⅰ等位基因和pft-ⅱ等位基因之间共有14个核苷酸差异,如图1所示。其中,12个位于内含子中,分别为pft基因的第578位、第620位、第804位、第998位、第1023位、第1182位、第1396位、第1471位、第1480位、第1493位、第1571-1572位(与pft-ⅰ相比,pft-ⅱ在序列3所示的pft-ⅰ的第1571和第1572位碱基之间插入一个碱基a)和2128位;2个位于外显子内,分别为第2255位和第2270位,位于外显子内的两个snp均属于同义突变;pft-ⅱ等位基因第2128位核苷酸(内含子内)由碱基g替换为碱基a导致mrna错误剪接,从而使该基因失去功能。
表2、不同小麦品种pft基因型及赤霉病病情指数
4、赤霉病抗性鉴定
对本研究中的204份小麦品种于2014-2016连续3年在湖北省农业科学院南湖试验田进行赤霉病接种鉴定,菌株为黄冈1号(该菌株在文献“湖北省小麦品种(系)的赤霉病抗性分析”中公开过)。试验采用完全随机区组设计,每材料种植两行,行长1m,行距0.25m,设两次重复。试验从抽穗期到调查结束采用微电脑定时弥雾装置增湿,促进发病。每小区选取10个正在开花的穗子,用浓度为1×105个ml-1分生孢子悬浮液进行喷雾接种。接种后20d调查发病穗数、每穗小穗数和病小穗数,计算病情指数(fhbindex=发病率×严重度),其中发病率为发病穗数与总穗数的比值,严重度为每穗病小穗数与小穗数比值的平均值,均以百分率计。
鉴定结果如表2所示,25份pft-ⅰ类型小麦品种平均赤霉病病情指数为51.40%;179份pft-ⅱ和pft-ⅲ类型小麦品种平均为62.04%,差异极显著(图5)。pft-ⅰ类型小麦品种赤霉病病情指数比其他两种类型小麦品种低17.15%。
二、分子标记pft-caps的获得及鉴定小麦抗赤霉病基因pft的方法
1、分子标记pft-caps的获得
根据pft基因的第1471位脱氧核糖核苷酸设计了分子标记pft-caps,分子标记pft-caps的序列如下:
pft-1f:acaggcacacacggctataaatacc(序列1);
pft-2r:agaactggatagcacgcaagcatat(序列2)。
2、pcr扩增
以204个小麦品种的基因组dna为模板,采用引物pft-1f和pft-2r进行pcr扩增,分别得到pcr扩增产物。
扩增程序为95℃预变性3min;94℃变性30s,65℃退火30s,68℃延伸2min30s,共33个循环;最后68℃延伸7min,4℃保存。pcr反应体系如表3所示。
表3、pft-caps标记pcr反应体系
对pcr产物进行琼脂糖凝胶电泳电泳并对其进行测序。结果表明:含pft-ⅰ小麦品种和含pft-ⅱ小麦品种分别扩增到2277bp和2276bp的片段,而含pft-ⅲ小麦品种无扩增产物(图2)。
3、酶切
用draⅰ内切酶分别对含pft-ⅰ小麦品种和含pft-ⅱ小麦品种pcr产物进行37℃下过夜酶切。酶切反应体系如下:pcr产物3μl,10×buffer1.5μl,draⅰ0.8μl,ddh2o9.7μl,总反应体积15μl。
对酶切产物进行电泳检测并对其进行测序。结果表明:含pft-ⅱ小麦品种的pcr产物经draⅰ酶切后可得到大小为1567bp和709bp的两个片段,而含pft-ⅰ小麦品种无法被酶切(图3和图4)。
因此,可以根据如下方法判断待测小麦品种的抗赤霉病基因pft:用引物pft-1f和pft-2r扩增待测小麦基因组dna,得到扩增产物,用draⅰ酶切扩增产物,得到酶切产物,根据扩增产物及酶切产物判断待测小麦品种的抗赤霉病基因pft:
若待测小麦品种有扩增产物,且扩增产物不能被draⅰ酶切,则待测小麦品种含有等位基因pft-ⅰ;
若待测小麦品种有扩增产物,且扩增产物能被draⅰ酶切为1567bp和709bp的两个片段,则待测小麦品种含有等位基因pft-ⅱ;
若待测小麦品种无扩增产物,则待测小麦品种含有等位基因pft-ⅲ。
- 还没有人留言评论。精彩留言会获得点赞!