用于生产活性肝细胞生长因子(HGF)的方法与流程
本发明涉及一种用于在不使用动物血清的情况下生产活性肝细胞生长因子激活物(在本文中也称为“活性hgfa”)和活性肝细胞生长因子(在本文中也称为“活性hgf”)的方法。
背景技术:
hgf是从人类暴发型肝炎患者的血浆中纯化的、具有肝实质细胞增殖活性的因子(专利文献1和非专利文献1),并且已经被报道具有各种药理学效果,例如抗肿瘤效果、增强细胞介导的免疫、伤口治疗效果和组织再生促进效果(专利文献2)。
迄今为止,已经通过重组dna技术克隆并产生了编码上述hgf的基因(专利文献3-5)。此外,已知hgf呈单链和双链形式,其由2种类型的亚基构成(大约60kda的α链和大约30kda的β链),其中单链形式不具有生物活性并以双链形式获得生物活性。此外,已知在通过重组dna技术的生产中,hgf可以在用动物血清的培养中作为活性双链形式获得,但是在不用动物血清的培养中,生产的大部分hgf是作为无活性单链形式获得的(例如,专利文献6)。由于动物血清中含有的蛋白酶参与从单链无活性肝细胞生长因子形式(在本文中也称为“前hgf”)到双链活性hgf形式的转化,因此认为有必要使用动物血清以有效获得活性hgf。
另一方面,近年来,通过重组dna技术生产生物材料的主流是在没有动物血清的情况下进行培养以避免病毒污染等风险。因此,为了用无动物血清的培养基生产活性hgf,有必要通过一些手段将单链前-hgf形式转化为活性hgf。已知可以将前-hgf转化为活性hgf的hgfa(专利文献7)、或丝氨酸蛋白酶如尿激酶型纤溶酶原激活物(非专利文献2)是此类手段。然而,存在如下问题:可以将前-hgf转化为活性hgf的这些酶是血清来源的,并且当需要通过将基因整合到微生物或动物细胞中进行生产来生产这些酶时,它们作为前体形式在无血清培养中生产并且因此难以原样使用。
引用列表
专利文献
[专利文献1]日本公开的未经审查的专利申请公开号s63-22526
[专利文献2]日本专利号2747979
[专利文献3]日本专利号2577091
[专利文献4]日本专利号2859577
[专利文献5]日本专利号3072628
[专利文献6]日本专利号3213985
[专利文献7]日本公开的未经审查的专利申请公开号h5-103670
非专利文献
[非专利文献1]j.clin.invest.[临床研究杂志],81,414(1988)
[非专利文献2]jgh[jgh杂志]26(2011)增刊1;188-202,第192页
技术实现要素:
发明欲解决的问题
本发明的目的是提供一种用于在不使用动物血清的情况下生产活性hgfa和活性hgf的方法。
本发明的另一个目的是提供通过本发明的方法生产的活性hgfa、活性hgf及其制剂。
解决问题的技术手段
作为本发明人为解决上述问题而进行的广泛研究的结果,发现通过在无血清的培养基中对表达无活性肝细胞生长因子激活物(前-hgfa)的哺乳动物细胞进行培养以获得其培养上清液,并通过对上述培养上清液进行特定处理,前述培养上清液中含有的前-hgfa可以转化为活性hgfa。因此,由于用动物血清的培养中生产的前-hgf可以通过在不用动物血清的培养中类似地生产的活性hgfa被转化为活性hgf,因此可以生产不含动物血清来源组分的活性hgf或包含其的制剂。
因此,本发明涵盖以下方面:
[1]一种用于生产活性肝细胞生长因子激活物(hgfa)的方法,该方法的特征在于其包括:
步骤1:
通过在无血清的培养基中对表达无活性肝细胞生长因子激活物(前-hgfa)的哺乳动物细胞进行培养来获得包含前-hgfa的培养上清液的步骤,和
步骤2:
将包含在上述步骤中获得的前-hgfa的该培养上清液调节至弱酸性以将前-hgfa转化为活性hgfa的步骤。
[2]根据[1]所述的生产方法,其特征在于所述步骤进一步包括向所述培养上清液中添加硫酸化多糖。
[3]根据[1]或[2]所述的生产方法,其特征在于将该培养上清液调节至弱酸性的所述步骤是将ph调节至4.0-6.0的步骤。
[4]根据[1]至[3]中任一项所述的生产方法,其特征在于所述将该培养上清液调节至弱酸性的所述步骤在是15℃-40℃的温度进行。
[5]根据[1]至[4]中任一项所述的生产方法,其特征在于所述培养上清液是在培养物中的哺乳动物细胞的存活率下降后获得的。
[6]根据[1]至[5]中任一项所述的生产方法,其特征在于所述哺乳动物细胞是中国仓鼠卵巢(cho)细胞。
[7]根据[1]至[6]中任一项所述的生产方法,其特征在于所述前-hgfa具有seqidno.2中所示的氨基酸序列。
[8]根据[1]至[7]中任一项所述的生产方法,其特征在于所述培养上清液是所述培养上清液本身、所述培养上清液的稀释液、所述培养上清液的浓缩物或所述培养上清液的部分纯化的产物。
[9]活性hgfa,该活性hgfa的特征在于其是通过根据[1]至[8]中任一项所述的生产方法获得的。
[10]一种用于生产活性肝细胞生长因子(hgf)的方法,该方法的特征在于其包括允许活性hgfa作用于包含无活性肝细胞生长因子(前-hgf)的培养上清液以将所述前-hgf转化为活性hgf的步骤,
其中
包含前-hgf的所述培养上清液是通过在无血清的培养基中对表达前-hgf的细胞进行培养而获得的培养上清液,并且
所述活性hgfa是通过根据[1]至[8]中任一项所述的方法生产的。
[11]根据[10]所述的生产方法,其特征在于用于培养表达前-hgf的细胞的所述培养基是不含任何动物来源组分的培养基。
[12]根据[10]或[11]所述的生产方法,其特征在于所述前-hgf具有seqidno.1中所示的氨基酸序列。
[13]活性hgf,该活性hgf的特征在于其是通过根据[10]至[12]中任一项所述的生产方法获得的。
本领域技术人员应认识到,上述的本发明的一个或多个特征的任何组合的发明也涵盖于本发明的范围内。
发明效果
根据本发明,提供了一种用于不使用动物血清的情况下生产活性hgfa和活性hgf的方法。
在本发明的用于生产活性hgf的方法中,由于在其生产方法中不需要使用任何动物血清,包含通过上述生产方法获得的活性hgf的组合物不包含动物血清来源组分并且可以非常安全地应用于人类。
附图说明
图1示出了通过激活前-hgfa培养上清液所制备的hgfa培养上清液激活了源自包含前-hgf的cho细胞的培养上清液中的前-hgf。
图2示出了关于前-hgfa培养上清液被激活的条件的采用实验设计(doe)的验证结果。
图3示出了色谱纯化后的sds-page,所述色谱纯化采用多峰阴离子交换剂captoadhere作为色谱载体并采用包含0.25m精氨酸和0.7m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0)作为洗脱液。
图4示出了色谱纯化后的sds-page,所述色谱纯化采用多峰阴离子交换剂captoadhere作为色谱载体并采用包含1m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0)作为洗脱液。
图5示出了纯化的产物在每个纯化阶段的非还原性和还原性sds-page结果,其中用包含未被hgfa培养上清液激活的前-hgf的培养上清液进行与实例5类似的纯化。
图6示出了测量在tgfβ的存在下,对实例5中获得的纯化的hgf的细胞增殖活性的结果。
具体实施方式
除非另有明确说明,否则本文提及的“活性肝细胞生长因子(活性hgf)”被解释为是指双链激活的hgf形式,并且与非活性肝细胞生长因子(前-hgf)区别使用,所述非活性肝细胞生长因子(前-hgf)呈其单链无活性形式。
在本发明中,hgf可以包含源自人、小鼠、大鼠、兔或其他动物的hgf。在本发明中,hgf优选地是源自人的hgf。
在本发明中,人hgf(hhgf)包括具有seqidno.1所示的氨基酸序列的多肽或其变体。具有seqidno.1所示的氨基酸序列的多肽的变体包括具有如下氨基酸序列的多肽、以及具有如下hgf活性或者可以被激活以具有如下hgf活性的多肽,所述氨基酸序列具有对seqidno.1所示氨基酸序列的一个或多个氨基酸的添加、缺失或取代,所述hgf活性类似于具有seqidno.1所示的氨基酸序列的多肽的hgf活性或比其更多。本文使用的“多个”是2-150个,更优选地是2-80个,更优选地是2-70个,更优选地是2-60个,更优选地是2-50个,更优选地是2-40个,更优选地是2-30个,更优选地是2-20个,更优选地是2-10个,或更优选地是2-5个。
具有seqidno.1所示的氨基酸序列的多肽的变体还包括具有如下氨基酸序列的多肽、以及具有如下hgf活性或者可以被激活以具有如下hgf活性的多肽,所述氨基酸序列示出与seqidno.1中所示的氨基酸序列具有至少80%,更优选地至少85%,并且更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性,所述hgf活性类似于具有seqidno.1所示的氨基酸序列的多肽的hgf活性或比其更多。
具有seqidno.1所示的氨基酸序列的多肽的变体还包括具有由如下多核苷酸编码的氨基酸序列的多肽、以及具有如下hgf活性或者可以被激活以具有如下hgf活性的多肽,所述多核苷酸在严格条件下与编码seqidno.1所示的氨基酸序列的多核苷酸杂交,所述hgf活性类似于具有seqidno.1所示的氨基酸序列的多肽的hgf活性或比其更多。
在本发明中,“严格条件”可以包括以下那些:其中在杂交后洗涤中,杂交在例如“2xssc、0.1%sds、50℃”的条件、“2xssc、0.1%sds、42℃”的条件、或“1xssc、0.1%sds、37℃”的条件下进行洗涤来实现;并且更严格条件可以包括以下那些:其中杂交在例如“2xssc、0.1%sds、65℃”、“0.5xssc、0.1%sds、42℃”、“0.2xssc、0.1%sds、65℃”或“0.1xssc、0.1%sds、65℃”的条件下进行洗涤来实现(1xssc是150mm氯化钠,15mm柠檬酸钠,ph7.0)。更具体地,作为采用rapid-hyb缓冲液(阿默舍姆生命科学公司(amershamlifescience))的方法,可以想象在68℃进行预杂交持续30分钟或更长时间,这之后添加探针并保留在68℃持续1小时或更长时间以允许杂交体的形成,并且然后在室温在2xssc和0.1%sds中洗涤三次持续20分钟,在1xssc和0.1%sds在37℃洗涤三次持续20分钟,并且最后在1xssc和0.1%sds在50℃洗涤两次持续20分钟。更优选地,使用溶液(例如,包含5xssc、7%(w/v)sds、100μg/ml变性鲑鱼精子dna、和5xdenhardt溶液(1x登哈特氏溶液(denhardt′ssolution)包含0.2%聚乙烯吡咯烷酮、0.2%牛血清白蛋白和0.2%ficoll))作为预杂交和杂交溶液,在65℃进行预杂交持续30分钟至1小时,并在相同温度下进行杂交过夜(6-8小时)。此外,还可以在55℃在expresshyb杂交溶液(clontech公司)中进行例如预杂交持续30分钟或更长时间,添加标记的探针并在37℃-55℃孵育1小时或更长时间,并且在室温在2xssc和0.1%sds中洗涤三次持续20分钟并且然后在37℃在1xssc和0.1%sds洗涤一次持续20分钟。这里,更严格的条件可以通过例如提高预杂交、杂交或第二次洗涤的温度来实现。例如,在更严格条件下,预杂交和杂交的温度可以是60℃、或65℃或68℃。除了例如这种缓冲液的盐浓度和温度之类的条件之外,通过考虑各种条件,例如其他探针浓度、探针长度和反应时间,本领域技术人员将能够为本发明的基因设定条件以获得源自其他生物物种的同种型、等位基因变体和相应基因。对于杂交方法的详细方案,可以参考“molecularcloning,alaboratorymanual[分子克隆:实验室手册]第二版”(coldspringharborpress[冷泉港出版社](1989);尤其是第9.47节-第9.58节)、“currentprotocolsinmolecularbiology[分子生物学当前方案]”(johnwiley&sons[约翰威利父子公司](1987-1997);尤其是第6.3节-第6.4节),“dnacloning1:coretechniques,apracticalapproach[dna克隆1:核心技术,实用方法]第二版”(oxforduniversity[牛津大学](1995);条件尤其见第2.10节)等。
除非另有明确说明,否则本文提及的“活性肝细胞生长因子激活物(活性hgfa)”被解释为是指激活的hgfa,并且与非活性肝细胞生长因子激活物(前-hgfa)区别使用,所述非活性肝细胞生长因子激活物(前-hgfa)呈其无活性形式。
在本发明中,hgfa可以包括源自人、小鼠、大鼠、兔或其他动物的hgfa。在本发明中,hgfa优选地是源自人的hgfa。
在本发明中,人hgfa包括具有seqidno.2所示的氨基酸序列的多肽或其变体。具有seqidno.2所示的氨基酸序列的多肽的变体包括具有如下氨基酸序列的多肽、以及具有如下hgf活性或者可以被激活以具有如下hgf活性的多肽,所述氨基酸序列具有对seqidno.2所示氨基酸序列的一个或多个氨基酸的添加、缺失或取代,所述hgf活性类似于具有seqidno.2所示的氨基酸序列的多肽的hgf活性或比其更多。本文使用的“多个”是2-150个,更优选地是2-80个,更优选地是2-70个,更优选地是2-60个,更优选地是2-50个,更优选地是2-40个,更优选地是2-30个,更优选地是2-20个,更优选地是2-10个,或更优选地是2-5个。
具有seqidno.2所示的氨基酸序列的多肽的变体还包括具有如下氨基酸序列的多肽、以及具有如下hgfa活性或者可以被激活以具有如下hgfa活性的多肽,所述氨基酸序列示出与seqidno.2中所示的氨基酸序列具有至少80%,更优选地至少85%,并且更优选地至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性,所述hgfa活性类似于具有seqidno.2所示的氨基酸序列的多肽的hgfa活性或比其更多。
具有seqidno.2所示的氨基酸序列的多肽的变体还包括具有由如下多核苷酸编码的氨基酸序列的多肽、以及具有如下hgf活性或者可以被激活以具有如下hgf活性的多肽,所述多核苷酸在严格条件下与编码seqidno.2所示的氨基酸序列的多核苷酸杂交,所述hgf活性类似于具有seqidno.2所示的氨基酸序列的多肽的hgf活性或比其更多。
以下详细描述本发明。
在一方面,本发明涉及用于在不使用动物血清的情况下生产活性hgfa的方法。具体地,用于生产本发明的活性hgfa的方法是通过对包含在哺乳动物细胞中重组表达的前-hgfa的培养上清液进行给定处理从而允许其转化为活性hgfa来生产活性hgfa的方法。由于动物血清不用于转化为活性hgfa,根据本方法,所获得的前-hgfa或包含其的组合物具有显著更低的带来被感染性物质(例如源自其他动物物种或其他个体的细胞的病毒)污染的风险的可能性,并且可以作为高度安全的生物材料用于各种目的。
具体地,在一个实施例中,用于生产本发明的活性hgfa的方法的特征在于其包括以下步骤:
步骤1:
通过在无血清的培养基中对表达前-hgfa的哺乳动物细胞进行培养来获得包含前-hgfa的培养上清液的步骤,和
步骤2:
将包含在上述步骤中获得的前-hgfa的该培养上清液调节至弱酸性以将前-hgfa转化为活性hgfa的步骤。
在另一个实施例中,本发明的hgfa生产方法的特征在于其包括将包含前-hgfa的培养上清液调节至弱酸性以将前-hgfa转化为活性hgfa的步骤,其中所述培养上清液是通过在无血清的培养基中对表达前-hgfa的哺乳动物细胞进行培养而获得的培养上清液。
培养上清液的弱酸化是将前-hgfa转化为活性hgfa的处理。由于从前-hgfa转化为活性hgfa是仅通过弱酸化而没有向培养上清液外部添加酶等发生的,因此认为哺乳动物细胞来源的组分参与从前-hgfa向活性hgfa的转化,并且弱酸化是用于激活所述哺乳动物细胞来源组分的手段。弱酸化可以通过本领域技术人员熟知的手段(例如添加像适当浓度的酸性溶液(无机酸如盐酸、硫酸和磷酸,或有机酸如乙酸、琥珀酸和柠檬酸))进行。在本发明的一个实施例中,“弱酸性”是ph4.0-6.0、优选地是5.0-6.0、并且更优选地是5.3-5.6(例如ph5.5)的范围。
在本发明中,“包含前-hgfa的培养上清液”(在本文中也称为“前-hgfa培养上清液”)是通过对表达前-hgfa的哺乳动物细胞进行细胞培养所获得的包含前-hgfa的级分,其可以由本领域技术人员根据常规方法从所述哺乳动物细胞的细胞培养物中获得。例如,前-hgfa培养上清液可以是其中通过例如离心的手段从所述哺乳动物细胞的细胞培养物中除去了残留物的级分。
在本发明中,培养上清液可以是通过对培养上清液进行任何处理达到前-hgfa的生物活性不丧失的程度所制备的任何级分。因此,在本发明中,培养上清液包括但不限于培养上清液本身,以及培养上清液的稀释液、浓缩物或部分纯化的产物。
在本发明的一个优选的实施例中,“将前-hgfa转化为活性hgfa的步骤”进一步包括向所述培养上清液中添加硫酸化多糖。通过添加硫酸化多糖,可以更有效地进行从前-hgfa向活性hgfa的转化。添加硫酸化多糖的时间可以是在所述培养上清液的弱酸化之前、与弱酸化同时、或在弱酸化之后的任何时间点。此外,添加的硫酸化多糖的量可以根据例如所使用的硫酸化多糖的类型而变化,并且可以以0.01mg-50mg的量添加,更优选地以0.1mg-20mg的量添加,例如以每1ml所述的前-hgfa培养上清液1mg的量添加。
可用于生产本发明的活性hgfa的方法的硫酸化多糖可以包括但不限于肝素、硫酸葡聚糖、硫酸软骨素、岩藻多糖及其盐。在本发明的一个优选的实施例中,使用硫酸葡聚糖。
在本发明的一个优选的实施例中,“将前-hgfa转化为活性hgfa的步骤”是在15℃-40℃的温度,优选地在20℃-37℃的温度(例如25℃的温度)进行。通过采用所述温度范围,可以使pro-hgfa向活性hgfa的转化更有效。
在用于生产本发明的活性hgfa的方法中,“将前-hgfa转化为活性hgfa的步骤”进行足够长的时间以在弱酸化后识别所需的hgfa活性。这样的时间长度可以根据ph,组合使用的硫酸化多糖的存在或不存在、以及温度条件等而变化,并且可以是弱酸化后的1-15小时,例如6-8小时。
在本发明的一个实施例中,前-hgfa培养上清液是在培养物中的哺乳动物细胞的存活率下降后获得的培养上清液。随着哺乳动物细胞的存活率的下降,参与从前-hgfa向活性hgfa的转化的动物细胞来源组分被从死细胞中洗脱出来,并且可以在前-hgfa培养上清液中充分收集。“培养物中的哺乳动物细胞的存活率的下降”在本文中是指在增殖至最大细胞密度后哺乳动物细胞的存活率的下降。在本发明中,前-hgfa培养上清液中的哺乳动物细胞的存活率优选地为95%或更低,更优选地为80%或更低,例如70%。
由于源自宿主细胞溶酶体的酶被认为参与从前-hgfa向活性hgfa的激活,因此可以添加源自溶酶体的酶以施加处理。
可用于生产本发明的活性hgfa的方法中的哺乳动物细胞可以包括但不限于中国仓鼠卵巢(cho)细胞、hela细胞、hek细胞(包括hek293细胞)、cos细胞、ns0小鼠骨髓瘤细胞、sp2/0小鼠骨髓瘤细胞等。在本发明的一个优选的实施例中,cho细胞被用作表达前-hgfa的哺乳动物细胞。
本发明还涉及包含活性hgfa或通过用于生产本发明的活性hgfa的方法生产的活性hgfa的组合物。由于包含活性hgfa或本发明的活性hgfa的组合物可以在不使用动物血清的情况下从不使用动物血清的重组表达的前-hgfa中生产,因此它可以用作高度安全的生物材料例如用于生产如下所述的活性hgf的方法。
在另一方面,本发明涉及用于生产活性hgf的方法。用于生产本发明的活性hgf的方法包括允许通过用于生产本发明的活性hgfa的方法获得的活性hgfa作用于包含在类似地无血清的培养基中重组表达的前-hgf的培养上清液,以将前-hgf转化活性hgf。根据该方法,由于活性hgf可以在包括获得用于转化为活性hgf的活性hgfa的所有步骤中在不采用动物血清的情况下生产,因此获得的活性hgf或包含其的组合物可以用作高度安全的药物材料,该药物材料消除了被感染性物质(例如病毒)污染的风险。
具体地,在一个实施例中,用于生产本发明的活性hgf的方法的特征在于其包括允许活性hgfa作用于包含前-hgf的培养上清液以将所述前-hgf转化为活性hgf的步骤,
其中
包含前-hgf的所述培养上清液是通过在无血清的培养基中对表达前-hgf的细胞进行培养而获得的培养上清液,并且
所述活性hgfa是通过上述用于生产本发明的活性hgfa的方法制备的。
此外,在另一个实施例中,用于生产本发明的活性hgf的方法的特征在于其包括以下步骤:
步骤a:
将包含前-hgfa的培养上清液调节至弱酸性以将前-hgfa转化为活性hgfa的步骤,其中所述培养上清液是通过在无血清的培养基中对表达前-hgfa的哺乳动物细胞进行培养而获得的培养上清液,
步骤b:
通过在无血清的培养基中对表达前-hgf的细胞进行培养来获得包含前-hgf的培养上清液的步骤,
步骤c:
允许在所述步骤a中获得的活性hgfa作用于包含于所述步骤b中获得的前-hgf的培养上清液,以将所述前-hgf转化为活性hgf的步骤。
在本发明中,“包含前-hgf的培养上清液”是包含通过对表达前-hgf的细胞进行培养所获得的前-hgf的级分,并且本领域技术人员可以根据常规手段从所述细胞的培养物中将其获得。例如,包含前-hgf的培养上清液可以是其中通过例如离心的手段从所述细胞的培养物中除去了残留物的级分。
在用于生产本发明的活性hgf的方法中,通过在无血清的培养基中对表达前-hgfa的哺乳动物细胞进行培养而获得的培养上清液可以被直接使用,或者上述培养上清液的稀释液、浓缩液、或部分或完全纯化的产物可以用作允许作用于“包含前-hgf的培养上清液”的活性hgfa。
在本发明中,表达前-hgfa的哺乳动物细胞可以通过但不限于创建包含编码前-hgfa的核酸的载体、并将其引入宿主细胞哺乳动物细胞以允许转化来获得。类似地,表达前-hgf的细胞可以通过创建包含编码前-hgf的核酸的载体、并将其引入宿主细胞以允许转化来获得。
基因表达载体等可以用作上述载体。“基因表达载体”是具有表达目标核酸所具有的碱基序列的功能的载体,并且可以包括用于控制所述碱基序列的表达的启动子序列、增强子序列、阻遏物序列、绝缘子序列等。这些序列没有特别限制,只要它们在宿主细胞中起作用即可。
创建包含目的核酸的载体的手段是本领域技术人员熟知的,并且本领域技术人员可以适当地选择合适的方法。例如,这种手段可以包括但不限于利用限制酶位点的连接酶反应等(currentprotocolsinmolecularbiology[分子生物学当前方案],johnwiley&sons[约翰威利父子公司](1987)第11.4节-第11.11节;molecularcloning,alaboratorymanual[分子克隆:实验室手册]第二版,coldspringharborpress[冷泉港出版社](1989)第5.61节-第5.63节)。
表达前-hgf的细胞不受特别限制,只要它们可以表达前-hgf,并且包括例如昆虫细胞、真核细胞、哺乳动物细胞即可。优选地,就有效表达编码源自人的前-hgf的核酸而言,使用哺乳动物细胞,例如cho细胞、hek细胞(包括hek293细胞)、hela细胞、ns0细胞或sp2/0小鼠骨髓瘤细胞。在本发明的一个优选的实施例中,cho细胞用作表达前-hgf的哺乳动物细胞。
用于将上述载体引入宿主细胞的手段是熟知的,并且本领域技术人员可以适当选择合适的方法。实例可以包括但不限于将载体引入宿主细胞、电穿孔方法(chu等人(1987)nucleicacidsres.[核酸研究]15:1311-26)、阳离子脂质体方法、电脉冲穿孔方法(currentprotocolsinmolecularbiology[现行分子生物学方案],johnwiley&sons[约翰威利父子公司](1987)第9.1节-第9.9节)、使用毛细管玻璃管的直接注射方法、显微注射方法、脂质转染法(derijard(1994)cell[细胞]7:1025-37;lamb(1993)naturegenetics[自然遗传学]5:22-30;rabindran等人(1993)science[科学]259:230-4)、脂质体转染方法(赛默飞世尔科技公司(thermofisherscientific))、磷酸钙方法(chen和okayama(1987)mol.cell.biol.[分子与细胞生物学]7:2745-52)、deae葡聚糖方法(lopata等人(1984)nucleicacidsres.[核酸研究]12:5707-17;sussman和milman(1985)mol.cell.biol.[分子与细胞生物学]4:1642-3)、自由式max试剂(freestylemaxreagent,赛默飞世尔科技公司(thermofisherscientific))等。
关于用于培养表达前-hgfa的细胞和表达前-hgf的细胞的无血清的培养基,本领域技术人员可以根据所使用的宿主细胞的类型等适当地选择合适的组合物。此外,本领域技术人员也可以适当地选择其他培养条件,并且例如但不限于:培养温度可以在35.5℃-37.5℃之间适当地选择,并且该培养期可以在5-20天之间选择。对于前-hgfa,可以根据目标存活率来设定培养期。根据一般方案,培养期间的二氧化碳浓度可以是5%的co2。
在一个实施例中,用于生产本发明的活性hgf的方法的特征在于在所述步骤之后,其进一步包括纯化活性hgf的步骤。该步骤可以包括纯化可能保留在包含活性hgf的制剂中的前-hgf。
可用于本发明的纯化方法没有特别限制,只要其能够纯化同时不损失蛋白质的生理活性即可。特别地,优选使用采用本发明中的混合模式载体的色谱纯化。
混合模式载体也称为混合物模式载体,并且是色谱载体,在所述色谱载体中,具有两种或更多种类型的特性的模式的配体被结合到一个载体中。特别地,在本发明中,为了纯化活性hgf,可以通过采用具有疏水性和离子交换载体特征的混合模式载体的色谱纯化来有效地纯化活性hgf。
可用于本发明的方法的“具有疏水性和离子交换载体特征的混合模式载体”的实例可以包括但不限于captoadhere、captommc、heahypercel、ppahypercel、mephypercel、toyopearlmx-trp-650m等。
采用所述混合模式载体的色谱纯化可以通过将柱加载溶液中的活性hgf吸附到所述混合模式载体上,并且然后用缓冲液洗涤以除去杂质,然后洗脱来进行。用于除去杂质的缓冲液可以基于ph、电导率、缓冲液组分、盐浓度或添加剂(其保持作为纯化的靶标的蛋白质和载体之间的吸附,同时降低杂质与该载体之间的亲和性)来设定。
所使用柱加载溶液和缓冲液的实例包括但不限于磷酸盐、柠檬酸盐、乙酸盐、琥珀酸盐、马来酸盐、硼酸盐、tris(碱)、hepes、mes、pipes、mops、tes、或曲辛(tricine)等。
所使用的柱加载溶液和缓冲液可以包含氨基酸。此类氨基酸的实例可以包括但不限于甘氨酸、丙氨酸、精氨酸、丝氨酸、苏氨酸、谷氨酸、天冬氨酸、组氨酸、其衍生物等。
在本发明中,可以使用具有用于将活性hgf吸附到所述混合模式载体上的合适的ph和盐浓度的柱加载溶液。这样的ph范围是ph6.0-10.0,更优选地是ph7.0-9.0,例如ph8.0。此外,这种盐浓度为0.01m-5m,优选地是0.1m-2m,例如1m。上述盐浓度可以通过采用例如0.001m-4m氯化钠、氯化钾、氯化钙、柠檬酸钠、硫酸钠、硫酸铵或其组合来制备。
在本发明中,活性hgf的洗脱可以通过采用降低所述混合模式载体和活性hgf之间的亲和力的缓冲液来进行。这种缓冲液包括包含至少0.1m精氨酸、更优选地至少0.3m精氨酸、进一步更优选地至少0.4m精氨酸,例如0.7m精氨酸的缓冲液。此外,也可以采用与精氨酸组合或代替精氨酸的包含镁离子(mg2+)的缓冲液。可替代地,活性hgf的洗脱也可以通过逐步降低ph以洗脱活性hgf的逐步方法进行。
在本发明的一个实施例中,所述纯化可以进一步包括,在通过包含离子交换基团和疏水相互作用基团的混合物模式载体的纯化后,通过单个或多个另外的色谱进行纯化。这将使得能够以更高纯度获得活性hgf。这种色谱纯化包括但不限于例如采用混合模式载体、阴离子交换载体、阳离子交换载体、疏水相互作用载体、尺寸排阻载体、凝胶过滤载体、反向相载体、羟磷灰石载体、氟磷灰石载体、硫酸化纤维素载体或硫酸化琼脂糖载体等的色谱纯化。
注意,本文使用的术语是用于描述特定实施例,并非意在限制本发明。
此外,除非上下文明确地表明以另外的方式理解,本说明书中所使用的术语“包含(comprising)”意指存在所描述的项目(例如组分、步骤、要素和数字),不排除存在其他项目(例如组分、步骤、要素和数字)。
除非另外定义,本文所使用的全部术语(包括技术术语及科学术语)具有与本发明所属的技术领域的普通技术人员广泛理解的含义相同的含义。除非另有明确定义,本文所使用的术语应解释为具有与本文和相关技术领域中的含义一致的含义,不应解释为具有理想化或过于正式的含义。
例如第一和第二的术语有时是用于表达各种要素,应该认识到这些要素不受这些术语的限定。这些术语仅用于将要素与其他要素区分,例如可于不脱离本发明的范围的情况下将第一要素记为第二要素,同样地,将第二要素记为第一要素。
现在通过实例更具体地描述本发明。然而,本发明可以通过各种实施例来体现,不应解释为限于本文中所描述的实例。
实例
下面通过展示实例具体描述本发明,但本发明不受实例的限定。
[实例1]
将重组表达全长前-hgfa的cho细胞在t75烧瓶(来自康宁公司(corning),430421)的ex-cell定制设计培养基(来自safc公司)中解冻,在250ml摇瓶(来自康宁公司(corning),431144)中进行扩增培养,并且然后在7l培养罐(来自able/biott公司,bcp-07)中以121rpm设定为36.5℃培养10天。培养第10天的细胞的存活率为47.1%。培养完成后,将细胞通过离心和通过0.2μm的过滤器(来自赛多利斯公司(sartorius),5445307h7--00)微滤来除去,并且将收集的前-hgfa上清液储存在冷藏下直至使用。
将与上述类似地得到的50ml的前-hgfa培养上清液置于100ml玻璃烧杯中,添加5ml(即该上清液的1/10体积)的10g/l葡聚糖硫酸钠水溶液(mw.500,000),并且然后用2m盐酸将ph调节至5.3。在ph调节后,将其用0.2μm的过滤器进行过滤,并且然后置于250ml摇瓶中。将5%的二氧化碳吹入60秒,并且然后在室温以设定为80rpm的搅拌速度进行反应6小时。激活反应在ph5.5左右进行。反应6小时后进行取样,并且用合成肽作为底物测量hgfa活性。将合成底物h-d-val-leu-arg-pna·2acoh(来自巴亨公司(bachem),l-1885)溶于包含0.25%的bsa的50mmtris-hcl-0.15m氯化钠-10mm氯化钙缓冲液(ph7.5)中,并调节至2mm。将其以100μl/孔在96孔板的必要数目的孔施加,并且添加已经经受激活处理的的hgfa培养上清液、阳性对照、和未经处理的前-hgfa培养上清液各10μl。采用已经被预先激活的并确认能够充分激活前-hgf的hgfa培养上清液作为阳性对照。用铝箔将板遮光,并在37℃孵育1小时。用来自tecan公司(tecan)的平板读数器读取吸光度(405nm),并通过从原始吸光度中减去未经处理的前-hgfa培养上清液的吸光度来计算hgfa活性值。结果发现,激活后hgfa样品的活性值显示为0.577,这与阳性对照的活性值相当。认为前-hgfa被源自宿主cho细胞的酶的作用激活,因为任何酶等都没有外部添加到该反应溶液中。此外,当在反应7.6小时后向溶液中添加1mtris以调节ph至7.0,并且然后将溶液在冷藏下储存2天以检测hgfa活性值的变化时,没有看到活性值的大幅下降,其中紧随中和后的活性值为0.653、冷藏第1天的活性值为0.667、并且冷藏第2天的活性值为0.679,其显示激活后2天的稳定性(表1)。
[表1]
表1激活处理后的hgfa活性值
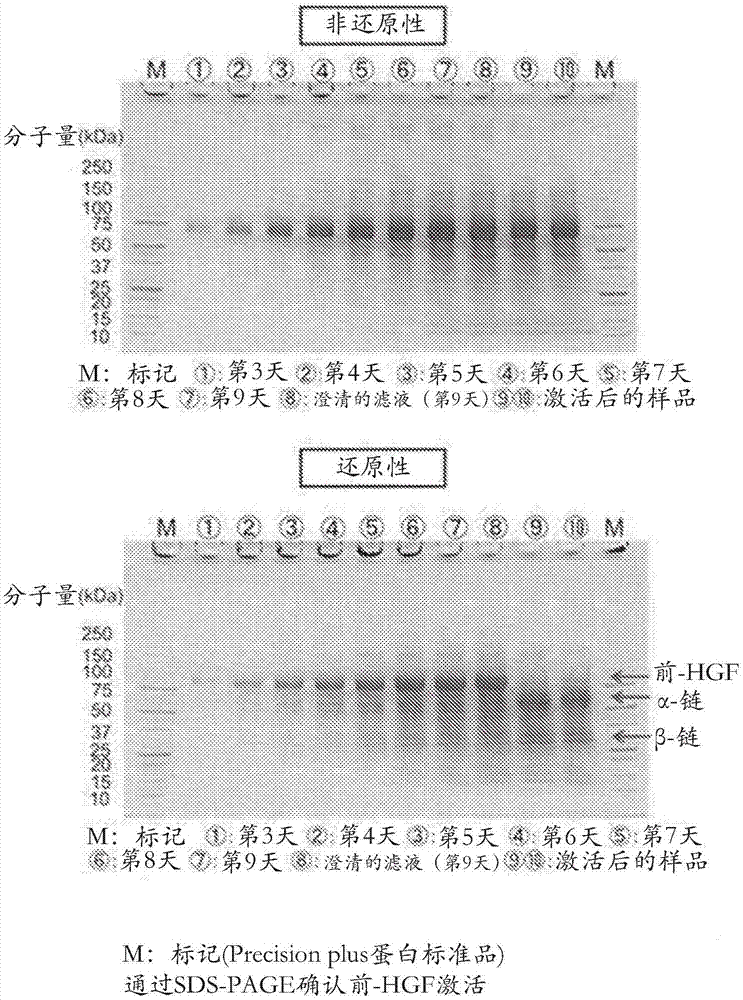
将重组表达前-hgf的cho细胞在t75烧瓶中的ex-cell定制设计培养基中解冻,在250ml摇瓶和7l培养罐中进行扩增培养,并且然后将其在20l培养罐中以144rpm设定为36.5℃培养9天。培养第9天存活率为90.6%。过滤以除去细胞后,将已经通过0.2μm的过滤器(来自赛多利斯公司(sartorius),5445307h9--00)微滤的19.14kg的前-hgf培养上清液装入一个30l培养罐中。向其中添加已经被激活并恢复至ph7.0并在冷藏下储存2天的0.96kg(即1/20体积的hgf上清液)的hgfa培养上清液,并将其在25℃伴随30rpm的搅拌进行反应。注意到装入的被激活的hgfa培养上清液具有与hgfa活性测量中的阳性对照相当的活性值。在反应约20小时后进行取样,并采用5%-20%聚丙烯酰胺凝胶(来自drc,nxv-271hp)用sds-page确认前-hgf的激活状态。在非还原条件下观察到单链条带,并且在激活后的还原条件下,单链物质消失并分离成α和β链,并且因此证实了前-hgf的充分激活(图1)。
[实例2]
使用实验设计(doe),测试实例1中描述的前-hgfa激活参数(其为ph(5.3-5.5)和反应温度(室温))的有效性。使用jmp软件(来自赛仕软件研究所(sasinstitute))用中心复合设计来设定实验条件,并且与实例1中描述的方法类似地制备用于前-hgfa激活处理的溶液。注意,用2m盐酸将ph调节至ph5.0、5.5和6.0的三个条件。每个100μl置于1.5ml管中,并通过在20℃、28.5℃和37℃保持静置来进行反应。在反应3、6、9和15小时后进行取样,并且用合成肽作为底物测量hgfa活性。通过减去未经处理的前-hgfa培养上清液的值(a405)获得了hgfa活性值。通过统计分析从总共27个条件获得的hgfa活性值创建响应表面图,并且具有0.4或更大的活性值的范围以白色显示。由该结果发现,给出最高hgfa活性的条件为ph5.4和反应温度为26.1℃,并且可以在很宽的范围内获得hgfa活性值(图2)。
[实例3]
用包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0)预先平衡2ml多峰阴离子交换剂captoadhere(来自ge生命科学公司(gelifesciences),28-4058-44)。向包含活性hgf的32ml培养上清液中添加氯化钠,以得到1m。将该培养上清液以2ml/min的流速加载到柱上,并且收集流过溶液。加载完成后,将包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0)以相当于柱体积3倍的量流动以进行洗涤,并收集洗脱液。洗涤完成后,将包含0.25m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0)以相当于柱体积3倍的量流动以进行洗涤,并收集洗脱液。接下来,将以对应于1柱体积的量流动包含0.7m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0)以收集洗脱液的操作重复5次。最后,使包含1.0m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0)以相当于柱体积3倍的量流动以收集洗脱液。图3示出了在非还原条件下用在该方法中收集的溶液进行sds-page的结果。所采用的sds-page凝胶是来自drc的xv-pantera(nxv-271hp),并且所采用的分子量标记是来自伯乐公司(biorad)的precisionplus蛋白全蓝标准品(161-0373)。在laemmli的样品缓冲液中在60℃进行10分钟的热处理后,对样品进行sds-page分析。在150v的恒定电压下进行电泳,并且当用来自cosmobio公司的pageblue83完成电泳时,将凝胶染色以确认分离的蛋白质。当比较柱加载溶液和流过溶液时,该流过溶液中分子量约为75,000的hgf带减少,表明它被吸附到载体上。不通过流过包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0)来洗脱hgf。在随后用包含0.25m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0)的洗涤中对包含大量杂质的组分进行洗脱。然后通过流过包含0.7m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0)来洗脱活性hgf。
[实例4]
用包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0)预先平衡1ml多峰阴离子交换剂captoadhere(来自ge医疗集团(gehealthcare),28-4058-44)。向包含活性hgf的8ml培养上清液中添加等量的包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0),以得到1m。将该培养上清液加载到柱上,并且收集流过溶液。加载完成后,将包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0)以相当于柱体积3倍的量流动以进行洗涤,并收集洗脱液。将相当于5倍柱体积的包含1m精氨酸的20mmtris-盐酸缓冲液(ph8.0)的量进行流动,并收集洗脱液。图4示出了在非还原条件下用在该方法中收集的溶液进行sds-page的结果。所采用的sds-page凝胶是来自drc的xv-pantera(nxv-271hp),并且所采用的分子量标记是来自伯乐公司(biorad)的precisionplus蛋白全蓝标准品(161-0373)。在laemmli的样品缓冲液中在60℃进行10分钟的热处理后,对样品进行sds-page分析。在150v的恒定电压下进行电泳,并且当用来自cosmobio公司的pageblue83完成电泳时,将凝胶染色以确认分离的蛋白质。当比较柱加载溶液和流过溶液时,该流过溶液中的hgf带减少,表明它被吸附到载体上。不通过流过包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0)来洗脱hgf。用随后的洗脱(用包含1m精氨酸的20mmtris-盐酸盐缓冲液(ph8.0))来洗脱活性hgf。
[实例5]
向在实例1的方法中获得的包含活性hgf的培养上清液中添加等量的包含2m氯化钠的40mmtris-盐酸盐缓冲液(ph8.0),并且然后将ph调节至8.0。将上述溶液加载到用包含2m氯化钠的20mmtris-盐酸盐缓冲液(ph8.0)平衡的captoadhere(ge医疗集团(gehealthcare),17-5444-05)柱上,并且在加载完成后,用用于平衡的缓冲液进行洗涤。用包含0.25m精氨酸盐酸的20mmtris-盐酸盐缓冲液(ph8.0)来洗涤柱,这之后用包含0.7m精氨酸盐酸的20mmtris-盐酸盐缓冲液(ph8.0)进行洗脱并且收集包含hgf的级分。
将captoadhere纯化级分进行合并,将用包含0.012%聚山梨醇酯80的20mmtris-盐酸盐缓冲液(ph7.5)稀释7倍的溶液加载到用包含0.012%聚山梨醇酯80的20mmtris-盐酸盐缓冲液(ph7.5)平衡的captoq(ge医疗集团(gehealthcare),17-5316-05)柱上,并且在加载完成后,用用于平衡的缓冲液进行洗涤。将柱流过溶液和洗涤溶液合并为captoq纯化级分。
将captoq纯化级分加载到用20mm磷酸盐缓冲液(ph7.5)平衡的unospheres(伯乐公司(bio-rad)156-0117)柱上,并且在加载完成后,用用于平衡的缓冲液进行洗涤。用相同溶液进行的洗涤完成后,将其用包含0.4m氯化钠的20mm磷酸盐缓冲液(ph7.5)进行洗涤,并且然后用包含0.6m氯化钠的20mm磷酸盐缓冲液(ph7.5)洗脱吸附的hgf作为unospheres纯化级分。
向unospheres纯化级分中添加包含5m氯化钠的20mm磷酸盐缓冲液(ph7.5),以将溶液的氯化钠浓度调节至3.3m,并且将ph调节至7.5。用包含3.3m氯化钠的20mm磷酸盐缓冲液(ph7.5)来平衡phenylsepharosehp(ge医疗集团(gehealthcare),17-1082-04柱),并且然后加载上述hgf溶液。加载完成后,将柱用用于平衡的缓冲液进行洗涤。通过平衡缓冲液(a)和20mm磷酸盐缓冲液(ph7.5)(b)(b的从30%至100%)的线性梯度来洗脱吸附的hgf。
[实例6]
对于包含未添加了活性hgfa的未激活的前-hgf溶液的培养上清液,与实例5类似地进行captoadherese纯化、captoq纯化、unospheres纯化和uf浓缩缓冲液交换。在图5中所示的每个步骤中获得的样品的非还原性和还原性sds-page结果显示,未激活的前-hgf也在本纯化方法中被纯化。
[实例7]
对于实例5中获得的活性hgf,在tgfβ-1的存在下测量细胞增殖活性。使用水貂肺上皮细胞mv1lu(细胞编号:jcrb9128),将活性hgf添加到如下细胞中,这些细胞的生长在转化生长因子β-1(tgfβ-1)的存在下受到抑制,并且基于对tgfβ-1活性的拮抗作用检测了其活性hgf增殖活性,以测量滴度(journalofimmunologicalmethods[免疫学方法杂志],258,1-11,2001)。
在一个96孔板的每个孔中,添加50μl的tgfβ-1(4ng/ml)、各50μl的国际hgf参考标准品(nibsc代码:96/564)或hgf(0、4、8、16、32、64、128、256、512和1024ng/ml)、以及100μl的水貂肺上皮细胞悬浮液(1x105个细胞/ml)并将其在37℃、5%的co2浓度下培养3天,并且然后用细胞计数试剂盒(同仁化学研究所(dojindolaboratories),目录号343-07623)染色活细胞。使用酶标仪,从450nm处的吸光度获得针对国际hgf参考标准品和hgf的各自的s形曲线(图6)。国际hgf参考标准品和hgf的ec50分别为13.4ng/ml和15.4ng/ml,并且用上述生产方法获得的hgf具有与国际hgf参考标准品相当的活性。
- 还没有人留言评论。精彩留言会获得点赞!