胃癌外泌体miRNA分子标记的应用及其试剂盒的制作方法
本发明属于医学分子生物学技术领域,具体涉及胃癌外泌体mirna分子标记的应用及其试剂盒。
背景技术:
根据国际癌症研究机构的统计数据,全球范围内,胃癌发病率位于恶性肿瘤第5位、死亡率居第3位。在我国,胃癌发病率及死亡率均居恶性肿瘤前列。胃癌的病因迄今未阐明,但已认识到多种因素会影响,共同参与胃癌的发生。胃癌癌症早期几乎不会有症状,以消瘦为最多,次为胃区疼痛,食欲不振,呕吐等,初诊时患者多已属晚期,五年生存率低于30%。但如果早期得到诊治,五年生存率可望达到90%。早期检出胃癌能明显有助于提高存活率。然而,由于已经诊断为处于相同阶段的胃癌根据患者的不同而显示出了预后的差异,因此精确预测胃癌预后以及早期检出胃癌是有效治疗胃癌的最重要因素。临床上,已经使用解剖观察法(癌细胞侵入程度和转移的淋巴结数目)以便预测胃癌患者的预后,但是该方法存在医师主观判断的可能介入和精确预测预后的局限。根据传统的治疗方案,一部分早期患者可能能够从术后辅助化疗中获益,而相反,有些低复发风险的进展期患者可能接受了原本不必要的辅助化疗,并为此接受化疗的毒性和风险带来的生活质量下降。因此探寻胃癌诊断标志物对于胃癌的早期诊断,疗效监测,复发及预后判断显得尤为重要。
外泌体(exosome)是一种直径为30-150纳米的囊泡状结构,广泛存在于血液、唾液、尿液、脑脊液等生物体液中。它形成于多种细胞,如树突状细胞、肿瘤细胞等的胞吐作用。外泌体的外膜为脂质双层结构,其内包裹有特异的蛋白、信使rna和非编码rna等。外泌体中的非编码rna以mirna为主,且种类丰富,其可以影响干细胞分化、器官形成、造血作用、肿瘤发生以及新陈代谢等诸多生理活动。mirna(microrna)是广泛存在于生物体内的19-25nt的非编码单链小分子rna,其通过与靶基因mrna的互补配对降解靶mrna或抑制其翻译。研究表明mirna在肿瘤发生过程中起重要作用,mirna很有可能成为癌症治疗与诊断的新途径。mirna与靶基因mrna的非编码序列(3′-utr或5′-utr)存在着一对多的关系。在癌症病例中经常发现mirna群表达失调的现象,而这些mirna表达的改变与癌症发生密切相关。在体外实验中,改变一个或者多个mirna的表达能够促进或者抑制癌细胞恶化,促进癌细胞恶化的mirna可以认为是一类癌基因,反之,抑癌基因。外泌体中的mirna能以稳定的形式存在于人类的体液如血清、血浆中而不被降解,通过特定的分离纯化手段能够被检测到,而且外泌体中生物活性物质可分析活细胞的动态变化,允许实时捕获肿瘤异质性,这也使它有可能成为无创检测筛查的新型重要标志物。
技术实现要素:
:
本发明结合外泌体(exosome)和mirna的相关特点,对胃癌血清exo-mirna、肺癌组织exo-mirna表达图谱的变化及与肿瘤的相关性进行评价,筛选出诊断和预示胃癌外泌体microrna分子标志物:
本发明中,所述胃癌外泌体mirna分子为mir-106a、mir-375、mir-148a或let-7a中至少两种。
进一步,所述标志物为mir-106a与mir-375联合,mir-106a与mir-148a联合或mir-106a与let-7a联合。
进一步,所述诊断和预示为胃癌筛查、辅助诊断、疗效评价、预后评估或复发监控。
本发明中,所述胃癌外泌体来源于体液或细胞。
本发明中,所述体液包括血液、痰液、胃液、胃部灌洗液、尿液或唾液中的至少一种。
本发明还公开了一种胃癌辅助诊断检测试剂盒,该试剂盒是基于pcr平台mirna两步法检测试剂盒,说明书中所述的所有两步法检测体系为构建该试剂盒的理论基础。包含microrna分子标志物特异性茎环结构逆转录引物、pcr上游引物、pcr通用下游引物,用于检测microrna分子标记物的特异探针;
所述特异性茎环结构逆转录引物的颈部的loop环部设计非连续互补碱基对tgcg和cgca构成钥匙状结构,逆转录反应时通过连接酶将短臂与microrna分子相连接。
进一步,所述的分子标志物mir-106a逆转录引物序列如seqidno.1:
5’-gatgaggagtgtcgtggagtcggcaatttcctcatcctacctg-3’;
mir-106apcr上游引物序列如seqidno.2:
5’-gaggtcagggaaaagtgcttacagtgca-3’;
mir-106apcr通用下游引物序列如seqidno.3:
5'-ctcaagtgtcgtggagtcggc-3';
mir-106a特异探针序列如seqidno.4:
5'-fam-tttcctcatcctacctg-mgb-3';
所述的分子标志物mir-375逆转录引物序列如seqidno.5:
5'-gatgaggagtgtcgtggagtcggcaatttcctcatcactcgggg-3';
mir-375pcr上游引物序列如seqidno.6:
5'-ctccgtcagggtcctgtactgagctg-3';
mir-375pcr通用下游引物序列如seqidno.3:
5'-ctcaagtgtcgtggagtcggc-3';
mir-375特异探针序列如seqidno.7:
5'-fam-tttcctcatcactcgggg-mgb-3'
所述的分子标志物mir-148a逆转录引物序列如seqidno.8:
5'-gatgaggagtgtcgtggagtcggcaatttcctcatcacagactc-3';
mir-148apcr上游引物序列如seqidno.9:
5'-ctccgtcagggtccttcattccaccg-3';
mir-148apcr通用下游引物序列如seqidno.3:
5'-ctcaagtgtcgtggagtcggc-3';
mir-148a特异探针序列如seqidno.10:
5'-fam-tttcctcatcacagactc-mgb-3';
所述的分子标志物let-7a逆转录引物序列如seqidno.11:
5'-gatgaggagtgtcgtggagtcggcaatttcctcatcaactatac-3';
let-7apcr上游引物序列如seqidno.12:
5'-ctccgtcagggtgaggtagtaggtt-3';
let-7apcr通用下游引物序列如seqidno.3:
5'-ctcaagtgtcgtggagtcggc-3';
let-7a特异探针序列如seqidno.13:
5'-fam-tttcctcatcaactatac-mgb-3'
更进一步,还包括胃癌外泌体mirna标准品:mir-106a分子标志物标准品为mir-106a,稀释后浓度为1011copy/μl,并梯度稀释为系列标准品;mir-375分子标志物标准品为mir-375,稀释后浓度为1011copy/μl;mir-148a分子标志物标准品为mir-148a,稀释后浓度为1011copy/μl;let-7a分子标志物标准品为let-7a,稀释后浓度为1011copy/μl。
本发明还公开了一种基于mirna双通道检测体系,包含分子标志物mir-106a、mir-375、mir-148a、let-7a;fam及hex标记的分子杂交探针;microrna分子标志物特异性茎环结构逆转录引物、pcr上游引物、pcr通用下游引物。
基于pcr平台mirna的两步法检测试剂盒
逆转录引物:本发明利用特异性的逆转录引物结合了茎环引物(stem-looprt-pcr)法和key-like法的设计优点:1.stem-looprt逆转录引物(图1)颈部stem碱基对延长,并且在loop环部设计了4对非连续互补碱基对加强其形成key-like结构的能力,从而促使rt引物在整个逆转录过程能更好地保持茎环结构,不仅杜绝了茎环引物与非目标mirna的错配提高特异性,而且使逆转录产物碱基数增加,更有利于后续的pcr检测。2.stem-looprt与mirna有5对碱基完全互补,并且在逆转录前增加了酶连接步骤(图1),使mirna与stem-looprt结合更牢固,增强了逆转录的效率。3.本发明利用stem-looprt引物对mirna逆转录产物也可用于荧光染料法pcr检测。
pcr上下游引物:特异性上游引物加上tag标签从而延长扩增模板增加扩增效率,并调整下游引物使上下游引物tm值基本相同,使得在pcr预变性后上下游引物可同时与模板结合并进行扩增,退火和延伸同一温度下进行。
水解探针:本发明采用taqman技术的设计方法,设计一条与模版互补的特异性水解探针(图1),增强检测的特异性。
对一种mirna标志物定量检测,选取该mirna作为mirna标志物的内控基因,根据cp值,使用相对定量公式(2-δδcp)计算标志物相对表达量的倍数变化,算出mirna的得分。临床病理诊断用作参考标准确定mirna标志物的敏感性和特异性。使用roc特征曲线和auc分析来确定mirna联合检测的准确度,以cutoff值对样本结果进行判读。
本发明的有益效果:
(1)microrna分子标志物在胃癌辅助诊断试剂中的应用,其包含mir-106a、mir-375、mir-148a或let-7a中的至少两种。经过大数据临床验证实验,在胃癌的辅助诊断指标方面具有突出优势,极大提高了进行mirna检测时相对定量的准确度。
(2)本发明对现有检测方法进行了优化改进,开发出基于pcr平台mirna的两步法检测试剂盒,可根据检测的目的及实验条件的需求选择相应的检测和分析方法。由于mirna自身的实效性及与胃肿瘤的相关性,本试剂盒既可用于早期胃癌良恶性鉴别,也可用于预后、对术前术后、治疗、疗效等起到实时监控作用。其中两步法检测体系包含独立自主设计的特异性的茎环结构rt引物、pcr上下游引物及taqman探针引物,特异性引物使得mirna检测特异性可区分单个碱基差异,灵敏度最低可达到1copy/μl的检测下限,大大提高了mirna的检测效率和精确度,此外,不同标志物pcr热循环条件一样,不仅可同批次同板检测多种标志物,提高了联合标志物检测的准确性和检测效率,也降低时间、成本。
(3)采用血清外泌体exo-mirna作为标志物联合检测,比血浆外泌体-mirna或血清-mirna、血浆-mirna直接检测效果更好。exo-mirna具有很好的稳定性,血清在4℃存放20天仍可有效提取exo-mirna,提取的exo-mirna可-20℃冻存50天,-80℃长期保存。
(4)本发明将胃癌与癌旁组织表达差异明显mir-106a进行外泌体表达分析,结果表明mir-106a在体液外泌体中稳定表达,体液外泌体mirna的表达与组织具有很好的一致性。
附图说明
图1为mirna两步法扩增原理图
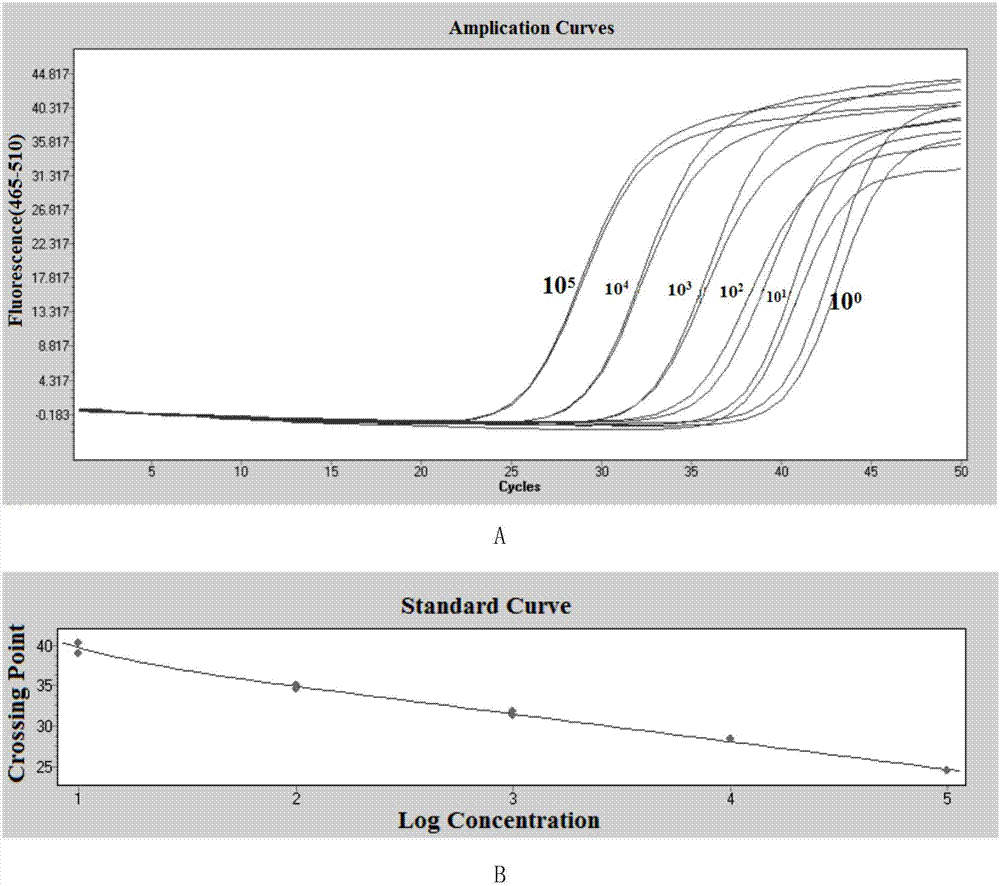
图2为mirna标志物pcr标准曲线及检测灵敏度(a:mir-106a的pcr最低检测下限;b:mir-106a的pcr标准曲线;c:mir-375的pcr最低检测下限;d:mir-375的pcr标准曲线;e:mir-148a的pcr最低检测下限;f:mir-148a的pcr标准曲线;g:let-7a的pcr最低检测下限;h:let-7a的pcr标准曲线)。
图3为两步法mirna检测体系对临床样本检测稳定性结果(a:批内检测结果;b:批间检测结果)。
图4为胃癌临床样本mir-106a联合mir-375检测结果(a:胃癌组织样本mir-106a联合mir-375检测结果,a-1:mir-106a联合mir-375mirna检测;a-2:mir-106a联合mir-375roc曲线;b:胃癌血清外泌体mir-106a联合mir-375检测结果;b-1:mir-106a联合mir-375mirna检测;b-2:mir-106a联合mir-375roc曲线;c:胃癌血浆外泌体mir-106a联合mir-375检测结果,c-1:mir-106a联合mir-375mirna检测;c-2:mir-106a联合mir-375roc曲线;d胃癌尿液外泌体mir-106a联合mir-375检测结果;d-1:mir-106a联合mir-375mirna检测;d-2:mir-106a联合mir-375roc曲线)。
图5为胃癌临床样本mir-106a联合mir-148a检测结果(a:胃癌组织样本mir-106a联合mir-148a检测结果,a-1:mir-106a联合mir-148amirna检测;a-2:mir-106a联合mir-148aroc曲线;b胃癌血清外泌体mir-106a联合mir-148a检测结果,b-1:mir-106a联合mir-148amirna检测;b-2:mir-106a联合mir-148aroc曲线;c:胃癌血浆外泌体mir-106a联合mir-148a检测结果,c-1:mir-106a联合mir-148amirna检测;c-2:mir-106a联合mir-148aroc曲线;d胃癌尿液外泌体mir-106a联合mir-148a检测结果,d-1:mir-106a联合mir-148amirna检测;d-2:mir-106a联合mir-148aroc曲线)。
图6为胃癌临床样本mir-106a联合let-7a检测结果(a:胃癌组织样本mir-106a联合let-7a检测结果,a-1:mir-106a联合let-7amirna检测,a-2:mir-106a联合let-7aroc曲线;b:胃癌血清外泌体mir-106a联合let-7a检测结果,b-1:mir-106a联合let-7amirna检测,b-2:mir-106a联合let-7aroc曲线;c:胃癌血浆外泌体mir-106a联合let-7a检测结果,c-1:mir-106a联合let-7amirna检测,c-2:mir-106a联合let-7aroc曲线;d:胃癌尿液外泌体mir-106a联合let-7a检测结果,d-1:mir-106a联合let-7amirna检测,d-2:mir-106a联合let-7aroc曲线)。
图7为术前和术后外泌体mirna表达水平及其差异(a:术前和术后血清外泌体mir-106a,mir-375,mir-148a,let-7a表达水平及其差异(a-1:mir-106a;a-2:mir-375;a-3:mir-148a;a-4:let-7a);b术前和术后血浆外泌体mir-106a,mir-375,mir-148a,let-7a表达水平及其差异(b-1:mir-106a;b-2:mir-375;b-3:mir-148a;b-4:let-7a);c术前和术后尿液外泌体mir-106a,mir-375,mir-148a,let-7a表达水平及其差异(c-1:mir-106a;c-2:mir-375;c-3:mir-148a;c-4:let-7a))。
图8为外泌体mir-106a联合mir-375检测对胃癌预后评估(a:血清外泌体mir-106a联合mir-375联合检测对胃癌预后评估,a-1,mir-106a联合mir-375表达水平,a-2:roc曲线;a-3:无进展生存曲线;a-4:总体生存率;b:血浆外泌体mir-106a联合mir-375联合检测对胃癌预后评估,b-1,mir-106a联合mir-375表达水平,b-2:roc曲线;b-3:无进展生存曲线,b-4:总体生存率;c:尿液外泌体mir-106a联合mir-375联合检测对胃癌预后评估,c-1,mir-106a联合mir-375表达水平,c-2:roc曲线;c-3:无进展生存曲线,c-4:总体生存率)。
图9为外泌体mir-106a联合mir-148a检测对胃癌预后评估(a:血清外泌体mir-106a联合mir-148a检测对胃癌预后评估,a-1,mir-106a联合mir-148a表达水平,a-2:roc曲线;a-3:无进展生存曲线;a-4:总体生存率;b血浆外泌体mir-106a联合mir-148a检测对胃癌预后评估,b-1,mir-106a联合mir-148a表达水平,b-2:roc曲线;b-3:无进展生存曲线,b-4:总体生存率;c尿液外泌体mir-106a联合mir-148a检测对胃癌预后评估,c-1,mir-106a联合mir-148a表达水平,c-2:roc曲线;c-3:无进展生存曲线,c-4:总体生存率)。
图10为外泌体mir-106a联合let-7a检测对胃癌预后评估(a:血清外泌体mir-106a联合let-7a检测对胃癌预后评估,a-1,mir-106a联合let-7a表达水平,a-2:roc曲线;a-3:无进展生存曲线;a-4:总体生存率;b:血浆外泌体mir-106a联合let-7a检测对胃癌预后评估,b-1,mir-106a联合let-7a表达水平,b-2:roc曲线;b-3:无进展生存曲线;c:尿液外泌体mir-106a联合let-7a检测对胃癌预后评估,c-1,mir-106a联合let-7a表达水平,c-2:roc曲线;c-3:无进展生存曲线)。
图11为基于mirna双通道体系检测试剂盒及其应用(a:mirna双通道检测体系对临床样本检测稳定性结果,a-1;批内检测结果;a-2:批间检测结果;b:胃癌血清外泌体mir-106a联合mir-375检测结果,b-1:mirna表达水平;b-2:roc曲线;c:胃癌血清外泌体mir-106a联合mir-148a检测结果,c-1:mirna表达水平;c-2:roc曲线)。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。优选实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件进行。
下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1、基于pcr平台mirna的两步法检测体系试剂盒
1)本实施例使用仪器如下:
仪器:4℃低温离心机(thermofisherfresco17)、lightcycler480实时荧光定量pcr仪(罗氏公司)、超净工作台(sw-cj-1d,龙扬科学仪器)、常规pcr仪(a100,杭州朗基科学仪器有限公司)。
2)rna逆转录反应体系:
试剂:用于配制逆转录反应体系的试剂包括逆转录引物(rt-primer,上海英潍捷基合成),mirna标准品粉末(上海英潍捷基合成)、t4dna连接酶(t4dnaligase,供应商:neb,商品号:m0202s,包含10×t4dnaligasebuffer)、rna酶抑制剂(rnaseinhibitor,供应商:fermentas,商品号:k1622)、转录酶transcriptase(供应商:上海英潍捷基生物技术有限公司,商品号:k1622,包含rnaseinhibitor、dntps、nuclease-freewater)、t4多聚核苷酸激酶(t4polynucleotidekinase,供应商:neb,商品号:m0201s)和无核酸酶纯水(nuclease-freewater,供应商:上海英潍捷基生物有限公司,商品号:k1622)。用于配制逆转录反应体系的试剂逐瓶封装,使用时按一定的比例制成逆转录体系,逆转录反应体系为20μl/次,分装的体积是50次的用量,如表1所示。
表1、通用逆转录反应体系组分表
逆转录条件如表2所示:
表2、通用rna逆转录条件
cdna10倍稀释后4℃保存用于后续pcr扩增。
3)pcr反应体系:
试剂:用于配制pcr反应体系的试剂包括三磷酸脱氧核苷酸dntps(dctp、dgtp、datp、dttp、dutp,供应商:thermoscientific,商品号分别为:r0151、r0161、r0141、r0171、r0133),dctp:dgtp:datp:dttp:dutp以1:1:1:0.5:0.5的比例配制成dntps。上游引物液(fprimer,上海英潍捷基合成)、通用下游引物液(rprimer,上海英潍捷基合成)、探针(probe,abi合成)、dna聚合酶(hstaq,供应商:takara公司,商品号:r007a)、尿嘧啶-dna糖基化酶(udg,供应商:neb,商品号:m0280s)和纯水(h2o),10×buffer(购自takara,商品号:r007a),mgcl2(购自roche,商品号11600770),反应体系如表3所示。
表3、优化后的pcr反应体系
pcr扩增条件如表4所示。
表4、pcr热循环条件
4)mirna两步法分子标志物标准品配置
标准品mirna经逆转录后cdna原液为1012copy/μl,取10μlcdna原液加入90μl灭菌纯化水稀释到1011copy/μl,再取10μl1011copy/μl稀释液加入90μl灭菌纯化水稀释到1010copy/μl,依次逐级稀释到1copy/μl的稀释液。
5)mirna两步法检测灵敏度
采用上述基于pcr平台mirna的两步法检测体系试剂盒,检测mir-106a、mir-375、mir-148a或let-7a的标准品,得出检测下限及扩增效率,检测原理如图1所示。
以mir-106a为例,mir-106a两步法分子标志物标准品配置:
标准品mir-106a经逆转录后cdna原液为1012copy/μl,取10μlcdna原液加入90μl灭菌纯化水稀释到1011copy/μl,再取10μl1011copy/μl稀释液加入90μl灭菌纯化水稀释到1010copy/μl,依次逐级稀释到1copy/μl的稀释液。
其他mirna分子标志物两步法检测体系构建及标准品配置参考mir-106a,仅模板、引物、及探针不同,pcr反应条件相同。
两步法检测体系mirna标准品检测结果,如表5所示。
表5mirna标准品检测结果
6)两步法mirna检测体系对临床样本检测稳定性评价
胃癌临床样本血清exo-mir-106a联合exo-mir-148a对检测结果稳定性进行评价。4例不同临床血清样本,每例样本分3个批次检测,每个批次3个重复,验证检测评价体系(包括exo-mirna提取纯化、逆转录、pcr上机检测)稳定性。结果如图3所示:同一样本批内差异cv值可达到4%以内,批间差异cv值可达到8%以内,说明mirna两步法检测评价体系具有良好的稳定性。
7)mirna的两步法检测体系的胃癌辅助诊断检测试剂盒效果评价
(1)样本采集
收集经医院检查确诊的胃癌(包括不同分期、不同亚型、不同性别及不同年龄段)、胃癌前病变、胃部疾病良性病变和健康人等系列人群组织、血清、血浆、尿液样本。收集经医院检查确诊的胃癌(包括不同分期、不同亚型、不同性别及不同年龄段)病人30例癌及癌旁组织样本。
(2)外泌体提取纯化
采用sbi公司商业化产品exoquicktm试剂盒(货号exoq5a-1)提取血清、血浆、尿液外泌体。采用凯杰商业化产品mirneasyminikit(货号217004),提取纯化外泌体中mirna及组织,体液mirna。并利用nano-drop2000测rna核酸质量,记录rna浓度及纯度。
(3)mirna两步法检测体系
采用本实施例中基于pcr平台mirna的两步法检测体系试剂盒,检测体系及反应条件。对早期胃癌病人30例,30例对照(健康人和良性病变)的血清,血浆,尿液样本的exo-mirna进行检测,检测mir-106a、let-7a、mir-148a、mir-375的cp值,根据cp值,使用相对定量公式计算相对表达量。
(4)胃部相关疾病mirna检测结果
a.临床样本外泌体mir-106a联合mir-375检测结果
如图4中a所示,对胃癌病人30例包括癌和癌旁的组织样本,检测mir-106a及mir-375的cp值,根据cp值,得出mirna的拷贝数。使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关,auc=0.90,具有显著优势。
如图4中b所示,对ⅰa期早期胃癌病人30例,30例对照(健康人和良性病变)的血清样本的exo-mirna进行检测,检测标志物mir-106a和mir-375的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.816,cutoff值取10.233时,诊断灵敏度81.8%,特异性80%,具有显著优势。
如图4中c所示,对ⅰa期早期胃癌病人30例,30例对照(健康人和良性病变)的血浆样本的exo-mirna进行检测,检测标志物mir-106a和mir-375的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.786,cutoff值取13.0086时,诊断灵敏度71.4%,特异性77.8%,具有显著优势。
如图4中d所示,对ⅰa期早期胃癌病人30例,30例对照(健康人和良性病变)的尿液样本的exo-mirna进行检测,检测标志物mir-106a和mir-375的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.780,cutoff值取11.9627时,诊断灵敏度74.3%,特异性74.1%,具有显著优势。
b.临床样本外泌体mir-106a联合mir-148a检测结果
如图5中a所示,对胃癌病人30例包括癌和癌旁的组织样本,检测mir-106a及mir-148a的cp值,根据cp值,得出mirna的拷贝数。使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关,auc=0.919,具有显著优势。
如图5中b所示,对ⅰa期早期胃癌病人30例,30例对照(癌前病变、健康人和良性病变)的血清样本的exo-mirna进行检测,检测标志物mir-106a和mir-148a的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.884,cutoff值取5.6661时,诊断灵敏度84.4%,特异性80%,具有显著优势。
如图5中c所示,对ⅰa期早期胃癌病人30例,30例对照(癌前病变、健康人和良性病变)的血浆样本的exo-mirna进行检测,检测标志物mir-106a和mir-148a的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.825,cutoff值取9.4156时,诊断灵敏度81.3%,特异性76.7%,具有显著优势。
如图5中d所示,对ⅰa期早期胃癌病人30例,30例对照(癌前病变、健康人和良性病变)的尿液样本的exo-mirna进行检测,检测标志物mir-106a和mir-148a的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.770,cutoff值取8.7695时,诊断灵敏度75%,特异性73.3%,具有显著优势。
c.临床样本外泌体mir-106a联合let-7a检测结果
如图6中a所示,对胃癌病人30例包括癌和癌旁的组织样本,检测mir-106a及let-7a的cp值,根据cp值,得出mirna的拷贝数。使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.82,具有显著优势。
如图6中b所示,对ⅰa期早期胃癌病人30例,30例对照(癌前病变、健康人和良性病变)的血清样本的exo-mirna进行检测,检测标志物mir-106a和let-7a的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.769,cutoff值取11.3578时,诊断灵敏度70%,特异性70%。
如图6中c所示,对ⅰa期早期胃癌病人30例,30例对照(癌前病变、健康人和良性病变)的血浆样本的exo-mirna进行检测,检测标志物mir-106a和let-7a的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.768,cutoff值取12.9373时,诊断灵敏度70%,特异性70.2%。
如图6中d所示,对ⅰa期早期胃癌病人30例,30例对照(癌前病变、健康人和良性病变)的尿液样本的exo-mirna进行检测,检测标志物mir-106a和let-7a的表达量cp值,根据cp值,使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关,auc=0.725。
8)胃癌术前和术后体液外泌体mirna表达水平及其差异
收集未经任何治疗的10例胃癌患者术前体液(血清、血浆、尿液)样本和对应的术后体液(血清、血浆、尿液)样本。检测外泌体mirna标志物mir-106a,mir-375,mir-148a,let-7a的表达量。对检测结果采用spss17.0进行t检测分析p<0.05。结果如图7中a所示,血清外泌体mir-106a,mir-375,mir-148a,let-7a的表达量在术前和术后1周之间差异有统计学意义;如图7中b所示血浆外泌体mir-106a,mir-375,mir-148a,let-7a的表达量在术前和术后1周之间差异有统计学意义;如图7中c所示尿液外泌体mir-106a,mir-375,mir-148a,let-7a的表达量在术前和术后1周之间差异有统计学意义。说明体液外泌体mir-106a,mir-375,mir-148a,let-7a的表达量有可能成为胃癌术后检测的生化标志物。
9)外泌体mirna用于预后评估检测结果
(1)对无远处转移、无全身重大疾病、可手术根治的ⅰa期早期胃癌患者共20例样本的exo-mirna进行检测。样本纳入标准为:能够按预定方案完成化疗。可从化疗前后收集体液,通过病理诊断将样本分为10例治疗有效组,10例治疗无效组。检测mir-106a,mir-375,mir-148a,let-7a的表达水平。采用相对定量法,计算基因的相对表达量
(2)外泌体mir-106a和mir-375联合检测对胃癌预后评估
如图8中a所示,10例治疗有效样本和10例治疗无效样本,血清外泌体mir-106a和mir-375联合检测结果,auc=0.880,与疗效显著性相关;kaplan-meier曲线显示,血清exo-mir-106a联合mir-375表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
如图8中b所示,10例治疗有效样本和10例治疗无效样本,血浆外泌体mir-106a和mir-375联合检测结果,auc=0.780,与疗效显著性相关;kaplan-meier曲线显示,血浆exo-mir-106a联合mir-375表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
如图8中c所示,10例治疗有效样本和10例治疗无效样本,尿液外泌体mir-106a和mir-375联合检测结果,auc=0.770,与疗效显著性相关。kaplan-meier曲线显示,尿液exo-mir-106a联合mir-375表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
(3)外泌体mir-106a和mir-148a联合检测对胃癌预后评估
如图9中a所示,10例治疗有效样本和10例治疗无效样本,血清外泌体mir-106a和mir-148a联合检测结果,auc=0.880,与疗效显著性相关;kaplan-meier曲线显示,血清exo-mir-106a联合mir-148a表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
如图9中b所示,10例治疗有效样本和10例治疗无效样本,血浆外泌体mir-106a和mir-148a联合检测结果,auc=0.810,与疗效显著性相关;kaplan-meier曲线显示,血浆exo-mir-106a联合mir-148a表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
如图9中c所示,10例治疗有效样本和10例治疗无效样本,尿液外泌体mir-106a和mir-148a联合检测结果,auc=0.780。kaplan-meier曲线显示,尿液exo-mir-106a联合mir-148a表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
(4)外泌体mir-106a和let-7a联合检测对胃癌预后评估
如图10中a所示,10例治疗有效样本和10例治疗无效样本,血清外泌体mir-106a和let-7a联合检测结果,auc=0.810,与疗效显著性相关;kaplan-meier曲线显示,血清exo-mir-106a联合let-7a表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
如图10中b所示,10例治疗有效样本和10例治疗无效样本,血浆外泌体mir-106a和let-7a联合检测结果,auc=0.770,与疗效显著性相关;kaplan-meier曲线显示,血浆exo-mir-106a联合let-7a表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
如图10中c所示,10例治疗有效样本和10例治疗无效样本,尿液外泌体mir-106a和let-7a联合检测结果,auc=0.750,与疗效显著性相关;kaplan-meier曲线显示,尿液exo-mir-106a联合let-7a表达水平与患者pfs密切相关,f>cutoff组的患者pfs更长(p<0.05)。
实施例2
1)双通道mirna检测体系
针对上调mirna标志物及下调mirna标志物设计合成2对引物和2条taqman探针,其中一条探针为hex标记,mir-106a特异探针序列如seqidno.14:5'-hex-tttcctcatcctacctg-mgb-3';mir-375特异探针序列如seqidno.15:5'-hex-tttcctcatcactcgggg-mgb-3';mir-148a特异探针序列如seqidno.16:5'-hex-tttcctcatcacagactc-mgb-3';let-7a特异探针序列如seqidno.17:5'-hex-tttcctcatcaactatac-mgb-3',其余探针和引物见发明内容。
优化体系,建立双通道荧光pcr体系:
表6双通道mirnapcr扩增体系
2)双通道mirna检测体系对临床样本检测稳定性评价
胃癌临床样本血清exo-mir-106a联合exo-mir-148a对检测结果稳定性进行评价。4例不同临床血清样本,每例样本分3个批次检测,每个批次3个重复,验证检测评价体系(包括exo-mirna提取纯化、逆转录、pcr上机检测)稳定性。结果如图11中a所示:同一样本批内差异cv值可达到5%以内,批间差异cv值可达到8%以内,说明mirna两步法检测评价体系具有良好的稳定性。
3)双通道mirna检测体系的胃癌辅助诊断试剂盒效果评价
(1)双通道mirna检测体系
采用实施例2中基于pcr平台双通道mirna检测体系试剂盒,检测体系、反应条件为实施例2中的体系。对早期胃癌病人30例,30例对照(健康人和良性病变)的血清样本的exo-mirna进行检测,检测mir-106a、mir-148a、mir-375的cp值,根据cp值,使用相对定量公式计算相对表达量。
(2)胃部相关疾病mirna检测结果
a.临床样本外泌体mir-106a联合mir-375检测结果
如图11中b所示,对ⅰa期早期胃癌病人30例,30例对照(健康人和良性病变)的血清样本的exo-mirna进行检测,检测mir-106a及mir-375的cp值,根据cp值,得出mirna的拷贝数。使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.89,具有显著优势。
如图11中c所示,对ⅰa期早期胃癌病人30例,30例对照(健康人和良性病变)的血清样本的exo-mirna进行检测,检测mir-106a及mir-148a的cp值,根据cp值,得出mirna的拷贝数。使用相对定量公式(2-δδcp)值,计算联合标志物相对表达量的倍数变化,进而得出mirna相对表达量的得分。对检测结果采用spss17.0进行t检测分析p<0.05,说明联合标志物与早期胃癌预测显著相关。auc=0.912,具有显著优势。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
序列表
<110>江苏为真生物医药技术股份有限公司
<120>胃癌外泌体mirna分子标记的应用及其试剂盒
<160>17
<170>siposequencelisting1.0
<210>1
<211>43
<212>dna
<213>人工序列(artificialsequence)
<400>1
gatgaggagtgtcgtggagtcggcaatttcctcatcctacctg43
<210>2
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>2
gaggtcagggaaaagtgcttacagtgca28
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctcaagtgtcgtggagtcggc21
<210>4
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>4
tttcctcatcctacctg17
<210>5
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>5
gatgaggagtgtcgtggagtcggcaatttcctcatcactcgggg44
<210>6
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctccgtcagggtcctgtactgagctg26
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>7
ctcaagtgtcgtggagtcggc21
<210>8
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>8
gatgaggagtgtcgtggagtcggcaatttcctcatcacagactc44
<210>9
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>9
ctccgtcagggtccttcattccaccg26
<210>10
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>10
tttcctcatcacagactc18
<210>11
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>11
gatgaggagtgtcgtggagtcggcaatttcctcatcaactatac44
<210>12
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>12
ctccgtcagggtgaggtagtaggtt25
<210>13
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>13
tttcctcatcaactatac18
<210>14
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>14
tttcctcatcctacctg17
<210>15
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>15
tttcctcatcactcgggg18
<210>16
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>16
tttcctcatcacagactc18
<210>17
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>17
tttcctcatcaactatac18
- 还没有人留言评论。精彩留言会获得点赞!