一种抗PD-1抗原和抗c-Met抗原的双特异性抗体及其构建方法与流程
本发明属生物技术领域,涉及一种双特异性抗体及其构建方法,具体涉及一种重组人源化pd-1&c-met双特异性抗体及其构建方法。
背景技术:
现有技术公开了t细胞是机体免疫系统抗肿瘤免疫应答的核心,它的完全活化有赖于双信号和细胞因子的共同作用。程序性死亡受体(programmedcelldeath-1,pd-1),属于t细胞活化所需第二信号中的负性共刺激分子,与其配体pd-l1,pd-l2结合后能够下调cd3(cd28)诱导的磷脂酰肌醇3激酶和蛋白激酶b的活性,抑制t细胞增殖相关基因的转录并促进其凋亡;同时还招募蛋白酪氨酸磷酸酶1(proteintyrosinephosphatase-1,ptp-1),使结合的分子去磷酸化,抑制t细胞的增殖与活化,从而减少t细胞的免疫应答,有利于维持自身免疫耐受;研究显示,肿瘤细胞也正是利用了该一点,通过在其表面表达pd-l1来沉默t细胞的功能,从而逃避免疫监视。
肿瘤的靶向治疗是在细胞分子水平上,针对肿瘤和正常组织表面分子表达的差异,设计相应的抗肿瘤药物,该药物进入体内将特异性地杀伤肿瘤细胞,而不会波及周围正常组织,能最大程度地减少传统的放疗,化疗等治疗措施会产生的毒副作用。
肝细胞生长因子受体(hepatocytegrowthfactorreceptor,hgfr),又名c-met,由原癌基因c-met编码,具有酪氨酸激酶活性,与其配体hgf结合后能够促进细胞的增殖与分化,研究表明,c-met与多种肿瘤发生与转移密切相关,且在众多肿瘤病人体内发现了c-met的过度激活,而在正常组织中几乎没有活性。
传统的单克隆抗体一般是通过结合肿瘤细胞表面异于正常细胞的抗原引起细胞的凋亡,还可以激活补体系统达到杀伤肿瘤细胞的目的,但是其无法招募t细胞来对对抗肿瘤的缺点使它的应用受到一定限制。
双特异性抗体(bispecificantibody,bsab),可以同时特异性结合两个不同的抗原,早在30年以前就被研发,因受限于生产技术加之临床试验失败故未能继续研究;近几年基因工程技术的发展为免疫原性较低的人源化双特异性抗体的开发提供了新的机遇,双特异性抗体主要特点是同时结合肿瘤细胞表面抗原和免疫效应细胞表面抗原,阻断双靶点的信号传递,并且能够直接触发免疫效应细胞对肿瘤细胞的特异性杀伤作用。
目前在研的大多数双特异性抗体均选择了t细胞表面的cd3作为效应细胞上的靶点,若干研究表明使用cd3双抗治疗后,t细胞表面的pd-1以及肿瘤细胞表面的pd-l1的表达水平均有升高,pd-1/pd-l1通路的持续激活将抑制t细胞的功能,从而减弱其杀伤肿瘤细胞的作用;目前,普遍采用的非对称结构的双特异性抗体存在有如下缺陷,如,在自体组装时常出现有轻重链错配的现象,而小分子的双特异性抗体结构不稳定,缺乏fc区域,导致其半衰期短,在体内容易被清除,难以达到有效治疗肿瘤的目的,等等。
基于现有技术的现状,本申请的发明人拟提供一种抗pd-1抗原和抗c-met抗原的双特异性抗体,可克服现有技术中的单一识别或者识别后引起的免疫抑制作用所导致的在肿瘤治疗中疗效不足的问题,以及抗体结构不稳定或者装配效率低下等问题。
技术实现要素:
本发明的目的在于,针对现有技术存在的问题,提供一种抗pd-1抗原和抗c-met抗原的双特异性抗体,尤其是,基于现有技术中的单一识别或者识别后引起的免疫抑制作用所导致的在肿瘤治疗中疗效不足的问题以及抗体结构不稳定或者装配效率低下等问题,本发明公开了一种能够同时结合肿瘤相关抗原c-met和免疫检查点分子pd-1的四价双特异性抗体,与抗c-met抗体的联合给予了pd-1抑制剂靶向c-met阳性肿瘤细胞的能力,由此降低脱靶的几率,对正常组织的副作用相应降低,且此双特异性抗体可以随时阻断pd-1/pd-l1抑制性通路,产生持续性的杀伤肿瘤细胞的作用。
具体的,
本发明提供了一种抗pd-1抗原和抗c-met抗原的双特异性抗体,其包含:特异性识别t淋巴细胞的pd-1抗原的第一抗体段和特异性识别肿瘤细胞c-met抗原的第二抗体段。
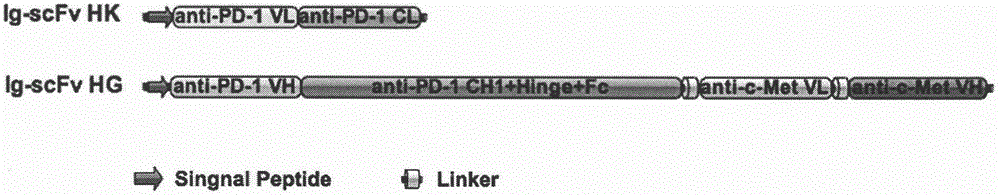
本发明中,所述的双特异性抗体的轻链单元为:抗pd-1抗体的轻链可变区与轻链恒定区,所述的双特异性抗体的重链单元为:由抗c-met抗体的轻链可变区与重链可变区通过gly4ser连接肽构成c-metscfv区,将此scfv区通过gly4ser连接肽序列连接到抗pd-1抗体重链单元的c末端,形成所述的双特异性抗体的重链单元;
本发明中,所述抗pd-1抗体的轻链单元的核苷酸序列如seqidno:1所示,所述抗pd-1抗体的重链单元的核苷酸序列如seqidno:2所示,所述抗c-met抗体的轻链可变区的核苷酸序列如seqidno:3所示,所述抗c-met抗体的重链可变区的核苷酸序列如seqidno:4所示,所述gly4ser连接肽的核苷酸序列如seqidno:5所示。
本发明的抗pd-1抗原和抗c-met抗原的双特异性抗体通过以下方法制备:
(1)将所述的重、轻链分别构建到同种表达载体中;
(2)将(1)构建的两个表达载体一起共转染到宿主细胞中,培养并分离上清;
(3)将分离的上清纯化,得pd-1&c-met双特异性抗体igg-scfv。
本发明中,所述表达载体为pcep4。
本发明中,所述宿主细胞为经ebna1改造的人胚肾293细胞hek293e。
本发明进行了乳酸脱氢酶检测双特异性抗体igg-scfv对肿瘤细胞的杀伤作用实验,双特异性抗体igg-scfv促进t细胞分泌细胞因子的作用实验,检测了双特异性抗体igg-scfv对肿瘤细胞增殖的抑制作用和对c-met下游信号通路的作用,以及双特异性抗体igg-scfv在nod-scid皮下荷瘤小鼠模型中的作用实验,经试验表明所述的双特异性抗体,能够识别肿瘤细胞表面的c-met并且阻断t细胞表面的负性共刺激分子pd-1与肿瘤细胞表面的pd-l1的结合,使t细胞对肿瘤细胞产生持续性的杀伤作用。
进一步,本发明提供了所述的抗pd-1抗原和抗c-met抗原的双特异性抗体在制药物中的用途;所述的药物为在治疗或预防c-met特异性抗原表达的肿瘤药物。
本发明在计算机分子结构模拟的基础上,利用分子克隆技术以筛选的两株单克隆抗体为模板,构建双特异性抗体的表达质粒,该表达质粒为四价双特异性抗体即重组人源化pd-1和c-met双特异性抗体,经试验表明,能够识别肿瘤细胞表面的c-met并且阻断t细胞表面的负性共刺激分子pd-1与肿瘤细胞表面的pd-l1的结合,使t细胞对肿瘤细胞产生持续性的杀伤作用,本发明为靶向c-met阳性肿瘤细胞的免疫干预提供了基础。
本发明中使用下述术语和缩略语:
pd-1:程序性死亡受体1(programmedcelldeath-1)
c-met:肝细胞生长因子受体(mesenchymalepithelialtransitionfactor)
hgf:肝细胞生长因子(hepatocytegrowthfactor)
igg:免疫球蛋白g(immuneglobuling)
bsab:双特异性抗体(bispecificantibody)
scfv:单链可变区抗体片段(single-chainvariablefragment)
vh:重链可变区(heavychainvariableregion)
vl:轻链可变区(lightchainvariableregion)
ebna1:eb病毒核抗原(epstein-barrvirusnuclearantigen1)
hek293:人胚肾293细胞(humanembryonickidney293)
ifn-γ:γ-干扰素(interferon-γ)
pei:聚乙烯亚胺(polyethylenimine)
fitc:异硫氰酸荧光素(fluoresceinisothiocyanate)
pha-l:植物血凝素(phytohemagglutinin-l)
sds-page:十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodiumdodecylsulfatepolyacrylamidegelelectrophoresis)
pi:碘化丙啶(propidiumlodide)
pbs:磷酸缓冲盐溶液(phosphatebuffersaline)
附图说明
图1是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体构建示意图。
图2是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体结构示意图。
图3是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体的sds-page电泳分析图。
图4是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体的流式结合图。
图5是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体的体外细胞毒性分析结果图。
图6是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体的细胞因子分泌分析结果图。
图7是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体在体外抑制肿瘤细胞增殖的结果图。
图8是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体抑制c-met下游信号通路的westernblot分析结果图。
图9是本发明的一种抗pd-1抗原和抗c-met抗原的双特异性抗体与pbs对照组以及单纯pbmc组的抑制体内肿瘤增殖的对比图。
下面结合附图,对本发明的较优的实施例作进一步的详细说明。
具体实施方式
实施例1:双特异性抗体igg-scfv的分子设计及表达质粒的构建
通过计算机分子结构模拟及序列分析,优化分泌信号肽及载体表达元件,设计双特异性抗体igg-scfv表达质粒,利用合适的引物及重叠延伸pcr分别连接两种抗体的可变区,然后通过重组反应将重轻链分别构建到真核表达载体pcep4中。
实施例2:双特异性抗体igg-scfv在宿主细胞hek293e细胞中的表达
转染前24hr将细胞换为无血清培养,转染当天细胞密度约在1x106左右,利用阳离子转染试剂pei将重轻链表达质粒以1∶1共同转染hek293e细胞,转染后24hr添加0.5%新鲜配制并过滤除菌的胰蛋白胨tryptonn1,待活细胞比例下降到60%左右,离心收取培养上清,过滤除菌后-20℃保存待纯化。
实施例3:双特异性抗体igg-scfv的proteina一步法纯化
将proteina1ml预装层析柱连接到akta蛋白纯化系统中,pbs(ph7.4)平衡柱子后上样,收集流穿样品,接着用约10个柱体积的pbs(ph7.4)冲洗柱子以去掉非特异性结合的杂蛋白,并收集冲洗样品,最后用0.1m的柠檬酸(ph3.0)将目的蛋白洗脱下来,并在洗脱液中加入1mtris-hcl(ph9.0)中和,超滤浓缩后冷冻干燥保存。
实施例4:双特异性抗体igg-scfv抗体结合特异性流式检测
将纯化获得的双特异性抗体igg-scfv分别与稳定表达pd-1胞外段的cho,表达c-met的胃癌细胞mkn45以及同型对照igg共同孵育,加入fitc标记的荧光二抗后,使用流式细胞仪分析荧光强度。
实施例5:乳酸脱氢酶检测双特异性抗体igg-scfv对肿瘤细胞的杀伤作用
实验前48hr培养pha-l刺激的hpbmcs,将mkn45细胞或mgc803细胞分别种植于96孔板中,按照不同的效应细胞与靶细胞的比例加入pbmc,并加入igg-scfv双抗,并按照说明书设置对照组。混匀后孵育48hr,然后按照试剂盒说明加入相应的reagent之后在490nm处读取吸光度值。
实施例6:双特异性抗体igg-scfv促进t细胞分泌细胞因子的作用
分离自人新鲜血样的pbmc与靶细胞(mkn45或mgc803)以不同比例种植于96孔板中,加入不同浓度梯度的igg-scfv双抗或者相应浓度igg4对照,孵育30min后加入终浓度为1μg/ml的pha-l,静置培养72hr后收集细胞培养上清按照elisakit说明书检测细胞因子ifn-γ、granzymeb的分泌水平。
实施例7:cck-8检测双特异性抗体igg-scfv对肿瘤细胞增殖的抑制作用
将mkn45细胞种植于96孔板中,加入0.5μm或1.0μm的igg-scfv双特异性抗体以及同样浓度的对照,静置培养12hr后加入cck8试剂,孵育4hr后用酶标仪在450nm处测定吸光度。
实施例8:westernblot检测双特异性抗体igg-scfv对c-met下游信号通路的作用
调整mkn45细胞密度为5x104种植于6孔板中,24hr后更换为无血清培养基,加入一定浓度梯度的igg-scfv双抗或相应浓度的对照,37℃孵育2hr后用终浓度为100ng.ml的hgf刺激10min,裂解细胞后离心取上清,上样进行sds-page电泳,转膜封闭后用相应磷酸化或者本底抗体孵育过夜,第二天孵育相应二抗后化学发光观察c-met及其下游信号分子的活化状态。
实施例9:双特异性抗体igg-scfv在nod-scid皮下荷瘤小鼠模型中的作用
选取5-6周雄性nod-scid小鼠30只,分为2组,分别在右侧腋下接种5×106胃癌细胞mkn45与mgc803,待肿瘤体积达到约50mm3时,将每组15只小鼠再随机分为3组,每组5只,收集激活的pbmc离心,对照组尾静脉注射pbs200μl/次;单纯pbmc组每只小鼠尾静脉注射1×107pbmc,双抗+pbmc实验组:igg-scfv双抗100μg,每只小鼠尾静脉注射1×107pbmc,以上各组均每周给药2次,连续4周,期间用游标卡尺测皮下肿瘤长度a和宽度b,并利用瘤体积公式计算肿瘤体积,瘤体积=0.5×a×b2,记录肿瘤体积变化。
- 还没有人留言评论。精彩留言会获得点赞!